Сепсис. ДВС синдром при сепсисе
Добавил пользователь Владимир З. Обновлено: 20.01.2026
Сепсис и септический шок - клиника, диагностика
Многие годы сепсис и септический шок остаются одной из самых актуальных проблем интенсивной терапии. Частота тяжелого сепсиса среди пациентов ОРИТ составляет от 2% до 18%, а септического шока -3-4%. Примечательно, что в ОРИТ сепсис развивается почти в 30 раз чаще, чем в других клинических отделениях больниц.
Увеличению частоты возникновения сепсиса и септического шока способствуют постарение населения, рост продолжительности жизни лиц с тяжелыми хроническими заболеваниями, значительная частота иммунодефицитных состояний у населения, рост штаммов микроорганизмов, резистентных к антибактериальной терапии, связанный с неконтролируемым назначением антибиотиков, применение в интенсивной терапии препаратов, снижающих иммунитет (цитостатаки, гормоны), повышением инвазивности лечения (расширением показании к обширным операциям, длительная катетеризация сосудов, использование экстракорпоральной детоксикации), нарушение правил асептики и антисептики.
Частота грамположительного и грамотрицательного сепсиса встречается практически одинаково - в 39 и 40% случаев соответственно. В 21% случаев диагносцируются полимикробные ассоциации. Это произошло в результате увеличения роли таких бактерий, как Streptococcus spp., Enterococcus spp., Staphylococcus spp., причем среди них отмечается рост метициллинрезистентных штаммов. Выросла частота сепсиса, вызванного рефрактерными к антибактериальной терапии бактериями (Р. Aeruginosa, Acinetobacter spp., Klebsiella spp.), которые, как правило, выступают в качестве возбудителей нозокомиальной инфекции. Увеличение продолжительности жизни больных, перенесших критические состояния, широкое использование комбинаций цефалоспоринов с ами-ногликозидами обусловили появление новых "ужасов" иифектологии -Enterococcus faecium, Stenothrophamonas maltophylia, Flavobacterium spp. и др. У больных, находящихся в стационаре более трех недель и получавших глюкокортикостероиды и парентеральное питание, сеансы гемодиализа, возросла частота грибкового (кандидозного) сепсиса.
Наиболее вероятная этиология сепсиса в зависимости от локализации очага инфекции представлена в таблице.
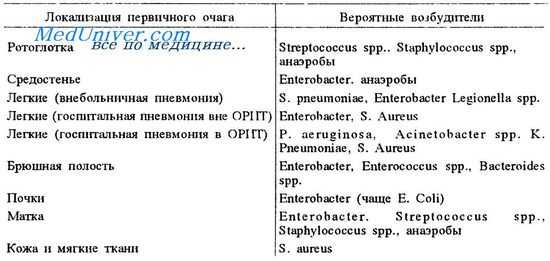
Несмотря на использование самых современных методов интенсивной терапии, достаточно высокой остается летальность, которая при тяжелом сепсисе и септическом шоке составляет 60-70%.
Высокой летальности способствуют поздняя диагностика, неадекватное хирургическое лечение и антибактериальная терапия, полимикробные инфекции, грибковая суперинфекция.
Сепсис классифицируется по темпу развития, по локализации, по виду возбудителя и стадии компенсации.
Клиника и диагностика сепсиса
В 1992 году была сформулирована концепция сепсиса на основе синдрома системного воспалительного ответа (ССВО), которая вошла в клиническую практику большинства стран мира, включая Россию. Главными достоинствами концепции являются простота диагностических критериев, четкое определение реально встречающихся в клинической практике ситуаций, возможность установления диагноза в короткий срок в лечебном учреждении любого уровня.
Бактериемия является одним из возможных, но необязательных признаков сепсиса. Даже при самом скрупулезном соблюдении техники забора крови и использовании современной технологии, как правило, в среднем высев микроорганизмов не превышает 45%, причем при сепсисе положительные результаты посева достигают 17%, при тяжелом сепсисе - 25%, при септическом шоке - 60-70%.
Клиническое значение результатов высева заключается в подтверждении диагноза и определении этиологии инфекционного процесса, обоснованности схемы и оценке эффективности интенсивной терапии, доказательстве механизма развития сепсиса (например, катетеризация).

Обнаружение микроорганизмов в крови у пациентов без признаков ССВО должно расцениваться как транзиторная бактериемия, часто возникающая после различных диагностических процедур.
Одним из первых проявлений ранней стадии септического шока (гипердинамическая фаза) является гипертермия (до 40-41 °С) с ознобами, сочетающаяся с тахипноэ и тахикардией. Лихорадке часто сопутствует изменение психического статуса в виде неадекватности поведения, возбуждения, двигательного беспокойства. Дыхание у больных частое, поверхностное. Артериальное давление нормальное или несколько снижено, тахикардия до ПО ударов в минуту. Темп диуреза снижен до 25 мл/ч. В крови отмечается леГпсоцитоз с высоким уровнем ЛИИ, лимфо- и тромбоцитопения, гипохромия, пойкилоцитоз, компенсированный метаболический ацидоз.
В поздней стадии септического шока (гиподинамическая фаза) гипертермия сменяется гипотермией, отмечается нарушение сознания, вплоть до комы. Кожные покровы бледные с мраморным рисунком. Бледно-цианотичная, холодная кожа, влажные кисти и стопы являются неблагоприятным признаком исхода заболевания. В легких при аускультации определяются рассеянные влажные хрипы, тахипноэ достигает 40-50 в минуту. Систолическое артериальное и пульсовое давление снижено, тахиаритмия выраженная - до 120 ударов в минуту и более.
Со стороны ЖКТ наблюдается развитие пареза кишечника. Уровень билирубина, АЛТ, ACT, ЛДГ возрастает.
Олигурия (менее 10 мл/ч) сопровождается ростом азотемии, снижением концентрационного индекса по осмолярности до 1,0, возрастанием фракционной экскреции натрия выше 2%.
В крови определяется анемия, выраженный лейкоцитоз, лимфопения. Метаболический ацидоз становится декомпенспровапным. Гипергликемия сменяется гипогликемией.
Сепсис. ДВС синдром при сепсисе
Активация при сепсисе системы гемостаза обусловлена эндото-ксемией и бактериальными липополисахаридами. Центральным медиатором сепсиса является фактор некроза опухоли (TNF—tumor necrosis factor), который вырабатывается в ответ на поступление эндотоксина. Вторичный медиатор — интерлейкин-1, концентрация которого резко возрастает после поступления в сосудистое русло TNF. Вслед за выработкой этих провоспалительных медиаторов происходит повышение уровня интерлейкина-6, который активизирует синтез в печени белков острой фазы.
Полисахариды грампозитивных бактерий также могут посредством цитокинов активизировать систему гемостаза, что резко увеличивает риск ДВС.
Иногда ДВС индуцируется фулминантной вирусной инфекцией. Тяжело протекающие инфекции сопровождаются обычно лейкоцитозом. Нейтрофильные лейкоциты вырабатывают ряд субстанций (в том числе нейтрофильную эластазу), которые вызывают дефицит AT III, а гепаринотерапия усугубляет этот процесс.
Следует иметь в виду, что применение бактерицидных антибиотиков увеличивает риск возникновения септического шока вследствие массивного поступления в русло эндотоксинов из разрушенных бактерий. Молниеносные формы сепсиса возникают на фоне иммуносупрессивнои терапии. Смертность при септическом шоке достигает 40 %. Септический шок, рефракторный к терапии, быстро, в течение нескольких часов приводит к полиорганной недостаточности и ДВС-синдрому.
В ряде случаев не удается установить возбудителя инфекции в гемокультуре больных сепсисом. Концепция системного воспалительного ответа предполагает наличие сепсиса при отсутствии (невозможности определения) возбудителя в крови в случаях выраженной характерной клиники:
• фебрильная температура (> 38 °С) или гипотермия (> 35,5 °С встречается у 10 % больных);
• тахикардия;
• тахипноэ, гипервентиляция с респираторным алкалозом. Для лабораторных показателей характерно:
• лейкоцитоз > 15 000 /мм3 или лейкопения > 3500 /мм3;
• сдвиг лейкоцитарной формулы влево, токсическая зернистость;
• изменения коагуляции — снижение числа тромбоцитов более чем на 30 % за 24 ч, снижение AT III;
• метаболические сдвиги — гиперлактатемия, гипергликемия, гипофосфатемия.
Для сепсиса характерен дефицит системы естественных антикоагулянтов, причем снижение AT III происходит ранее основных клинических проявлений сепсиса. При снижении содержания AT III ниже 60 % смертность резко возрастает.
Причины сепсиса

Количество тромбоцитов при сепсисе снижается вследствие тромбоцитопении потребления — тромбоциты связываются с фибрином, адгезируют к поврежденному эндотелию, секвестрируются в легких и печени. Тромбоцитопатия — снижение агрегирующих свойств тромбоцитов — может быть вызвана длительным применением антибиотиков.
Лечение сепсиса, септического шока и ДВС-синдрома должно носить комплексный характер и основываться на следующих принципах:
1. Хирургическое лечение очага инфекции (санация и дренирование).
2. Антибиотикотерапия, основанная на идентификации возбудителя и определении его чувствительности к соответствующей группе антибиотиков.
3. Адекватная оксигенация — необходима ранняя ИВЛ в различных режимах.
4. Инфузионная терапия — высока опасность гипергидратации, особенно в условиях тканевой гипоксии и повышения капиллярной проницаемости. Трансфузия эритроцитов не только повышает кислородтранспортную функцию крови, но и обеспечивает эффективность трансфузионной терапии. Критическим для септических больных считается содержание гемоглобина менее 70—80 г/л. Предпочтительна трансфузия свежезаготовленной эритроцитной массы.
5. Применение катехоламинов. Содержание фактора некроза опухоли (TNF) при сепсисе значительно возрастает (TNF — медиатор, обладающий выраженным кардиодепрессйвным действием).
6. Препараты AT III.
В 1985 году В. Blauhut опубликовал результат клинических исследований по применению препарата AT III (кубернина HS). У пациентов с клиникой септического шока и ДВС, которым был назначен кубернин HS, отмечено ускоренное восстановление показателей коагуляции, хотя и не было отмечено снижение смертности.
Некоторые исследователи рекомендуют поддерживать содержание AT III на уровне 140 %, это возможно при введении препарата в суммарной дозе 18 000 ЕД. Содержание AT III не должно снижаться менее 80 %.
7. Фибринолитические препараты. Установлено, что у погибших от сепсиса больных отмечалась выраженная активация коагуляции и еще более выраженное угнетение фибринолиза, что позволило предположить, что назначение фибринолитических препаратов приведет к коррекции гемостаза. Применение препаратов в экспериментах на животных с эндотоксемией повышает выживаемость и препятствует развитию легочной недостаточности.
8. Адекватное энтеральное и парентеральное питание. Рекомендуется ранний переход на энтеральное питание, которое препятствует развитию пареза желудочно-кишечного тракта и уменьшает интестинальную атрофию. В питательные смеси для энтерального питания вводятся специальные добавки: омега-3 жирные кислоты, аргинин, глутамин, рыбий жир. Раннее энтеральное питание с вышеуказанными пищевыми добавками оказывает благоприятное влияние на иммунный статус больных, и получило название «иммунного питания».
9. Поливалентные иммуноглобулины используются для нейтрализации эндотоксинов. Отмечено снижение смертности при их применении у кардиохирургических больных.
10. Методы экстракорпоральной детоксикации: гемофильтрация, плазмаферез.
ДВС-синдром
ДВС-синдром – расстройство гемостаза, связанное с гиперстимуляцией и дефицитом резервов свертывающей системы крови, приводящее к развитию тромботических, микроциркуляторных и геморрагических нарушений. При ДВС-синдроме наблюдается петехиально-гематомная сыпь, повышенная кровоточивость, дисфункция органов, а в острых случаях – развитие шока, гипотонии, сильных кровотечений, ОДН и ОПН. Диагноз устанавливают по характерным признакам и лабораторным тестам системы гемостаза. Лечение ДВС-синдрома направлено на коррекцию гемодинамики и нарушений свертывающей системы (антиагреганты, антикоагулянты, ангиопротекторы, гемотрансфузии, плазмаферез и др.).
Общие сведения
ДВС-синдром (диссеминированное внутрисосудистое свертывание, тромбогеморрагический синдром) – геморрагический диатез, характеризующийся чрезмерным ускорением внутрисосудистой коагуляции, образованием рыхлых сгустков крови в микроциркуляторной сети с развитием гипоксических и дистрофически-некротических измерений в органах. ДВС-синдром представляет опасность для жизни пациента из-за риска возникновения обширных, плохо купируемых кровотечений и острой дисфункции органов (главным образом, легких, почек, надпочечников, печени, селезенки), имеющих обширную микроциркуляторную сеть.
ДВС-синдром можно рассматривать, как неадекватную защитную реакцию, направленную на ликвидацию кровотечения при повреждении кровеносных сосудов и изоляцию организма от пораженных тканей. Встречаемость ДВС-синдрома в различных отраслях практической медицины (гематологии, реаниматологии, хирургии, акушерстве и гинекологии, травматологии и др.) достаточно велика.
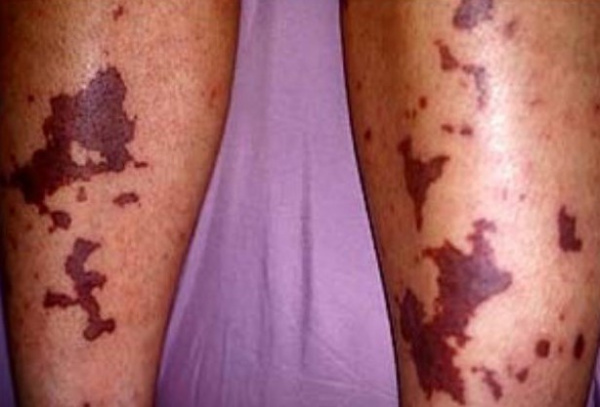
Причины ДВС-синдрома
ДВС-синдром развивается на фоне заболеваний, протекающих с повреждением тканей, эндотелия сосудов и клеток крови, сопровождаемых микрогемодинамическими нарушениями и сдвигом гемостаза в сторону гиперкоагуляции. Основной причиной ДВС-синдрома выступают септические осложнения бактериальных и вирусных инфекций, шок любой природы. ДВС-синдром часто сопутствует акушерской патологии - тяжелому гестозу, предлежанию и преждевременной отслойке плаценты, внутриутробной гибели плода, эмболии амниотической жидкостью, ручному отделению последа, атоническим маточным кровотечениям, а также операции кесарево сечение.
Развитие тромбогеморрагического синдрома могут инициировать метастазирующие злокачественные опухоли (рак легкого, рак желудка), обширные травмы, ожоги, серьезные хирургические вмешательства. Нередко ДВС-синдром сопровождает трансфузию крови и ее компонентов, трансплантацию тканей и органов, протезирование сосудов и клапанов сердца, применение искусственного кровообращения.
Способствовать возникновению ДВС-синдрома могут сердечно-сосудистые заболевания, протекающие с гиперфибриногенемией, увеличением вязкости и снижением текучести крови, механическим препятствием кровотоку атеросклеротической бляшкой. К ДВС-синдрому могут приводить прием медикаментов (ОК, ристомицина, диуретиков), острые отравления (например, ядом змеи) и острые аллергические реакции.
Патогенез
Несостоятельность гемостаза при ДВС-синдроме возникает за счет гиперстимуляции свертывающей и быстрого истощения антикоагулянтной и фибринолитической систем гемостаза.
Развитие ДВС-синдрома обуславливается различными факторами, которые появляются в кровяном русле и напрямую активируют процесс свертывания, либо осуществляют это через медиаторы, воздействующие на эндотелий. В качестве активаторов ДВС-синдрома могут выступать токсины, ферменты бактерий, околоплодные воды, иммунные комплексы, стрессовые катехоламины, фосфолипиды, снижение сердечного выброса и кровотока, ацидоз, гиповолемия и др.
Развитие ДВС-синдрома происходит с последовательной сменой 4-х стадий.
I - начальная стадия гиперкоагуляции и внутрисосудистой агрегации клеток. Обусловлена выбросом в кровь тканевого тромбопластина или веществ, обладающих тромбопластиноподобным действием и запускающих внутренний и внешний пути свертывания. Может продолжаться от нескольких минут и часов (при острой форме) до нескольких дней и месяцев (при хронической).
II - стадия прогрессирующей коагулопатии потребления. Характеризуется дефицитом фибриногена, кровяных пластинок и плазменных факторов вследствие их избыточного расхода на тромбообразование и недостаточного возмещения.
III - критическая стадия вторичного фибринолиза и выраженной гипокоагуляции. Отмечается разбалансировка гемостатического процесса (афибриногенемия, накопление патологических продуктов, разрушение эритроцитов) с замедлением свертывания крови (вплоть до полной неспособности к свертыванию).
IV - стадия восстановления. Наблюдаются либо остаточные очаговые дистрофические и некротические изменения в тканях тех или иных органов и выздоровление, либо осложнения в виде острой органной недостаточности.

Классификация ДВС-синдрома
По выраженности и скорости развития ДВС-синдром может быть острым (в т.ч., молниеносным), подострым, хроническим и рецидивирующим. Острая форма тромбогеморрагического синдрома возникает при массивном выбросе в кровь тромбопластина и ему подобных факторов (при акушерской патологии, обширных операциях, травмах, ожогах, синдроме длительного сдавления тканей). Характеризуется ускоренной сменой стадий ДВС-синдрома, отсутствием нормального защитного антикоагуляционного механизма. Подострая и хроническая формы ДВС-синдрома связаны с обширным изменением поверхности эндотелия сосудов (например, вследствие атеросклеротических отложений), выступающим в роли активирующей субстанции.
ДВС-синдром может проявляться локально (ограниченно, в одном органе) и генерализованно (с поражением нескольких органов или всего организма). По компенсаторному потенциалу организма можно выделить компенсированный, субкомпенсированный и декомпенсированный ДВС-синдром. Компенсированная форма протекает бессимптомно, микросгустки лизируются за счет усиления фибринолиза, факторы свертывания восполняются из резервов и путем биосинтеза. Субкомпенсированная форма проявляется в виде гемосиндрома средней степени тяжести; декомпенсированная - характеризуется каскадными реакциями реактивного фибринолиза, несостоятельностью коагуляционных процессов, несворачиваемостью крови.
ДВС-синдром может протекать с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев гемостаза (смешанный патогенез) или с преобладанием активности одного из них.
Симптомы ДВС-синдрома
Клинические проявления ДВС-синдрома определяются темпом развития и распространенностью поражения, стадией процесса, состоянием компенсаторных механизмов, наслоением симптомов заболевания-индуктора. В основе ДВС-синдрома лежит комплекс тромбогеморрагических реакций и дисфункции органов.
При острой манифестной форме быстро (за несколько часов) развивается генерализованный ДВС-синдром, для которого характерно шоковое состояние с гипотонией, потерей сознания, признаками отека легких и острой дыхательной недостаточности. Гемосиндром выражается нарастающей кровоточивостью, массивными и профузными кровотечениями (легочными, маточными, носовыми, желудочно-кишечными). Характерно развитие очагов ишемической дистрофии миокарда, панкреонекроза, эрозивно-язвенного гастроэнтерита. Молниеносная форма ДВС-синдрома свойственна эмболии околоплодными водами, когда коагулопатия стремительно (в течение нескольких минут) переходит в критическую стадию, сопровождаясь кардиопульмонарным и геморрагическим шоком. Летальность матери и ребенка при этой форме ДВС-синдрома приближается к 80%.
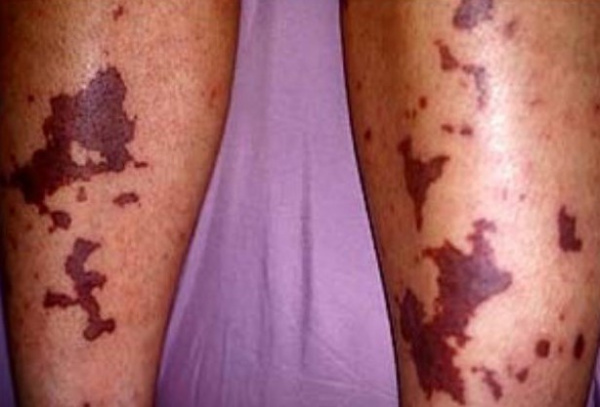
Подострая форма ДВС-синдрома носит локальный характер с более благоприятным течением. Незначительный или умеренный гемосиндром проявляется петехиальной или сливной геморрагической сыпью, синяками и гематомами, усиленной кровоточивостью из мест инъекций и ран, кровотечениями из слизистых оболочек (иногда - «кровавый пот», «кровавые слезы»). Кожа приобретает бледный вид, мраморность, становится холодной на ощупь. В ткани почек, легких, печени, надпочечников, ЖКТ развиваются отек, резкое полнокровие, внутрисосудистая коагуляция, сочетание очагов некроза и множественных кровоизлияний. Самая распространенная - хроническая форма ДВС-синдрома часто имеет бессимптомное течение. Но по мере прогрессирования фонового заболевания нарастают проявления геморрагического диатеза и нарушения функции органов.
ДВС-синдром сопровождается астеническим синдромом, плохим заживлением ран, присоединением гнойной инфекции, развитием келоидных рубцов. К осложнениям ДВС-синдрома относятся гемокоагуляционный шок, острая дыхательная недостаточность, ОПН, некроз печени, язвенная болезнь желудка, инфаркт кишечника, панкреонекроз, ишемический инсульт, острая постгеморрагическая анемия.

Диагностика ДВС-синдрома
Для установления ДВС-синдрома необходимы тщательный сбор анамнеза с поиском этиологического фактора, анализ клинической картины и данных лабораторных исследований (общего анализа крови и мочи, мазка крови, коагулограммы, паракоагуляционных проб, ИФА). Важно оценить характер кровоточивости, уточнить стадию коагулопатии, отражающую глубину нарушений.
Для ДВС-синдрома характерна петехиально-гематомная кровоточивость, геморрагии сразу из нескольких мест. При малосимптомном течении гиперкоагуляция выявляется только лабораторными методами. К обязательным скрининговым тестам относятся определение количества тромбоцитов, фибриногена, АПТВ, протромбинового и тромбинового времени, времени свертывания по Ли-Уайту. Исследование маркеров внутрисосудистого свертывания - РФМК и ПДФ, D-димера методом ИФА и паракоагуляционных проб помогает подтвердить ДВС-синдром.
Критериями ДВС-синдрома являются наличие фрагментированных эритроцитов в мазке крови, дефицит тромбоцитов и фибриногена, повышение концентрации ПДФ, падение активности антитромбина III в сыворотке крови, удлинение АПТВ и тромбинового времени, отсутствие образования или нестабильность сгустка или in vitro. Выполняется оценка функционального состояния «шоковых органов»: легких, почек, печени, сердечно-сосудистой системы, головного мозга. ДВС-синдром необходимо дифференцировать от первичного фибринолиза, других коагулопатических синдромов.
Лечение ДВС-синдрома
Успех лечения ДВС-синдрома возможен при его ранней диагностике. Активные лечебные мероприятия требуются при выраженной симптоматике в виде кровотечений и органной недостаточности. Больных с ДВС-синдромом следует госпитализировать в ОРИТ и при необходимости проводить ИВЛ, активную противошоковую терапию. При малосимптомном ДВС-синдроме основным представляется лечение фоновой патологии, коррекция параметров гемодинамики и функциональных нарушений органов.
Острый ДВС-синдром требует срочного устранения его первопричины, например, экстренного родоразрешения, гистерэктомии - при акушерской патологии или антибиотикотерапии – при септических осложнениях. Для ликвидации гиперкоагуляции показано введение антикоагулянтов (гепарина), дезагрегантов (дипиридамола, пентоксифиллина), фибринолитиков. Больные должны находиться под постоянным динамическим контролем показателей гемостаза.
В качестве заместительной терапии при ДВС-синдроме применяются трансинфузии свежезамороженной плазмы, тромбоцитарной или эритроцитарной массы (при падении уровня тромбоцитов или Hb); криопреципитата (при сердечной недостаточности), физраствора. При кровотечениях, угрожающих жизни, возможно назначение антифибринолитических средств (аминокапроновой к-ты, ингибиторов протеаз). При кожных геморрагиях и ранах накладываются повязки с этамзилатом, гемостатическая губка.
По показаниям применяют кортикостероиды, оксигенотерапию, плазмаферез. Для восстановления микроциркуляции и нарушенных функций органов назначают ангиопротекторы, ноотропные препараты, посиндромную терапию. В случае ОПН проводят гемодиализ, гемодиафильтрацию. При хроническом ДВС-синдроме целесообразно использование дезагрегантов, вазодилататоров, в послеоперационном периоде - гепаринотерапии.
Прогноз и профилактика ДВС-синдрома
Прогноз ДВС-синдрома - вариативный, зависит от основного, этиологически значимого заболевания, тяжести нарушений гемостаза и своевременности начатого лечения. При остром ДВС-синдроме не исключен летальный исход в результате некупируемой большой кровопотери, развития шока, ОПН, острой дыхательной недостаточности, внутренних кровоизлияний. Предупреждение ДВС-синдрома заключается в выявлении пациентов группы риска (особенно, среди беременных и лиц пожилого возраста), лечении фонового заболевания.
Сепсис
Сепсис - общая гнойная инфекция, развивающаяся вследствие проникновения и циркуляции в крови различных возбудителей и их токсинов. Клиническая картина сепсиса складывается из интоксикационного синдрома (лихорадки, ознобов, бледно-землистой окраски кожных покровов), тромбогеморрагического синдрома (кровоизлияний в кожу, слизистые, конъюнктиву), метастатического поражения тканей и органов (абсцессов различных локализаций, артритов, остеомиелитов и др.). Подтверждением сепсиса служит выделение возбудителя из культуры крови и локальных очагов инфекции. При сепсисе показано проведение массивной дезинтоксикационной, антибактериальной терапии, иммунотерапии; по показаниям – хирургическое удаление источника инфекции.
Сепсис (заражение крови) – вторичное инфекционное заболевание, вызванное попаданием патогенной флоры из первичного локального инфекционного очага в кровяное русло. Сегодня ежегодно в мире диагностируется от 750 до 1,5 млн. случаев сепсиса. По статистике, чаще всего сепсисом осложняются абдоминальные, легочные и урогенитальные инфекции, поэтому данная проблема наиболее актуальная для общей хирургии, пульмонологии, урологии, гинекологии. В рамках педиатрии изучаются проблемы, связанные с сепсисом новорожденных. Несмотря на использование современных антибактериальных и химиотерапевтических препаратов, летальность от сепсиса остается на стабильно высоком уровне – 30-50%.
Причины сепсиса
Важнейшими факторами, приводящими к срыву противоинфекционной резистентности и развитию сепсиса, выступают:
- со стороны макроорганизма - наличие септического очага, периодически или постоянно связанного с кровяным или лимфатическим руслом; нарушенная реактивность организма
- со стороны инфекционного возбудителя – качественные и количественные свойства (массивность, вирулентность, генерализация по крови или лимфе)
Ведущая этиологическая роль в развитии большинства случаев сепсиса принадлежит стафилококкам, стрептококкам, энтерококкам, менингококкам, грамотрицательной флоре (синегнойной палочке, кишечной палочке, протею, клебсиелле, энтеробактер), в меньшей степени - грибковым возбудителям (кандидам, аспергиллам, актиномицетам).
Выявление в крови полимикробных ассоциаций в 2,5 раза увеличивает уровень летальности больных сепсисом. Возбудители могут попадать в кровь из окружающей среды или заноситься из очагов первичной гнойной инфекции.
Велико значение внутрибольничной инфекции: ее росту способствует широкое применение инвазивных диагностических процедур, иммуносупрессивных лекарственных препаратов (глюкокортикоидов, цитостатиков). В условиях иммунодефицита, на фоне травмы, операционного стресса или острой кровопотери инфекция из хронических очагов беспрепятственно распространяется по организму, вызывая сепсис. Развитию сепсиса более подвержены недоношенные дети, больные, длительно находящиеся на ИВЛ, гемодиализе; онкологические, гематологические пациенты; больные сахарным диабетом, ВИЧ-инфекцией, первичными и вторичными иммунодефицитами.
Механизм развития сепсиса многоступенчатый и очень сложный. Из первичного инфекционного очага патогены и их токсины проникают в кровь или лимфу, обуславливая развитие бактериемии. Это вызывает активацию иммунной системы, которая реагирует выбросом эндогенных веществ (интерлейкинов, фактора некроза опухолей, простагландинов, фактора активации тромбоцитов, эндотелинов и др.), вызывающих повреждение эндотелия сосудистой стенки. В свою очередь, под воздействием медиаторов воспаления активизируется каскад коагуляции, что в конечном итоге приводит к возникновению ДВС-синдрома. Кроме этого, под влиянием высвобождающихся токсических кислородсодержащих продуктов (оксида азота, перекиси водорода, супероксидов) снижается перфузия, а также утилизация кислорода органами. Закономерным итогом при сепсисе является тканевая гипоксия и органная недостаточность.

Классификация
Формы сепсиса классифицируются в зависимости от локализации первичного инфекционного очага. На основании этого признака различают первичный (криптогенный, эссенциальный, идиопатический) и вторичный сепсис. При первичном сепсисе входные ворота обнаружить не удается. Вторичный септический процесс подразделяется на:
- хирургический – развивается при заносе инфекции в кровь из послеоперационной раны
- акушерско-гинекологический – возникает после осложненных абортов и родов
- уросепсис – характеризуется наличием входных ворот в отделах мочеполового аппарата (пиелонефрит, цистит, простатит)
- кожный – источником инфекции служат гнойные заболевания кожи и поврежденные кожные покровы (фурункулы, абсцессы, ожоги, инфицированные раны и др.)
- перитонеальный (в т. ч. билиарный, кишечный) – с локализацией первичных очагов в брюшной полости
- плевро-легочный – развивается на фоне гнойных заболеваний легких (абсцедирующей пневмонии, эмпиемы плевры и др.)
- одонтогенный– обусловлен заболеваниями зубочелюстной системы (кариесом, корневыми гранулемами, апикальным периодонтитом, периоститом, околочелюстными флегмонами, остеомиелитом челюстей)
- тонзиллогенный – возникает на фоне тяжелых ангин, вызванных стрептококками или стафилококками
- риногенный – развивается вследствие распространения инфекции из полости носа и придаточных пазух, обычно при синуситах
- отогенный - связан с воспалительными заболеваниями уха, чаще гнойным средним отитом.
- пупочный– встречается при омфалите новорожденных
По времени возникновения сепсис подразделяется на ранний (возникает в течение 2-х недель с момента появления первичного септического очага) и поздний (возникает позднее двухнедельного срока). По темпам развития сепсис может быть молниеносным (с быстрым развитием септического шока и наступлением летального исхода в течение 1-2 суток), острым (длительностью 4 недели), подострым (3-4 месяца), рецидивирующим (продолжительностью до 6 месяцев с чередованием затуханий и обострений) и хроническим (продолжительностью более года).
Сепсис в своем развитии проходит три фазы: токсемии, септицемии и септикопиемии. Фаза токсемии характеризуется развитием системного воспалительного ответа вследствие начала распространения микробных экзотоксинов из первичного очага инфекции; в этой фазе бактериемия отсутствует. Септицемия знаменуется диссеминацией возбудителей, развитием множественных вторичных септических очагов в виде микротромбов в микроциркуляторном русле; наблюдается стойкая бактериемия. Для фазы септикопиемии характерно образование вторичных метастатических гнойных очагов в органах и костной системе.
Симптомы сепсиса
Симптоматика сепсиса крайне полиморфна, зависит от этиологической формы и течения заболевания. Основные проявления обусловлены общей интоксикацией, полиорганными нарушениями и локализацией метастазов.
Состояние больного сепсисом быстро утяжеляется. Кожные покровы приобретают бледновато-серый (иногда желтушный) цвет, черты лица заостряются. Могут возникать герпетические высыпания на губах, гнойнички или геморрагические высыпания на коже, кровоизлияния в конъюнктиву и слизистые оболочки. При остром течении сепсиса у больных быстро возникают пролежни, нарастает обезвоживание и истощение.
В условиях интоксикации и тканевой гипоксии при сепсисе развиваются полиорганные изменения различной степени тяжести. На фоне лихорадки отчетливо выражены признаки нарушения функций ЦНС, характеризующиеся заторможенностью или возбуждением, сонливостью или бессонницей, головными болями, инфекционными психозами и комой. Сердечно-сосудистые нарушения представлены артериальной гипотонией, ослаблением пульса, тахикардией, глухостью сердечных тонов. На этом этапе сепсис может осложниться токсическим миокардитом, кардиомиопатией, острой сердечно-сосудистой недостаточностью.
На происходящие в организме патологические процессы дыхательная система реагирует развитием тахипноэ, инфаркта легкого, респираторного дистресс-синдрома, дыхательной недостаточности. Со стороны органов ЖКТ отмечается анорексия, возникновение «септических поносов», чередующихся с запорами, гепатомегалии, токсического гепатита. Нарушение функции мочевыделительной системы при сепсисе выражается в развитии олигурии, азотемии, токсического нефрита, ОПН.
В первичном очаге инфекции при сепсисе также происходят характерные изменения. Заживление ран замедляется; грануляции становятся вялыми, бледными, кровоточащими. Дно раны покрывается грязно-сероватым налетом и участками некрозов. Отделяемое приобретает мутный цвет и зловонный запах.
Метастатические очаги при сепсисе могут выявляться в различных органах и тканях, что обусловливает наслоение дополнительной симптоматики, свойственной гнойно-септическому процессу данной локализации. Следствием заноса инфекции в легкие служит развитие пневмонии, гнойного плеврита, абсцессов и гангрены легкого. При метастазах в почки возникают пиелиты, паранефриты. Появление вторичных гнойных очагов в опорно-двигательной системе сопровождается явлениями остеомиелита и артрита. При поражении головного мозга отмечается возникновение церебральных абсцессов и гнойного менингита. Возможно наличие метастазов гнойной инфекции в сердце (перикардит, эндокардит), мышцах или подкожной жировой клетчатке (абсцессы мягких тканей), органах брюшной полости (абсцессы печени и др.).
Осложнения сепсиса
Основные осложнения сепсиса связаны с полиорганной недостаточностью (почечной, надпочечниковой, дыхательной, сердечно-сосудистой) и ДВС-синдромом (кровотечения, тромбоэмболии).
Тяжелейшей специфической формой сепсиса является септический (инфекционно-токсический, эндотоксический) шок. Он чаще развивается при сепсисе, вызванном стафилококком и грамотрицательной флорой. Предвестниками септического шока служат дезориентация больного, видимая одышка и нарушение сознания. Быстро нарастают расстройства кровообращения и тканевого обмена. Характерны акроцианоз на фоне бледных кожных покровов, тахипноэ, гипертермия, критическое падение АД, олигурия, учащение пульса до 120-160 уд. в минуту, аритмия. Летальность при развитии септического шока достигает 90%.

Диагностика сепсиса
Распознавание сепсиса основывается на клинических критериях (инфекционно-токсической симптоматике, наличии известного первичного очага и вторичных гнойных метастазов), а также лабораторных показателях (посев крови на стерильность).
Вместе с тем, следует учитывать, что кратковременная бактериемия возможна и при других инфекционных заболеваниях, а посевы крови при сепсисе (особенно на фоне проводимой антибиотикотерапии) в 20-30% случаев бывают отрицательными. Поэтому посев крови на аэробные и анаэробные бактерии необходимо проводить минимум трехкратно и желательно на высоте лихорадочного приступа. Также производится бакпосев содержимого гнойного очага. В качестве экспресс-метода выделения ДНК возбудителя сепсиса используется ПЦР. В периферической крови отмечается нарастание гипохромной анемии, ускорение СОЭ, лейкоцитоз со сдвигом влево.
Дифференцировать сепсис необходимо от лимфогранулематоза, лейкемии, брюшного тифа, паратифов А и В, бруцеллеза, туберкулеза, малярии и других заболеваний, сопровождающихся длительной лихорадкой.
Лечение сепсиса
Пациенты с сепсисом госпитализируются в отделение интенсивной терапии. Комплекс лечебных мероприятий включает в себя антибактериальную, дезинтоксикационную, симптоматическую терапию, иммунотерапию, устранение белковых и водно-электролитных нарушений, восстановление функций органов.
С целью устранения источника инфекции, поддерживающего течение сепсиса, проводится хирургическое лечение. Оно может заключаться во вскрытии и дренировании гнойного очага, выполнении некрэктомии, вскрытии гнойных карманов и внутрикостных гнойников, санации полостей (при абсцессе мягких тканей, флегмоне, остеомиелите, перитоните и др.). В некоторых случаях может потребоваться резекция или удаление органа вместе с гнойником (например, при абсцессе легкого или селезенки, карбункуле почки, пиосальпинксе, гнойном эндометрите и др.).
Борьба с микробной флорой предполагает назначение интенсивного курса антибиотикотерапии, проточное промывание дренажей, местное введение антисептиков и антибиотиков. До получения посева с антибиотикочувствительностью терапию начинают эмпирически; после верификации возбудителя при необходимости производится смена противомикробного препарата. При сепсисе для проведения эмпирической терапии обычно используются цефалоспорины, фторхинолоны, карбапенемы, различные комбинации препаратов. При кандидосепсисе этиотропное лечение проводится амфотерицином В, флуконазолом, каспофунгином. Антибиотикотерапия продолжается в течение 1-2 недель после нормализации температуры и двух отрицательных бакпосевов крови.
Дезинтоксикационная терапия при сепсисе проводится по общим принципам с использованием солевых и полиионных растворов, форсированного диуреза. С целью коррекции КОС используются электролитные инфузионные растворы; для восстановления белкового баланса вводятся аминокислотные смеси, альбумин, донорская плазма. Для борьбы с бактериемией при сепсисе широко используются процедуры экстракорпоральной детоксикации: плазмаферез, гемосорбция, гемофильтрация. При развитии почечной недостаточности применяется гемодиализ.
Иммунотерапия предполагает использование антистафилококковой плазмы и гамма-глобулина, переливание лейкоцитарной массы, назначение иммуностимуляторов. В качестве симптоматических средств используются сердечно-сосудистые препараты, анальгетики, антикоагулянты и др. Интенсивная медикаментозная терапия при сепсисе проводится до стойкого улучшения состояния больного и нормализации показателей гомеостаза.
Прогноз и профилактика
Исход сепсиса определяется вирулентностью микрофлоры, общим состоянием организма, своевременностью и адекватностью проводимой терапии. К развитию осложнений и неблагоприятному прогнозу предрасположены больные пожилого возраста, с сопутствующими общими заболеваниями, иммунодефицитами. При различных видах сепсиса летальность составляет 15-50%. При развитии септического шока вероятность летального исхода крайне высока.
Профилактические меры в отношении сепсиса состоят в устранении очагов гнойной инфекции; правильном ведении ожогов, ран, локальных инфекционно-воспалительных процессов; соблюдении асептики и антисептики при выполнении лечебно-диагностических манипуляций и операций; предупреждении госпитальной инфекции; проведении вакцинации (против пневмококковой, менингококковой инфекции и др.).
Акушерский сепсис ( Родильная горячка )
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
Акушерский сепсис (родильная горячка) – угрожающее жизни состояние, характеризующееся нарушениями гемодинамики, метаболизма, свертывания крови, полиорганной недостаточностью и возникающее в ответ на инфекционное воспаление в половых и мочевыделительных органах, а также в молочной железе в гестационном, родовом и послеродовом периодах. Устаревший синоним сепсиса «заражение крови» ныне неактуален: проникновение инфекционного агента в кровь не является обязательным условием развития септического процесса – бактериемия регистрируется только у 50% больных. Сепсис развивается у одной из 5000 беременных и родящих и сопровождается септическим шоком в 10% случаев, доля заболевания в структуре материнской смертности составляет 12%. В 44% случаев сепсис регистрируется на этапе беременности (с равномерным распределением по периодам гестации), в 10% - в родах, в 46% - в послеродовом периоде.
Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
При отсутствии лечения нарастает интоксикация организма и развивается тяжёлая форма с шоковым синдромом. В ранней («тёплой») фазе прогрессирует слабость, отмечается головокружение. Одновременно до нормы или субфебрильных величин снижается температура, нарастает тахикардия. Слизистые оболочки и ногтевые ложа приобретают синюшный оттенок, кожные покровы гиперемированы. Наблюдается возбуждение, сознание может быть ясным или спутанным, нередки психозы, галлюцинации. Средняя продолжительность ранней стадии составляет 5-8 часов, реже – до двух суток. В случае грамотрицательной инфекции эта фаза может длиться несколько минут.
Поздняя («холодная») стадия знаменуется усилением или ослаблением сердцебиения с переходом в брадикардию, падением температуры ниже нормы, значительным затруднением дыхания. Беспокойство и возбуждение усиливается, затем сменяется адинамией, сознание затемняется. Кожа приобретает землистый оттенок, покрывается липким холодным потом, на ногах проступает цианотично-мраморный рисунок, особенно выраженный в области колен. Развивается олигурия, иногда появляется желтуха.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Читайте также:
- Дородовый разрыв околоплодных оболочек. Диагностика дородового разрыва околоплодных оболочек.
- Опухоль Вилмса (нефробластома) - частота, причины
- Негеномный механизм действия стероидных гормонов.
- Индукция ремиссии и поддерживающая терапия в химиотерапии рака
- Каспазы участвующие в воспалении и обмене цитокинов
