Сернокислая магнезия, бикарбонат натрия при реанимации больного.
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Дефибрилляция. Техника и методика дефибрилляции.
Дефибрилляция - один из наиболее важных компонентов сердечно-легочной реанимации. Спонтанное прекращение фибрилляции желудочков наблюдается крайне редко и возможно лишь при кратковременной, чаще рефлекторной остановке сердца без выраженной гипоксии. В то же время дефибрилляция с помощью электрического тока может быть эффективной и после длительной фибрилляции.
С патофизиологической точки зрения возникновение фибрилляции -это результат несоответствия функциональной подвижности сердца частоте падающих на него раздражений. По мнению С. Beck (1960), фибрилляция есть результат "электрической нестабильности" сердца вследствие разности электрических потенциалов, возникающих на границе ишемизированной (инфаркт) и хорошо оксигенированной зон миокарда. Примечательно, что весьма нередко у погибающих от инфаркта миокарда людей нарушение ритма происходит при минимальнейших изменениях в самой мышще сердца - "слишком здоровое сердце, чтобы умирать" (Т. R. Evans, 1992).
По клиническим признакам, без данных кардиоскопии, фибрилляцию желудочков нельзя отличить от других видов остановки кровообращения. Первичную фибрилляцию с большей вероятностью можно лишь предполагать у пациентов, страдающих нарушением коронарного кровообращения, при остром инфаркте миокарда, особенно в первые часы и сутки, у больных с митральным стенозом, при поражении электрическим током или молнией, при утоплении. При незамедлительно начатых реанимационных мероприятиях о фибрилляции может свидетельствовать положительная ответная реакция, которая на прекращение СЛР становится быстро отрицательной, а на новые попытки массажа сердца и ИВЛ - становится положительной (суживается зрачок, пальпируется пульс на сонной артерии).
Вторичная фибрилляция желудочков (после асистолии или ЭМД) чаще развивается на фоне длительного массажа сердца, а также после неоднократных введений адреналина. Переход асистолии сразу в нормосистолию, минуя фибрилляцию, может наблюдаться (по нашим данным с частотой 0,73), но лишь при условии быстро начатой реанимации с хорошей оксигенацией и коррекцией электролитного баланса.

Наиболее эффективным средством устранения любой фибрилляции является электрическая дефибрилляция. Химическая дефибрилляция лидокаином, новокаинамидом, растворами калия, бета-блокаторами играет вспомогательную роль и в чистом виде может использоваться при отсутствии дефибриллятора. Как правило, дефибрилляция эффективна при тонической, высоко амплитудной фибрилляции. К тому же электрический разряд оказывает полезный "дислокаторный эффект". Общая судорога поперечно-полосатой мускулатуры с последующим ее расслаблением способствует подкачиранию крови к сердцу и увеличению эффективности массажа.
Атоническая, низкоамплитудная фибрилляция, как правило, является следствием истощения энергетических резервов миокарда (тяжелый порок сердца, обширный инфаркт миокарда, массивная кровопотеря, медикаментозная, наркозная или алкогольная интоксикация pi др.), и успешная дефибрилляция возможна только после перехода атонической формы в тоническую.
Дефибриллирующий эффект зависит от множества факторов. Во-первых, это технические характеристики аппаратуры - величина и характер тока, длительность действия и форма импульса. Во-вторых, правильность методики ее исполнения и, наконец, множеств трудно учитываемых на практике факторов, зависящих "от ряда неоднородностей как на органном, так и на клеточном уровне" (М С. Богушевич с соавт., 1997).
В эксперименте и клинике подтверждена большая эффективность биполярного импульса (импульс Гурвича), нежели монополярного ("типа Эдмарка). При биполярном импульсе эффект обуславливается деполяризацией обеих сторон клетки (дефибриллятор "ДИ-03", длительность импульса 9 мс). При этом требуется меньшее пороговое значение энергии разряда: эффект дефибрилляции почти в два раза выше за счет суммации пиковых значений обеих полуволн, повреждение миокарда меньше. Монополярный импульс (дефибриллятор Lifepak-7) реализует механизм электрического пробоя плазменных мембран. Тем самым снижается дефибриллирующий эффект и возрастает эффект повреждения. Однако биполярный импульс также может вызвать эффект пробоя при надпороговых значениях разряда.
Устройство дефибриллятора с расположением электродов по принципу "грудь - спина" даёт большую однородность распределения тока по всем участкам миокарда. При расположении обоих электродов на передней поверхности грудной клетки создается криволинейное электрическое поле. При этом, как и в первом случае, больший размер электродов более целесообразен.
Сернокислая магнезия, бикарбонат натрия при реанимации больного.
Сернокислая магнезия. Дефицит магния нередко сопровождает сердечные аритмии, сердечную недостаточность, внезапную остановку сердца. Гипомагниемия может усиливать рефрактерную фибрилляцию желудочков, задерживать проникновение ионов калия в клетку. При неоднократно повторяющихся эпизодах фибрилляции сердца введение магния считается весьма целесообразным.
Доза магния, вводимого капельно в виде сернокислой магнезии, составляет 1-2 г (5-8 мл 25% раствора в 100 мл изотонического раствора хлорида натрия).
Требуется особая осторожность при введении растворов магния в восстановительном периоде, если имеется асистолия или гипотензия.
Бикарбонат натрия.
Метаболический ацидоз, нередко являясь первопричиной остановки сердца, всегда сопутствует в той или иной степени периоду сердечно-легочной реанимации. Это обусловлено низкой тканевой перфузией и гипоксией, неоднократным введением адреналина, высоким уровнем шунтирования крови в легких и тканях.
Считается, что при гипоксии ацидоз является направленной компенсаторной реакцией организма, при которой кривая диссоциации оксигемоглобина смещается вправо, прочность связи кислорода с гемоглобином снижается и потребление тканями кислорода улучшается. Появились экспериментальные работы, в которых утверждается, что возобновление сердечной деятельности у животных происходит быстрее в условиях ацидоза, нежели алкалоза. Однако любая клиническая ситуация гораздо сложнее любой экспериментальной модели. Тяжелый ацидоз на фоне системных расстройств у больного нельзя считать полезной физиологической реакцией организма.
Метаболический ацидоз оказывает немало отрицательных эффектов: тормозится активность ферментов тканевого дыхания, слабо проявляется или полностью отсутствует прессорный эффект адреналина, что требует введения больших его доз, снижается тонус миокарда, ослабевает реакция на электрический разряд дефибриллятора. Доказано, что ацидоз ведет к повреждению и гибели эндотелия, препятствует нормальному функционированию клеток, их регенерации, способствует образованию свободных радикалов.
Бикарбонат натрия - это буфер, действие которого проявляется во внеклеточном пространстве, в отличие от трис-буфера (ТНАМ - трисгидроксиметил-амино-метан), корригирующего внутриклеточный ацидоз. В отличие от бикарбоната, ТНАМ не содержит натрия и, следовательно, не вызывает гипернатриемии. Вместе с тем, при остановке сердца препарат не находит широкого применения, так как вызываемое им расширение артерий не способствует сохранению высокого диастолического давления, важного в период проведении реанимационных мероприятий. Отмечено его отрицательное влияние на функцию печени. Способность ТНАМ связывать СО2 может привести к резкой гипокапнии, которая еще более отрицательно воздействует на тонус артериального русла.
Известно, что после введения бикарбоната натрия в крови высвобождается С02. Отсюда вытекает, что для выведения С02, особенно после переливания бикарбоната, требуется хорошая вентиляция легких. Это тем более важно, что в терминальных ситуациях роль почек в коррекции рН весьма ограничена.
Существует мнение, что на первых этапах реанимации целесообразно поддерживать нормальный рН не введением бикарбоната, а гипервентиляцией легких и гипокапнией. Однако достичь гипервентиляции во время СЛР в силу самых разных причин не всегда удается.
Не следует забывать также, что "С02 - не просто результат оксидативных процессов, а существенный фактор их поддержания, необходимый для осуществления процессов карбоксилирования пирувата при его переходе в яблочную и щавелево-уксусную кислоты - главные компоненты цикла Кребса. При падении рС02 ниже 20 мм рт. столба оксидативные процессы в митохондриях глубоко нарушаются" (А. Лабори, 1970).
В последнее время отношение к применению бикарбоната натрия при остановке сердца претерпело значительные изменения. Указывается на ряд его отрицательных свойств: высокая осмолярность, способность снижать перфузионное коронарное давление, смещать кривую диссоциации оксигемоглобина влево и даже ухудшать исходы выживания после реанимации. Подобные эффекты бикарбоната, по-видимому, больше всего связаны со слишком ранним и быстрым введением необоснованно больших количеств препарата в условиях минимальной циркуляции и слабого возврата закисленной крови, которые складываются при низкопроизводительном массаже сердца.
Необоснованно преувеличенная опасность бикарбоната натрия нередко приводит к другой крайности, когда при явной необходимости коррекции ацидоза препарат не вводится.
С учетом всего изложенного следует остановиться на следующих рекомендациях:
1. Главными факторами в коррекции КОС при остановке сердца являются хорошая вентиляция легких и оксигенация с поддержанием тканевой перфузии, вначале с помощью массажа сердца, а затем -быстрейшим восстановлением и поддержанием эффективного самостоятельного кровообращения.
2. Бикарбонат натрия следует вводить на фоне эффективной ИВЛ после использования адреналина и проведения дефибрилляции.
3. Бикарбонат натрия должен использоваться всегда, если было известно об исходном метаболическом ацидозе и/или гиперкалиемии.
4. При невосстановлении деятельности сердца более 10 минут -использовать бикарбонат в дозе 1 ммоль/кг, что составляет примерно 2 мл/кг 4,2% - 5% раствора, с последующим введением половинной дозы через каждые 10 минут, если реанимация продолжается.
5. Во всех сомнительных случаях, при отсутствии лабораторных данных КОС, следует считать оправданным введение 100-150, а в некоторых случаях и 200 мл 5% раствора без опасности усугубить возможный метаболический алкалоз или гиперкапнию (введение 100— 180 мл 5% раствора повышает рС02 лишь на 5-10 мм рт. столба). Гиперкапния оказывает значительно меньший кардиодепрессорный эффект, нежели продукты метаболического молочнокислого ацидоза. По аналогии подобный подход можно сравнить с использованием 60 мл 40% раствора глюкозы для дифференциальной диагностики гипо- или гипергликемической комы. Некоторое усиление гипергликемии не будет иметь практически никакого значения для больного, тогда как при гипогликемических состояниях введением глюкозы можно достичь быстрого, иногда очень заметного улучшения.
6. При невозможности обеспечить эффективную вентиляцию легких (аспирация, отек легких, бронхоспазм и др.) от введения бикарбоната следует воздержаться до создания лучших условий вентиляции.
7. После восстановления сердечной деятельности вливание бикарбоната натрия желательно только после лабораторного исследования КОС. При невозможности получения таких данных препарат показан в случае подозрения на метаболический ацидоз по клиническим признакам: сохранение гипотензии, особенно с явлениями нарушений микроциркуляции (мраморность кожных покровов), необходимость применения вазопрессоров, при повторных остановках сердца, при кровопотере с переливанием больших количеств декстранов крови, имеющих, как правило, кислую реакцию.
Показания к интубации трахеи при оживлении.
Показания к интубации трахеи при оживлении:
1. Неэффективность вентиляции легких простейшими способами.
2. Большое сопротивление вдуванию воздуха (не снявшийся бронхоспазм, большой вес грудных желез при ожирении, у беременных, особенно при токсикозах).
3. Регургитация и аспирация желудочного содержимого, наличие большого количества мокроты, крови в полости рта, в трахее, бронхах.
4. Множественные переломы ребер.
5. Невосстановление сердечной деятельности более 5-7 минут.
6. Переход на открытый массаж сердца.
7. Необходимость транспортировки больного при продолжающейся реанимации.
При развитии фибрилляции желудочков у больного с инфарктом миокарда спешить с интубацией абсолютно не следует, так как теряется время, которое лучше использовать для электрической дефибрилляции. К тому же пребывание трубки в трахее без должной анестезии у этих больных может провоцировать повторные эпизоды фибрилляции.
Искусственная вентиляция легких автоматическими респираторами при оживлении затрудняет синхронизацию вдохов с ритмом массажа. При этом большая доля дыхательного объема сбрасывается через предохранительный клапан, не обеспечивая должного расправления легких при короткой фазе вдоха. Тем более, что с каждым сдавлением грудной клетки сопротивление в дыхательных путях за счет их мелких отделов всегда возрастает. Таким образом, автоматическим респиратором целе сообразно пользоваться, когда реаниматолог не имеет помощников. В этой ситуации Vt следует увеличить до 1000-1200 мл, Ve до 12-14 л/мин, что обеспечит частоту дыхания около 12 в минуту и позволит проводить массаж в соотношении с дыханием как 5 : I. Если реанимацию проводят двое, надо всегда переходить на ручную вентиляцию дыхательным мехом типа "Амбу", либо мехом наркозного аппарата или респиратора.
В благоприятных условиях вентиляцию легких следует проводить 100% кислородом или с максимальным добавлением его в воздушно-кислородную смесь ручных портативных аппаратов. Хотя гипероксия как противоишемическое средство признается не всеми авторами, все зависит от времени ее создания. Представляется, что на стадии "заместительного эффекта", каким является период немедленно начатой реанимации, высокие концентрации кислорода в дыхательной смеси оправданы. Тем более, что в этой ситуации мы часто встречаемся со множеством барьеров на пути доступа кислорода (аспирапия, отек легкого, низкая производительность массажа сердца, вазоспазм и т. п.). В восстановительном периоде после оживления для профилактики неизбежных реперфузионных осложнений в головном мозге и других органах может стоять вопрос о более низких концентрациях кислорода, подаваемого при ИВЛ с целью профилактики так называемого "кислородного парадокса". Суть его состоит в том, что в постишемическом периоде содержание кислорода в органе может значительно превышать его потребности и антаоксидантные возможности, что создает условия для нарастания процессов ПОЛ. Эта проблема еще окончательно не разрешена и требует изучения. Однако, без всякого сомнения, в первые минуты и часы после восстановления устойчивой сердечной деятельности вентиляция чистым кислородом должна быть прекращена, а РаО2 поддерживаться на субнормальных и нормальных цифрах. В клинике мы пока не в состоянии определить ту степень оксигенащш, которая в постишемическом периоде может играть резко негативную роль. Оптимальной считается 40-60%-ное содержание кислорода в дыхательной смеси в сочетании с антиоксидантной медикаментозной терапией.

Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
- восстановление проходимости дыхательных путей;
- искусственную вентиляцию легких (ИВЛ) и оксигенацию;
- непрямой массаж сердца.
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
- электрокардиографию и дефибрилляцию;
- обеспечение венозного доступа и введение медикаментозных средств;
- интубацию трахеи.
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
У пациентов с фибрилляцией желудочков и желудочковой тахикардией рекомендуется при отсутствии подготовленного к работе дефибриллятора нанести прекордиальный удар (1–2 резких удара кулаком в область границы средней и нижней трети грудины с расстояния не менее 30 см).
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
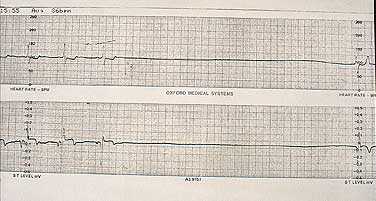
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара
Сердечно-легочная реанимация на догоспитальном этапе
Каковы наиболее частые причины внезапной смерти? Что можно сделать в случаях остановки дыхания и кровообращения на догоспитальном этапе? Почему внутрисердечный путь введения лекарственных средств — «путь отчаяния»? Сердечно-легочная реанимация — э
Каковы наиболее частые причины внезапной смерти?
Что можно сделать в случаях остановки дыхания и кровообращения на догоспитальном этапе?
Почему внутрисердечный путь введения лекарственных средств — «путь отчаяния»?
Сердечно-легочная реанимация — это комплекс мероприятий, направленных на оживление организма в случае остановки кровообращения и/или дыхания. Своевременное (в течение первых минут) начало реанимационных мероприятий может предотвратить необратимое повреждение мозга и, возможно, наступление биологической смерти.
Большинство случаев внезапной смерти имеют кардиальную причину.
Основными признаками остановки кровообращения являются потеря сознания, остановка дыхания и отсутствие пульса (следует оценивать наличие пульса на сонных артериях).
Сердечно-легочная реанимация (СРЛ) состоит из двух основных частей.
- Основные реанимационные мероприятия (ОРМ) или неспецифическая реанимация. Проводится вне зависимости от причины остановки кровообращения и включает в себя поддержание кровообращения (наружный массаж сердца с частотой 80—100 компрессий в минуту следует производить, положив больного на твердую поверхность), а также обеспечение проходимости дыхательных путей и достаточного уровня вентиляции легких (искусственная вентиляция легких — 12 вдохов в минуту методами «рот в рот», «рот в нос» или с помощью дыхательного мешка). Начинать реанимацию следует со вдоха, а затем, в том случае если реанимацию проводит один человек, осуществлять 12—15 компрессий на 2 вдоха, если же два человека — 5 компрессий на один вдох. Вероятность сохранения жизни пациента в случае остановки кровообращения обратно пропорциональна времени, прошедшему до момента начала реанимационных мероприятий.
Алгоритм действий при проведении ОРМ представлен на рис. 1.
- Специализированные реанимационные мероприятия — использование лекарственных средств и реанимационного оборудования в зависимости от причин, вызвавших остановку кровообращения. Эти мероприятия не исключают, а дополняют ОРМ.
Способы введения лекарственных препаратов при СЛР
Внутривенный. При налаженном периферическом венозном доступе возможно введение лекарственных препаратов в периферическую вену, но после каждого болюсного введения необходимо поднимать руку больного для ускорения доставки препарата к сердцу, сопровождая болюс введением некоторого количества жидкости (для его проталкивания). С целью обеспечения доступа в центральную вену предпочтительно катетеризировать подключичную или внутреннюю яремную вену. Введение лекарственных препаратов в бедренную вену сопряжено с их замедленной доставкой к сердцу и уменьшением концентрации.
Эндотрахеальный. Если интубация трахеи произведена раньше, чем обеспечен венозный доступ, то атропин, адреналин, лидокаин можно вводить зондом в трахею. При этом препарат разводят на 10 мл физиологического раствора, и его доза должна быть в 2–2,5 раза больше, чем при внутривенном введении. Конец зонда должен находиться ниже конца интубационной трубки; после введения препарата необходимо выполнить последовательно 2—3 вдоха (прекратив при этом непрямой массаж сердца) для распределения лекарства по бронхиальному дереву.
Внутрисердечный. «Путь отчаяния» применяется лишь в том случае, если невозможен другой способ введения. Следует по возможности воздерживаться от внутрисердечных инъекций, так как при использовании этого способа в 40% случаев повреждаются крупные коронарные артерии.
Тактика реанимации при фибрилляции желудочков и гемодинамически неэффективной желудочковой тахикардии
Начинать реанимацию необходимо с ОРМ и электрической дефибрилляции (ЭДФ). Дефибрилляцию начинают с разряда мощностью 200 Дж. При сохранении фибрилляции снова используют разряд, но более высокой мощности — 200—300 Дж, затем — 360 Дж. Начинать реанимационные мероприятия сразу с разряда максимальной мощности не следует, чтобы избежать повреждающего действия на миокард.
При неэффективности вышеперечисленных мероприятий возобновляют ОРМ, производят интубацию трахеи, налаживают венозный доступ, вводят адреналин в дозе 1 мг каждые 3—5 минут; можно вводить возрастающие дозы адреналина 1—3—5 мг каждые 3—5 минут или промежуточные дозы 2—5 мг каждые 3—5 минут. Адреналин можно заменить вазопрессином, который вводится в дозировке 40 мг в вену однократно.
При продолжении фибрилляции желудочков используют антиаритмические препараты, которые позволяют снизить порог дефибрилляции:
- лидокаин 1,5 мг/кг внутривенно струйно, повторное введение через 3-5 минут, в случае восстановления кровообращения налаживают непрерывную инфузию лидокаина со скоростью 2-4 мг/мин;
- амиодарон 300 мг в вену за 2-3 минуты, при отсутствии эффекта возможно введение еще 150 мг в вену; в случае восстановления кровообращения налаживают непрерывную инфузию в первые 6 часов 1мг/мин (360 мг), в следующие 18 часов 0,5 мг/мин (540 мг);
- прокаинамид в дозировке 100 мг; при необходимости введение повторяют через 5 минут (до общей дозы 17 мг/кг);
- сульфат магния 1-2 г в течение 5 минут, при необходимости введение можно повторить через 5-10 минут при тахикардии "пируэт".
После введения лекарства 30—60 секунд проводят ОРМ, а затем повторно проводят ЭДФ (за это время антиаритмик достигает цели). Рекомендуется чередовать введение лекарств с ДФ по такой схеме: антиаритмик — ЭДФ (360 кДж) — адреналин — ЭДФ (360 кДж) —антиритмик — ЭДФ (360 кДж) — адреналин и т. д. Можно использовать не один, а три разряда максимальной мощности. Количество ЭДФ не ограничено.
Алгоритм действий при фибрилляции желудочков представлен на рис. 2.
Широко практиковавшееся ранее введение бикарбоната натрия (как средства борьбы с ацидозом) в настоящее время применяется значительно реже из-за ограниченных показаний:
- затянувшиеся (более 15 минут) реанимационные мероприятия;
- отравление трициклическими антидепрессантами;
- выраженный ацидоз;
- гиперкалиемия.
Бикарбонат натрия вводится в дозе 1 мэкв/кг в вену (в среднем 140–180 мл 4%-ого раствора).
Тактика при электромеханической диссоциации
Электромеханическая диссоциация (ЭМД) — это отсутствие пульса и дыхания у больного с сохраненной электрической активностью сердца (на мониторе ритм виден, а пульса нет).
К сожалению, прогноз при этом виде нарушения деятельности сердца плохой, если не устраняется причина, вызвавшая остановку кровообращения (ацидоз, гиповолемия, гипоксия, гипотермия, тампонада сердца, напряженный пневмоторакс).
Лечение ЭМД включает ОРМ, внутривенное введение адреналина — 1 мг каждые 3—5 минут и атропина 1 мг каждые 3—5 минут, электрокардиостимуляцию, на 15-й минуте реанимации введение бикарбоната натрия. Необходимо попытаться устранить причину ЭМД.
Тактика при асистолии
Тактика устранения этой причины остановки кровообращения практически не отличается от схемы лечения ЭМД. Необходимо обратить внимание на то, что ЭКГ в одном отведении при мелковолновой фибрилляции желудочков может имитировать экстрасистолию, поэтому асистолия должна быть подтверждена в нескольких отведениях ЭКГ. Электрическая дефибрилляция в этом случае не только не показана, но даже вредна, так как она усиливает ваготонию. Лечение включает ОРМ, в вену вводится адреналин — 1 мг каждые 3—5 минут, атропин — 1 мг каждые 3—5 минут, проводится электрокардиостимуляция, на 15-й минуте реанимации показано введение бикарбоната натрия. Необходимо попытаться устранить причину асистолии. Алгоритм действий при асистолии представлен на рис. 3.
Заключение
В случае успешно проведенных реанимационных мероприятий необходимо:
- убедиться в том, что имеет место адекватная вентиляция легких (проходимость дыхательных путей, симметричность дыхания и экскурсии грудной клетки; оценить цвет кожных покровов, при наличии пульсоксиметра убедиться, что сатурация кислородом составляет не менее 90%);
- продолжить введение антиаритмиков с профилактической целью;
- попытаться выявить, какое патологическое состояние привело к остановке кровообращения, и начать лечение основного заболевания.
А. Л. Верткин, доктор медицинских наук, профессор
О. Б. Талибов, кандидат медицинских наук
О. Н. Ткачева
МГМСУ, ННПОСМП, Москва
Читайте также:
- Лучевая диагностика повреждения селезенки
- Классификация лейкодистрофий по поражению клеток, нарушению метаболизма
- КТ при хроническом отомастоидите с тимпаносклерозом
- Питуитрин и коронарная недостаточность. Некроз миокарда под действием вазопрессина
- Возбудитель амебных кератитов. Диагностика возбудителя амебных кератитов. Лечение амебного кератита.
