Серологические методы исследований. Аллергологические методы исследования.
Добавил пользователь Алексей Ф. Обновлено: 24.01.2026
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
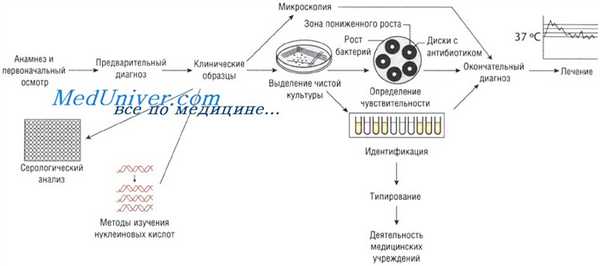
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Идентификация - это комплекс бактериологических методов изучения бактерий, позволяющий определить вид микроорганизма. В Лаборатории «Ситилаб» идентификация большинства видов бактерий и грибов осуществляется на автоматическом бактериологическом анализаторе с использованием диагностических панелей зарубежного производства: на бланке результата исследования в виде наименования микроорганизма или его рода, например, Streptococcus pneumoniae (пневмококк) или Eschrichia coli (кишечная палочка).
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
В Лаборатории «Ситилаб» определение чувствительности выделенной чистой культуры большинства видов бактерий и грибов осуществляется на автоматическом бактериологическом анализаторе с использованием диагностических панелей зарубежного производства к широкому спектру современных антибактериальных препаратов (от 6 до 32 препаратов, в зависимости от выделенного микроорганизма) с определением минимальной ингибирующей концентрации (МИК). На бланке результатов определения чувствительности к антибактериальным препаратам обозначение R указывает на резистентность, I - умеренную чувствительность, S - чувствительность микроорганизма к данному препарату.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
1. Обнаружение с диагностической целью антител в сыворотке крови обследуемого. В этом случае из двух компонентов реакции (антитело, антиген) неизвестным является сыворотка крови, так как постановка реакции проводится с заведомо известными антигенами. Положительный результат реакции свидетельствует о наличии в крови антител, гомологичных применяемому антигену; отрицательный результат указывает на отсутствие таковых. Достоверные результаты получают при исследовании «парных» сывороток крови больного, взятой в начале заболевания (3-7-й день) и через 10-12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Серологические методы исследований. Аллергологические методы исследования.
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.
Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.
Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Метод гибридизации нуклеиновых кислот в растворах даёт наиболее быстрые результаты (рис. 11-18, А). Широкому внедрению метода препятствует проблема удаления несвязавшихся нитей нуклеиновых кислот.
Метод гибридизации нуклеиновых кислот на твёрдой основе (рис. 11-18, Б) и его сэндвич-модификация (рис. 11-18, В) распространён больше. В качестве твёрдой основы служат мембраны из нитроцеллюлозы или нейлона. Несвязавшиеся реагенты удаляют многократным отмыванием.
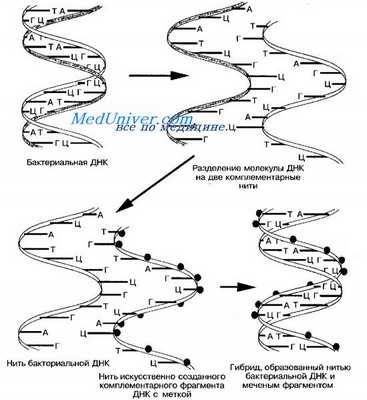
Рис. 11-17. Схема гибридизации нуклеиновых кислот.
Полимеразная цепная реакция ( ПЦР )
Основу метода ы составляет катализируемое ДНК-полимеразой многократное образование копий определённого участка ДНК. Первоначально проводят отжиг — термическое разделение двухнитевой молекулы ДНК на отдельные цепочки. Затем среду охлаждают и вносят праймеры (затравки), комплементарные нуклеотидным последовательностям обеих цепочек. Для запуска реакции применяют синтетические праймеры — олигонуклеотиды, состоящие из 10-20 нуклеоти-дов (например, дезоксинуклеотидтрифосфат), взаимодействующие с окончаниями последовательностей и образующие последовательности в 50-1000 оснований. Затем в среду вносят термостабильную tag-полимеразу (по названию бактерии Thermits aquaticus), что запускает образование вторичных копий цепей ДНК, после чего образующиеся двухнитевые молекулы ДНК снова подогревают. Образующиеся отдельные цепочки остужают, вносят праимеры и снова повторяют процедуру подогрева и охлаждения; поскольку tag-полимераза термостабильна, то необходимость в её повторном внесении отсутствует (рис. 11-19). ПЦР позволяет получить большие количества изучаемого фрагмента ДНК даже в том случае, если в распоряжении исследователя имеется всего лишь одна исходная молекула геномной ДНК. Идентификацию копий ДНК проводят методом электрофореза. Метод полимеразной цепной реакции ( ПЦР ) лежит также в основе ДНК-идентификации личности, установления родства людей, выявления генов наследственных болезней и пр.
Рис. 11-18. Гибридизация нуклеиновых кислот: в растворах (А), на твёрдой основе (Б), сэндвич-гибридизация (Б)
Серологические методы диагностики бактерий
Классические серологические реакции применяют для выявления бактериальных AT, а также для выявления Аг, особенно для идентификации бактериальных Аг. Среди современных методов наибольшее распространение нашли методы твердофазного ИФА и латекс-агглютинации.
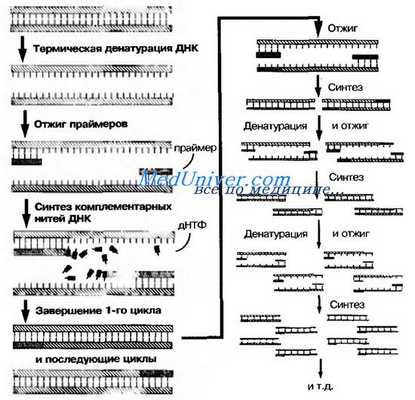
Рис. 11-19. Схема ПЦР. дНТФ — дезоксинуклеотидтрифосфат
Аллергологические методы диагностики бактерий
Сенсибилизирующей активностью обладает ограниченное количество бактериальных Аг. Поэтому метод кожных проб применяют лишь при диагностике туберкулёза, сапа, мелиоидоза, бруцеллёза и туляремии.
Что такое серологические исследования крови
Диагностика является важнейшим этапом в лечении любого заболевания. В зависимости от правильно поставленного диагноза находится не только успешное лечение, но и возможность предотвратить развитие осложнений и сопутствующих патологий. Серологическое исследование что это такое? Это метод диагностического анализа биологического образца пациента на предмет наличия антител и антигенов. Тест позволяет выявить десятки заболеваний, фазу болезни и контролировать лечение.
Для чего назначается исследование
Этот тип медицинского исследования широко применяется в различных областях медицины. Реакция связывания комплемента или РСК направлена на выявление в сыворотке крови специфических клеток, антител, которые вырабатывает организм для борьбы с инфекциями и вирусами.
Изосерологическое исследование направлено на определение группы крови, резус-фактора и других параметров крови пациента.
- Серологический анализ крови используется в гинекологии для выявления заболеваний, передающихся половым путем. Также серологическое титрование используется для комплексного обследования будущих мам (токсоплазмоз, ВИЧ, сифилис и пр.). При постановке на учет беременных, это обязательный тест.
- В педиатрии серологические реакции применяются для подтверждения диагноза «детских» болезней (ветрянка, краснуха, корь и пр.), если симптомы выражены не ярко и нет возможности определить недуг по клиническим показаниям.
- Серологические исследования позволяют венерологам быстро и безошибочно ставить диагноз. При схожих симптомах и жалобах анализ крови позволяет выявить антитела к сифилису, лямблиозу, уреплазмозу, хламидиозу, герпесу и другим заболеваниям.
- Гастроэнерологи, гепатологи и инфекционисты используют серологический анализ крови для диагностики вирусного гепатита.
- Подозрение на любое инфекционное или вирусное заболевание может возникнуть у терапевта. Для подтверждения используются серологические реакции на специфические антитела в организме. Проводится анализ на энцефалит, бруцеллез, коклюш, вирус Денге, вирус иммунодефицита, аллергию и пр.
- Серологическая диагностика для госпитализации играет важную роль. Этот метод диагностики может показать, на какой стадии развития находится болезнь, и требуется ли немедленное оформление в стационар или достаточно амбулаторного лечения.
В качестве биологического материала для исследования может использоваться образец слюны и кала, но чаще всего используется венозная кровь пациента. Анализ для серологических реакций должен браться из локтевой вены в лабораторных условиях. Перед тем как сдать анализ следует проконсультироваться с лечащим врачом и подготовиться.
Подготовка к анализу
Этот тип исследования проводится как в муниципальных, так и в коммерческих учреждениях. Выбор лучше сделать в пользу той лаборатории, которая располагает самым современным оборудованием и имеет только положительные отзывы о своей работе. Для занятых пациентов лаборатория может предоставлять услуги по забору крови на РСК дома.
В этом случае пациенту не приходиться тратить время на дорогу, а очереди исключены.
Подготовка к забору венозной крови включает в себя несколько общих правил. Перед тестом нельзя употреблять пищу, то есть анализ берется натощак. Сдавая кровь необходимо находиться в состоянии спокойствия и не волноваться. Перед процедурой не следует проходить другие процедуры (рентгенография, ультразвуковое обследование и пр.). За несколько недель до забора крови по согласованию с лечащим врачом отменяется прием лекарственных препаратов. Некоторые рекомендации зависят от болезни, на которую проводится тест. Например, при исследовании на гепатит за 2 дня до анализа из рациона исключают жирную пищу и алкоголь.
Реакция флюоресценции
Один из видов серологических реакций флюоресценция или РИФ. Этот метод исследования проводится с использованием реагента, который подсвечивает искомые антитела в сыворотке крови. Для постановки серологической реакции прямого типа или ПИФ специфические антитела помечаются флюоресцирующим веществом. Это самый быстрый тип исследований, который проводится в один этап.
Другой способ, который называется непрямым или РНИФ, проводится в 2 стадии. На первой специфические клетки (антитела) не имеют флюоресцирующих меток, а на второй используются соответствующие меченые антитела для выявления комплекса антиген-антитело. Реакция свечения появляется только после связи со специфическим антителом. Результат манипуляций оценивается специальным прибором, который оценивает интенсивность излучения, а также определяет форму и размер исследуемых объектов. Инфекционный агент определяется с достоверностью 90-95% в зависимости от типа и стадии заболевания.
Иммуноферментный анализ
Для исследования ИФА серологические реакции проводятся с использованием уникальных стабильных реагентов. Вещества с меткой присоединяются к определенному (искомому) типу антител. В результате серология дает качественную или количественную оценку по образцу крови пациента. Если субстрат не имеет выраженных маркеров, результат считается отрицательным. В случае качественного исследования положительный результат означат только присутствие антител в биологическом образце.
Серодиагностика с количественным определением клеток антител дает более полную картину. По сумме выявленных клеток врач может сказать находится ли заболевание в начальной стадии, острой или это обострение хронической формы болезни. При постановке диагноза также учитывается киническая картина и жалобы пациента.
Особенности исследований
При исследовании на бруцеллез проводится контроль сыворотки крови на самозадержку без антигена. Это позволяет повысить достоверность теста. Результат анализа на бруцеллез может быть положительным, отрицательным или невыраженным, то есть вызывающим сомнения. При получении сомнительных результатов, рекомендуется повторный забор крови. Также бруцеллез диагностируется по результатам посева крови, исследования костного мозга и спинно-мозговой жидкости.
Достоинства и недостатки серологии
Диагностика с применением серологических методов широко используется в современной медицине. Особенно актуален этот тест при выявлении вирусных и инфекционных заболеваний. Этот же тип анализов используется при географических скринингах и медицинских обследованиях для предотвращения эпидемиологических вспышек.
Серологические анализы имеют ряд преимуществ.
- Серологический тест любого типа имеет высокую достоверность.
- Анализы на серологию проводятся достаточно быстро. Результат РСК известен уже через сутки, а получить его можно посредством интернета, не выходя из дома. В особых случаях при стационарном лечении тест проводится в течение нескольких часов.
- РСК позволяет контролировать развитие болезни, и отслеживать эффективность проводимого лечения.
- Серологические методы исследования отличаются невысокой стоимостью и доступны пациентам.
Серологические анализы имеют и некоторые недостатки. Для того, чтобы обследование дало максимально достоверную информацию анализ крови следует проводить с учетом времени инкубационного периода болезни.
Простой герпес 1 и 2 типа можно определить только спустя 2 недели после заражения, а исследование на вирус иммунодефицита проводится спустя 1, 3 и 6 месяцев после контакта с больным.
На достоверность исследования может повлиять человеческий фактор. Если пациент пренебрегает правилами подготовки к исследованию или лаборант допустил ошибку в обработке образца крови, возможно получение ложного или сомнительного результата. Такая ситуация возникает приблизительно в 5% случаев. Как правило, лечащий врач на основании клинических показаний легко вычисляет ошибку РСК.
Серологическое исследование крови современный и надежный способ выявления таких опасных заболеваний как ВИЧ, гепатит, бруцеллез, ЗППП и пр. Этот раздел медицины направлен на изучение плазмы крови человека и ее иммунологических свойств. Серологический метод широко распространен, а стоимость исследований в частных лабораториях сравнительно невысока. Для проведения анализа используется современное оборудование, которое сводит к минимуму влияние человеческого фактора на результаты исследований.
Серологические и иммунологические исследования
Серологические исследования - методы изучения взаимодействия антигенов с антителами в сыворотке крови. Серологическая диагностика базируется на определении специфических антител, которые образуются в процессе иммунного ответа, вызванного проникновением антигена - возбудителя заболевания.
Серологические реакции (реакции «антиген-антитело») применяются для определения антигенов групп крови, в диагностике заболеваний, в судебной медицине для идентификации тканевых, микробных антигенов.
Название «серология» - от латинских слов serum (сыворотка) и logos (знание) - учение о сыворотке крови и ее свойствах.
Серологические реакции:
реакции агглютинации
реакции преципитации
реакции нейтрализации
реакции с участием комплемента
реакции с использованием меченых антител или антигенов
- реакция агглютинации хорошо выявляет lgM-антитела, но менее чувствительна для определения lgG-антител.
- реакции связывания комплемента и гемолиза, которые требуют участия комплемента, не выявляют lgA-антитела и lgE-антитела.

Иммунологические исследования позволяют идентифицировать вирусные, бактериальные, паразитарные заболевания, определять титры антител к ним, что позволяет оценивать устойчивость организма к отдельным видам инфекционных заболеваний и прогнозировать их развитие.
Чувствительность И.м.и. превосходит все другие методы исследования антигенов и антител - с их помощью определяют группу и проверяют безопасность крови (гепатит В и ВИЧ-инфекция), при трансплантации тканей и органов определяется совместимость тканей.
Антиген - вещество, которое распознается организмом как чужеродное, и способное запускать иммунную (защитную) реакцию.
Антитела (иммуноглобулины -IgG, IgA, IgM, IgD, IgE) - белки, образующиеся в ответ на проникновение в организм антигена. Связываясь активными участками (антигенными детерминантами) с бактериями или вирусами, антитела препятствуют их размножению, нейтрализуют выделяемые ими токсические вещества.
Реакции агглютинации.
Это реакции, основанные на феномене агглютинации - склеивании носителей антигена с помощью иммунной сыворотки к этому антигену. Корпускулярные антигены (крупные частицы - микробные клетки, эритроциты, лейкоциты и т.д., склеиваются антителами и выпадают в осадок на дно пробирки в виде иммунных комплексов в форме хлопьев или зерен, видимых невооруженным глазом).
Различают:
прямые реакции агглютинации, используемые для выявления антител в сыворотке крови больного.
Реакция агглютинации бактерий с использованием соответствующей антибактериальной сыворотки относится к наиболее простым серологическим реакциям. Взвесь бактерий добавляют к различным разведениям испытуемой сыворотки крови и через определенное время контакта при t°37° регистрируют, при каком наивысшем разведении сыворотки крови происходит агглютинация. Реакцию агглютинации бактерий используют для диагностики многих инфекционных заболеваний: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа.
Реакции агглютинации для определения группы крови и резус-фактора основаны на взаимодействии аллоантител (изоантител) и антигенов эритроцитов. Для их обнаружения используют реакцию Кумбса, основанную на выявлении неполных антител с помощью антиглобулиновых сывороток.
К эритроцитам известной специфичности добавляют исследуемую сыворотку крови, антиглобулиновую сыворотку против lgG (непрямая реакция Кумбса). Fab-фрагменты неполных антител исследуемой сыворотки крови присоединяются к эритроцитам, а к свободным Fc-фрагментам этих антител присоединяются антитела против lgG, и происходит агглютинация эритроцитов.
реакция пассивной, или непрямой гемагглютинации основана на использовании эритроцитов с адсорбированными на их поверхности антигенами, взаимодействие которых с соответствующими антителами сыворотки крови больных приводит к образованию фестончатого осадка. Используется для определения беременности, выявления повышенной чувствительности больных к лекарственным препаратам и гормонам;
В реакции пассивной (непрямой), гемагглютинации (РПГА, РНГА) используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител.
Эритроциты, сенсибилизированные антителами. называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.
Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных бактериями (брюшной тиф и паратифы, дизентерия, бруцеллез, чума, холера и др.), простейшими (малярия) и вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.), а также для определения некоторых гормонов, выявления повышенной чувствительности больного к лекарственным препаратам и гормонам, например пенициллину и инсулину.
реакция торможения гемагглютинации основана на способности антител иммунной сыворотки нейтрализовать вирусы, которые в результате теряют свойство склеивать эритроциты. Используется для диагностики вирусных болезней;
Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможении) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами. например, для серодиагностики клещевого энцефалита в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t°4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит
реакция коагглютинации — разновидность реакции агглютинации, в которой антигены возбудителя определяют с помощью стафилококков, предварительно обработанных иммунной диагностической сывороткой.
Реакции преципитации.
Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело. Широко применяют различные разновидности реакции преципитации в полужидких гелях агара или агарозы (метод двойной иммунодиффузии по Оухтерлоню, метод радиальной иммунодиффузии, иммуноэлетрофорез), которые носят одновременно качественный и количественный характер.
В результате свободной диффузии в геле антигенов и антител в зоне оптимального их соотношения образуются специфические комплексы — полосы преципитации, которые выявляют визуально или при окрашивании. Особенностью метода является то, что каждая пара антиген — антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител
Реакция связывания комплемента (РСК) основаны на способности субкомпонента комплемента Clq и затем других компонентов комплемента присоединяться к иммунным комплексам, позволяют титровать антигены или антитела по степени фиксации комплемента комплексом антиген — антитело. Эта реакция состоит из двух фаз: взаимодействия антигена с испытуемой сывороткой крови (исследуемая система) и взаимодействия гемолитической сыворотки с эритроцитами (индикаторная система). При положительной реакции в исследуемой системе происходит связывание комплемента, и тогда при добавлении сенсибилизированных антителами эритроцитов гемолиза не наблюдается. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.
Иммунное прилипание. Эритроциты, тромбоциты и другие клетки крови имеют на поверхности рецепторы к третьему компоненту комплемента (СЗ). Если к антигену (бактериям, вирусам и др.) добавить соответствующую иммунную сыворотку и комплемент, то образуется комплекс антиген — антитело, покрытый СЗ-компонентом комплемента. Эту реакцию применяют при изучении ряда вирусных инфекций (клещевого энцефалита, денге), которые сопровождаются иммунопатологическими процессами и циркуляцией в крови вирусных антигенов в комплексе с антителами.
Реакция нейтрализации основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. В бактериологии эту реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов. Реакцию нейтрализации токсинов можно оценивать по биологическому эффекту, так, например, титруют антистолбнячные и антиботулинические сыворотки. Смесь токсина с антисывороткой, введенная животным, не вызывает их гибели. Различные варианты реакции нейтрализации применяют в вирусологии. При смешивании вирусов с соответствующей антисывороткой и введении этой смеси животным или в клеточные культуры патогенность вирусов нейтрализуется и при этом животные не заболевают, а клетки культур не подвергаются деструкции.
Реакции с использованием химических и физических меток
Иммунофлюоресценция заключается в использовании меченных флюорохромом антител, точнее, иммуноглобулиновой фракции антител lgG. Меченное флюорохромом антитело образует с антигеном комплекс антиген — антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию прямой иммунофлюоресценции используют для изучения клеточных антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках. На обнаружении антигенов вирусов в клетках отпечатков со слизистой оболочки носа основана экспресс-диагностика гриппа, парагриппа и аденовирусной инфекции.
Более широко применяют метод непрямой иммунофлюоресценции. основанный на выявлении комплекса антиген — антитело с помощью люминесцирующей иммунной сыворотки против lgG-антител и используемой для обнаружения не только антигенов, но и титрования антител. Метод нашел применение в серодиагностике герпеса, цитомегалии, лихорадки Ласса. Препараты с наслоенной исследуемой сывороткой крови помещают в термостат при t° 37° для образования иммунных комплексов, а затем после отмывания несвязавшихся реагентов выявляют эти комплексы меченой люминесцирующей сывороткой против глобулинов человека. Применяя меченые иммунные сыворотки против lgM- или lgG-антител, можно дифференцировать тип антител и обнаруживать ранний иммунный ответ по наличию lgM-антител.

Иммунологические методы исследования основаны на специфическом взаимодействии антигенов и антител. Широко используются для определения групп крови, лабораторной диагностики инфекционных и паразитарных заболеваний, тканевых и опухолевых антигенов, видовой принадлежности белка, распознавания аллергии и аутоиммунных болезней, беременности, гормональных нарушений, в научно-исследовательской работе. Они включают серологические исследования (реакции прямого воздействия антигенов и антител сыворотки крови).
При переливании крови и ее компонентов клинически значимыми являются группы крови по следующим системам:
- система АВ0, включающая антигены А, В;
- система Резус, включающая антиген Резус-принадлежности класса D и антигены эритроцитов С, с, Е, е;
- система Келл, включающая антигены эритроцитов класса К.
Исследование образцов донорской крови для определения групп крови по системам АВ0, Резус-принадлежности, определения фенотипа антигенов эритроцитов по системам Резус и Келл, скрининга антиэритроцитарных аллоантител.
Иммунологические методы: метод агглютинации, основанный на слипании и выпадении в осадок частиц (агглютинатов), корпускулярного антигена под воздействием антител (агглютининов) - для определения групп крови по системам АВ0, Резус-принадлежности и фенотипа антигенов эритроцитов по системам Резус и Келл; метод гемагглютинации, основанный на способности эритроцитов с адсорбированными антигенами или антителами агглютинироваться в присутствии гомологичных сывороток или соответствующих антигенов с образованием гемагглютинатов (определение Резус-принадлежности, фенотипа антигенов эритроцитов по системам Резус и Келл, скрининга антиэритроцитарных аллоантител).
Группа крови по системе АВ0 определяется перед каждым взятием у донора крови или ее компонентов с использованием моноклональных антител специфичности анти-А, анти-В одной серии реактивов;повторное определение группы крови по системе АВ0 проводится из образца донорской крови, взятого во время донации перекрестным способом со стандартными эритроцитами А, В
Резус-принадлежность определяется наличием или отсутствием антигена D, выявляемого при исследовании образца донорской крови, взятого во время донации;Резус-принадлежность устанавливается как положительная при наличии антигена D и как отрицательная при отсутствии антигена D; производится типирование антигенов эритроцитов С, с, Е, е системы Резус;определения антигена эритроцитов К системы Келл;скрининг антиэритроцитарных аллоантител донорской крови;устанавливается специфичность антител к антигенам эритроцитов.
Метод иммунохемилюминесцентного анализа, основанный на выявлении комплекса "антиген-антитело" при взаимодействии антигенов со специфическими антителами для определения маркеров вирусов иммунодефицита человека, гепатитов В и С и возбудителя сифилиса
Метод пассивной гемагглютинации, основанный на способности эритроцитов с адсорбированными растворимыми антигенами агглютинироваться в присутствии специфической иммунной сыворотки с образованием гемагглютинатов, - используется для определения маркеров возбудителя сифилиса
Метод преципитации, основанный на взаимодействии эквивалентных количеств мелкодисперсных растворимых антигенов (преципитиногенов) с соответствующими антителами (преципитинами) с образованием комплекса антиген-антитело (преципитата) и последующим выпадением данного комплекса в осадок, - используется для выявления неспецифических антител к кардиолипиновому антигену при диагностике сифилиса;
антитела к эритроцитарным антигенам
гемолитическая болезнь новорожденных
Определение группы крови системы АВО (простая и перекрестная реакция). Определение группы крови системы Резус
Фенотипирование антигенов эритроцитов всех известных систем.
Выявление, определение активности и специфичности аллоиммунных антиэритроцитарных антител классов IgG и IgM.
Определение аутоиммунизации к антигенам эритроцитов. Индивидуальный подбор эритроцитсодержащих компонентов для переливания.
Диагностика иммуноконфликтной беременности и гемолитической болезни новорожденных.
Иммунологические исследования (анализ крови):
Определение цитокинов в периферической крови
Уровень интерферона и секреция его лейкоцитами (пробирка с гепарином)
Определение фагоцитарной активности (пробирка с гепарином)
Определение спонтанной миграции - моноцитов и нейтрофилов ( пробирка с гепарином)
Окислительная активност
ь фагоцитарных клеток (пон, вт, ср, чтв. до 1100, пробирка с гепарином)
Иммуноглобулины IgE, IgM, IgG, IgA
Определение Rh-фактора
Определение антирезусных антител
Определение антирезусных антител с раститровкой
Определение антигрупповых антител
Определение совместимости крови супругов с определением группы и Rh-фактора
Определение антифосфолипидных антител (lgG+ IgM)
Определение антинуклеарных антител
Определение антител к ДНК
Определение антиспермальных антител в крови (общие)
Определение антиспермальных антител в сперме IgG
Определение антиовариальных антител
Определение антител к Zona pellucida
Определение ревматоидного фактора с латексом
Определение антистрептолизина «0»
Определение С-реактивного белка (качественное)
Определение С-реактивного белка (количественное)
Исследования на сифилис:
Иммуноферментный анализ (IgG)
Обследование на сифилис (иммуноферментный анализ) с раститровкой
Реакция микроагглютинации на сифилис
Исследования на гепатит А:
Антитела класса IgM
Исследования на гепатит В:
Австралийский антиген - HBsAg
НbсогАb - общие
Определение числа копий вируса гепатита В (вирусная нагрузка)
НВеАg
ПЦР (пробирка с ЭДТА)
AнтиHBsAd
b - иммуноглобулины М
АнтиНВеАb
Исследования на гепатит С:
Антитела (общие)
Анализ крови на антитела к NS3, NS4, NS5, cor
ПЦР (пробирка с ЭДТА)
Генотипирование вируса гепатита «С» (пробирка с ЭДТА)
Определение числа копий вируса гепатита «С» (вирусная нагрузка) real-time PCR (пробирка с ЭДТА)
Определение антител IgM
Исследование на краснуху:
Определение антител IgG
Определение антител IgA
Определение антител IgG
Чувствительность к антибиотикам (эппендорф с трансп. ср)
Определение антител IgM
Исследования на герпес I+II типов:
Определение антител к предранним белкам вируса герпеса - маркеру обострения хронической инфекции
Определение антител к вирусу герпеса IgG
Исследование на вирус герпеса 6 типа (синдром хронической усталости) методом ПЦР (пробирка с ЭДТА)
Исследование на вирус герпеса 7 типа (синдром хронической усталости) методом ПЦР (пробирка с ЭДТА
Исследование на вирус Эпштейна-Барра:
Определение антител к вирусу Эпштейна-Барра, IgM
Определение антител к вирусу Эпштейна-Барра, IgG
Определение IgG к капсидному антигену
анализ по капле крови
Читайте также:
