Синдром Альпорта - клиника, диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 09.02.2026
Синдром Альпорта (Alport) - синонимы, авторы, клиника
Синонимы синдрома Альпорта. Синдром наследственной нефропатии и глухоты. Синдром наследственной гематурии, нефропатии и глухоты. Отоокулоренальный синдром. Наследственный семейный врожденный геморрагический нефрит. Врожденная наследственная гематурия. Семейная гематурическая нефропатия (Dickinson).
Определение синдрома Альпорта. Сочетание прогрессирующей нефропатии с тугоухостью. По-видимому, существует связь с синдромом гидроксипролинемии; имеются и переходные формы.
Симптоматология синдрома Альпорта:
1. Признаки прогрессирующей почечной недостаточности.
2. Моча: альбуминурия, цилиндрурия, эритроцитурия (иногда симптомы поражения почек по типу так называемой зссенциальной гематурии). Иногда почечная глюкозурия, а также аминоацидурия с глицином (гликокол), гидроксипролипом и пролином.
3. Прогрессирующая тугоухость (поражение внутреннего уха) вплоть до полной глухоты.
4. Иногда врожденная катаракта; шаровидный хрусталик.
5. Нефропатия, особенно у мужчин, является злокачественной и приводит к сморщиванию почек.
6. У родственников больных нередко выявляют так называемую эссенциальную гематурию, гломерулонефрит ( особенно его хронические формы), хронический пиелонефрит, туберкулез почек, кисты почек и другие заболевания мочеобразующих и мочевыделяющих органов, а также различные пороки развития глаза (конусообразный хрусталик, помутнение хрусталика и т. д.).
Этиология и патогенез синдрома Альпорта. По-видимому, имеет место не полностью сцепленное с полом и передаваемое по доминантному типу наследственное страдание (плейотропное действие отдельных генов с неполной проницаемостью и гибкой экспрессивностью). Патогенетически речь идет о врожденной функциональной недостаточности органа по типу гипогенетического нефрита ( Barbes, Fahr), о генетических нарушениях в различных стадиях органогенеза с одновременным поражением почек и внутреннего уха.
Можно предполагать также наличие врожденного ферментативного дефекта, ведущего к уменьшению резистентности к инфекциям или к патологическим иммунологическим реакциям почек.
Дифференциальный диагноз синдрома Альпорта. Приобретенные нефропатии с приобретенной или врожденной тугоухостью. Гидроксипролинемия.
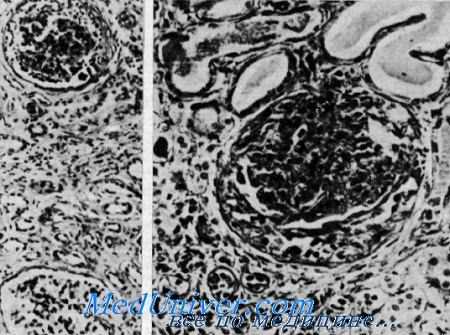
Нефрит и нейросенсорная глухота (синдром Альпорта). Сверху клубочек с утолщенной основной мембраной и слипшейся капсулой в противоположность почти нормальному клубочку внизу. Видны редкие клубочки, имеющие полулупиую форму, расширенные канальцы, содержащие белковые цилиндры. Утолщенная основная мембрана, окружающая атрофичные канальцы в области фиброза (из H. I. Krickstein et al.).
Видео этиология, патогенез синдрома Альпорта
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Альпорта - клиника, диагностика
Синдром Альпорта — генетически гетерогенное заболевание, в основе которого лежат мутации генов коллагена IV типа — основного компонента базальной мембраны. Соответственно, клинические проявления синдрома Альпорта связаны с нарушениями в строении и функционировании базальной мембраны. Основной симптом — стойкая микрогематурия.
У мальчиков и мужчин неизбежно развиваются протеинурия, артериальная гипертония и почечная недостаточность, тогда как у девочек и женщин почечная недостаточность возникает редко. Поражение почек нередко сочетается с нейросенсорной глухотой и поражением глаз, в частности дегенерацией пигментного эпителия в области желтого пятна сетчатки и лентиконусом.
Примерно в 80% случаев синдром Альпорта наследуется Х-сцепленно и вызван мутацией гена COL4A5, кодирующего а5-цепь коллагена IV типа. Вариант Х-сцепленного синдрома Альпорта с диффузным лейомиоматозом вызван делецией, затрагивающей лежащие рядом гены COL4A5 и COL4A6. У оставшейся части больных заболевание наследуется аутосомно-рецессивно и связано с мутациями генов COL4A3 или COL4A4, расположенных на 2-й хромосоме и кодирующих а3- и а4-цепи коллагена IV типа соответственно.
Аутосомно-доминантный тип синдрома Альпорта встречается редко, он также связан с мутациями генов COL4A3 и COL4A4.
Существует шесть изомеров а-цепи коллагена IV типа, их обозначают от а 1 до а6. Цепи а.1 и а2 присутствуют во всех базальных мембранах, тогда как экспрессия остальных цепей в разных тканях различна. Цепи с аЗ по а5 имеются в тех органах, которые поражаются при синдроме Альпорта: почках, глазах и ушах. В почках а3-, а4- и а5-цепи присутствуют в базальных мембранах клубочков, дистальных канальцев и собирательных трубочек, а также в капсуле клубочка.
У большинства мальчиков с Х-сцепленным синдромом Альпорта в почечных базальных мембранах полностью отсутствуют цепи с а3 по а6. У девочек с этим заболеванием из-за случайного характера инактивации Х-хромосомы экспрессия этих цепей частично сохранена. При аутосомно-рецессивном синдроме Альпорта аЗ- и а4-цепи отсутствуют во всех базальных мембранах, а5-цепь отсутствует только в базальной мембране клубочка, а в капсуле клубочка и базальных мембранах дистальных канальцев, собирательных трубочек и эпидермиса экспрессия а5- и а6-цепей сохранена. В глазах цепи с а3 по а5 имеются в базальных мембранах капсулы хрусталика, роговицы, задней пограничной пластинки, базальной пластинки (мембраны Бруха) и внутренней пограничной мембраны сетчатки. Они присутствуют также во внутреннем ухе: основной мембране внутреннего уха и базальных мембранах спирального выступа, спирального гребешка, внутренней и наружной спиральных борозд.
Сегодня основной метод диагностики синдрома Альпорта — биопсия почки, хотя, возможно, в будущем ее заменят молекулярно-генетические методы. При электронной микроскопии выявляют расслаивание и утолщение базальной мембраны клубочка. Дополнительное исследование аЗ-, а4- и а5-цепей в ткани почки может оказаться полезным в тех случаях, когда данные биопсии сомнительны. Отсутствие а5-цепи в базальной мембране эпидермиса указывает на Х-сцепленный синдром Альпорта, в этом случае биопсия почки необязательна.
Лечения не существует. Х-сцепленный синдром Альпорта встречается у собак, он служит моделью для разработки генотерапии и лекарственных средств. Трансплантация почки, как правило, дает хороший результат. Из-за того что вместе со здоровой почкой больные получают и новые антигены, примерно у 5% больных развивается антительный гломерулонефрит пересаженной почки, который почти всегда приводит к гибели трансплантата.
Синдром Альпорта ( Гематурический нефрит , Наследственный нефрит 1 типа , Семейный гломерулонефрит )
Синдром Альпорта – наследственное заболевание почек, вызванное изменением синтеза коллагена типа IV, образующего базальные мембраны почечных клубочков, структуры внутреннего уха, хрусталика глаза. Мужчины страдают развернутой формой болезни с тяжелой симптоматикой. Женщины часто являются носителями гена, оставаясь здоровыми, или проявления болезни у них выражены слабо. Основные симптомы – микрогематурия, протеинурия, почечная недостаточность, сенсорная тугоухость, деформация и вывих хрусталика, катаракта. Диагноз устанавливается согласно клинико-анамнестическим данным, результатам общего анализа мочи, исследования биоптата почки, аудиометрии и офтальмологического осмотра. Лечение симптоматическое, включает терапию иАПФ и БРА.
МКБ-10
Общие сведения
Семейные случаи гематурической нефропатии впервые привлекли внимание исследователей в 1902 году. Спустя почти 30 лет, в 1927 году американский врач А. Альпорт обнаружил частую сочетаемость гематурии с тугоухостью и уремией у мужчин, в то время как у женщин симптомы отсутствовали или были слабовыраженными. Он предположил наследственный характер болезни, которая впоследствии была названа синдромом Альпорта. Синонимы – наследственный нефрит 1 типа, гематурический нефрит, семейный гломерулонефрит. Распространенность невысока – 1 случай на 5 тысяч человек. На долю патологии приходится 1% больных с почечной недостаточностью, 2,3% пациентов, перенесших трансплантацию почек. Заболевание диагностируется у людей всех рас, но соотношение различных форм неодинаково.
Причины
По своей природе синдром является гетерогенным наследственным заболеванием – его развитие провоцируется дефектом генов, которые кодируют структуру различных цепей IV типа коллагена. Генетические изменения представлены делециями, сплайсинг, миссенс и нонсенс-мутациями. Их локализация определяет тип наследования болезни:
- X-сцепленный доминантный. Связан с мутацией в локусе COL4A5, который находится на половой хромосоме X. Ген кодирует а5-цепь коллагена 4 типа. Данный генетический дефект обуславливает 80-85% случаев наследственного нефрита. В полной мере заболевание проявляется у мальчиков и мужчин, у представительниц женского пола оставшийся нормальный ген в X-хромосоме компенсирует производство функционального коллагена.
- Аутосомно-рецессивный. Развивается на основе мутаций в генах C0L4A3 и COL4A4. Они локализованы на второй хромосоме, отвечают за структуру а3- и а4-цепи коллагена. Пациенты с этим вариантом синдрома составляют около 15% больных. Выраженность симптомов не зависит от пола.
- Аутосомно-доминантный. Нефрит возникает в результате мутаций генов COL4A3-COLA4, находящихся на 2 хромосоме. Как и в случае аутосомно-рецессивной формой болезни, нарушается синтез а4- и а3-цепей коллагена четвертого типа. Распространенность – 1% всех случаев генетического нефрита.
Патогенез
Гломерулярная базальная мембрана имеет сложное строение, ее образует строгая геометрическая последовательность молекул коллагена 4-го типа и полисахаридные компоненты. При синдроме Альпорта имеются мутации, которые задают дефектное строение спиралевидных коллагеновых молекул. На первых этапах болезни базальная мембрана истончается, начинает расщепляться и расслаиваться. Одновременно возникают утолщенные участки с неравномерными просветлениями. Внутри скапливается тонкогранулярное вещество. Прогрессирование болезни сопровождается полным разрушением базальной гломерулярной мембраны клубочковых капилляров, канальцев почек, структур внутреннего уха и глаз. Таким образом, патогенетически синдром Альпорта представлен четырьмя звеньями: мутацией гена, дефектом строения коллагена, деструкцией базальных мембран, патологией почек (иногда – нарушением слуха и зрения).
Симптомы
Самым распространенным проявлением синдрома Альпорта является гематурия. Микроскопически этот симптом определяется у 95% женщин и у 100% мужчин. При рутинном обследовании мальчиков гематурия обнаруживается уже в первые годы жизни. Другой распространенный признак заболевания – протеинурия. Выведение белка с мочой у пациентов мужского пола с X-сцепленным синдромом начинается в раннем детском возрасте, у остальных – позже. У девочек и женщин уровень экскреции белка повышается незначительно, случаи выраженной протеинурии крайне редки. У всех больных отмечается неуклонное прогрессирование симптома.
Артериальная гипертензия характерна для мужчин с классическим типом синдрома и для пациентов обоих полов с аутосомно-рецессивным вариантом наследования. Тяжесть гипертонии увеличивается вместе с нарастанием ХПН. У юношей, мужчин снижение функции почек достигает терминальной стадии к 16-35 годам, при медленном течении болезни – к 45-65 годам. Иногда выявляются диффузные гладкомышечные опухоли пищевода и бронхов, проявляющиеся в позднем детстве дисфагией, рвотой, болями в эпигастрии и за грудиной, одышкой, частыми бронхитами.
Часто у больных формируется нейросенсорная тугоухость. Нарушения слуха дебютируют в детстве, но становятся заметными в подростничестве или молодости. У детей тугоухость распространяется только на звуки высокой частоты, обнаруживается в специально созданных условиях – при аудиометрии. По мере взросления и прогрессирования синдрома нарушается слуховое восприятие средних и низких частот, в том числе человеческой речи. При X-связанном синдроме расстройство слуха к 25 годам имеется у 50% больных мужчин, к 40 годам – у 90%. Тяжесть тугоухости вариабельна, от изменений только в результатах аудиограммы до полной глухоты. Патологии вестибулярного аппарата отсутствуют.
Расстройства зрения включают передний лентиконус – выпячивание центра хрусталика глаза вперед и ретинопатию. Обе патологии проявляются прогрессирующим ухудшением зрительной функции, покраснением, болью в глазах. У некоторых больных имеются стигмы дизэмбриогенеза – анатомические аномалии мочевыделительной системы, глаз, ушных раковин, конечностей. Может наблюдаться высокое расположение неба, укорочение и искривление мизинцев, сращивание пальцев ног, широко расставленные глаза.
Осложнения
Отсутствие лечения больных синдромом Альпорта приводит к быстрому прогрессированию глухоты и слепоты, формированию катаракт. У части пациентов развивается полиневропатия – поражение нервов, сопровождающееся мышечной слабостью, болями, судорогами, тремором, парестезиями, снижением чувствительности. Другим осложнением является тромбоцитопения с высоким риском кровотечений. Наиболее опасным состоянием при наследственном нефрите считается терминальная стадия почечной недостаточности. Больше всего ей подвержены мужчины с типом наследования, сцепленным с половой X-хромосомой. К 60 годам 100% больных этой группы нуждаются в процедурах гемодиализа, перитонеального диализа, трансплантации донорской почки.
Диагностика
В диагностическом процессе принимают участие врачи-нефрологи, урологи, терапевты и генетики. При опросе выясняется возраст дебюта симптомов, наличие у родственников первой линии гематурии, протеинурии или смертельных исходов вследствие ХПН. Для синдрома Альпорта характерно раннее начало и отягощенный семейный анамнез. Дифференциальная диагностика направлена на исключение гематурической формы гломерулонефритов, вторичных нефропатий. Для подтверждения диагноза проводятся следующие процедуры:
- Физикальное обследование. Определяется бледность кожных покров и слизистых оболочек, сниженный мышечный тонус, внешние и соматические признаки дизэмбриогенеза – высокое небо, аномалии строения конечностей, увеличенное расстояние между глазами, сосками. На ранних стадиях болезни диагностируется артериальная гипотония, на поздних – артериальная гипертония.
- Общий анализ мочи. Обнаруживаются эритроциты и повышенное содержание белка – признаки гематурии и протеинурии. Показатель белка мочи напрямую коррелирует с тяжестью синдрома, по его изменению оценивается прогрессирование патологии, вероятность нефротического синдрома, ХПН. Возможно наличие признаков лейкоцитурии абактериального характера.
- Исследование биоптата почек. При микроскопии визуализируется истонченная базальная мембрана, расщепление и разделение ее слоев. На поздней стадии отмечаются утолщенные дистрофичные участки с «сотами» просветления, зоны полной деструкции слоя.
- Молекулярно-генетическое исследование. Генетическая диагностика не является обязательной, но позволяет составить более точный прогноз, подобрать оптимальную схему лечения. Изучается строение генов, мутации в которых обуславливают развитие синдрома. У большей части больных выявляются мутации гена COL4A5.
- Аудиометрия, офтальмологическое исследование. Дополнительно пациентам могут быть назначены диагностические консультации сурдолога и офтальмолога. При аудиометрии обнаруживается снижение слуха: в детском и подростковом возрасте – билатеральная высокочастотная тугоухость, во взрослом возрасте – низкочастотная и среднечастотная тугоухость. Офтальмолог определяет искажение формы хрусталика, поражение сетчатки, наличие катаракты, снижение зрения.
Лечение синдрома Альпорта
Специфическая терапия отсутствует. С раннего возраста проводится активное симптоматическое лечение, снижающее протеинурию. Оно позволяет предотвратить поражение и атрофию почечных канальцев, развитие интерстициального фиброза. С помощью ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов к ангиотензину II удается приостановить прогрессирование заболевания, добиться регрессии гломерулосклероза, тубулоинтерстициальных и сосудистых изменений в почках. Пациентам с терминальной стадией ХПН назначается гемодиализ, перитонеальный диализ, решается вопрос о целесообразности трансплантации почек.
Прогноз и профилактика
Синдром прогностически благоприятен в случаях, когда гематурия протекает без протеинурии, нет расстройств зрения и тугоухости. Кроме этого, прогноз хороший у большинства женщин – даже при наличии гематурии болезнь прогрессирует медленно, не ухудшает общего состояния. Ввиду наследственного характера патологии предупредить ее развитие невозможно. В семьях, где установлено наличие X-сцепленной формы синдрома, возможно проведение пренатальной диагностики. Генетический скрининг особенно рекомендован женщинам, вынашивающим мальчиков.
1. Наследственный нефрит (синдром Альпорта) / Сунгатуллина И.Л. // Казанский медицинский журнал – 2002 – Т.83, №1.
2. Проект клинических рекомендаций по диагностике и лечению синдрома Альпорта у детей / Длин В.В., Игнатова М.С., Конькова Н.Е. – 2014.
3. Наследственные заболевания почек, протекающие с гематурией / Длин В.В., Игнатова М.С. // Российский вестник перинатологии и педиатрии – 2014 - №3.
Псевдоахондроплазия
Псевдоахондроплазия – наследственное заболевание из группы остеохондродисплазий, считается самым распространенным состоянием подобного типа. Симптомами этой патологии являются непропорциональная карликовость, искривления нижних конечностей (О- или Х-образные ноги), повышенная подвижность суставов (за исключением локтевых) и другие пороки развития скелета. Диагностика псевдоахондроплазии производится на основании данных настоящего статуса больного, рентгенологических исследований, молекулярно-генетических анализов. Специфического лечения этого заболевания на сегодняшний момент не существует, используются различные симптоматические мероприятия (физиотерапия, хирургическая коррекция) для улучшения качества жизни больного.
Псевдоахондроплазия – генетическое заболевание, характеризующееся нарушением формирования хрящевой ткани и энхондральной кости и, как следствие, остеоартропатией. Является самым распространенным вариантом скелетной дисплазии, но при этом обладает различными по степени выраженности проявлениями – от тяжелой диспропорциональной карликовости до низкорослости с незначительными изменениями скелета.
Впервые псевдоахондроплазия была описана во Франции педиатром Пьером Марото и врачом-генетиком Морисом Лами в 1959 году, специалисты определили ее как псевдоахондропластическую спондилоэпифизарую дисплазию. Лишь с 1969 года данное состояние выделили в отдельную нозологическую единицу под названием псевдоахондроплазия. В настоящий момент удалось выяснить, это заболевание характеризуется аутосомно-доминантным механизмом наследования и с одинаковой частотой поражает как мальчиков, так и девочек. Встречаемость псевдоахондроплазии оценивается на уровне 1:20 000, при этом ее распространение является повсеместным, расовых или национальных особенностей распределения заболевания не выявлено.
Причины псевдоахондроплазии
Причиной развития псевдоахондроплазии являются дефекты гена COMP, расположенного на 19-й хромосоме. Мутации этого же гена приводят к другому распространенному варианту наследственных скелетных нарушений – множественной эпифизарной дисплазии. COMP кодирует последовательность олигомерного белка хрящевого матрикса, участвующего в развитии хрящевой ткани, процессах энхондрального окостенения и формировании сухожилий. Генетический дефект при псевдоахондроплазии представляет собой изменение GAC-повторов в кодирующей последовательности гена, что влечет за собой отличное от нормы содержание аспарагиновой кислоты в белке. В нормальном гене COMP содержится 5 GAC-повторов, тогда как у больных псевдоахондроплазией регистрируется как большее (6-7), так и меньшее их количество.
Изменение количества аминокислотных остатков аспарагиновой кислоты в олигомерном белке хрящевого матрикса проявляется как аномальная изоэлектрическая точка этого протеина. В результате нарушаются процессы внутриклеточной транспортировки данного белка, он начинает накапливаться в шероховатом эндоплазматическом ретикулуме клетки. Внеклеточно при этом формируется его дефицит, из-за чего нарушается формирование хрящей и ассоциированных с ними участков костной ткани – метафизов, эпифизов, тел позвонков, что проявляется как псевдоахондроплазия. Кроме того, так как ген COMP также экспрессируется в тканях сухожилий и суставных связок, у больных эти заболеванием наблюдаются патологические изменения суставов и слабость их связочного аппарата.
Вышеуказанная мутация (изменение числа GAC-повторов) наследуется по аутосомно-доминантному механизму с полной пенетрантностью, вопрос о спонтанных генетических дефектах, приводящих к псевдоахондроплазии, в настоящее время является дискуссионным. Характер деформаций нижних конечностей и искривлений позвоночного столба находится в сильной зависимости от внешних факторов – физической нагрузки, качества ухода за больным, его веса и активности. Это становится причиной значительного разнообразия клинической картины псевдоахондроплазии у разных пациентов.
Симптомы псевдоахондроплазии
Как правило, у новорожденных проявления псевдоахондроплазии не выявляются. Беременность в подавляющем большинстве случаев протекает нормально, физические параметры грудного ребенка также не обнаруживают аномалий. Первые 2-3 года жизни физическое развитие детей без патологий, затем начинают обнаруживаться разнообразные признаки скелетных аномалий. Первым симптомом псевдоахондроплазии часто является изменение пропорций тела – происходит укорочение конечностей за счет уменьшения длины плечевых и бедренных костей, ладони и стопы становятся более широкими, пальцы короткими. В возрасте 3-4 года уже наблюдается выраженное отставание больного ребенка в росте и физическом развитии по сравнению со здоровыми сверстниками.
По мере роста пациента с псевдоахондроплазией возникают искривления позвоночника – главным образом, усиление поясничного лордоза. Изменяется походка, которая становится переваливающейся. В старшем возрасте могут выявляться искривления нижних конечностей различного типа (варусного или вальгусного) – выраженность такой деформации во многом зависит от степени нагрузки на ноги. Нередко при псевдоахондроплазии обращает на себя внимание повышенная подвижность суставов, за исключением локтевых – они подвергаются более или менее выраженной сгибательной контрактуре. Рост больных редко превышает 130 сантиметров, во многих случаях имеет место диспропорциональная карликовость. При своевременно начатом профилактическом лечении и ортопедической коррекции выраженность этого проявления псевдоахондроплазии можно значительно уменьшить.
У больных псевдоахондроплазией могут развиваться остеоартрозы, при этом наиболее сильно поражаются тазобедренные и коленные суставы. Патологические изменения в суставах проявляются болезненностью при движениях и локальным отеком, нередко в суставах возникают похрустывания. В дальнейшем остеоартроз может перерасти в ограничение подвижности и даже стать причиной тяжелой инвалидизации больного. Время развития остеоартрозов при псевдоахондроплазии и скорость их прогрессирования во многом зависят от степени нагрузки на суставы и правильности назначенного лечения. В отличие от многих других наследственных дисплазий, при этом заболевании интеллектуальное развитие больного не страдает.
Определение псевдоахондроплазии производится на основании данных общего осмотра больного, рентгенологических исследований, молекулярно-генетических анализов. Достаточно точным методом диагностики этого состояния, позволяющим дифференцировать его от ахондроплазии, является определение концентрации олигомерного белка хрящевого матрикса в плазме крови, однако данная техника доступна не в каждой лаборатории. При осмотре больного псевдоахондроплазией клиническая картина заболевания зависит от возраста. У ребенка 2-3 лет может выявляться лишь незначительное отставание в росте и диспропорциональность тела. К 4-5 годам к этим проявлениям добавляются искривления позвоночного столба и изменения походки. У старших детей и взрослых с псевдоахондроплазией определяется значительное укорочение конечностей, карликовость, возможны признаки коксартроза и гонартроза.
Рентгенологические исследования при псевдоахондроплазии также характеризуются определенными различиями у больных разных возрастов. В детском возрасте наиболее частыми изменениями являются замедление процессов окостенения метафизов длинных трубчатых костей, платиспондилия (уплощение тел позвонков), укорочение бедренных и плечевых костей. Головка бедренной кости уменьшена, что приводит к расширению суставной щели тазобедренного сустава. В более старшем возрасте (17-19 лет) у большинства пациентов с псевдоахондроплазией несколько улучшается состояние тел позвонков, происходит окостенение метафизов и эпифизов, но могут выявляться рентгенологические признаки остеоартроза коленных и тазобедренных суставов, а также О- или Х-образная деформация ног.
Исследование крови на уровень содержания олигомерного белка хрящевого матрикса при псевдоахондроплазии показывает его отсутствие или крайне низкий уровень. Во многих случаях только это исследование и молекулярно-генетический анализ помогают дифференцировать данное заболевание от классической ахондроплазии. При помощи достижений современной генетики имеется возможность произвести прямое автоматическое секвенирование гена COMP с целью выявления мутаций. Учитывая аутосомно-доминантный характер псевдоахондроплазии, при наличии этого заболевания у одного из родителей вероятность наследования составляет 50%.
Лечение псевдоахондроплазии
Специфического лечения псевдоахондроплазии не существует, но правильно назначаемые симптоматические и профилактические лечебные мероприятия способны значительно облегчить течение заболевания и улучшить качество жизни больных. Все техники, используемые при терапии этого состояния, относятся к трем разновидностям – консервативным, физиотерапевтическим (сюда часто также включают ортопедические методики) и хирургическим. Как правило, вскоре после определения псевдоахондроплазии в детском возрасте начинают консервативное и физиотерапевтическое лечение, направленное на предупреждение развития тяжелых деформаций скелета и остеоартрозов. Для профилактики последних назначают длительный прием хондропротекторов, средств, улучшающих кровообращение в суставах, лечебную физкультуру. Благотворный эффект на состояние суставов при псевдоахондроплазии оказывают физиотерапевтические методы – прогревание, массажи, магнитотерапия, электрофорез и ряд других.
Важную роль в профилактике деформаций конечностей и позвоночника при псевдоахондроплазии играет применение ортопедических средств – специальной обуви, наколенников для укрепления суставов, бандажа для спины. Помимо использования таких средств важно ограничивать статические нагрузки на ноги и спину – противопоказано длительное стояние, ходьба на большие дистанции. В старшем возрасте для облегчения состояния больных псевдоахондроплазией могут прибегать к хирургической коррекции деформированных костей (остеотомии), производить операции по укреплению и даже протезированию суставов.
Прогноз и профилактика псевдоахондроплазии
Большинство специалистов оценивают псевдоахондроплазию как состояние с благоприятным прогнозом – несмотря на карликовость, диспропорциональность и деформации костей, большинство больных сохраняют подвижность и относительную трудоспособность. Наибольшую угрозу при этом заболевании представляет значительная деформация ног, остеоартроз тазобедренных и коленных суставов, однако при правильном лечении этих проблем удается избежать. К тому же, возможно их устранение хирургическим путем. Интеллект и фертильность больных псевдоахондроплазией полностью сохраняются, но женщины должны быть особенно осторожны при вынашивании ребенка из-за возросшей нагрузки на позвоночник и нижние конечности. Необходимо избегать работ, связанных с длительным стоянием или ходьбой. Профилактика псевдоахондроплазии возможна только в рамках пренатальной диагностики в случае наличия такого заболевания у одного из родителей.
Эпифизарные дисплазии
Эпифизарные дисплазии – это многочисленная группа генетически гетерогенных скелетных дисплазий, которые объединяет нарушение формирования энхондральной спонгиозной кости в области метафизов и эпифизов костей, а также (в ряде случаев) тел позвонков. Симптомы этого состояния различаются в зависимости от типа заболевания, чаще всего наблюдается искривление ног, аномалии суставов конечностей, уменьшение роста. Диагностика эпифизарных дисплазий осуществляется на основании данных рентгенологических исследований, изучения наследственного анамнеза больного, молекулярно-генетических анализов. Специфической терапии не существует, возможно паллиативное и симптоматическое лечение, в том числе – ортопедические мероприятия и хирургическая коррекция.
Эпифизарные дисплазии – одни из наиболее распространенных форм врожденного поражения скелета, имеющие генетическую природу с разнообразным характером наследования и клинических проявлений. Многие варианты этой патологии были известны давно, однако в качестве отдельной нозологической единицы ее в 1935 году описал немецкий врач Т. Фейрбанк, сумевший правильно определить причину заболевания – нарушение развития эпифизов костей.
Встречаемость состояния с аутосомно-доминантным характером наследования составляет порядка 1:10 000, частота редкой аутосомно-рецессивной разновидности заболевания неизвестна. Эпифизарные дисплазии большинства типов с одинаковой вероятностью поражают как мужчин, так и женщин, однако некоторые разновидности характеризуется несколько более частой встречаемостью у лиц мужского пола (распределение составляет примерно 3:1).
Эпифизарные дисплазии характеризуются выраженной генетической гетерогенностью, поэтому в современной ортопедии насчитывается несколько различных вариантов этого заболевания. Кроме того, имеются определенные фенотипические различия в течении патологии и ее прогнозе.
По данным врачей-генетиков, более половины всех клинических случаев эпифизарных дисплазий имеют в своей основе неизвестные на сегодняшний день молекулярно-генетические нарушения, поэтому исследования этого заболевания продолжаются. Большинство форм эпифизарной дисплазии характеризуется аутосомно-доминантным характером наследования, однако пенетрантность и экспрессивность колеблются в очень широких пределах, что отражается на клиническом течении патологии.
Существует еще ряд типов эпифизарных дисплазий, в отношении некоторых выявлены ключевые гены. Но встречаются они намного реже – есть формы этих заболеваний, описанные всего у нескольких семей. Кроме собственно этиологии, различные формы эпифизарных дисплазий могут различаться между собой клиническим течением – разным возрастом начала развития заболевания, наличием или отсутствием иных нарушений (тугоухости, глухоты, миопии, кожных аномалий).
Классификация
Всего в настоящее время известно свыше 10 различных форм данной патологии, наиболее распространенными являются 1, 2, 3 и 4-й типы:
- Эпифизарная дисплазия 1-го типа (болезнь Фейрбанка) является аутосомно-доминантным заболеванием и наиболее часто встречающейся разновидностью данного порока развития скелета. Она обусловлена мутациями в гене COMP, который располагается на 19-й хромосоме и кодирует олигомерный белок хрящевого матрикса – один из протеинов, отвечающий за метаболизм и развитие костной и хрящевой ткани. Помимо эпифизарной дисплазии 1-го типа, мутации в этом гене могут приводить к другому известному заболеванию опорно-двигательного аппарата – псевдоахондроплазии. Одной из причин, обуславливающих широкое распространение этой патологии, является аутосомно-доминантный характер наследования.
- Эпифизарная дисплазия 2-го типа обусловлена мутацией гена COL9A2, который кодирует альфа-2-цепь коллагена 9-го типа, наиболее широко представленного в костной и хрящевой ткани. Как правило, в данном гене отмечаются миссенс-мутации, приводящие к изменению структуры кодируемого белка, что и становится причиной патологических изменений.
- Эпифизарная дисплазия 3-го типа во многом сходна по своей этиологии с предыдущим вариантом заболевания, так как обусловлена мутацией гена COL9A3, расположенного на 20-й хромосоме. Он кодирует другую цепь коллагена 9-го типа, поэтому нарушения в ее структуре приводят к развитию скелетных патологий и осложняют формирование энхондральных костей.
- Эпифизарная дисплазия 4-го типа вызвана мутациями гена SLC26A2, расположенного на 5-й хромосоме. Является аутосомно-рецессивным заболеванием. Продуктом экспрессии данного гена считается трансмембранный белок хондробластов и остеобластов, отвечающий за транспорт сульфат-ионов, крайне необходимых для формирования протеогликанов хрящевой и костной ткани. Особенности строения SLC26A2 приводят к относительно высокой частоте развития в нем дефектов, поэтому мутации этого гена выступают причиной многих наследственных заболеваний опорно-двигательного аппарата. Помимо множественной эпифизарной дисплазии, дефекты SLC26A2 являются причиной некоторых типов ахондрогенеза, ателостеогенеза, диастофической дисплазии.
Характер скелетных нарушений при разных формах очень схож и сводится к аномалиям развития суставов, особенно тех, которые испытывают наибольшие нагрузки – тазобедренных, коленных, голеностопных. Роль физических нагрузок в развитии аномалий скелета при эпифизарных дисплазиях достаточно велика, поэтому различные ортопедические методы лечения позволяют значительно улучшать состояние больных.
Симптомы эпифизарной дисплазии
Из-за выраженной гетерогенности эпифизарной дисплазии возникновение симптомов этого заболевания может начинаться в разном возрасте в зависимости от типа патологии. Некоторые формы приводят к аномалиям скелета, регистрируемым уже при рождении больного, значительная часть разновидностей характеризуется развитием пороков в возрасте 2-3 лет, некоторые редкие типы эпифизарной дисплазии диагностируются в подростковом или даже взрослом возрасте. Причина, по которой это заболевание обычно начинает проявляться в младшем детском возрасте, связана с повышением нагрузок на кости и суставы после начала хождения и увеличения массы ребенка.
Многие формы эпифизарной дисплазии характеризуются развитием искривлений ног Х- или О-образного характера, обусловленных деформацией эпифизов бедренных и большеберцовых костей. В ряде случаев отмечается низкорослость, вызванная как сокращением длины конечностей (из-за укорочения длинных трубчатых костей), так и уменьшением туловища по причине деформации позвоночника.
Практически все типы эпифизарных дисплазий в большей или меньшей степени приводят к гипоплазии тел позвонков и запоздалому формированию в них точек окостенения. Это может становиться причиной уменьшения длины позвоночного столба и к его разнообразных искривлений (сколиоз, лордоз) – особенно при отсутствии методов ортопедической коррекции. Распространенным симптомом многих типов эпифизарных дисплазий является также повышенная подвижность ряда суставов.
Отдельные формы эпифизарных дисплази помимо скелетных нарушений сопровождаются поражениями внутренних органов, глаз, слуховой и эндокринной систем. Например, тип Уолкотта-Ралшсона проявляется ранним развитием инсулинозависимого сахарного диабета и миопией, некоторые другие формы сочетаются с глухотой. Описаны разновидности эпифизарных дисплазий, которые характеризуются также остеопорозом и атрофией кожи.
Интеллектуальное развитие при большинстве типов заболевания не страдает, но при некоторых формах может наблюдаться умственная отсталость различной степени выраженности. Чаще всего эпифизарная дисплазия не влияет на продолжительность жизни больных, но сопутствующие нарушения, характерные для некоторых форм, могут приводить к тяжелым осложнениям.
Ведущую роль в определении любого типа эпифизарной дисплазии играют рентгенологические исследования, общий осмотр больных и молекулярно-генетические анализы. В некоторых случаях дополнительно применяют изучение наследственного анамнеза – его результаты могут различаться в зависимости от аутосомно-рецессивного или доминантного характера наследования патологии.
- Рентгенография. На рентгенограммах в зависимости от формы эпифизарной дисплазии и возраста больных может определяться замедление процессов окостенения эпифизов, их деформация, укорочение длинных трубчатых костей. У более взрослых больных часто выявляется расширение и деформация коленных и голеностопных суставов. Многие формы эпифизарной дисплазии также приводят деформациям тел позвонков, их костный возраст зачастую отстает от фактического.
- Молекулярно-генетическая диагностика. Возможна в отношении лишь некоторых наиболее распространенных форм эпифизарной дисплазии с достоверно известной этиологией. Как правило, большинство лабораторий и клиник предоставляют такую возможность в отношении типов патологии, обусловленных мутациями генов COMP, COL9A2, COL9A3 и SLC26A2. Чаще всего применяется метод прямого автоматического секвенирования вышеуказанных генов с целью выявления мутаций.
Для диагностики форм эпифизарной дисплазии, которые сочетаются с другими пороками развития (например, глухотой, глазными и эндокринными нарушениями) могут потребоваться другие методы исследования – осмотр у специалиста соответствующего профиля, анализы крови и мочи.
Лечение эпифизарной дисплазии
Специфического лечения эпифизарной дисплазии на сегодняшний момент не существует, применяют разнообразные методы поддерживающей и симптоматической терапии. Особенно важно своевременно назначить ортопедическую коррекцию – ношение бандажей и корсетов для снижения нагрузки на позвоночник и суставы ног. Это позволяет избежать тяжелых деформаций и, тем самым, улучшает качество жизни больных эпифизарной дисплазией. Некоторые уже развившиеся искривления и пороки могут быть исправлены путем хирургического вмешательства. Симптоматическое лечение показано и в отношении нарушений, сопровождающих некоторые формы эпифизарной дисплазии – сахарного диабета, миопии, остеопороза.
Как правило, прогноз большинства форм эпифизарной дисплазии в отношении выживаемости больных благоприятный – деформации конечностей и низкорослость не угрожают жизни и не сокращают ее длительность. Лишь некоторые тяжелые формы искривления позвоночника могут приводить к нарушениям со стороны внутренних органов, что усугубляет течение заболевания. При своевременном выявлении эпифизарной дисплазии и начале ортопедического лечения инвалидизация больных отмечается относительно редко, многие сохраняют подвижность и трудоспособность (хоть и несколько ограниченную). Ухудшает прогноз наличие сопутствующих нарушений, особенно со стороны эндокринной системы (сахарный диабет).
Профилактика эпифизарной дисплазии возможна только в рамках медико-генетического консультирования родителей перед зачатием ребенка (при отягощенной наследственности) и пренатальной диагностике молекулярно-генетическими методиками.
Читайте также:
- Отравление марганцем и его лечение
- Пигментный дерматоз (синдром Блоха-Сульцбергера) - клиника, диагностика
- Диагностика внематочной беременности. Дифференциация кишечной инфекции и внематочной беременности
- Суперинфекции. Реинфекции. Рецидивы инфекции. Манифестные инфекции. Типичная инфекция. Атипичная инфекция. Хроническая инфекция. Медленные инфекции. Персистирующие инфекции.
- Рентгенограмма, КТ, МРТ при дегенеративном сколиозе позвоночника
