Синдром эндогенной интоксикации при перитоните. Патогенез, диагностика, классификация эндогенной интоксикации при перитоните.
Добавил пользователь Валентин П. Обновлено: 28.01.2026
В работе на основе изучения в динамике уровня токсических продуктов, степени мембранодестабилизирующих явлений в плазме крови и лимфе определена роль основного воспалительного очага и функционального состояния печени в прогрессировании эндотоксикоза при различной тяжести острого перитонита. Исследования показали, что при остром перитоните после санации брюшной полости (хирургического лечения) уменьшение уровня токсических продуктов в плазме крови происходит быстрее, чем в лимфе, что обусловлено быстрым восстановлением функциональной активности печени благодаря регрессу мембранодестабилизирующих явлений в ее тканях при сохранении их значительного уровня в тканях брюшины и кишечника. При нарастании воспалительного процесса в брюшной полости (без хирургического лечения) отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
1. Брискин Б.С., Яровая Г.А., Савченко З.И. Иммунные и ферментные нарушения у больных с острым панкреатитом // Хирургия. Журнал им. Н.И. Пирогова. – 2001. – № 7. – С. 21–24.
2. Глушко В.А. Неотложные хирургические вмешательства при нагноившихся постнекротических кистах поджелудочной железы // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 126–127.
3. Кифус Ф.В., Пахомова Г.В., Береснева Э.А., Дубров Э.Я. Выбор лечебной тактики при забрюшинных флегмонах на основании клинико-экспериментальных исследований // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 42–43.
4. Купцова М.Ф., Васильков В.Г., Бегунов В.А., Чернова Т.В. Интенсивная терапия гнойно-септических заболеваний // Материалы четвертого Всероссийского съезда анестезиологов и реаниматологов. – М., 1994. – С. 203–204.
5. Малярчук В.И., Корольков А.Ю., Иванов В.А. Малоинвазивные вмешательства при осложненном панкреонекрозе // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 85–86.
6. Batalik B., Mydlo J. Peroperative peritoneal lavage and intra-abdominal instillation of antibiotics in an experiment // Rozhl. Chir. – 1991, mar. – Vol. 70. – № 5. – P. 300–303.
7. Cuesta M.A., Doblas M., Castaneda L. Sequential abdominal Reexplorations with Zipper Technique // World. J. Surg. – 1991. – Vol. 15. – P. 74–80.
8. Wahl W., Minkus A., Junginger T. Prognostisch relevante Faktoren bei der intraabdominalen Infektion // Langenbecks. Arch. Chir. – 1992. – Bd. 377 (4). – Р. 237–243.
Эндогенная интоксикация является ведущим синдромом у 85 % больных гнойно-септическими заболеваниями [4]. Одной из основных причин развития эндогенной интоксикации является перитонит. Актуальность гнойного воспаления брюшины перед современной хирургией обусловливает то, что оно является главенствующим осложнением многих заболеваний и встречается достаточно часто [1, 2, 5]. Кроме того, при остром перитоните сохраняется достаточно высокая летальность ‒ 20–30 %, которая в терминальной стадии заболевания достигает 50–70 %, а при генерализации инфекции и развитии полиорганной недостаточности 75,8–100,0 % [3, 6–8]. Поэтому особую значимость приобретает изучение факторов прогрессирования эндогенной интоксикации при остром перитоните с целью своевременного патогенетического влияния на них.
Цель работы. В эксперименте на основе изучения в динамике уровня токсических продуктов, степени мембранодестабилизирующих явлений в плазме крови и лимфе определить роль основного воспалительного очага и функционального состояния печени в прогрессировании эндотоксикоза при различной тяжести острого перитонита.
Материалы и методы исследования
В основу работы положены экспериментальные исследования на взрослых беспородных собаках обоего пола, разделенных для решения поставленных задач на 2 группы. Первая группа (n = 16) – животным моделировали острый перитонит по способу А.П. Власова (1991) путем введения каловой взвеси в брюшную полость, через сутки проводили лапаротомию, оценивали выраженность воспалительного процесса в брюшной полости, количество экссудата, макроскопическое состояние кишечника и печени, забирали образцы ткани печени и кишечника. Брюшную полость санировали. Вторая группа (n = 12) – животным моделировали острый перитонит по той же методике, однако брюшную полость не санировали.
В контрольные сроки проводили забор крови и лимфы, биопсию тканей печени и кишечника, исследовали выраженность эндогенной интоксикации по содержанию ее маркеров в плазме крови и лимфе, активность перекисного окисления липидов (ПОЛ), фосфолипазы А2 и супероксиддисмутазы в плазме крови, лимфе, тканях печени и кишечника.
В послеоперационном периоде животным проводилась антибактериальная (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела) и инфузионная (внутривенные введения 5 % раствора глюкозы и 0,89 % раствора хлорида натрия из расчета 50 мл/кг массы животного) терапия.
Эксперименты поставлены под внутривенным наркозом с использованием тиопентал-натрия из расчета 0,04 г/кг массы тела животного. Научные изыскания проводились в соответствии с этическими требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.) и Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г.) и одобрены локальным этическим комитетом.
Уровень молекул средней массы (МСМ) в сыворотке крови и лимфы измеряли на спектрофотометре СФ-46 при длине волны 254 и 280 нм. Для характеристики физико-химических свойств альбумина оценивали эффективную и общую концентрацию альбумина (ЭКА и ОКА) в сыворотке крови флуоресцентным методом на специализированном анализаторе АКЛ-01 «Зонд». Резерв связывания альбумина (РСА) определяли по формуле РСА = ЭКА/ОКА; индекс токсичности (ИТ) плазмы – по формуле ИТ = ОКА/ЭКА – 1 (Грызунов Ю.А., Добрецов Г.Е., 1994).
Активность фосфолипазы А2 оценивали по каталитической деятельности фермента потенциометрическим методом. Диеновые и триеновые конъюгаты в липидах определяли спектрофотометрическим методом при длине волны 232 и 275 нм. Содержание малонового диальдегида выявляли в реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы изучали в реакции с нитросиним тетразолием.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента, корреляционная зависимость оценена с помощью критерия r. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение
Экспериментальные исследования показали, что через сутки (первая группа) после введения в брюшную полость каловой взвеси у животных развивался острый перитонит. Животные были вялые, адинамичные, жадно пили воду, у некоторых животных отмечено возникновение рвоты или рвотных движений. Температура тела была субфебрильной. При лапаротомии в брюшной полости имелся мутный с хлопьями фибрина и неприятным запахом выпот, количество которого достигало 114,40 ± 4,15 мл. Петли кишок были увеличены в диаметре за счет содержания в них кишечного содержимого и газа, стенка тонкой кишки была инфильтрирована, с налетом фибрина. Париетальная брюшина гиперемирована, инфильтрирована, с мелкоточечными кровоизлияниями.
В динамике развития патологического процесса отмечалось существенное увеличение в плазме крови содержания токсических продуктов как гидрофильной, так и гидрофобной природы (рис. 1).
Рис. 1. Показатели эндогенной интоксикации плазмы крови общего кровотока при остром перитоните (значения нормы приняты за 100 %). Примечание: здесь и далее: * – достоверность отличия от нормы при p < 0,001
В лимфе содержание токсических продуктов также возрастало. Однако в отличие от данных плазмы крови, где после санации брюшной полости отмечается снижение выраженности эндогенной интоксикации, в лимфе в течение всего эксперимента их уровень сохранялся на высоких цифрах (рис. 2).
При исследовании скорости лимфотока было выявлено снижение значения данного показателя на всех этапах динамического наблюдения. Так, на первые сутки эксперимента он был ниже нормы на 27,3 % (р < 0,05), на третьи – уже на 48,2 % (р < 0,05), а на пятые – на 45,3 % (р < 0,05).
В ходе проведения экспериментальных исследований при остром перитоните нами установлен факт интенсификации процессов перекисного окисления липидов и активации фосфолипазы А2 в динамике патологического процесса в плазме крови и лимфе.
Рис. 2. Показатели эндогенной интоксикации лимфы при остром перитоните (значения нормы приняты за 100 %)
В лимфе содержание продуктов ПОЛ и активность фосфолипазы А2 нарастали до третьих суток заболевания, к концу наблюдения данные показатели стабилизировались. Так, уровень первичных продуктов ПОЛ превышал норму на 68,1–124,5 % (р < 0,05), активность фосфолипазы А2 возрастала на 215,2–714,3 % (р < 0,05), активность супероксиддисмутазы снижалась на 24,5–49,3 % (р < 0,05).
Изучение мембранодеструктивных процессов в тканях кишечника показало, что при остром перитоните содержание первичных и вторичных продуктов перекисного окисления липидов в тканях органа существенно возрастало и было на 51,36–149,24 % (p < 0,001) выше нормы (рис. 3), а активность супероксиддисмутазы была на 28,12–64,23 % (p < 0,001) ниже нормальных значений.
Рис. 3. Динамика молекулярных продуктов липопереокисления в ткани тонкой кишки при остром перитоните на фоне стандартной терапии (ДК – диеновые, ТК – триеновые коньюгаты; МДА – малоновый диальдегид)
В ткани печени также существенно возрастала интенсивность ПОЛ, о чём свидетельствовало увеличение уровней его первичных и вторичных продуктов на фоне снижения активности супероксиддисмутазы более чем в 2 раза. В тканевых структурах органа отмечалась интенсификация фосфолипазы А2. Отметим, что в ткани печени положительная динамика изученных показателей регистрировалась уже с первых суток после проведения хирургического лечения перитонита.
Корреляционный анализ выявил сопряженность эндогенной интоксикации с выраженностью мембранодестабилизирующих явлений в тканевых структурах кишечника и печени. Отметим, что наиболее высокие значения коэффициента корреляции были зафиксированы при анализе взаимосвязи мембранодеструктивных процессов в кишечнике и содержания маркеров эндогенной интоксикации в лимфе, а также мембранодеструктивных процессов в печени и содержания маркеров эндогенной интоксикации в плазме крови.
Следует выделить, что восстановление гомеостатических констант в плазме крови при остром перитоните происходит быстрее, чем в лимфе, что обусловлено быстрым регрессом мембранодестабилизирующих явлений в тканях печени при сохранении их значительного уровня в тканях брюшины и кишечника.
В заключении данной серии экспериментов отметим, что в прогрессировании эндогенной интоксикации при остром перитоните важное значение имеют мембранодестабилизирующие явления не только в тканях брюшины и кишечника, но и печени. При остром перитоните после санации брюшной полости и уменьшения воспалительного процесса в ней происходит быстрое восстановление функциональной активности печени, что приводит к уменьшению уровня токсических продуктов в плазме крови при сохранении относительно высокого их уровня в лимфе.
Во второй группе, как указано выше, санация брюшной полости животным не проводилась, что способствовало прогрессивному течению заболевания с утяжелением клинической, макроскопической и биохимической симптоматики у подопытных животных.
Явления эндотоксикоза в данной группе исследования нарастали в течение всего периода наблюдения. Так, содержание молекул средней массы в плазме крови превышало норму на 125,3–412 % (p < 0,05). Индекс токсичности возрастал относительно нормы от 658,7 % (p < 0,05) на вторые сутки эксперимента до 974,3 % (p < 0,05) – на конечном этапе наблюдения.
В лимфе содержание токсических продуктов также возрастало на всех сроках эксперимента, но прирост (темп) был ниже такового в плазме крови. При исследовании скорости лимфотока было выявлено прогрессивное снижение значения данного показателя на всех этапах динамического наблюдения на 34,4–59,2 % (p < 0,05).
При прогрессировании перитонита регистрировалось динамическое увеличение интенсификации процессов перекисного окисления липидов и активации фосфолипазы А2 в плазме крови и лимфе.
В лимфе содержание продуктов ПОЛ и активность фосфолипазы А2 нарастали в течение всего эксперимента. Так, уровень первичных продуктов ПОЛ превышал норму на 148,3–226,4 % (р < 0,05), активность фосфолипазы А2 возрастала на 812,5–1121,5 % (р < 0,05), активность супероксиддисмутазы снижалась на 52,4–76,3 % (р < 0,05).
Изучение мембранодеструктивных процессов в тканях кишечника показало, что при остром перитоните содержание первичных и вторичных продуктов перекисного окисления липидов в тканях органа существенно возрастало и было на 154,3–235,7 % (p < 0,05) выше нормы, а активность супероксиддисмутазы была ниже нормы на 56,3–78,4 % (p < 0,05).
В ткани печени также прогрессивно возрастала интенсивность ПОЛ, о чем свидетельствовало увеличение уровней его первичных и вторичных продуктов на фоне снижения активности супероксиддисмутазы; отмечалось повышение фосфолипазной активности.
Отметим, что при прогрессировании острого перитонита при отсутствии хирургического лечения динамика содержания токсических продуктов в плазме крови и лимфе, а также в ткани кишечника и печени одинакова.
Таким образом, исследования показали, что при нарастании воспалительного процесса в брюшной полости отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
1. При остром перитоните после санации брюшной полости (хирургического лечения) уменьшение уровня токсических продуктов в плазме крови происходит быстрее, чем в лимфе, что во многом обусловлено быстрым восстановлением функциональной активности печени благодаря регрессу мембранодестабилизирующих явлений в тканях органа при сохранении их значительного уровня в тканях брюшины и кишечника.
2. При нарастании воспалительного процесса в брюшной полости (без хирургического лечения) отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Синдром эндогенной интоксикации при перитоните. Патогенез, диагностика, классификация эндогенной интоксикации при перитоните.
Этиология синдрома эндогенной интоксикации. СЭИ встречается при гнойно-воспалительных заболеваниях (перитонит, холецистит, панкреатит и др.), тяжелых травмах (краш-синдром), некоторых заболеваниях (сахарный диабет, тиреотоксический зоб), различных отравлениях и др.
Патогенез синдрома эндогенной интоксикации. Что может объединять данные нозологические формы, весьма далекие по этиологии? На определенном этапе заболевания, при стечении неблагоприятных факторов, это будет: 1. Токсемия, 2. Тканевая гипоксия и 3. Угнетение функции собственных детоксицируюших и защитных систем организма.
Основным звеном данного патологического каскада является токсемия (В. А. Остапенко, 1994).

Токсемия
Токсемию вызывает избыточное накопление в организме эндотоксинов. С. А. Симбирцев и Н. А. Беляков (1994) классифицируют эндотоксины по следующим группам:
• продукты естественного обмена в высоких концентрациях;
• активированные ферменты, способные повреждать ткани;
• медиаторы воспаления и другие биологически активные вещества (БАВ);
• класс среднемолекулярных веществ различной природы;
• перекисные продукты;
• неоднородные по составу ингредиенты нежизнеспособных тканей;
• агрессивные компоненты комплемента;
• бактериальные токсины (экзо- и эндотоксины).
Эндотоксины вызывают деструкцию белков и липидов клеток, блокируют синтетические и окислительные процессы. Особо следует акцентировать внимание на биологически активных веществах (БАВ) и средних молекулах (СМ).
Существуют четкие корреляции между концентрацией в крови и тканях продуктов калликреин-кининового каскада, биогенных аминов и степенью структурных поражений при многих острых процессах. Во всех случаях увеличение активности медиаторов воспаления сочетается с усилением тяжести поражений органов и систем (С. А. Симбирцев, Н. А. Беляков, 1994).
Эндотоксины оказывают прямое и опосредованное воздействие на структуру клеток, сами клетки, системы и органы (дистантное действие).
По действию на уровне клеточных структур эндотоксины можно классифицировать следующим образом (С. А. Симбирцев, Н. А. Беляков (1994):
• обладающие цитолитическим эффектом;
• активаторы лизосомальных ферментов;
• блокаторы митохондриальной энергетики;
• инициаторы свободнорадикальных процессов;
• ингибиторы рибосомального синтеза;
• способные к воздействию на различные клеточные образования.
Дистантное действие эндотоксинов выражается поражением системы микроциркуляции, которое наблюдается как в виде изолированных вне- и внутрисосудистых расстройств, так и комбинированных изменений. К внесосудистым изменениям относят нарушение регуляции тонуса периферических сосудов, среди внутрисосудистых изменений основное место отводят нарушениям реологического состояния крови, нарушениям транскапиллярного и трансмембранного обмена.
На уровне межорганных и межсистемных влияний (дистантное повреждение) действие эндотоксинов преломляется следующим образом (С. А. Симбирцев, Н. А. Беляков (1994):
• активаторы комплемента и белых клеток крови;
• активаторы калликреин-кининовой системы;
• активаторы коагуляции и фибринолизиса;
• вещества, изменяющие тонус гладкой мускулатуры;
• индукторы агрегации;
• воздействующие на проницаемость сосудистой стенки.
Это разделение на группы носит элемент условности, поскольку нет четкой границы между особенностями действия эндотоксинов, когда одни и те же вещества запускают каскадные реакции и повреждающий эффект тканевых структур осуществляется синерги-ческим влиянием с одномоментным включением защитных механизмов.
Заключение. Развитие процесса интоксикации можно представить как поступление эндотоксинов из мест образования (очаги воспаления, иммунная система, печень как источник синтеза патологических белков) в кровоток. Через кровь они попадают в органы фиксации и биотрансформации (печень, иммунная система, легкие), органы выделения патологических субстанций (печень, почки, ЖКТ, легкие, кожа), а также в органы и ткани депонирования патологических субстанций (жировая, нервная, костная ткань, органы эндокринной системы, лимфоидная ткань). При различных патологических состояниях, когда количество естественных продуктов жизнедеятельности организма, появившихся в больших количествах в биологических средах, а также заведомо агрессивные компоненты превышают возможности их биотрансформации, развивается СЭИ (К. Я. Гуревич, А. Л. Костюченко, 1994).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Несмотря на схожесть патогенеза, синдрома эндогенной интоксикации при каждой нозологической форме имеет определенные специфические признаки (Ю. С. Гольд-фарб, 1988; Б. И. Шулутко, 1993; Э. А. Туликова, 1994). Перитонит условно можно назвать классической моделью СЭИ, поэтому его целесообразно рассмотреть в качестве базовой модели данного состояния.
Патогенез. Выделяют три компонента, участвующих в формировании СЭИ при перитоните:
1. Микробиологический.
2. Биохимический.
3. Иммунологический.
В течении СЭИ выделяют три (разы (В. К. Гостищев и соавт., 1992):
I фаза — фаза интоксикации. В формировании СЭИ участвуют болезнетворные микробы и их токсины, биоактивные вещества, синтезируемые в организме в норме, но в данном случае их синтез выходит из-под контроля и вещества начинают накапливаться.
II фаза — диспротеинемия. Для нее характерны активные деструктивные процессы в тканях; усиливается распад белков, снижается их синтез, нарушаются процессы дезаминирования. С момента начала деструкции в крови повышается уровень некротических тел, СМ, которые и вызывают токсический эффект. В начале II фазы присоединяются аутоаллергические процессы.
III фаза — накопление промежуточных метаболитов. В крови и лимфе накапливаются этанол, аммиак, ацетон и др. Микробный фактор может ускорить переход одной фазы в другую. Тяжесть, время развития и обратимость СЭИ прямо связаны с тем, какие микробы вызвали заболевание: ранее имевшаяся микрофлора или новые.
Клинически в течении синдрома эндогенной интоксикации различают три степени тяжести (В. К. Гостищев и соавт., 1992). Основные критерии клинических данных степеней тяжести эндогенной интоксикации представлены в табл. 28.
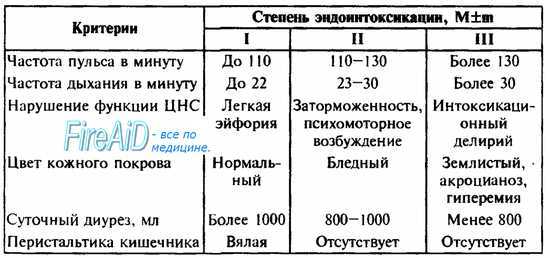
Таблица 28. Степени эндогенной интоксикации при перитоните (В. К. Гостищев и соавт., 1992).
Наиболее характерным признаком появления синдрома эндогенной интоксикации при перитоните является нарушение сознания в виде энцефалопатии (см. тему НЕОТЛОЖНЫЕ СОСТОЯНИЯ В ПСИХИАТРИИ). Больной становится заторможенным и безразличным к окружающему. Вначале данное состояние чередуется с периодами легкой эйфории, в это время больные говорливы, не могут сосредоточиться на одной мысли. При нарастании интоксикации заторможенность также нарастает, иногда наоборот, возникает психомоторное возбуждение, переходящее в интоксикационный делирий, после чего возможно наступление комы (см. тему ОБМОРОК, КОЛЛАПС, КОМА). Для определения снижения (угнетения) уровня сознания можно использовать шкалу Глазго.
Другим характерным признаком синдрома эндогенной интоксикации является сокращение почасового диуреза, обусловленное поражением почечных канальцев по типу острого нефроза и потери жидкости (рвота, понос, выход жидкости во внеклеточное пространство). Вследствие этого происходит дополнительное отравление организма невыведенными продуктами белкового обмена. Каждой степени СЭИ соответствует определенный суточный диурез (см. табл. 28). Критическим является почасовой диурез в объеме 40 мл/час и менее. При тяжелой степени интоксикации с переходом олигурии в анурию возможно формирование ОПН (см. тему ОСТРАЯ ПОЧЕЧНАЯ И ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТИ).
Появление желтушности кожных покровов и склер является прогностически неблагоприятным признаком, так как это свидетельствует о развитии острой печеночной недостаточности и снижении детоксикационных возможностей организма (см. тему ОСТРАЯ ПОЧЕЧНАЯ И ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТИ).
При «чистых» ранениях, несмотря на выраженные симптомы интоксикации, температура тела может быть нормальной или даже пониженной. Для гнойно-воспалительных заболеваний характерна гектическая температура тела с подъемом к вечеру до 38—40°С и резким снижением почти до нормы к утру.
Гемодинамические изменения при СЭИ, как впрочем и все другие, не являются специфическими. Причиной учащения пульса, снижения АД могут быть шок, реакция на боль, кровопотерю, предшествующая сердечная недостаточность. Следует помнить, что снижение давления ниже 90 мм рт. ст. характерно для шока II степени (см. тему ШОКОВЫЕ СОСТОЯНИЯ).
Основные биохимические показатели синдрома эндогенной интоксикации на фоне перитонита представлены в табл. 29.
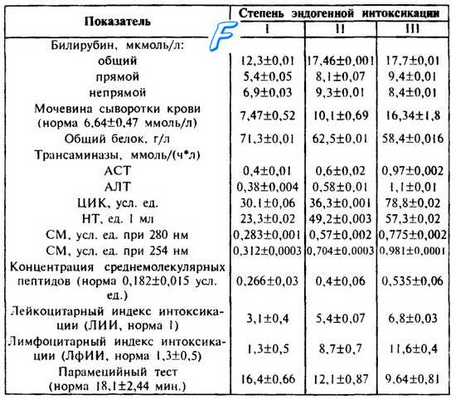
Таблица 29. Биохимические показатели крови при эндогенной интоксикации различной степени, М±т (В. К. Гостищев и соавт., 1992).
Примечание. 1. ЦИК — циркулирующие имунные комплексы; НТ некротические тела; СМ — средние молекулы.
ми миелоциты;
с сегментоядерные лейкоциты;
ю метамиелоциты;
п палочкоядерные лейкоциты;
пл плазменные клетки;
лф лимфоциты;
МО моноциты;
э эозинофилы.
Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
Хирургическое лечение. При активном вмешательстве на ранних стадиях ЭИ достаточно ликвидировать причину, чтобы прервать дальнейшее развитие эндотоксикоза. При запущенных формах продукты промежуточного обмена накапливаются в сосудистом русле и паренхиматозных органах, вызывая полиорганную недостаточность, поэтому хирургическое устранение очага воспаления и его санация способствуют ликвидации лишь отдельных компонентов ЭИ.
Консервативное лечение больных с ЭИ должно строиться с учетом степени эндотоксикоза (В. К. Гостищев и соавт., 1994). К общим методам воздействия на ЭИ относятся инфузионная терапия, различные способы экстракорпоральной детоксикации (см. выше), гипербарическая оксигенация.
Больному необходимо обеспечить полноценное парентеральное питание. Суточный каллораж должен быть не менее 3000 ккал/ сутки, 2/3 этой потребности рекомендуется обеспечивать за счет концентрированных растворов глюкозы, а 1/3 — за счет жировых эмульсий (20% раствор интралипида, липофундина).
Общий объем вводимой жидкости в период острой интоксикации — 4—5 л/сутки. Из этого количества 2,5—3 литра должно приходиться на кристаллоидные растворы, остальное — коллоиды и белковые препараты крови (плазма, альбумин, протеин). Выбор инфузионно-трансфузионных сред, их комбинация определяются характером волемических нарушений, дефицитом белкового и электролитного состава крови. Коррекцию водно-электролитного состава осуществляют с помощью солевых растворов типа Рингер-Локка. Коррекцию диспротеинемий проводят с помощью белковых гидролизатов, плазмы и протеинов.
Простым и широко используемым методом лечения эндогенной интоксикаци является форсированный диурез, основанный на использовании естественного процесса удаления токсических веществ из организма. Предварительно проводят умеренную гемодилюцию, для чего используют растворы кристаллоидов, низкомолекулярных декстранов, а при гиповолемии — белковые кровезаменители. Один из вариантов водной нагрузки: в/в вводится 1000 мл физиологического раствора, 200 мл 4% раствора бикарбоната натрия и 400 мл реополиг-люкина, затем маннитол из расчета 1 — 1,5 г/кг или 40—80 мг лазик-са; мосле этого продолжают вливание 5% раствора глюкозы, белковых препаратов (плазма крови, раствор альбумина, белковый гид-ролизат) в объеме 1000—1500 мл. Кроме того, в состав трансфузи-онных сред включают растворы хлорида калия (40—60 мл 10% раствора или 100—120 мл 4% раствора дробно), хлорида натрия (50 мл 10% раствора), хлорида кальция (30 мл 10% раствора) для коррекции неизбежной при проведении методики форсированного диуреза потери электролитов. Лечение осуществляется под контролем за почасовым диурезом и ЦВД, электролитным и белковым балансом организма, КЩС, остаточным азотом.

Антибактериальная терапия проводится препаратами широкого спектра действия в сочетании трех препаратов разных групп. При этом учитывается вид микроорганизма и его чувствительность к препарату.
В качестве иммунокоррегируюшей терапии используют иммуномодуляторы: Тактивин (синоним: Т-активин) по 1 мл 0,01% раствора п/к (ежедневно, курс 10—12 инъекций), тималин, взрослым по 5—20 мг ежедневно (30—100 мг на курс), левамизол (обычно 50 мг 3 раза в день в течение 4—5 дней, через 7 дней курс повторяют; или по 150 мг 1 раз/день, курс 5—7 дней), диуцифон по 0,1 г 3—4 раза в день или вводят в/м по 4 мл 5% р-ра (0,2 г) 1 раз в сутки.
Раздел: Патогенез и клиническая диагностика синдрома эндогенной интоксикации (В.В. Щекотов)
ИНТОКСИКАЦИЯ (лат. in в, внутрь + греч. toxikon яд) – патологическое состояние, возникающее в результате действия на организм токсических (ядовитых) веществ эндогенного или экзогенного происхождения.
Соответственно различают экзогенные и эндогенные интоксикации (И). Понятие «интоксикация» нередко отождествляют с понятием «отравление», хотя отравлением принято называть только те И, которые вызваны экзогенными ядами.
Понятие «яды» охватывает по существу все токсические вещества окружающей среды, которые способны при определенных условиях вызвать И организма. Эндогенные И объединены термином «аутоинтоксикация». Впервые упоминание об И как причине болезни встречается у Парацельса, который различал болезни от внутренних и наружных ядов. Экспериментальное изучение И в России связано с работами Пеликана (1878), изучавшего патогенез И, вызванных некоторыми ядами, имеющими судебно-медицинское значение, и школы В. В. Пашутина; ученик В. В. Пашутина С. Бочаров (1884) показал роль продуктов гниения в патогенезе И при сепсисе.
Эндогенная интоксикация (ЭнИ) – это полиэтиологичный и полипатогенетичный синдром, характеризующийся накоплением в тканях и биологических жидкостях эндогенных токсических субстанций (ЭТС) – избытка продуктов нормального или извращенного обмена веществ или клеточного реагирования. Она представляет собой сложное многокомпонентное явление, включающее:
- источник токсемии, обеспечивающий образование ЭТС;
- биологические барьеры, предупреждающие прорыв эндогенных
токсинов за пределы источника;
- механизмы переноса этих токсических продуктов к клеткам-
мишеням, к органам биотрансформации и/или экскреции;
- механизмы иммобилизации и депонирования, биотрансформации
(нейтрализации) и экскреции токсических продуктов;
- эффекторные ответы на интоксикацию в виде так называемой
вторичной токсической агрессии, в результате которой ЭнИ в значительной мере теряет свою специфичность.
Хотя эндогенная интоксикация полиэтиологична, можно выделить следующие первичные механизмы ее развития:
- продукционный или обменный, обусловленный избыточной продукцией эндогенных токсических субстанций (разлитой перитонит, острый панкреатит, пневмония);
- резорбционный, когда происходит резорбция токсических веществ из ограниченного очага инфекции, распадающихся тканей (кишечная непроходимость, флегмоны мягких тканей, абсцессы и т. д.);
- реперфузионный, при котором в системный кровоток поступают вещества, накопившиеся в длительно ишемизированных тканях, а также выделившиеся из клеток этих тканей при их повреждении активным
кислородом и избытком свободных радикалов на фоне несостоятельности антиоксидантной защиты (шок, реперфузионный синдром, операции с применением аппарата искусственного
кровообращения и т.д.);
- ретенционный, при котором накопление ЭТС происходит в результате нарушения их выделения естественными органами детоксикации (острая почечная (ОПН) и печеночная (ОПечН)
недостаточность);
- инфекционный, в результате поступления микроорганизмов, продуктов их обмена и распада из очага инвазивной инфекции или путем транслокации из извращенно контаминированного желудочно-
кишечного тракта. В развитии острого эндотоксикоза одновременно или последовательно могут участвовать несколько механизмов образования ЭТС и накопления их во внутренней среде организма.
Вопрос о том, что может являться такими токсическими субстанциями и обусловливать тяжесть состояния пациентов, сложен и противоречив, так как многие вещества в зависимости от их концентрации могут оказывать и благоприятное, и неблагоприятное функциональное воздействие, а большинство из них вообще не идентифицированы. Можно классифицировать их в зависимости от этиологии и механизма выведения.
2.КЛАССИФИКАЦИЯ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Классификация экзогенных И основана на природе вызывающих их ядов (отравление дихлорэтаном, мышьяком и т. д.) или содержащих их продуктов (пищевые отравления). Эндогенные И классифицируются в зависимости от заболевания, послужившего источником их возникновения (травматическая, радиационная, инфекционная, гормональная И), или физиологической системы, расстройство которой привело к накоплению в организме токсических продуктов (кишечная, почечная И).
И обычно наступает в результате действия циркулирующих в крови токсических веществ; циркуляция в крови эндогенных ядов чаще обозначается как токсемия, а циркуляция токсинов – как токсинемия. Часто используют термины, указывающие вещество, находящееся в крови в избытке (хотя и свойственное организму) - напр., азотемия. Термином «токсикоз» иногда пользуются для названия заболеваний, вызванных экзогенными ядами, например, алиментарный токсикоз, протеотоксикоз (в случае отравления экзогенными белками). Токсикозами иногда называют синдромы, развивающиеся вследствие избыточного поступления в кровь гормона, например, щитовидной железы – тиреотоксикоз, а также при осложнениях беременности, связанных с явлениями аутоинтоксикации – токсикозы беременных и др.
2.1. ПРИЧИНЫ И МЕХАНИЗМЫ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Эндогенная И может быть вызвана токсическими продуктами, образующимися в организме при различных заболеваниях (аллергических болезнях, ожоговой болезни) и экстремальных состояниях. К эндогенной И. относится отравление продуктами жизнедеятельности бактерий, находящихся в организме. В ряде случаев И. становится ведущим патогенетическим фактором, определяющим развитие клинической картины (уремия, токсикоинфекции, тиреотоксикоз, токсическая дифтерия, токсическая диспепсия и др).
В механизмах как эндогенной, так и экзогенной И. имеется много общего, т. к. в том и другом случае повреждающим фактором является токсический агент. Кроме того, И, вызванная экзогенным фактором, может реализоваться эндогенным путем; например, отравление антихолинэстеразными ядами типа физостигмина или фосфакола в основном сводится к аутоинтоксикации ацетилхолином, который накапливается в синаптических образованиях вследствие прекращения его ферментативного гидролиза.
К числу веществ, накапливающихся в организме при различных заболеваниях и вызывающих эндогенную И., относятся химические соединения различной природы: продукты превращения аминокислот (фенол, крезол, индол, скатол, путресцин, кадаверин), жиров (γ-оксимасляная кислота, ацетоуксусная кислота и ацетон). Имеют значение также активные белки, аденилнуклеотиды, гистамин, серотонин, кинины и другие физиологически активные вещества, выделяющиеся в значительных количествах при повреждении клеток и тканей. При инфекционных заболеваниях происходит накопление бактериальных токсинов и других продуктов жизнедеятельности микробов, а также продуктов распада тканей.
Основной причиной И в условиях трансплантации является реакция трансплантат против хозяина. При возникновении И в различных экстремальных состояниях, например, при ожоговой болезни, травме, патогенетическое значение имеет подавление детоксицирующей способности ретикулоэндотелиальной системы, в связи с чем в организме происходит накопление эндотоксина Е. coli. вызывающего расстройства микроциркуляции. Имеет место также стимулирование неферментативного перекисного окисления липидов клеточных мембран, в результате чего в организме накапливаются токсичные продукты, что вызывает изменение проницаемости этих мембран. При лучевом поражении, кроме того, происходит накопление липидных и хиноноподобных токсинов, повреждающее действие которых на клетки приводит к накоплению в организме гистамина и других физиологически активных продуктов белкового распада. Снижение содержания в тканях естественного ингибитора цепных окислительных реакций токоферола имеет значение для развития И при авитаминозе Е и новообразованиях.
2.2. ИСТОЧНИКИ ЭНДОТОКСИНЕМИИ
- продукты нормального обмена веществ в высоких концентрациях (лактат, пируват, мочевая кислота, мочевина, креатинин, билирубина глюкуронид и др.);
- вещества, избыточно образующиеся при извращенном метаболизме (кетоны, альдегиды, спирты, карбоновые кислоты, аммиак и др.);
- продукты распада клеток и тканей из очагов тканевой деструкции и/или из ЖКТ при нарушении барьерных функций мембран (липазы, лизосомальные ферменты, катионные белки, миоглобин, индол, скатол, фенол и др.);
-компоненты и эффекторы регуляторных систем организма в патологических концентрациях: активированные ферменты (лизосомальные, протеолитические, продукты активации калликреинкининового каскада, системы свертывания крови и фибринолиза);
- медиаторы воспаления, биогенные амины, цитокины, простагландины, лейкотриены, белки острой фазы и другие биологически активные вещества;
- активные соединения, образующиеся при перекисном окислении липидов;
- микробные токсины (экзо- и эндотоксины) и другие факторы патогенности микроорганизмов (патогенных, условно-патогенных, непатогенных);
- иммуночужеродные продукты клеточного распада, антигены и иммунные комплексы-агрессоры.
2.3. ПУТИ ЭЛИМИНАЦИИ ЭНДОГЕННЫХ ТОКСИНОВ
- газообразные вещества – выделяются через легкие;
- гидрофильные низко- и среднемолекулярные вещества – удаляются почками, через кожу, ЖКТ в виде растворов;
- гидрофобные низко- и среднемолекулярные вещества – транспортируются белками и/или клетками крови в печень и легкие, где и биотрансформируются при участии монооксигеназной системы или
претерпевают изменения в реакциях связывания с последующим удалением через почки, кожу, ЖКТ;
- гидрофобные низко- и среднемолекулярные вещества – связываются с белками плазмы крови, приобретают свойства гаптенов и поглощаются клетками иммунной системы;
- высокомолекулярные соединения – транспортируются по лимфатическим сосудам, элиминируются моноцитарно-макрофагальной системой (до 80% макрофагов организма находится в печени).
2.4. СТАДИИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Острый эндотоксикоз протекает как каскадный процесс. Развитие и прогрессирование его связано с несоответствием между образованием (поступлением и т.д.) токсических субстанций, в том числе образующихся в результате последующей токсической аутоагрессии, и способностью органов, входящих в функциональную систему детоксикации (легкие, печень, почки, ЖКТ, кожа, система иммунологического надзора), их трансформировать, нейтрализовать и элиминировать. Существенное значение могут иметь нарушения соотношений между веществами антагонистами в гуморальных регуляторных системах (ферменты-антиферменты, оксиданты-антиоксиданты, цитокины-антицитокины и т.д.).
Исходя из взаимоотношений эндогенной интоксикации и возможностей функциональной системы детоксикации (ФСД) можно выделить 4 стадии развития эндотоксикоза: компенсации, напряжения, субкомпенсации и декомпенсации.
3. ПАТОГЕНЕЗ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Механизм И в основном заключается в повреждающем действии эндогенного или экзогенного токсического агента на те или иные клеточные структуры и нарушении метаболических процессов в организме. При некоторых видах И повреждение клеток может иметь характер некроза (напр., при воздействии четыреххлористого углерода на печень), однако, в большинстве случаев происходят обратимые изменения на различных уровнях организма от субклеточного до системного, которые приводят к сдвигам гомеостаза в связи с нарушением метаболизма. Так, в основе мембранотоксического действия афлатоксинов, некоторых бактериальных токсинов, сапонинов лежит нарушение структуры фосфолипидов и образование промежуточных продуктов гидролиза. В механизмах И имеет значение не только непосредственное действие токсических веществ на определенные функции, но и нейрогуморальные и рефлекторные влияния, а также вовлечение в патологический процесс серотонина, кининов и других физиологически активных веществ, выделяющихся в значительных количествах при повреждении клеток и тканей.
В механизмах И имеют значение не только непосредственное действие токсических веществ на определенные функции, но и нейрогуморальные и рефлекторные влияния, а также вовлечение в патологический процесс различных органов и систем. При хронических И некоторыми химическими соединениями, алкилирующими фосфатные группы нуклеиновых кислот (нитрозоэтилмочевина, этилметан-сульфонат и др.), может проявиться их мутагенное действие; при И некоторыми циклическими углеводородами (3,4-бензпирен и др.) – канцерогенное действие.
Развитию И противостоят детоксицирующие системы организма, обеспечивающие химическое превращение токсичных веществ в менее токсичные или растворимые вещества, поддающиеся выведению из организма (окисление, гидролиз, метилирование, восстановление и образование парных соединений и другие процессы). Эти процессы происходят с участием ферментных систем организма, обеспечивающих обезвреживание и метаболические превращения ядовитых веществ. Яды, поступающие в кровь, через воротную вену попадают в печень, являющуюся мощным детоксицирующим барьером, и частично в ней нейтрализуются. И развивается при поступлении в организм токсичных веществ в количестве, превышающем возможности детоксицирующих систем или при их неполноценности.
4. КЛИНИКА ЭНДОГЕНОЙ ИНТОКСИКАЦИИ
По клиническому течению И делят на острые и хронические. Тяжесть И определяется величиной токсической дозы и реактивностью организма. Соответственно выделяют И легкой, средней и тяжелой степени.
Клинические проявления эндогенных и экзогенных И имеют свои особенности. Течение эндогенной И в значительной степени определяется характером основного заболевания. Так, например, для диффузного токсического зоба характерны стойкая тахикардия, похудание, экзофтальм – симптомы токсического действия избыточного количества тиреоидных гормонов (тиреотоксикоз). При хронической уремии отмечаются явления воспаления в местах выделения азотистых шлаков; в гортани, глотке, желудочно-кишечном тракте, на коже обнаруживаются скопления кристаллов мочевины («уремическая пудра»). При хронической эндогенной И больные отмечают недомогание, раздражительность, разбитость, головную боль, головокружение, тошноту; наступает истощение, снижается резистентность организма. В ряде случаев эндогенная И может протекать в форме тяжелого острого отравления (рвота, ступор, коматозное состояние). Такое течение характерно для острой почечной недостаточности, гепатаргии, токсемического шока, острой ожоговой токсемии.
Течение экзогенной И определяется, в основном, токсикодинамикой яда, его дозой, способом попадания в организм, функциональным состоянием организма. Избирательность действия различных ядов обусловливает возникновение тех или иных синдромов: бронхоспазм, токсический отек легких, судороги. Тяжелая экзогенная И может протекать с нарушением дыхания и гемодинамики, преобладанием почечной и печеночной недостаточности, может наблюдаться коматозное состояние; при отравлении некоторыми ядами возможны интоксикационные психозы.
При длительном действии ядов в малых концентрациях (часто ниже минимально токсических доз) вначале возникают неспецифические симптомы в виде разнообразных нарушений функций преимущественно нервной и эндокринной систем, позднее присоединяются симптом специфических системных поражений (напр., марганцовый паркинсонизм, остеопороз при хроническом отравлении соединениями фтора и др.). Хроническая И некоторыми нейротропными ядами избирательного действия может с самого начала сопровождаться специфическими симптомами (миоз при отравлении мускарином, эзерином и подобными им веществами, сухость во рту и мидриаз при отравлении атропином). Иногда в процессе хронической И могут возникнуть бурно протекающие симптомы (например, свинцовая колика).
5. КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ С СИНДРОМОМ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ. УРОВНИ ДИАГНОСТИКИ
Диагностика ЭИ разработана главным образом на биохимическом уровне.
В том случае, если состояние не является критическим, для его диагностики целесообразно использовать тот же принцип, что и заложенный в основу распознавания дистресса, т.к., по-видимому, эндогенная интоксикация во многом пересекается с реакцией общего адаптационного синдрома. Мы предлагаем оценивать такие признаки дистресса, главным образом субъективные, которые составляют основу ряда вопросников для диагностики дистресса (табл. 1).
Читайте также:
- Рентгенограмма, КТ при остеобластоме челюсти
- Поражение почек паразитами. Влияние очаговых инфекций на почки
- Смерть при хилотораксе. Течение послеоперационного хилоторакса
- Методика иммунохимического исследования парапротеинов - принципы
- Многоплодная беременность. Частота многоплодной беременности. Перинатальная смертность при многоплодной беременности.
