Синдром фето-фетальной трансфузии. Диагностика синдрома фето-фетальной трансфузии (СФФТ)
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Цель исследования: оптимизировать обследование детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
Дизайн: сравнительное проспективное когортное наблюдение.
Материалы и методы. Проведено наблюдение за 60 недоношенными детьми из монохориальных диамниотических двоен с гестационным возрастом 26 недель 0–6 суток — 32 недели 0–6 суток. Основную группу (группу I) составили 30 детей, перенесших СФФТ и его внутриутробную хирургическую коррекцию. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было. Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения: 1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток); 2-я точка — 6 мес корригированного возраста; 3-я точка — 12 мес корригированного возраста; 4-я точка — 18 мес корригированного возраста. Всем детям выполняли диффузионно-тензорную магнитно-резонансную томографию с трактографией. В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота грубых органических поражений центральной нервной системы (ЦНС) и негрубых резидуальных (функциональных) нарушений.
Результаты. Согласно данным МР-трактографии, изучаемые показатели у детей групп I и II в 6 месяцев корригированного возраста значимо не различались, кроме среднего коэффициента диффузии (average diffusion coefficient, ADC) справа задней ножки внутренней капсулы. В возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела (р = 0,034) и валике мозолистого тела справа (р = 0,001), повышение значения ADC в валике мозолистого тела справа (р = 0,0001). Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы (р = 0,0001). В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р >0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05).
Заключение. Дети из монохориальных диамниотических двоен, перенесшие СФФТ, составляют группу риска нарушения темпов миелинизации проводящих путей в 18 месяцев корригированного возраста. Определена прогностическая значимость СФФТ и темповой задержки созревания проводящих путей кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля процесса миелинизации проводящих путей головного мозга у детей из группы риска.
Вклад авторов: Павличенко М.В. — разработка концепции и дизайна исследования, сбор и обработка материала, написание текста рукописи, ответственность за целостность всех частей статьи; Косовцова Н.В. — разработка концепции и дизайна исследования, редактирование рукописи, утверждение окончательного варианта статьи; Зырянов М.Н., Липацев Ю.А. — проведение магнитно-резонансной трактографии, интерпретация результатов; Маркова Т.В. — статистическая обработка материала, выполнение работы по систематизации материала; Поспелова Я.Ю. — сбор литературных данных, выполнение работы по систематизации материала.
Конфликт интересов: авторы заявляют об отсутствии возможных конфликтов интересов.
Широкое внедрение в практику ВРТ, успехи преодоления бесплодия привели к повышению частоты монохориального многоплодия [1–3] . При данном виде многоплодия велика вероятность возникновения осложнений у женщины, плодов, новорожденных и детей раннего возраста [4–6] . Высокие заболеваемость и смертность детей из монохориальных диамниотических двоен обусловлены особенностями ангиоархитектуры монохориальной плаценты. Морфологической основой развития трансфузионного синдрома является функционирование плацентарных анастомозов [7–9] .
Современные возможности фетальной хирургии повышают вероятность сохранения жизни обоих плодов, однако вопрос о влиянии преодоленного трансфузионного синдрома на здоровье ребенка нуждается в дополнительном изучении и уточнении [10, 11] . Поскольку у недоношенных детей из монохориальных диамниотических двоен наиболее высок уровень инвалидности по нервно-психическим заболеваниям [12, 13] , целью нашей работы стала оптимизация обследования детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
МАТЕРИАЛЫ И МЕТОДЫ
Проведено наблюдение за развитием недоношенных детей из монохориальных диамниотических двоен от рождения до достижения возраста 18 месяцев с проведением магнитно-резонансной трактографии.
- гестационный возраст 26 недель 0–6 суток — 32 недели 0–6 суток;
- монохориальная диамниотическая беременность;
- родители — жители Екатеринбурга и Свердловской области;
- принадлежность пациентов к славянской этнической группе.
Для всех пациентов родителями оформлялось информированное согласие на включение в исследование.
- дети из дихориальных диамниотических двоен;
- дети из троен;
- наличие серьезных врожденных пороков развития, не связанных с СФФТ (врожденных пороков сердца и ЖКТ);
- выявление наследственных (генетических) заболеваний у детей.
- отказ родителей на очередном этапе от последующего наблюдения;
- переезд семьи в другой регион России или за границу.
В исследование включены 60 недоношенных новорожденных из монохориальных диамниотических двоен. Основную группу (группу I) составили 30 пациентов, перенесших СФФТ и его внутриутробную хирургическую коррекцию методом лазерной коагуляции плацентарных анастомозов в сроке 22–24 недели гестации. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было.
Наблюдаемые дети родились в 2019–2020 гг. в ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России (директор — д. м. н. Галина Борисовна Мальгина). Все они выхаживались в стационаре второго этапа указанной медицинской организации и до достижения конечной точки наблюдения (18 месяцев постменструального возраста, ПМВ) в декретированные сроки госпитализировались в стационар отделения детской реабилитации для дообследования и проведения лечебных мероприятий.
Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения:
1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток, гестационный возраст равен ПМВ);
2-я точка — 6 мес корригированного возраста (64 нед ПМВ);
3-я точка — 12 мес корригированного возраста (88 нед ПМВ);
4-я точка — 18 мес корригированного возраста (112 нед ПМВ).
- осмотр и физикальное обследование;
- общеклинические лабораторные исследования;
- инструментальные исследования (нейросонография с ультразвуковой доплерометрией, электроэнцефалограмма-видеомониторинг, МРТ головного мозга с МР-трактографией).
Диффузионно-тензорную МРТ с трактографией (МР-трактографию) проводили на томографе Signa HDxt 1.5Т (General Electric, США) с индукцией магнитного поля 1,5 Тл. Исследование включало 2D BRAVO Т1 последовательность (TR/ТЕ — 8,4/3,1 мс, толщина среза — 1,2 мм, непрерывно, FOV — 24 × 24 см, матрица — 200 × 200, аксиальная плоскость), Т2 FLAIR (TR/ТЕ — 9002,0/135,6 мс, толщина среза — 4 мм, непрерывно, FOV — 24 × 24 см, матрица — 288 × 56, аксиальная плоскость). Диффузионно-тензорные изображения были получены с использованием следующих параметров: TR/ТЕ — 9000,0/94,9 мс, матрица — 96 × 96; толщина среза — 2,5 мм, непрерывно, максимальный коэффициент диффузии (b-value) — 1000 с/мм 2 , без наркоза и седации, в период естественного дневного сна.
Полученные данные обрабатывались на рабочей станции AW версии 4.3, где проводили измерения среднего коэффициента диффузии (average diffusion coefficient, ADC) и фракционной анизотропии (fractional anisotropy, FА) в выделенных симметричных областях (region of interest, ROI) с использованием инструментов программного обеспечения Functools рабочей станции AW версии 4.3. Проводилась трехмерная реконструкция проводящих путей головного мозга. Результаты оценивались совместно со специалистами отделения биофизических и лучевых методов исследований.
Для оценки моторных и сенсорных путей исследовали кортикоспинальный тракт и заднюю таламическую лучистость. Кортикоспинальный тракт оценивали на уровне передней ножки, задней ножки и колена внутренней капсулы. Для оценки комиссуральных межполушарных волокон проводили измерения мозолистого тела на следующих уровнях: колено мозолистого тела, средняя и задняя треть ствола, а также валик мозолистого тела. Для каждой исследуемой анатомической структуры выделялись области интереса (ROI). Количество пикселей соответствовало размерам анатомической области на данном срезе. Для основной группы и группы сравнения показатели FA и ADC были получены в аналогичных анатомических структурах.
Возрастные периоды выбраны с учетом стадий миелинизации по R.B. Dietrich (1988): младенческая стадия — до 6 мес, переходная стадия — 8–12 мес, ранняя взрослая стадия — 10–31 мес жизни.
Восстановительное лечение (абилитация) всех пациентов включало:
- нейропротекторы и противосудорожные средства по индивидуальным показаниям;
- кинезиотерапию (лечебную физкультуру, массаж, тактильно-кинестетическую стимуляцию);
- гидротерапию;
- иглорефлексотерапию;
- физиотерапию — токолечение, теплолечение, сухую иммерсию;
- семейно-ориентированное психологическое сопровождение (работу с перинатальным психологом).
В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота:
- грубых органических поражений ЦНС, таких как детский церебральный паралич, судорожный синдром, выраженная задержка психомоторного развития;
- негрубых резидуальных (функциональных) нарушений — темповой задержки психомоторного развития, вегето-висцеральных нарушений.
В связи с ограниченным контингентом больных и небольшой длительностью наблюдения гендерные различия не фиксировали.
Этическая экспертиза осуществлена в соответствии с процедурой комплексной экспертной оценки полного конкурсного цикла Российского фонда фундаментальных исследований, предусмотренной для исследования по данному направлению.
За время наблюдения нежелательных явлений не было. Все пациенты перенесли исследование удовлетворительно.
Обработка цифрового материала выполнена с использованием пакета компьютерной программы Statistica 10.0 for Windows ХР, BioStat в соответствии с общепринятыми методами медицинской статистики. Количественные данные (FA и ADC) представлены в формате медианы (Me) и стандартного отклонения (m). Рассчитывали также непараметрические показатели: χ 2 , критерий Фишера, отношения рисков. Различия считали статистически значимыми при р ≤ 0,05.
В настоящее время диффузионно-тензорная МРТ с трактографией (МР-трактография) прочно вошла в клиническую практику, с ее помощью совершенствуются подходы к диагностике заболеваний в детской неврологии благодаря уникальным возможностям клинико-нейровизуализационных сопоставлений. Трактография головного мозга — диагностический метод, основанный на диффузионно-тензорной МРТ (МР-трактографии), позволяющий визуализировать ориентацию и целостность проводящих путей головного мозга in vivo. Еще несколько лет назад трактография была предметом научных исследований, в настоящее время этот метод становится доступным [14, 15] .
При оценке тяжести перинатальных энцефалопатий у наблюдаемых детей из монохориальных диамниотических двоен мы учитывали следующие показатели: оценку по шкале Апгар, тяжесть состояния при рождении, неврологические синдромы в постнатальном периоде, характер патологических изменений по данным нейросонографии, результаты доплерометрии.
Таблица 1
Частота диагностированных перинатальных энцефалопатий у пациентов
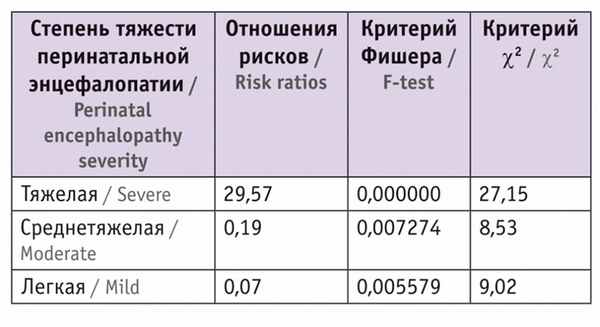
СФФТ вызывает развитие гемодинамических нарушений у плодов, что может спровоцировать гибель нейронов, снижение как общего числа нейронов, так и количества правильно миелинизированных аксонов. С целью диагностики целостности и направления проводящих каналов головного мозга у изучаемых детей была проведена диффузионно-тензорная МРТ с трактографией в возрасте 6, 12, 18 месяцев корригированного возраста ( табл. 2–4 ).
Таблица 2
Показатели магнитно-резонансной трактографии у младенцев в 6 месяцев корригированного возраста
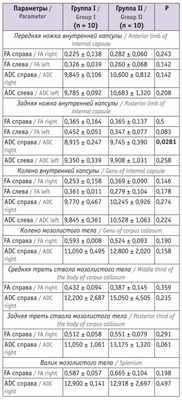
Примечание. Здесь и в таблицах 3, 4: ADC — средний коэффициент диффузии (average diffusion coefficient) (единица измерения — –10 3 мм/с), FА — коэффициент фракционной анизотропии (fractional anisotropy).
Таблица 3
Показатели магнитно-резонансной трактографии у младенцев в 12 месяцев корригированного возраста
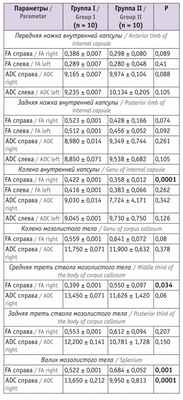
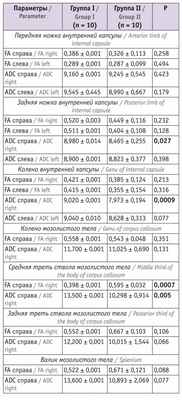
Таблица 4
Показатели магнитно-резонансной трактографии у младенцев в 18 месяцев корригированного возраста
Согласно представленным в таблице 2 данным, исследуемые показатели у детей групп I и II значимо не различались, кроме показателя ADC справа задней ножки внутренней капсулы. У детей в возрасте 12 мес значимые различия в изучаемых параметрах выявлялись чаще (см. табл. 3 ).
При анализе изучаемых показателей в возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела и валике мозолистого тела справа, повышение значения ADC в валике мозолистого тела справа. Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы. Значения ADC в колене, передней и задней ножках внутренней капсулы в основной группе и группе сравнения существенно не различались.
В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р >0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05). Случаев оформления инвалидности по неврологической патологии не было.
Проведенный нами анализ подтверждает значимость базового критерия — задержки темпов миелинизации кортикоспинального тракта и задней таламической лучистости у недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, в определении прогноза развития отсроченных неврологических нарушений, особенно грубой органической патологии ЦНС. Полученные значимые различия при относительно небольшой численности наших когорт и ограниченном сроке исследования свидетельствуют о том, что требуется дальнейшее изучение состояния здоровья недоношенных детей, перенесших СФФТ.
В настоящее время все больше возрастает необходимость в неинвазивном бесконтактном получении информации о характере регионарных и очаговых процессов, происходящих в головном мозге ребенка, как на диагностическом этапе, так и в процессе лечения заболеваний ЦНС у детей различных возрастных групп. В этом отношении новые перспективы открывает метод МР-трактографии [16, 17] . МР-трактография мозга у детей в различные возрастные периоды обладает рядом особенностей. У новорожденных реконструкция проводящих путей затруднена из-за малонаправленного характера диффузии на фоне незавершенной сформированности. Тяжелое состояние новорожденного ребенка, ИВЛ могут стать препятствиями для проведения данной диагностической процедуры. Малые размеры головного мозга требуют использования уменьшенной величины вокселя, что снижает интенсивность получаемых сигналов и затрудняет реконструкцию трактограмм [18, 19] .
Процесс миелинизации мозга (увеличение содержания липидов и уменьшение содержания воды в оболочках нервных путей) начинается на пятом месяце внутриутробного развития и продолжается активно до 2 лет. В этом возрасте миелинизация мозга является ключевым компонентом неврологического развития, она коррелирует с увеличением сенсорных, моторных и когнитивных способностей, тесно связана с неврологической функциональной зрелостью [20] .
Недоношенные новорожденные из монохориальных диамниотических двоен, перенесшие синдром фето-фетальной трансфузии (СФФТ), составляют группу риска нарушения миелинизации проводящих путей, по результатам магнитно-резонансной трактографии. Определена прогностическая значимость СФФТ и темповой задержки созревания кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля за процессом миелинизации у детей из группы риска. Ранняя диагностика повреждения, своевременный подбор абилитационной и реабилитационной терапии повышают шансы успешного лечения и благоприятных отдаленных исходов у недоношенных детей из монохориальных диамниотических двоен. Предполагается продолжить медицинское сопровождение семей недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, с целью этапной коррекции неврологических нарушений и улучшений показателей здоровья и психомоторного развития.
Случай диагностики фето-фетального трансфузионного синдрома. Клиническое наблюдение
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Введение
Синдром фето-фетальной трансфузии (СФФТ), известный так же, как фето-фетальный трансфузионный синдром (ФФТС) (англ. "twin-to-twin transfusion syndrome", TTTS; нем. "Fetofetale Transfusions syndrom", FFTS) - серьезное осложнение многоплодной монохориальной беременности, при котором у плодов возникает диспропорциональный кровоток [1].
По данным литературы, частота ФФТС составляет 10-15% от всех монохориальных двоен. Перинатальная смертность при ФФТС достигает 60-100% [2, 3].
Причина развития ФФТС - наличие сосудистых анастомозов, которые соединяют системы плацентарной гемоциркуляции обоих плодов. Предполагается, что основным пусковым фактором формирования ФФТС служит патология развития плаценты плода-донора, в результате которой повышается периферическая резистентность плацентарного кровотока, что приводит к шунтированию крови к плоду-реципиенту [4, 5]. У реципиента развивается многоводие, гиперволемия, кардиомегалия, трикуспидальная регургитация, а в некоторых случаях - обструкция легочного ствола. Степень выраженности патологических изменений зависит от степени перераспределения крови через анастомозы.
- I cтадия: многоводие реципиента в сочетании с олигоангидрамнионом у донора.
- II cтадия: отсутствие наполнения мочевого пузыря донора.
- III cтадия: сердечно-сосудистые изменения у обоих плодов, проявляющиеся патологическими показателями допплерографии артерий пуповины и венозного протока.
- IV cтадия: водянка плода-реципиента.
- V cтадия: внутриутробная гибель одного или обоих плодов.
Ультразвуковая диагностика ФФТС становится возможной в 16-24 нед беременности и основана на установлении монохориальности плодов, выявлении дискордантности размеров и количества амниотической жидкости плода "донора " и "реципиента", исследовании плодово-плацентарной гемодинамики, а обнаружение повышения постнагрузки и преднагрузки свидетельствует о тяжести ФФТС [1, 2, 6, 7].
Наиболее неблагоприятный прогноз течения беременности при развитии синдрома до 25 нед.
Отсутствие какого-либо вмешательства приводит к гибели (около 80%) или тяжелой заболеваемости плодов. На сегодняшний день наиболее эффективной процедурой является фетоскопическая лазерная коагуляция плацентарных анастомозов при ФФТС. Неонатальные исходы зависят от стадии течения заболевания, на которой произведено вмешательство. Чем раньше произведена операция, тем лучше ожидаемые результаты [1, 8].
Клиническое наблюдение
Беременная И., 27 лет. Данная беременность вторая, первые роды в 2006 году, не осложненные, в срок. Данная беременность наступила самопроизвольно и протекала с угрозой прерывания. Диагноз многоплодной беременности установлен при первом скрининговом исследовании.
В 23-24 нед гестации при УЗИ впервые поставлен диагноз ФФТС. Пациентка получала лечение утрожестаном, курантилом, гинипралом, актовегином, кокарбоксилазой амбулаторно.
При контрольном ультразвуковом исследовании, проведенном в научно-консультативном отделе института в 29 нед беременности выявлено: в полости матки находятся 2 живых плода: I плод в головном предлежании 1 позиции переднем виде, женского пола, II плод в головном предлежании 1 позиции переднем виде женского пола. Данные фетометрии представлены в таблице.
Синдром фето-фетальной трансфузии. Диагностика синдрома фето-фетальной трансфузии (СФФТ)
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ "Уральский научно-исследовательский институт охраны материнства и младенчества" Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
Синдром фето-фетальной трансфузии. Анализ исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов
Журнал: Российский вестник акушера-гинеколога. 2019;19(4): 22‑28
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
Цель обзора литературы — анализ исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов, проведенный при различного рода исследованиях, опубликованных за последние годы в зарубежных и отечественных медицинских изданиях. В результате анализа были определены основные ультразвуковые и фетоскопические маркеры, влияющие на исходы оперативного лечения: расположение плаценты по передней и задней стенке, место прикрепления пуповины, количество плацентарных анастомозов, аномальные кривые скоростей кровотока в артериях пуповины, расстояние между местами прикрепления пуповин, диссоциированный рост плодов, срок беременности и стадия тяжести синдрома фето-фетальной трансфузии по R. Quintero на момент проведения операции, опыт оперирующих хирургов и продолжительность операции. Анализ данных литературы показал, что перечисленные маркеры имеют крайне противоречивую значимость для определения прогноза выживаемости одного или обоих плодов. Дальнейшее изучение ультразвуковых и фетоскопических предикторов неблагоприятного исхода лазерной коагуляции плацентарных анастомозов позволит более взвешенно подходить к выбору оперативной тактики и персонифицированному консультированию пациенток.
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ "Уральский научно-исследовательский институт охраны материнства и младенчества" Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
Монохориальное многоплодие представляет собой одну из самых неоднозначных клинических ситуаций в акушерстве и фетальной хирургии. Применение вспомогательных репродуктивных технологий (ВРТ), в особенности интрацитоплазматической инъекции сперматозоида (ИКСИ) и отсроченного переноса эмбриона, увеличивает риск развития монохориальной плацентации и соответственно осложнений монохориального многоплодия в 3—4 раза [1].
При монохориальном многоплодии наблюдаются более высокие, чем при дихориальном многоплодии или одноплодной беременности, перинатальная заболеваемость и смертность [2]. Чаще всего формируются такие специфические осложнения, как синдром фето-фетальной трансфузии (СФФТ), селективная задержка роста одного из плодов (СЗРП), синдром обратной артериальной перфузии или внутриутробная гибель одного плода из двойни [3]. Фетоскопическая лазерная коагуляция плацентарных анастомозов (ЛКПА) зарекомендовала себя как лучшая методика для коррекции СФФТ с наименьшими перинатальными потерями и послеоперационными осложнениями для матери и плода [4, 5].
В настоящем обзоре литературы будет уделено внимание исходам коагуляции плацентарных анастомозов, ультразвуковым и фетоскопическим предикторам неблагоприятных исходов после данного вида хирургической коррекции СФФТ.
Впервые фетоскопическая лазерная коагуляция как метод непосредственного воздействия на причину развития СФФТ была предложена J. De Lia и соавт. [6] в 1990 г.
Операция выполняется с помощью фетоскопов диаметром 3,3 мм и менее, которые используются для прямой визуализации сосудов на поверхности плаценты. После выявления коммуникативных анастомозов выполняется их коагуляция с использованием лазерной энергии, которая проводится в амниотическую полость с помощью кварцевого волокна через операционный канал фетоскопа. Изначально коагулировали все сосуды (неселективная лазерная коагуляция), пересекающие амниотическую мембрану [7, 8]. Впоследствии R. Quintero и соавт. [9, 10] разработали методику селективной лазерной коагуляции. Подобная методика позволила предотвратить коагуляцию сосудов, ветви которых не имеют анастомозов с системой циркуляции второго плода, и сократить число выключенных из фетоплацентарной циркуляции котиледонов, что обеспечило увеличение выживаемости плодов до 62—77% [11—16].
Позже была представлена «методика Соломона», суть которой заключалась в непрерывной коагуляции поверхности плаценты на отрезках, соединяющих соседние коагуляционные зоны, образовавшиеся после первого этапа, от одного до другого края плаценты. Такая техника операции позволяет коагулировать мелкие анастомозы и осуществить полную «дихорионизацию» плаценты и тем самым значительно снизить вероятность рецидива СФФТ и улучшить исходы беременности [17].
В последние годы научная группа [18] предложила третью модификацию фетоскопической лазерной коагуляции. Эта техника предполагает пересечение артериовенозных анастомозов от донора к реципиенту в первую очередь, затем артериовенозных анастомозов от реципиента к донору с последующей коагуляцией оставшихся артериоартериальных и веновенозных анастомозов (последовательная селективная лазерная коагуляция анастомозов). Выполнение лазерной аблации в такой последовательности позволяет предотвратить сброс крови донора в систему гемоциркуляции реципиента во время операции. Последовательная селективная лазерная коагуляция анастомозов характеризуется повышением выживаемости обоих плодов по сравнению с селективной лазерной коагуляцией (74 и 57%; p=0,005). Выживаемость хотя бы одного плода из двойни также соответственно выше (91 и 88%; p=0,005).
В каждом отдельном исследовании, проведенном отечественными и зарубежными авторами, приведены результаты выживаемости одного или обоих плодов. В источниках литературы приведены статистические данные по выживаемости донора и реципиента при использовании той или иной модификации ЛКПА. Но крайне скудно освещен вопрос причин таких исходов, что является довольно ценной информацией для выбора метода хирургического лечения СФФТ.
С января 1995 г. по сентябрь 1999 г. K. Hecher и соавт. [19] провели исследование 200 беременных с СФФТ между 16-й и 25-й неделями беременности. Показатель выживаемости по крайней мере одного плода составила 81%. По мнению авторов статьи, основная причина благоприятного исхода оперативного лечения напрямую связана с растущим опытом хирургов при использовании данной технологии, а именно с более избирательной идентификацией и эффективностью коагуляции плацентарных анастомозов.
M. Barbosa и соавт. [20] в свою очередь проанализировали 24 монохориальные диамниотические беременности с диагнозом СФФТ на 18—26-й неделе беременности, где была проведена неселективная ЛКПА. Выживаемость обоих плодов составила 45,8%, одного — 87,5%. В результате отмечена прямая взаимосвязь между результатом хирургической коррекции синдрома и его стадией по R. Quintero [20]: чем ниже стадия синдрома — тем лучше прогноз. По данным этих же авторов, расположение плаценты (по передней или задней стенке) на исход операции не влияло.
В период с 2002 по 2008 г. группой ученых под руководством R. Cincotta [21] проанализированы наблюдения использования селективной ЛКПА при II—IV стадиях по R. Quintero. Были получены данные, что общая выживаемость при IV стадии синдрома значительно выше, чем при СФФТ III стадии, что противоречило выводам других исследователей [22].
В это же время были получены данные о закономерности в последовательности коагуляции артериовенозных плацентарных анастомозов от донора к реципиенту в группе SQLPCV (Sequential Selective Laser Photocoagulation of Communicating Vessels, последовательная селективная лазерная фотокоагуляция сообщающихся сосудов) и от реципиента к донору в группе SLPCV (Selective Laser Photocoagulation of Communicating Vessels, селективная лазерная коагуляция сообщающихся сосудов). Выживаемость обоих плодов была значительно выше в 1-й группе (SQLPCV), чем в группе SLPCV (73,7 и 57,1% соответственно), но выживаемость одного плода не различалась в той и другой группе (90,5% против 87,5%). Процент гибели плода-донора (IUFD-D: intrauterine fetal death, внутриутробная смерть плода) был значительно ниже при SQLPCV, чем при SLPCV (7,3 и 21,4% соответственно). Группа SQLPCV ассоциируется с меньшей вероятностью внутриутробной гибели плода и увеличением числа выживших плодов по сравнению с таковыми в группе SLPCV. Расположение плаценты, продолжительность операции и количество анастомозов, по данным авторов исследования [23], не повлияли на исход лазерной коагуляции плацентарных анастомозов.
В 2010 г. N. Meriki и соавт. [24] в ходе наблюдений выявили отсутствие корреляции между исходами ЛКПА и расположением плаценты. Выживаемость одного плода в их исследовании составила 90,7% (88,9% для передней и 92,1% для задней плаценты), а обоих плодов — 60%.
В 2015 г. S. Snowise и соавт. [25] провели проспективное когортное исследование с участием 166 пациенток, которым была проведена селективная ЛКПА, в результате которого получили следующие данные: послеоперационная смертность доноров составила 13%, а реципиентов — 2,6%. Авторами выделены основные причины, влияющие на неблагоприятный исход для плода донора: задержка развития 30% и более, отсутствие конечного диастолического кровотока в артериях пуповины, аномалия прикрепления пуповины к плаценте (краевое, оболочечное), большое количество плацентарных анастомозов. Знание этих факторов риска, по мнению авторов статьи, в дальнейшем должно помочь в выборе наиболее подходящего метода лечения при СФФТ [25].
Одновременно с предыдущим исследованием в 2015 г. S. Müllers и соавт. [26] проведен анализ 105 наблюдений ЛКПА при СФФТ. Выживаемость одного и двух плодов установлена в 75 и 47% наблюдений соответственно. Не обнаружено корреляции исхода оперативного лечения и гестационного возраста при постановке диагноза, исхода и расположения плаценты, ультразвуковых маркеров СФФТ, хотя отмечено, что выживаемость обоих плодов значительно снижается с увеличением стадии СФФТ по R. Quintero [26—28].
Модификация селективной ЛКПА, называемая «методикой Соломона», по данным многих исследователей, значительно улучшила перинатальные исходы, а также снизила частоту рецидивов СФФТ [29—31]. H. Sago и соавт. [32] в 2018 г. опубликовали показатели выживаемости при использовании данной методики: выживаемость обоих близнецов — 70% и одного близнеца — 90,6%. Единственным определяющим фактором успеха ЛКПА по «методике Соломона», по мнению авторов, является проведение манипуляции в сроках беременности 16—26 нед.
J. Stirnemann (цит. по [33]) отмечает улучшение перинатальных исходов ЛКПА за период с 2000 по 2016 г. Выживаемость обоих близнецов выросла с 42 до 66%, а одного плода с 44 до 58%. Кроме того, неблагоприятным условием для прогноза выживаемости автор исследования считает гестационный возраст менее 17 нед беременности. С противоположным мнением выступает группа ученых L. Lecointre и соавт. [34], D. Baud и соавт. [35], D. Valsky и соавт. [36], которые не отмечают значительной разницы в выживаемости одного либо двух плодов при проведении ЛКПА в сроках менее 17 нед и более 26 нед беременности.
По итогам анализа применения «методики Соломона» исследователями S. Murata и соавт. [37], выживаемость обоих плодов составила 74% и одного плода — 94%. Авторы отмечают, что аномальные кривые скорости кровотока в артериях пуповины в предоперационном периоде связаны с высоким риском летального исхода для плода-донора после применения ЛКПА [38].
Y. Chang и соавт. [39] в период с 2005 по 2014 г. выявили, что более высокая стадия СФФТ по R. Quintero обусловливает меньший процент выживаемоcти плодов, аналогичные статистические данные были получены X. Liu и соавт. [40] в 2012 г.
Немаловажным фактором для благоприятного исхода после ЛКПА является расстояние между пуповинами. Данное исследование было проведено D. Zhao и соавт. [41] с 2002 по 2013 г. Клинически значимым расстоянием между местами прикрепления пуповин считается 5 см и менее. Это связано в первую очередь с ухудшением визуализации сосудистого экватора и затруднением коагуляции плацентарных анастомозов.
M. Finneran и соавт. [42] отмечают немаловажную роль степени диссоциации роста плодов. Наиболее частый летальный исход для плода-донора в исследовании отмечался при сочетании таких факторов, как диссоциированный рост плодов и аномальные показатели кровотока в артерии пуповины у плода-донора, выявленные в предоперационном периоде.
После проведения анализа 86 беременностей, осложнившихся СФФТ, E. Gil Guevara и соавт. [43] выяснили, что основными причинами неблагоприятного исхода для плода-реципиента были аномальные кривые скоростей кровотока в венозном протоке и диссоциированное развитие плодов. Кроме того, на исход влияло наличие признаков истмико-цервикальной недостаточности.
Проведение процедуры под местной анестезией по сравнению с общей не дало весомых различий в исходах. Явлений дискомфорта у беременной, а также неудовлетворительной визуализации плацентарных анастомозов при применении местного обезболивания отмечено не было [44—46]. Использование миллиметровой оптики, а также уменьшение диаметра троакара с 3,8 до 2,3 мм привело к значительному улучшению исходов для новорожденных и снижению числа рецидивов СФФТ. Выживаемость одного близнеца составила 98%, обоих близнецов — 83,3% [47, 48].
J. Akkermans и соавт. [49] выявили, что мощность лазерного излучения (50 W) и величина апертурного угла оптики (90°) играют несомненную роль при проведении ЛКПА, улучшая визуализацию плацентарных анастомозов и тем самым снижая риск развития такого осложнения, как кровотечение, а также сокращают время проведения оперативного лечения.
Немаловажную роль играет оценка остаточных анастомозов с использованием современных неинвазивных технологий, таких как компьютерная томография с созданием трехмерной виртуальной плацентоскопии постнатально [50].

В таблице Факторы, влияющие на выживаемость плодов при лазерной коагуляции плацентарных анастомозов авторами статьи суммарно приведены факторы, влияющие на выживаемость плодов при лазерной коагуляции плацентарных анастомозов.
С развитием пренатальной диагностики и медицинской техники доступ к фетоплацентарной системе с помощью минимально инвазивных манипуляций позволяет оказывать помощь еще неродившемуся пациенту. Анализируя данные как зарубежных авторов, так и отечественных коллег, можно сделать вывод, что большинство наблюдаемых детей из монохориальных двоен, подвергнутых оперативному лечению, в результате которого остались в живых оба плода, родились недоношенными. Средний гестационный возраст у этих детей составил 33,5±2,7 нед [51]. Было отмечено, что лучшие перинатальные исходы были в группах, в которых остался в живых один плод. Гестационный возраст детей этой группы при рождении составил 38,4±0,7 нед. Новорожденные имели более высокие антропометрические показатели физического развития, что является немаловажным фактором для дальнейшего течения раннего и позднего неонатального периодов [51].
Заключение
Несмотря на колоссальный опыт, накопленный с момента внедрения малоинвазивных хирургических способов коррекции СФФТ, решение вопроса о применении альтернативных методик в каждом конкретном случае может сопровождаться определенными трудностями [52]. Мы полагаем, что дальнейшее изучение ультразвуковых и фетоскопических факторов прогноза благоприятного исхода лазерной коагуляция плацентарных анастомозов позволит более взвешенно подходить к выбору оперативной тактики и персонифицированному консультированию пациенток.
Осложненная многоплодная беременность и фето-фетальный синдром
Ожидание рождения близнецов всегда большая радость в семье, но иногда это счастье омрачается осложнениями, возникающими во время беременности. Многоплодная беременность ассоциируется с высоким риском развития осложнений, как со стороны матери, так и со стороны плодов. В связи с этим многоплодную беременность и роды относят к состоянию пограничному между нормой и патологией.
Многоплодные беременности различают по типу плацентации и по количеству амниотических полостей. При беременности дихориальной диамниотической двойней у каждого ребенка есть своя плацента и своя отдельная амниотическая полость, в результате такой беременности рождаются разнополые дети или дети не похожие друг на друга. При монохориальной диамниотической двойне близнецы находятся в отдельных амниотических полостях, но делят одну плаценту на двоих, в результате такой беременности рождаются однополые дети похожие друг на друга как две капли воды.
Осложнения монохориальной многоплодной беременности
Монохориальная многоплодная беременность часто сопровождаются серьезными осложнениями, встречающимися только при данном типе плацентации. Уникальная ангио-архитектоника монохориальной плаценты прямо или косвенно связана с большинством осложнений. При монохориальной многоплодной беременности возможно развитие специфических, не характерных для дихориальной беременности, осложнений: селективная задержка роста одного плода из двойни, фето-фетальный трансфузионный синдром, синдром анемии-полицитемии, синдром обратной артериальной перфузии.
Фето-фетальный трансфузионный синдром (ФФТС)
Самым грозным осложнением монохориальной двойни является фето-фетальный трансфузионный синдром (ФФТС). Наличие патологических артерио-венозных анастомозов в плаценте между близнецами приводит к неравномерному распределению кровотока, со сбросом крови от одного плода к другому. Один близнец “обкрадывает” другого. В случае отсутствия лечения беременность может прерваться или близнецы погибнут внутриутробно в 73-100% случаев.
Диагностика фето-фетального трансфузионного синдрома
ФФТС диагностируется с 16 недель при проведении ультразвукового исследования. Диагноз основывается на наличии многоводия одного плода и маловодия другого, состояния мочевых пузырей плодов. Ранняя диагностика ФФТС является крайне важной задачей. Для обеспечения благоприятного исхода беременности необходимы своевременная диагностика и выбор правильной тактики ведения. Ультразвуковое исследование монохориальной двойни должно проводиться каждые две недели, начиная с 16 недель беременности и продолжаться до 27 недель, так как ФФТС обычно развивается между 16 и 27 неделями гестации.
Лечение фето-фетального трансфузионного синдрома
Единственным патогенетическим методом лечения ФФТС, позволяющим максимально пролонгировать беременность и родить здоровых детей, является лазерная коагуляция сосудистых анастомозов плаценты. В нашем Центре проводится фетоскопическая селективная лазерная коагуляция анастомозов плаценты с 16 до 27 недель беременности.
Фетоскопическая селективная лазерная коагуляция
Фетоскопическая лазерная процедура выполняется трансабдоминально под внутривенной, местной или региональной анестезией. Троакар диаметром 2,3-3,3мм под эхографическим контролем вводят в амниотическую полость плода-реципиента, одновременно вводят 2 мм эндоскоп с проводником лазерной энергии (400-600 μm). Коагуляцию осуществляют бесконтактно, процедуру завершают амниоредукцией до достижения нормального количества околоплодных вод. Выживание одного или двух близнецов после проведенного лечения составляет 70%.
Важным является последующий ультразвуковой и допплерометрический контроль за состоянием плодов, наблюдение за течением беременности, выбор оптимального времени родоразрешения. Вы можете получить квалифицированную медицинскую помощь в нашем стационаре – 2-м отделении акушерском патологии беременности, под руководством д.м.н. Н. К. Тетруашвили, где будущие мамы проходят необходимое лечение и готовятся к родоразрешению.
Возможности неонатальной службы позволяют сделать все возможное для выхаживания недоношенных новорожденных при осложненной монохориальной беременности.
В Научном Центре акушерства, гинекологии и перинатологии им. В.И. Кулакова Вы можете получить экспертную консультацию акушеров-гинекологов, фетальных хирургов, хирургов неонатологов, провести экспертное эхографическое обследование плода, МРТ плода.
Наша команда состоит из врачей акушеров – гинекологов, фетальных хирургов, специалистов ультразвуковой диагностики, хирургов неонатологов, генетиков, трансфузиологов, неонатологов.
Фетальные операции в рамках государственных программ
Стационарное лечение, фетальные операции субсидируются государством в рамках программы Высокотехнологичной медицинской помощи (ВМП) и бесплатны для пациентов.
Пациентам проводится полное эхографическое обследование плода, эхокардиография плода, при необходимости МРТ плода, для полной оценки состояния ребенка. Мультидисциплинарная команда специалистов совместно с будущими родителям, обсуждают план лечения, возможные результаты и риски осложнений.
В Научном Центре акушерства, гинекологии и перинатологии им. В.И. Кулакова проводится
- Экспертная ультразвуковая оценка состояния плода
- МРТ плода
- Фетоскопические операции при осложненной монохориальной двойне
- Фетоскопические операции при синдроме амниотических тяжей
- Пункционная хирургия плода под контролем эхографии (амниоредукция, редукция эмбрионов при многоплодной беременности)
- Кордоцентез, внутриутробное переливание эритроцитарной массы плоду при диагностированной анемии плода.
- Наблюдение, амбулаторное, стационарное лечение и родоразрешение женщин, перенесших фетальные хирургические вмешательства, выхаживание новорожденных.
В ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России Вы получаете уникальную возможность получить БЕСПЛАТНО оперативное стационарное лечение по квотам на высоко-технологическую медицинскую помощь (ВМП по ОМС).
Синдром фето-фетальной трансфузии. Фетоскопическая лазерная коагуляция анастомозов
Цель исследования. Оценка эффективности фетоскопических вмешательств у пациенток с монохориальным типом плацентации при многоплодной беременности, осложнившейся развитием синдрома фето-фетальной трансфузии (СФФТ).
Материал и методы. Выполнена 61 фетоскопическая лазерная коагуляция анастомозов по поводу СФФТ. Возраст пациенток колебался от 18 до 39 лет. Фетоскопия выполнялась при стадии заболевания не менее II и не более IV по Quintero.
Результаты. 41 беременность закончилась рождением хотя бы одного живого ребенка. Из тяжелых осложнений отмечено 3 преждевременных отслойки нормально расположенной плаценты.
Заключение. Своевременное и успешное применение фетоскопии дает значительные шансы на успешное завершение беременности. Расположение плаценты по передней стенке матки усложняет ход вмешательства.
Ключевые слова
За последние десятилетия во всем мире отмечается неуклонный рост числа многоплодных беременностей [1–3], что может быть связано с бурным развитием вспомогательных репродуктивных технологий (ВРТ). Течение и исход многоплодной беременности были и остаются в целом менее благоприятными, чем одноплодной. Дополнительным фактором, ухудшающим прогноз при многоплодии, является монохориальный тип плацентации [1–6]. Помимо осложнений, характерных для многоплодия как такового, при монохориальном типе плацентации имеется риск возникновения такого специфического осложнения, как синдром фето-фетальной трансфузии (СФФТ). По данным разных авторов [2–4, 7–10], СФФТ различной степени тяжести осложняет от 5 до 25% беременностей с монохориальным типом плацентации, и, как правило, при развитии этого осложнения беременность заканчивается неблагоприятно, если не предпринимать никаких лечебных мероприятий.
Механизм развития СФФТ достаточно хорошо изучен [2, 7–10]. СФФТ возникает при трансфузии крови через плацентарные сосудистые анастомозы между кровеносными системами двух плодов, вызывая анемию и гипоксию у «донора», а у плода – «реципиента» – полицитемию с перегрузкой кровообращения [6–12]. Реципиент компенсирует увеличенный объем крови полиурией [7, 8, 10, 13], но белок и клеточные компоненты остаются в кровотоке, в результате увеличенное коллоидное осмотическое давление способствует переходу воды к нему из материнского русла. Образуется порочный круг: гиперволемия, полиурия, гиперосмоляльность, которые приводят к развитию сердечной недостаточности и многоводию у реципиента [7, 8, 10, 12, 13]. При развитии СФФТ во II триместре беременности существует высокий риск перинатальной гибели или повреждения головного мозга вследствие комбинации таких факторов, как внутриутробная гипоксия плода и преждевременные роды. Более того, внутриутробная гибель одного из плодов (обычно донора) влечет за собой последующую гибель или гипоксически-ишемические осложнения у второго плода [10, 14, 15].
Появление в арсенале акушеров-гинекологов эндоскопов малого диаметра дало возможность проводить радикальное устранение этиологического фактора развития СФФТ – «разделение» кровеносных систем плодов путем фетоскопической лазерной коагуляции сосудистых анастомозов (ФЛКА).
Целью данного исследования была оценка эффективности фетоскопических вмешательств у пациенток с монохориальным типом плацентации при многоплодной беременности, осложнившейся развитием СФФТ.
Материал и методы исследования
На базе Центра планирования семьи и репродукции Департамента здравоохранения Москвы нами за период с 2005 года по настоящее время выполнена 61 ФЛКА по поводу СФФТ.
Возраст пациенток колебался от 18 до 39 лет, первые роды предстояли 22 пациенткам, одни роды имели в анамнезе 26 пациенток, двое – 13. Из сопутствующей соматической патологии отмечались: хронический пиелонефрит (10), хронический цистит (5), анемия (2), нефроптоз (2), миопия средней степени (3), хронический тонзиллит (2). У 7 пациенток беременность наступила в результате ВРТ (ЭКО – 5, стимуляция овуляции – 2). Рубец на матке после кесарева сечения имели 6 пациенток, после миомэктомии – 2. Перенесли лапароскопическое вмешательство по поводу бесплодия 2 пациентки.
Всем пациенткам проводилось ультразвуковое исследование (УЗИ) на аппарате экспертного класса «Siemens Antares» с обязательным включением, помимо фетометрии, допплерометрии кровотока в системе «мать-плацента-плод».
Для выполнения фетоскопии использовали комплект оборудования и инструментов фирмы «Kарл Шторц», АИГ-лазер «Дорнье». Следует особо отметить, что на первых этапах исследования мы не применяли для доступа в амниотическую полость троакары, а осуществляли проникновение через все слои непосредственно тубусом для фетоскопа со вставленным в него стилетом. Начиная с 2010 года доступ обеспечивали через отдельный троакар 3,9 и 4,7 мм. Диаметр троакара зависел от расположения плаценты: 4,7 мм использовался при локализации плаценты по передней стенке матки. Для коагуляции анастомозов использовали хирургический полупроводниковый АИГ-лазер «Dornier Medilas fibertom 5100» 1 mWt, устанавливали мощность 45–47 Ватт в режиме «лапароскопия+аблация». Перед началом непосредственно коагуляции в обязательном порядке определяли межплодовую перегородку и тщательно отслеживали все сосуды, пересекающие ее. Ход сосудов по возможности просматривали до зоны анастомозов, обращали внимание не только на количество анастомозов, но и на их направление (артерио-артериальные, вено-венозные, артерио-венозные) и диаметр сосудов.
Хирургическую коррекцию СФФТ осуществляли под регионарной (эпидуральной или спинальной) анестезией в условиях эндоскопической операционной при ультразвуковом мониторинге.
Стадию развития СФФТ устанавливали по данным УЗИ по классификации Quintero [16, 17] (табл. 1).
ФЛКА выполнялась при стадии заболевания не менее II и не более IV.
На догоспитальном этапе проводилось стандартное клинико-лабораторное обследование, включавшее в обязательном порядке исследование состояния гемостаза пациентки.
Госпитализация пациенток осуществлялась за 1–2 суток до оперативного вмешательства с целью возможного дообследования и начала превентивной токолитической терапии.
Все обследованные пациентки (61) были разделены на 2 клинические группы в зависимости от техники вхождения в амниотическую полость. Первую группу составили 22 пациентки, у которых троакар не применялся. Во вторую группу вошли 39 пациенток, у которых для проведения фетоскопа в полость матки использовался отдельный троакар диаметром 3,9 или 4,7 мм.
В послеоперационном периоде продолжалась токолитическая терапия, а также назначался профилактический курс антибактериальной терапии и низкомолекулярный гепарин (фраксипарин), дозировка которого затем корректировалась в соответствии с данными гемостазиограммы. Контрольное УЗИ проводилось на 1-е и 7-е сутки после оперативного лечения, далее с интервалом в 2 недели.
Эффективность ФЛКА оценивалась по двум критериям: течение и исход непосредственно операции и раннего послеоперационного периода и исход беременности. Благоприятным исходом беременности считали рождение хотя бы одного живого ребенка [18–20].
Статистический анализ полученных данных проводился с использованием пакетов приложений Microsoft Office XP для статистической обработки материала – Microsoft Excel (версия 7.0) и программы статистической обработки материала Statistica (версия 6.0) с учетом вычислительных методов, рекомендованных для биологии и медицины. Использовались методы непараметрической статистики – точный критерий Фишера. Различия считались статистически значимыми при р
Результаты исследования и их обсуждение
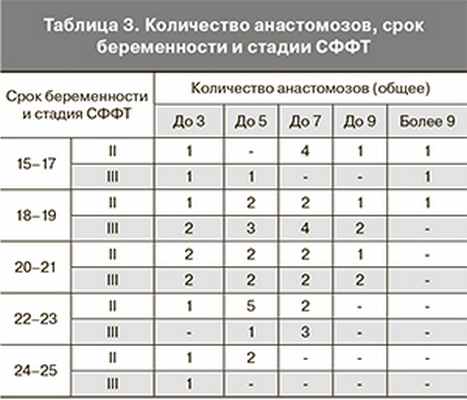
Признаки, указывающие на развитие СФФТ, по данным литературы, выявляются при УЗИ не ранее 15 недель гестации [2, 4, 7–9, 21, 22]. Сроки беременности, при которых выполнялась операция в нашем исследовании, представлены на рис. 1.
В мировой литературе дискутируется вопрос о необходимости фетоскопического вмешательства у беременных с СФФТ I стадии [16, 21, 25, 26]. Однако при такой ситуации мы придерживались выжидательной тактики, с тщательным наблюдением за состоянием плодов. ФЛКА выполнялись нами только при II и более стадии СФФТ. С другой стороны, примерно половина (44%) пациенток была прооперирована уже при III стадии СФФТ, когда уже имелись выраженные гемодинамические нарушения – обычно нулевой или отрицательный диастолический кровоток в артерии пуповины плода-донора. В одном из наблюдений была отмечена IV стадия СФФТ, когда гемодинамические нарушения привели к формированию гидроперикарда у плода-реципиента. Данные о стадиях СФФТ и сроках беременности на момент вмешательства представлены в табл. 2.
Как видно из представленных в таблице данных, у половины пациенток, прооперированных при III стадии СФФТ, срок беременности не превышал 19 недель, что может свидетельствовать, с одной стороны, о тяжести течения синдрома, а с другой стороны, о запоздалой диагностике данного патологического состояния на догоспитальном этапе.
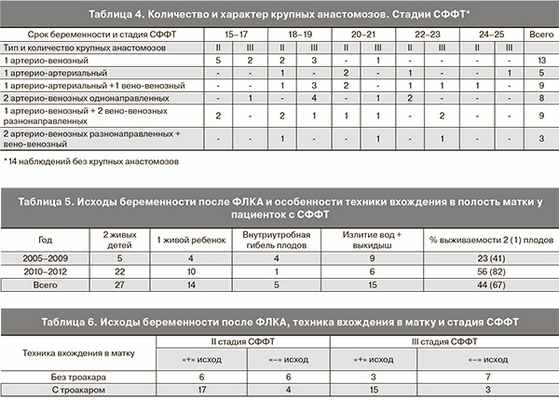
При детальном анализе протоколов операций была выявлена корреляция тяжести течения заболевания (срок манифестации и стадия СФФТ) с количеством, и самое главное, характером анастомозов, что в свою очередь определялось расстоянием между пуповинами плодов. Полученные данные совпадают сприведенными в 2004 г. Т.В. Марковой [10]. При расположении пуповин на расстоянии менее 3 см мы наблюдали наличие не менее 7 анастомозов, причем как минимум один из них был большого диаметра (сопоставимого с ½ диаметра пуповинных сосудов). Данные о количестве и характере анастомозов представлены в табл. 3 и 4.
Как видно из представленных в табл. 3 и 4 данных, просматривается корреляция тяжести течения СФФТ с количеством и характером анастомозов. Наиболее значимыми были асимметричные (однонаправленные) артерио-венозные и артерио-артериальные анастомозы большого диаметра, что совпадает с данными литературы [4, 7, 10, 13, 27]. Обращает внимание нечетное количество анастомозов во всех наблюдениях, что заставляет предположить важную роль этого параметра как «пускового механизма» в развитии СФФТ. Именно нечетное число, возможно, обусловливает «асимметричность» обмена кровью между плодами, тогда как «парные» анастомозы взаимно компенсируют друг друга.
Первым признаком эффективности вмешательства мы считали «появление» эхо-тени мочевого пузыря у донора на следующие сутки при УЗИ. Этот критерий был положительным у всех пациенток, родивших 2 живых детей. В дальнейшем, с увеличением прошедшего после операции времени, отмечалось исчезновение маловодия у донора, нормализация пуповинного кровотока и уменьшение диссоциации плодов по массе.
Исходы беременности после ФЛКА (61): в 27 случаях родилось 2 живых ребенка, в 14 – 1 живой ребенок; самопроизвольные выкидыши в сроки 18–22 недели имели место в 6 случаях, преждевременные роды до 28 недель – в 14 (живых детей нет).
На втором этапе работы мы провели оценку течения беременности и перинатальных исходов после ФЛКА с использованием и без использования троакара. Данные представлены в табл. 5.
Как видно из представленных в табл. 5 данных, изменение технологии вхождения в полость матки при ФЛКА привело к улучшению перинатальных исходов (p=0,04; точный критерий Фишера).
Важный результат получен при анализе исходов ФЛКА по двум критериям: в зависимости от техники вхождения в матку и стадии СФФТ на момент вмешательства (табл. 6).
Как видно из данных, представленных в табл. 6, при использовании для вхождения в амниотическую полость тубуса фетоскопа со стилетом большее количество благоприятных исходов приходилось на II стадию СФФТ. Неблагоприятные исходы практически одинаково распределены между II и III стадиями. При использовании троакара положительный результат наблюдался в два раза чаще и практически не зависел от стадии СФФТ. Неблагоприятные исходы, так же, как и в первой группе, равномерно распределены между II и III стадиями. Следовательно, при использовании троакара не только улучшается прогноз, но и нивелируется разница между эффективностью ФЛКА при различных стадиях СФФТ.
Также нами были изучены исходы беременности в зависимости от техники вхождения в полость матки и сроков гестации, в которые проводилась ФЛКА (рис. 2).
Как видно из рис. 2, частота благоприятных исходов беременности при выполнении ФЛКА с использованием троакара статистически значимо возросла (p<0,05).
Оценивая результаты проведенных исследований в целом, следует отметить более низкий по сравнению с данными литературы [18–20, 23] общий процент (67%) благоприятных исходов, что, по-видимому, можно объяснить, помимо отсутствия достаточного опыта на первых этапах исследования, большой долей III стадии СФФТ вследствие запоздалого выявления данной патологии на догоспитальном этапе. Возможно, также это связано и с недочетами в дальнейшем ведении беременности, приведшими к выкидышу вследствие истмико-цервикальной недостаточности (4) и антенатальной гибели одного из плодов в сроке 29–30 недель гестации (2).
О значимости приобретения опыта при ФЛКА говорит тот факт, что средняя продолжительность вмешательства составляла в 2005–2009 годах 73 мин, а в 2010–2012 годах сократилась до 41 мин. Помимо опыта хирурга, на продолжительность операции влияет расположение плаценты. При локализации плаценты по передней стенке матки длительность вмешательства была достоверно выше (р<0,01).
Из тяжелых осложнений ФЛКА необходимо отметить: частичную отслойку нормально расположенной плаценты – 3, причем, только одна из них в течение первых 2 часов после операции, у двух других пациенток отслойка произошла после излития околоплодных вод через 10 и 4 недели после операции. Во всех этих наблюдениях в связи с начавшимся кровотечением беременность завершилась операцией кесарева сечения в экстренном порядке в сроки беременности 19, 22 и 31 неделя (оба плода, родившиеся в 31-ю неделю гестации, выжили). Наблюдались также: межоболочечная гематома – 1, излитие вод в брюшную полость – 2 (обе беременности завершились благополучно).
Являясь тяжелым осложнением многоплодной монохориальной беременности, СФФТ должен быть не только диагностирован на ранних этапах развития, но и своевременно и адекватно корригирован для предотвращения неблагоприятного исхода для обоих или хотя бы одного плода. При ранней (до 20 недель) манифестации и/или тяжелом течении (прогрессирование на одну стадию за одну неделю) методом лечения СФФТ должна являться ФЛКА. Своевременное и успешное ее применение дает значительные шансы на благоприятный исход беременности. Расположение плаценты по передней стенке матки создает технические трудности в ходе оперативного вмешательства и увеличивает его продолжительность, однако не влияет на исход беременности в целом.
Список литературы
Об авторах / Для корреспонденции
Читайте также:
