Синдром гиперандрогенизма. Проявления синдрома гиперандрогенизма
Добавил пользователь Morpheus Обновлено: 27.01.2026
Синдром поликистозных яичников 4 точки (гены INS, PPARy2, CYP11A, AR).
Синдром поликистозных яичников (СПКЯ, известный также как синдром Штейна-Левенталя) — полиэндокринный синдром, сопровождающийся нарушениями функции яичников (отсутствием или нерегулярностью овуляции, повышенной секрецией андрогенов и эстрогенов), поджелудочной железы (гиперсекреция инсулина), коры надпочечников (гиперсекреция надпочечниковых андрогенов), гипоталамуса и гипофиза.
- болезнь поликистозных яичников (некорректно, поскольку это состояние характеризуется не как болезнь, отдельная нозологическая форма, а как клинический синдром, причины которого могут быть различны);
- функциональная яичниковая гиперандрогения (или функциональный яичниковый гиперандрогенизм);
- гиперандрогенная хроническая ановуляция;
- яичниковый дисметаболический синдром;
- синдром поликистоза яичников;
- поликистоз яичников.
Симптомы
Признаки и симптомы СПКЯ часто появляются в период полового созревания, вскоре после первой менструации (менархе). В некоторых случаях синдром развивается позже, во время репродуктивного периода, например, под влиянием существенного увеличения веса.
- олигоменорея, аменорея — нерегулярные, редкие менструации или полное отсутствие менструаций; те менструации, которые всё же происходят, могут быть патологически скудными или, напротив, чрезмерно обильными, а также болезненными;
- бесплодие, обычно являющееся результатом хронической ановуляции или олигоовуляции (полного отсутствия овуляций либо овуляция происходит не в каждом цикле);
- повышенные уровни в крови андрогенов (мужских гормонов), в особенности свободных фракций тестостерона, андростендиона и дегидроэпиандростерона сульфата, что вызывает гирсутизм и иногда маскулинизацию;
- центральное ожирение — «паукообразное» или «в форме яблока» ожирение по мужскому типу, при котором основная масса жировой ткани концентрируется внизу живота и в брюшной полости;
- андрогенная алопеция (существенное облысение или выпадение волос по мужскому типу с залысинами по бокам лба, на макушке, происходящее из-за нарушения гормонального баланса);
- угревая сыпь, жирная кожа, себорея;
- акантоз (тёмные пигментные пятна на коже: от светло-бежевого до тёмно-коричневого или чёрного);
- акрохордоны (кожные складки) — мелкие складки и морщинки кожи;
- появление стрий (полос растяжения) на коже живота, бёдер, ягодиц в результате быстрой прибавки массы тела на фоне гормонального дисбаланса;
- длительные периоды симптомов, напоминающих симптомы предменструального синдрома (отёки, колебания настроения, боль внизу живота, в пояснице, боли или набухание молочных желёз);
- ночные апноэ — остановки дыхания во сне, приводящие к частым ночным пробуждениям больной;
- депрессия, дисфория (раздражительность, нервозность, агрессивность), нередко сонливость, вялость, апатия, жалобы на «туман в голове»;
- множественные кисты яичников. Сонографически они могут выглядеть как «жемчужное ожерелье», скопление белёсых пузырьков или «косточки фрукта», рассеянные по всей ткани яичников;
- увеличение размеров яичников в 1,5–3 раза за счёт возникновения множества мелких кист;
- утолщённая, гладкая, жемчужно-белая наружная поверхность (капсула) яичников;
- утолщённый, гиперплазированный эндометрий матки — результат длительного избытка эстрогенов, не сбалансированного адекватными прогестероновыми влияниями;
- хроническая боль внизу живота или в пояснице, в тазовой области, вероятно, вследствие сдавления органов малого таза увеличенными яичниками или вследствие гиперсекреции простагландинов в яичниках и эндометрии; точная причина хронической боли при поликистозе яичников неизвестна;
- повышенный уровень ЛГ или повышенное соотношение ЛГ/ФСГ: при измерении на 3-й день менструального цикла соотношение ЛГ/ФСГ оказывается больше 1:1;
- пониженный уровень глобулина, связывающего половые стероиды;
- гиперинсулинемия (повышенный уровень инсулина в крови), нарушение толерантности к глюкозе, признаки инсулинорезистентности тканей при тестировании по методу сахарной кривой.
- Ген инсулина (INS).
- Ген PPARy2.
- Ген CYP11A.
- Ген рецептора андрогенов (AR).
Роль генетических факторов в развитии СПКЯ
Ключевые гены, имеющие отношение к развитию клинических проявлений СПКЯ представлены двумя основными группами:
► В первую группу включены гены, контролирующие метаболические процессы обмена глюкозы и, соответственно, состояния гиперинсулинемии и инсулинорезистентности.
Ген INS, — инсулин. При гиперинсулинемии стимулируется избыточный синтез стероидных гормонов в яичниках, преимущественно андрогенов.
Ген PPAR-γ, — рецептор, активирующий пролиферацию пероксисом (РАПП), является гормональным рецептором, регулирующим дифференциацию жировых клеток. РАПП регулирует энергетический, жировой и углеводный обмен. Высокая активность РАПП предрасполагает к развитию инсулинорезистентности.
► Во вторую группу включены гены, отвечающие за синтез стероидных гормонов и индивидуальную чувствительность тканей к андрогенам.
Ген CYP11α, — фермент, отщепляющий боковую цепь, лимитирует скорость реакции образования прегненолона из холестерина в яичниках и надпочечниках. Повышение активности гена CYP11α лежит в основе увеличенной продукции андрогенов.
Ген AR, — рецептор андрогенов, связывает биологически активный андроген — дигидротестостерон. При связывании рецептора с дигидротестостероном, включается цепь биохимических реакций, связанных с эффектами тестостерона в андроген-зависимых тканях.
Основные принципы диагностики и лечения заболеваний в составе синдрома гиперандрогении
Заболевания (состояния), связанные с избыточной продукцией андрогенов в женском организме или повышением чувствительности к ним гормонозависимых органов, объединяются понятием «синдром гиперандрогении» (СГА). Варианты СГА распределяются от изолированных поражений кожи и ее производных до системных заболеваний, сопровождающихся высоким риском нарушений менструального цикла, бесплодия, метаболических расстройств, сердечно-сосудистой патологии, канцерогенеза. Ведением больных с гиперандрогенизмом занимаются гинекологи, эндокринологи, дерматологи, терапевты общей практики, но в реальной жизни взаимодействие между представителями отдельных медицинских специальностей, ксожалению, наблюдается редко. Врезультате лечение пациентов с гиперандрогенизмом грешит полипрагмазией, неправомерными назначениями и игнорированием текущих потребностей женщин. Ситуация усугубляется тем, что лекарственных средств, аннотированных для терапии внешних проявлений гиперандрогенизма, практически нет, а число препаратов, способных оказать многоплановое действие, невелико. Одной из стратегий, позволяющих уменьшить лекарственную нагрузку и решить сразу несколько задач по компенсации андрогензависимых дермопатий и сохранению здоровья у пациенток с гиперандрогенизмом, является назначение комбинированной гормональной контрацепции. Определяющими факторами выбора гормонального контрацептива для женщин с гиперандрогенизмом должны быть наличие антиандрогенного эффекта прогестина в составе лекарственного средства и безопасность длительного применения препарата.
Ключевые слова
Об авторе
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России
Россия
Кузнецова Ирина Всеволодовна, доктор медицинских наук, профессор, советник директора
Список литературы
1. Churchill SJ, Wang ET, Pisarska MD. Metabolic consequences of polycystic ovary syndrome. Minerva Ginecol. 2015; 67 (6): 545–555. PMID: 26372304.
2. Azziz R. Polycystic Ovary Syndrome. Obstet Gynecol. 2018; 132 (2): 321–336. DOI: 10.1097/AOG.0000000000002698.
3. Escobar-Morreale H. F. Polycystic ovary syndrome: treatment strategies and management. Expert Opin Pharmacother 2008; 9 (17): 2995–3008.
4. Teede HJ, Misso ML, Costello MF, Dokras A, Laven J, Moran L, et al; International PCOS Network. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril. 2018; 110 (3): 364–379. DOI: 10.1016/j.fertnstert.2018.05.004.
5. Unluhizarci K, Kaltsas G, Kelestimur F. Non polycystic ovary syndrome-related endocrine disorders associated with hirsutism. Eur J Clin Invest. 2012; 42 (1): 86–94. DOI: 10.1111/j.1365–2362.2011.02550.x.
6. Rachoń D. Differential diagnosis of hyperandrogenism in women with polycystic ovary syndrome. Exp Clin Endocrinol Diabetes. 2012; 120 (4): 205–9. DOI: 10.1055/s0031–1299765.
7. Carmina E, Dewailly D, Escobar-Morreale HF, Kelestimur F, Moran C, Oberfield S, et al. Non-classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency revisited: an update with a special focus on adolescent and adult women. Hum Reprod Update. 2017; 23 (5): 580–599. DOI: 10.1093/humupd/dmx014.
8. Lause M, Kamboj A, Fernandez Faith E. Dermatologic manifestations of endocrine disorders. Transl Pediatr. 2017 Oct; 6 (4): 300–312. DOI: 10.21037/tp.2017.09.08. PMID: 29184811; PMCID: PMC5682371.
9. Matheson E, Bain J. Hirsutism in Women. Am Fam Physician. 2019; 100 (3): 168–175. PMID: 31361105.
10. Augustin M, Herberger K, Hintzen S, Heigel H, Franzke N, Schäfer I. Prevalence of skin lesions and need for treatment in a cohort of 90880 workers. Br J Dermatol. 2011; 165 (4): 865–873. DOI: 10.1111/j.1365–2133.2011.10436.x.
11. Starace M, Orlando G, Alessandrini A, Piraccini BM. Female Androgenetic Alopecia: An Update on Diagnosis and Management. Am J Clin Dermatol. 2020; 21 (1): 69–84. DOI: 10.1007/s40257–019–00479-x.
12. Saei Ghare Naz M, Ramezani Tehrani F, Behroozi Lak T, Mohammadzadeh F, Nasiri M, Kholosi Badr F, Ozgoli G. Quality of Life and Emotional States of Depression, Anxiety and Stress in Adolescents with Polycystic Ovary Syndrome: A Cross-Sectional Study. Psychol Res Behav Manag. 2020; 13: 203–209. DOI: 10.2147/PRBM.S241192.
13. Greenwood EA, Pasch LA, Cedars MI, Legro RS, Huddleston HG; Eunice Kennedy Shriver National Institute of Child Health and Human Development Reproductive Medicine Network. Association among depression, symptom experience, and quality of life in polycystic ovary syndrome. Am J Obstet Gynecol. 2018; 219 (3): 279. e1–279.e7. DOI: 10.1016/j.ajog.2018.06.017.
14. Naumova I, Castelo-Branco C, Kasterina I, Casals G. Quality of Life in Infertile Women with Polycystic Ovary Syndrome: a Comparative Study. Reprod Sci. 2021; 28 (7): 1901.-1909. DOI: 10.1007/s43032–020–00394–1.
15. Cooney LG, Lee I, Sammel MD, Dokras A. High prevalence of moderate and severe depressive and anxiety symptoms in polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod. 2017; 32 (5): 1075–1091. DOI: 10.1093/humrep/dex044.
16. Bozdag G, Mumusoglu S, Zengin D, Karabulut E, Yildiz BO. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod. 2016; 31 (12): 2841–2855. DOI: 10.1093/humrep/dew218.
17. Hillebrand JJ, Wickenhagen WV, Heijboer AC. Improving Science by Overcoming Laboratory Pitfalls with Hormone Measurements. J Clin Endocrinol Metab. 2021; 106 (4): e1504–e1512. DOI: 10.1210/clinem/dgaa923.
18. Mimoto MS, Oyler JL, Davis AM. Evaluation. and Treatment of Hirsutism in Premenopausal Women. JAMA. 2018; 319 (15): 1613–1614. DOI: 10.1001/jama.2018.2611.
19. Al Kindi MK, Al Essry FS, Al Essry FS, Mula-Abed WA. Validity of serum testosterone, free androgen index, and calculated free testosterone in women with suspected hyperandrogenism. Oman Med J. 2012; 27 (6): 471–474. DOI: 10.5001/omj.2012.112.
20. Bienenfeld A, Azarchi S, Lo Sicco K, Marchbein S, Shapiro J, Nagler AR. Androgens in women: Androgen-mediated skin disease and patient evaluation. J Am Acad Dermatol. 2019; 80 (6): 1497–1506. DOI: 10.1016/j.jaad.2018.08.062.
21. Lizneva D, Gavrilova-Jordan L, Walker W, Azziz R. Androgen excess: Investigations and management. Best Pract Res Clin Obstet Gynaecol. 2016; 37: 98–118. DOI: 10.1016/j.bpobgyn.2016.05.003.
22. Panico A, Messina G, Lupoli GA, Lupoli R, Cacciapuoti M, Moscatelli F, et al. Quality of life in overweight (obese) and normal-weight women with polycystic ovary syndrome. Patient Prefer Adherence. 2017; 11: 423–429. DOI: 10.2147/PPA.S119180.
23. Iamsumang W, Leerunyakul K, Suchonwanit P. Finasteride and Its Potential for the Treatment of Female Pattern Hair Loss: Evidence to Date. Drug Des Devel Ther. 2020; 14: 951–959. DOI: 10.2147/DDDT.S240615.
24. Boztosun A, Açmaz G, Ozturk A, Müderris II. Clinical efficacy of low dose flutamide plus Diane 35 in the treatment of idiopathic hirsutism and polycystic ovary syndrome. Ginekol Pol. 2013; 84 (4): 258–262. DOI: 10.17772/gp/1573.
25. Gao X, Xie C, Wang Y, Luo Y, Yagai T, Sun D, et al. The antiandrogen flutamide is a novel aryl hydrocarbon receptor ligand that disrupts bile acid homeostasis in mice through induction of Abcc4. Biochem Pharmacol. 2016; 119: 93–104. DOI: 10.1016/j.bcp.2016.08.021.
26. Brahm J, Brahm M, Segovia R, Latorre R, Zapata R, Poniachik J, et al. Acute and fulminant hepatitis induced by flutamide: case series report and review of the literature. Ann Hepatol. 2011; 10 (1): 93–98.
27. Generali JA, Cada DJ. Flutamide: hirsutism in women. Hosp Pharm. 2014; 49 (6): 517–520. DOI: 10.1310/hpj4906–517.
28. Fraison E, Kostova E, Moran LJ, Bilal S, Ee CC, Venetis C, Costello MF. Metformin versus the combined oral contraceptive pill for hirsutism, acne, and menstrual pattern in polycystic ovary syndrome. Cochrane Database Syst Rev. 2020; 8 (8): CD005552. DOI: 10.1002/14651858.CD005552.pub3.
29. Morley LC, Tang T, Yasmin E, Norman RJ, Balen AH. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev. 2017; 11 (11): CD003053. DOI: 10.1002/14651858.CD003053.pub6.
30. Ibáñez L, Diaz M, Sebastiani G, Sánchez-Infantes D, Salvador C, Lopez-Bermejo A, de Zegher F. Treatment of androgen excess in adolescent girls: ethinylestradiol-cyproteroneacetate versus low-dose pioglitazone-flutamide-metformin. J Clin Endocrinol Metab. 2011; 96 (11): 3361–3366. DOI: 10.1210/jc.2011–1671.
31. van Zuuren EJ, Fedorowicz Z, Carter B, Pandis N. Interventions for hirsutism (excluding laser and photoepilation therapy alone). Cochrane Database Syst Rev. 2015; 2015 (4): CD010334. DOI: 10.1002/14651858.CD010334.pub2.
32. Балан В. Е., Зайдиева Я. З., Тихомирова Е. В. Эффективное лечение кожных и метаболических проявлений гиперандрогении – комплексное улучшение качества жизни. Медицинский совет. 2019; 7: 45–50. Balan V.E., Zaydieva Ya.Z., Tikhomirova E.V. Effective treatment of skin and metabolic manifestations of hyperandrogenism – a comprehensive improvement in the quality of life. Medical Advice. 2019; 7: 45–50.
33. de Medeiros SF. Risks, benefits size and clinical implications of combined oral contraceptive use in women with polycystic ovary syndrome. Reprod Biol Endocrinol. 2017; 15 (1): 93. DOI: 10.1186/s12958–017–0313-y.
34. Bozdag G, Yildiz BO. Combined oral contraceptives in polycystic ovary syndrome– indications and cautions. Front Horm Res. 2013; 40: 115–127. DOI: 10.1159/000341823.
35. Hohl A, Ronsoni MF, Oliveira Md. Hirsutism: diagnosis and treatment. Arq Bras Endocrinol Metabol. 2014; 58 (2): 97–107. DOI: 10.1590/0004–2730000002923.
36. Barrionuevo P, Nabhan M, Altayar O, Wang Z, Erwin PJ, Asi N, et al. Treatment Options for Hirsutism: A Systematic Review and Network Meta-Analysis. J Clin Endocrinol Metab. 2018; 103 (4): 1258–1264. DOI: 10.1210/jc.2017–02052.
37. de Melo AS, Dos Reis RM, Ferriani RA, Vieira CS. Hormonal contraception in women with polycystic ovary syndrome: choices, challenges, and noncontraceptive benefits. Open Access J Contracept. 2017; 8: 13–23. DOI: 10.2147/OAJC.S85543.
38. Podfigurna A, Meczekalski B, Petraglia F, Luisi S. Clinical, hormonal and metabolic parameters in women with PCOS with different combined oral contraceptives (containing chlormadinone acetate versus drospirenone). J Endocrinol Invest. 2020; 43 (4): 483–492. DOI: 10.1007/s40618–019–01133–3.
39. Kerscher M, Reuther T, Krueger N, Buntrock H. Effects of an oral contraceptive containing chlormadinone acetate and ethinylestradiol on hair and skin quality in women wishing to use hormonal contraception. J Eur Acad Dermatol Venereol. 2013; 27 (5): 601–608. DOI: 10.1111/j.1468–3083.2012.04497.x.
40. Jaisamrarn U, Santibenchakul S. A comparison of combined oral contraceptives containing chlormadinone acetate versus drospirenone for the treatment of acne and dysmenorrhea: a randomized trial. Contracept Reprod Med. 2018; 3: 5. DOI: 10.1186/s40834–018–0058–9.
41. McCartney CR, Marshall JC. CLINICAL PRACTICE. Polycystic Ovary Syndrome. N Engl J Med. 2016; 375 (1): 54–64. DOI: 10.1056/NEJMcp1514916.
42. Yanes Cardozo LL, Romero DG, Reckelhoff JF. Cardiometabolic Features of Polycystic Ovary Syndrome: Role of Androgens. Physiology (Bethesda). 2017; 32 (5): 357–366. DOI: 10.1152/physiol.00030.2016.
43. Cai WY, Gao JS, Luo X, Ma HL, Ge H, Liu N, et al. Effects of metabolic abnormalities, hyperandrogenemia and clomiphene on liver function parameters among Chinese women with polycystic ovary syndrome: results from a randomized controlled trial. J Endocrinol Invest. 2019; 42 (5): 549–555. DOI: 10.1007/s40618–018–0953–6.
44. Mu L, Li R, Lai Y, Zhao Y, Qiao J. Adipose insulin resistance is associated with cardiovascular risk factors in polycystic ovary syndrome. J Endocrinol Invest. 2019; 42 (5): 541–548. DOI: 10.1007/s40618–018–0949–2.
45. Zhang L, Fang X, Li L, Liu R, Zhang C, Liu H, et al. The association between circulating irisin levels and different phenotypes of polycystic ovary syndrome. J Endocrinol Invest. 2018; 41 (12): 1401–1407. DOI: 10.1007/s40618–018–0902–4.
46. Harris HR, Terry KL. Polycystic ovary syndrome and risk of endometrial, ovarian, and breast cancer: a systematic review. Fertil Res Pract. 2016 Dec 5; 2: 14. DOI: 10.1186/s40738–016–0029–2. PMID: 28620541; PMCID: PMC5424400.
47. Dokras A, Sarwer DB, Allison KC, Milman L, Kris-Etherton PM, Kunselman AR, et al. Weight Loss and Lowering Androgens Predict Improvements in Health-Related Quality of Life in Women With PCOS. J Clin Endocrinol Metab. 2016; 101 (8): 2966–2974. DOI: 10.1210/jc.2016–1896.
48. Helvaci N, Yildiz BO. Oral contraceptives in polycystic ovary syndrome. Minerva Endocrinol. 2014; 39 (3): 175–187. PMID: 25003228.
Синдром гиперандрогенизма. Проявления синдрома гиперандрогенизма
Синдром гиперандрогенизма. Проявления синдрома гиперандрогенизма
Существует ли синдром гиперандрогенизма аналогичного женскому гиперфолликулинизму? фроммель утверждал это. Более сдержанный нежели его женский гомолог, этот синдром якобы существует, моделируя морфологию, физиологию и психизм мужчины в возрасте около 50-ти лет.
Внезапная усталость, головокружение, отсутствие аппетита, неопределенные пищеварительные расстройства, перемежающееся благодушие и подавленность, затруднения умственной сосредоточенности, появляясь в указанном возрасте, сопровождаемые иногда пищеварительной атонией, печеночная конгестия, аэрохолия, запоры, гипогликемия, гиперхолестеринемия якобы являются проявлением такого гормонального расстройства, доказательстом чего служит сосуществование гиперандрогенурии и факт, что расстройства замечательно улучшаются под влиянием лечения гипофизарными вытяжками.
Не знаю взялся ли кто-нибудь продолжать исследования Фроммеля и подтверждена ли его концепция. Мы отметили ее, считая, что она заслуживает внимания, хотя бы как еще открытый вопрос, как субъект внимания (если не исследования, даже).
Возвращаясь к женщине, мы должны еще отметить, что некоторые из ее непонятных страданий могут происходить под влиянием излишка или недостачи семенной жидкости, в положительном или отрицательном смысле.

Семенная недостаточность известна луче всего. Понятие имеет хождение и вне медицинского мира и часто, по праву или нет, обращаются к нему как к объяснению некоторых невыясненных, более причудливых расстройств женщины. К таким объяснениям иногда прибегают с той же легкостью, с которой используется ярлык истерии: как и этот диагноз, чересчур широко охватывающий для некоторых, объяснение семенной недостаточностью приводится возможно, слишком часто, слишком неправильно на него ссылаются некоторые умы (даже если не во всеуслышание и ясно выраженно).
Реальность расстройств семенной недостаточности у женщины — несомненна. Половой акт влияет на женщину обще-тонически, посредством стимулирования гипофиза, а затем остальных желез внутренней секреции (Ван де Вельде, Мавромати и др.). Вероятность, что воздержание определяет у женщины некоторые нервные, вегетативные и даже психические расстройства, общепризнана. Связь, однако, не абсолютна и причинная связь не неразрешима: существуют многие женщины, переносящие воздержание без расстройств (точнее: без очевидных, проявленных расстройств).
Вопрос следует рассматривать индивидуально, в зависимости, особенно, от почвы, то есть от телосложения и невропсихической реактивности соответствующей женщины (впрочем, как и в случае любых эндокриновых расстройств). Как и отклонения генезического инстинкта и как нарушения половой жизни, у женщины недостаточность полового акта, совокупления а тем самым и спермы, может вызвать отголоски большого разнообразия: от абсолютного нуля до самых интенсивных и самых странных последствий и проявлений.
К сожалению, в обычной практике, этой стороне жизни женщины часто оказывается слишком мало внимания; очень часто совершенно не оказывают внимания. По застенчивости ли, по стыдливости, по сдержанности, которая не должна иметь места, врач избегает этой стороны женщины. Нередко, таким образом остается не исследованной область с широкими патогенетическими возможностями; так, нередко, ускользают важные причины и условия заболевания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром гиперандрогенизма. Проявления синдрома гиперандрогенизма
1 ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
2 ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Министерства здравоохранения Российской Федерации
В статье проведен анализ значения симптомов гиперандрогении при синдроме поликистозных яичников (СПКЯ) как актуальная проблема в практике дерматолога. Рассматривается необходимость изучения данного синдрома как диагноза трех наук: дерматологии, эндокринологии и гинекологии. Цель исследования состоит в дифференцировании действительно диагностически значимых от ложных симптомов для выявления изучаемого заболевания. В ходе исследования было выявлено, что себорея, андрогенная алопеция не доказали большой значимости в диагностике синдрома поликистозных яичников. Акне в большинстве случаев является физиологическим проявлением, транзиторным состоянием или просто не несет значения в диагностике. Обработка данных исследований показала, что при разных когортах степень распространенности указанных заболеваний не зависела от наличия синдрома у пациенток. Тогда как гирсутизм и черный акантоз можно считать основополагающими симптомами данного заболевания. Актуальность исследования связана прежде всего с тем, что синдром поликистозных яичников – это важный в диагностике симптомокомплекс, так как он напрямую влияет на репродуктивную функцию женщин, а значит и в целом на процент рождаемости, и важно понимать, что успех в эффективной борьбе с синдромом поликистозных яичников состоит в совместной работе дерматолога, эндокринолога и гинеколога.
1. Joseph S. et al. PCOSKB: A KnowledgeBase on genes, diseases, ontology terms and biochemical pathways associated with PolyCystic Ovary Syndrome // Nucleic. Acids. Res. 2015. Vol. 44 (D1). P. d1032–d1035.
2. Joham A.E. et al. Prevalence of infertility and use of fertility treatment in women with polycystic ovary syndrome: data from a large community-based cohort study // J. Womens Health. 2015. Vol. 24. № 4. P. 299–307.
3. Azziz R. et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report // Fertil. Steril. 2009. Vol. 91. № 2. P. 456–488.
4. Housman E., Reynolds R.V. Polycystic ovary syndrome: a review for dermatologists: Part I. Diagnosis and manifestations // Journal of the American Academy of Dermatology. 2014-11-01. Vol. 71. № 5. P. 847.e1-847.e10.
5. Moura H., Costa D., Bagatin E. et al. Polycystic ovary syndrome: a dermatologic approach // An. Bras. Dermatol. 2011. Vol. 86. № 1. Rio de Janeiro Jan./Feb.
6. Burt Solorzano C.M. et al. Neuroendocrine dysfunction in polycystic ovary syndrome // Steroids. 2012. Vol. 77. № 4. P. 332–337.
7. Mukherjee S., Maitra A. Molecular and genetic factors contributing to insulin resistance in polycystic ovary syndrome // Indian J. Med. Res. 2010. Vol. 131. P. 743–760.
8. Унанян А.Л., Руднева О.Д. Синдром гиперандрогенизма в практике гинеколога. - М.: Редакция журнала StatusPaesens, 2014. - 20 с.
9. Schmidt T.H., Khanijow K., Cedars M.I. et al. Cutaneous Findings and Systemic Associations in Women With Polycystic Ovary Syndrome // JAMA Dermatol. 2016. Apr. 152 (4):391-8. doi: 10.1001/jamadermatol.2015.4498.
10. Clark C.M., Rudolph J., Gerber D.A. et al. Dermatologic manifestation of hyperandrogenism: a retrospective chart review // Skinmed. 2014. Mar-Apr. 12 (2):84-8.
11. Hong J.S.1, Kwon H.H., Park S.Y. et al. Cutaneous manifestations of the subtypes of polycystic ovary syndrome in Korean patients // J. Eur. Acad. Dermatol. Venereol. 2015. Jan. 29 (1):42-7. doi: 10.1111/jdv.12432. Epub 2014 Mar 14.
12. Ozdemir S., Ozdemir M., Görkemli H. et al. Specific dermatologic features of the polycystic ovary syndrome and its association with biochemical markers of the metabolic syndrome and hyperandrogenism // Acta. Obstet. Gynecol. Scand. 2010. 89 (2):199-204. doi: 10.3109/00016340903353284.
13. Sujata M. Clinical, Biochemical, and Hormonal Associations in Female Patients with Acne: A Study and Literature Review // J. Clin. Aesthet. Dermatol. 2017. Oct. 10 (10): 18–24.Published online 2017 Oct 1.
14. Mohammad A., Iffat H., Gousia S. Cutaneous Manifestations of Polycystic Ovary Syndrome: A Cross-Sectional Clinical Study // Indian Dermatol Online J. 2017. Mar-Apr. 8 (2): P. 104–110.
15. Яурова А.С. Взаимоcвязь жизнестойкости и самоотношения у подростков с акне (угревой болезнью) // Педиатр. – 2017. - Т. 8. - Вып. 5. - С. 110.
17. Богатырёва Е.М., Кутушева Г.Ф., Гоготадзе И.Н., Зернюк А.Д. Гиперандрогения. Случаи сочетания различных вариантов гиперандрогенных состояний у девочек-подростков с периферической формой гиперандрогении // Педиатр. – 2015. - Т. VI. - № 1. - С. 62-67.
Синдром поликистозных яичников (СПКЯ) является одним из наиболее часто встречаемых заболеваний эндокринной этиологии среди женщин репродуктивного возраста. Этот синдром можно обнаружить почти у каждой десятой женщины данной категории (7–10%) [1] в популяции, а по некоторым данным - у каждой пятой (20%) [2]. Процентное соотношение увеличивается при следующих рисках: в когорте пациенток с расстройствами менструации СПКЯ может быть диагностирован с частотой 17–46%; гиперандрогении - 72–82%; ановуляторном бесплодии - 55–91% [3]. Важно отметить, что СПКЯ неправильно считать только гинекологическим синдромом, так как впоследствии он может стать предпосылкой для развития таких заболеваний, как сахарный диабет, тромбоэмболия, гиперпластические процессы в эндометрии, а также психосоматические расстройства.
Патогенез данного заболевания еще недостаточно изучен, но в настоящее время СПКЯ считается сложным полиэтиологичным расстройством, включающим в себя аномалии гипоталамо-гипофизарной системы, стероиодогенез и инсулинорезистентность [4].
К основным клиническим проявлениям СПКЯ относят: гиперандрогенизм, хроническую овуляторную дисфункцию и поликистозную морфологию яичников, подтвержденную данными УЗИ малого таза [5].
При исследовании повышения андрогенного синтеза следует учитывать следующие факторы. Во-первых, инсулин совместно с ЛГ непосредственно влияет на яичники, сверхчувствительные к данным гормонам, и вследствие этого ускоряется синтез яичниковых андрогенов [6]. Во-вторых, инсулин действует угнетающе на синтез белков, связывающих инсулиноподобные факторы роста, кроме того, понижает уровень глобулина, связывающего половые стероиды. В результате содержание инсулиноподобных факторов роста увеличивается, в то же время происходит стимуляция выработки андрогенов в яичниках, а концентрации глобулина, связывающего половые стероиды, который должен их инактивировать, не хватает. Таким образом, возникает абсолютная и относительная гиперандрогения [7].
Гиперандрогенизм является патологическим симптомокомплексом, характеризующимся избыточным действием андрогенов на органы и ткани-мишени у женщин. Для абсолютного гиперандрогенизма характерна повышенная продукция андрогенов в яичниках, надпочечниках и периферических тканях.
Абсолютный гиперандрогенизм функционального генеза может быть различного происхождения: яичникового (синдром поликистозных яичников), надпочечникового (врождённая дисфункция коры надпочечников) или смешанного генеза [8] .
Так как к основным симптомам гиперандрогенизма относят гирсутизм, себорею, акне, а также андрогенную алопецию, пациенты часто обращаются именно к дерматологам для оценки и лечения данных заболеваний. Поэтому данные специалисты играют значимую роль в ранней диагностике и лечении синдрома поликистозных яичников.
Еще несколько лет назад считалось, что гиперандрогенизм в целом является одним из базовых симптомов синдрома поликистозных яичников. В настоящее время проведены исследования, которые указывают на то, что основную значимость в диагностике СПКЯ несет только гирсутизм и черный акантоз, тогда как акне может быть всего лишь сомнительной предпосылкой.
В данной статье мы провели обзор статей и литературы и рассмотрели, какие именно симптомы гиперандрогенизма в действительности влияют на диагностику синдрома поликистозных яичников, а какие из них являются ложными. Для более точного заключения мы отобрали исследования нескольких когорт, куда входили женщины репродуктивного возраста, принадлежащие к разным расовым и возрастным группам.
Группа ученых университета Калифорнии (Сан-Франциско) провели исследование среди 401 женщины с подозрением на синдром поликистозных яичников. Средний возраст обследуемых составлял 28 лет. По сравнению с женщинами, которые не соответствовали диагностическим критериям для СПКЯ, пациентки, которые соответствовали критериям, имели более высокие показатели гирсутизма (53,3% [144 из 270] против 31,2% [15 из 48], P = 0,005), акне (61,2% [164 из 268] против 40,4% [19 из 47], P = 0,004) и черного акантоза (36,9% [89 из 241] против 20,0% [9 из 45], P = 0,03). Кожные показатели также варьировались. Женщины с диагностическими критериями СПКЯ продемонстрировали более тяжелый гирсутизм и более высокий уровень подмышечного черного акантоза. Среди обследуемых с СПКЯ наличие гирсутизма (43,9% [54 из 123] против 30,9% [34 из 110], P = 0,04) и черного акантоза (53,3% [40 из 75] против 27,0% [40 из 148], P <001) было связано с более высокими показателями повышенного уровня свободного тестостерона, а также с несколькими нарушениями метаболизма, включая инсулинорезистентность, дислипидемию и увеличение индекса массы тела. Хотя распространенность акне была увеличена среди женщин с СПКЯ, были минимальные различия в типах акне и распределении между женщинами с диагностическими критериями СПКЯ и женщинами, не подходящими под эти критерии [9].
В нескольких исследованиях описывается широкий спектр заболеваний гиперандрогенизма, многие из которых трудно отличить друг от друга. Для лучшего понимания заболеваний гиперандрогенизма авторы провели ретроспективное исследование кожных изменений у женщин с гиперандрогенизмом. Проведен ретроспективный анализ диаграмм, составленный тремя дерматологами как в академических, так и в частных условиях, включая пациентов с показаниями двух или более проявлений гиперандрогенизма. Были рассмотрены соответствующие дерматологические и связанные с ними проявления, результаты лабораторных исследований и исследований изображений. Наиболее распространенным проявлением было умеренное и тяжелое акне. Другими распространенными проявлениями, которые впервые были представлены, являются гирсутизм, черный акантоз, андрогенная алопеция. Олигоменоррея была наиболее распространенным системным представляющим клиническим симптомом. Статистический анализ различных клинических маркеров выявил корреляции с гиперандрогенемией. Было обнаружено, что черный акантоз и гирсутизм являются полезными клиническими маркерами для гиперандрогенизма, тогда как андрогенная алопеция не подтвердила своей диагностической значимости [10].
Исследователи из Сеульского национального университета изучили роль дерматологических проявлений у корейских пациенток с СПКЯ, классифицированных по трем критериям ASRM / ESHERE, на базе Лаборатории акне и розацеи в Национальной университетской больнице Сеула. Было обследовано 40 пациенток с синдромом поликистозных яичников, которым недавно был поставлен диагноз в Отделе акушерства и гинекологии больницы Сеульского национального университета. Пациенты были классифицированы в зависимости от наличия нерегулярных менструаций, морфологии поликистозных яичников и гиперандрогении. В результате исследования чаще всего был выявлен гирсутизм, распространенность других кожных проявлений существенно не различалась. Вследствие этого ученые пришли к выводу о том, что кожные проявления могут быть первыми признаками СПКЯ, поэтому дерматологи должны акцентировать внимание на кожные проявления у различных этнических групп [11].
Турецкие исследователи провели перспективный описательный анализ, в котором было обследовано 115 женщин с диагнозом СПКЯ. Каждая женщина была обследована по состоянию акне, гирсутизма, себореи, андрогенной алопеции и черного акантоза. Взаимосвязи между кожными особенностями и гормональными метаболическими параметрами были проанализированы с помощью многомерных моделей логистической регрессии. В результате чего была выявлена распространенность акне, гирсутизма, себореи, андрогенной алопеции и черного акантоза - 53; 73,9; 34,8; 34,8 и 5,2% (рис. 1) соответственно. Акне не было связано с гормональными, метаболическими и антропометрическими переменными. Гирсутизм имел положительные ассоциации с общим тестостероном, глюкозой натощак и общим холестерином, но отрицательную ассоциацию с возрастом. Было обнаружено, что себорея связана со свободным тестостероном, глюкозой натощак и инсулином. Отрицательные ассоциации наблюдались среди андрогенной алопеции, свободного тестостерона, липопротеинов низкой плотности и инсулина [12].
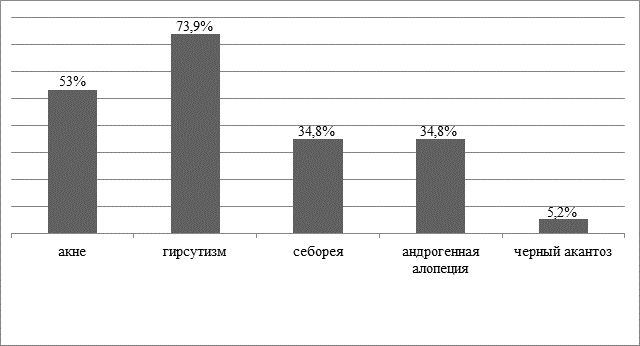
Рис. 1. Распространенность акне, гирсутизма, себореи, андрогенетической алопеции и черного акантоза
Другие исследователи считают, что женское акне часто связанo с клиническими признаками гиперандрогении, в том числе с синдромом поликистозных яичников, или метаболического синдрома. Различные гормональные и биохимические факторы, а также дефицит витамина D играют определенную роль в этиопатогенезе акне, и важно иметь возможность диагностировать маркеры, указывающие на определенные аномалии, чтобы полноценно подходить к лечению. Однако интерпретация этих маркеров может быть затруднена, поскольку существует двусмысленность относительно того, что считается «нормальным» или «ненормальным». При частном центре дерматологии в Западной Индии было проведено исследование, в котором участвовало 36 женщин в возрасте от 16 до 39 лет. 33 пациенткам было выполнено ультразвуковое исследование малого таза, в результате чего 14 из них (45%) был поставлен диагноз СПКЯ. Также исследовали распространенность показателей повышенных биохимических маркеров резистентности к инсулину и дисфункции гормонов. 35 из 36 пациентов (97,22%) показали по крайней мере один измененный маркер. Исследования автора показывают очень высокую распространенность аномальных метаболических и гормональных статусов у женщин с акне, что указывает на необходимость поддержания дерматологами высокого индекса подозрения на другие нарушения, особенно нарушения обмена веществ, и в частности на синдром поликистозных яичников, при лечении женщин-пациенток с акне. Но мы считаем, что на фоне вышеуказанных исследований 45% является не таким значимым показателем, так как исследовалась небольшая когорта женщин. Следовательно, важность акне для диагностики синдрома поликистозных яичников остается сомнительной [13].
Также в Индии был проведен статистический анализ с целью изучения частоты различных кожных проявлений у пациенток с СПКЯ. В течение года были обследованы 100 женщин на базе дерматологического центра. Возрастной показатель пациенток был от 20 до 40 лет. Диагноз СПКЯ был поставлен на основании Роттердамских критериев 2003 года, а именно:
1) олигоменорея или/и аменорея;
2) гиперандрогения (клинические и лабораторные проявления);
3) поликистозные изменения яичников.
В результате исследования распространенность гирсутизма, акне, андрогенной алопеции у женщин, черного акантоза, себореи, стрии и акрохордонов составила 78, 48, 31, 30, 29, 13 и 9% соответственно (рис. 2) [14].
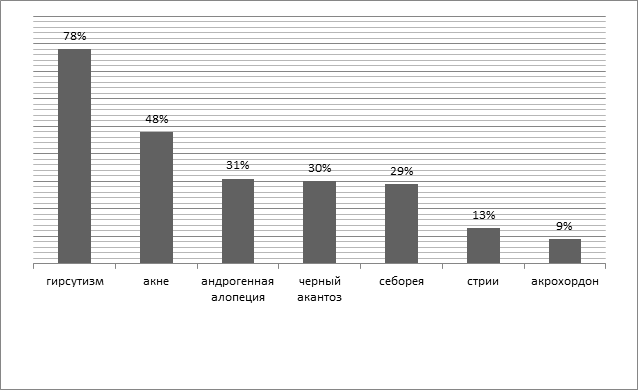
Рис. 2. Распространенность гирсутизма, акне, андрогенной алопеции у женщин, черного акантоза, себореи, стрии и акрохордонов
В ходе обзора выше представленных источников было выявлено, что не все симптомы гиперандрогении можно считать ключевыми.
Cеборея и андрогенная алопеция не доказали своей большой значимости в диагностике синдрома поликистозных яичников. Акне, зачастую воспринимающееся как «звонок», для того чтобы обратить внимание на возможно необследованный СПКЯ, на самом деле чаще является у подростков физиологическим, транзиторным или просто не несёт значения в диагностике.
Тогда как гирсутизим и черный акантоз можно смело считать основополагающими симптомами для того, чтобы обратить на них внимание на приеме у дерматолога, особенно если до этого пациентка не наблюдалась по поводу СПКЯ.
Косметический дефект на лице у подростков, обусловленный наличием акне, является частой причиной неуверенности в себе и неудовлетворенностью собой как личностью [15]. Е.В. Сибирская, Л.В. Адамян, И.Е. Колтунов, А.А. Плошкина говорят о том, что степень распространения акне среди данной группы пациентов достаточно велика, но в большинстве случаев угревую болезнь следует воспринимать как транзиторное явление. Больше внимания следует уделять гирсутизму [16]. У подростков особенно внимательно следует проводить дифференциальную диагностику разных форм гиперандрогении, так как сопутствующие формы влияют на изменение лабораторных данных и клинические проявления синдрома [17].
В связи с тем что гирсутизм является диагностически важным критерием для постановки диагноза СПКЯ для пациенток от подросткового возраста до периода перименопаузы, предлагаем ознакомиться с методом оценки симптома по шкале Ферримана-Галвея (рис. 3), который был впервые описан Д. Ферриманом и Дж.Д. Геллвеем в Journal of Clinical Endocrinology. Данная шкала в её новой интерпретации оценивает распространенность терминальных волос в 9 андрогенозависимых зонах по пятибалльной шкале (от 1 до 4 баллов).
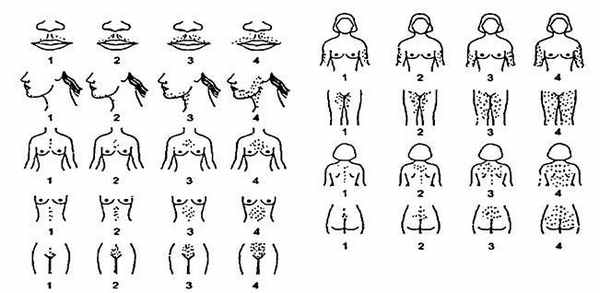
Рис. 3. Методы оценки симптома по шкале Ферримана-Галвея
Важно понимать, что СПКЯ – это диагноз трех наук: дерматологии, эндокринологии и гинекологии.
Синдром поликистозных яичников – это очень важный в диагностике симптомокомплекс, так как он напрямую влияет на репродуктивную функцию женщин, а значит и в целом на процент рождаемости.
Гиперандрогения: мифы и реальность
В настоящее время накоплено немало исследований и практического опыта по гиперандрогении у женщин, однако до сих пор нет четких критериев постановки данного диагноза, в связи с чем остро стоит проблема гипердиагностики и вытекающей из этого неправильной тактики лечения пациенток. В статье представлены результаты крупных и известных на сегодняшний день исследований в этой области, ставящие под сомнение негативное влияние избытка андрогенов на женское здоровье.
- КЛЮЧЕВЫЕ СЛОВА: гиперандрогения, синдром поликистозных яичников, гирсутизм, гипертензия, овуляторная дисфункция
В настоящее время накоплено немало исследований и практического опыта по гиперандрогении у женщин, однако до сих пор нет четких критериев постановки данного диагноза, в связи с чем остро стоит проблема гипердиагностики и вытекающей из этого неправильной тактики лечения пациенток. В статье представлены результаты крупных и известных на сегодняшний день исследований в этой области, ставящие под сомнение негативное влияние избытка андрогенов на женское здоровье.
Гиперандрогения – расстройство эндокринного статуса, обусловленное избыточной продукцией андрогенов. Данный синдром встречается у 5–10% женщин репродуктивного возраста [1] и является следствием повышенной продукции андрогенов как в яичниках, так и в надпочечниках. Однако такое разделение носит весьма условный характер, так как повышенная продукция андрогенов в надпочечниках может приводить к их повышенной продукции в яичниках и наоборот [2].
Впервые гиперандрогению в виде синдрома поликистозных яичников (СПКЯ) описал А. Vallisneri еще в 1721 г. [3]. Подробно изучили и описали классическую форму «склерокистозных яичников» в 1935 г. I. Stein и M. Leventhal: «Молочные железы, как правило, в норме. У некоторых пациенток наблюдается явная тенденция к маскулинизации. Выявлен типичный ромбовидный тип оволосения лобка, волосы на лице, руках и ногах, изменения кожи. Отсутствует изменение тембра голоса. Наружные половые органы не изменены, в редких случаях гипертрофированы малые половые губы. Либидо не изменено, несмотря на изменения в яичниках» [4].
В настоящее время в научной литературе и клинической практике проблема гиперандрогении сохраняет свою актуальность и значимость. Но связаны ли эти значимость и актуальность с избытком андрогенов? И каковы критерии истинной гиперандрогении?
К классическим клиническим ее проявлениям принято относить гирсутизм, акне и алопецию. По данным ряда авторов, гиперандрогения помимо гирсутизма, акне и алопеции должна приводить к маскулинизации внешнего вида, развитию ожирения по мужскому типу, артериальной гипертензии, аменореи и овуляторной дисфункции, приводящей к бесплодию [5], огрубению голоса, повышению либидо, гипертрофии клитора, увеличению мышечной массы, уменьшению молочных желез [6].
Согласно современным рекомендациям, при наличии выраженных клинических проявлений избытка андрогенов лабораторное подтверждение не является обязательным. Кроме того, для лабораторного подтверждения гиперандрогении, к сожалению, точные диагностические критерии до настоящего времени не разработаны, что связано с рядом причин. В первую очередь это связано с методологическими ограничениями точного определения более низких, чем у мужчин, уровней тестостерона, характерных для женщин. Известно, что даже у мужчин определение уровня общего тестостерона в крови на основе наиболее распространенных в клинической практике методов радиоиммунного анализа имеет высокие уровни погрешности. В нижних процентилях диапазона концентрации общего тестостерона для женщин погрешность особенно велика.
Более того, плазменный уровень тестостерона как у мужчин, так и у женщин может не соответствовать его истинной концентрации в клетках органов-мишеней с учетом возможности связывания половых стероидов с белками-переносчиками плазмы крови (например, необратимо с глобулином, связывающим половые гормоны (ГСПГ), обратимо с альбуминами плазмы) и наличия механизмов внутриклеточного синтеза из надпочечниковых и яичниковых прогормонов. Затруднительность точного определения уровней фракций тестостерона у женщин в рутинной практике не позволяет с высокой достоверностью оценить взаимосвязь между концентрацией тестостерона и возможными клиническими проявлениями гиперандрогении в разные периоды жизни женщины. Однако, по мнению мировых экспертов, решение методологических проблем корректного измерения концентрации тестостерона у женщин (так же, как у мужчин) может быть связано с более широким внедрением в клиническую практику самого точного метода определения уровней стероидных гормонов в крови – хромато-масс-спектрометрии [7, 8].
Кроме того, концентрация андрогенов у женщин, так же как у мужчин, зависит от времени суток и возраста. Этнические различия клинических проявлений гиперандрогении ставят под сомнение правомерность данного диагноза (низкий процент гирсутизма среди женщин из Восточной Азии), что, скорее, связано с наличием различной чувствительности тканей к андрогенам [9].
Проблема гиперандрогении стала источником многочисленных мифов о вреде андрогенов и необоснованной гипердиагностики с последующим назначением антиандрогенных препаратов, что, бесспорно, связано с неправильным представлением о физиологической роли тестостерона в жизни женщины.
Нормальная физиология андрогенов в женском организме
Андрогены у женщин синтезируются яичниками, надпочечниками и периферическими тканями, которые также принимают активное участие в метаболизме. Набор андрогенов и у женщин, и у мужчин включает дегидроэпиандростерон-сульфат, дегидроэпиандростерон, андростендион, тестостерон и 5-альфа-дигидротестостерон (5-альфа-ДГТ), но в отличие от мужчин у женщин концентрация первых трех гормонов выше, чем двух последних. Синтез андрогенов в надпочечниках у женщин регулируется адренокортикотропным, а в яичниках – лютеинизирующим гормоном (ЛГ), а также некоторыми другими интрагландулярными аутопаракринными механизмами [10].
У женщин около 25% андрогенов образуется в яичниках, еще 25% – в надпочечниках, остальные синтезируются в периферических тканях из одних и тех же исходных гормонов: дегидроэпиандростендиона и дегидроэпиандростендион-сульфата, которые являются универсальными прогормонами, синтезирующимися в надпочечниках, причем в количествах, превышающих уровень секреции кортизола, а содержание дегидроэпиандростендиона в крови уступает только уровню холестерина [11, 12]. Тестостерон у женщин функционирует как прогормон, который метаболизируется в 5-альфа-ДГТ или 17-бета-эстрадиол в тканях-мишенях [13]. Помимо этого тестостерон может синтезироваться в тканях-мишенях по требованию. Данный гормон у женщин оказывает как непосредственное действие на органы-мишени, в которых экспрессируются рецепторы к тестостерону (именно он необходим для синтеза мозговых нейростероидов, обеспечивающих либидо и болевую перцепцию, а также является основным участником метаболизма жировой и в большей степени мышечной ткани, в том числе детрузора и сфинктеров мочевого пузыря), так и опосредованное влияние – через переход в 5-альфа-ДГТ, регулирующий метаболизм волосяных фолликулов, рост волос и синтез кожного сала [13].
Синергическое действие тестостерона с эстрогенами чрезвычайно важно для полноценных физиологических эффектов в центральной нервной системе, костной ткани, ткани молочной железы, яичников и т.д. Поэтому изменение синтеза или метаболизма тестостерона может иметь неблагоприятные последствия и для женского здоровья (репродуктивной, мочеполовой, костно-мышечной, центральной нервной системы, сексуальной сферы), и для качества жизни женщины в целом [13–19].
В норме уровень плазменного тестостерона у женщин превышает в десятки раз уровень плазменного эстрадиола. В связи с этим наиболее вероятен тот факт, что именно тестостерон является одним из наиболее активных половых стероидных гормонов у женщин [13, 20].
Для обеспечения слаженной работы женского организма в любом возрасте, несомненно, нужны эффекты всех трех стероидных гормонов (эстрогенов, прогестерона, андрогенов).
Они имеют огромное значение для регуляции клеточного метаболизма (транскрипции и внутриклеточной передачи сигнала, связывания цинка, кальция и ДНК, обеспечения нормальной функции митохондрий клеток, направленной не только на синтез энергии, но и на инактивацию свободных радикалов кислорода).
Кроме того, активация рецепторов этих гормонов оказывает влияние на гены. Активация эстрогеновых рецепторов приводит к модулированию экспрессии около 600 генов, прогестероновых – около 1800 генов, андрогеновых рецепторов – около 250 генов [21].
Основные функции тестостерона в женском организме
Благодаря последним исследованиям помимо основных биологических, ранее общеизвестных эффектов андрогенов были открыты их новые механизмы влияния на организм женщины.
По результатам последних исследований, рецепторы к андрогенам у женщин расположены в клетках практически всех тканей, включая молочные железы, сердце, кровеносные сосуды, желудочно-кишечный тракт, легкие, головной и спинной мозг, периферические нервы, мочевой пузырь, уретру, матку, яичники, влагалище, кожу, костную ткань, костный мозг, синовиальные оболочки, мышечную и жировую ткани [17, 22–25]. Исходя из этого, можно предположить, что дефицит тестостерона у женщин – это не только сексуальные нарушения, но и изменение настроения, сопровождающееся тревогой, раздражительностью, депрессией, физическая усталость, потеря костной и мышечной массы (остеопороз и саркопения), ожирение, изменение познавательной и когнитивных функций (болезнь Альцгеймера), нарушение памяти, хроническая боль, нарушение мочеиспускания, в том числе недержание мочи, репродуктивные нарушения и т.д. [13, 17, 18, 25–39].
К настоящему времени накопилось достаточное количество данных, демонстрирующих важность андрогенов в жизни женщин. Однако, как показывает практика, диагноз «гиперандрогения» является предпочтительным в любой ситуации, сопровождающейся даже единичными клиническими проявлениями, такими как акне, гирсутизм, нарушения овариально-менструального цикла.
Основные мифы о гиперандрогении
Миф 1. Гирсутизм, угри, алопеция и олигоменорея являются клиническими проявлениями избытка андрогенов.
Как показывают исследования, гирсутизм сопровождается повышением уровня андрогенов лишь в 70–80% случаев. Он значительно реже встречается у женщин из азиатских стран. У 20–30% женщин гирсутизм не сопровождается овуляторной дисфункцией и повышением уровня андрогенов. Всем хорошо известна генетически обусловленная высокая чувствительность рецепторов волосяных фолликулов к воздействию андрогенов. Дополнительно хотелось бы подчеркнуть важный фактор, регулирующий развитие роста волос, – активность 5-альфа-редуктазы. В ряде случаев у женщин с генетической предрасположенностью ее активность повышена под стимулирующим воздействием высоких уровней инсулина [40, 41].
В ретроспективном исследовании S. Karrer-Voegeli и соавт. (2009) (228 пациенток, наблюдение – шесть лет) было показано, что уровни общего слюнного тестостерона не коррелируют с оценкой гирсутизма. Пациентки с гирсутизмом имеют более низкие уровни ГСПГ и более высокие уровни андростендиона, дегидроэпиандростерон-сульфата и слюнного тестостерона. Однако ни один андрогенный параметр не позволяет в нем идентифицировать все случаи гиперандрогении [42].
В исследовании R.L. Glaser и соавт. (2012) принимали участие 285 пациенток с дефицитом тестостерона, 27% из них страдали алопецией. На фоне применения в течение 12 месяцев импланта с тестостероном 63% из них отметили значительное улучшение роста волос на голове. В связи с тем что ни одна пациентка не пожаловалась на потерю волос на фоне терапии тестостероном, это ставит под сомнение роль андрогенов в развитии алопеции [43].
Миф 2. Гиперандрогения – это всегда олиго- и аменорея.
В соответствии с последними рекомендациями Американской ассоциации клинических эндокринологов (American Association Clinical Endocrinologists – AACE) гиперандрогения сопровождается овуляторной дисфункцией, а олиго- или аменорея является одним из диагностических критериев для постановки диагноза «синдром поликистозных яичников» как наиболее часто встречающейся классической модели гиперандрогении. Однако в ряде исследований была подчеркнута чрезвычайно важная роль тестостерона в регуляции овуляции и обеспечении нормального менструального цикла. Об этом свидетельствует относительное повышение его плазменной концентрации в периовуляторный период менструального цикла [13, 44, 45].
N. Gleicher и соавт. (2008–2014) выдвинули новую революционную концепцию патогенеза репродуктивных нарушений у женщин, обусловленных овуляторной дисфункцией [36, 46, 47]. Их исследования продемонстрировали, что в ранней фолликулярной фазе менструального цикла существует механизм возможного взаимодействия между андрогенами и фолликулостимулирующим гормоном [36, 46, 47]. Это является объяснением подъема плазменного уровня тестостерона у женщин в периовуляторном периоде. При соблюдении идентичных клинических параметров и программ стимуляции яичников в циклах экстракорпорального оплодотворения частота наступления беременности (16,18 против 40,15%, р 1,115 нмоль/л. Авторы исследования полагают, что базальный уровень общего тестостерона крови у женщин ≤ 1,115 нмоль/л может служить показателем более низкой частоты имплантации после экстракорпорального оплодотворения у женщин со сниженным фолликулярным резервом [10, 13, 39].
Гиперинсулинемия, вызывая снижение ГСПГ, приводит к гиперандрогении за счет свободного тестостерона [48]. В свою очередь гиперинсулинемия стимулирует выработку 5-альфа-редуктазы, которая отрицательно влияет на рост и пролиферацию клеток гранулезы, тем самым ухудшая рост фолликулов и овуляцию [49].
Вышеперечисленные факты подвергают сомнению роль гиперандрогении в развитии хронической овуляторной дисфункции.
Миф 3. Гиперандрогения приводит к ожирению и бесплодию.
Патофизиология ожирения при СПКЯ как классической модели гиперандрогении сложна. Одним из возможных механизмов может быть взаимодействие между резистентностью к инсулину и совместное гонадотропное ЛГ-стимулирующее действие инсулина и, как следствие, увеличение уровня циркулирующего андрогена. Подробная схема взаимодействия между абдоминальным ожирением, инсулинорезистентностью и гиперандрогенией в патогенезе и прогрессировании СПКЯ представлена на рисунке [45]. Гиперинсулинемия – причина снижения сывороточного глобулина, связывающего половые стероиды, что приводит к увеличению в сыворотке свободных и метаболически активных андрогенов [48, 50], снижению клиренса андрогенов и активности ароматазы, усилению стероидогенеза.
Кроме того, использование метформина приводит к улучшению менструального цикла и снижению уровня андрогенов [45]. В ряде исследований метформин продемонстрировал положительный эффект на динамику снижения антимюллерова гормона, который повышен в два-три раза у женщин с ановуляторным бесплодием при СПКЯ, что также ставит под сомнение гиперандрогению как первичное звено в возникновении бесплодия [51–53].
Что же является реальностью? Как правило, большая часть гиперандрогений приходится на синдром поликистозных яичников, в то время как на неклассические формы врожденной гиперплазии коры надпочечников (недостаточность 21-й дегидрогеназы), синдром HAIR-AN, андрогенсекретирующие опухоли и гиперандрогению, вызванную приемом лекарственных средств, – менее 10% случаев. Что касается последних, то постановка этих диагнозов проста ввиду четкого определения критериев диагностики, в то время как синдром поликистозных яичников – сложный (и в настоящее время) для верификации диагноз. Часто возникает его гипердиагностика с последующим необоснованным назначением препаратов с антиандрогенным эффектом.
В 2015 г. в журнале «Эндокринологическая практика» были опубликованы новые рекомендации AACE. Наличие хотя бы двух из трех перечисленных критериев является основанием для постановки диагноза «синдром поликистозных яичников»: хроническая ановуляция, гиперандрогенизм (клинический или биологический) и поликистозные яичники. Длина цикла > 35 дней предполагает хроническую ановуляцию, длина цикла, несколько превышающая нормальную (32–35 дней) или слегка нерегулярная (от 32 до 35–36 дней), требует уточнения наличия овуляторной дисфункции. По данным ультразвуковой диагностики, объем хотя бы одного яичника должен быть более 10 см 3 , мультифолликулярное строение – насчитывать 25 и более фолликулов от 2 до 9 мм в диаметре [54]. Уровни свободного тестостерона более чувствительны, чем измерение его общей фракции, для установления существования избытка андрогенов [54]. К сожалению, до сих пор не определены референсные значения уровней общего и свободного тестостерона, что, собственно, является краеугольным моментом в многочисленных дискуссиях при постановке диагноза и выборе метода терапии [10, 13].
Большинство авторов считают, что лечение гиперандрогении в основном симптоматическое, основные его цели включают нормализацию менструального цикла, устранение кожных проявлений, устранение и профилактику сопутствующих метаболических нарушений, лечение бесплодия, вызванного ановуляцией. Комбинация разных методов терапии дает наилучшие результаты [55].
Цель данной обзорной статьи – развеять сложившиеся годами предубеждения о гиперандрогении как неразрешимой проблеме. Клинические признаки, которые трактуются как гиперандрогения, есть не что иное, как многоликие проявления инсулинорезистентности. Они не могут и не должны расцениваться как абсолютный или относительный избыток андрогенов. К сожалению, современные тенденции нарастающей необоснованной постановки диагнозов «гиперандрогения» и «синдром поликистозных яичников», незнание патогенеза заболевания привели к рутинному массовому использованию препаратов с антиандрогенным эффектом, что влечет за собой усугубление течения заболевания и нарастание метаболических нарушений, ассоциированных с инсулинорезистентностью и дефицитом андрогенов.
Только глубокое знание поможет правильно поставить диагноз и выбрать эффективную этиопатогенетическую терапию, что позволит улучшить гормональное и репродуктивное здоровье женщин и повысить качество их жизни.
Читайте также:
