Синдром Маршалла: близорукость, катаракта, седловидный нос и глухота
Добавил пользователь Владимир З. Обновлено: 20.01.2026
Глухота с ретинитом, слабоумием и прогрессирующим тетрапарезом
Пигментная дегенерация сетчатки, прогрессирующий тетрапарез, умственная отсталость и умеренно глубокая нсйросенсорная глухота у 2 мальчиков сибсов описаны Gordon, Capute и Konigsmark.
Клинические данные. Данные осмотра. Братья отличались низким ростом, атрофичной мускулатурой всех конечностей и тупым, невыразительным лицом. Окружность головы, длина тела и вес были ниже физиологических норм на 30%. Пальцы, особенно средние фаланги, были короткими. Отмечалась клинодактилия V пальцев. Наблюдались умеренные сгибательные контрактуры на ногах.
Орган зрения. Произведенное братьям в возрасте 3 и 4 лет офтальмологическое исследование обнаружило по всей сетчатке диффузное распространение крупных гранул пигмента, маленький и бледный диск зрительного нерва и суженный калибр сосудов (артериол) сетчатки. С возрастом все эти изменения становились более резкими.
Нервная система. Уровень IQ.s, установленный при психометрическом тестировании, был равен 34 и 44. Наиболее постоянным неврологическим симптомом болезни являлся прогрессирующий спастический паралич ног со сгибательными контрактурами бедер и коленей. Отмечались повышение сухожильных рефлексов и сгибательный подошвенный рефлекс. Несмотря на то что масса мышц была резко уменьшена, мышечная сила оставалась вполне хорошей. Больные ходили на широко расставленных ногах. Их походка была неустойчивой. Постепенно они ходили все с большим трудом, и в конце концов передвижение стало совсем невозможным.
Патологических движений и нарушения чувствительности не обнаружено. Выражение лица становилось все более тупым. Нарастали угнетение рвотного и глотательного рефлексов, а также нарушения смыкания век.
Орган слуха. Проведение аудиометрического исследования было затруднено из-за умственной отсталости мальчиков. Отологическое исследование патологии не выявило. ЭЭГ-аудиометрия показала умеренно глубокую пейросенсорную глухоту, охватывающую главным образом высокие частоты. Другие аудиометрические пробы не производились. Речь у обоих братьев не развивалась.
Вестибулярная система. Калорические вестибулярные пробы были нормальными.
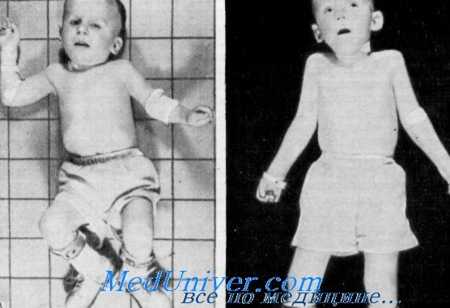
Пигментный ретинит, прогрессирующий тетрапарез, слабоумие и нейро-сенсорная глухота. Два брата маленького роста с невыразительным лицом и низко посаженными деформированными ушами
Лабораторные данные. Рентгенограммы. На краниограмме обнаружены малые размеры и асимметрия черепа. Отмечались укорочение средних фаланг и гипоплазия V пястной кости.
Другие данные. На ЭЭГ у одного из мальчиков была обнаружена чрезмерно медленная активность, в то время как у его брата ЭЭГ была нормальная. Электроретинографическое исследование зарегистрировало у старшего мальчика почти нормальную реакцию на свет.
Рутинные анализы мочи и крови, проба на электролиты и спинномозговая жидкость были нормальными.
Патология. Результаты гистопатологического исследования не представлены.
Наследственность. Родители больших детей состояли в отдаленном родстве. У тетки по линии матери был спастический церебральный паралич, но без ретинопатии. Тип наследования более всего похож на аутосомно-рецессивный, но нельзя исключить возможность Х-сцепленного наследования.
Диагноз. При синдроме Ушера моторика и психическая сфера ингактны. Другие заболевания, включающие пигментный ретинит и глухоту, такие как синдром Кокейна, синдром Рефсума и синдром Альстрёма, имеют другие сопутствующие аномалии, отличные от спастической параплегии и умственной отсталости, наблюдающихся при этом заболевании.
Существует несколько синдромов, включающих умственную отсталость и нарушения походки. Синдром Ричарде — Раидля (Richards — Rundle) характеризуется глухотой и медленно прогрессирующей атаксией, но мышечная сила остается вполне хорошей в течение многих лет. Синдром Тройера (Тгоуег) включает спастическую параплегию и дистальиые мышечные атрофии, которые начинаются в детстве и медленно прогрессируют, пока в третьем — четвертом десятилетии жизни ходьба становится совершенно невозможной. Хотя у некоторых больных и выявляют умственную отсталость, у них не доказаны пигментный ретинит или атрофия зрительных нервов (Cross, McKusick).
В одной семье была описана спастическая параплегия с дегенерацией сетчатки в сочетании с нейросеисорной глухотой, но интеллект у больных был нормальным (Louis-Bar, Pirot, Mahloudji, Chuke)
Лечение. Так как умственная отсталость у больных выражена резко, применение слуховых аппаратов ограничено.
Прогноз. Заболевание очень медленно прогрессирует, в результате развивается полная идиотия.
Выводы. Характеристика этого синдрома включает: 1) вероятное аутосомно-рецессивное наследование, 2) прогрессирующий пигментный ретинит, 3) прогрессирующий тетрапарез, 4) выраженное прогрессирующее слабоумие, 5) умеренную нейросенсорную глухоту.
Синдром Маршалла: близорукость, катаракта, седловидный нос и глухота
Синдром Рефсума: наследственная атаксическая полинейропатия с глухотой
Клинические данные. Данные осмотра. Больные обычно выглядят здоровыми до второго десятилетня жизни, когда становятся заметными мышечные атрофии и слабость, а также нарушения зрения. Эти расстройства медленно прогрессируют у взрослых. Состояние может резко ухудшиться в связи с беременностью (Fryer et al.).
Орган зрения. Потеря зрения является, по-видимому, одним из первых проявлений синдрома. Впервые отмечающаяся в начале второго десятилетия жизни ночная слепота медленно прогрессирует, приводя к концу этого периода к серьезным нарушениям зрения. Поля зрения медленно сужаются. Реакция зрачков становится замедленной. Постоянными симптомами являются миоз и гемералопия.
Офтальмологическое исследование выявляет бледность диска зрительного нерва и умеренное увеличение пигмента, более заметное в макулярной области и на периферии сетчатки. Сосуды сетчатки сужены. В 80% случаев наблюдаются задние катаракты (Richterich et al.), относительно часты также нистагм и анизокория (Fryer et al.).
Нервная система. В детстве или в молодости появляются атаксия и общая мышечная слабость, поражающие главным образом ноги, а позже и руки. Мышечные атрофии и параличи медленно прогрессируют и более заметны в дистальпых отделах конечностей. В детстве нарушение чувствительности к булавочным уколам и прикосновениям отмечается только в дистальных отделах конечностей, впоследствии оно, прогрессируя, ведет к расстройствам вибрационной и позиционной чувствительности. Сухожильные рефлексы снижены.
Постепенно развивается полная арефлексия. У большей части больных отмечается патологическая пальце-носовая проба и положительная проба Ромберга.
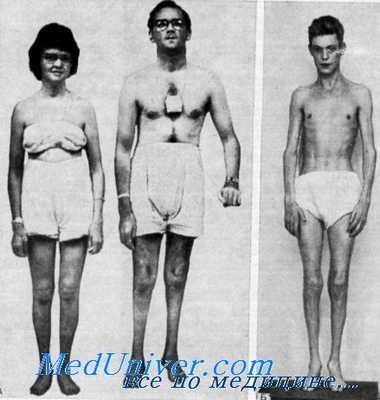
При обзоре данных о 37 случаях публикации Richterich с сотр. нашли следующие симптомы в порядке убывающей частоты: аносмия, парестезия, боль, утрата поверхностных рефлексов, наружная врожденная офтальмоплегия, иальпируемость периферических нервов.
Сердечно-сосудистая система. У 20 из 25 обследованных больных отмечались заболевания сердца. Клинические данные включали тахикардию, ритм галопа, систолический шум, расширение сердца и сердечную недостаточность (Richterich et al.).
Электрокардиографическая патология, такая, как увеличение интервала Р — Q, узловые или предсердные экстрасистолы и изменения комплекса QRS, отмечалась почти у 35% больных.
Костная система. Почти у 75% больных были выявлены некоторые виды костной патологии. Наиболее часто встречались спондилиты, экзостозы грудины, кифосколиоз, молоткообразное искривление пальцев ног и полая стопа. Были случайно обнаружены и такие аномалии, как укорочение нескольких пястных н плюсневых костей или клешнеобразная рука (Richterich et al.).
Кожные покровы. Почти у 60% молодых больных наблюдается легкий ихтиоз.
Орган слуха. У 34 из 44 больных с синдромом Рефсума Bergsmark и Djupesland обнаружили нейросенсорную глухоту. Часто снижение слуха на одной стороне было более глубоким, чем на другой. Степень глухоты у разных больных слегка варьировала. Потеря слуха наиболее часто начиналась во втором и третьем десятилетиях жизни и медленно прогрессировала, захватывая главным образом высокие частоты, tone-decay-тест и тест на различение речи были нормальными.
Вестибулярная система. Колорические вестибулярные пробы были нормальными (Fleming, Bergsmark, Djupesland).
Синдром Маршалла ( PFAPA-синдром )
Синдром Маршалла (PFAPA-синдром) – это заболевание преимущественно детского возраста, включающее периодическую лихорадку, афтозный стоматит, фарингит, шейную лимфаденопатию. Симптомами являются регулярно повторяющиеся эпизоды повышения температуры выше 39˚С, боли в горле, язвенные поражение слизистой рта, увеличение шейных лимфоузлов. Диагноз устанавливается на основании клиники, анализов крови, посевов отделяемого из зева, исключения других возможных причин рецидивирующей лихорадки. Лечение ограничено глюкокортикоидами или жаропонижающими препаратами, так как антибиотики и противовирусные средства неэффективны. В редких случаях проводится тонзиллэктомия.
МКБ-10
Общие сведения
В 1987 году американским педиатром Г.Маршаллом и соавторами описана ранее неизвестная периодическая лихорадка, которая первоначально была названа синдромом Маршалла. В современных источниках используется название PFAPA-синдром как аббревиатура симптомов, включающих периодическую лихорадку (periodic fever), афтозный стоматит (aphthous stomatitis), фарингит (pharingitis), шейный лимфаденит (cervical adenitis). Распространенность и заболеваемость точно неизвестны. Дебют патологии отмечается в возрасте от 1 до 5 лет и, как правило, к подростковому периоду симптоматика разрешается. В последнее время появились данные о возможности развития PFAPA-синдрома у взрослых. Среди заболевших преобладают мужчины (55-70%).
Причины синдрома Маршалла
Этиология остается неизвестной. Сегодня PFAPA-синдром рассматривается как полигенное или мультифакториальное заболевание, при котором модифицирующую роль играют генетические, средовые факторы, возможные особенности реагирования организма на инфекцию. У 7-10% пациентов выявляются мутации гена MEFV, который участвует в образовании белка пирина гранулоцитами, моноцитами, дендритными клетками, фибробластами кожи, брюшины и синовиальной оболочки. Его предполагаемая функция состоит в снижении воспалительного ответа путем ингибирования активации и хемотаксиса нейтрофилов. Выявляются мутации TNFRSF1A, МВК, гена, кодирующего белок NLRP3.
Цитокиновый профиль при данной патологии позволяет отметить повышение сывороточных уровней интерлейкина-1β (ИЛ-1β), ТNFα, ИЛ-6, ИЛ12р70, в том числе в период между атаками, что указывает на постоянно текущее субклиническое воспаление. Определенный инфекционный агент не выделен, некоторые исследования указывают на возможное участие вирусов Эпштейна-Барр, простого герпеса 1, 2 типов и цитомегаловируса, а также редких бактериальных агентов: Муcobacterium chelonae (микобактерии хелона), Plasmodium (плазмодии), Borrelia (боррелии), Brucella (бруцеллы). У части исследуемых больных выявляется дефицит витамина D.
Патогенез
Точный патогенез не установлен. Современные исследователи относят PFAPA-синдром к системным аутовоспалительным заболеваниям. Их отличием от аутоиммунных являются генетически обусловленные особенности протекания воспалительной реакции и реагирования иммунитета, а не механизмы синтеза антител и активации Т-лимфоцитов при контакте с антигеном. Наличие мутации гена MEFV ведет к синтезу дефектного пирина, который в норме ослабляет и ингибирует чрезмерную восприимчивость организма, а в измененном виде приводит к дефициту ингибитора хемотаксического фактора С5а, что нарушает функцию контроля процесса воспаления.
Ген NLRP3 кодирует белок криопирин, при его мутации моноциты под влиянием разнообразных триггеров начинают синтезировать огромное количество ИЛ-1β. В норме иммунная система способна защитить себя от избытка данного цитокина. При PFAPA-синдроме эта регуляция нарушена, вследствие чего развивается клиническая картина, так как интерлейкин-1β ответственен не только за гипертермию, но и за повреждение, ремоделирование тканей, повышенный уровень маркеров системного воспаления.
Симптомы синдрома Маршалла
Клиническая картина представляет собой лихорадочные эпизоды, которые повторяются каждые 2-12 недель (средний цикл 28 дней). Температура чаще повышается внезапно, лихорадка достигает высоких цифр (от 40 до 41°C). Иногда за сутки перед повышением температуры появляется общая слабость, астения, снижение аппетита. Затем присоединяется афтозный стоматит, при котором появляются мелкие (до 5 мм) язвенные поражения слизистой полости рта – афты. Фарингит характеризуется болью в горле, гиперемией слизистой глотки. В типичных случаях развивается шейный лимфаденит – лимфоузлы в области шеи увеличиваются, становятся болезненными при пальпации.
В 43-48% наблюдений симптомы возникают все вместе, чаще всего встречается стоматит (55%). Крайне редко пациентов беспокоит головная боль, тошнота, рвота, вздутие живота. На 4-5 сутки температура тела нормализуется, воспалительные явления разрешаются. Интервалы между атаками составляют от 2 до 7 недель. Со временем межприступные промежутки могут удлиняться. Особенностью протекания лихорадки является то, что при температуре 40°C общее самочувствие детей остается относительно удовлетворительным. Между эпизодами восстанавливается аппетит, набирается потерянная масса тела. Рост, общее психоэмоциональное развитие не страдает. Течение заболевания доброкачественное, атаки обычно прекращаются к подростковому возрасту. Описание дебютов синдрома Маршалла во взрослом возрасте делает его актуальным не только для педиатрии.
Осложнения
Осложнений синдрома Маршалла описано не было. Долгосрочных исследований у пациентов не проводилось. Однако на фоне афтозного стоматита, фарингита возможно присоединение вторичной инфекции, что может привести к развитию тонзиллита, заглоточного абсцесса, отита, гнойного медиастинита. Длительно текущий воспалительный процесс повышает риск возникновения амилоидоза. Кроме того, рецидивирующие эпизоды лихорадки оказывают изнуряющее действие, вынуждают ребенка пропускать школьные занятия, могут привести к неуспеваемости.
Диагностика
Для постановки диагноза PFAPA-синдрома используют диагностические критерии, предложенные Маршаллом (1987 г.): регулярно повторяющиеся лихорадки с раннего возраста (начало 2-5 лет); присутствие одного из следующих клинических признаков: афтозный стоматит, шейный лимфаденит, фарингит; полностью бессимптомный интервал между эпизодами лихорадки; нормальное физическое и нервно-психическое развитие ребенка; отсутствие циклической нейтропении. На данный момент нет специфических анализов для установления синдрома Маршалла. Диагностический поиск включает:
- Консультацию педиатра, ревматолога. Производится детальный сбор анамнеза пациента: история течения беременности и родов у матери, наследственность, особенности питания, роста, развития ребенка, перенесенные заболевания, информация о вакцинации, наличие или отсутствие контакта с инфекционными больными. Осматриваются слизистые оболочки щёк, глотки, миндалин; проводится аускультация сердца, легких, измерение АД, пульса; пальпация живота, лимфоузлов.
- Клинико-биохимические анализы. В период лихорадки общий анализ крови выявляет лейкоцитоз с повышением нейтрофилов, ускорение СОЭ. В периоды между приступами все воспалительные параметры нормализуются. Также во время атак повышается уровень С-реактивного белка, печеночные ферменты не изменены. Анализ крови на 25-OH может выявлять дефицит витамина Д3- холекальциферола. IgG, IgA, IgM, IgD, прокальцитонин, антинуклеарные антитела, ревматоидный фактор даже при повышении температуры тела остаются нормальными.
- Дополнительные исследования. Посев отделяемого из верхних дыхательных путей на микрофлору и чувствительность к антибиотикам, посев мочи, крови на стерильность (на высоте лихорадки), рентгенография органов грудной клетки, придаточных пазух носа выполняются для исключения инфекционной природы лихорадки. При синдроме Маршалла патологических изменений при данных исследованиях не выявляется.
Дифференциальный диагноз синдрома Маршалла проводят со следующими нозологиями: возвратный тонзиллит, инфекционные заболевания, ювенильный идиопатический артрит, циклическая нейтропения, семейная средиземноморская лихорадка (FMF), синдром гиперглобулинемии D, болезнь Бехчета.
Лечение синдрома Маршалла
Методы лечения все еще являются предметом споров. Антибиотикотерапия, применение противовирусных, антигистаминных препаратов не имеют эффективности; НПВС обладают только кратковременным жаропонижающим эффектом. На сегодняшний день для терапии PFAPA-синдрома успешно используются:
- Кортикостероиды. Одна или две дозы преднизолона (1-2 мг/кг), бетаметазона (0,1-0,2 мг/кг) могут резко прекратить приступы лихорадки в течение нескольких часов. Другие сопутствующие симптомы требуют больше времени для разрешения. Стероиды применяются только во время приступов, указанные дозировки не вызывают токсических эффектов. Глюкокортикоидная терапия способна сократить интервал между приступами, но не предотвращает рецидивы.
- Колхицин. Может быть эффективным для предотвращения частых эпизодов лихорадки, на течение лихорадочного периода он не влияет. Побочным эффектом являются желудочно-кишечные расстройства (в 20% случаев). Было проведено несколько исследований данного препарата, причем большинство из них – в Израиле, где большая доля пациентов несут патогенные варианты MEFV.
- Циметидин. В исследованиях на небольших группах примерно четверть пациентов (24-27%) имели полное разрешение эпизодов лихорадки при его приеме, а еще 24-32% сообщили о частичной эффективности с уменьшением частоты или тяжести приступов.
- Анакинра. В настоящее время в качестве экспериментальной терапии рассматриваются рекомбинантные антагонисты рецептора интерлейкина-1β (анакинра), проводятся исследования данной группы препаратов. Все пациенты продемонстрировали клиническое улучшение, снижение уровня цитокинов в крови.
- Тонзиллэктомия. Является радикальным методом, который приводит к полному излечению. Операция должна выполняться только в случае непереносимости или неэффективности стандартной лекарственной терапии в связи с определенными рисками инвазивного вмешательства (кровотечение, осложнения анестезии).
Прогноз и профилактика
Все проявления синдрома Маршалла обычно самостоятельно разрешаются до подросткового возраста. Фатальные последствия и серьезные осложнения в литературе не описаны. Несмотря на благоприятный прогноз, при появлении схожих жалоб необходимо обратиться к детским специалистам (педиатру, отоларингологу, стоматологу) для обследования, установления диагноза и подбора адекватной терапии. Специфических методов профилактики не существует. Пациентам, страдающим данным синдромом, рекомендовано применять витамин Д3 в дозе 400 МЕ в зимнее время.
1. Клинико-лабораторная характеристика детей с синдромомм Маршалла/ Жданова Л.В., Бимбаев А. Б-Ж.// Вестник Бурятского государственного университета. - 2017.
2. Случай трудной диагностики больной с синдромом Маршалла/ Сафина А.И., Лутфуллин И.Я., Закиров К.З, Шапиро В.Ю.// Казанский медицинский журнал. - 2001.
3. Синдром периодической лихорадки, афтозного стоматита, фарингита и шейного лимфаденита (синдром Маршалла)/ Таточенко В.К. и соавт.// Вопросы современной педиатрии. - 2003.
В семье, описанной Маршаллом (Marshall), у 7 членов в четырех поколениях был выявлен синдром, включающий дефект в виде седловидного носа, врожденную или юношескую катаракту, миопию и нейросенсорную глухоту. Другая семья была описана Ruppert, Buerk и Pfordrescher. Zellweger, Smith и Grutzner изучили этот же самый синдром у матери и у нескольких ее детей. Случаи, описанные Keith с соавт., являются менее определенными.
Клинические данные. Данные осмотра. Лицо характеризуется маленьким носом с запавшим переносьем, вывернутыми вперед ноздрями и резко гипопластичной средней частью лица.
Орган зрения. Снижение остроты зрения обычно отмечается во втором десятилетии жизни, но у одного больного, описанного Ruppert с соавт., и у одного мальчика, изученного Marshall, нарушения зрения были отмечены в первые б мес жизни. Заднее полярное кортикальное и субкапсулярное помутнение, которое спонтанно рассосалось, было отмечено во втором, третьем и четвертом десятилетиях (наблюдение Marshall) и в первом десятилетии жизни (наблюдение Ruppert et al.,).
Отслойка сетчатки наблюдалась у одного больного (наблюдение Marshall) и у отца пробанда в 14-летнем возрасте, описанного Ruppert.
Орган слуха. В семье, изученной Marshall, ряд лиц сообщили о нарушении слуха с детства. Потеря слуха прогрессировала и вызвала необходимость пользоваться слуховыми аппаратами. Аудиометрические исследования обнаружили у нескольких больных смешанную, главным образом нейросенсорную, глухоту (около 50 дБ). Ruppert с сотрудниками выявили у одного ребенка глубокую глухоту в 9-месячном возрасте. К 6 годам глухота не выглядела прогрессирующей. У отца больного была обнаружена умеренная высокочастотная глухота.
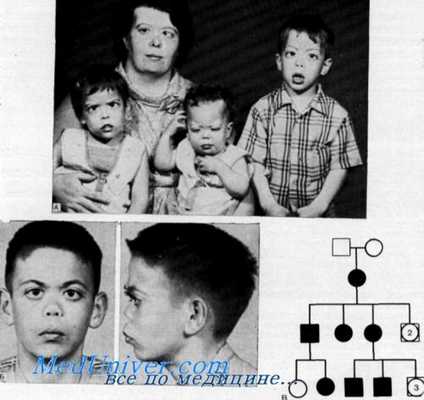
Мионатия, катаракта, седловидный нос и псйросснсорная глухота (синдром Маршалла). Сходство черт лица у матери и у трех ее больных детей (из Н. Zellweger el al., J. Pediatr.). (Б) Детали лица: маленький нос, запавшее переносье и вывернутые пперед ноздри. Обратите внимание на то, что оба глаза видны сбоку (из D. Marshall, Am. J. Ophthalmol.). Родословная пораженной семьи из статьи Д. Маршалла.
Zellweger с соавторами сообщили о нейросенсорной глухоте в диапазоне 30—60 дБ у больных членов описанной ими семьи.
Вестибулярная система. Ruppert с сотрудниками сообщили о нормальных вестибулярных реакциях.
Лабораторные данные. Рентгенограммы. Рентгенографическое исследование обнаружило гипоплазию костей носа, гипоплазию верхней челюсти, отсутствие лобных синусов и утолщение наружной пластинки черепа. O'Donnell с сотр. отметили внутричерепную кальцификацию, клювовидные или пулевидные позвонки у детей, заметную вогнутость краев позвонков у взрослых, маленький неправильной формы таз с задержанным смыканием лонных и седалищных костей, вальгусную деформацию бедер, легкую изогнутость лучевой и локтевой костей, а также некоторую неправильность эпифизов конечностей.
Наследственность. Заболевание встречается в нескольких поколениях и отчетливо наследуется по доминантному типу. Однако пока еще не имеется примеров передачи синдрома от мужчины к мужчине, поэтому нельзя исключить Х-сценленное наследование.
Диагноз. Седловидный нос может наблюдаться при врожденном сифилисе, акродизостозе и точечной хондродисплазии. Близорукость может встречаться как изолированная патология, наследующаяся по аутосомно-рецессивному или по аутосомпо-доминантному типу, а также как компонент многочисленных синдромов, таких, как Х-сцепленпая миопия и наружная офтальмоплегия, аутосомпо-доминантная спондилоэпифизарная дисплазия, синдром Альпорта, пли наследственная прогрессирующая артроофтальмопатия (Waardenburg et al., McKusick).
Лечение. Необходимо удалить катаракту и использовать слуховые аппараты. Гипоплазия средней части лица может быть неправлена челюстно-лицевой хирургией, если такая, являющаяся чисто косметической, коррекция желательна для больного.
Прогноз. Глухота прогрессирует.
Выводы. Характеристика этого синдрома включает: 1) аутосомно-доминантное наследование; 2) резкую миопию; 3) врожденную или юношескую катаракту; 4) седловидный нос; 5) различные скелетные аномалии и 6) рано выявляющуюся прогрессирующую умеренную нейросенсорную глухоту.
Синдром Ушера ( Синдром Ашера )
Синдром Ушера – это редко встречающееся генетическое заболевание, протекающее с врожденной сенсоневральной тугоухостью, прогрессирующим пигментным ретинитом и вестибулярной атаксией. В зависимости от типа синдрома у пациентов присутствуют следующие признаки: значительная потеря слуха либо глухота, снижение зрения, нарушение равновесия, когнитивные расстройства. Диагностика включает офтальмологическое (визометрия, офтальмоскопия, электроретинография), отоневрологическое (аудиометрия, вестибулярные пробы), генетическое обследование. Лечение направлено на коррекцию слуха (слухопротезирование, КИ), поддержание зрения (вит. А, Е, омега-3).
Синдром Ушера (синдром Ашера) – самая частая причина наследственной слепоглухоты. Его распространенность в популяции оценивается в 3,2-6,2 случая на 100 тыс. населения (по другим данным – 1:6000). Наибольшая заболеваемость отмечается среди евреев-ашкенази, франкоканадцев, испанских аргентинцев, финнов и др. «Первооткрывателем» заболевания считается германский офтальмолог А. фон Грефе. Однако свое «имя» синдром получил в честь британского окулиста Ч. Ушера, который в 1914 г. указал на наследственный характер болезни. Молекулярно-генетические механизмы синдрома были расшифрованы в 1995 г., что открыло широкие возможности для его изучения.
Причины
В настоящее время известно более десятка генов, дефекты которых могут привести к развитию синдрома Ушера. Все эти гены, несмотря на разную локализацию и функцию, входят в состав трансмембранного белкового комплекса, участвующего в перемещении миозина, функционировании фоторецепторов сетчатки, а также волосковых клеток улитки. Наиболее часто мутации обнаруживаются в следующих генах:
- CDH23 – «ген глухоты», кодирует белок кадгерин-23;
- MYO7A – ген миозина VIIA;
- PCDH15 – ген протокадгерина-15;
- USH1С – ген гармонина;
- USH1G – ген анкириноподобного белка;
- USH2A – ген ушерина;
- ADGRV1 - ген адгезии G-белка;
- CLRN1 – ген кларина-1 и др.
Синдром Ушера наследуется аутосомно-рецессивным путем от обоих родителей, являющихся носителями дефектных генов. Чаще болеют представители закрытых этнических групп, среди которых достаточно часты близкородственные браки.
Белковые продукты, кодируемые названными генами, принимают непосредственное участие в развитии и функционировании рецепторного аппарата сетчатки глаза и внутреннего уха. Генетические мутации приводят к нарушению формирования воспринимающего аппарата – фоторецепторов и волосковых клеток, что сопровождается врожденными или рано дебютирующими нарушениями зрительной, слуховой и вестибулярной функции.
При синдроме Ушера на глазном дне накапливаются гранулы пигмента, которые распространяются от центра к периферии. Со временем происходит сужение полей и снижение остроты зрения. Патология также затрагивает структуры внутреннего уха: отмечается атрофия спирального узла, нервных волокон кортиева органа, сосудистой полоски улитки.
Классификация
Синдром Ушера генетически неоднороден. Выделяют 4 клинических подтипа, различающихся молекулярно-генетическими механизмами, возрастом манифестации и выраженностью симптоматики:
- Тип 1. Сопряжен с мутациями в генах MYO7A, CDH23, PCDH15, USH1G, USH1C. Протекает наиболее тяжело. Характерна врожденная глухота или глубокая тугоухость. Вестибулярные нарушения и признаки пигментного ретинита развиваются до 5 лет. Составляет около 30% всех случаев.
- Тип 2. Вызывается мутациями USH2A, DFNB31, ADGRV1. Сопровождается непрогрессирующей тугоухостью, ухудшением зрения после 10 лет. Вестибулярная функция не нарушена. Диагностируется примерно у 60% пациентов.
- Тип 3. Связан с мутациями гена CLRN1. Протекает с постепенным ухудшением слуха и зрения, часто – с вестибулярной дисфункцией. Изменения сетчатки развиваются после 20 лет. Выявляется у 3% больных.
- Тип 4. Атипичный вариант синдрома Ушера. Обусловлен дефектами генов HARS, PDZD7, CEP250, C2orf71, может наследоваться Х-сцеплено.
Симптомы
Классическая клиническая картина развивается при 1-м типе синдрома Ушера. Уже в раннем детстве у ребенка диагностируется тяжелая сенсоневральная тугоухость или полная глухота. Наблюдается задержка психомоторного развития, дети поздно начинают ходить. В дошкольном возрасте обнаруживается зрительная дисфункция: в результате усугубления пигментного ретинита быстро ухудшается периферическое зрение, развивается ночная слепота (гемералопия). Это проявляется затруднением ориентации в темноте, частыми спотыканиями, столкновениями с препятствием (другой человек, дверной проем, мебель).
Возникают вестибулярные расстройства: головокружение, нарушение равновесия, атактическая походка. В некоторых случаях может отмечаться когнитивный дефицит, психозы. При других типах болезни Ушера зрительные и слуховые нарушения развиваются позднее и выражены в меньшей степени; вестибулярный синдром не отмечается.
Нейросенсорная тугоухость и постепенная утрата зрения приводят к глубокой инвалидизации. Дети с синдромом Ушера нуждаются в специальном обучении, психолого-педагогическом сопровождении, создании безопасной окружающей среды. Вестибулярные нарушения могут провоцировать падения, повышать риск травматизма. Вторично страдает речь и интеллектуальная сфера. Одним из частых осложнений является катаракта. Прогрессивное снижение зрения приводит к тому, что к 40–50 годам больные синдромом Ушера могут полностью ослепнуть. В тяжелых случаях возникает слепоглухота.
Поскольку нарушения при синдроме Ушера затрагивают несколько анатомо-функциональных систем, диагностика должна носить мультидисциплинарный подход. Больным необходимы консультации отоларинголога, офтальмолога, генетика, проведение комплексного инструментально-лабораторного обследования:
- Офтальмологический осмотр.Визометрия и осмотр глазного дна не всегда позволяют обнаружить начальные признаки пигментной дегенерации сетчатки. В этом отношении наиболее чувствительным тестом является электроретинография, выявляющая изменения еще на доклиническом уровне. По результатам периметрии отмечается концентрическое сужение полей зрения.
- Исследование слуха. Степень снижения слуха устанавливается с помощью аудиометрии. Дополнительно регистрируется отоакустическая эмиссия, стволовые ВП, проводится электрокохлеарография. Больного осматривает врач-сурдолог.
- Исследование вестибулярного анализатора. Для выявления вестибулярных нарушений выполняется видеонистагмография, вестибулометрические пробы.
- Генодиагностика. Проводится секвенирование образцов генетического материала пациента. На основе обнаруженных изменений определяется генетический вариант синдрома Ушера. Также необходимо медико-генетическое консультирование членов семьи.
Дифференциальная диагностика
Синдром Ушера необходимо отличать от других синдромальных и несиндромальных форм глухоты и слепоты, развивающихся при:
- врожденной краснухе – врожденная тугоухость, катаракта, ВПС;
- синдроме Альстрема – дегенерация сетчатки, сенсоневральная тугоухость, ожирение, СД, кардиомиопатия, нефропатия;
- синдроме Халлгрена (акустико-ретино-церебеллярной дегенерации) – пигментный ретинит, катаракта, тугоухость, мозжечковый синдром.
Лечение синдрома Ушера
Консервативная терапия
На сегодняшний день методов полного излечения заболевания не разработано. Все предпринимаемые меры направлены на компенсацию нарушенных функций и замедление течения патологии. Больным синдромом Ушера рекомендовано проведение ежегодных поддерживающих курсов медикаментозной терапии, включающей ноотропы, сосудорасширяющие препараты, антиоксиданты. С целью торможения прогрессирования пигментного ретинита рекомендуется прием больших доз ретинола пальмитата, соблюдение диеты, богатой содержанием витаминов А, Е, ПНЖК.
Способ коррекции слуховой функции подбирается индивидуально. Выбор может быть сделан в пользу слухового протезирования или установки кохлеарного импланта. Для адаптации детей с синдром Ушера к жизни в социуме важна помощь психологов, сурдопедагогов.
Экспериментальное лечение
Сообщается о разработке генной терапии для больных с синдромом Ушера 1 типа. Клинические испытания проходит препарат UshStat, который представляет собой лентивирусный вектор для доставки неповрежденного гена MYO7A. Предполагается субретинальное введение UshStat с целью восстановления функции зрения.
Качество жизни пациентов с синдромом Ушера значительно страдает из-за проблем со зрением и слухом. Около 50% лиц с 1-м и 70% со 2-м типом заболевания сохраняют остроту зрения от 20 до 40% на обоих или одном глазу. Больным необходимо пожизненное соблюдение диеты, защита глаз от ультрафиолета. Профилактика заключается в проведении генетических консультаций и лабораторного тестирования в семьях, где имеются случаи данного заболевания. Возможна пренатальная диагностика синдрома Ушера.
1. Изучение интерактома при синдроме Ашера в российской популяции для выбора приоритетных патогенетически ориентированных терапевтических подходов/ Иванова М.Е , Атарщиков Д.С. , Демчинский А.М. , Стрельников В.В. , Бар Д. , Порядин Г.В. , Балашова Л.М. , Салмаси Ж.М.// РМЖ «Клиническая Офтальмология». – 2019. - №4.
3. Этиологические аспекты врожденной тугоухости/ Коноплев О.И. и др./ Медицинский вестник Северного Кавказа. – 2019.
Читайте также:
