Синоназальный аденокистозный рак - лучевая диагностика
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Аденокистозный рак представляет собой достаточно редкое заболевание. Он образуется из клеток эпителиальной ткани, которая выстилает просветы выводных желез. Следовательно, данная разновидность злокачественных опухолей может развиваться лишь в некоторых органах. Наиболее часто поражаются слюнные железы, трахея, бронхи, пищевод, шейка матки, верхние дыхательные пути, молочные железы.
Особенности аденокистозного рака
Для каждой локализации опухоли характерны определенные особенности. Например, среди органов дыхательной системы аденокистозный рак в трахее выявляется в два раза чаще, чем в бронхах. Первичная опухоль локализуется на ее боковой и задней стенке. Отдаленные метастазы в регионарных лимфатических узлах выявляются в 30-50% случаев. Аденокистозный рак не связан с курением. Наиболее частыми причинами его развития являются:
- Генетическая предрасположенность.
- Воздействие некоторых канцерогенов.
- Частые инфекции дыхательных путей.
Опухоль характеризуется экзофитным ростом. Во время диагностики определяется новообразование бугристой структуры, которое выступает в просвет трахеи или бронха. В некоторых случаях опухоль имеет вид полипа.
Характерные особенности присущи и для аденокистозного рака других локализаций. Врач должен помнить и учитывать их при осмотре пациента, составлении плана диагностики и лечения.

Клинические проявления
Специфические симптомы аденокистозного рака любой локализации отсутствуют. Пациенты могут предъявлять стандартные жалобы на боль, слабость, плохой аппетит. Как и при других видах злокачественных опухолей, на первых стадиях часто не отмечается никаких симптомов. По мере прогрессирования, клиническая картина становится более отчетливой.
- При поражении слюнных желез отмечается появление опухолевидного образования в области щеки или слизистых оболочек полости рта. При этом отмечается онемение и нарушение двигательной функции лицевых мышц, воспалительные процессы в слюнной железе.
- При аденокистозном раке трахеи и бронхов пациентов беспокоит одышка, кашель (сухой или с мокротой, в которой могут определяться прожилки крови), осиплость голоса, свистящие звуки во время дыхания.
- Если поражается молочная железа, то женщины могут отмечать небольшое объемное образование, которое при надавливании может быть болезненным. В некоторых случаях отмечаются патологические выделения из сосков, изменение кожи в области опухоли.
На поздних стадиях рака клиническая картина дополняется выраженным похудением, постоянно повышенной температурой тела и др.
Методы диагностики
Для того чтобы выявить очаг рака, определить его размер, точную локализацию и особенности роста, пациенту назначается комплексное обследование. Важное место в нем занимают методы визуальной оценки опухоли. К ним относятся:
- Бронхоскопия.
- Эзофагогастроскопия.
- Ультразвуковая диагностика.
- Магнитно-резонансная и компьютерная томография.
- Рентгенография и др.
Однако поставить точный диагноз после визуализации рака невозможно, поэтому дополнительно назначаются и другие методы диагностики, например, биопсия, молекулярно-генетические и лабораторные исследования, диагностические операции и др.
Особенности лечения аденокистозного рака
Выбор метода лечения во многом зависит от стадии опухолевого процесса. Если рак выявлен на 1-2 стадии, то предпочтение отдается радикальному хирургическому лечению, которое подразумевает удаление опухоли в пределах здоровых тканей или полное удаление органа. При наличии показаний проводится лимфодиссекция (удаление регионарных лимфоузлов).
Аденокистозный рак считается умеренно чувствительным к лучевой терапии, поэтому ее редко используют в качестве единственного метода лечения. Однако при комбинации с хирургическим вмешательством лучевая терапия может оказаться достаточно эффективной. Ее активно применяют в таком сочетании при лечении аденокистозного рака слюнных желез средней и низкой степени дифференцировки. Также комбинация дистанционной лучевой терапии и хирургического вмешательства применяется в тех случаях, когда выявляются дополнительные неблагоприятные признаки:
- Периневральная инвазия.
- Нарушение капсулы слюнной железы.
- Положительные края резекции.
Химиолучевую терапию применяют на поздних стадиях аденокистозного рака при наличии отдаленных метастазов в лимфатических узлах или органах. Схемы лечения подбираются индивидуально.

После проведенного лечения пациент должен регулярно наблюдаться у онколога. Причем в первые 1-2 года консультироваться у специалиста и проходить специальное обследование необходимо каждые 3-6 месяцев, а затем не реже двух раз в год. Если отмечается высокий риск рецидива рака, то врач может назначить индивидуальный график консультаций.
Прогноз
Существует прямая связь между прогнозом заболевания, его стадией, общим состоянием здоровья пациента и его ответом на проведенное лечение. Например, 5-летняя выживаемость после радикального лечения аденокистозного рака трахеи на начальных стадиях составляет 65-85%, что является очень хорошим показателем. Если лечение проводится на более поздних стадиях, и при этом применяют радикальные операции в сочетании с лучевой терапией, то вероятность прожить 10 лет составляет около 25%.
Самые худшие показатели выживаемости при аденокистозном раке отмечаются при запущенных случаях либо при агрессивных видах опухолей, которые плохо поддаются лечению. Продолжительность жизни таких пациентов может не превышать и года, но, к счастью, на практике такие примеры встречаются очень редко.
Синоназальный аденокистозный рак - лучевая диагностика
а) Терминология:
1. Аббревиатура:
• Аденокистозный рак (АКР)
2. Определение:
• Слюнной тип синоназальной аденокарциномы
б) Визуализация:
• Лучший диагностический критерий:
о Плохо отграниченное объемное образование верхнечелюстной пазухи или полости носа с периневральным распространением (ПНРО)
• Локализация:
о Верхнечелюстная пазуха: 47%, полость носа: 30%, решетчатая пазуха: 11 %, сфеноидальная пазуха: 5%, решетчатая пазуха: 2%
• Размер:
о Большой (> 4 см) при обнаружении
• Морфология:
о Четкие контуры (низкая степень злокачественности) - расплывчатые контуры (высокая степень злокачественности)
1. Рекомендации по визуализации:
• Лучший метод визуализации:
о Мультипланарная МРТ с контрастом на основе гадолиния
• Выбор протокола:
о Жироподавление на постконтрастных последовательностях позволяет повысить выявляемость ПНРО
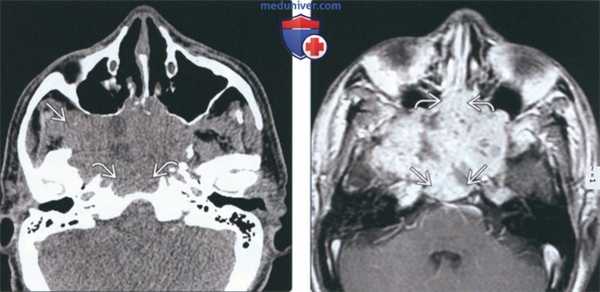
(Слева) На аксиальной КТ без КУ в сфеноидальных пазухах определяется большое мягкотканное образование неоднородной плотности, распространяющееся кнаружи в правую подвисочную ямку и кзади в скат. Картина типична для поздней стадии Т синоназального аденокистозного рака (АКР).
(Справа) На аксиальной MPT (Т1 ВИ С+) у этого же пациента определяется диффузное неоднородное контрастирование опухоли с обширной инвазией ската и распространением в полость носа.
2. КТ при аденокистозном раке носа и околоносовых пазух:
• КТ с КУ:
о Низкая степень злокачественности: солидное контрастирующееся мягкотканное образование с четкими контурами
о Большие образования высокой степени злокачественности хуже отграничены и неравномерно накапливают контраст
• КТ в костном окне:
о Опухоли низкой степени злокачественности могут приводить к ремоделированию костей
о Опухоли высокой степени злокачественности приводят к инфильтрации и выраженной деструкции костей
3. МРТ при аденокистозном раке носа и околоносовых пазух:
• Т1 ВИ:
о Сигнал низкой —промежуточной интенсивности (аналогичный мышцам)
• Т2 ВИ:
о Неоднородный промежуточный сигнал (> мышц); низкодифференцированные образования — ниже Т2 сигнал
• Т1 ВИ С+ FS:
о Диффузное контрастирование, более неравномерное в низкодифференцированных опухолях
о Утолщение и контрастное усиление ближайших нервов (особенно V2) означает ПНРО
в) Дифференциальная диагностика аденокистозного рака носа и околоносовых пазух:
1. Синоназальный плоскоклеточный рак:
• Преимущественное поражение верхнечелюстной пазухи
• Агрессивная деструкция кости
• Лучевые признаки могут быть идентичны АКР
2. Синоназальная аденокарцинома (интестинальный тип):
• Склонность к поражению решетчатых пазух
• Менее вероятно ПНРО
3. Эстезионейробластома:
• Возникает в верхних отделах полости носа
4. Недифференцированный синоназальный рак:
• Агрессивнее, чем АКР обладает более быстрым ростом
5. Злокачественная опухоль малой слюнной железы твердого неба:
• Опухоль распространяется в верхнечелюстную пазуху, а не растет из нее
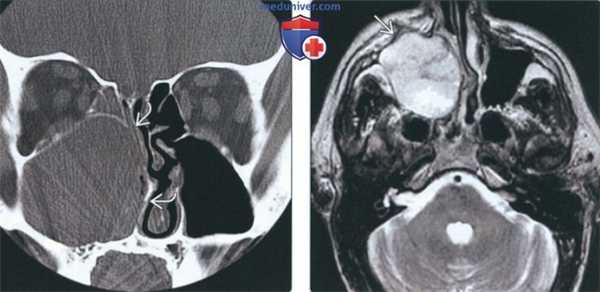
(Слева) На корональной КТ в костном окне определяется снижение пневматизации правой верхнечелюстной пазухи, обусловленное большим экспансивным АКР. Внутренняя стенка верхнечелюстной пазухи разрушена; объемное образование распространяется в полость носа. Обратите внимание на отклонение носовой перегородки влево.
(Справа) На аксиальной МРТ (Т2ВИ) у этого же пациента визуализируется объемное образование с неоднородным сигналом во всех отделах, минимально распространяющееся в предчелюстные мягкие ткани. Четкие края опухоли позволяют предположить более низкую степень злокачеавенности АКР.
г) Патология:
1. Общая характеристика:
• Сопутствующие нарушения
о Склонность к ПНРО и инвазии костей
2. Стадирование, градации, классификация аденокистозного рака носа и околоносовых пазух:
• Три гистологических типа:
о Решетчатый (52%): лучшая выживаемость
о Тубулярно-трабекулярный (20%)
о Солидный (29%): наихудший исход, выше уровень ПНРО
• Стадирование осуществляется с использованием классификации TNM:
о У большинства пациентов опухоль проявляется на стадии Т4
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Обструкция носа, боль в лице, носовое кровотечение
• Другие признаки/симптомы:
о Выделения из носа, онемение в зоне иннервации V2, отек тканей лица и области рта, анопсия, аносмия, слезотечение, язвы в области рта
2. Демография:
• Возраст:
о От раннего подросткового до 80 лет (средний: 51 год)
• Этническая принадлежность:
о Чаще заболевают люди европейского происхождения
• Эпидемиология:
о Синоназальный АКР составляет 10-25% всех АКР головы и шеи, 1% злокачественных опухолей головы и шеи, 1,3-11,5% всех злокачественных опухолей синоназальной области
3. Течение и прогноз:
• Опухоль преимущественно обнаруживается на поздних стадиях из-за задержки диагностики и наличия симптомов, имитирующих синусит
• Общая пятилетняя выживаемость: 50-86%:
о Первичные опухоли полости носа: наилучшая выживаемость; опухоли сфеноидальной пазухи: наихудшая о Уровень рецидивов не зависит от возраста или гистопатоло-гического типа
о Уровень рецидивов выше при вовлечении кости
• Поздние рецидивы могут возникать даже > 15 лет спустя после изначального лечения
• Синоназальный АКР реже дает отдаленные метастазы, чем АКР другой локализации:
о Локальный рецидив: 52%, отдаленные метастазы: 40%, регионарная лимфаденопатия: 19%
4. Лечение:
• Хирургическое (резекция) + лучевая терапия после операции
ВПЧ — вирус папилломы человека
ОВ — общая выживаемость
ПЭТ — позитронно-эмиссионная томография
ТМО — твердая мозговая оболочка
EGFR — эпидермальный рецептор фактора роста опухолевых клеток
SNUС — синоназальная недифференцированная карцинома
TNM (аббревиатура от tumor, nodus, metastasis) — международная классификация стадий злокачественных новообразований
Краниофациальные (синоназальные) злокачественные новообразования, распространяющиеся в структуры основания черепа, являются редкими заболеваниями, на которые приходится от 3 до 5% злокачественных новообразований головы и шеи и от 0,2 до 0,8% всех опухолей [1]. Злокачественные опухоли этой локализации чаще всего имеют эпителиальное происхождение и, соответственно, неблагоприятный прогноз. К ним относятся плоскоклеточный рак, аденокарцинома, недифференцированный рак, нейроэндокринный рак, синоназальная недифференцированная карцинома (SNUC), аденокистозный рак и другие [2, 3].
Большинство публикаций [4—6] о лечении злокачественных новообразований основания черепа часто сочетают описание различных гистологических типов опухолей и различных схем лечения, что обусловливает отсутствие единых принятых протоколов лечения этой сложной категории пациентов, затрудняет принятие решения об оптимальной тактике их ведения.
Для прогнозирования исходов заболевания у пациентов с краниофациальными первичными злокачественными новообразованиями используется международная классификация стадий злокачественных новообразований TNM (аббревиатура от tumor, nodus, metastasis) [7]. Вовлечение в опухоль таких окружающих структур, как твердая мозговая оболочка (ТМО), черепные нервы, орбита и основная кость являются предикторами худших результатов. По данным H. Ziai и соавт. [8, 9], более чем в 50% случаев распространения опухоли в область основания черепа имеется прорастание ТМО, даже если по данным нейровизуализации этого не отмечается. На основании классификации TNM выстраиваются хирургическая тактика и последовательность применения хирургического, химиотерапевтического и лучевого лечения, но четких стандартов и рекомендаций в настоящее время нет. Несмотря на использование всех современных методов лечения первичного очага, частота метастазирования в локальные лимфоузлы составляет до 20% [10], при этом местные или отдаленные метастазы могут проявиться спустя несколько лет после лечения [11].
В ряде исследований [12, 13] показан лучший прогноз в исходах лечения плоскоклеточного рака основания черепа при выявлении вируса папилломы человека (ВПЧ), к сожалению, в настоящее время факт его наличия не учитывается при выборе тактики лечения пациентов с подобной патологией.
В нашем обзоре приведен анализ литературы, посвященной наиболее часто встречающимся краниофациальным злокачественным опухолям: это плоскоклеточный рак, аденокарцинома, синоназальная недифференцированная карцинома, эстезионейробластома, аденокистозный рак, синоназальная аденокарцинома.
Плоскоклеточный рак встречается чаще других первичных краниофациальных злокачественных опухолей и составляет 89% от всех типов рака этой локализации [14, 15]. Он может возникать либо из эпителия околоносовых пазух и полости носа, либо, примерно в 10%, в сочетании с инвертированными папилломами, т. е. трансформироваться из них [16], что не влияет на исход лечения [17, 18].
Синоназальный плоскоклеточный рак, поражающий структуры основания черепа, традиционно оперировали, используя открытые доступы (комбинированные трансфациальные и/или транскраниальные доступы для en bloc резекции) [19, 20]. При использовании открытых доступов в сочетании с адъювантной терапией 5-летняя общая выживаемость (ОВ) пациентов с плоскоклеточным раком колеблется от 43 до 59% [9, 19, 21—24].
За последнее десятилетие в нескольких центрах изучали роль эндоскопического эндоназального доступа при удалении злокачественных опухолей этой локализации [25—28]. Несмотря на то что традиционный принцип en bloc резекции в эндоскопической хирургии недостижим, исследования показали, что частичное удаление может давать сопоставимые онкологические результаты [20]. Однако следует отметить, что использование эндоскопических технологий не подразумевает ограничений в объеме удаления опухоли, и, помимо этого, позволяет проводить симптоматическое лечение и выполнять циторедуцирующие операции в качестве подготовки к химиолучевой терапии [29]. В настоящее время общепринятой тактикой лечения при плоскоклеточном раке основания черепа и полости носа является именно эндоскопическое удаление опухоли с возможной комбинацией с открытыми доступами (при распространении опухоли в орбиту, подвисочную ямку, переднюю черепную ямку) с последующей радио- и химиотерапией [14, 17, 30].
Так, исследователи из Питтсбургского университета представили свой опыт лечения 34 пациентов с использованием эндоскопической техники. Когорта состояла в основном (85%) из опухолей стадии Т3—Т4. У 25 пациентов использован исключительно эндоскопический эндоназальный доступ, а у 9 — комбинированный транскраниальный/трансфациальный и эндоскопический эндоназальный доступ. У 27 пациентов опухоль удалена тотально, а у 7 проведена циторедуктивная операция. Безрецидивная выживаемость (БРВ) и ОВ составили 62 и 78% соответственно [17]. Анализируя свою серию пациентов, J. De Almeida и соавт. [17] отметили, что осложнение, которое чаще встречается при использовании эндоскопического эндоназального доступа в хирургии плоскоклеточного рака, распространяющегося на основании черепа, как и при других типах рака этой локализации, это ликворея (21%) и соответственно менингит (9%). Кроме того, в различных сериях выявлен и неблагоприятный для долгосрочной выживаемости таких пациентов фактор — инвазия опухолью ТМО [5, 31].
В последнее время активно развивается направление таргетной терапии в лечении плоскоклеточного рака органов головы и шеи. Широкое использование таргетных препаратов основано на их высокой селективной активности в отношении опухолевых клеток по сравнению с клетками нормальных тканей, прицельном действии в отношении факторов канцерогенеза, меньшем профиле токсичности лечения в целом [32, 33]. К таким препаратам относятся блокаторы рецепторов эпидермального фактора роста клетки, ингибиторы факторов роста, блокаторы сигнальных путей, препараты, контролирующие клеточный рост, подавляющие синтез белков и ангиогенез [34]. В настоящее время проведено большое количество исследований и отмечена высокая эффективность блокаторов факторов роста клеток опухоли.
Одним из наиболее перспективных препаратов для лечения злокачественных новообразований, в частности плоскоклеточного рака органов головы и шеи, является цетуксимаб — химерное моноклональное антитело, специфически направленное против эпидермального рецептора фактора роста опухолевых клеток (EGFR), уровень которого патологически повышен в опухолях эпителиального происхождения, в том числе и при плоскоклеточном раке головы и шеи [35, 36]. В настоящее время цетуксимаб уже одобрен для лечения платинорезистентного метастатического или местно-распространенного плоскоклеточного рака области головы и шеи [37]. Одобрен также таргентый препарат ниволумаб, который является антителом к PD-1 (Programmed cell death protein 1) [38].
Адъювантная химиолучевая терапия на основе платины, как правило, используется только в случаях положительного края (опухолевые клетки обнаруживаются в краях иссеченных тканей) после операции и при доказательстве инвазии опухоли в лимфоваскулярные и нервные структуры [1]. При лечении низкодифференцированного плоскоклеточного рака на поздних стадиях (Т3—Т4) многообещающие результаты показали схемы индукционной химиотерапии. Это начальный курс лечения, который применяется при высокой либо умеренной чувствительности опухолевого образования к химиопрепаратам и невозможности иных видов лечения. Методы включают в основном комбинацию таксанов (противоопухолевых средств растительного происхождения) и препаратов платины с последующим хирургическим вмешательством и адъювантным химиолучевым лечением (частичный или полный ответ на этот протокол наблюдался у 67% пациентов) [39].
Облучение шеи следует рассматривать как метод лечения при местно-распространенном поражении (Т3—Т4) из-за достаточно частого (23%) метастазирования в шейные лимфатические узлы [1].
Все эти протоколы в настоящее время изучаются в ходе ECOGACRIN protocol 3163 (EA3163) — это рандомизированное клиническое исследование, в котором сравнивают протоколы, включающие неоадъювантную химиотерапию + хирургическое + лучевое лечение и хирургическое + лучевое лечение в плане сохранения орбиты.
Аденокарциномы, преимущественно образующиеся в слизистой лабиринтов решетчатой кости (85%) и ольфакторной области (13%), в 4 раза чаще встречаются у мужчин, чем у женщин, что обусловлено профессиональной деятельностью определенной группы специальностей, связанной с воздействием древесной пыли [40]. Эти особенности обусловливают и возможную мультифокальность опухолей, из-за чего рекомендуется производить двустороннее удаление решетчатого лабиринта [40, 41].
Хирургическое лечение является основным методом лечения на ранних (T1—T2) стадиях заболевания. При стадиях Т3—Т4 общепринятым является использование адъювантной интенсивно-модулированной лучевой терапии (высокотехнологичной методики трехмерной лучевой терапии, позволяющей ионизирующему излучению более точно приспосабливаться к опухоли). При этом создается очень точное распределение дозы ионизирующего излучения вокруг мишени (опухоли) сложной формы [42]. Эндоскопическое эндоназальное удаление краниофациальных аденокарцином, как показано еще в начале XXI века, эффективно в плане онкологических исходов и более безопасно относительно осложнений [27, 29]. В более поздних сериях сообщено об уровне ОВ 72,7% при использовании эндоскопического трансназального удаления с последующим адъювантным облучением [41]. Наиболее крупная серия, включающая 169 пациентов с синоназальными аденокарциномами, описана P. Nicolai и соавт. [3], в ней ОВ и БРВ составили 68,9 и 63,6% соответственно. Сопоставимые данные 5-летней ОВ представлены M. Camp (68% в серии из 123 больных) и S. Vergez (62% в серии из 159 больных) в 2014 г. Эти данные способствовали сдвигу в сторону протокола лечения синоназальных аденокарцином, включающего эндоскопическое трансназальное удаление с адъювантной лучевой терапией или без нее вместо открытых доступов, которые используются только в случае распространения опухолей в переднюю черепную ямку и лобную пазуху. На поздних стадиях заболевания при подозрении на распространение опухоли на оболочки головного мозга может быть также рассмотрен вопрос о профилактическом облучении всего головного мозга [3]. Шейные лимфоузлы поражаются лишь в 7% случаев, в связи с чем рутинно их облучение не проводится [1]. Для опухолей стадии Т3—Т4 с функционально активным протеином р53 эффективным и многообещающим показал себя протокол, включающий индукционную химиотерапию на базе цисплатина, фторурацила и лейковорина с последующими хирургическим и радиологическим этапами [43].
Эта высокоагрессивная карцинома неопределенного гистогенеза с нейроэндокринной дифференцировкой или без нее обычно манифестирует в виде обширно распространенной опухоли и отличается большей частотой метастазирования по сравнению с обычной плоскоклеточной карциномой [44]. Даже в поздних стадиях заболевания неоадъювантная химиотерапия с последующим либо химиолучевым, либо хирургическим лечением и дальнейшим послеоперационным облучением дает довольно неплохие результаты [45, 46].
С патогистологической точки зрения, недифференцированная карцинома околоносовых пазух трудно отличима от ольфакторной нейробластомы и нейроэндокринной карциномы [44]. Нюансы дифференциации этих новообразований не являются чисто методологическими, поскольку существуют значительные различия в прогнозах и стратегии лечения, но ни одна из них не принята окончательно. Так, А. Al-Mamgani и соавт. [47] опубликовали серию из наблюдений 21 пациента, подразделенных на группы в зависимости от применяемого протокола лечения (химиолучевая терапия, неоадъювантная химиотерапия или хирургия в качестве основных методов лечения). Проведено сравнение данных локального контроля заболевания на основании многофакторного анализа, включающего степень инвазии опухоли и примененный метод лечения. В этой серии получены лучшие результаты выживаемости из всех опубликованных на сегодняшний день (ОВ — 74%), это подтверждает, что индивидуальный подход к лечению лучше, чем любая общепринятая стратегия.
Синоназальная аденокарцинома — это опухоль с высокой склонностью к периневральному распространению (например, по ветви тройничного нерва) и костной инвазии, что может привести к значительному вовлечению костных структур основания черепа и внутричерепному распространению, включая кавернозный синус и среднюю черепную ямку. Как и остальные опухоли этой группы, она исходит из слизистой околоносовых пазух. Хирургическое вмешательство в сочетании с послеоперационным облучением обеспечивает более высокий уровень ОВ у таких пациентов [48].
По данным Y. Lee и соавт. [49], которые провели исследование, включающее 47 пациентов с распространенными аденокистозными карциномами, достигнут достаточно высокий уровень ОВ (61,7%). При проведении исследования авторы отметили, что наилучшие результаты получены у пациентов, которым на первом этапе проводилось хирургическое лечение с последующей адъювантной радиотерапией. При этом роль химиотерапии на основе цисплатина в лечении этой патологии остается не до конца определенной.
Послеоперационное облучение может осуществляться с помощью обычной фотонной лучевой терапии или с использованием недавно введенной в практику протонной терапии, которая продемонстрировала перспективные показатели локального контроля заболевания не только в послеоперационном периоде, но и в неоперабельных случаях [50]. У таких пациентов целесообразно использовать позитронно-эмиссионую томографию (ПЭТ) с F-фтордезоксиглюкозой (F-ФДГ) в качестве прогнозирования эффективности терапии тяжелыми частицами [51].
Несмотря на то что рецидивирование при синоназальных аденокарциномах наблюдается практически у 65% пациентов, уровень 5-летней ОВ (77,3%) превышает таковой при других типах краниофациальных карцином [48, 52].
Ольфакторная нейробластома (она же эстезионейробластома) — редкая злокачественная опухоль, происходящая из обонятельного нейроэпителия, составляет 3—5% от всех злокачественных новообразований полости носа [53—55]. Из-за редкого выявления этой патологии в настоящее время нет общепринятых схем лечения эстезионейробластом. Основным методом является хирургический с последующей лучевой терапией и с химиотерапией или без нее [56—58]. Равно, как и при других злокачественных синоназальных новообразованиях, распространяющихся на основание черепа, показаны сопоставимые результаты использования эндоскопической техники и краниофациальной резекции [56].
По разным данным, 5- и 10-летняя ОВ пациентов с нейробластомами составляет 85—93 и 57—75% соответственно независимо от метода хирургического лечения [59, 60]. Анализ, проведенный X. Peng и соавт. [61], показал, что ОВ пациентов мужского пола значительно выше, нежели женского.
Метастазы в шейных лимфатических узлах обнаруживаются в 5—12% случаев при первичном обследовании пациентов, однако в связи с более высокой частотой метастазирования в катамнезе (до 39% в течение 40 мес) [62] целесообразным является рассмотрение вопроса о проведении облучения шеи при лечении первичного очага [63, 64].
Пациенты с опухолями основания черепа — достаточно сложная группа больных. Лечение их требует комплексного подхода для определения характера опухолевого процесса, его распространенности и стадийности заболевания. Выбор хирургического доступа, методика оперативного вмешательства зависят от распространенности опухоли. Использование интраоперационного мониторинга при удалении опухолей основания черепа должно быть необходимой опцией, так как улучшает результаты хирургического лечения, что особенно важно при распространенных процессах в области орбиты и подвисочной ямки. Радикальность удаления часто ограничивается вовлечением в процесс функционально важных структур основания черепа. В целом лечение нерезектабельных форм плоскоклеточного рака органов головы и шеи остается открытым вопросом. Поскольку критерии нерезектабельности в большинстве своем являются субъективными и зависят от профессионализма специалистов-хирургов, технической оснащенности разных клиник, то сравнительная оценка результатов существующих методик крайне затруднена. Имеющиеся химиопрепараты с доказанной эффективностью не позволяют гарантировать излечение и предотвратить метастазирование. Методики химиолучевой терапии являются более эффективными по сравнению с лучевым лечением в качестве монометода, однако применение их ограничено возрастными критериями, наличием у больных сопутствующих заболеваний, общим соматическим статусом. В схемах комбинированного лечения практически не используются средства, способные усиливать эффект лучевой терапии за счет изменения радиобиологических свойств клеток (так называемые радиосенсибилизаторы). Использование таргетных препаратов на сегодняшний день дает небольшое улучшение результатов лечения. Однако дороговизна такой терапии делает ее практически недоступной для подавляющего большинства больных. Физические средства радиомодификации в настоящий момент незаслуженно забыты, несмотря на то что они доказанно повышают эффективность лечения как такового за счет снижения толерантности опухоли к воздействию цитотоксических агентов. Это позволяет снизить суммарную лучевую нагрузку на организм и токсичость лечения в целом, так как уменьшение суммарной дозы компенсируется или дополняется вкладом радиосенсибилизаторов. При использовании радиопротекторов можно повысить непосредственно очаговую дозу, так как защищенность нормальных тканей отодвигает планку предельно допустимых границ доз. Улучшается также качество жизни за счет сохранения функциональной активности нормальных органов и тканей. Кроме того, необходимо определить, имеет ли вирус папилломы человека отношение к возникновению рака, выяснить прогностическое значение выявления указанного типа вируса, а также обосновать выбор схемы химиотерапии с учетом наличия этого маркера.
Текущий раздел: Л учевая терапия
Роль лучевой терапии в лечении аденокистозного рака трахеи
Харченко В.П., Паньшин Г.А., Гваришвили А.А., ФГУ «Российский научный центр рентгенорадиологии Росмедтехнологий», г.Москва
Статья опубликована 7 июля 2010 года.
Идентификационный номер статьи в ФГУП НТЦ “ИНФОРМРЕГИСТР”: 0421000015\0021
Рабочий адрес: 117997, г . Москва, ул. Профсоюзная, д. 86
Харченко Владимир Петрович
Гваришвили Александр Александрович
В статье представлены результаты радикальной лучевой терапии 40 больных аденокистозным раком трахеи. Разовые очаговые дозы составляли 2 Гр, суммарные очаговые дозы (СОД) доводились до 64-70 Гр, ритм облучения – ежедневный, 5 раз в неделю. Большинство больных облучалось по методике «расщепленного курса» с 2 - 3-х недельным перерывом между ними после достижения СОД=30 Гр.
Полная резорбция опухоли после окончания лечения отмечена у 19 больных (47,5%), а частичная - у 20 пациентов (50%). Лучевой эзофагит различной степени выраженности определялся в 100% случаев. Трахеопищеводный свищ сформировался у 1 больного (2,5%). В ближайшее время после окончания лечения умерло 3 больных. 5-ти и 10-ти летняя выживаемость составила, соответственно - 75,0% и 55,0% .
Ключевые слова: трахея, лучевая терапия.
The role of radiotherapy in the treatment of the trachea Adenoid Cystic carcinoma
V.P.Harchenko, G.A.Panshin, A.A.Gvarishvili
Federal State Enterprise “Russian Scientific Center of Roentgenoradiology of Russian Health and Social Development Ministry”
The results of radical radiotherapy of the 40 patients trachea Adenoid Cystic carcinoma, are presented. Single focal dose was 2 Gy, total focal dose (TFD) were brought to 64-70 Gy irradiation rhythm - daily, 5 times a week. Most patients were irradiated with 2 - 3-week break after the TFD 30 Gy. Complete tumor resorption after treatment was noted in 19 patients (47,5%), and partially - in 20 patients ( 50%). Radiation esophagitis of varying severity was determined in 100% of cases. Tracheoesophageal fistula was formed in 1 patient (2.5%). Shortly after the end of treatment in 3 patients died. 5 and 10-year survival rates were respectively - 75,0% and 55,0%.
Keywords: trachea, radial therapy
Лечение больных злокачественными новообразованиями трахеи является одной из наиболее сложных проблем современной клинической онкологии. Несмотря на то, что первичные злокачественные опухоли трахеи составляют 0,1-0,2% всех онкологических заболеваний [4] (или примерно 0,2 случая на 100.000 населения ежегодно), в абсолютных цифрах это довольно значительная по численности группа больных, которые далеко не всегда могут получить квалифицированную медицинскую помощь. Наиболее распространенными гистологическими формами являются аденокистозный рак (цилиндрома) и плоскоклеточный рак, составляющие 75-90% от всех злокачественных опухолей трахеи [6]. При этом частота аденокистозного рака по данным большинства авторов несколько выше, чем плоскоклеточного [1, 7, 8].
Необходимо отметить, что адекватное лечение новообразований трахеи представляет собой одну из сложных задач современной клинической онкологии. Грамотный подход к радикальному лечению таких больных требует значительных материальных затрат и слаженной работы большого коллектива квалифицированных специалистов
Ввиду трудностей ранней диагностики, исключительной технической сложности хирургических вмешательств и не всегда удовлетворительных результатов лечения, до настоящего момента нет однозначного подхода к выбору тактики лечения данной категории онкологических больных. Большинство специалистов, имеющих большой опыт в лечении больных раком трахеи, единственно радикальным методом считают комбинированное лечение (радикальная резекция с последующей лучевой терапией) [1, 3].
Повышенный интерес к этой проблеме, который можно отметить по данным литературы в 60-80-е годы, в настоящее время несколько снизился. Этот факт можно объяснить неудовлетворительными результатами лечения. При анализе литературы последнего десятилетия создается впечатление, что у многих исследователей, занимающихся этой проблемой, возникают сомнения в оправданности тех затрат и усилий, которые необходимы для радикального лечения этих больных [5, 9].
Научные изыскания стали переходить в несколько иную, упрощенную плоскость, когда основной упор делается на оказание паллиативной помощи в виде эндоскопической реканализации просвета трахеи с последующим проведением паллиативной лучевой терапии [2, 10].
Несомненно, что такому подходу способствовали прогресс в развитии эндоскопических методик с использованием лазерной фотокоагуляции
опухоли в просвете трахеи, а также усовершенствование методик лучевой терапии [11, 12].
Цель исследования : клиническое обоснование эффективности применения лучевой терапии в лечении аденокистозного рака трахеи.
Задачи исследования : ретроспективный анализ результатов применения радикальной лучевой терапии больным аденокистозным раком трахеи.
В РНЦРР по поводу аденокистозного рака трахеи специальное радикальное лечение проведено 139 больным, из которых хирургическое – у 47, комбинированное у 52 и лучевое - у 40 пациентов. При радикальной лучевой терапии разовые очаговые дозы составляли 2 Гр при ежедневном ритме облучения, а суммарные очаговые дозы (СОД) доводились до 64-70 Гр. При этом, при облучении верхнего (шейного) отдела трахеи применялась 2- х польная, а при облучении нижнего (грудного и бифуркации) - 3-х польная методики лучевой терапии. Большинство больных при радикальной лучевой терапии облучалось по методике «расщепленного курса» с 2 - 3-х недельным перерывом между ними после достижения СОД=30 Гр. Среди 40 больных аденокистозным раком трахеи, которым проводилась радикальная лучевая терапия, соответственно в шейном отделе опухоль
локализовалась у 13 пациентов (32,5%), в грудном - у 15 (37,5%), в области бифуркации - 10 (25,0%) и тотальное поражение было отмечено у 2 больных (5,0%).
Касаясь непосредственных результатов радикальной лучевой терапии аденокистозноого рака трахеи, необходимо отметить, что полная резорбция опухоли после окончания лечения выявлена у 19 больных (47,5%), а частичная - у 20 пациентов (50%). При этом лучевой эзофагит различной степени выраженности определялся в 100% случаев. Трахеопищеводный свищ сформировался у 1 больного (2,5%), а от легочно-сердечной недостаточности и развития трахеомедиастинального свища умерло 3 больных. 5-ти и 10-ти летняя выживаемость больных аденокистозным раком трахеи составила, соответственно после радикальной лучевой терапии - 75,0 и 55,0% .
На сегодняшний день, в целом, мы считаем, что ведущим методом лечения больных со злокачественными опухолями трахеи остается хирургический, причем как один из компонентов комбинированного лечения, включающего в себя, в первую очередь, радикальную резекцию трахеи с послеоперационной лучевой терапией.
Вместе с тем, при невозможности выполнения радикального хирургического лечения из-за распространенности опухоли или по общим противопоказаниям у этих больных на первый план выступают консервативные методы лечения, одним из основных среди которых является лучевая терапия., В ряде случаев, лучевая терапия, даже без проведения эндоскопической реканализации и эндопротезирования трахеи, может являться альтернативой хирургическому лечению и приобретает статус «спасательного, по жизненным показаниям» пособия онкологическому больному. На сегодняшний день развитие новых технологий применения лучевой терапии в онкологии с помощью современных радиотерапевтических комплексов позволяет в значительной мере расширить показания к ее использованию при невозможности оказания хирургического пособия.
И, конечно, лечение таких больных необходимо осуществлять в специализированных медицинских центрах онкологического профиля, где на высоком профессиональном уровне им будут реализованы с наименьшими экономическими затратами - этапный лечебно-диагностический комплекс, включающий в себя первичную и уточняющую диагностику рака трахеи, соответствующая предоперационная подготовка перед хирургическим или комбинированным лечением и, в случае выявленных противопоказаний к ее реализации, проведение современной органосохраняющей конформной лучевой терапии, позволяющей подводить к опухоли дозы, обеспечивающие возможно наиболее полную девитализацию опухолевых клеток на фоне максимального снижения развития местных лучевых реакций и осложнений.
Как правило, больные со злокачественными новообразованиями трахеи поступают в клинику в тяжелом состоянии с выраженными нарушениями дыхания из-за стеноза просвета трахеи опухолью. У неоперабельных больных при небольших по протяженности опухолях возможно эндоскопическое удаление экзофитной части опухоли без нарушения каркасности стенок трахеи и необходимости эндопротезирования. Затем возможно безопасное проведение лучевой терапии.
При этом, у неоперабельных больных в случае невозможности наложения по жизненным показаниям трахеостомы и для подготовки больного к возможному проведению «спасающей» лучевой терапии необходимо реканализовать трахею с помощью эндоскопического удаления опухоли. При обширном опухолевом поражении после восстановления просвета трахеи часто нарушается каркасность ее стенки, а первые сеансы лучевой терапии могут привести к полной обтурации просвета трахеи и асфиксии в результате отека в тканях в зоне опухоли. Для ее восстановления и профилактики этого грозного осложнения используется разработанная в Центре академиком РАМН, профессором В.П.Харченко методика эндопротезирования при опухолевых стенозах трахеи и крупных бронхов с
применением цилиндрического силиконового протеза с гладкой внутренней поверхностью и опорными плоскими шипами - на наружной. За различные варианты рентгено-хирургических технологий по реканализации трахеи и крупных бронхов получено 10 патентов на изобретение, внедрение которых в практику отечественного здравоохранения позволило снизить затраты на медицинскую помошь этим больным ~ в 7 раз. Необходимо отметить, что при лучевой терапии, по мере резорбции опухоли производится замена эндопротеза на более широкий.
Таким образом, ретроспективный анализ результатов применения радикальной лучевой терапии больным аденокистозным раком трахеи в РНЦРР показал, что аденокистозный рак трахеи является опухолью, довольно высокочувствительной к воздействию ионизирующего излучения, требующей, при консервативном лечении данной патологии, применения лучевой терапии.
1. Харченко В.П., Чхиквадзе В.Д., Гваришвилли А.А. Хирургическое лечение заболеваний трахеи// Вестник хирургии , 1985, №10, стр. 10-15.
2. Харченко В.П.. Гваришвили А.А., Паньшин Г.А., Петрова М.В., Авилов О.Н. Опухоли трахеи: хирургическое и комбинированное лечение // «Онкология 2000» Тезисы II съезда онкологов стран СНГ, Киев 23-26 мая, 2000, тезис №551.
3. Харченко В.П., Паньшин Г.А., Гваришвили А.А., Елтышев Н.А., Альбеков Р.З., Петрова М.В., Воскресенский С.В., Васильев О.А. Хирургическое и комбинирование лечение опухолей трахеи // Радиология 2001, Материалы VIII Всероссийского съезда рентгенологов и радиологов, «Алгоритмы в лучевой диагностике и программы лучевого и комплексного лечения больных», Москва, 2001, стр. 196-197.
4. Харченко В.П., Паньшин Г.А., Гваришвили А.А., Елтышев Н.А., Альбеков Р.З., Петрова М.В., Воскресенский С.В., Васильев О.А. Лечение злокачественных опухолей трахеи // «Тезисы докладов VIII Всероссийского съезда рентгенологов и радиологов», Челябинск-Москва 2001, стр. 56-57.
5. Харченко В.П., Гваришвили А.А., Паньшин Г.А., Альбеков Р.З., Красникова Е.В. Комбинированное и хирургическое лечение опухолей трахеи // Тезисы доклада в сборнике «Научно-технический прогресс отечественной лучевой диагностики и лучевой терапии» Материалы конференции, посвящённой 80-летию РНЦРР, Москва 2004, стр. 245-246.
6 . Albers E, Lawrie T, Harrell JH, Yi ES. Tracheobronchial adenoid cystic carcinoma: a clinicopathologic study of 14 cases //Chest 2004; 125:1160-5.
7 . Gaissert HA, Grillo HC, Shadmehrt MB, Wright CD, Gokhale M, Wain JC, et al. Long-term survival after resection of primary adenoid cystic and squamous cell carcinoma of the trachea and carina // Ann Thorac Surg 2004; 78:1889-97.
9. Li W, Ellerbroek NA, Libshitz HI. Primary malignant tumors of the trachea. A radiologic and clinical study // Cancer 1990; 66:894-9.
1 0 . Makarewicz R, Mross M. Radiation therapy alone in the treatment of tumours of the trachea // Lung Cancer 1998; 20:169-74.
11. Maziak DE, Todd TRJ, Keshavjee SH, Winton TL, Van Nostrand P, Pearson FG. Adenoid Cystic carcinoma of the airway:thirty-two-year experience // Thorac Cardiovase Surg 1996; 112:1522-31.
12. Mornex F, Coquard R, Danhier S, Maingon P, El Husseini G, Van Houtte P. Role of radiation therapy in the treatment of primary tracheal carcinoma // Int J Radiat Oncol Biol Phys 1998;41:299-305.
Цилиндрома – аденокистозная карцинома
Аденокистозная карцинома или цилиндрома представляет собой редко встречающееся злокачественное новообразование, чаще всего поражающее слюнные железы. При развитии данной опухоли наблюдается неконтролируемый рост и размножение эпителиальных клеток с формированием характерных «шнуров» и «гнезд», заметных под микроскопом. Аденокистозная карцинома характеризуется низким уровнем дифференцировки, а значит, является довольно агрессивной. По мере роста и развития новообразования такого типа прорастают в окружающие ткани и нередко за короткий срок дают метастазы в регионарные лимфатические узлы.
Помимо слюнных желез аденокистозная карцинома может поражать и другие органы, содержащие железистую ткань, например, молочные железы, шейку матки, предстательную железу, кожу. Такие опухоли склонные к рецидивам и раннему появлению отдаленных метастазов. Чаще всего вторичные очаги опухолевого роста появляются в легочной ткани.
Содержание:
Симптомы аденокистозной карциномы (цилиндромы)
Клиническая картина цилиндромы нарастает по мере увеличения новообразования в размерах. Именно поэтому большинство пациентов не предъявляют жалоб на ранних стадиях заболевания. Зачастую патологические изменения выявляются при проведении профилактического осмотра или проведении лечения у стоматолога. К симптомам патологического процесса относят следующее:
- опухолевидное новообразование на поверхности неба;
- цианоз или синюшность слизистой оболочки ротовой полости;
- повышенное слюнотечение;
- боль и дискомфорт в области опухолевидного новообразования;
- затруднение носового дыхание;
- хронический насморк;
- появление храпа во сне;
- нарушение акта глотания;
- изъязвление поверхности новообразования;
- нарушение функции мимических мышц;
- снижение общей трудоспособности;
- головная боль и головокружение;
- снижение аппетита.
Диагностика аденокистозной карциномы в Израиле
Обследование пациентов с признаками цилиндромой необходимо для уточнения диагноза и проведения дифференциальной диагностики с другими заболеваниями. В диагностическую программу включены следующие исследования:
- консультация стоматолога, ЛОР-врача – на приеме у этих специалистов проводится осмотр и физикальное обследование ротовой полости и органов чувств. Такие простейшие исследования как осмотр ротовой полости, назоскопия, отоскопия позволяют определить наличие опухолевидного новообразования и оценить степень повреждения тканей.
- рентгенография черепа – изучение рентгеновских снимков пораженной области дате специалисту возможность определить степень вовлечения в патологический процесс костной ткани.
- биопсия – при выполнении данной манипуляции производится забор образцов ткани опухоли для лабораторной диагностики. Последующее патогистологическое исследование дает возможность определить тип, степень дифференцировки и прогноз для развития новообразования.
- УЗИ – при наличии аденокистозной карциномы ультразвуковое исследование может использоваться как для обследования регионарных лимфатических узлов, так и для поиска отдаленных очагов опухолевого роста в других органах.
- КТ – компьютерная томография грудной клетки направлена на исследование легочной ткани, являющейся самой часто встречающейся областью метастазирования аденокистозной карциномы.
Лечение аденокистозной карциномы в Израиле
Лечение аденокистозной цилиндромы (цилиндромы) представляет большие трудности во многом вследствие особенностей ее расположения. Как правило, для того чтобы добиться хорошего результата используется сразу несколько методик воздействия на опухоль.
- Хирургическое лечение – является наиболее радикальным методом борьбы с аденокистозной карциномой. При этом чем раньше диагностируется заболевание, тем менее травматичным является оперативное вмешательство. На начальных стадиях развития опухоли достаточно иссечения основного очага опухолевого роста с небольшим объемом прилегающих тканей. В случае далеко зашедшего патологического процесса требуется удаление новообразования со значительной частью неба и других тканей ротовой полости. В результате создаются обширные дефекты, требующие в последствие помощи пластического хирурга.
- Лучевая терапия – облучение злокачественного новообразование позволяет уменьшить его размеры и предупредить метастазирование. В лечении аденокистозной карциномы сеансы лучевой терапии нередко выполняются до проведения оперативного вмешательства, что позволяет подготовить новообразование к удалению и уменьшить объем здоровых тканей, подлежащих удалению. В послеоперационном периоде послеоперационная рана может облучаться с целью уничтожения сохранившихся опухолевых клеток. Таким образом, лучевая терапия помогает значительно улучшить результаты противоопухолевого лечения.
- Химиотерапия – прием цитостатических препаратов помогает бороться с ростом основной опухоли и развитием отдаленных метастазов. Как правило, химиотерапевтическое лечение применяется в комбинации с другими методиками воздействия на опухоль. Курсы химиотерапии показаны и пациентам с неоперабельными опухолями поздних стадий развития.
Преимущества лечения в нашем центре
Благодаря следующим преимуществам лечение аденокистозной карциномы в Израиле обладает особенно высокой эффективностью:
- качественное обследование и консультации у известных врачей, специализирующихся на лечении опухолей головы и шеи;
- проведение щадящих, но эффективных оперативных вмешательств;
- поддерживающая терапия, уход и наблюдение высококвалифицированного медицинского персонала;
- современные методики лучевой терапии.
Раннее обращение к врачу при появлении первых признаков аденокистозной карциномы значительно повышает шансы на благоприятный исход заболевания.
Читайте также:
- Индукция ремиссии и поддерживающая терапия в химиотерапии рака
- Лучевые признаки аневризмы межпредсердной перегородки сердца плода
- Комплекс Эйзенменгера. Диагностика комплекса эйзенменгера.
- Потенциал покоя мышц желудочно-кишечного тракта. Тоническое сокращение мышц кишечника
- Причины холестеатомы (эпидермоида) верхушки пирамиды
