Синтез ноадреналина. Рецепторы эффекторных органов
Добавил пользователь Евгений Кузнецов Обновлено: 07.01.2026
R-фразы :
R26 / 27/28 : Очень токсично при вдыхании, контакте с кожей и проглатывании.
S-фразы :
S28 : При попадании на кожу немедленно и обильно промыть… (подходящие продукты должны быть указаны производителем).
S45 : В случае аварии или плохого самочувствия немедленно обратиться к врачу (по возможности показать этикетку).
S36 / 37 : Носите подходящую защитную одежду и перчатки.
Код
Кемлера : 60/66 Номер
ООН :
2811 : ТОКСИЧНОЕ ОРГАНИЧЕСКОЕ ТВЕРДОЕ,
Класс NSA :
6.1
Этикетка: 6.1 : Токсичные вещества
Норадреналина или норадреналина представляет собой органическое соединение , которое действует на гормон адренергические и нейротрансмиттеров . Это катехоламин, такой как дофамин или адреналин .
Он в основном выделяется стволом мозга и нервными волокнами ортосимпатической (или симпатической) нервной системы и действует как нейротрансмиттер в эффекторных органах . Это также метаболический предшественник адреналина (NOR означает Nitrogen ohne Radikal на немецком языке, буквально азот без радикалов или свободный азот ).
Он также выделяется в небольших количествах (20%) мозговым веществом надпочечников и действует как гормон . Затем он играет роль в возбуждении, ориентации новых стимулов , избирательном внимании , бдительности , эмоциях , пробуждении и сне , сновидениях и кошмарах , обучении и укреплении определенных контуров памяти, связанной с хроническим стрессом .
Будь то гормон или нейротрансмиттер, норэпинефрин действует на одни и те же рецепторы, известные как альфа- и бета-адренорецепторы , все связанные с тримерными G- белками.
Резюме
Место расположения
Нейронный
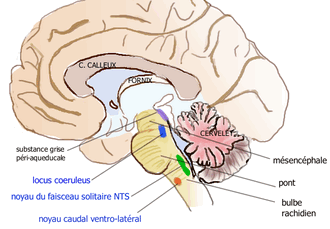
На центральном уровне тела клеток норадренергических нейронов расположены в 7 группах А1-А7 ствола мозга (луковица и мостик):
- группа A6 или locus cœruleus является наиболее плотной норадренергической структурой . Расположенная в дорсальной части моста , в понто-мезэнцефалическом соединении, эта группа дает начало дорсальному восходящему пути, который проецируется на ядра шва , таламус, гипоталамус, неокортекс, гиппокамп и мозжечок . Из этой группы также выходит нисходящий путь, составляющий часть пресимпатических вазомоторных нейронов, которые иннервируют симпатические преганглионарные нейроны.
Норадренергические нейроны голубого пятна имеют тонизирующую (непрерывную) разрядку во время бодрствования, они снижают свою активность во время медленного сна и молчат во время быстрого сна .
- Группа A1 продолговатого мозга , называемая вентро-латеральным каудальным ядром ( area caudalis superficialis ventrolateralis , CVLM), включает норадренергические нейроны, иннервирующие норадренергическую группу A2 и адренергическую группу C1, где они оказывают постоянное ингибирование нейрональной активности пресимпатических вазомоторов.
- Группа A2, расположенная в ядре одиночного пучка (NTS), состоит из норадренергических интернейронов. Это ядро расположено в дорсомедиальной области луковицы, где заканчиваются чувствительные волокна блуждающего нерва (X) и языкоглоточного нерва (IX), а также все первичные вкусовые волокна.
- группы A3, A4 и A7 объединяют тела клеток, аксоны которых проецируются на двигательное ядро блуждающего нерва, ядро одиночного пучка, периакведуктальное серое вещество и гипоталамус.
Периферически симпатические постганглионарные волокна производят норадреналин. Симпатическая нервная система работает по модели с двумя нейронами: преганглионарный нейрон (тело клетки которого расположено в спинном мозге) синапс с постганглионарным нейроном (тело клетки находится в ганглии), который сам иннервирует ткань-мишень. Преганглионарный нейрон - ацетилхолинергический, постганглионарный - норадренергический. Высвобождение норэпинефрина этими нейронами сопровождается рядом медиаторов, АТФ и нейропептидов .
Мозговое вещество надпочечников
Норэпинефрин секретируется надпочечниками и попадает в общий кровоток , где он может быть ответственным за выброс адреналина при стрессе или интенсивной физической нагрузке.
Метаболизм норэпинефрина
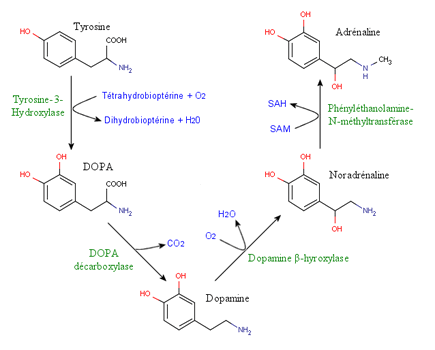
Норадреналин и адреналин связаны путями их синтеза и распада. Оба они вырабатываются нейронами и попадают в синаптическую щель, чтобы действовать как нейротрансмиттер . Но они также синтезируются хромаффинными клетками в мозговом веществе надпочечников и секретируются в кровоток, чтобы действовать как гормон .
Биосинтез
Синтетический путь начинается с аминокислоты l-тирозина , которая может происходить из внеклеточной среды и проникать в цитоплазму с помощью переносчика. Тирозин также мог быть синтезирован в клетке из фенилаланина .
Этот путь биосинтеза является общим для катехоламинов , дофамина , норадреналина и адреналина .
Первая стадия, гидроксилирование тирозина до L-DOPA, выполняется цитоплазматическим ферментом, тирозингидроксилазой (TH). Это ограничивающий шаг в биосинтезе, потому что фермент быстро насыщается. Второй этап - декарбоксилирование L-ДОФА в дофамин, обеспечиваемое ДОФА-декарбоксилазой . Этот фермент неспецифичен, в отличие от TH, поскольку он может катализировать декарбоксилирование других ароматических аминокислот. Дофамин концентрируется в гранулах (через переносчик VMAT, переносчик везикулярных моноаминов ) перед гидроксилированием до норадреналина под действием дофамингидроксилазы . Почти весь норадреналин в нейронах или хромаффинных клетках содержится в везикулах. Когда достигается потенциал действия и образующиеся ионы Са ++ входят , синаптические везикулы высвобождают содержащиеся в них норэпинефрин и допамингидроксилазу в синаптическую щель. Затем норадралин может:
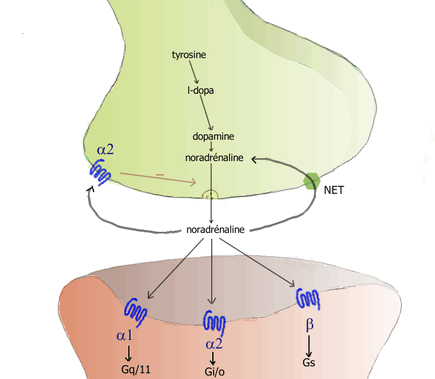
- связываются с постсинаптическими рецепторами альфа1 и бета и способствуют передаче нервных сигналов ;
- быть повторно захваченным на пресинаптическом уровне селективным мембранным транспортером NET ( транспортером норэпинефрина ) для рециклирования в норадренергический нейрон;
- захватывается рецептором альфа2 ненейрональными клетками, в частности, гладкомышечными клетками сосудов.
Деградация
После пресинаптического обратного захвата переносчиком NET норадреналин либо расщепляется митохондриальной моноаминоксидазой МАО, либо повторно сохраняется в везикуле. Норэпинефрин, высвобождаемый в синаптическую щель, также может расщепляться катехол-O-метилтрансферазой COMT.
Два фермента разрушают норадреналин: СОМТ ( катекол-О-метилтрансфераза ) и МАО-А ( моноаминоксидаза-А ).
Сначала создать метиловый эфир на гидроксиле в мете углеродной цепи, в то время как второй практики окисления из амина функции в альдегиде , который может быть преобразован в спирт ( редуктаза ) , или в карбоновую кислоту ( дегидрогеназа ). Эти метаболиты могут быть:
- гомованиловая кислота HVA (гомованиловая кислота);
- VMA (VanylMandelic Acid) ванилминдальная кислота;
- MHPE (3-метокси-4-гидроксифенилэтанол);
- MHPG или MOPEG (3-метокси-4-гидроксифенилэтиленгликоль).
Эти метаболиты могут быть исследованы в крови при подозрении на фенилкетонурию или опухоль, секретирующую катехоламины .
Синтез норадреналина
Предшественником норадреналина является дофамин (он синтезируется из тирозина, который, в свою очередь — производное фенилаланина), который с помощью фермента дофамин-бета-гидроксилазы гидроксилируется (присоединяет OH-группу) до норадреналина в везикулах синаптических окончаний. При этом норадреналин тормозит фермент, превращающий тирозин в предшественник дофамина, благодаря чему осуществляется саморегуляция его синтеза.
Фармакологическое действие:
Проявляет яркое альфа1-, альфа2-адреностимулирующее действие, слабо возбуждает бета1-адренорецепторы, а на бета2-адренорецепторы практически не влияет. Преобладание альфа-адреномиметического действия приводит к сужению сосудов, повышению ОПСС и системного АД. Поскольку стимулирующее действие на сердце выражено очень слабо (слабо возбуждает бета1-адренорецепторы миокарда), то превалируют компенсаторные механизмы, связанные с возбуждением вагуса в ответ на повышение АД, что, в конечном счете, приводит к снижению ЧСС и развитию брадикардии. Однако, несмотря на снижение ЧСС, положительное инотропное действие на сердце сохраняется, поэтому МОК снижается незначительно. Норэпинефрин способен вызывать сужение сосудов брыжейки, что может приводить к ишемии внутренних органов и способствовать проникновению бактерий из просвета кишечника. Повышает также сопротивление почечных сосудов.
На постсинаптической мембране эффекторных клеток локализованы а,и р,адренорецепторы (постсинаптические рецепторы). Эти рецепторы стимулируются норадреналином, который высвобождается из окончаний адренергических волокон.
Находящиеся на пресинаптической мембране (пресинаптические) а2адренорецепторы регулируют высвобождение норадреналина по принципу отрицательной обратной связи. Стимуляция этих рецепторов норадреналином или другими веществами с ос2адреномиметической активностью тормозит высвобождение норадреналина из варикозных утолщений. В отличие от пресинаптических ос2адренорецепторов стимуляция пресинаптических Р2адренорецепторов приводит к повышению выделения норадреналина.
Резерпин нарушает процесс депонирования норадреналина и дофамина в везикулах, которые находятся в варикозных утолщениях (окончаниях адренергических волокон). Он накапливается в мембране везикул и препятствует захвату везикулами дофамина (при этом уменьшается синтез норадреналина) и обратному захвату везикулами норадреналина. В цитоплазме нервных окончаний норадреналин подвергается окислительному дезаминированию под влиянием МАО (инактивируется). В результате истощаются запасы норадреналина в окончаниях адренергических волокон, меньше адреналина выделяется в синаптическую щель и нарушается передача возбуждения в адренергических синапсах.
Влияние симпатического отдела:
На сердце — повышает частоту и силу сокращений сердца.
На артерии — не влияет в большинстве органов, вызывает расширение артерий половых органов и мозга, сужение коронарных артерий и артерий лёгких[5].
На кишечник — угнетает перистальтику кишечника и выработку пищеварительных ферментов.
На слюнные железы — угнетает слюноотделение.
На мочевой пузырь — расслабляет мочевой пузырь.
На бронхи и дыхание — расширяет бронхи и бронхиолы, усиливает вентиляцию лёгких.
На зрачок — расширяет зрачки.
Типы холинергических медиаторных рецепторов. Их локализация, селективные агонисты и антагонисты.
Синтез ноадреналина. Рецепторы эффекторных органов
Синтез ноадреналина. Рецепторы эффекторных органов
а) Синтез ацетилхолина, его разрушение после секреции и длительность его действия. Синтез норадреналина начинается в аксоплазме терминалей адренергических нервных волокон и завершается внутри секреторных пузырьков. Основные этапы следующие.

В мозговом веществе надпочечников эта реакция дополнена еще одним этапом, в результате которого примерно 80% норадреналина превращается в адреналин:

После секреции норадреналина окончаниями нервных терминалей он удаляется из места секреции тремя способами:
(1) обратным захватом самими адренергическими нервными окончаниями путем активного транспортного процесса (так удаляется 50-80% секретируемого норадреналина);
(2) диффузией от нервных окончаний в окружающие жидкости тела и затем в кровь (таким путем удаляется основная часть остального норадреналина);
(3) разрушением небольшого количества медиатора тканевыми ферментами (один из этих ферментов — моноаминоксидаза — обнаруживается в нервных окончаниях, а другой фермент — катехол-О-метилтрансфераза — присутствует диффузно во всех тканях).
Обычно норадреналин, секретирующийся непосредственно в ткань, остается активным лишь несколько секунд, что свидетельствует о его быстром обратном захвате и диффузии из ткани. Однако норадреналин и адреналин, секретируемые мозговым веществом надпочечника в кровь, остаются активными до тех пор, пока они не диффундируют в некоторые ткани, где могут разрушаться катехол-О-метилтрансферазой; это происходит главным образом в печени. Следовательно, если норадреналин и адреналин секретируются в кровь, они остаются очень активными в течение 10-30 сек; но их активность ослабевает вплоть до полного угасания в течение периода от одной до нескольких минут.
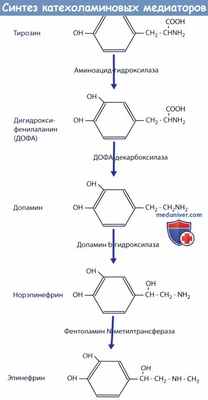
Схема синтеза катехоламиновых медиаторов.
Рецепторы эффекторных органов
Для стимуляции эффекторного органа ацетилхолин, норадреналин или адреналин, секретируемые окончаниями вегетативных нервов, должны связаться со специфическим рецептором на эффекторных клетках. Рецептор, расположенный снаружи клеточной мембраны, связан в качестве простетической группы с белковой молекулой, которая проходит сквозь мембрану клетки. При связывании медиатора с рецептором возникает конформационное изменение структуры белковой молекулы. В свою очередь, измененная белковая молекула возбуждает или тормозит клетку, чаще всего (1) изменяя проницаемость клеточной мембраны к одному или более ионам или (2) активируя или инактивируя фермент, прикрепленный к другому концу рецепторного белка, где он проникает внутрь клетки.

а) Возбуждение или торможение эффекторной клетки путем изменения проницаемости ее мембраны. Поскольку рецепторный белок является составной частью клеточной мембраны, конформационное изменение его структуры часто открывает или закрывает ионный канал, изменяя таким образом проницаемость клеточной мембраны к различным ионам. Например, часто открываются натриевые и/или кальциевые ионные каналы, позволяя соответствующим ионам быстро входить в клетку, что обычно деполяризует мембрану и возбуждает клетку. В других случаях открываются калиевые каналы, позволяя ионам калия диффундировать из клетки, и это обычно тормозит клетку, поскольку потеря электроположительных ионов калия создает внутри клетки гиперполяризацию. В некоторых клетках изменение ионной среды внутри клетки вызывает некое внутриклеточное действие, например прямое действие ионов кальция, способствующее сокращению гладких мышц.
б) Действие рецептора путем изменения активности внутриклеточных ферментов вторичных посредников. Другой частой функцией рецептора является активация или инактивация фермента (или другого вещества) внутри клетки. Фермент часто прикреплен к рецепторному белку с внутренней стороны клеточной мембраны. Например, связывание норадреналина с его рецептором снаружи многих клеток увеличивает активность фермента аденилилциклазы внутри клетки, и это вызывает образование циклического аденозинмонофосфата. Это вещество, в свою очередь, может инициировать любое из различных внутриклеточных действий, при этом точный эффект зависит от химических особенностей эффекторной клетки. Легко понять, почему медиаторы автономной нервной системы могут вызвать торможение в одних органах и возбуждение в других. Это обычно обусловлено природой рецепторного белка в клеточной мембране и влиянием связывания рецептора на его конформационное состояние. В каждом органе результирующие эффекты, вероятно, совершенно отличны от эффектов в других органах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синтез ноадреналина. Рецепторы эффекторных органов
АЛЬФА- 2 АДРЕНОМИМЕТИКИ
И АНЕСТЕЗИЯ
Toshiki Mizobe, Mervyn Maze:
// New Drugs in Anesthesia Vol. 33,
N. 1, 1995, P. 81-103
Клонидин, агонист 2 адренорецепторов (А2АР), был введен в клиническую практику в качестве антигипертензивного препарата более 25 лет назад. Кроме использования в качестве антигипертензивного препарата, клонидин использовался при многих состояниях, начиная от психиатрической патологии и кончая лечением детей с задержкой роста. В ветеринарной практике в течение нескольких лет он использовался в качестве анестетика. Экспериментальные и клинические исследования привели к тому, что в течение последних лет внимание анестезиологов сфокусировано на использовании препаратов этого класса в качестве препаратов для анестезии. Последней тенденцией является разработка и использование таких суперселективных препаратов, как дексометедомидин.
Основы фармакологии.
Классификация адренорецепторов.
Alquist дифференцировал адренорецепторы на альфа и бета подклассы , причем эта классификация лежит в основе деления по механизму действия и мощности современных препаратов синтетических и естественных катехоламинов. Интенсивность действия катехоламинов на бета- адренорецепторы позволила выделить два подкласса бета 1 и бета 2 адренорецепторы. Что касается альфа-адренорецепторов, то следующим шагом было определение их как адренорецепторов, регулирующих выброс нейротрансмиттеров. В результате этих физиологических исследований было выяснено, что альфа-2 аренорецепторы располагаются в пресинапсе, а альфа 1 в постсинапсе. Эта красивая анатомическая классификация была, однако, бесполезной, поскольку были обнаружены такие альфа-2 адренорецепторы, которые располагались постсинаптически или даже вне синапса, и поэтому их довольно-таки сложно назвать регуляторами выброса нейротрансмиттеров. Синтез селективных антагонистов альфа-адренорецепторов привел к тому, что альфа-адренорецепторы теперь классифицируются на две подгруппы по фармакологическому принципу. Современная фармакологическая классификация на альфа-1 и альфа-2 адренорецепторы основана на реакции, возникающей в ответ на селективные агонисты для альфа-1 это празозин, а для альфа-2 это йохимбин.
Классификация альфа-2 адренорецепторов
Имеются две отдельные номенклатуры этих рецепторов, одна основана на фармакологических признаках ( альфа 2 А, В или С ) а вторая на величине молекулярного веса, причем разработка этих двух номенклатур дала окончательный результат альфа 2 адренорецепторы, в свою очередь, делятся на три подгруппы. В соответствии с молекулярно- генетической классификацией, которая основывается на локализации гена, ответственного за синтез белка рецептора в хромосоме, выделены следующие подгруппы: альфа-2 С2 во второй хромосоме, альфа-2 С4 в четвертой и альфа-2 С10 в десятой хромосоме. В разных областях мозга, как и в разных органах, обычно содержатся разные подтипы рецепторов, однако это совсем не является обязательным.
Структура альфа-2 адренорецептора
Структура этих рецепторов идентична таковой других нейротрансмиттерных рецепторов , в том числе и других адренергических рецепторов альфа 1 и бета, структуре мускариновых, допаминовых. опиатных, аденозиновых и серотониновых рецепторов. Эти белки состоят из одной полипептидной цепочки, которая насквозь проникает через клеточную мембрану семь раз подряд. Гидрофобные домены рецепторов, связанные с мембраной , очень сходны по своей первичной структуре. Итак, считается, что гидрофобные участки распознают такие эндогенные лиганды, как адреналин и норадреналин. Разные адренорецепторные белки имеют разную структуру цитоплазматических участков. Это является основой реакции рецептора, также на этот процесс влияет состав цитозоля. Особенно четко это можно проследить на примере того как рецепторы образуют “точки контакта“ с эффекторными механизмами, начиная с белков, связывающих гуанин (G-протеины).
G-протеины.
Эти связывающие белки обеспечивают передачу трансмембранного потенциала на эффекторный механизм, который может быть трансмембранным ионным каналом или внутриклеточным каскадом вторичных мессенджеров. Выделено около 20 видов G-протеинов, которые разнятся по аминокислотному составу в одной из трех субъединиц, а именно альфа. Это и обеспечивает специфичность реакции, осуществляемой через каждый тип адренорецепторов. G-протеины могут быть также классифицированы в соответствии с их чувствительностью к бактериальным токсинам холерному и коклюшному токсинам. Имеется по крайней мере четыре типа G-протеина, чувствительного к коклюшному токсину, которые связываются с альфа2 адренорецепторами и осуществляют реализацию ответной физиологической реакции через эффекторные механизмы.
Эффекторные механизмы.
Все альфа-2 адренорецепторы при активации способны ингибировать аденилатциклазу. В результате уменьшается накопление циклического аденозинмонофосфата (цАМФ), снижается стимуляция цАМФ- зависимой протеинкиназы, и, в конце концов, это угнетает фосфорилирование регуляторных белков-мишеней. Однако, во многих случаях снижения накопления цАМФ недостаточно, чтобы осуществлять альфа-2 адренергические реакции. Другим эффекторным механизмом является вход калия в клетку через активируемые кальцием калиевые каналы. Эти изменения проницаемости клеточной мембраны для отдельных ионов вызывает гиперполяризацию мембраны и может эффективно угнетать нейроны. Активация альфа 2 адренорецепторов также угнетает механизмы входа кальция в клетку через вольтаж - зависимые кальциевые каналы в нервных окончаниях. Это может объяснить ингибирующий эффект альфа-2 адренорецепторов на внеклеточный выброс нейротрансмиттеров.
Прикладная фармакология
Альфа-2 адреномиметики могут быть разделены на три основных класса: фенилэтиламины (например, альфа-метилнорадреналин), имидазолины (например, клонидин) и оксалоазепины (например, азепексол).
Клонидин производное имидазолина, является селективным частичным агонистом альфа-2 адренорецепторов с отношением примерно 200:1 (альфа-1 к альфа-2) Клонидин быстро и практически полностью абсорбируется после пер орального назначения и пик его концентрации в плазме отмечается через 60-90 минут после приема. Клонидин также можно использовать в такой лекарственной форме, как длительная пролонгированная форма в виде трансдермального пластыря. В этом случае терапевтическая концентрация в крови достигается примерно через двое суток. Время полуэлиминации клонидина составляет от 9 до 12 часов, причем примерно 50% препарата метаболизируется в печени до неактивных метаболитов, тогда как остальное выделяется почками в неизмененном виде.
Альфа-метилдофа метаболизируется до альфа-метилнорадреналина, который является полным агонистом альфа-2 адренорецепторов и примерно в 10 раз более селективен для альфа-2 , чем для альфа 1 адренорецепторов. Поскольку необходима трансформация препарата в активную субстанцию, и она происходит довольно медленно (4-6 часов) и не всегда предсказуема, то пока создана единственная парентеральная лекарственная форма препарта. Она называется гуанабенц (Guanabenz) и практически идентична клонидину по клиническим эффектам, однако препарат менее активен, чем клонидин и имеет гораздо меньшую продолжительность действия, поскольку время полуэлиминации препарата составляет 6 часов. У гуанфацина наиболее длительное время полужизни (14-18 часов) из всех применяемых в клинической практике альфа-2 агонистов. Последние два из названных препаратов являются производными гуанидина.
Медетомидин ( 4- [5] - [1-2,3-диметилфенил [этил] имидазол) является прототипом суперселективных агонистов альфа-2 адренорецепторов нового поколения. Он примерно на порядок более селективен, чем клонидин и является полным агонистом данного класса рецепторов. Медетомидин обладает высокой активностью и активен в очень низких (наномолярных) концентрациях. Он широко используется в ветеринарной практике в Европе. С тех пор, как стало известно, что только D-энанциомер данного рацемата является активным ингредиентом, дексмедетомидин был введен в клиническую практику. Исследования III ступени позволили обеспечить введение данного препарата в Европе и США для использования в периоперационный период.
Некоторые лиганды, имеющие в своей структуре имидазольное кольцо могут соединяться с неадренергическими имидазол предпочтительными рецепторами, также, как и с альфа-2 адренорецепторами. Влияние лигандов альфа-2 адренорецепторов на сердечно-сосудистую систему зависит от того, активируются ли при этом имидазоловые рецепторы.
Клиническая фармакология альфа-2 адреномиметиков
Мочевыделительная система.
Альфа-2 адреномиметики обладают диуретическим действием, особенно у животных. Угнетение выработки антидиуретического гормона ( АДГ) и увеличение клубочковой фильтрации являются главными механизмами реализации этого эффекта. Недавно было сделано предположение и том, что эти препараты стимулируют выброс предсердного натрийуретического фактора .
Система крови.
Агрегация тромбоцитов под влиянием альфа-2 адреномиметиков увеличивается. В клинических условиях это действие уравнивается путем уменьшения концентрации циркулирующих катехоламинов.
Использование в послеоперационном периоде.
Мощное аналгетическое действие альфа-2 агонистов позволяет применять их в послеоперационном периоде. Наиболее удобным в этом случае является эпидуральный путь введения. Эффективность клонидина в этом случае зависит от интенсивности боли. Многие авторы подтвердили эффективность препарат при его использовании в ортопедии, гинекологии, торакальной и брюшной хирургии. Они применяли разные дозы клонидина (в среднем 3 мкг/кг эпидурально). Наиболее серьезными побочными эффектами при введении болюсных доз были угнетение дыхания, гипотония и брадикардия.
Для того, чтобы избежать всех этих проблем, было предложено длительное непрерывное эпидуральное введение очень маленьких доз клонидина ( 800 мкг - болюс, а затем- 20 мкг/час) В этом случае выгодно сочетать клонидин с местными анестетиками и наркотическими аналгетиками, причем такая методика особенно оправдана в акушерской практике во время и после операции кесарева сечения. Интересно, что если бупивакаин заменить 2- хлорпрокаином, то наблюдается антагонизм между ним и клонидином в отношении аналгетического действия, такая же ситуация отмечена и с опиатами. В дополнение к вышесказанному стоит отметить, что клонидин эффективен в качестве монопрепарата (150 мкг однократно эпидурально) для достаточно надежного обезболивания после операции кесарева сечения.
Имеются также данные о том, что клонидин эффективен для обезболивания после малых хирургических вмешательств при внутримышечном введении (2 мкг/кг). Несмотря на то, что при этом концентрация препарата в плазме выше, чем при эпидуральном введении, частота таких побочных эффектов как гипотония, брадикардия и ознобы неизменна.
Другим способом введения может быть внутривенный. Сообщается об одинаковой эффективности 150 мкг клонидина и 5 мг морфина после ортопедических вмешательств. Однако, после холецистэктомии такого эффекта отмечено не было.
Спорным остается применение клонидина у больных с патологией коронарных артерий вследствие того, что возможно снижение потребления кислорода и угнетение дыхания.
Выводы
В данном обзоре мы попытались снабдить студентов и практических врачей рабочим материалом относительно механизма действия, физиологии и фармакологии нового класса анестетиков - альфа-2 адреномиметиков. Сейчас их преимущества стали еще яснее, поскольку синтезированы суперселективные препараты этого класса. Недавние революционные открытия в области молекулярной биологии позволили идентифицировать подклассы рецепторов и синтезировать наиболее селективные и безопасные препараты для анестезии.
Синтез ноадреналина. Рецепторы эффекторных органов
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Роль антихолинэстеразных средств в оптимизации лечения цереброваскулярных заболеваний (теоретические предпосылки и клиническая феноменология)
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(8‑2): 57‑64
Живолупов С.А., Бардаков С.Н., Самарцев И.Н., Гневышев Е.Н. Роль антихолинэстеразных средств в оптимизации лечения цереброваскулярных заболеваний (теоретические предпосылки и клиническая феноменология). Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(8‑2):57‑64.
Zhivolupov SA, Bardakov SN, Samartsev IN, Gnevyshev EN. The role of cholinesterase inhibitors in optimization of brain`s vascular pathology treatment (theoretical basis and clinical phenomenology). Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(8‑2):57‑64. ().
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Холинергическая нейротрансмиттерная система является наиболее распространенной в организме человека. Ацетилхолин обеспечивает взаимодействие нейронов центральной нервной системы, а также обусловливает передачу нервных импульсов от периферических нейронов к органам эффекторам. Результаты исследований последних лет продемонстрировали значимость дисфункции холинергической системы в развитии целого комплекса неврологических заболеваний. Oдной из наиболее широко используемых групп фармакологических средств для их лечения являются ингибиторы холинэстеразы. В обзоре рассмотрены особенности препаратов этой группы и их практическое применение при сосудистых заболеваниях нервной системы.
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Реализация национальной программы по борьбе с инсультами значительно расширила современные представления о патогенезе, своевременной диагностике и рациональной терапии цереброваскулярных заболеваний (ЦВЗ). В частности, общепризнанной считается парадигма агрессивной стратегии консервативной терапии, направленной на контроль факторов риска ЦВЗ и нейропротекцию.
В связи с этим в последние годы на роль нейропротекторов претендует огромное количество лекарственных средств из различных фармакологических групп. Среди них особое место занимают антихолинэстеразные средства (от др.-греч. α&ngr;&tgr;&igr; - против, &khgr;&ogr;λ&eegr; - желчь и эстераза – ферменты класса гидролаз или ингибиторы ацетилхолинэстеразы (АХЭС)), поскольку их применение согласуется с концепцией нейроваскулярной единицы как матрицы функциональной активности центральной нервной системы (ЦНС), суть которой состоит в том, что мозговая перфузия поддерживается на адекватном уровне не только и не столько за счет сосудистого фактора, сколько вследствие поляризационной активности нейрональных сетей, модулируемой холинергической системой [1]. Это означает, что восстановление нарушенных функций при ЦВЗ можно вызвать не только вазоактивными средствами, но и препаратами, поддерживающими функциональную активность нейронов (например, АХЭС).
АХЭС - одна из наиболее перспективных групп лекарственных препаратов в неврологической практике, уменьшающих активность холинэстеразы и приводящих к повышению содержания ацетилхолина в синапсах. Это облегчает проведение возбуждения в периферической нервной системе, в межнейрональных соединениях ЦНС и, в целом, активизирует холинергическую систему организма. Под последней понимают комплекс нейрональных структур, включающий в себя центральные и периферические холинергические нейроны, рецепторный аппарат пре- и постсинаптических мембран, ферменты (ацетилхолинэстераза, бутирилхолинэстераза) и универсальный медиатор - ацетилхолин [2]. Необходимость качественного понимания клиницистами важности и значимости холинергической системы организма человека продиктована ее широким распространением, выраженной уязвимостью и главенствующей ролью в компенсаторно-восстановительных процессах при патологии нервной системы.
Ацетилхолин - основной нейромедиатор холинергической системы, относящийся к четвертичным аммонийным основаниям, осуществляющий передачу нервного возбуждения в ЦНС, вегетативных ганглиях, окончаниях парасимпатических и двигательных нервов. Ацетилхолин образуется в терминальной части холинергических нейронов из ацетилкоэнзима А и холина при участии холинацетилтрансферазы. После высвобождения в синаптическую щель ацетилхолин быстро гидролизуется ферментом ацетилхолинэстеразой на холин и ацетат [1].
Холинергические рецепторы (холинорецепторы) - комплексные белковые структуры, локализованные на постсинаптических мембранах, как в периферической, так и в ЦНС. Они могут располагаться на пресинаптических мембранах холинергических нейронов и в синапсах с другим типом нейромедиатора. Холинорецепторы выполняют функцию регулятора высвобождения нейромедиатора в синаптическую щель. По типу чувствительности к мускарину (алкалоид Amanita muscaria) и никотину (алкалоид Nicotinia tabacum) выделяют соответственно М-холинорецепторы (мускариночувствительные) и N-холинорецепторы (никотиночувствительные). Ингибиторы холинэстеразы (ИХЭ) способны усиливать холинергические эффекты как в никотиновых, так и в мускариновых рецепторах [2].
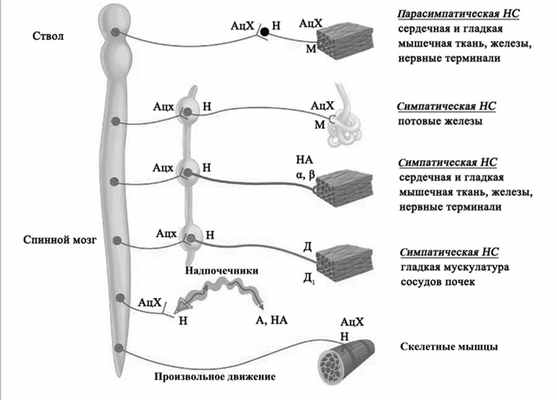
N-холинорецепторы. N-холинорецептор является гетероолигомерным комплексом, состоящим из четырех разных белковых субъединиц, названных соответственно их молекулярной массе (в кДа): α (40), β (50), γ (60), δ (65). В постсинаптические мембраны встраивается функциональный пентамер со стехиометрией α2βγδ (рис. 1). Рисунок 1. Основные точки приложения холинергического влияния в организме (А - адреналин, АцХ - ацетилхолин, Д - дофамин, М - мускариновый рецептор, Н - никотиновый рецептор, НА - норадреналин). Основное место связывания агониста ацетилхолина расположено на внешнеклеточной поверхности каждой из α-субъединиц. Структурные β-, γ- и δ-субъединицы лишены агонистсвязывающего места. Всего выявлено 17 типов субъединиц никотиновых рецепторов (α1-10, β1-4, γ, δ, &egr;) [3]. Они образуют множество разных сочетаний, но некоторые из них встречаются наиболее часто и имеют наиболее важное значение: это (α1)2β1δ&egr; (мышечный тип), (α3)2(β4)3 (ганглионарный тип), (α4)2(β2)3 (ЦНС-тип) и (α7)5 (другой ЦНС-тип). Трансмембранная часть рецептора образует катионный ионный канал, стенки которого сформированы сегментами М2 всех пяти субъединиц. В открытом состоянии рецептор может пропускать ионы Na + , К + и, в меньшей мере, двухвалентные катионы. Длительное воздействие ацетилхолина или других агонистов рецептора приводит к снижению его чувствительности и к увеличению времени пребывания ионного канала в закрытом состоянии (десенситизация). Этот феномен лежит в основе возникновения холинергических кризов при передозировке АХЭС [3].
М-холинорецепторы. Мускариновые рецепторы являются метаботропными, сопряженными и состоят из одной полипептидной цепи длиной 440-540 остатков аминокислот с внеклеточным N-концом и внутриклеточным С-концом. Аминокислотная последовательность в этих отрезках является очень консервативной (более 90% совпадений) во всех пяти типах мускариновых рецепторов. На третьей внутриклеточной петле, а также на С-конце рецепторной молекулы расположено несколько последовательных отрезков, на которых происходит фосфорилирование при передаче нервного импульса. Ацетилхолин связывается с участком, который находится в складке, сформированной спирально закрученными трансмембранными доменами [4].
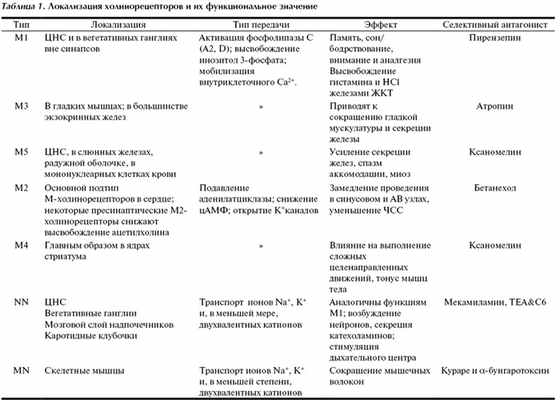
М-холинорецепторы расположены в постсинаптической мембране клеток эффекторных органов у окончаний постганглионарных холинергических (парасимпатических) волокон. Кроме того, они имеются на нейронах вегетативных ганглиев и в ЦНС (табл.1, см. рис.1) [4].
Пресинаптические М-холинорецепторы локализуются на симпатических сосудосуживающих нервах. Их активация сопровождается снижением выброса норадреналина в ответ на нервные импульсы. Введение эфиров холина приводит к расширению сосудов. Точек приложения у этих веществ несколько: холинорецепторы тормозных синапсов на пресинаптических симпатических окончаниях и холинорецепторы на сосудах, расположенные вне синапсов. Сосудорасширяющее действие ацетилхолина возможно только при неповрежденном эндотелии. Активация М-холинорецепторов эндотелия приводит к выделению из него NО (эндотелиального фактора расслабления сосудов). Диффундируя от эндотелия к гладким мышцам, NО вызывает расширение сосудов [5].
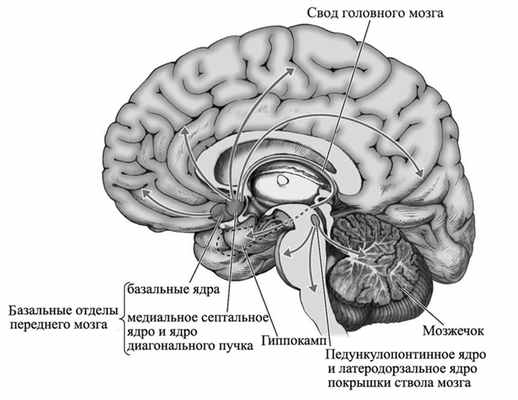
Холинергическая система головного мозга. Описано восемь групп холинергических клеток, от которых начинаются проводящие пути в структуры ЦНС [6]. Медиальное ядро перегородки и вертикальное ядро диагонального пучка - основные скопления холинергических клеток, от которых начинаются проводящие пути к гиппокампу, поясной извилине, обонятельной луковице и гипоталамусу. От горизонтального края ядра диагонального пучка нервные волокна направляются к обонятельной луковице, тогда как базальное ядро Мейнерта практически полностью обеспечивает иннервацию коры головного мозга и миндалевидных ядер (рис. 2). Рисунок 2. Холинергические пути от базальных ядер к коре головного мозга и связанным с ней структурам. Ядро ножки моста и латеральное дорсальное ядро покрышки ствола мозга проецируются в таламус; волокна медиальной уздечки направляются к интерпедункулярному ядру, а волокна от парабигеминального ядра - к верхним бугоркам четверохолмия. Холинергические нейроны вырабатывают холинацетилтрансферазу, которая транспортируется в проекционные зоны, где она служит катализатором синтеза ацетилхолина. Вся холинергическая иннервация коры головного мозга и таламуса человека исходит из этих холинергических образований [7].
Холинергические волокна направляются во все слои коры головного мозга; самая высокая плотность холинергических волокон наблюдается в первом и втором слоях, а также в верхней части третьего слоя коры [7]. Мускариновое действие растормаживает клетки пирамидного слоя коры мозга, усиливая внутрислойную передачу информации между группами клеток. Наоборот, никотиновое действие усиливает торможение [8]. Различные зоны коры человеческого мозга различаются по концентрации холинергической иннервации: самая большая плотность аксонов этого типа отмечается в образованиях лимбической системы, к которой относятся миндалевидные ядра и гиппокамп; следующее место по плотности аксонов занимают образования паралимбической области; уни- и гетеромодальные ассоциативные пути коры имеют среднюю плотность холинергических волокон, а основная часть зрительной коры имеет самое незначительное представительство холинергических волокон [9].
Нейроны базальных ядер и комплекса базальных структур переднего мозга не имеют реципрокной связи со многими зонами их кортикальной проекции. Афферентный путь к базальным ядрам обеспечивается главным образом волокнами, исходящими из лимбической системы мозга, к которым относятся препириформная и орбитофронтальная области коры, переднеинсулярная зона, полюс и средняя часть височной коры, энторинальная кора, ядра перегородки, n. accumbens и гипоталамус. Фактически единственное начало афферентных путей из лимбической системы к базальным ядрам в сочетании с их обширной представленностью в коре, лимбической и паралимбической зонах, предопределяет функцию этой структуры - установление соответствия эмоционального ответа характеру раздражителя, модуляция воздействия эмоционально релевантной информации на корковые функции [10].
М1 является наиболее распространенным подтипом мускариновых рецепторов в коре головного мозга. Самая высокая их концентрация обнаруживается в зубчатой извилине, гиппокампе, переднем обонятельном ядре, коре мозга, обонятельном бугорке и n. accumbens; умеренная концентрация - в обонятельных луковицах и миндалевидных ядрах [10].
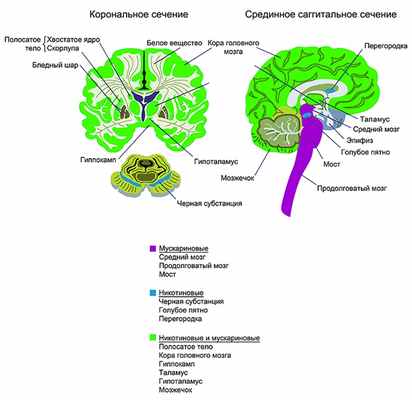
М2-рецепторы обнаруживаются в зонах мозга, содержащих большое количество холинергических нейронов, а именно в интерпедункулярном ядре и базальных отделах переднего мозга. М2-рецептор - это пресинаптический ауторецептор, который регулирует высвобождение ацетилхолина. М3-рецепторы в основном концентрируются в диэнцефальной области и в стволе мозга, а М4-рецепторы обнаруживаются главным образом в полосатом теле и обонятельном бугорке [7] (рис. 3, см. на цв. вклейке). Рисунок 3. Схема распределения мускариновых и никотиновых рецепторов в головном мозге. Самое большое количество никотиновых рецепторов расположено в таламусе, сером веществе в области сильвиева водопровода и в черной субстанции. Умеренная концентрация никотиновых рецепторов обнаруживается в коре головного мозга и в полосатом теле, относительно низкие концентрации - в гиппокампе и миндалевидном ядре [9].
В настоящее время установлено, что по мере старения организма происходит угасание активности холинергической системы ЦНС (снижение «холинергического профиля»), приводящее к формированию когнитивных нарушений и всей гаммы проявлений старения. Одной из главных причин данного феномена считается прогрессирующее с возрастом повышение активности холинэстераз [11].
Холинэстеразы - группа ферментов класса гидролаз карбоновых кислот, субстратами которых являются сложные эфиры холина с уксусной, пропионовой или масляной кислотами. Выделяют ацетилхолинэстеразу (АХЭ) и бутирилхолинэстеразу (БХЭ).
АХЭ (истинная холинэстераза; холинэстераза) - фермент, катализирующий гидролиз ацетилхолина до холина и остатка уксусной кислоты. АХЭ обнаруживается не только в холинергических синапсах, но и в других структурах холинергических нейронов (дендритах, теле, аксонах) [12]. Представлена в двух формах: гомомерных олигомеров (ди-, моно- и тетра-) и гетеромеров. Гомомерные формы (сывороточная холинэстераза) свободно растворены в цитоплазме и выполняют в организме защитные функции, в частности предохраняют от инактивации АХЭ, поскольку с большой скоростью гидролизуют ингибитор данного фермента - бутирилхолин. Гетеромерные комплексы - тетрамеры представлены в нейрональных и нервно-мышечных синапсах. Дезактивация (гидролиз) ацетилхолина в синаптической щели занимает меньше 1 мс и обусловливает переход клетки-мишени в состояние покоя.
Ген, кодирующий фермент АХЭ у человека, находится на длинном плече 7 хромосомы. Альтернативный сплайсинг РНК этого гена приводит к образованию четырех изоформ АХЭ - T, H, R и 4.
В синапсах АХЭ присутствует в виде тетрамера изоформы T, присоединенного к коллагеноподобному белку, который кодируется отдельным геном COLQ и обеспечивает фиксацию АХЭ на постсинаптической мембране. Мутация этого гена является одной из наиболее распространенных причин наследственной миастении. Кроме этого АХЭ обнаружена в плазматических мембранах эритроцитов (изоформа H) и является Yt-антигеном крови. В нейронах АХЭ может локализоваться внутриклеточно (изоформа T); причем накопление АХЭ внутри ядер клеток нейробластомы приводит к апоптозу [12].
БХЭ (ложная холинэстераза, псевдохолинэстераза, бутирилхолинэстераза, холинэстераза II) - семейство ферментов, широко распространенных в организме. БХЭ обнаруживается в плазме крови, печени, коже, гладких мышцах, где находится в растворенном состоянии. Фермент не имеет топографической связи с холинергическим синапсом и субстратной специфичности. Гидролизует сложные эфиры (бутирилхолин, пропионилхолин). В глиальных клетках ЦНС и мантийных глиоцитах БХЭ содержится в низкой концентрации; в центральных и периферических нейронах она почти отсутствует. БХЭ обнаруживается главным образом в печени (где она в основном и образуется) и в плазме. Выполняет рудиментарную физиологическую функцию - гидролиз эфиров холина, содержащихся в растительной пище [9].
АХЭ и БХЭ различаются по скорости гидролиза ацетилхолина и бутирилхолина, а также по реакции на избирательные ингибиторы. Почти все фармакологические эффекты ингибиторов АХЭ обусловлены подавлением активности именно этого фермента и, как следствие, накоплением эндогенного ацетилхолина в холинергических синапсах и окружающих тканях. ИХЭ являются некоторые природные и синтетические соединения: фосфорорганические соединения (ФОС), эфиры N-алкилкарбаминовых кислот (карбаматы), четвертичные аммониевые основания, гетероциклические соединения, содержащие третичный или четвертичный атом азота. ИХЭ относятся к непрямым холиномиметикам, хотя в высоких дозах многие из них способны непосредственно взаимодействовать с холинорецепторами.

В терапевтических дозах они, в отличие от холиномиметиков прямого действия, усиливают возбуждение всех типов периферических холинорецепторов, а проходящие гематоэнцефалический барьер, также холинорецепторов ЦНС (табл.2) [13].

Ингибиторы АХЭ связываются с тремя доменами фермента: ацильным карманом активного центра, холиновым участком и периферическим анионным участком. Эти же домены определяют различия между АХЭ и БХЭ (табл.3).
По механизму инактивации фермента антихолинэстеразные средства делятся на три группы:
Читайте также:
