Внутриклеточные рецепторы гормонов. Механизмы вторичных посредников
Добавил пользователь Alex Обновлено: 28.01.2026
Гормоны током крови разносятся по всему организму, попадают во все органы, но действуют только на те из них, которые чувствительны к данному гормону. В этих органах – мишенях имеются специфические воспринимающие структуры – рецепторы, которые трансформируют гормональный сигнал в гормональное действие. Одни рецепторы располагаются поверхностно на мембранах, другие располагаются внутриклеточно.
В 50% случаев гормональные рецепторы локализуются на мембранах клеток-мишеней, в остальных случаях – внутри клетки. Гормоны, которые не способны проникать через плазматическую мембрану, имеют рецепторы на поверхности клетки. Такие рецепторы имеют белковые гормоны, а также катехоламины, простагландины, нейротензин, вещество Р, гистамин.
Стероидные и тиреоидные гормоны воспринимаются внутриклеточными рецепторами.
Ко многим гормонам рецепторы еще не выявлены.
Локализация рецепторов и виды вторичных посредников
Рецепторы обладают высоким сродством и избирательностью к гормонам. Однако они могут связывать и структурные аналоги гормонов. Одни из них могут связываться с рецепторами и вызывать действие, аналогичное действию самого гормона (это агонисты или миметики). Другие – связываются с рецепторами, но при этом не вызывают биологического эффекта или мешают связыванию с гормоном (это антагонисты или литики). Все связывающиеся с данным рецептором соединения называются его лигандами.
Рецепторы являются белковыми структурами. На мембране одной и той же клетки может располагаться большое число различных рецепторов.
Гормональные рецепторы плазматических мембран – это один из видов многочисленных мембранных молекул.
β- Рецепторы катехоламинов принадлежат к семейству, члены которого имеют по семь внутримембранных доменов, а также внутриклеточный белоксвязывающий домены (рис.2).
Рис. 2. Типичный мембранный рецептор.
Трансмембранные, внеклеточные и внутриклеточные домены обладают специфическими связывающими особенностями.
Вначале гормон образует со своим рецептором комплекс, который впоследствии взаимодействует с так называемыми G-белками (белками, связывающими гуаниловые нуклеотиды) клеточной мембраны. Комплекс гормон – рецептор подвергается конформационным изменениям, которые придают ему способность взаимодействовать с этими белками. Одни из них (Gс) стимулируют, а другие (GII) ингибируют превращение гуанрозинтрифосфата в гуанозиндифосфат. Каждый G-белок состоит из трех субъединиц – α, β и γ. При активации эти субъединицы диссоциируют, причем α-субъединица (в зависимости от того, образовалась ли она из Gс - или GII –белка) соответсвенно либо стимулирует, либо ингибирует каталитическую единицу. Каталитичпские единицы представляют собой ферменты, такие как аденилатциклаза, гуанилциклаза, фосфолипаза С мили различные протеинкиназы (рис.3).
Рис. 3. Связывание гормона с его мембранным рецептором.
Внутриклеточный домен рецептора сцеплен с G-белком (состоящим из α, β и γ субъединин) и его каталитической единицей, через которую активируются различные внутриклеточные процессы (ЭЦП и ИЦП – соответсвенно экста- и интрацеллюлярное пространство)
Рецепторы тех гормонов, которые проникают в клетку путем диффузии (как стероиды) или другими способами (например, путем эндоцитоза или с помощью специфических молекул-переносчиков), локализуются внутри клетки.
Стероидные рецепторы, как правило, расположены в ядре. Ядерные рецепторы образуют семейства близких белков, функция которых связана с консервативными аминокислотными последовательностями. Так, рецепторы минералокортикоидов, глюкокортикоидов, андрогенов, эстрогенов, прогестерона, йодтиронинов, метаболитов витамина D и ретиноевых кислот входят в одно суперсемейство регуляторных белков.
Любой ядерный рецептор включает ряд компонентов. Области А/В содержат компоненты, специфически активирубющие транскрипцию. Область С высококонсервативна и соответствует ДНК-связывающему домену, содержащему два «цинковых пальца». Область Dой не ясна, примыкает к области Е (также высококонсервативной и присутствующей во всех рецепторах). Эта область активирует транскрипцию и содержит гормонсвязывающий домен. Область F присутсвует не во всех рецепторах.
Ядерные рецепторы стероидов связывают свои гормоны, а затем сами связываются гормончувствительными элементами ДНК своих генов-мишеней, что приводит к активации транскрипции (рис. 4).
Число специфических рецепторных молекул в клетках-мишенях колеблется от 500 до 300 000 и коррелирует со степенью их чувствительности к гормону. Однако в физиологических условиях всего лишь около 5 % рецепторов занята гормоном.
Количество рецепторов одного и того же типа в данной клетке может изменяться, претерпевает суточные и сезонные колебания и зависит от физиологического состояния организма.
Причинами изменений могут явиться:
а) изменение синтеза рецепторов в клетке;
б) изменение уровня гормона в крови (повышение уровня гормона приводит к уменьшению количества рецепторов и наоборот, уменьшение уровня гормона вызывает увеличение количества рецепторов, что приводит к повышению чувствительности клетки);
Внутриклеточные рецепторы гормонов. Механизмы вторичных посредников
а) Внутриклеточные рецепторы гормонов и активация генов. Некоторые гормоны, в том числе стероиды коры надпочечников и гонад, гормоны щитовидной железы, ретиноидные гормоны и витамин D, связываются с белковыми рецепторами в основном внутри клетки, а не на ее поверхности. Эти гормоны жирорастворимы, поэтому легко проникают через мембрану и взаимодействуют с рецепторами в цитоплазме или ядре. Активированный гормон-рецепторный комплекс взаимодействует со специфическим регулятором (промоутером) последовательности в ДНК, называемым элементом гормонального ответа.
Таким образом, он активирует или репрессирует транскрипцию конкретных генов и образование матричной РНК (для облегчения понимания просим вас изучить рисунок ниже), поэтому через несколько минут, часов и даже дней после поступления гормона в клетку в ней появляются вновь сформированные белки и становятся регуляторами новых или измененных функций клетки.
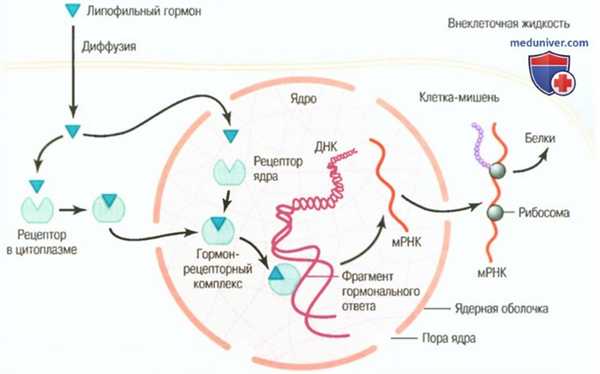
Механизмы взаимодействия липотропных гормонов, таких как стероиды, с внутриклеточным рецептором клеток-мишеней. После взаимодействия гормона с рецептором в цитоплазме или ядре гормон-рецепторный комплекс присоединяется к фрагменту гормонального ответа (пособнику) на ДНК, что активирует или тормозит транскрипцию гена, образование матричной РНК и синтез белка
Многие ткани имеют идентичные внутриклеточные гормональные рецепторы, однако гены, регулируемые этими рецепторами, различны. Внутриклеточные рецепторы могут активировать генный ответ только в случае наличия в клетке соответствующих комбинаций ген-регуляторных белков. Многие из этих протеин-регуляторных комплексов имеют в разных тканях свои особенности, поэтому ответ различных тканей предопределяется не только специфичностью рецепторов, но также генами, которые регулируются через эти рецепторы.
цАМФ — не единственный вторичный посредник, используемый гормонами. Существуют два других, наиболее важных посредника:
(1) ионы кальция, сопряженные с кальмодулином;
(2) фосфолипидные фрагменты мембран.
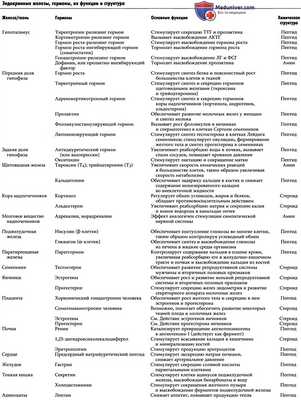
в) Система аденилатциклаза-цАМФ как вторичный посредник. В таблице ниже указаны некоторые из многочисленных гормонов, использующих систему аденилат-циклаза-цАМФ как механизм для стимуляции тканей-мишеней, а на рисунке ниже продемонстрирована система аденилатциклаза-цАМФ как вторичный посредник.
Механизм, использующий циклический аденозинмонофосфат, как способ гормональной регуляции функций клетки
Присоединение гормона к рецептору позволяет последнему взаимодействовать с G-белком. Если G-белок активирует систему аденилатциклаза-цАМФ, его называют Gs-белком, указывая на стимулирующую роль G-белка. Стимуляция аденилатциклазы, связанной с мембраной фермента посредствам Gs-белка, катализирует превращение небольшого количества присутствующего в цитоплазме аденозинтрифосфата в цАМФ внутри клетки.
Следующий этап опосредован активацией цАМФ-зависимой протеинкиназой, которая фосфорилирует специфические белки в клетке, запуская биохимические реакции, что гарантированно обеспечивает ответ клетки на действие гормона.
Как только цАМФ образуется в клетке, это обеспечивает последовательную активацию ряда ферментов, т.е. каскадную реакцию. Таким образом, первый активированный фермент активирует второй, который активирует третий. Задача такого механизма заключается в том, что небольшое количество молекул, активированных аденилатциклазой, может активировать значительно большее количество молекул на следующем этапе каскадной реакции, что является способом усиления ответа.
В итоге благодаря этому механизму ничтожно малое количество гормона, действующее на поверхность мембраны клетки, запускает мощный каскад активирующих реакций.
Если гормон взаимодействует с рецептором, сопряженным с тормозящим G-белком (Gi-белок), это снижает образование цАМФ и, как следствие, снижает активность клетки. Следовательно, в зависимости от взаимодействия гормона с рецептором, сопряженным с активирующим или тормозящим G-белком, гормон может как увеличивать, так и уменьшать концентрацию цАМФ и фосфорилирование ключевых белков клетки.
Специфичность эффекта, наблюдаемого в ответ на увеличение или уменьшение цАМФ в различных клетках, зависит от природы внутриклеточных механизмов: некоторые клетки имеют один набор ферментов, другие — иной. В связи с этим реакции, вызываемые в клетках-мишенях, разнообразны. Например, инициация синтеза специфических химических соединений вызывает сокращение или расслабление мышц либо процессы секреции в клетках или изменение проницаемости мембран.
Клетки щитовидной железы, активированные цАМФ, образуют метаболические гормоны — тироксин или трииодтиронин, в то время как тот же цАМФ в клетках надпочечников приводит к синтезу стероидных гормонов коры надпочечников. В клетках тубулярного аппарата почек цАМФ повышает проницаемость для воды.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Рецепторы гормонов. Количество и чувствительность рецепторов гормонов
а) Механизм действия гормонов. Рецепторы гормонов и их активация. Первым этапом действия гормона является его взаимодействие со специфическим рецептором клетки-мишени. Клетки, утратившие рецепторы, не способны к ответу. Рецепторы некоторых гормонов локализуются на поверхности клеточных мембран, рецепторы других — присутствуют в цитоплазме и ядре. Взаимодействие гормона и рецептора инициирует начало каскада ферментативных реакций, каждая стадия которого становится все более мощной, поэтому даже малая концентрация гормона способна давать существенный эффект.
Рецепторы гормонов являются крупными белками, и каждая восприимчивая к гормону клетка может иметь от 2000 до 100000 таких рецепторов. Рецепторы высокоспецифичны для конкретного гормона, что предопределяет тип гормона, который сможет оказать влияние на определенную ткань. Гормоном активирует только те ткани, которые располагают специфическим к нему рецептором.
Локализация различных типов рецепторов гормонов обычно следующая.
1. Внутри клеточной мембраны или на ее поверхности (рецепторы к гормонам белковой и полипептидной природы, катехоламинам).
2. В цитоплазме клетки (рецепторы к различным стероидным гормонам).
3. В клеточном ядре (рецепторы к гормонам щитовидной железы, которые предположительно связаны с одной или более хромосомами).
б) Количество и чувствительность рецепторов гормонов регулируются. Количество рецепторов клеток-мишеней обычно меняется изо дня в день и даже в течение нескольких минут. Белки-рецепторы часто инактивируются и разрушаются в процессе функционирования, а затем реактивируются и воссоздаются протеин-синтезирующими механизмами клеток. Например, увеличение концентрации гормона и связывание его с рецепторами может спровоцировать уменьшение количества активных рецепторов.
Регулируемое снижение активных рецепторов может быть результатом:
(1) инактивации части молекул рецептора;
(2) инактивации части внутриклеточных белковых информационных молекул;
(3) временной секвестрации рецептора внутри клетки, вне области взаимодействия с гормоном на мембране клетки;
(4) разрушения рецепторов лизосомами после их попадания в клетку;
(5) снижения формирования рецепторов.
В этом случае низкая рецепторная плотность приводит к снижению способности клетки реагировать на присутствие гормона в межклеточном веществе.
Некоторые гормоны способны повышать активность рецепторов и внутриклеточных информационных белков-переносчиков в клетках-мишенях. Это означает, что гормон либо индуцирует большее, чем обычно, образование рецепторов или сигнальных молекул в клетке с помощью протеин-синтезирующих систем, либо повышает способность рецептора к взаимодействию с гормоном. В этом случае ткани-мишени становятся более чувствительными к стимулирующему действию гормона.
в) Внутриклеточные сигналы гормон-рецепторного взаимодействия. Практически всегда ответ тканей-мишеней формируется при условии образования гормон-рецепторного комплекса. Это изменяет функцию самого рецептора, и активированный рецептор инициирует ответную реакцию клетки. Чтобы пояснить это, приведем несколько примеров различных видов такого взаимодействия.
г) Рецепторы, связанные с ионными каналами. Практически все нейромедиаторы, такие как ацетилхолин и норадреналин, взаимодействуют с рецепторами постсинаптической мембраны, что всегда является причиной изменения структуры рецептора, приводя к открытию или закрытию каналов для одного или более ионов. Одни из связанных с ионными каналами рецепторов открывают или закрывают натриевые или калиевые каналы, другие — кальциевые и т.д. Ионный ток через канал обусловливает последующий эффект в постсинаптических клетках.
Некоторые гормоны могут реализовать свои влияния, активируя ионные каналы рецепторов, однако большинство гормонов, открывающих и закрывающих ионные каналы, делают это не напрямую, а взаимодействуя с G-белок-или энзим-сопряженными рецепторами, как это обсуждается далее.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
II. Взаимодействие гормонов с рецепторами и механизмы передачи гормональных сигналов в клетки
Биологическое действие гормонов проявляется через их взаимодействие с рецепторами клеток-мишеней. Для проявления биологической активности связывание гормона с рецептором должно приводить к образованию химического сигнала внутри клетки, который вызывает специфический биологический ответ, например изменение скорости синтеза ферментов и других белков или изменение их активности (см. раздел 5).
Мишенью для гормона могут служить клетки одной или нескольких тканей. Воздействуя на клетку-мишень, гормон вызывает специфическую ответную реакцию. Например, щитовидная железа — специфическая мишень для тиреотропина, под действием которого увеличивается количество ацинарных клеток щитовидной железы, повышается скорость биосинтеза тиреоидных гормонов. Глюкагон, воздействуя на адипоциты, активирует липолиз, в печени стимулирует мобилизацию гликогена и глюконеогенез. Характерный признак клетки-мишени — способность воспринимать информацию, закодированную в химической структуре гормона.
А. Рецепторы гормонов
Начальный этап в действии гормона на клет-ку-мишень — взаимодействие гормона с рецептором клетки. Концентрация гормонов во внеклеточной жидкости очень низка и обычно колеблется в пределах 10 -6 —10 -11 ммоль/л. Клетки-мишени отличают соответствующий гормон от множества других молекул и гормонов благодаря наличию на клетке-мишени соответствующего рецептора со специфическим центром связывания с гормоном.
1. Общая характеристика рецепторов
Рецепторы пептидных гормонов и адреналина располагаются на поверхности клеточной мембраны. Рецепторы стероидных и тиреоидных гормонов находятся внутри клетки. Причём внутриклеточные рецепторы для одних гормонов, например глюкокортикоидов, локализованы в цитозоле, для других, таких как андрогены, эстрогены, тиреоидные гормоны, расположены в ядре клетки (см. раздел 5).
Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
В структуре мембранных рецепторов можно выделить 3 функционально разных участка. Первый домен (домен узнавания) расположен в N-концевой части полипептидной цепи на внешней стороне клеточной мембраны; он содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен — трансмембранный. У рецепторов одного типа, сопряжённых с G-белками, он состоит из 7 плотно упакованных α -спиральных полипептидных последовательностей. У рецепторов другого типа трансмембранный домен включает только одну α -спирализованную полипептидную цепь (например, обе β-субъединицы гетеротетрамерного рецептора инсулина α 2β2).
Третий (цитоплазматический) домен создаёт химический сигнал в клетке, который сопрягает узнавание и связывание гормона с определённым внутриклеточным ответом. Цитоплазматический участок рецептора таких гормонов, как инсулин, фактор роста эпидермиса и инсулиноподобный фактор роста-1 на внутренней стороне мембраны обладает тирозинки-назной активностью, а цитоплазматические участки рецепторов гормона роста, пролактина и цитокинов сами не проявляют тирозинкиназ-ную активность, а ассоциируются с другими цитоплазматическими протеинкиназами, которые их фосфорилируют и активируют.
Рецепторы стероидных и тиреоидных гормонов содержат 3 функциональные области. На С-концевом участке полипеггщдной цепи рецептора находится домен узнавания и связывания гормона. Центральная часть рецептора включает домен связывания ДНК. На N-концевом участке поли-пептидной цепи располагается домен, называемый вариабельной областью рецептора, отвечающий за связывание с другими белками, вместе с которыми участвует в регуляции транскрипции.
2. Регуляция количества и активности рецепторов
Концентрация рецепторов внутри клетки или на её поверхности и их сродство к данному гормону в норме регулируются различными способами, а также могут меняться при заболеваниях или при использовании гормонов или их агонистов в качестве лекарственных средств. Например, при воздействии β-адренергических агонистов на клетки в течение нескольких минут в ответ на новое добавление агониста прекращается активация аденилатциклазы, и биологический ответ исчезает. Такое снижение чувствительности рецептора к гормону (десенситизация) может происходить в результате изменения количества рецепторов по механизму понижающей регуляции.
Гормон связывается с рецептором, комплекс гормон-рецептор путём эндоцитоза проникает в клетку (интернализуется), где часть рецепторов подвергается протеолитическому расщеплению под действием ферментов лизосом, а часть инактивируется, отделяясь от других мембранных компонентов. Это приводит к уменьшению количества рецепторов на плазматической мембране. Например, в случае инсулина, глюкагона, катехоламинов это происходит в течение нескольких минут или часов. При снижении концентрации гормона рецепторы возвращаются на поверхность клетки, и чувствительность к гормону восстанавливается. Активность рецептора, т.е. его сродство к гормону, может изменяться также в результате ковалентной модификации, главным образом путём фосфорилирования. Концентрация внутриклеточных рецепторов может также регулироваться по механизму индукции и репрессии.
Б. Механизмы передачи гормональных сигналов в клетки
По механизму действия гормоны можно разделить на 2 группы. К первой группе относят гормоны, взаимодействующие с мембранными рецепторами (пептидные гормоны, адреналин, а также гормоны местного действия — цитокины, эйкозаноиды). Вторая группа включает гормоны, взаимодействующие с внутриклеточными рецепторами.
- в результате изменения активности ферментов;
- в результате изменения количества ферментов (табл. 11-3).
Таблица 11-3. Основные этапы передачи гормональных сигналов
1. Передача гормональных сигналов через мембранные рецепторы
Гормоны (первичные посредники), связываясь с рецепторами на поверхности клеточной мембраны, образуют комплекс гормон-рецептор, который трансформирует сигнал первичного посредника в изменение концентрации особых молекул внутри клетки — вторичных посредников. Вторичными посредниками могут быть следующие молекулы: цАМФ, цГМФ, ИФ3, ДДГ, Са 2+ , NO.
Гормоны, взаимодействие которых с рецептором клетки-мишени приводит к образованию цАМФ, действуют через трёхкомпонентную систему, которая включает белок-рецептор, G-белок и фермент аденилатциклазу. Образующийся под действием аденилатциклазы цАМФ активирует протеинкиназу А, фосфорилирую-щую ферменты и другие белки (см. раздел 5). Известно более 200 различных G-белков, в структуре которых обнаружены 3 субъединицы α, β и γ (см. раздел 5). В отсутствие гормона α-субъединица G-белка связана с ГДФ. Образование комплекса гормон-рецептора приводит к конформационным изменениям α-субъединицы, замене ГДФ на ГТФ и отщеплению димера βγ от α-ГТФ. В случае рецепторов, сопряжённых с Gs-белком, субъединица α-ГТФ активирует аденилатциклазу (рис. 11-3).
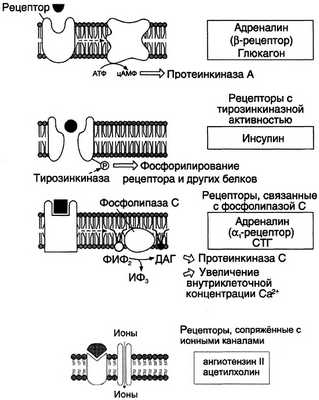
Рис. 11-3. Передача гормональных сигналов через мембранные рецепторы. ИФ3 — инозитол-3-фосфат; ДАГ — диацилглицерол; ФИФ2 — фосфоинозитолбисфосфат; СТГ — соматотропный гормон
В случае рецепторов, сопряжённых с Gsбелком, субъединица α1-ГТФ ингибирует аденилатциклазу. В таблице 11-4 приведены примеры гормонов, взаимодействие которых с соответствующим рецептором активирует или ингибирует аденилатциклазу.
Таблица 11-4. Активация и ингибирование аденилатциклазы гормонами

Другая система, генерирующая цГМФ как вторичный посредник, сопряжена с гуанилат-циклазой. Цитоплазматический домен такого типа рецепторов обладает активностью гуани-латциклазы, которая катализирует реакцию образования цГМФ из ГТФ (подобно аденилат-циклазе). Молекулы цГМФ могут активировать ионные каналы либо активировать цГМФ-зависимую протеинкиназу G, участвующую в фосфорилировании других белков в клетке. Например, фосфодиэстераза, которая гидролизует цАМФ до АМФ, активируется в результате фосфорилирования цГМФ-зависимой протеин-киназой.
Некоторые гормоны (например, вазопрессин или адреналин), образуя комплекс с соответствующими рецепторами (рецептор V1 для вазопрессина и α,-рецептор для адреналина), через активацию соответствующих G-белков активируют фосфолипазу С1 в результате чего в клетке появляются вторичные посредники ИФ3, ДАТ. Молекула ИФ3 стимулирует высвобождение Са 2+ из ЭР. Кальций связывается с белком кальмодулином. Этот комплекс активирует Са 2+ -кальмодулинзависимую протеинкиназу. Ионы кальция и ДАГ участвуют в активации протеинкиназы С (см. раздел 5).
Многие гормоны передают сигнал в клетку через рецепторы, которые либо обладают тирозинкиназной активностью, либо связываются с цитоплазматическими белками, проявляющими активность тирозинкиназы. Связывание инсулина с мембранным рецептором, который является тирозинкиназой и имеет центр фосфорилирования, инициирует аутофосфорилирование и последующее фосфорилирование субстратов рецептора инсулина и других белков (см. разделы 5 и ниже подраздел III, Ж).
В случае взаимодействия, например, эпидермального фактора роста или инсулиноподобного фактора роста -1с мембранным рецептором сначала происходят димеризация рецептора и его активация. Активированный таким образом гомодимер рецептора, участок которого на внутренней стороне мембраны обладает активностью тирозинкиназы, фосфорилируется сам (аутофосфорилирование) и вызывает фосфорилирование других белков и ферментов, которые участвуют в активации факторов транскрипции генов.
Некоторые гормоны (например, гормон роста, пролакгин, интерферон, цитокины) взаимодействуют с мембранными рецепторами, ассоциированными с цитоплазматическими протеинкина-зами (так называемыми «Янус-киназами», или киназами семейства JAK). Присоединение гормона вызывает димеризацию рецептора, присоединение Янус-киназ, их аутофосфорилирование и активацию. Янус-киназы, в свою очередь, фосфорилируют рецептор по остаткам тирозина, в результате чего рецептор связывается с другими белками, например, особыми белками — переносчиками сигнала и активаторами транскрипции (ПСАТ, или STAT — от англ. signal transducer and activator of transcription — переносчик сигнала и активатор транскрипции). Далее следует инициируемый тирозинкиназой каскад реакций фосфорилирования. Белки STAT фосфорилируются, образуют димеры, транспортируются в ядро, где, связываясь со специфическими участками ДНК, участвуют в регуляции транскрипции (рис. 11-4).
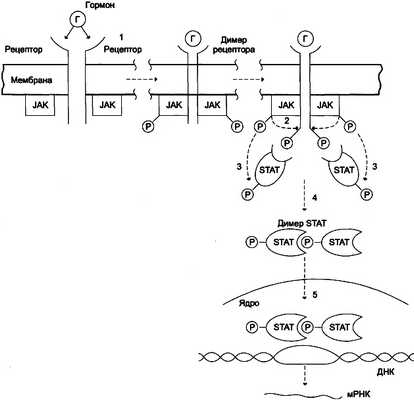
Рис. 11-4. Механизм передачи сигнала через мембранные рецепторы, ассоциированные с Янус-киназами (JAK). 1 — гормон взаимодействует с мембранным рецептором и вызывает димеризацию рецептора. Янус-киназы (цитоплазматические тиро-зинкиназы, имеющие два активных центра) связываются с димером мембранного рецептора, что приводит к их активации и ауто-фосфорилированию; 2 — янус-киназы (JAK) фосфорилируют димер рецептора по остаткам тирозина; 3 — комплекс фосфорилированного димера рецептора с Янус-киназами связывает особые цитоплазматические белки (STAT), которые фосфорилируются Янус-киназами; 4 — фосфорилированные белки STAT активируются, образуя димер; 5 — димер STAT перемещается из цитозоля в ядро, связывается с промоторным участком ДНК и индуцирует транскрипцию генов
Сигнальной молекулой в клетке может служить также оксид азота NO, образующийся в организме из аргинина при участии фермента NO-синтазы, присутствующего в нервной ткани, эндотелии сосудов, тромбоцитах и других тканях (см. раздел 9). Молекула NO может быстро диффундировать через мембрану эндотелиальных клеток, где она синтезируется, в соседние клетки. Действие оксида азота кратковременно, так как Т1/2 NO колеблется в пределах 5—10 с. В крови молекула существует примерно 100 мс, поскольку быстро взаимодействует с молекулярным кислородом, образуя нитрит, который далее превращается в нитрат и экскретируется с мочой.
В клетках-мишенях, например, эндотелиальных клетках NO взаимодействует с входящим в активный центр гуанилатциклазы ионом железа (см. раздел 5), способствуя тем самым быстрому образованию цГМФ. Увеличение концентрации цГМФ в клетках гладких мышц вызывает активациюкиназ, что в конечном итоге приводит к расслаблению ГМК сосудов и последующему их расширению. Механизм действия оксида азота объясняет использование нитроглицерина в качестве лекарственного препарата для снятия острых болей в сердце, поскольку нитроглицерин — источник образующихся молекул NO, которые и вызывают расслабление кровеносных сосудов и увеличение притока крови в миокард.
2. Передача сигналов через внутриклеточные рецепторы
Стероидные и тиреоидные гормоны связываются с рецепторами внутри клетки и регулируют скорость транскрипции специфических генов (рис. 11-5).
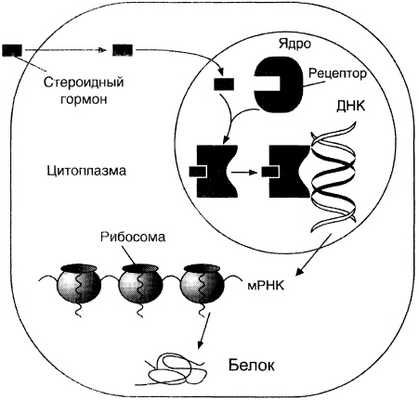
Рис. 11-5. Передача гормональных сигналов через внутриклеточные рецепторы (рецепторы стероидных гормонов могут находиться в цитоплазме и ядре)
В отсутствие гормона внутриклеточные рецепторы связаны обычно с другими белками в цитозоле или ядре. Например, рецепторы глюко-кортикоидов образуют в цитозоле комплекс с шапероном, что препятствует связыванию рецептора с молекулой ДНК (рис. 11-6).
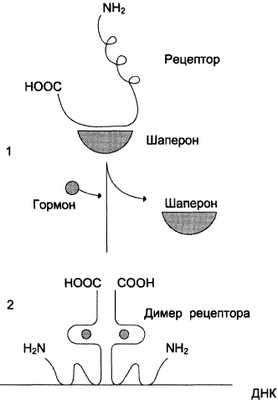
Рис. 11-6. Регуляция активности рецептора стероидных гормонов. 1 — в отсутствие гормона рецептор через гормонсвязывающий домен образует комплекс с шапероном, что препятствует связыванию рецептора с молекулой ДНК; 2 — в присутствии гормона рецептор освобождается от шаперо-на, образуется димер рецептора, который присоединяется к молекуле ДНК и вызывает активацию транскрипции
Взаимодействие гормона с центром связывания на С-концевом участке полипептидной цепи рецептора вызывает конформационные изменения и освобождение рецептора от шаперона. Происходит объединение 2 молекул рецептора с образованием гомодимера. Димер рецептора узнаёт специфическую последовательность нуклеотидов, которая расположена в промоторной области гена. Взаимодействие со специфическим участком ДНК HRE (от англ. hormone response element, элемент, реагирующий на воздействие гормона) обеспечивает центральный домен рецептора. Этот домен содержит аминокислотную последовательность, образующую 2 «цинковых пальца». В каждом «цинковом пальце» атом цинка связан с 4 остатками цистеина (рис. 11-7).
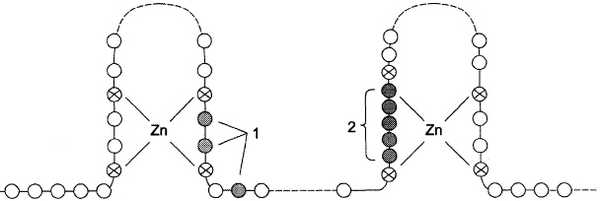
Рис. 11-7. Структура центрального домена стероидного гормона. 1 — аминокислотные остатки, участвующие в связывании ДНК; 2 — область димеризации. Центральный ДНК-связывающий домен содержит 2 «цинковых пальца». Атомы цинка связаны с аминокислотной последовательностью через остатки цистеина. Функциональные области 1 и 2 отвечают соответственно за связывание ДНК и димеризацию рецептора
В структуре одного «цинкового пальца» имеется последовательность аминокислот, отвечающая за связывание с ДНК, а второй «цинковый палец» содержит последовательность аминокислот, участвующую в димеризации рецепторов. Взаимодействие комплекса гормон-рецептор с определённой последовательностью нуклеотидов в промоторной части ДНК приводит к активации транскрипции.
Рецепторы тиреоидных гормонов всегда связаны с ДНК. В отсутствие гормонов соответствующие рецепторы ингибируют экспрессию генов. Напротив, взаимодействие с гормоном превращает их в активаторы транскрипции.
3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
Рецепторы, сопряжённые с ионными каналами, являются интегральными мембранными белками, состоящими из нескольких субъединиц. Они действуют одновременно как ионные каналы и как рецепторы, которые способны специфически связывать с внешней стороны эффектор, изменяющий их ионную проводимость. Эффекторами такого типа могут быть гормоны и нейромедиаторы (см. рис. 11-3).
Известны рецепторы для ряда гормонов, ассоциированных с ионными каналами, и большинства медиаторов, среди которых наиболее изучен рецептор ацетилхолина. Рецептор ацетилхолина состоит из пяти цилиндрообразных субъединиц, расположенных в мембране параллельно друг другу: α2, β, γ, δ. Между ними вдоль оси цилиндров находится заполненный молекулами воды канал. Каждая субъединица рецептора состоит из большого количества гидрофобных аминокислотных остатков. Кроме этого, все субъединицы содержат один спирализованный трансмембранный фрагмент, аминокислотные радикалы которого (полярные незаряженные аминокислотные остатки, в основном серин и треонин) выстилают центральный канал рецептора изнутри.
В средней части субъединиц, обращённой к каналу, локализованы остатки лейцина. В присутствии ацетилхолина боковые взаимодействия между субъединицами поддерживают канал в открытом состоянии и создают возможность для транспорта ионов. В отсутствие ацетилхолина в результате изменения ориентации субъединиц относительно друг друга канал закрывается, так как выступающие внутрь канала остатки лейцина образуют плотное гидрофобное кольцо, блокируя движение гидратированных ионов в этой области (рис. 11-8).
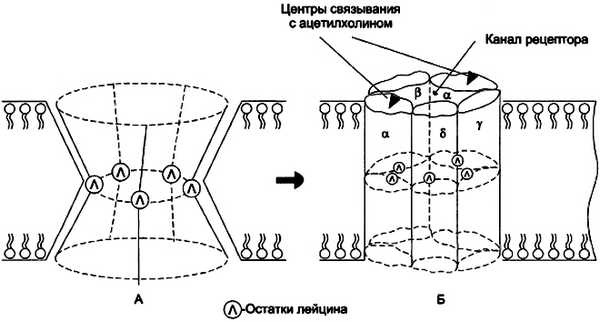
Рис. 11-8. Схема строения рецептора ацетилхолина. А — закрытый канал рецептора в отсутствие ацетилхолина; Б — открытый канал рецептора в присутствии ацетилхолина. Трансмембранные спирализованные участки всех 5 субъединиц содержат полярные незаряженные радикалы аминокислот; гидрофобные остатки лейцина (Л), локализованные в середине каждого спирализованного гидрофильного участка, выступают в центральную часть канала и препятствуют движению ионов
Читайте также:
- Отравление аминокапроновой кислотой и его побочные эффекты
- Инфекции Enterobius vermicularis и Strongyloides stercoralis: диагностика, лечение
- Наследственный синдром Меньера: клиника, диагностика и эпидемиология
- Псевдоневротические формы туберкулеза. Patraqueries у пациента
- Отравления растениями и их побочные эффекты
