Скрытая бактериемия
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Хронический пиелонефрит – это весьма часто встречающееся неспецифическое урологическое заболевание. Воспалительный процесс локализуется в почечных лоханках, а также может затрагивать паренхиматозную (основную) ткань почки. Хроническая форма, как правило, возникает в следствие недолеченного острого состояния, подобная история болезни характерна и возможна при любом воспалительном процессе.
Предрасполагающие факторы:
1. Пол - чаще у женщин, в 2-3 раза, 70% женщин заболевают до 40 лет, а
мужчины - после.
2. Гормональный дисбаланс: глюкокортикоиды и гормональные
контрацептивы.
3. Сахарный диабет, подагра.
4. Аномалии почек и мочевыводящих путей.
Пути инфицирования почек:
• основной – восходящая инфекция;
• гематогенный – исключительно на фоне сепсиса или эпизодов
бактериемии.
У женщин и девочек:
• анатомические особенности мочеполовой системы (болеют в 8
раз чаще);
• интенсивная половая жизнь;
• изменение в период менопаузы вагинальной флоры.
У мужчин пиелонефрит чаще развивается в пожилом возрасте при нарушении уродинамики.
Наиболее важные причины перехода острого инфекционного воспалительного процесса в хронический:
• имеющиеся причины нарушения оттока мочи;
• неправильное или недостаточное по длительности лечение
острого пиелонефрита;
• образование L-форм бактерий;
• хронические сопутствующие заболевания (СД, ожирение,
болезни ЖКТ, тонзиллит и др.);
• иммунодефицитные состояния.
Каждое очередное обострение пиелонефрита сопровождается вовлечением в воспалительный процесс все новых участков функционирующей почечной паренхимы. Это, в конечном итоге, приводит к вторично сморщенной почке, а при двустороннем процессе – к хронической почечной недостаточности.
Симптомы хронического пиелонефрита можно разбить на несколько синдромов.
1. Интоксикационный синдром: Астения, познабливание при нормальной температуре тела. В период обострения лишь у 20% повышается температура тела и чаще в вечернее время.
2. Болевой синдром выражен нерезко и характерен для периода обострения. В период скрытого течения симптомы пиелонефрита отсутствуют.
Чаще всего человек испытывает боли в поясничной области. Боль может отдавать вниз, в паховую область и на переднюю поверхность бедра. Часто врачи определяют положительный симптом Пастернацкого — болезненность в области почек при поколачивании в поясничной области.
3. Синдром артериальной гипертензии. При длительном течении заболевания симптомы пиелонефрита расширяются за счёт артериальной гипертензии, которая встречается у 50-75% больных.
4. Отёчный синдром не характерен для пиелонефрита и обычно исключает этот диагноз.
5. Синдром нарушения ритма отделения мочи. Характерные симптомы пиелонефрита — это поллакурия (увеличение частоты мочеиспускания) и никтурия, когда большая часть нормального суточного диуреза (объёма мочи) выделяется ночью.
6. Синдром патологических изменений в общем анализе мочи. Изменения в общем анализе мочи непостоянны: вне обострения будут нормальные показатели, а в период обострения наблюдаются лейкоцитурия и бактериурия.
7. Синдром анемии. Хронический пиелонефрит способствует и развитию анемии, возникающей на фоне хронических воспалительных заболеваний.
Прогноз и профилактика хронического пиелонефрита
Пациентам с хроническим пиелонефритом показано соблюдение щадящего режима с исключением факторов, провоцирующих обострение (переохлаждения, простуды). Необходима адекватная терапия всех сопутствующих заболеваний, периодический контроль анализов мочи, динамическое наблюдение уролога (нефролога).
Рекомендации по пищевому рациону включают отказ от острых и солёных блюд, специй, кофе, алкогольных напитков, рыбных и мясных наваров.
Диета должна быть витаминизированной, с содержанием молочных продуктов, овощных блюд, фруктов, отварной рыбы и мяса. В сутки необходимо употреблять не менее 1,5–2 л жидкости, чтобы не допустить чрезмерной концентрации мочи и обеспечить промывание мочевых путей. При обострениях хронического пиелонефрита и при его гипертонической форме накладываются ограничения на прием поваренной соли. При хроническом пиелонефрите полезны клюквенный морс, арбузы, тыква, дыни.
Профилактика хронического пиелонефрита состоит в своевременной и активной терапии острых мочевых инфекций (уретрита, цистита, острого пиелонефрита), санации очагов инфекции (хронического тонзиллита, гайморита, холецистита и др.); ликвидации местных нарушений уродинамики (удалении камней, рассечении стриктур и др.); коррекции иммунитета.
Скрытая бактериемия
Возраст детей со скрытой бактериемией и лихорадкой
Как уже указывалось в статьях на нашем сайте, наиболее часто бактериемия и другие тяжелые бактериальные инфекции наблюдаются у детей раннего возраста. Общее правило таково: чем младше ребенок, тем значительнее риск. Однако скрытая бактериемия, особенно вызванная S. pneumoniae, наиболее часто развивается в возрасте от 6 до 24 мес.
Сходные принципы применимы к детям с лихорадкой без локальных симптомов. McCarthy обнаружил, что у детей в возрасте от 3 до 18 мес с температурой выше 40 °С и без явных очагов инфекции скрытая бактериемия отмечалась в 14,5% наблюдений. Tophy описал 12 случаев скрытой пневмококковой бактериемии у детей с лихорадкой без локальных симптомов.
Возраст больных колебался от 2,5 мес до 6 лет, но 8 из 12 детей были в возрасте от 6 до 24 мес. Поданным Burke, из 111 больных пневмококковой бактериемией у 30 заболевание начиналось с лихорадки и без какой-либо явной причины. При контрольном обследовании, когда уже имелись положительные результаты посевов крови, у 15 из 30 детей по-прежнему не было очаговых проявлений инфекции и причина развития лихорадки осталась невыясненной.
Все 15 детей были в возрасте от 6 мес до 2,5 лет. Напротив, 35% детей с очаговой инфекцией были младше 6 мес или старше 2,5 лет. Baron изучил группу лихорадящих детей в возрасте 3— 24 мес, не имевших клинических признаков очаговой инфекции. Из 8 больных бактериемией, выявленных в этом исследовании, лишь двое (25%) были в возрасте от 3 до 6 мес; из крови у них был выделен S. pneumoniae. Возраст остальных 6 детей колебался между 6 и 24 мес и в 5 случаях возбудителем явился S. pneumoniae.
Сравнительная частота бактериемии у детей с лихорадкой без локальных симптомов и у детей с локализованной инфекцией
Roberts, Stuickland и McCarthy отмечают, что дети первых 3 мес жизни составляют группу, не только подверженную наибольшей опасности развития бактериемии и тяжелых инфекционных заболеваний, но и представляющую наибольшие трудности для клинической диагностики бактериемии.
Хотя Greene у 55 детей младше 2 мес с лихорадкой без явного ее источника и с нормальными показателями спинномозговой жидкости не выявил ни одного случая бессимптомной бактериемии, однако в дальнейшем у 9 из них развились тяжелые бактериальные и инфекционные заболевания: в 1 случае — мастит, в 4 — средний отит, в 4 — инфекция мочевых путей.
Как правило, чем меньше возраст ребенка с лихорадкой без локальных симптомов, тем больше вероятность развития у него скрытой бактериемии. Хотя пик частоты скрытой пневмококковой бактериемии приходится на возрастную группу от 6 мес до 2,5 лет, но дети первых 6 мес жизни подвержены большему риску развития инфекций, вызываемых другими возбудителя ми. К тому же бактериемия у них протекает с тяжелыми осложнениями.
В заключение следует сказать, что приведенные данные не нужно истолковывать таким образом, что старшие дети не входят в группу риска. Вернее оказать, что для них этот риск менее выражен.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Скрытая бактериемия
Сальмонеллез – это инфекция, которая вызывается сальмонеллой – бактерией, широко распространенной во всем мире. Также сальмонеллы могут вызывать другое инфекционное заболевание – брюшной тиф.
Чаще всего сальмонеллез протекает в виде кишечной инфекции и проявляется повышением температуры тела, поносом и рвотой. Однако иногда он может протекать значительно тяжелее и угрожать жизни больного.
Инфицирование обычно происходит через употребление продуктов, зараженных сальмонеллами, обычно это куриное мясо и яйца.
Легкие формы сальмонеллеза без лечения проходят за 3-5 дней. В тяжелых случаях необходима госпитализация и антибиотики.
Синонимы русские
Сальмонеллезная инфекция, нетифоидный сальмонеллез, небрюшнотифозный сальмонеллез.
Синонимы английские
Salmonellosis, Nontyphoidal salmonellosis, Nontyphoidal Salmonella Infections.
Симптомы
Обычно через 1-2 дня после заражения возникают следующие симптомы:
- тошнота;
- рвота, которая может быть многократной;
- схваткообразные боли в животе;
- понос желтого, зеленого цвета, часто водянистый, редко с примесью крови; стул многократный, до 10-20 раз в сутки;
- болезненность при прощупывании живота вокруг пупка, в правой нижней части живота;
- повышение температуры тела (при заболевании средней тяжести – до 39-40 градусов), общая слабость.
В типичных случаях сальмонеллез протекает 3-5 дней и проходит самостоятельно без лечения.
При заражении крови и распространении инфекции по организму симптомы будут зависеть от преимущественного поражения того или иного органа.
Общая информация о заболевании
Сальмонеллез является крайне распространенной инфекцией. Ежегодно по всему миру отмечается несколько десятков миллионов случаев заболевания.
Сальмонеллы – это бактерии, которые являются причиной большого количества заболеваний у человека, в том числе и брюшной тиф. Под сальмонеллезом понимают любое заболевание, вызванное бактериями из рода сальмонелл, кроме тех, которые вызывают брюшной тиф.
Сальмонеллы живут в организмах различных домашних животных: крупного рогатого скота, овец, свиней, цыплят, уток, домашних черепах. Кроме того, сальмонелл выделяют и птицы: воробьи, голуби, чайки. До 50 % кур также инфицировано сальмонеллами. Инфекция легко может попадать в яйца. В молочных и мясных продуктах сальмонеллы способны сохраняться до четырех месяцев, размножаясь в них. Вкус и внешний вид продуктов при этом не изменяются. Сальмонеллы устойчивы к солению, копчению, они выживают даже в сухих и замороженных продуктах. Во внешней среде бактерии могут сохраняться в течение нескольких месяцев.
Мясо животных может инфицироваться сальмонеллами при транспортировке, обработке, при неправильной кулинарной обработке, приготовлении пищи на загрязненных столах.
Вспышки заболевания чаще отмечаются в летнее время, что объясняется ухудшением условий хранения пищевых продуктов. Причины заражения: употребление зараженной еды, в основном куриного мяса, яиц, а также неправильно приготовленных фруктов, овощей, молочных продуктов.
Гораздо реже источником инфекции могут быть зараженные люди.
Инкубационный период (период от контакта с зараженной едой до возникновения симптомов) обычно довольно короткий – 12-48 часов (иногда 6 часов). Попадая в организм через рот, бактерии через желудок человека проникают в кишечник. В желудке часть из них погибает под воздействием желудочного сока. По этой причине для развития сальмонеллеза необходимо попадание в организм большого количества бактерий. Однако при повреждении желудка, уменьшении кислотности желудочного сока может быть достаточно лишь 1000 бактерий.
Когда бактерии проникают в кишечник, они преодолевают барьер слизистой и размножаются, вызывая повреждение стенки кишечника. Возникает воспаление, что приводит к образованию активных веществ, способствующих повышенному выделению жидкости в стенке кишки и, как следствие, поносу. Клетки иммунной системы начинают бороться с сальмонеллой, бактерии погибают, образуя при этом токсин, который поступает в кровь и вызывает повышение температуры тела и общую слабость.
В некоторых случаях сальмонеллы попадают в кровь и вызывают ее заражение (бактериемия) с последующими отсевами в различные органы и образованием там гнойных очагов, что значительно ухудшает прогноз заболевания. Это происходит у 10-15 % больных, особенно у маленьких детей и лиц пожилого возраста, а также у пациентов с нарушениями иммунитета (например, у ВИЧ-инфицированных).
Чаще всего сальмонеллезом болеют дети. У взрослых заболевание иногда протекает бессимптомно, хотя они могут выделять сальмонелл с калом. Выделение бактерии с фекалиями происходит нечасто, однако может играть роль в распространении заболевания, особенно если инфицированный человек работает в системе общественного питания.
Заражения крови при сальмонеллезе опасно развитием следующих осложнений:
- Эндокардит – это воспаление клапанов сердца, которое требует использования мощных антибиотиков при лечении и иногда хирургического вмешательства.
- Менингит – воспаление мозговых оболочек, которое чаще развивается у детей и в половине случаев приводит к летальному исходу. К счастью, он развивается довольно редко.
- Инфекция мочевыводящих путей. Риск воспаления мочевыводящих путей повышается при наличии их заболеваний (камни в почках, аномалии развития почек и мочеточников). . Воспаление легких особенно часто возникает у пожилых пациентов с диабетом или у алкоголиков.
- Абсцессы печени и селезенки. В печени и селезенке в результате размножения сальмонелл могут образовываться полости, заполненные гноем, – абсцессы. Их появление требует хирургической операции.
- Гнойное воспаление суставов (септический артрит).
- Остеомиелит – гнойное воспаление костей.
- Сепсис – системное воспаление, связанное с распространением возбудителя по крови и различным органам. В этом случае сальмонелл можно обнаружить в крови. Прогноз крайне неблагоприятен.
Кто в группе риска?
- Дети до 5 лет
- Пожилые люди
- Люди, у которых удален желудок или селезенка
- Лица со сниженным иммунитетом (больные онкологическими (раковыми) заболеваниями лимфатической системы, ВИЧ-инфицированные)
- Работники птицефабрик, животноводческих ферм
- Лица, употребляющие сырые куриные, гусиные, утиные яйца
- Путешественники
Диагностика
Диагностика сальмонеллеза осуществляется с учетом данных о наличии вспышки инфекции, истории развития заболевания, выделении сальмонелл из кала.
- . При сальмонеллезе в общем анализе кала могут обнаруживаться лейкоциты (белые кровяные клетки), что может указывать на активность воспаления в кишечнике. По сути, ключевой анализ, необходимый для установления диагноза. Исследование предполагает помещение кала в питательную среду, где бактерии начинают быстро размножаться и становятся доступными визуальной оценке. Биологический материал для посева рекомендуется брать до начала лечения антибиотиками, желательно на самых ранних сроках. . Метод основан на выявлении генетического материала возбудителя в исследуемом материале, обладает очень высокой достоверностью.
В целях оценки функции почек и проверки на обезвоживание проводятся следующие анализы:
- Лейкоциты. Повышение уровня лейкоцитов отражает активность воспаления. Чем тяжелее протекает сальмонеллез, тем выше уровень лейкоцитов.
- . Необходимо контролировать уровень электролитов в крови, так как их выраженное снижение в результате обезвоживания может приводить к тяжелым осложнениям. и аспартатаминотрансфераза (АСТ). Уровень этих печеночных ферментов может повышаться у значительного количества пациентов с сальмонеллезом, что отражает вовлечение в патологический процесс печени. и липаза в крови. Уровень амилазы и липазы – ферментов, выделяемых поджелудочной железой, – повышается при воспалении поджелудочной железы. и мочевина в сыворотке. Повышение содержания креатинина и мочевины указывает на развитие почечной недостаточности.
Объем дополнительного обследования определяется лечащим врачом и зависит от тяжести заболевания и возникших осложнений.
Лечение
В легких случаях достаточно восполнения потери жидкости с помощью приема солевых растворов. Заболевание проходит самостоятельно за несколько дней. Применение антибиотиков нежелательно, так как при этом увеличивается период выделения сальмонелл из организма с калом.
В тяжелых случаях или при высоком риске развития осложнений необходима госпитализация пациента в инфекционный стационар, назначаются антибактериальные препараты (ко‑тримоксазол или ципрофлоксацин). Как правило, лечение длится 3-5 дней. Если произошло заражение крови, прием антибиотиков может быть продлен на 1-1,5 месяца.
При возникновении гнойных осложнений может потребоваться хирургическая операция.
Заболевшие работники сферы питания должны быть отстранены от приготовления пищи. Для того чтобы убедиться в полном исчезновении возбудителя из организма, проводятся многократные посевы кала в течение нескольких недель.
Профилактика
Инфицирование сальмонеллезом не может быть исключено, так как его возбудители распространены повсеместно. Профилактика состоит в предотвращении заражения пищевых продуктов сальмонеллами и в соблюдении правил личной гигиены.
В целях профилактики сальмонеллеза и других кишечных инфекций необходимо соблюдать следующие рекомендации:
- Тщательно мыть руки перед приготовлением пищи
- Учить детей тщательно следовать правилам гигиены
- Соблюдать правила приготовления и хранения пищи, выдерживать необходимый температурный режим приготовления мяса и яиц
- Употреблять в пищу только пастеризованное молоко
- При наличии у больного диареи следует доверить приготовление пищи другим лицам
- Не рекомендуется употреблять сырые и сваренные всмятку куриные, страусиные, гусиные и утиные яйца
Также проводятся профилактические мероприятия, направленные на предупреждение заражения пищевых продуктов, соблюдение санитарно-гигиенических норм в животноводческих хозяйствах, торговле, сфере общественного питания
Рекомендуемые анализы
Литература
Dan L. Longo, Dennis L. Kasper, J. Larry Jameson, Anthony S. Fauci, Harrison's principles of internal medicine (18th ed.). New York: McGraw-Hill Medical Publishing Division, 2011.
Инфекции и сердце
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
Среди многообразной патологии сердца немалую долю занимают заболевания, возникающие вследствие негативного воздействия инфекционных агентов на сердце.
Инфекционные агенты - это огромное количество микроорганизмов, встречающихся в окружающем человека мире. К ним относятся бактерии, спирохеты, риккетсии, простейшие, патогенные грибы, вирусы. Если в прошлом веке виновниками поражения сердца были преимущественно бактерии, то в последние годы увеличивается значимость вирусных инфекций.
Инфекционные агенты могут оказывать прямое повреждающее действие на сердечную мышцу - миокард, или вызывать определенные негативные изменения со стороны иммунной системы, что приводит к нарушению ее функций.
Иммунная система - совокупность клеток, органов и тканей, осуществляющих иммунные реакции, основной смысл которых сводится к защите человеческого организма от негативного воздействия факторов окружающей среды. Защита осуществляется путем распознавания чужеродных клеток или веществ, попавших в организм человека, их обезвреживании или удалении из организма.
Функции иммунной системы регулируются нервной и эндокринной системами. Многообразие мощных стрессорных воздействий, сопровождающих жизнь современного человека, приводит к нарушению функций иммунной системы, а, следовательно, ослабляет его защиту от воздействия инфекционных агентов. Поэтому достаточно часто инфекционные поражения сердца возникают на фоне чрезмерных нагрузок, психических травм, негативных событий в жизни человека (конфликт на работе или в семье, болезнь близких людей, потеря работы, развод, смерть близкого человека и т.д.).
Защита организма от инфекций - бактериальной, вирусной, грибковой или паразитарной - осуществляется двумя системами иммунитета: врожденного, определенного генетическими факторами, передающимися от родителей, и приобретенного, формирующегося в процессе жизни человека.
Выделяют естественный и искусственный иммунитет. Естественный иммунитет формируется вследствие передачи от матери к плоду через плаценту или с молоком готовых защитных факторов, а также в результате контакта с возбудителем (после перенесенного заболевания или после скрытого контакта без появлений симптомов болезни). Профилактика инфекционных поражений начинается с зачатия ребенка и продолжается после его рождения - здоровая мать и грудное вскармливание - лучшие методы профилактики на этом этапе жизни человека.
После рождения ребенка в защиту включается и искусственный иммунитет, формирующийся при проведении профилактических прививок. Соблюдение календаря прививок - основа профилактики на последующих этапах жизни человека. В настоящее время прививки осуществляются против наиболее распространенных и тяжелых инфекций, но существует огромное количество других микроорганизмов, оказывающих повреждающее действие на организм человека в целом и сердце, в частности.
Наступила зима, а с ее приходом увеличивается количество болезней простудного характера. К наиболее распространенным простудным заболеваниям относятся острый тонзиллит (ангина), обострения хронического тонзиллита, фарингиты.
Тонзиллит - это воспаление глоточных миндалин, которые относятся к вторичным органам иммунной системы. Причиной возникновения как острого, так и хронического тонзиллита являются патогенные микроорганизмы (бактерии вирусы и грибки), которые, проникая в ткань миндалины, вызывают воспалительный процесс и могут оказать общее негативное воздействие на организм в виде интоксикации.
Острый и хронический процессы в миндалинах протекают по-разному. Проявлениями ангины бывают сильные боли в горле при глотании, увеличение подчелюстных и шейных лимфатических узлов, повышение температуры до 39-40 градусов, головные и мышечные боли, общая слабость, связанные с интоксикацией. Эти симптомы требуют обязательного, раннего обращения к врачу. Хронический тонзиллит и его обострения могут проявляться незначительным повышением температуры, особенно в вечерние часы, першением или небольшими болями в горле, сочетающимися с повышенной утомляемостью, утренней слабостью, беспокойным сном, нарушением аппетита, что в итоге снижает трудоспособность человека. Такое состояние называют тонзиллогенной интоксикацией. Очень часто пациент, побывав на приеме у многих специалистов, так и уходит от них без ответа на вопрос: «Почему у него повышенная температура?». А все дело только в хроническом воспалении миндалин, при лечении которого указанные симптомы исчезают. Многие люди переносят обострения тонзиллита "на ногах", не придают значения его симптомам. А в последующем расплачиваются за это развитием осложнений. Для возникновения тонзиллита есть несколько причин - особенности строения миндалин, нарушение иммунитета, неблагоприятные факторы внешней среды - переохлаждение, вирусные простудные заболевания. Среди факторов, вызывающие обострение тонзиллита, выделяют социальные -некачественное питание, неблагоприятная экологическая обстановка, максимальная занятость на рабочем месте, стрессы, условия труда, быта, курение, и медицинские - заболевания ЛОР-органов - патология околоносовых пазух, индивидуальные особенности строения ЛОР-органов (искривление носовой перегородки, увеличение носовых раковин, заболевания носоглотки (аденоиды, полипы), частые респираторные заболевания, а также кариес зубов. Хроническому воспалению в небных миндалинах могут способствовать иммунодефицитные состояния, другие заболевания внутренних органов, сопутствующая эндокринная патология.
При хроническом тонзиллите в миндалинах можно обнаружить до нескольких десятков (обычно около 30) видов микроорганизмов - грибов и бактерий, но основной причиной заболевания является стрептококк.
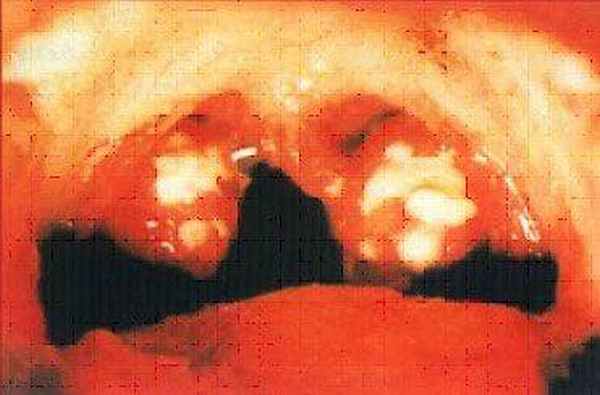
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
- Для больных, перенесших ОРЛ без кардита (артрит, хорея) - не менее 5 лет после атаки или до 18 лет (по принципу «что дольше»).
- Для больных, с излеченным кардитом без порока сердца - не менее 10 лет после атаки или до 25 лет (по принципу «что дольше»).
- Для больных, со сформированным пороком сердца (в том числе оперированным) - пожизненно.
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
Аортальный клапан
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Стрептококковая инфекция — инфекционные заболевания, вызываемые стрептококками, преимущественно β-гемолитическими группы А (СГА).
Стрептококки группы А могут вызывать заболевания (скарлатина, рожа) и местные воспалительные процессы с локализацией в различных органах и системах организма (кожа, суставы, сердце, мочевыделительная, дыхательная системы и др.).
В настоящее время известно 83 серологических типа СГА. Считается, что один и тот же серотип стрептококка способен вызвать как носительство, так и любое заболевание.
Стрептококки способны продуцировать ряд токсинов и ферментов агрессии, наличие и уровень активности которых определяют индивидуальную вирулентность каждого отдельного штамма возбудителя.
Вот только некоторые из них:
1. Токсин эритрогенин оказывает на организм наибольшее воздействие:
- цитотоксическое,
- пирогенное,
- симпатикотропные свойства, вызывают у больных нарушение кровообращения,подавляет функции ретикулоэндотелиальной системы.
2. Стрептолизин S оказывает на организм иммуносупрессорное (подавляющее) действие.
Стрептококки высокоустойчивы к физическим воздействиям, хорошо переносят замораживание, в высохшем гное способны сохраняться неделями и месяцами, но быстро погибают под действием дезинфицирующих средств и антибиотиков, особенно пенициллина.
Вот такая интересная инфекция, особенно если вспомнить, что сейчас осень и мы все, и в большей степени дети, подвержены различным простудным заболеваниям, а стрептококки не дремлют.
Чем же он так страшен? Почему его так боятся?
Источник инфекции — человек, больной любой формой стрептококковой инфекции, а также носитель патогенных штаммов стрептококка.
В эпидемическом отношении наиболее опасными являются дети с поражением носа, ротоглотки и бронхов (скарлатина, ангина, назофарингит, бронхит), особенно посещающие детские сады и школы.
Большую роль в распространении инфекции играют пациенты с легкими, атипичными формами стрептококковых заболеваний (типа "немного болит горло"), а также носители стрептококка, имеющие хронические заболевания (аденоидиты, тонзиллиты, фарингиты и др.).
Основной путь передачи — воздушно-капельный. Интенсивность распространения стрептококка значительно возрастает при ОРВИ (кашель, чихание).
У детей раннего возраста возможен контактно-бытовой путь — через инфицированные игрушки, предметы ухода, руки ухаживающего персонала.
Пищевой путь — через продукты (молоко, сметана, творог, кремы), в которых стрептококки быстро размножаются, может приводить к возникновению вспышек стрептококковых заболеваний, характеризующихся чертами, присущими пищевым токсикоинфекциям.
Восприимчивость к стрептококку высокая. В различных возрастных группах преобладают определенные клинические формы стрептококковой инфекции.
У новорожденных и детей первых месяцев жизни в связи с наличием антитоксического иммунитета, приобретенного от матери, практически не встречается скарлатина, но наблюдаются различные гнойно-воспалительные заболевания (отит, стрептодермия, лимфаденит, остеомиелит и др.).
В более старших возрастных группах чаще встречается скарлатина и относительно реже — гнойно-септические процессы.
Заболевания которые может вызвать стрептококк
Скарлатина является наиболее распространенной формой стрептококковой инфекции у детей.
На современном этапе скарлатина в большинстве случаев протекает в легкой форме, что приводит к поздней диагностике, частым диагностическим ошибкам, несвоевременному лечению.
Дети, посещающие детские учреждения, заболевают в 3-4 раза чаще детей, воспитывающихся дома. В этой же группе отмечают более высокие показатели «здорового» бактерионосительства.
Проявления заболевания
Характерная алая сыпь, возникающая при скарлатине, — это реакция организма на эритротоксин, который с первого дня развития болезни вырабатывается стрептококка при размножении на слизистых поверхностях. Под воздействием этого токсина мелкие кровеносные сосуды расширяются, образуя пятна красного цвета и округлой формы.
Сочетание ангины и красной сыпи, постепенно захватывающей поверхности тела, начиная с головы и спускаясь вниз, позволяет уверенно диагностировать данное заболевание при внешнем осмотре.
К специфическим симптомам относят также отсутствие сыпи в области носогубного треугольника, что, вместе с выраженной гипертермией, покраснением щек и одутловатостью шеи из-за увеличения шейных лимфатических узлов составляет характерную картину внешности заболевшего ребенка.
Инкубационный период от момента заражения до появления явных симптомов составляет в среднем 5-7 дней, но известны случаи, когда скрытый этап длился от нескольких часов до 12 дней. При этом заболевший скарлатиной ребенок заразен с первого же дня до клинического выздоровления, то есть в течение примерно трех недель.
Ранние осложнения скарлатины у детей
Как правило, возникновение осложнений раннего и позднего периода связано с несвоевременной диагностикой или недостаточностью терапии заболевания.
Лечение скарлатины требует четкого соблюдения всех назначений специалиста не только для быстрого и эффективного выздоровления, но и для предотвращения развития многочисленных и достаточно серьезных осложнений данной инфекции.
При внедрении в организм инфекционный агент начинает негативно воздействовать на различные органы и системы. К наиболее распространенным осложнениям раннего периода скарлатины у детей относят такие явления, как:
- отит среднего уха, воспаление миндалин, носовых пазух вследствие развития инфекции в носоглотке;
- воспалительные процессы, гнойные очаги в печени, почках;
- изменение, истончение сердечных стенок, что приводит к увеличению размеров сердца, снижению его работоспособности, уровня наполнения кровеносных сосудов. «Скарлатиновое» или токсическое сердце как синдром сопровождается понижением кровяного давления, снижением частоты сердцебиения, одышкой, болями в области груди;
- нарушения в работе кровеносной системы вследствие воздействия стрептококков на стенки сосудов, что опасно кровоизлияниями в различных частях тела, в том числе в головном мозге.
Данные осложнения развиваются при заболевании скарлатиной ослабленным ребенком или при несвоевременном начале терапии, приводящим к тяжелой форме скарлатины. Поэтому так важно вовремя обратиться к врачу, чтобы был установлен правильный диагноз.
Поздние осложнения скарлатины
Большинство поздних осложнений при заболевании скарлатиной связаны с несвоевременным начало лечения и несоблюдением назначений в режиме и ограничении нагрузок во период заболевания и восстановления.
1. Суставной ревматизм
Первые симптомы отмечаются в среднем спустя две недели после клинического выздоровления и включают следующие проявления:
- болевые ощущения в крупных суставах конечностей;
- несимметричную локализацию воспалительных процессов;
- покраснение, отечность над суставом.
2. Миокардит
Воспаление развивается при проникновении стрептококка в сердечную мышцу. Для излечения миокардита необходимо устранение причины заболевания, что подразумевает полноценное лечение скарлатины.
Для уменьшения вероятности возникновения миокардита в период заболевания и в течение двух недель после выздоровления необходимо ограничивать физическую нагрузку. Поэтому скарлатина у детей требует освобождения от уроков физкультуры на срок от двух недель и соблюдение постельного режима в процессе лечения скарлатины.
3. Гломерулонефрит
Проявления гломерулонефрита могут отмечаться как через несколько дней, так и спустя несколько недель после заболевания скарлатиной.
В начале болезни проявляются следующие признаки:
- гипертермический вираж, повышение температуры тела;
- боли в поясничном отделе;
- снижение общего объема выделяемой мочи, изменение ее прозрачности, наличие осадка;
- отеки, особенно проявляющиеся после сна.
4. Пневмония
В 5% случаев поздним осложнением скарлатины является воспаление легких. Стрептококковая пневмония развивается на первой неделе заболевания скарлатиной септической формы из-за попадания стрептококков в легкие по дыхательным путям.
Если воспаление легких отмечается позднее, то обычно возбудителем является пневмококк, присоединяющийся на фоне ослабленного иммунитета организма ребенка.
Вот такая бы казалась детская инфекция, которая приводит к таким серьезным осложнениям в здоровье.
Принципы лечения скарлатины в детском возрасте
При диагностике скарлатины лечение определяется врачом. В первую очередь выбор терапии основывается на форме заболевания, тяжести его течения и сопутствующих болезнях, дисфункциях и индивидуальных особенностях ребенка.
Легкая форма не всегда требует назначения антибиотиков, необходимость антибиотикотерапии определяется педиатром.
В обязательную поддерживающую терапию, направленную на облегчение симптоматики и снижение вероятности развития осложнений, включают препараты противовоспалительного действия для носоглотки, жаропонижающее, если есть такая необходимость. Обязательным условием является обильное питье, а также соблюдение постельного режима больного, отсутствие нагрузок, покой, диетическое питание.
Средняя и тяжелая формы заболевания скарлатиной излечиваются антибиотиками пенициллиновой группы, наиболее эффективной против стрептококков.
Если при установленном диагнозе скарлатины лечение антибиотиками пенициллинового ряда невозможно (например, при наличии аллергической реакции к пенициллину), подбираются препараты других групп, к которым установлена чувствительность стрептококка.
В дополнение к обязательной антибиотикотерапии назначаются жаропонижающие средства, препараты для дезинтоксикации организма, витамины. При присоединении осложнений подбирается соответствующий курс лечения.
Лечением скарлатины занимается врач-педиатр, самостоятельные назначения препаратов недопустимы.
При любой форме заболевания скарлатиной необходимо обильное питье для вывода эритотоксинов и облегчения состояния больного, а также постельный режим и полный покой пациента.
Следует помнить, что скарлатина в легкой форме при несоблюдении назначений врача может стать причиной серьезных осложнений, приводящих к хроническим заболеваниям или инвалидизации ребенка.
Стрептококк профилактика
Скарлатина — болезнь, пока не поддающаяся профилактике методами вакцинации. Поэтому, чтобы избежать заболевания скарлатиной, проводятся меры неспецифической профилактики, препятствующие распространению инфекции в детских коллективах.
Поэтому при диагностике скарлатины у ребенка, посещающего дошкольное или школьное образовательное учреждение в классе или группе детского сада, устанавливается недельный карантин. При наличии контакта с заболевшим скарлатиной ребенком других детей допускают в коллектив только через 17 дней при отсутствии симптомов начала болезни.
Тем, кто перенес скарлатину дома, разрешается посещение детского учреждения спустя 22 дня от первого дня болезни, а выписанным из стационара — через 12 дней с момента выписки.
Такие карантинные меры помогают снизить процент заболеваемости и предотвратить эпидемии в детских садах, школах и иных формах детских коллективов.
Соблюдение личной гигиены также является одним из методов профилактики заболевания скарлатиной.
1. Обязательное мытье рук с мылом в течение 30 секунд, тщательная их обработка, особенно по возвращении из мест скопления людей, регулярная санитарная обработка игрушек, предметов, поверхностей, мытье продуктов питания позволяют эффективно уничтожать большинство болезнетворных микроорганизмов.
2. В доме, где находится больной скарлатиной, проводят особые гигиенические мероприятия, включающие регулярную обработку поверхностей хлорамином, кипячение постельного, нательного белья и посуды, антисептическую обработку игрушек.
3. При контакте с больным скарлатиной рекомендуется регулярное полоскание горла антисептиком, особенно при наличии хронических заболеваний носоглотки (фарингит, тонзиллит, гайморит и т. п.), промывание носовых ходов солевым раствором.
Факты о стрептококковой инфекции
Обзор составлен на основе обзора Федеральных клинических рекомендации от апреля 2015 года.
По данным ВОЗ стрептококковая инфекция признается самой опасной из всех предупреждаемых вакцинопрофилактикой болезней.
Стрептококки — это бактерии, которые вызывают отиты, бронхиты, пневмонию, менингиты, сепсис.
В России из 500 тысяч случаев пневмоний в год пневмококковую этиологию имеют 76% у взрослых и до 90% у детей в возрасте до 5-ти лет!
При обследовании детей в возрасте до 5-ти лет, госпитализированных в стационары по поводу острой бактериальной инфекции (сепсис, бактериемия, менингит, пневмония, острый отит, синусит), при посевах образцов в 47% случаев был выявлен S.pneumoniae («стрептококк пневмония»), что подтверждает его лидирующую роль в структуре инфекционных заболеваний.
Носительство стрептококка в носоглотке в большинстве случаев протекает бессимптомно, однако у детей первых лет жизни может сопровождаться насморком.
К сожалению, в настоящее время формируется большое количество антибиотикоустойчивых форм стрептококка.
Согласно позиции ВОЗ — единственный способ существенно повлиять на заболеваемость и смертность от стрептококковой инфекции, снижение уровня антибиотикорезистентности.
В настоящее время в России вакцинация против стрептококк пневмония проводится 3-мя препаратами — Превенар, Пневмовакс 23, Синфлорикс. Какой препарат наиболее подходящий для конкретного случая — подробнее подскажет врач-педиатр на приеме.
В настоящее время вакцинация проводится, начиная с 2-х месячного возраста и до глубокой старости.
Читайте также:
