Содержание ДНК в нуклеосоме
Добавил пользователь Валентин П. Обновлено: 07.01.2026
Структурная динамика нуклеосом и их взаимодействий: поиск подходов для диагностики и лечения онкологических заболеваний. НИР
Structural dynamics of nucleosomes and their interactions: identifying approaches for the diagnosis and treatment of cancer.
Нуклеосомы являются ключевым структурным элементом хроматина у всех высших организмов и представляют собой около 200 пар нуклеотидов ДНК, намотанных на октамер белков гистонов. Нуклеосомы не только способствуют компактизации ДНК, но и непосредственно участвуют в регуляции практически всех процессов, связанных с работой генома (транскрипция, репликация, репарация ДНК, регуляции экспрессии генов и т.д.). Множество белков хроматина взаимодействует с нуклеосомами, узнавая особенности их белкового состава и/или последовательности и конформации ДНК. Понимание множества этих взаимодействий является ключом к дальнейшему пониманию работы хроматина, регуляции деятельности клеток и живых организмов на эпигенетическом уровне, и, в конечном итоге механизмов многих социально значимых заболеваний человека. В частности, ряд исследований на данный момент свидетельствуют от том, что нарушения в механизмах взаимодействий нуклеосом и белков ремоделеров хроматина (комплексов, которые передвигают нуклеосомы или изменяют их состав) помогают раковым клеткам репрограммировать свой геном (в эпигенетическом смысле) для поддержания онкогенного фенотипа. Важной особенностью нуклеосом, которая стала очевидной буквально за последний год, является пластичность гистонового октамера внутри нуклеосомы. Так изменения ряда аминокислотных остатков внутри октамера или введение дисульфидных связей внутри глобулярных доменов гистоновых димеров (ранее считавшихся компактными жесткими образованиями) влияют на возможности некоторых ремодлелеров хроматина (Swr1, SWI/SNF, SNF2h) перемещать нуклеосомы или изменять их состав. Механизмы этой пластичности пока остаются загадкой, но очевидно, что она играет важную роль во взаимодействиях нуклеосом с белками хроматина. Можно только предположить, что поскольку в ходе миллиардов лет эволюции эукариот структура нуклеосом и последовательность основных гистонов практически не менялась, машинерия хроматина подстроилась под тончайшие аспекты динамики и пластичности нуклеосом. Несмотря на успехи методов структурной биологии, хроматин в структурном и динамическом плане остается весьма сложной для изучения и понимания системой. Стандартные методы кристаллографии и ЯМР испытывают проблемы с изучением динамических структур большого размера, каковыми являются комплексы нуклеосом с взаимодействующими белками, хотя некоторый прогресс в этой области наблюдается в последние годы. В этой связи все большую роль приобретают методы компьютерного моделирования, в том числе методы интегративного и сравнительного моделирования, методы анализа “омиксных” данных. Они позволяют проводить структурную интерпретацию различных экспериментальных данных, создавать модели (в том числе динамические) на основе комбинации различных данных, проводить отбор наиболее вероятных моделей, в ряде случаев изучать динамику систем из “первых принципов” (методы атомистической молекулярной динамики). Настоящий проект посвящен исследованию внутренней динамики/пластичности нуклеосом и исследованию их взаимодействий с белками хроматина методами молекулярного моделирования и биоинформатики. Проект состоит из четырех взаимодополняющих частей: 1) Моделирования внутренней пластичности октамера гистонов в нуклеосоме, для понимания влияния этой пластичности на взаимодействия нуклеосом с белками хроматина (в частности, ремоделеров SWR1, SNF2h, SWI/SNF); 2) Моделирования взаимодействия нуклеосом с пептидами, включая дизайн пептидов эффективно связывающихся с кислотным лоскутом на нуклеосоме 3) Биоинформатического анализа всех взаимодействий нуклеосом с белками хроматина человека, включая создание базы данных по этим взаимодействиям, 4) Биоинформатического анализа мутаций и профилей экспрессии в злокачественных опухолях на предмет наличия изменений в последовательности или уровне экспрессии белков взаимодействующих с нуклеосомами с последующей структурной интерпретацией таких изменений. В результате проекта будут получены новые знания в области взаимодействия нуклеосом и гистонов с белками хроматина, разработаны методы анализа и моделирования таких взаимодействий востребованные научным сообществом, изучено влияние аминокислотных замен на такие взаимодействия, сформулированы гипотезы для экспериментальной проверки, которые могут быть экспериментально проверены нашими коллегами. Исследования будут выполняться молодым, но квалифицированным коллективом специалистами, обладающих высоким рейтингом научных публикаций, опытом международной работы, широкими связями с экспериментальными группами в своей области. Результаты проекта будут востребованы для понимания механизмов развития онкологических заболеваний, в том числе, разработке лекарственных препаратов и биомаркеров.
Nucleosomes are the key structural elements of chromatin in all higher organisms and represent about 200 pairs of DNA nucleotides wound around the octamer of histone proteins. Nucleosomes not only contribute to the DNA compactification, but also directly participate in the regulation of virtually all processes associated with the genome (transcription, replication, DNA repair, regulation of gene expression, etc.). A variety of chromatin proteins interact with nucleosomes, recognizing the characteristics of their protein composition and / or DNA sequence and conformation. Understanding the multitude of these interactions is the key to further understanding the work of chromatin, regulating the activity of cells and living organisms at the epigenetic level, and, ultimately, the mechanisms of many socially significant human diseases. In particular, a number of studies at the moment show that disturbances in the mechanisms of interactions between nucleosomes and proteins of chromatin remodelers (complexes that move nucleosomes or change their composition) help cancer cells reprogram their genome (in the epigenetic sense) to maintain the oncogenic phenotype. An important feature of nucleosomes, which became apparent literally over the past year, is the plasticity of the histone octamer inside the nucleosome. Thus, changes in a number of amino acid residues within an octamer or the introduction of disulfide bonds within the globular domains of histone dimers (previously considered compact rigid formations) affect the ability of some chromatin remodelers (Swr1, SWI / SNF, SNF2h) to move nucleosomes or change their composition. The mechanisms of this plasticity are still a mystery, but it is obvious that it plays an important role in the interactions of nucleosomes with chromatin proteins. One can only assume that since during the billions of years of evolution of eukaryotes the structure of the nucleosomes and the sequence of the main histones practically did not change, the chromatin machinery was adjusted to the subtlest aspects of the dynamics and plasticity of the nucleosomes. Despite the success of the methods of structural biology, chromatin in structural and dynamic terms remains very difficult to study and understand by the system. Standard methods of crystallography and NMR are experiencing problems with the study of dynamic structures of large size, such as nucleosome complexes with interacting proteins, although some progress in this area has been observed in recent years. In this regard, an increasing role is played by methods of computer modeling, including methods of integrative and comparative modeling, methods for analyzing "omics" data. They allow to carry out a structural interpretation of various experimental data, to create models (including dynamic ones) on the basis of a combination of different data, to select the most probable models, and in a number of cases to study the dynamics of systems from the "first principles" (methods of atomistic molecular dynamics). The present project is devoted to the study of internal dynamics / plasticity of nucleosomes and to the study of their interactions with chromatin proteins by methods of molecular modeling and bioinformatics. The project consists of four complementary parts: 1) Modeling the internal plasticity of the histamine octamer in the nucleosome, to understand the effect of this plasticity on the interactions of nucleosomes with chromatin proteins (in particular, SWR1, SNF2h and SWI / SNF remodelers); 2) Modeling the interaction of nucleosomes with peptides, including the design of peptides that effectively bind to the acid flap on the nucleosome; 3) the bioinformatic analysis of all interactions of nucleosomes with human chromatin proteins, including the creation of a database on these interactions, 4) the bioinformatic analysis of mutations and expression profiles in malignant tumors subject to the presence of changes in the sequence or level of expression of proteins interacting with nucleosomes, followed by a structural interpretation of such changes neny. As a result of the project, new knowledge will be obtained in the field of interaction of nucleosomes and histones with chromatin proteins, methods for analysis and modeling of such interactions are claimed by the scientific community, the effect of amino acid substitutions on such interactions has been developed, hypotheses for experimental verification have been formulated that can be verified experimentally by our colleagues. The research will be carried out by young, but qualified specialists with high scientific publications, international work experience, wide connections with experimental groups in their field. The results of the project will be in demand for understanding the mechanisms of development of cancer, including the development of new therapeutics and biomarkers.
==== План работ и ожидаемые результаты ==== Диаграмма работ приведена на Рисунке 10. =Пакет задач 1. Моделирование внутренней пластичности октамера гистонов в нуклеосоме. (Годы 1-3).= Задача 1.1. Построить модели конформационных перестроек димеров H3-H4 в нуклеосомах необходимых для взаимодействий с ремоделерами SNF2h и SWI/SNF. - Годы 1-2 Ожидаемые результаты (Год 1): С помощью методов атомистической МД (включая метадинамику, управляемую динамику и иные “продвинутые” методы) будет изучена внутренняя динамика димера гистонов H3-H4 в контексте имеющихся экспериментальных данных. Ожидаемые результаты (Год 2): Будут построены модели пластичности нуклеосомы (включая ДНК) согласующиеся с динамикой димера H3-H4. Задача 1.2. Установить влияние различия последовательности гистонов H2A и его варианта H2A.Z на конформацию и динамику H2A-H2B димеров и построить комплексную модель, объясняющую селективность связывания ремоделера Swr1 у дрожжей (аналог p400 и SRCAP человека) с нуклеосомами содержащими гистон H2A. - Год 2-3. Ожидаемые результаты (Год 2): Проведено сравнительное моделирование димеров гистонов H2A/H2B и H2A.Z/H2B пекарских дрожжей методами атомистической молекулярной динамики, включая “продвинутые” методы МД. Установлен характер влияния аминокислотных различий на динамику. Ожидаемые результаты (Год 3): Разработаны методы вычисления вероятности дейтеро-водородного обмена по данным динамики. Получены профили динамики и вероятности дейтеро-водородной обмена вдоль последовательности гистонов для сравнения с возможными экспериментальными данными. Задача 2.1. Провести структурный и энергетический анализ известных взаимодействий пептидов/ мотивов белков с кислотным лоскутом нуклеосомы (включая пептид LANA, белок CENP-C, антитело PL2-6). - Годы 1-2 Ожидаемые результаты (Год 1): Проведена молекулярная динамика комплексов пептидов с нуклеосомами, оценена динамика взаимодействий различных участков пептидов, построены карты контактов. Ожидаемые результаты (Год 2): Оценена энергия взаимодействия различных известных пептидов с нуклеосомами, проведенabintiдокингизвестныхпептидовдляоценкивоспроизводимостирезультатовикачества скоринговых функций. Задача 2.2. Провести дизайн искусственных пептидов с высокой аффинностью связывания с кислотным лоскутом. - Годы 2-3 Ожидаемые результаты (Год 2): Проведен дизайн пептидов на основе оценки изменения энергии взаимодействия известных пептидов при введении точечных мутаций в пептиды с целью оптимизации энергии связывания. Ожидаемые результаты (Год 3): Проведен дизайн пептидов селективных к нуклеосомам с различными гистоновыми вариантами. =Пакет задач 3. Биоинформатический анализ интерактома нуклеосом, разработка базы данных по взаимодействиям нуклеосом. (Годы 1-3).= Задача 3.1. Анализ и классификация всех имеющихся в открытом доступе данных по взаимодействию нуклеосом с белками хроматина у человека (Годы 1-2). Ожидаемые результаты (Год 1): Реализован программный пайплайн, который в полуавтоматическом режиме загружает и анализирует из открытых баз данных информацию о взаимодействиях нуклеосом с белками хроматина. Ожидаемые результаты (Год 2): Проведена полуавтоматическая курация, аннотация и классификация собранного набора данных. Задача 3.2. Разработать базу данных и веб-ресурс, представляющие в интерактивном виде информацию о известных взаимодействиях нуклеосом с белками хроматина, включая информацию по имеющимся трехмерным структурам. (Годы 2-3). Ожидаемые результаты (Год 2): Разработан дизайн структуры базы данных, создана тестовая реализация на основе СУБД ( Системы управления базы данных). Ожидаемые результаты (Год 3): Реализован интерактивный интерфейс к базе данных. =Пакет задач 4. Пакет задач 4. Биоинформатический анализ геномных и транскиптомных данных опухолей с точки зрения организации хроматина на нуклеосомном уровне (Годы 2-3)= Задача 4.1. Проанализировать белки, взаимодействующие с гистонами и нуклеосомами, на предмет наличия в них повторяющихся (более чем у одного пациента) мутаций в образцах раковых опухолей по наборам данных международного консорциума раковых геномов и атласа раковых геномов (ICGC, TCGA). Провести структурную интерпретацию этих мутаций с расчетом их влияния на стабильность комплексов (при наличии соответствующий структур). -( Годы 2-3) Ожидаемые результаты (Год 2): Список белков взаимодействующих с гистонами и нуклеосомами (включая сами гистоны), для которых обнаружены статистически значимые мутации в образцах раковых опухолей. Ожидаемые результаты (Год 3): Анализ влияния мутаций в образцах раковых опухолей на стабильность и структуру комплексов нуклеосом и гистонов с белками хроматина. Задача 4.2. Проанализировать белки, взаимодействующие с гистонами и нуклеосомами, на предмет аномалий экспрессии в образцах раковых опухолей по наборам данных международного консорциума раковых геномов и атласа раковых геномов (ICGC, TCGA). Провести интерпретацию влияния повышенной или пониженной концентрации белка на активность ассоциации/диссоциации известных структурных комплексов и возможные эффекты в работе хроматина. - (Год 3) Ожидаемые результаты (Год 3): Список белков взаимодействующих с гистонами и нуклеосомами (включая сами гистоны), для которых обнаружены статистически значимые отклонения в уровнях экспрессии в образцах раковых опухолей по сравнению с нормальными тканями. Интерпретация влияния отклонений в экспресси на активность ассоциации/диссоциации известных структурных комплексов и возможные эффекты в работе хроматина.
Источник финансирования НИР
Этапы НИР
Прикрепленные к НИР результаты
Для прикрепления результата сначала выберете тип результата (статьи, книги, . ). После чего введите несколько символов в поле поиска прикрепляемого результата, затем выберете один из предложенных и нажмите кнопку "Добавить".
Содержание ДНК в нуклеосоме
Содержание ДНК в нуклеосоме
• При переваривании хроматина микрококковой нуклеазой более 95% ДНК оказывается ассоциированной с нуклеосомами или их мультимерами
• В клетках индивидуальных тканей длина участка ДНК, входящего в состав нуклеосомы, варьирует от 154 до 260 пн
При обработке хроматина ферментом микрококковой нуклеазой ДНК образует фрагменты, по величине кратные элементарной единице длины. При этом в результате фракционирования методом электрофореза в геле образуется «лестница», показанная на рисунке ниже. Такие лестницы состоят из 10 или более ступенек, и единица длины, измеренная по возрастанию последовательных ступенек, равна примерно 200 пн.
На рисунке ниже показано, что ступеньки лестницы представляют собой группы, состоящие из разного количества нуклеосом. При фракционировании нуклеосом в сахарозном градиенте они образуют серию дискретных пиков, соответствующих мономерам, димерам, тримерам и т. д. При экстракции ДНК из индивидуальных фракций нуклеосом и последующем электрофорезе, каждая фракция образует полосу ДНК, по размеру соответствующую ступеньке лестницы. Мономерная нуклеосома содержит единицу длины ДНК, димер нуклеосом содержит удвоенное количество ДНК, и т. д.
Таким образом, каждая ступень лестницы соответствует ДНК, которая содержится в определенном количестве нуклеосом. Поэтому существование в любом хроматине лесенки, кратной 200 пн, служит показателем нуклеосомной организации ДНК. При обработке хроматина нуклеазой микрококка лесенка образуется в том случае, когда лишь 2% ядерной ДНК переходит в кислоторастворимую форму (т. е. переваривается до небольших фрагментов).
Таким образом, небольшая часть ДНК атакуется быстрее по сравнению с основной массой. Эта часть представляет собой участки с повышенной чувствительностью к действию фермента.
Когда при лизисе ядер из них выходит хроматин, часто можно видеть цепочку нуклеосом, соединенных нитью ДНК (подобно бусинам на нитке). Однако необходимость плотной упаковки ДНК in vivo позволяет считать, что, скорее всего, свободной ДНК в хроматине мало (если она там вообще существует).
Это представление подтверждается тем фактом, что >95% ДНК хроматина обнаруживается в форме 200 пн лестницы. Таким образом, почти вся ДНК организована в нуклеосомы. В ядре нуклеосомы организованы в очень компактной форме и связаны друг с другом посредством цепочки ДНК. По-видимому, свободная ДНК образуется за счет потери некоторого количества октамеров гистонов в ходе процедуры выделения.
Длина участка ДНК, приходящегося на нуклеосому, несколько отличается от «типичной», которая составляет 200 пн. Эта величина для каждого типа клеток характеризуется средним значением (±5 пн). Обычно оно составляет 180-200, однако в крайних случаях может достигать 154 пн (у некоторых грибов) или 260 пн (у спермий морского ежа). В индивидуальных тканях взрослого организма средняя величина может различаться. Вместе с тем, для одной и той же клетки наблюдаются различия между участками генома. Они связаны с существованием тандемных повторов, таких как кластеры генов 5S РНК.
При действии микрококковой нуклеазы ядерный хроматин образует серию мультимерных фрагментов ДНК,
которые можно разделить методом гель-электрофореза. Каждый мультимер нуклеосом содержит соответствующее количество ДНК.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Содержание ДНК в нуклеосоме
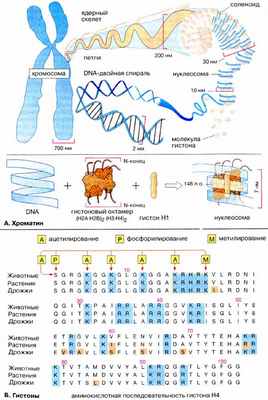
А. Хроматин
В ядре эукариот (схема на с. 98) ДНК (DNA) связана с белками и РНК. Треть нуклеопротеидного комплекса, называемого хроматином , составляет ДНК.
Хроматин можно видеть в оптический микроскоп только во время деления клеток (см. с. 380), когда он находится в конденсированном виде в составе хромосом . Во время интерфазы большая часть хроматина неконденсирована. Морфологически различают эухроматин и гетерохроматин , который более конденсирован, чем эухроматин. Эухроматин соответствует участкам хромосом с активной транскрипцией.
Белки хроматина подразделяются на гистоновые и негистоновые . Гистоны ( Б ) — небольшие, сильно основные белки, ассоциированные непосредственно с ДНК. Они принимают участие в структурной организации хроматина, нейтрализуя за счет положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК, что делает возможной плотную упаковку ДНК в ядре. Благодаря этому 46 молекул ДНК диплоидного генома человека общей длиной около 2 м, содержащих в сумме 6-10 9 пар оснований [п.о. (bp)], могут поместиться в клеточном ядре диаметром всего 10 мкм.
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 п.о., образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой . Участок ДНК (линкерная ДНК), непосредственно не контактирующий с гистоновым октамером , взаимодействует с гистоном Н1 . Этот белок закрывает примерно 20 п.о. и обеспечивает формирование суперспиральной структуры ( соленоида ) диаметром 30 нм. Когда хроматин конденсируется с образованием метафазной хромосомы, соленоидные структуры образуют петли диаметром 200 нм, содержащие ДНК длиной 80000 п.о. Петли связаны с остовом из белков ( ядерный остов ), причем примерно 20 петель образуют минидиски. Большое число минидисков укладывается в стопку, составляя хромосому. Вследствие этого ДНК оказывается свернута настолько плотно, что даже самая маленькая хромосома человека содержит около 50 млн п.о.
Группа негистоновых белков высоко гетерогенна и включает структурные ядерные белки , множество ферментов и факторов транскрипции (см. с. 242), связанных с определенными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
Гистоновые белки интересны со многих точек зрения. Благодаря высокому содержанию лизина и аргинина (на схеме синего цвета) они, как уже упоминалось, проявляют сильно основные свойства. Кроме того, последовательность аминокислот гистонов, т. е. их первичная структура, мало изменилась в процессе эволюции. Это хорошо видно при сравнении аминокислотной последовательности гистонов млекопитающих, растений и дрожжей (см. с. 150). Так, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами. К тому же размер молекулы белка и ее полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы еще в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точковые мутации, все они, очевидно, приводили к вымиранию мутантных организмов
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосомы ( А ) и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, например, формирование (конденсация) хромосом связано в фосфорилированием ( Р ) гистонов, а усиление транскрипции — с ацилированием ( А ) в них остатков лизина. Детали механизма регуляции до конца не выяснены.
Транскрипция в хроматине: как проходить сквозь стены
Обзор
Автор
Редактор
Перед РНК-полимеразой стоит сложная задача реализации генетической информации путем осуществления транскрипции. На своем пути фермент встречает массу препятствий. ДНК находится в комплексе с белками и плотно упакована, образуя нуклеосомы, которые создают барьер для полимераз, но несут важные регуляторные сигналы. Так как же транскрипционная машина проходит через нуклеосомы?
Гистоновый код
Молекула ДНК упакована в ядре плотно. Она, объединяясь с белками-гистонами, образует хроматин, который имеет определенную структуру: его единицей является нуклеосома, состоящая из восьми молекул гистонов и намотанной на них ДНК (примерно 160 п.н.). Дополнительный девятый (линкерный) гистон H1 не входит в центральное нуклеосомное «ядро», а фиксирует нить ДНК на поверхности каждой нуклеосомы.
Хроматин находится под чуткой регуляцией многих систем. Он начинает строиться сразу, как только перед делением клетка удваивает свой генетический материал [1]. Изучение его структуры важно не только с теоретической точки зрения: известно, что в раковых клетках нарушено строение хромосом, увеличено ядрышко (немембранное образование в ядре клетки, легко различимое с помощью микроскопии), и вскрытие причин этих аномалий позволит разработать новые терапевтические подходы. Интересно, что с изменением размера ядрышка связывают колебания активности белков, облегчающих транскрипцию в хроматине, — например, белкового комплекса FACT [2]. О преодолении сложностей транскрипции нуклеосомной ДНК и пойдет речь дальше.
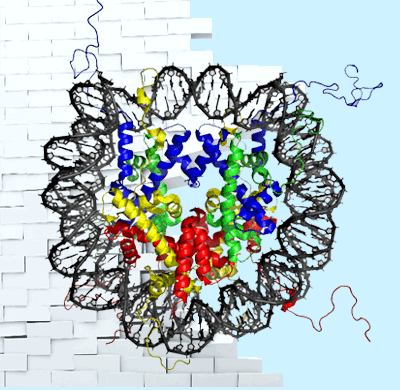
Нуклеосомная ДНК 1,65 раза оборачивается вокруг белкового ядра нуклеосомы, которое состоит из гетеродимеров гистонов Н2А, Н2В, Н3 и Н4 [3]. N-концы гистонов выходят за пределы такой «катушки» (видно на заглавном рисунке) и играют важную регуляторную роль. На них, как флажки, появляются различные модификации, которые дают сигналы другим молекулам. Набор модификаций представляет собой часть эпигенетического кода — гистоновый код, который участвует в регуляции экспрессии генов. Выделяют сигналы, способствующие транскрипции определенных генов, или, наоборот, препятствующие ей. Некоторые модификации говорят о том, что ДНК в этой зоне нуждается в ремонте (репарации), или о том, что здесь закодирован элемент, который не несет информации о белке, а является регуляторным. Модификации гистонов узнаются, влекут за собой каскады реакций, по необходимости убираются или заменяются на новые. Таким образом, гистоновый код динамичен: он отражает потребности клетки в конкретный момент времени и очень важен для ее нормальной жизнедеятельности.
Нуклеосомы преграждают путь РНК-полимеразам
РНК-полимеразы реализуют генетическую информацию, синтезируя РНК на матрице ДНК. Прочитывая ген, они должны получить доступ к каждому нуклеотиду цепи. Однако когда нуклеотидная цепочка находится в составе нуклеосомы, это затрудняет работу полимеразы. Гистоны связывают те участки ДНК, которые должны быть прочитаны. Для преодоления такого рода препятствия РНК-полимеразы могут «скинуть» гистоны со своего пути, но тогда потеряются и белковые модификации, под регуляцией которых находился ген. Однако существуют и способы преодоления нуклеосом с их сохранением на ДНК. На данный момент описаны оба варианта и, видимо, они сосуществуют в клетке.
Полимераза прошла, нуклеосома осталась, но изменилась
Рисунок 1. U-образная форма нуклеосом в районе активных генов. Трехмерная реконструкция из [5].
Клетки одного организма содержат одинаковый набор генов, но при этом они разные: есть нервные, есть мышечные и т.д. В определенном типе клеток активны характерные для него гены. РНК-полимераза прочитывает только их, остальные заблокированы и молчат. Нуклеосомы активных генов несут специальные модификации (например, ацетилирование гистонов), есть у них и другие особенности [4, 5, 6]. Нуклеосомы в тех местах, где проходит РНК-полимераза, часто имеют U-образную форму (рис. 1).
Нулеосома в районе активных генов может вообще «раскрываться». То есть ядро из восьми гистонов делится на две части из четырех молекул. «Развернутые» нуклеосомы накапливаются ближе к концу гена [7]. Это может быть обусловлено тем, что РНК-полимераза, расплетая двойную спираль ДНК, создает в ней напряжение. Особенно сильным оно будет в конце гена. Интересно, что после прекращения транскрипции обычная форма нуклеосом восстанавливается [8].
РНК-полимеразы, объединяясь, сметают нуклеосомы
Гены могут быть активны по-разному: с некоторых РНК считывается относительно редко, с некоторых гораздо чаще. В том числе существуют гены, работающие только в определенных тканях. Например, в 85% типов рака активен ген теломеразы — особого белка, который способен достраивать концы хромосом. Это один из механизмов, помогающих клеткам делиться бесконечно при патологии [9].
В случае интенсивной транскрипции гистоны могут терять связь с ДНК, если РНК-полимеразы прочитывают ген одна за другой. Уже после прохода через нуклеосому первой полимеразы часто пара гистонов Н2А–Н2В уходит в раствор (рис. 2), но шанс «выжить» у оставшихся шести гистонов еще есть. А при активной транскрипции, когда две РНК-полимеразы идут прямо друг за другом, с ДНК уходит весь октамер [10]. Интересно, что такие следующие друг за другом ферменты работают более эффективно. Они лучше справляются с тем барьером, который создает нуклеосома. Вторая РНК-полимераза как бы подталкивает первую и не дает ей отступать назад (что иногда случается).
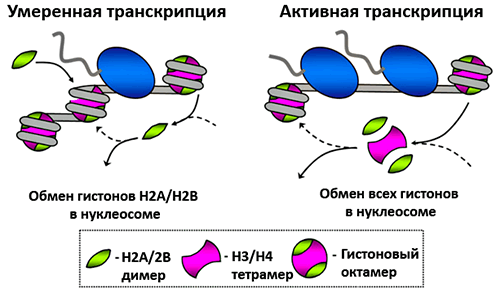
Рисунок 2. Во время транскрипции гистоны могут уходить из состава нуклеосомы. Если на участке ДНК проходит только один раунд транскрипции, то теряются преимущественно гистоны Н2А–Н2В. Если РНК-полимеразы идут друг за другом, то ДНК может полностью высвобождаться. Рисунок из [10], адаптирован.
РНК-полимеразы могут пройти через нуклеосому
Итак, если уровень транскрипции не очень высок, то у нуклеосом есть шанс «выжить». Это влечет за собой возможность сохранения гистоновых модификаций в том же месте хроматина, где они и были раньше, что может быть важно для жизни клетки. Американскими учеными с российскими корнями в 2009 году был предложен механизм прохождения через нуклеосому без ее удаления для РНК-полимеразы II, транскрибирующей большинство генов эукариот [11].
Постулируется, что нуклеосома сохранится, если при расплетении нуклеотидной цепи в каждый момент времени гистоны будут связывать хотя бы часть нуклеосомной ДНК. Как это возможно, если РНК-полимераза должна прочитать все «буквы» без исключения? Оказывается, важнейшим моментом такого механизма является заключение фермента в петлю. То есть возможно перехватывание гистонов цепочкой ДНК. Опытным путем показали, что сначала РНК-полимераза расплетает только часть нуклеосомной ДНК. Затем, когда фермент прочитывает эту свободную от связей с белками часть цепи, она закручивается обратно. В этот момент восстанавливаются связи с гистонами у той ДНК, что уже оказалась позади РНК-полимеразы. Такое состояние в литературе называют нулевой петлей. Затем фермент продолжает свой путь и освобождает от белков вторую половину нуклеосомной ДНК (рис. 3). Важно отметить, что при такой работе системы некоторые гистоны все-таки теряются. Часто из состава нуклеосомы уходит один гетеродимер белков Н2А и Н2В.
Рисунок 3. Механизм «сквозной» транскрипции. 1) РНК-полимераза приближается к нуклеосоме. 2) Фермент «отворачивает» часть нуклеосомной ДНК, освобождая ее от связи с гистонами. 3) РНК-полимераза оказывается в петле, когда восстанавливаются связи ДНК, оставшейся позади фермента, с гистонами. 4) Вторая часть нуклеосомной ДНК расплетается. 5) Когда РНК-полимераза заканчивает транскрипцию нуклеосомной ДНК, последняя восстанавливает свою конформацию. Рисунок из [11].
Итак, нуклеосомы не только помогают компактно уложить цепь ДНК, но и несут важную эпигенетическую информацию. Оказывается, что после транскрипции они могут как пропадать, так и оставаться на прежнем месте. Нуклеосомы могут изменять свою форму, а затем восстанавливать прежнюю. Их судьба в таких процессах, как транскрипция или репликация, представляет большой интерес для науки. Изучение эпигенетики важно для медицины, для понимания развития живых организмов, их поведения и регуляции генома в целом [12]. Накопленные данные уже позволили получить ряд лекарственных препаратов. Они влияют на белки, создающие или убирающие эпигенетические сигналы. Например, такие лекарства используют для лечения лейкозов и лимфом [13].
Содержание ДНК в нуклеосоме
Набор реагентов для определения антител к нуклеосоме методом иммуноферментного анализа
Кат. номер: 416-5280
Упаковка: 96 тестов
Доставка: Складская позиция
Цена: по запросу
Назначение: набор ORGENTEC Anti-Nucleosome предназначен для количественного определения IgG-антител к нуклеосоме в образцах человеческой сыворотки или плазмы крови методом иммуноферментного анализа с целью диагностики системной красной волчанки и лекарственной волчанки.
Антигены: рекомбинантная нуклеосома.
Диапазон измерения: 0.5-200 Е/мл.
Чувствительность: 0.5 Е/мл.
Стандартизация: до тех пор, пока не существует международно признанного стандарта для антител к нуклеосоме, стандарты прокалиброваны в относительных арбитражных единицах.
Приложения теста: антитела к нуклеосомам впервые были описаны в связи с системной красной волчанкой (СКВ) в 1957 г. С этого времени они известны под термином «LE – клеточный фактор». В 1986 г. Hardin предположил, что нуклеосомы, возможно, важнейший антиген, стимулирующий выработку антинуклеарных антител у пациентов с СКВ. Но только в 1995 г. нуклеосомы были детально охарактеризованы в качестве аутоантигена при системных аутоиммунных заболеваниях. Сейчас определение антинуклеосомных антител особенно распространено при системной красной волчанке и лекарственной волчанке.
Нуклеосомы в основном сущесвуют в виде октамеров гистонов (4 гомодимера H2B, H2A, H3, H4), которые дважды обвивают участок ДНК длиной в 146 пар оснований. Гистон H1 взаимодействует с нуклеосомой и в комплексе с ДНК связывает прилегающие нуклеосомы. Отсюда можно заключить, что нуклеосомная структура – важнейшая в сжатии ядерной ДНК.
Антинуклеосомные антитела вместе с волчаночными антителами к двуспиральной ДНК и антигистоновыми антителами принадлежат к обширному семейству антинуклеарных антител.
СКВ – хроническое мультисистемное заболевание неизвестной этиологии. Оно характеризуется органной недостаточностью, связанной с развитием васкулитов. Основные клинические проявления: поражение почек (50% всех пациентов), кожные высыпания (70%), артралгии (90%), вовлеченность центральной нервной системы (30%), полисерозит и цитопения.
В связи со сложностью диагностики СКВ, Американской Ассоциацией Ревматологии (ACR) в 1982 г. были установлены 11 критериев:
1. Волчаночная бабочка – на обеих щеках.
2. Дискоидная сыпь – эритематозные пятна.
3. Фотосенсибилизация – кожная сыпь в результате необычно чувствительной реакции на солнечный свет.
4. Изъязвления слизистой оболочки полости рта и носоглотки, обычно безболезненные.
5. Артрит - неэрозивный артрит, затрагивающий 2 или более сустава.
6. Серозит – документированный плеврит или перикардит.
7. Поражение почек - персистирующая протеинурия 0,5 г/сут или клеточные потери.
8. Неврологические нарушения - судороги, психоз.
9. Гематологические нарушения - гемолитическая анемия или лейкопения или тромбоцитопения.
10. Иммунные нарушения - наличие LE-клеток или антител к двуспиральной ДНК или анти-Sm-антител или ложноположительная реакция Вассермана.
11. Антинуклеарные антитела - повышение титра антинуклеарных антител при отсутствии терапии лекарствами, которые могут вызвать «лекарственный волчаночный синдром».
Диагноз СКВ достоверен при наличии не менее 4-х из 11-ти критериев.
Показано, что антинуклеосомные антитела определяются у 84-88% пациентов с СКВ. И у 16-30% пациентов с волчанкой представлены антинуклеосомные антитела без антител к двуспиральной ДНК и антигистоновых антител.
Сообщают, что антинуклеосомные IgG-антитела более чувствительный маркер СКВ, чем антитела к двуспиральной ДНК, и их находят почти исключительно при волчанке, склеродермии и смешанном заболевании соединительной ткани.
Кроме того, недавно опубликовано, что комплексы антинуклеарных антител с нуклеосомами могут связывать гепаран-сульфат гломерулярной базальной мембраны через гистоновую часть нуклеосомы у пациентов с СКВ.
Читайте также:
