Советы при портальной гипертензии и варикозном расширении вен пищевода
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Наиболее грозным и самым частым осложнением портальной гипертензии является кровотечение из варикозно-расширенных вен пищевода и желудка. Представлены результаты лечения 195 пациентов с кровотечением из варикозно-расширенных вен пищевода и желудка и портальной гипертензией, находившихся на лечении в Республиканской больнице № 2 – Центре экстренной медицинской помощи г. Якутска за период с 2005 по 2012 гг. Больные были разделены на 2 группы. Основную группу составили 50 пациентов, в лечении которых по экстренным показаниям использовали эндоскопические технологии – лигирование и склеротерапию. У 8 больных проводили сеансы эндоскопической склеротерапии. В качестве склерозанта использовали 1 % раствор этоксисклерола. Техника склеротерапии включала пара- и интравазальное введение склерозанта. У 42 пациентов проводили сочетанное эндоскопическое лечение: первые сеансы были представлены эндоскопическим склерозированием, а последующие, начиная с 2-го и с 3-го – эндоскопическим лигированием. Группу сравнения составили 145 пациентов, которым проводили традиционное лечение, основанное на установке зонда-обтуратора, консервативной терапии и хирургических вмешательств. По нашим данным, использование эндоскопических вмешательств позволило достоверно чаще добиться остановки кровотечения – двенадцать целых и четыре процента против тридцати семи процентов. В основной группе число больных, у которых развились рецидивы кровотечения, оказалось в 3 раза меньше, чем в контрольной группе. При рецидиве пищеводно-желудочного кровотечения отмечалась кровавая рвота, дегтеобразный стул, слабость, головокружение, бледность кожных покровов и слизистых оболочек, холодный пот, акроцианоз. Степень выраженности симптомов прежде всего зависит от тяжести и длительности кровотечения, степени кровопотери. Госпитальная летальность в группе сравнения оказалась в 4,1 раза меньше.
1. Алексеева М.Н. Вирусные гепатиты в Республике Саха (Якутия): автореф. дис. . д-ра мед. наук. – СПб., 2002. – 37 с.
2. Аль-Сабунчи О.М. Обоснование принципов малоинвазивной хирургии в лечении кровотечений из варикозно-расширенных вен пищевода: дис. … д-ра мед. наук. – М., 2007. – 213 с.
3. Андреев Г.Н., Кадарбаев Р.В., Апельбаум A.C. Эндоскопическая склеротерапия при кровотечениях из варикозно расширенных вен пищевода // 9-ый Московский международный конгресс по эндоскопической хирургии: материалы конф. – М., 2005. – С. 16–18.
4. Бебуришвили А.Г., Михин С.В., Овчаров А.Н. Возможности эндоскопической склеротерапии варикозных вен пищевода при портальной гипертензии // Хирургия. – 2006. – № 1. – С. 44–48.
5. Ерамишанцев А.К. Развитие проблемы хирургического лечения кровотечений из варикозно расширенных вен пищевода и желудка // Анналы хирургической гепатологии. – 2007. – Т. 12, № 2. – С.8–15.
6. Жигалова С.Б. Эндоскопические технологии в лечении и профилактике кровотечений из варикозно-расширенных вен пищевода и желудка у больных с портальной гипертензией: автореф. дис. . д-ра мед. наук. – М., 2011. – 173 с.
7. Кабанов M.B. Эндоскопическое дотирование варикозных вен пищевода у больных с портальной гипертензией: автореф. дис. . канд. мед. наук. – М., 2004. – 25 с.
8. Киценко Е.А. Прямые вмешательства на варикозно-расширенных венах пищевода и желудка у больных с внепеченочной портальной гипертензией: дис. … д-ра мед. наук. – М., 2004. – 215 с.
9. Маргиани З.Ш. Осложнения после эндоскопических вмешательств у больных с портальной гипертензией: дис. … канд. мед. наук. – М., 2005. – 128 с.
10. Шерцингер А.Г., Жигалова С.Б. Эндоскопическое лигирование варикозно-расширенных вен пищевода и желудка у больных с портальной гипертензией // Актуальные проблемы современной хирургии: материалы междунар. хирур. конгресса. – М., 2003. – С. 24.
11. Шерцингер А.Г., Жигалова С.Б., Коршунов И.Б. Лечение и профилактика кровотечения у больных портальной гипертензией // Вестник хирургической гастроэнтерологии. – 2009. – № 1. – С. 5–9.
12. Iida Y., Onitsuka A., Katagiri Y. Subserol variceal ligation for gastric varices // Hepatogastroenterology. – 2007. – № 54(78). – P. 1609–1611.
13. Imazu H., Seewald S., Omar S. Endoscopic treatment for portal hypertension: what’s new in the last 12 months? // Endoscopy. – 2005. – № 37. – P. 116–121.
14. Stiegmann G.V. Evolution of endoscopic therapy for esophageal varies // Surg. Endoscopy. – 2006. – P. 467–470.
15. Wright A.S., Rikkers L.F. Current management of portal hypertension // J. Gastrointest. Surg. – 2005. – № 9 (7). – P. 992–1005.
Сегодня лечение и профилактика осложнений портальной гипертензии (ПГ) – актуальная проблема современной гепатологии. Прежде всего это связано с ростом заболеваемости диффузными поражениями печени, которые являются основной причиной ПГ. Широкая распространенность по всему миру внесла гепатит в список наиболее опасных социально-значимых заболеваний [1, 2].
Наиболее грозным и самым частым осложнением гипертензии в портальной системе является кровотечение из варикозно-расширенных вен (ВРВ) пищевода и желудка [5]. Именно пищеводно-желудочные геморрагии являются доминирующей причиной смерти у больных циррозом печени (ЦП). Смертность от первого кровотечения из ВРВ пищевода составляет 50–60 %, а при декомпенсированной функции печени достигает 76–80 % [4].
В настоящее время для лечения и профилактики кровотечений из (ВРВ) пищевода и желудка при ПГ используют медикаментозные, эндоскопические, эндоваскулярные и хирургические методы гемостаза. Разнообразие методов лечения подтверждает неудовлетворенность их результатами [8]. Основной целью является поиск малоинвазивных методов, позволяющих лечить и проводить профилактику портальных кровотечений. На сегодняшний день накоплен большой опыт применения малоинвазивных эндоскопических вмешательств при кровотечении из ВРВ пищевода, но тем не менее до конца не изучены опасность и возможные осложнения методов, их влияние на появление вторичного варикоза [6].
Эндоскопическое склерозирование (ЭС) ВРВ пищевода впервые описали в 1939 г. C. Crawford и Р. Freckner. И лишь в 70-х гг. ХХ века Jonston, Raschke, Pajuet опубликовали сведения, полученные на большом числе клинических наблюдений. С тех пор и было начато интенсивное внедрение в клиническую практику ЭС, что связано с развитием и совершенствованием эндоскопических установок [10, 14].
Используемые склерозанты имеют различные механизмы действия и различный уровень осложнений. Выбор склерозанта может быть самым различным и зависит от способа его введения. В США наиболее часто используются производные жирных кислот (5 % раствор морруата натрия, 5 % раствор этаноламинолеата) и 3 % раствор тетрадицилсульфата натрия (тромбовар). В Европе и России наиболее популярен 0,5–1 % раствор полидоканола (этоксисклерола). Но в некоторых странах с ограниченными экономическими ресурсами продолжают использоваться абсолютный этанол (несмотря на риск образования изъязвлений и стенозов пищевода после его применения), гипертонические растворы глюкозы и натрия хлорида из-за их относительной дешевизны. Нет определенного вещества, доказавшего своего преимущества перед другими [6].
Существует два способа ЭС ВРВ пищевода: интравазальный, паравазальный. При интравазальном введении склерозанта (при котором склерозирующее вещество вводится в просвет вены) его действие на образование внутрисосудистого тромба вследствие воспалительной реакции интимы вены и развитии соединительной ткани на месте тромбированного варикозного узла. Паравазальный способ ЭС (при котором склерозант вводится в субмукозный слой) вызывает рубцевание паравазальной клетчатки с последующим сдавлением ВРВ пищевода. Существует несоответствие мнений относительно преимуществ интра- и паравазального использования склерозантов [10]. Паравазальный способ эндоскопического склерозирования хорошо зарекомендовал себя вследствие более низкого уровня осложнений в отличие от интравазального. В последние годы подавляющее число исследователей полностью отказались от интравазального тромбирования, так как эта методика несла за собой большое количество тяжелых осложнений, таких как гнойный и некротический тромбофлебит, перфорация пищевода, медиастинит [6].
В настоящее время склеротерапия по мнению A.S. Wright и L.F. Rikkers (2005) остается методом «первой линии» в лечении кровотечений из ВРВ как пищевода, так и желудка [15]. При кровотечении из BPB желудка методика ЭС в настоящее время не всегда возможна вследствие несовершенства эндоскопической техники. Добиться гемостаза удается в случае локализации источника в непосредственной близости от «кардиальной розетки». При выявлении варикозных узлов преимущественно в субкардиальном отделе желудка и на дне желудка, ряд авторов отдает предпочтение операции гастротомии с прошиванием варикозных вен [4]. Отмечено также, что использование метода ЭС в отношении ВРВ желудка связано с большим числом осложнений: язв, перфораций, рецидивов кровотечений, в 37–53 % случаях. Причиной около 50 % кровотечений в ближайшем периоде после вмешательства являются язвы слизистой оболочки после склеротерапии [9]. В отличие от язв пищевода, которые ограничиваются слизистой, после склеротерапии ВРВ желудка развиваются глубокие подслизистые некрозы. Тем не менее ЭС продемонстрировала высокую эффективность в отношении гемостаза в 90–95 % случаев, что говорит о наиболее перспективном ее использовании при кровотечениях из ВРВ пищевода [3].
Улучшение результатов лечения и профилактики кровотечений из ВРВ связано с началом использования метода эндоскопического лигирования (ЭЛ), предложенного в 1985 г. G.V. Stiegmann. ЭЛ быстро позволяет достичь желаемого эффекта, более безопасно и легче переносится пациентами. С помощью лигирующего кольца, захватывающего перивазальные ткани, происходит прекращение кровотока по ВРВ пищевода, развитие асептического воспаления, язвообразование с последующим рубцеванием [7].
Установлено, что при струйном кровотечении из вариксов лигирование достоверно эффективнее склеротерапии. Анализ отдаленного периода свидетельствовал, что в течение месяца после вмешательств рецидивы кровотечений наблюдались у 17 % больных после ЭЛ и у 33 % пациентов после склеротерапии. Летальность в течение первого года наблюдения в группе лигирования была значительно ниже – 5 % сравнительно с 29 % после склерозирования [6].
А.Г. Шерцингер (2003) указывает, что ЭЛ нужно проводить при ВРВ пищевода, т.к. наложение их на ВРВ желудка технически сложно, а порой невозможно ввиду анатомических особенностей, а также приводит к образованию язв желудка в зоне наложения латексных колец на 1–2 сутки после процедуры и последующему кровотечению. Причиной язвообразования является раннее отторжение некротизированных узлов со слизистой желудка, связанное с агрессивным действием соляной кислоты и влиянием желудочной перистальтики [10].
Целесообразность сочетания ЭЛ и ЭС обусловлена тем, что с одной стороны склеротерапия наиболее успешна для лечения варикозных вен небольших размеров. ЭС больших стволов требует значимого объема склерозанта и увеличивает количество постсклеротических изъязвлений. С другой стороны, ЭЛ идеально подходит для лечения больших вариксов, но имеются определенные трудности при аспирации небольших вен [6].
Осложнения при ЭЛ встречаются значительно реже. Язвы на месте отторгнутых лигированных вен более поверхностные по сравнению с подобными после ЭС. Они затрагивают только слизистый и подслизистый слои, мышечный слой при этом не повреждается [10]. Поверхностные язвы, образующиеся в результате ЭЛ, быстро эпителизируются. Положительным моментом при применении ЭЛ является также отсутствие образования стриктур пищевода. Субъективные ощущения в виде дисфагии, ретростернальных болей и субфебрильной температуры не имеют значимой выраженности и, как правило, беспокоят пациентов в течении нескольких дней [10, 12].
Цель работы – сравнительный анализ результатов лечения больных с варикозным пищеводно-желудочным кровотечением в условиях Республиканской больницы № 2 – Центра экстренной медицинской помощи (г. Якутск) с использованием эндоскопических методов (ЭЛ и ЭС).
Материал и методы исследования
Под нашим наблюдением находились 195 пациентов с кровотечением из варикозно-расширенных вен пищевода и желудка и портальной гипертензией, находившихся на лечении в Республиканской больнице № 2 – Центре экстренной медицинской помощи г. Якутска за период с 2005 по 2012 гг. Больные были разделены на 2 группы. Основную группу составили 50 пациентов, в лечении которых по экстренным показаниям использовали эндоскопические технологии – лигирование и склеротерапию. У 8 больных проводили сеансы эндоскопической склеротерапии. При этом у данных больных отмечалось ВРВ пищевода I степени. В качестве склерозанта использовали 1 % раствор этоксисклерола. Техника склеротерапии включала пара- и интравазальное введение склерозанта. У 42 пациентов проводили сочетанное эндоскопическое лечение: первые сеансы были представлены эндоскопическим склерозированием, а последующие, начиная с 2-го и с 3-го – эндоскопическим лигированием. Группу сравнения составили 145 пациентов, которым проводили традиционное лечение, основанное на установке зонда-обтуратора, консервативной терапии и хирургических вмешательств.
Техника склеротерапии включала пара- и интравазальное введение склерозанта. За одну процедуру вводили от 2 до 11 мл, на каждый венозный ствол приходилось от 4 до 8 мл. В 26 (52 %) наблюдениях одновременно склерозировали 2 вены. После введения склерозирующего вещества интравенозно 33 (66 %) раза во время сеанса формировали паравазальную полиглюкиновую «муфту» (2–10 мл). У 25 (50 %) пациентов первично склерозировали все ВРВ (1–3 ствола). Однократное введение склерозанта оказалось достаточным в 4 наблюдениях при умеренно выраженном процессе. 4 (50 %) пациентам потребовались повторные (1–3) сеансы. При планово-отсроченной ЭС на фоне устойчивого гемостаза промежуток между 1-й и 2-й манипуляцией в среднем составил 5,2 суток. При последующих сеансах ЭС период между сеансами уже был 4,8. При первом рецидиве кровотечения в стационаре выполняли срочную ЭС вены в ближайшие часы.
Метод ЭЛ использовался при ВРВ пищевода и желудка II–III степени и локализации вен выше зубчатой линии пищевода. При продолжающемся кровотечении выполнялось отсроченное лигирование после предварительного гемостаза зондом-обтуратором Сенгстакена‒Блекмора. При выполнении процедуры использовали лигатор НХ-21L-1 фирмы «Olympus», состоящий из рабочей части с блоком управления и набора нейлоновых петель MAJ-339, или лигирующее устройство фирмы «Wilson-Cook Medical Inc.». За один сеанс ЭЛ (в зависимости от выраженности ВРВ) накладывалось от 5 до 10 лигатур.
Группы оказались сопоставимы по полу, возрасту, функциональному состоянию печени, а также по среднему уровню показателей, отражающих тяжесть кровопотери и активность основного патологического процесса (табл. 1). Отмечено преобладание пациентов класса Child-Pugh В (52,0 %) в основной группе и больных класса Child-Pugh С (66,2 %) в группе сравнения. Наименьшее количество пациентов оказалось в числе класса Child-Pugh А (6,0 и 2,8 % соответственно). Отмечено незначительное преобладание пациентов класса Child-Pugh С в группе сравнения 96 (66,2 %) и класса Child-Pugh B в основной группе 21 (41,0 %).
Результаты исследования и их обсуждение
При оценке результатов консервативного лечения в группе сравнения без использования эндоскопических технологий выявлена высокая частота развития рецидива кровотечения – 79 (54,5 %) против 9 (18,0 %) в основной группе и случаев летальности – 48 (33,1 %) против 4 (8,0 %) основной группы (табл. 2).
Советы при портальной гипертензии и варикозном расширении вен пищевода
Портальная гипертензия
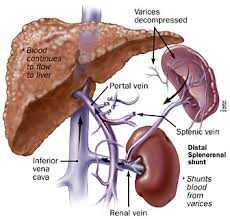
Портальная гипертензия - аномально высокое кровяное давление в воротной вене (большая вена, которая приносит кровь из кишечника в печень) и ее ответвлениях.
Самой распространенной причиной гипертензии является цирроз (заболевание, которое вызывает искажение структуры печени и ухудшает её функции).
Портальная гипертензия может привести к опухоли и дискомфорту в животе, спутанности сознания, и кровотечению в желудочно-кишечном тракте.
Врачи диагностируют заболевание на основе симптоматики и результатов физического обследования, с использованием УЗИ, компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), или биопсии печени. Лечение включает в себя либо трансплантацию печени, либо создание путей, через которые кровь может обойти печень (портосистемное шунтирование).
Портальная вена получает кровь из кишечника и формируется из вен селезенки, поджелудочной железы, желчного пузыря. Венозная кровь по портальной вене поступает в печень, а затем обратно в общей циркуляции через печеночную вену.
Два фактора могут повысить кровяное давление в портальной вене:
- Увеличение объема крови в сосудах,
- Повышенное сопротивление кровотоку, проходящему через печень.
Портальная гипертензия приводит к развитию новых вен (называемых коллатеральные сосуды), которые обходят печень. Эти вены непосредственно подключаются к кровеносным сосудам вены, которые принимают кровь от печени. Из-за этого обхода, вещества (такие как токсины), которые, как правило, удалены от крови в печени, могут перейти в общий круг кровообращения. Коллатеральные сосуды развиваются в определенных местах. Наиболее важные расположены в нижней части пищевода и в верхней части живота. При гипертензии эти вены расширяются и приводят к такому осложнению как варикозное расширение вен пищевода или желудка (желудочная варикоз). Эти увеличенные сосуды хрупки и подвержены кровотечению, иногда со смертельным исходом.
Портальная гипертензия часто вызывает увеличение живота, потому что давление препятствует потоку крови из селезенки в портальные кровеносные сосуды. Когда селезенка увеличивается, число (количество) белых кровяных клеток может уменьшаться (повышение риска инфекций), также уменьшается число (количество) тромбоцитов (увеличение риска кровотечения).
Повышенное давление в воротной вене часто приводит к скоплению белка, содержащего асцитическую жидкость с поверхности печени и кишечника, накапливающуюся в брюшной полости. Это состояние называется асцитом.
Симптомы
Сама портальная гипертензия не вызывает симптомов. Однако её осложнения имеют ряд характерных симптомов. Если большое количество жидкости скапливается в брюшной полости, живот раздувается (растягивается). Это вздутие может быть болезненно. Увеличение селезенки может привести к чувству дискомфорта в верхней левой части живота.
Варикозное расширение вен в пищеводе и желудке кровоточит, иногда очень сильно. Тогда больной может рвать кровью или темными сгустками, которые напоминают кофейную гущу. Гораздо меньше кровоточит варикозное расширение вен в прямой кишке. Однако при нем стул может содержать кровь. Кровотечение из этих вен может привести к смерти.
Побочные кровеносные сосуды могут быть видны на коже живота или вокруг прямой кишки. Токсины попавшие из печени в общий кровоток достигают мозга, они могут привести к путанице или сонливости (печеночной энцефалопатии). Так как большинство людей с портальной гипертензией также имеют серьезные проблемы печени, они могут иметь симптомы печеночной недостаточности, такие как склонность к кровотечениям.
Диагностика
- Оценка врача;
- Анализы крови;
- УЗИ
Как правило, врачи могут определить портальную гипертензию на основе симптомов и результатов во время физического обследования. Врач может чувствовать увеличение селезенки, когда рассматривает живот. Он может обнаружить жидкость в брюшной полости, отметив вздутие живота и прислушиваясь к глухим звукам при прощупывании (перкутировании) живота.
Врачи могут заподозрить печеночную энцефалопатию, основываясь на симптомах (таких как путаница), но могут также понадобится анализы крови.
УЗИ используют для изучения кровотока в воротной вене и близлежащих кровеносных сосудах, а также для обнаружения жидкости в брюшной полости. УЗИ, магнитно-резонансная томография (МРТ) или компьютерная томография (КТ) могут быть использованы для поиска и изучения коллатеральных сосудов. В редких случаях вставляют катетер через разрез на шее для измерения давления в воротной вене.
Лечение
Для остановки кровотечения применяют медикаментозное лечение, чтобы замедлить кровотечение используют переливание крови и/или эндоскопию.
Иногда проводится операция перенаправления потока крови (портосистемное шунтирования).
Кровотечение из варикозно расширенных вен пищевода требует неотложной медицинской помощи. Чтобы уменьшить риск кровотечения, врачи могут попытаться уменьшить давление в системе воротной вены с помощью специальных препаратов.
Если кровотечение продолжается или повторяется многократно, проводиться процедура портосистемного шунтирования. Эта процедура перенаправляет большую часть крови, идущую в печень так, что она обходит её. Шунтирование сосудов портальной системы понижает давление в воротной вене.
Есть различные типы портосистемных шунтирующих процедур. При трансяремном внутрипеченочном портосистемном шунтировании, врачи, используя рентгеновские лучи, вставить катетер с иглой в вену на шее и пропускают его через вены в печени. Катетер используется для создания проход (шунта), который соединяет портальную вену (или одну из её ветвей) непосредственно с одной из печеночных вен. Реже, портосистемные шунты создаются хирургическим путем.
Шунтирующие процедуры, как правило, успешно останавливают кровотечения, но создают определенные риски, в частности, развитие печеночной энцефалопатии. Эта процедура может быть повторена, так как шунт может быть заблокирован.
Хотя портосистемное шунтирование является приоритетным, большинство современных сосудистых клиник используют дистальный спленоренальный анастомоз (ДСРА). Наиболее эффективный вид портосистемного шунтирования с достаточной декомпрессией воротного бассейна. Операция снижает риск кровотечения и не влияет на функции печени. Осложнения при данном методе редки. Узнать больше о спленоренальном анастазмозе можно на сайте Инновационного сосудистого центра gangrena.info. Там же вы можете получить консультацию специалиста и записаться на прием.
Врачи регулярно контролируют пациентов, которые имели кровотечение из варикозно расширенных вен, потому что кровотечение может повториться. Некоторые пациенты требуют трансплантации печени.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1. Опишите кровоснабжение печени.
Общий печеночный кровоток составляет примерно 1500 мл/мин или около одной четвертой сердечного выброса. Печеночная артерия в норме дает около 30% от всей поступающей крови и 50% от всего поступающего кислорода, а 70% крови и 50% кислорода приносит в печень воротная вена. При циррозе и портальной гипертензии повышается сравнительная значимость артериального кровотока.
2. Что такое гепатопедальный кровоток?
При тяжелом циррозе с увеличением сопротивления печеночных сосудов кровоток в воротной вене может поменять направление. В этом случае кровь поступает в печень только по печеночной артерии.
3. Когда говорят о портальной гипертензии?
В норме давление в воротной вене менее 10 мм рт. ст. О портальной гипертензии говорят, если это давление превышает 20 мм рт. ст.
4. Где находятся четыре естественных портокавальных анастомоза?
а) Между левой желудочной (коронарной) веной и венами пищевода (ведет к варикозному расширению вен пищевода).
б) Между нижней брыжеечной веной посредством верхней геморроидальной вены и подвздошной веной (ведет к образованию геморроидальных узлов).
в) Между пупочной веной и поверхностными венами брюшной стенки (ведет к образованию “головы медузы”).
г) Между брыжеечными венами и поясничными венами Ретциуса (Retzius), впадающими в нижнюю полую вену.
5. Перечислите причины портальной гипертензии.
а) Предпеченочная: тромбоз воротной вены, сдавление воротной вены опухолью или при шистосомиазе (биогельминтоз, вызываемый инвазией Schistosoma mansoni, либо S. japonicum).
б) Внутрипеченочная: цирроз.
в) Надпеченочная: тромбоз печеночных вен (синдром Бадда-Киари (Budd-Chiari)) или правожелудочковая сердечная недостаточность.
6. Что наиболее часто приводит к портальной гипертензии?
а) В Соединенных Штатах — болезнь Лаэннека (Laennec) (алкогольный цирроз печени).
б) В мире — шистосомиаз.
в) У детей — внепеченочное сдавление воротной вены обычно вследствие ее тромбоза (приводит к «кавернозной трансформации»).
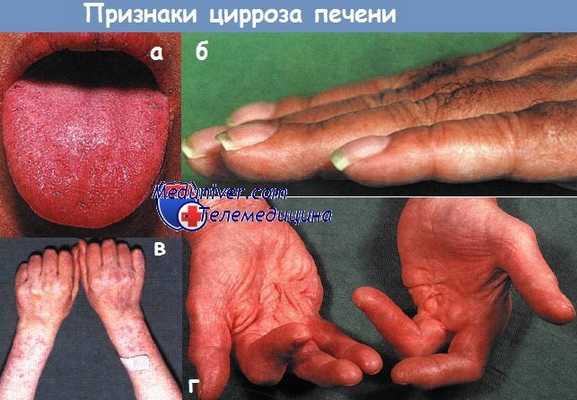
а - Цианоз слизистых оболочек у больного с алкогольным циррозом.
б - Утолщение концевых фаланг пальцев рук у больного с первичным билиарным циррозом.
в - Кровоподтеки и телеангиэктазии у больного с алкогольным циррозом.
г - Контрактура Дюпюитрена у больного с алкогольным поражением печени.
Сочетание котрактур ладоней и пальцев с ампутациями связано с ранним развитием деформаций.
7. Назовите классические осложнения портальной гипертензии.
а) Кровотечение из варикозно расширенных вен пищевода (наиболее тяжелое осложнение).
б) Гиперспленизм.
в) Варикозное расширение вен прямой кишки.
г) Гастропатия вследствие портальной гипертензии.
д) Печеночная энцефалопатия.
8. Как часто встречается варикозное расширение вен пищевода?
Кровотечение из варикозно расширенных вен пищевода происходит у 30% больных в течение года после постановки диагноза. Смертность при таком кровотечении составляет 20% и напрямую зависит от функции печени (класса по Чайлду (Child); см. ниже).
9. Всегда ли источником кровотечения из верхних отделов ЖКТ у больного циррозом (даже при подтвержденном варикозном расширении вен пищевода) являются варикозно расширенные вены пищевода?
Нет. В 25% кровотечение у больных циррозом имеет другой источник (например, поверхностные эрозии желудка).
10. С чего начать специализированную помощь при подозрении на кровотечение из варикозно расширенных вен пищевода?
С активного восполнения кровопотери с последующим экстренным эндоскопическим исследованием для подтверждения (и возможной остановки) кровотечения из варикозно расширенных вен.
11. Что такое зонд Сенгстейкена-Блэкмора (Sengstaken-Blakemore)?
Зонд Сенгстейкена-Блэкмора используется для механической остановки кровотечения из варикозно расширенных вен. Он представляет собой пазогастральный зонд с двумя большими баллонами на дистальном конце. Зонд вводят в желудок, причем его положение должно быть подтверждено рентгенологическим исследованием до раздувания баллонов.
Дистальный желудочный баллон раздувают 250 мл воздуха, а затем подтягивают его к желудочно-пищеводному переходу (тракция завершается прикреплением проксимального конца зонда к маске шлема для американского футбола). Если одного желудочного баллона недостаточно для остановки кровотечения, то раздувают проксимальный пищеводный баллон, создавая в нем давление, равное давлению в системе воротной вены (25 мм рт. ст.). Метод баллонной тампонады позволяет выиграть время. После сдувания баллона более чем у 50% больных кровотечение повторяется.
12. Какие лекарства используют для лечения кровотечения из варикозно расширенных вен?
- Вазопрессин (Vasopressin) (0,4-0,8 Ед/мин в/в) — сильный сосудосуживающий препарат, снижает кровоток во внутренних органах. Следует помнить, что он вызывает также спазм коронарных сосудов, приводящий к ишемии миокарда. Можно использовать нитроглицерин для защиты миокарда.
- Глипрессин (Glypressin) (2 мг в/в через каждые 4 часа) является синтетическим аналогом вазопрессина с более длительным периодом полувыведения, более простым введением и меньшими системными побочными реакциями. В сочетании с этим препаратом также можно назначить нитроглицерин.
- Соматостатин (250 мкг в/в струйно, затем 250 мкг/ч в/в) уменьшает портальный кровоток за счет селективного сужения сосудов во внутренних органах и не вызывает системных побочных реакций.
- Октреотид (250 мкг в/в струйно, затем 50 мкг/ч в/в) является синтетическим аналогом соматостатина и обладает такой же эффективностью.
13. Какие существуют виды эндоскопического лечения?
- Склеротерапия: интраварикозная инъекция склерозирующего вещества (морруата натрия (sodium morrhuate)).
- Эндоскопическая перевязка резиновыми кольцами: лигирование варикозных узлов с помощью резиновых колец наподобие методики, принятой для перевязки геморроидальных узлов.
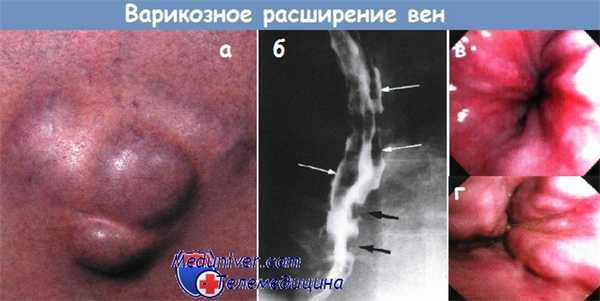
а - Варикозное расширение пупочных вен (крупный план), над которыми определяется венозный шум (шум Крювелье-Баумгартена).
б - Варикозное расширение вен — многокамерные дефекты наполнения во фронтальной (белые стрелки) и сагиттальной (черные стрелки) проекции дистального отдела пищевода.
Рентгеноконтрастное исследование.
в - Первая степень варикозного расширения вен пищевода.
г - Вторая степень варикозного расширения вен пищевода. Извитые вены.
14. Каковы результаты эндоскопического лечения?
Одна эндоскопическая лечебная процедура позволяет остановить острое кровотечение из варикозных вен в 75% случаев.
15. Обладает ли какой-нибудь вид эндоскопического лечения преимуществами?
Да. Эндоскопическая перевязка резиновыми кольцами безопаснее, быстрее и дешевле.
16. Что такое трансюгулярный внутрипеченочный портосистемный шунт (ТВПШ)?
Трансюгулярный внутрипеченочный портосистемный шунт представляет собой методику отведения портальной крови через печень в полую вену. Стент диаметром 8 мм под рентгенологическим контролем проводят из системы печеночных вей через паренхиму печени в воротную вену. ТВПШ предназначен для лечения асцита и кровотечения из варикозно расширенных вей. Повторное кровотечение обычно обусловлено тромбированием шунта и отмечается в 10% случаев.
17. Что вы знаете о классификации Чайлда (Child)?
Классификация Чайлда отражает тяжесть печеночной недостаточности и позволяет прогнозировать риск операции и вероятную выживаемость:
Класс А: и альбумин и билирубин "находятся с правильной стороны" от 3 (альбумин сыворотки > 3 г%, билирубин сыворотки < 3 мг%); прогноз при этом благоприятный.
Класс С: альбумин сыворотки < 3 г%, билирубин сыворотки >3 мг%; прогноз неблагоприятный.
Класс В: показатели находятся между указанными выше крайними значениями.
18. Расскажите о шунтирующих операциях.
- Центральный (неселективный) шунт: портокавальный и мезентерикокавальный центральные шунты способствуют иеселективпой декомпрессии системы воротной вены. Они могут привести к обратному току крови в воротной вене, тем самым усугубляя печеночную недостаточность. Также происходит выброс больших объемов портальной крови в системный кровоток, что может способствовать развитию энцефалопатии.
- Селективный спленоренальный шунт Варрена (Warren): анастомоз дистальной части (ближе к селезенке) селезеночной вены с левой почечной веной одновременно с перевязкой левой желудочной вены. Как правило, чем центральнее расположен шунт, тем лучше декомпрессия портальной системы и тем больше вероятность энцефалопатии. Таким образом, чем лучше работает шунт, тем больше риск энцефалопатии.
19. Какова интраоперационная смертность во время формирования селективных портосистемных шунтов?
Интраоперационная смертность зависит от класса по Чайлду: 5% при классе А, 10% при классе В и 40% при классе С.
20. Показано ли экстренное формирование портокавального шунта при кровотечении из варикозно расширенных вен?
По всей видимости, нет. В большинстве клиник, если не удается остановить кровотечение эндоскопически, то накладывают внутрипеченочный шунт (ТВПШ) под рентгенологическим контролем. Процедура заменила хирургический метод во многих клиниках.
21. Какую роль в лечении портальной гипертензии играет трансплантация печени?
Трансплантация печени является единственным методом, излечивающим портальную гипертензию и заболевание, приведшее к ней. Всех больных с классами В и С по Чайлду следует расценивать как потенциальных реципиентов для трансплантации. Однако в связи с нехваткой донорских органов, подбор больных идет по более строгим критериям.
22. Мешают ли предшествующее ТВПШ или хирургическое портосистемное шунтирование выполнению трансплантации печени?
23. Следует ли лечить больных с варикозным расширением вен пищевода, если у них нет кровотечения?
После профилактических шунтирующих операций, направленных на предотвращение первого кровотечения из варикозно расширенных вен, риск больного умереть выше, чем в случае, если бы его не лечили вообще. Профилактическая эндоскопическая склеротерапия по сравнению с группами больных, где лечение не проводилось, или не дает никакого эффекта, или сопровождается худшими показателями.
В нескольких исследованиях показано, что эндоскопическое лигирование, выполненное с профилактической целью, способствует уменьшению риска кровотечения и снижает смертность, однако эти результаты требуют дальнейшего подтверждения. Профилактический прием неселективных бета-блокаторов ведет к уменьшению риска первого кровотечения из варикозно расширенных вен и, но всей видимости, улучшает выживаемость. Кровотечение более вероятно у больных с большими варикозными узлами. Именно им следует проводить профилактическое лечение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ГЭРБ - гастроэзофагеальная рефлюксная болезнь. Рефлюкс-эзофагит.
1. Какие симптомы позволяют думать о желудочно-пищеводном рефлюксе (ЖПР)?
При желудочно-пищеводном рефллюксе (ЖПР) часто наблюдают жжение за грудиной после еды или ночью, иногда сопровождающееся срыгиванием желудочного сока. Жжение уменьшается в положении стоя или сидя. Дисфагия, позднее осложнение ЖПР, вызывается отеком слизистой или стриктурой дистальной части пищевода.
2. В чем различие между изжогой и желудочно-пищеводном рефллюксе (ЖПР)?
Изжога — принятый в обиходе термин, указывающий на умеренный непостоянный рефлюкс желудочного содержимого в пищевод без повреждения ткани. Она сравнительно часто встречается у взрослых. Желудочно-пищеводный рефлюкс (ЖПР) подразумевает эзофагит с различной выраженностью эритемы, отека и рыхлости слизистой дистальной части пищевода. Частота его в популяции составляет 5%.
3. Что является причиной желудочно-пищеводного рефллюкса (ЖПР)?
Желудочно-пищеводный рефлюкс (ЖПР) происходит на фоне функциональной недостаточности нижнего пищеводного сфинктера, при которой желудочная кислота, желчь и пищеварительные ферменты повреждают незащищенную слизистую пищевода.
4. Является ли грыжа пищеводного отверстия диафрагмы важным фактором в развитии желудочно-пищеводного рефлюкса (ЖПР)?
Не у всех больных с ЖПР есть грыжа пищеводного отверстия диафрагмы, и не у всех больных с такой грыжей наблюдается ЖПР. Однако они часто сочетаются (у 50% больных с ЖПР есть грыжа пищеводного отверстия диафрагмы).
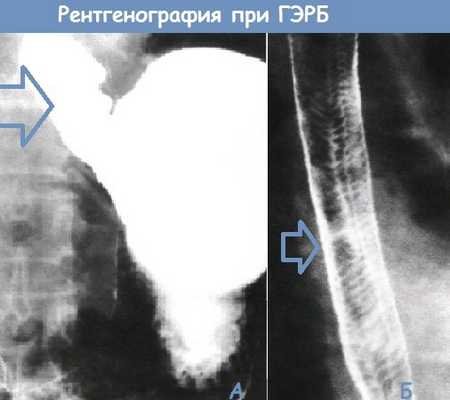
А. Рентгеноконтрастное исследование с барием, демонстрирующее спонтанный гастроэзофагеальный рефлюкс у пациента в горизонтальном положении
Б. Рентгенограмма пищевода с двойным контрастированием. «Кошачий пищевод» с многочисленными тонкими поперечными складками. Данные складки обычно непостоянны и часто сопутствуют ГЭРБ.
5. Какие исследования помогают обнаружить желудочно-пищеводный рефлюкс (ЖПР)?
Важным для постановки диагноза является эндоскопическое исследование с биопсией. Рефлюкс можно обнаружить во время рентгенологического обследования контрастированного барием пищевода, однако эта методика часто не позволяет выявить эзофагит. У некоторых больных уточнить диагноз помогает изучение в течение 24 часов pH пищевода, и сопоставление данных с клиническими проявлениями.
При подозрении на расстройство моторики пищевода, а также перед любым хирургическим вмешательством необходимо измерить давление нижнего пищеводного сфинктера и в пищеводе.
6. Какие нужно дать рекомендации больному с желудочно-пищеводным рефлюксом (ЖПР) или подозрением на желудочно-пищеводный рефлюкс (ЖПР)?
• Соблюдать диету с исключением продуктов, которые могут вызывать рефлюкс (например, шоколад, кофе)
• Избегать приема большого количества нищи перед сном
• Бросить курить
• Не носить тугую, обтягивающую одежду
• Поднять головной конец кровати на 4-5 дюймов (10-12 см)
• При клинических проявлениях принимать антациды
• Похудание может способствовать значительному уменьшению выраженности симптомов ЖПР
7. Что делать, если названные выше рекомендации не помогают?
Примерно у 50% больных удается достигнуть значительного улучшения с помощью Н2-блокаторов, однако лишь у 10% такой эффект сохраняется в течение года. Для улучшения эвакуации из желудка можно назначить метоклопрамид или цизаприд. Ни один препарат не приводит к длительному исчезновению симптомов, если не снижена выработка кислоты.
8. Какую роль при рефлюкс-эзофагите играют ингибиторы протонового насоса?
Ингибиторы протонового насоса ИПН (омепразол, лансопразол) необратимо ингибируют систему транспорта ионов водорода в париетальных клетках; их эффективность при лечении тяжелого эрозивного эзофагита превышает 80%. Излечение наступает у двух третей больных из числа тех, кто длительно принимает препарат. Проблемой при длительном лечении ингибиторами протонового насоса является гипергастринемия, наступающая вследствие ощелачивания антрального отдела.
Тот факт, что для слизистой желудка и кишечника гастрин является трофическим фактором, вначале заставлял опасаться развития в последующем опухолей, однако наблюдение за больными не подтвердили эти опасения.
9. Когда при ЖПР рекомендуют операцию?
В настоящее время хирургическое вмешательство при рефлюкс-эзофагите рекомендуют при:
(1) безуспешной медикаментозной терапии (заболевание не поддается лечению; непереносимость и аллергия на лекарства; больной не соблюдает предписания врача; рецидив симптомов во время проведения медикаментозной терапии);
(2) осложнениях (стриктура, расстройства дыхательной системы, эрозия зубов, медико-социальные нарушения, предраковые изменения слизистой) и
(3) если больной отдает ему предпочтение (вопрос стоимости лечения или образа жизни).
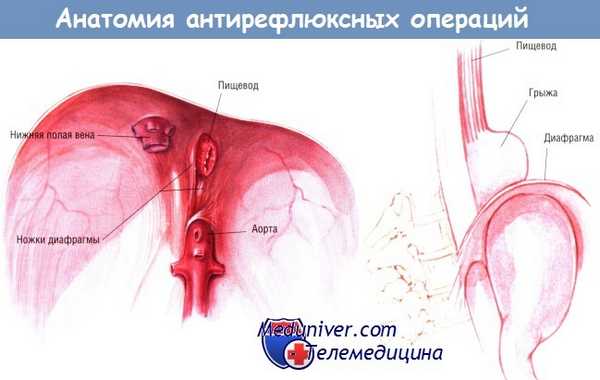
10. В чем заключаются цели хирургического лечения?
Операции при ЖПР направлены на предотвращение рефлюкса за счет механического увеличения давления нижнего нищеводного сфинктера, а также (большинство процедур) на восстановление достаточной длины дистальной части пищевода в зоне с высоким давлением брюшной полости. Если есть грыжа пищеводного отверстия диафрагмы, то ее устраняют одновременно. Ножки дифрагмы иногда можно приспособить в качестве зажима для нижнего пищеводного сфинктера.
11. Какие операции позволяют достичь эти цели? Как их выполняют?
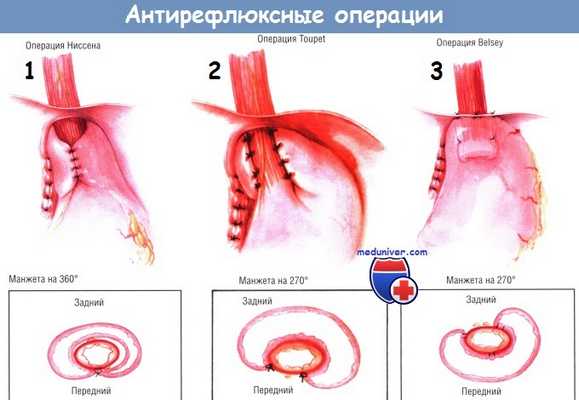
а) При фундопликации по Ниссену (Nissen), которую выполняют в более чем 95% случаях, дно желудка мобилизуют и обертывают вокруг дистальной части пищевода, сшивая его края спереди. Операция приводит к изменению угла пищеводно-желудочного перехода и удержанию дистальной части пищевода в брюшной полости, что предотвращает рефлюкс. Выполняют вмешательство через ланаротомный разрез или лапароскопически.
б) Операция Белси Марка IV (Belsey Mark) пол ностыо соответствует предыдущему вмешательству, однако выполняет ся через торакотомический доступ.
в) Фундопликацию по Тупе (Toupet) выполняют у больных с сопутствующими нарушениями моторики. Поскольку при ней не создается кольцевидной обертки, то послеоперационную дисфагию наблюдают значительно реже, чем при обертывании желудка вокруг всего пищевода (фундопликации по Ниссену). Однако отдаленные результаты могут быть хуже, чем при фундопликации по Ниссену. Эту операцию можно выполнять как через лапаротомный разрез, так и лапароскопически.
г) Гастропексия по Хиллу (Hill) возвращает пищевод в брюшную полость за счет подшивания кардиального отдела желудка к преаортальной фасции.

д) Протез Ангельчика (Angelchik) представляет собой силиконовое кольцо, которое одевают на дистальную часть пищевода в брюшной полости.

12. Насколько эффективны такие операции?
Все вмешательства, описанные в 11 вопросе, позволяют устранить ЖПР примерно у 90% больных, наблюдавшихся в течение 10 лет. В сравнительных исследованиях показано, что наиболее эффективной является фундопликация по Ниссену.
13. Какие отдаленные осложнения возможны при этих вмешательствах?
Рецидив рефлюкса возможен после каждой операции. При фундопликации по Ниссену и операции Белеи Марка IV возможно неправильное формирование или сползание желудочной манжеты. Дисфагия и потеря способности отрыгивать (синдром раздувания газом) являются следствием излишнего затягивания обертки. Протез Ангельчика может попасть в просвет органа вследствие эрозии стенки или сместиться.
14. Что делать, если вследствие ЖПР развилась стриктура?
Мягкую (нефиксированную) стриктуру можно раздуть. Фиксированные стриктуры требуют хирургического вмешательства. Одним из методов является пластика суженного пищевода стенкой желудка (Тал (Thai)).
15. Что дает лучшие отдаленные результаты при лечении ЖПР — терапия ингибиторами протонового насоса или фундопликация по Ниссену?
Ингибиторы протонового насоса высокоэффективно лечат эзофагит и устраняют симптомы ЖПР, однако отдаленное побочное действие этих препаратов полностью не изучено. Фундопликация освобождает больных от необходимости ежедневно принимать лекарства, но примерно у 5% больных сопровождается осложнениями.
16. Как лучше выполнять фундопликацию по Ниссену — лапароскопически или через лапаротомный доступ?
Процедура при любом способе одна и та же. Частота послеоперационных осложнений и смертей сопоставима. Лапароскопия характеризуется меньшей послеоперационной болью, меньшим сроком пребывания в больнице и более ранним возвращением к работе.
Варикозное расширение вен пищевода
Варикозное расширение вен пищевода – патология эзофагеальных вен, характеризующаяся их извитостью и мешотчатым расширением за счет формирования флебоэктазов. Причиной данного заболевания может служить поражение печени, сердца и других органов. Чаще всего варикоз пищевода никак не проявляется до возникновения самого грозного осложнения – кровотечения. Основной метод диагностики варикоза – ЭГДС, в процессе которой производится лечебный гемостаз. Также лечение включает в себя консервативные мероприятия: терапию основного заболевания, медикаментозную остановку кровотечения. При неэффективности терапевтических мероприятий проводится шунтирующая операция.
МКБ-10
Общие сведения
Варикозное расширение вен пищевода (ВРВ пищевода) – патология его венозной системы, развивающаяся вследствие повышения давления в системе воротной или полой вены. Сосуды пищевода тесно связаны с венозной системой органов брюшной полости и, в первую очередь, с системой воротной вены. Повышение давления в портальной вене приводит к нарушению оттока и застою крови в эзофагеальных венах, провоцируя развитие варикоза. В последние годы частота выявления портальной гипертензии значительно возросла, что связано с широкой распространенностью вирусных гепатитов, других заболеваний печени, алкоголизма.
Опасность данной патологии заключается в том, что примерно половина больных погибает уже при первом кровотечении. Риск повторных геморрагий очень высок, а смертность доходит до 80%. Заболевание неизлечимо, увеличить продолжительность жизни возможно только при регулярном обследовании и проведении мероприятий по предупреждению кровотечений. При появлении первых признаков заболевания последующая выживаемость составляет обычно не более нескольких лет.
Причины ВРВ пищевода
Причины варикоза пищевода зачастую связаны с повышением давления в системе портальной вены, гораздо реже флебоэктазии развиваются на фоне системной гипертензии (гипертонической болезни) или врожденной патологии. Чаще всего давление в v.portae повышается при циррозе или другой тяжелой печеночной патологии, опухолях печени или поджелудочной железы, которые сдавливают воротную вену, портальном тромбозе или аномалиях развития. При этом кровь сбрасывается из системы воротной вены по коллатералям через сосуды желудка в вены пищевода, вследствие чего давление в них значительно повышается. Так как пищеводные вены расположены в рыхлой клетчатке, а стенки их очень тонкие, при перегрузке объемом крови они растягиваются с образованием варикоза. При поражении печени варикозные узлы чаще всего располагаются в нижнем отделе пищевода и при входе в желудок, в то время как при системной гипертензии узлы более мелкие и расположены обычно по всей длине органа. Также варикоз может сформироваться при сдавлении верхней полой вены, при тяжелом поражении щитовидной железы, синдроме Киари. Более подвержены ВРВ пищевода мужчины после 50 лет.
Симптомы ВРВ пищевода
Первым симптомом болезни зачастую бывает кровотечение из флебоэктазов пищевода Изредка больные могут отмечать появление чувства давления и тяжести за грудиной за несколько дней до начала геморрагических осложнений. Иногда кровотечению предшествует эзофагит – из-за близости сосудистой стенки слизистая становится рыхлой, легко повреждается твердой пищей, воспаляется. При этом пациента может беспокоить чувство жжения, изжога и отрыжка кислым, затруднения при глотании плотной пищи.
Нормальное давление в пищеводных венах обычно не превышает 15 мм.рт.ст., при варикозе оно может значительно повышаться. Достижение уровня 25 мм.рт.ст. является критичным. При этом значение имеет не столько цифра давления, сколько выраженные колебания этого показателя. Кровотечение может быть незначительным, но примерно у 60% больных оно массивное, приводит к значительному ухудшению состояния или смерти. Чаще всего геморрагические проявления возникают на фоне колебаний давления – после физической нагрузки, переедания, часто во сне. Постоянные незначительные кровопотери могут не проявляться выраженной симптоматикой, но приводить к истощению и железодефицитной анемии. Такие кровотечения сопровождаются рвотой с прожилками крови, тошнотой, слабостью, меленой (черный стул из-за примеси свернувшейся крови), снижением веса. Если же кровотечение массивное, у пациента возникает обильная кровавая рвота, сильная слабость, нарушения сознания, потливость, давление понижается одновременно с повышением частоты сердечных сокращений.
Диагностика ВРВ пищевода
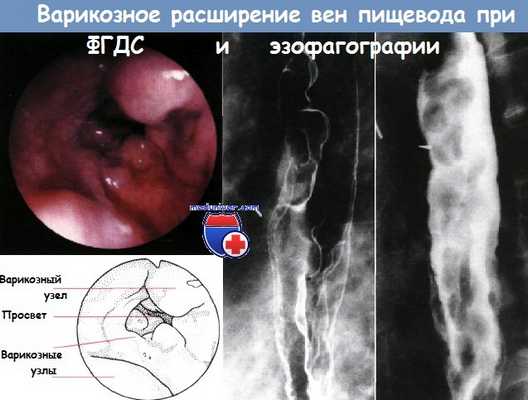
Обследование по поводу заболеваний печени позволяет обнаружить снижение уровня гемоглобина на фоне кровотечения. УЗИ органов брюшной полости, МРТ печени помогают выявить фоновое заболевание, которое привело к формированию варикозного расширения вен пищевода. Рентгенография пищевода с введением контрастного вещества дает возможность определить его сужение и деформацию стенок, вызванную выпячиванием варикозных узлов в просвет пищеводной трубки.
Наиболее информативным методом диагностики варикоза пищевода является эзофагогастродуоденоскопия – при осмотре просвета органа через эндоскоп видны синеватые узловые выпячивания вен. При обследовании на фоне профузного кровотечения определить его источник бывает затруднительно. ЭГДС позволяет выставить правильный диагноз, определить степень варикоза и опасность разрыва флебоэктаза, провести лечебные мероприятия. Следует помнить и о том, что кровотечение на фоне флебоэктазии пищевода может развиваться из других отделов ЖКТ (например, желудочно-кишечное кровотечение) и из-за других причин: опухолей ЖКТ, язвенной болезни, патологии свертывающей системы крови (тромбоцитопений, болезни Виллебранда, гемофилии, тромбоцитопенической пурпуры), синдрома Меллори-Вейса и др.
Лечение ВРВ пищевода
В зависимости от симптомов заболевания пациент может находиться под наблюдением в отделении гастроэнтерологии или хирургии. Задачей гастроэнтеролога является лечение основного заболевания и предупреждение развития кровотечения. Для этого пациент получает гемостатические препараты, антациды, витамины. В обязательном порядке осуществляют профилактику пищеводного рефлюкса. Рекомендуют строгое соблюдение правильного режима питания, отдыха и физических нагрузок.
При развитии кровотечения проводят гемостатическую терапию – назначают препараты кальция, витамин К, свежезамороженную плазму. Производят экстренную эзофагоскопию для установления источника геморрагии и эндоскопического клипирования кровоточащей вены, нанесение клеевой пленки и тромбина, электрокоагуляцию сосуда. Для остановки кровотечения применяют введение зонда Блэкмора – он имеет специальные баллоны, которые при надувании перекрывают просвет пищевода и сдавливают сосуды. Однако даже после этих манипуляций в 40-60% случаев положительный эффект не достигается.
После остановки кровотечения и стабилизации состояния применяют хирургические методы лечения – их эффективность намного выше, чем у консервативных методов. Обычно оперативное лечение заключается в наложении шунтов между портальной веной и системным кровотоком, благодаря которым давление в воротной вене снижается и вероятность кровотечения становится минимальной. Наиболее безопасным и популярным методом является эндоваскулярный трансъюгулярный метод наложения шунта (доступ через яремную вену), также накладывают портокавальные и спленоренальные анастомозы, практикуют удаление селезенки, перевязку непарной и воротной вен, селезеночной артерии и прошивание или эмболизацию вен пищевода.
Прогноз и профилактика ВРВ пищевода
Прогноз заболевания неблагоприятный – варикоз пищевода неизлечим, при появлении этого заболевания должны предприниматься все меры для предотвращения прогрессирования патологии и фатальных кровотечений. Даже впервые возникшее кровотечение существенно отягощает прогноз, сокращая продолжительность жизни до 3-5 лет.
Единственным методом профилактики варикозного расширения пищеводных вен является предупреждение и своевременное лечение заболеваний, провоцирующих данную патологию. Если в анамнезе имеется заболевание печени, которое может приводить к циррозу и повышению давления в портальной вене, пациент должен регулярно проходить обследование у гастроэнтеролога для своевременного выявления расширения сосудов пищевода.
При сформировавшемся варикозе следует соблюдать строгую диету: пища должна быть приготовлена на пару или сварена, желательно протирать еду и не употреблять плотные продукты в виде больших кусков. Не следует принимать блюда слишком холодными или горячими, грубую и твердую пищу для предотвращения травматизации слизистой пищевода. Для профилактики рефлюкса содержимого желудка в пищевод изголовье кровати приподнимают во время сна. Чтобы избежать кровотечений, рекомендуют исключить тяжелые физические нагрузки и подъем тяжестей.
Читайте также:
- Рентгенограмма, сцинтиграмма, КТ, МРТ бластических костных метастазов позвоночника
- Клиника хантавирусного легочного синдрома. Лечение хантавирусного легочного синдрома
- Тактика при сочетанной травме живота и таза.
- Плечеголовной ствол. Топография плечеголовного ствола. Левая общая сонная артерия. Левая подключичная артерия.
- Первичный туберкулезный комплекс. Формирование первичного туберкулезного комплекса.
