Тактика при сочетанной травме живота и таза.
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Оперативное лечение при сочетанной травме.
Оперативные вмешательства по поводу повреждения органов брюшной полости произведены 265 пострадавшим обеих групп. При сравнении результатов хирургического лечения в зависимости от применяемой лечебно-диагностической тактики видно, что уровень летальности при всех видах операций был существенно ниже при использовании предлагаемой методики. Летальность среди пострадавших, оперированных по поводу повреждении органов брюшной полости, снизилась с 42,8 % (59 случаев летального исхода среди 138 пострадавших) до 35,4 % (45 летальных исходов среди 127 пострадавших). При этом удалось полностью избежать проведения диагностических лапаротомий.
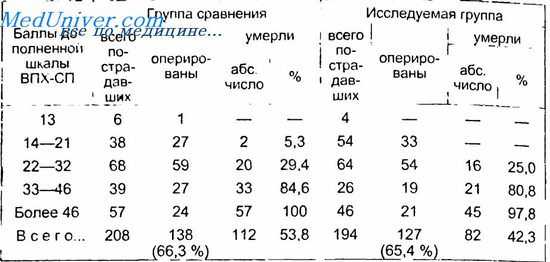
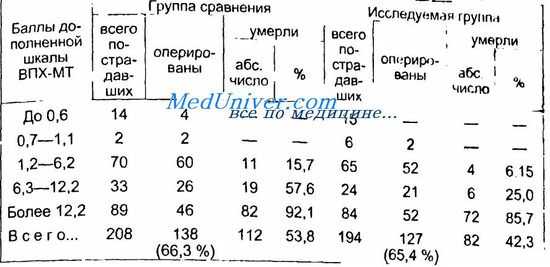
Результаты лечения в зависимости от тяжести состояния пострадавших при поступлении и выбранной лечебно-диагностической тактики представлены в табл. 3.5.
Как следует из таблице, предлагаемый лечебно-диагностический алгоритм позволяет не только ускорить дооперационное обследование пострадавшего, но и выбрать оптимальную тактику лечения, что способствует снижению летальности у данной группы больных с 53,8 до 42,3 %.
Уменьшение времени дооперационного обследования и использование инвазивных методов исследования (лапароскопия и лапароцентез) без задержки, но только при неясной клинической и сонографической картине позволяют добиться снижения летальности при всех степенях тяжести механических повреждений и исключить проведение диагностических лапаротомий. Особенно ярко это прослеживаете я при тяжелых и крайне тяжелых сочетанных повреждениях — свыше 1,2 балла по дополненной шкале ВПХ-МТ.
Использование предложенного алгоритма позволило снизить легальность при различной степени тяжести повреждения живота. Стопроцентная летальность при тяжести повреждения органов брюшной полости 15 баллов (повреждения живота с разрывом трех органов, причем два разрыва тяжелые), 19 баллов (разрыв аорты, нижней полой, воротной или печеночных вен) была связана с характером повреждения, а не с эффективностью диагностики.
Результаты лечения пострадавших с повреждениями живота при сочетаннои травме в зависимости от их тяжести состояния и использованного лечебно-диагностического алгоритма
Иллюстрацией эффективности предлагаемого лечебно-диагностического алгоритма в диагностике повреждений живота у пострадавших с сочетаннои травмой являются следующие примеры.
Больная Б., 24 лет, поступила в ГКБ № 64 16 ноября. Избита за сутки до поступления При поступлении состояние средней тяжести (16 баллов по дополненной шкале ВПХ-СП; прогнозируемая летальность до 3 %, частота развития осложнений до 25 %). Сознание сохранено, бледна. Жалобы на боль в пр «вой половине живота. Живот при пальпации мягкий, болезненный в правой половине. Симптом Щеткина—Блюмберга отрицательный. АД 150/90 мм рт. ст., ЧСС 76 в 1 мин, ЧД 18 в 1 мин. Выявлен перелом X ребра слева. При УЗИ, выполненном через 20 мин после поступления, обнаружено незначительное количество свободной жидкости в малом тазу. Селезенка не увеличена, контуры ее ровные, в паренхиме верхнего полюса определяется жидкостное образование неправильной формы размером 21 х 16 мм. Для уточнения характера патологии и решения вопроса об оперативном лечении выполнена видеолапароскопия. В брюшной полости выявлено до 250 мл крови. Селезенка в поле зрения не выводится. В области селезенки — фиксированные сгустки размером 3 х 4 и 4 х 5 см. В связи с инструментальной картиной повреждения селезенки больная была оперирована. На операции в брюшной полости выявлен гемоперитонеум 250 мл, в области ворот селезенки — фиксированный сгусток крови, после удаления которого началось кровотечение из разрыва селезенки. Произведена спленэктомия. Послеоперационный период протекал без осложнений. Выписана в удовлетворительном состоянии.
В данном случае быстрое использование УЗИ и видеолапароскопии, результаты которых взаимно дополняли друг друга, позволило своевременно установить показания к оперативному лечению и провести его до возникновения массивного внутрибрюшного кровотечения.
Больной Ш., 43 лет, посипит в НИИСП им. Н.В. Склифосовского через 2 сут после автотравмы (находился за рулем). Состояние при поступлении средней тяжести (17 баллов по дополненной шкале ВПХ-СП; прогнозируемая летальность до 3 % частота развития осложнений до 25 %). Сознание сохранено. Жалобы на интенсивную боль в левом подреберье. АД 120/80 мм рт. ст., ЧСС 98 в 1 мин, ЧД 20 в 1 мин. Выявлены множественные (с III по X) переломы ребер справа гемопневмоторакс. Живот не вздут, ограниченно участвует в акте дыхания, резко бо!езненныи при пальпации в левом подреберье, где определяется симптом Шеткина— Блюмберга При УЗИ выявлена свободная жидкость в нижних отделах живота и между петлями тонкой кишки (разобщение листков брюшины 1,0—1,5 см). В связи с неоднозначностью клинической и сонографической картин произведена видеолапароскопия, при которой во всех отделах брюшной полости обнаружены небольшие скопления темной крови. Серозная оболочка петли тонкой кишки, находящейся в малом тазу, на протяжении 3 см пропитана кровью. Повреждений печени и селезенки нет. Заключение: ушиб участка тонкой кишки.
Учитывая данные лапароскопии, от оперативного лечения у данного больного отказались. Произведено дренирование плевральной полости. Для динамического контроля в последующие дни трижды выполняли УЗИ с интервалами 2—3 дня. При УЗИ свободной жидкости в брюшной полости не выявлено. Выписан в удовлетворительном состоянии на 39-е сутки после поступления.
Это наблюдение доказывает эффективность предлагаемой лечебно-диагностической схемы у пострадавших, не нуждающихся в оперативном лечении.
Больной Ф., 23 лет, поступил в НИИСП им. Н.В. Склифосовского в 07.00 24 июля, через 2 ч после получения травмы (избит). Состояние при поступлении средней тяжести (17 баллов по дополненной шкале ВПХ-СП; прогнозируемая летальность до 3 %, частота развития осложнений до 25 %), в сознании. Жалобы на головную боль, незначительные боли в животе. АД 120/80 мм рт. ст., ЧСС 100 в 1 мин, ЧД 18 в 1 мин. Живот участвует в акте дыхания, при пальпации мягким, болезненный в правом подреберье. Перитонеальная симптоматика отсутствует. Диагностировано сотрясение головного мозга. При УЗИ, выполненном через 30 мин после поступления, свободной жидкости в брюшной полости не обнаружено. Выявляется ушиб левой почки. Через 3 ч с момента поступления больной начал отмечать усиление боли в правом подреберье. При пальпации живота в этой области определялась болезненность. Перитонеальная симптоматика отсутствовала. В отлогих местах живота укорочение перкуторного звука не определялось. При повторном УЗИ свободной жидкости в брюшной полости не выявлено. Определялась утолщенная до 7 мм стенка желчного пузыря с признаками удвоения контура. Заключение: травма желчного пузыря?, острый холецистит?
В связи с неясностью клинической картины и ее несоответствием данным УЗИ выполнена видеолапароскопия. В брюшной полости обнаружены небольшое количество фибринозного выпота с примесью желчи, гематома стенки желчного пузыря 3 х 1 см, имбибиция желчью гепатодуоденальнои связки и забрюшинной клетчатки в области двенадцатиперстнои кишки. Заключение: разрыв двенадцатиперстной кишки. Данные видеолапароскопии послужили основанием для проведения оперативною лечения. При лапаротомии после мобилизации двенадцатиперстной кишки по Кохеру на переднеправой стенке нисходящей её части выявлен разрыв 2 х 1 см с поступлением из него желчи Разрыв ушит двухрядным викриловым швом на атравматической игле В связи с гематомой стенки желчного пузыря наложена холецистостома ппоиз ведено дренирование брюшной полости. Пocлeoпepaционный, период протекал гладко. Холецистостомическая трубка удалена на 15-е сутки после операции. Выписан на 22-е сутки после поступления.
В данном наблюдении применение лапароскопии, при несоответствии клинической и сонографической картин, позволило выявить разрыв двенадцатиперстной кишки до развития забрюшинной флегмоны и распространенного перитонита.
Особенно важно, что у всех 24 пострадавших с гемоперитонеумом менее 500 мл крови без признаков продолжающегося кровотечения (что было установлено инструментальными методами диагностики) применение предлагаемого диагностического алгоритма позволило избежать неоправданной лапаротомии.
Больной К., 26 лет. поступил в реанимационное отделение НИИСП им. Н.В. Склифосовского в 21.00 14 января, через 50 мин после автотравмы. Состояние при поступлении тяжелое (32 балла по дополненной шкале ВПХ-СП; прогнозируемая летальность до 30 %, вероятность развития осложнений до 50 %), уровень сознания — кома. АД 140/80 мм рт. ст., ЧСС 100 в 1 мин, ЧД 22 в 1 мин. Начаты реанимационные мероприятия, ИВЛ. Выявлены перелом свода черепа, ушиб мозга правой лобной доли, субарахноидальное кровоизлияние, перелом VIII—XI ребер справа. Живот не вздут, в отлогих его местах укорочение перкуторного звука отсутствует. При обзорной рентгенографии обнаружены свободная жидкость в брюшной полости, забрюшинная гематома. При УЗИ, выполненном через 10 мин после поступления, гидроперитонеума не выявлено. Обнаружены ушиб правой почки, забрюшинная гематома. Через 2,5 ч при контрольном УЗИ найдено минимальное количество жидкости в брюшной полости, подтвержден ушиб правой почки, забрюшинная гематома. За время лечения гемодинамика больного оставалась стабильной При очередном УЗИ выявлен ушиб правой доли печени без признаков гематомы. При последующих УЗИ определялся регресс ушиба печени. Свободная жидкость в брюшной полости перестала определяться к концу 2-х суток после поступления пострадавшего в институт. На 30-е сутки больной выписан в удовлетворительном состоянии.
Таким образом, УЗИ позволило выявить гемоперитонеум небольшого объема, исключив при этом его нарастание, что дало возможность избежать диагностической лапаротомии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тактика при сочетанной травме живота и таза.
В заключение следует остановиться на диагностическом алгоритме при сложных случаях сочетанной травмы живота и таза. Перелом костей газа является абсолютным показанием к пальцевому исследованию прямой кишки, а при подозрении на ее повреждение — к ректоскопии. Обязательными являются УЗИ малого таза, а при наличии гематомы в области промеж ности и по внутренним поверхностям бедер — ультразвуковое доппдеровское исследование для исключения травмы сосудов.
Если при первичном осмотре из уретры выделялись капли крови, следует заподозрить ее разрыв и после стабилизации гемодинамики выполнить уретрографию. Катетеризация мочевого пузыря при этом противопоказана из-за большой вероятности увеличения разрыва уретры. В таких случаях необходимо наложение эпицистостомы. При необходимости срочной эвакуации мочи из переполненного мочевого пузыря выполняют его пункцию под контролем УЗИ. Во всех остальных случаях производят катетеризацию мочевого пузыря с оценкой вида и количества мочи. Наличие макрогематурии свидетельствует о повреждении мочевыделительной системы в целом, при этом для уточнения локализации и характера повреждения необходимо применение комплекса инструментальных методов исследования (от контрастной цистографии до селективной ангиографии). Малое количество или отсутствие мочи, равно как и необычно большое ее количество, могут свидетельствовать о разрыве мочевого пузыря В частности, при внутрибрюшном разрыве пузыря по катетеру может поступать содержимое не только мочевого пузыря, но и брюшной полости (симптом Зельдовича),
При подозрении на разрыв мочевого пузыря выполняют цистографию в положении пострадавшего на спине. В предварительно опорожненный мочевой пузырь шприцем Жане по катетеру вводят 250—300 мл 20 % водорастворимого контрастного вещества, после чего катетер пережимают кровоостанавливающим зажимом и производят три рентгеновских снимка: прямой снимок области таза, снимок мочевого пузыря в косой проекции и прямой снимок области таза после опорожнения мочевого пузыря от контрастного раствора.
При анализе полученных цистограмм обращают внимание на положение мочевого пузыря, его форму, размер, контуры, характер затекания контраста в брюшную полость, в околопузырную клетчатку.

При отсутствии данных о повреждении мочевого пузыря и сохраняющейся макрогематурии выполняют экскреторную урографию с целью выявления травмы почек или мочеточника. Если почки и мочеточники не повреждены, гематурию следует объяснить контузией мочевого пузыря либо травмой его слизистой оболочки при катетеризации.
В группе больных с закрытой травмой органов брюшной полости, в лечении которых была использована разработанная нами лечебно-диагностическая схема, основной причиной смерти была острая кровопотеря в сочетании с травматическим шоком (49 наблюдений). У 48 пострадавших летальный исход наступил в первые сутки с момента поступления. В более поздний период основными причинами смерти были пневмония (10 наблюдений) и нарастающий отек и дислокация головного мозга (8 наблюдений). Осложнения развились у 61 пострадавшего (у 43,6 % пострадавших, проведших в стационаре более 1 сут).
Использование предлагаемого лечебно-диагностического алгоритма сокращает время дооперационного обследования и исключает проведение диагностических лапаротомий, способствуя снижению летальности у пострадавших с травмой живота при сочетанных повреждениях в целом с 53,8 до 42,3 % и в группе оперированных больных с 42,8 до 35,4 %. Использование комплекса современных диагностических методов позволяет проводить консервативное лечение пострадавших с гемоперитонеумом до 500 мл при остановившемся кровотечении.
Опыт объективной оценки тяжести состояния по дополненной шкате ВПХ-СП показал, что она в значительной степени определяет диагностический и лечебный алгоритмы оказания помоши пострадавшим.
К сожалению, внедрению в практику предлагаемого лечебно-диагностического алгоритма мешает отсутствие во многих лечебных учреждениях круглосуточной службы ультразвуковой диагностики. Данное обстоятельство лишает возможности проведения УЗИ больным в вечернее и ночное время и резко ограничивает возможность проведения динамического ультразвукового наблюдения.
В последние годы количество повреждений после высокоэнергетических травм продолжает расти, среди них в 5—20% случаев встречаются переломы тазовых костей [1—4]. Чаще всего причиной несращения или неправильного сращения костей таза после лечения нестабильных травм тазового кольца является неправильное первичное лечение. Все травмы таза в 90% случаев имеют многочисленный сочетанный характер и сопровождаются травматическим шоком, поэтому в первые часы травмы проводят лечебные мероприятия для спасения жизни больного [2, 5, 6].
Травмы таза по сравнению с другими травмами чаще приводят к смерти и длительной потере трудоспособности, что обусловлено наличием органов внутри таза, и поэтому входят в число самых тяжелых травм опорно-двигательной системы (ОДС) [7—10]. Тяжесть таких травм связана с сильным болевым синдромом, массивным кровотечением и травматическим шоком [11].
В настоящее время многие специалисты оценивают фиксацию переломов как основной фактор борьбы против шока, а также профилактики гипостатических осложнений и достижения хороших функциональных результатов [10, 12, 13]. Неотложная фиксация нестабильных травм тазового кольца простым аппаратом (ХФА) входит в алгоритм лечения тяжелых травм — ATLS (Advancede Trauma Life Support) [14].
Среди причин инвалидизации, обусловленных повреждениями ОДС, удельный вес травм таза составляет 25—55% [11].
Основу повреждений таза при политравмах составляют осложненные переломы тазовых костей, т. е. повреждения тазовых органов, связанные с нарушением тазового кольца, в том числе повреждение нижних отделов мочевыводящих путей. В целом в связи с характером политравм формируются различные варианты возможных повреждений органов, близко расположенных к тазу. В клинической практике встречаются различные варианты сочетанных травм органов таза и брюшной полости. Такие травмы создают необходимость обсуждения спорных проблем и определяют направление научных исследований. Таким образом, актуальность сочетанных травм таза и брюшной полости связана с постоянным ростом высокоэнергетических травм, возникновением тяжелых последствий этих травм и высоким процентом инвалидности и неблагоприятных исходов.
Цель работы — снижение инвалидности и летальности у больных с сочетанными травмами таза и живота, а также формирование новой тактики лечения.
Материал и методы
Проведен ретроспективный и проспективный анализ лечения 1033 больных с тяжелыми сочетанными травмами (ТСТ) в бакинской клинической больнице № 3 в течение 2009—2015 гг. Больные, получавшие лечение в 2009—2010 гг. (n=205), вошли в группу сравнения, а больные, пролеченные в 2011—2015 гг. (n=828), — в основную группу.
У 204 (19,2%) больных были переломы костей таза, из них 165 (19,3%) из основной, а 39 (19%) из группы сравнения (107 (52,5%) мужчин и 97 (47,5%) женщин). Лечение группы сравнения заметно отличалось от традиционных методов. Степень тяжести травмы у больных основной группы оценивали по шкалам AİS (Abbreviated İnjury Scale) и İSS (İnjury Severity Scale), помощь им оказывали по принципу damage control [15].
Для применения принципов damage control на практике необходимо оценить 3 важных признака:
1) тяжесть основной травмы (Firsthit);
2) биологическую конституцию больного (возраст, масса тела, сопутствующие заболевания);
3) количество абсолютно необходимых оперативных вмешательств, ожидаемое время их выполнения, травматичность и возможную кровопотерю. Эти операции для больных с ТСТ и политравмой являются «вторичным ударом» (second hit).
Таким образом, принципы damage control подразумевают выполнение в первую очередь неотложных операций на органах грудной полости, живота и черепа. Однако и эти операции целесообразно разделять на 2, а порой и на 3 этапа. На первом этапе, например, ликвидация гемопневмоторакса при помощи дренирования плевральной полости, далее выполнение лапаротомии для остановки внутрибрюшного кровотечения путем пережатия сосудов, тампонады, изоляции поврежденного кишечника. На данном этапе брюшную полость временно закрывают кожными провизорными швами. Параллельно с этим проводят интенсивную реанимационную поддержку для стабилизации центральной гемодинамики, дыхания и сердечной деятельности. В большинстве случаев, если удается стабилизировать основные витальные функции, в ближайшие 24—36 ч этих больных подвергают окончательной хирургической коррекции и лапаротомную рану зашивают. Таким образом, программированное многоэтапное хирургическое лечение, учитывающее степень тяжести травмы, составляет основу этого принципа.
При помощи методов лучевой диагностики (УЗИ, рентгенографии и КТ) у больных обнаружены перелом костей таза, свободная жидкость, газ и гематомы в брюшной полости. Кроме того, больным проведено контрастное обследование мочевого пузыря и почек.
У больных с ТСТ, доставленных в клинику в тяжелом состоянии, большое значение имеет применение малотравматичного инвазивного метода диагностики с большей информативностью. Одним из методов, отвечающих этим требованиям, является лапароцентез, его применение создает условие для немедленного обнаружения патологической жидкости в брюшной полости и помогает снизить в несколько раз количество ошибок. Чувствительность метода очень высокая, но при обширных гематомах можно получить сомнительные диагностические данные. По этой причине у 8 больных был использован более информативный метод — лапароскопия.
Несмотря на высокую информативность, этот метод является травматичным, однако при тяжелых повреждениях других анатомических областей лапароскопическое обследование показано. Лапароскопию широко применяют для диагностики повреждений органов брюшной полости при травмах. Однако при сочетанных травмах метод лапароскопии не считается обязательным, дающим полную картину. У 14 больных диагноз уточнен при помощи цистографии, ретроградной уретропиелографии. У 12 больных на фоне пареза кишечника результаты УЗИ были сомнительными, что потребовало проведения экскреторной урографии, и у 6 больных выявлено повреждение почек.
Для обнаружения повреждений органов брюшной полости и забрюшинного пространства после ликвидации жизненеопасных и нуждающихся в неотложной помощи повреждений у 29 больных в срочном порядке проведено КТ-обследование.
Конечным этапом обследований, согласно принципам damage control, является лапаротомия — сразу или после предшествующей лапароскопии или лапароцентеза.
У 87 (42,6%) из 204 больных с переломом костей таза зафиксировано повреждение черепа, у 73 (36,8%) — грудной клетки, у 61 (29,9%) — органов брюшной полости, в том числе у 34 (16,7%) — повреждение паренхиматозных органов, у 9 (4,4%) —перелом позвонков, у 132 (64,7%) — перелом длинных трубчатых костей. Чаще всего встречались переломы лонных костей — 116 (56,9%), из них у 23 (19,8%) больных был двусторонний перелом. У 108 (52,9%) выявлен перелом седалищной кости, из них у 28 (25,9%) — двусторонний перелом. Перелом вертлужной впадины зафиксирован у 74 (36,3%) больных, из них у 13 (17,6%) его выявили наряду с вывихом головки бедренной кости. У 2 (2,7%) пациентов был двусторонний перелом суставной ямки тазобедренного сустава.
У 65 (31,9%) из поступивших в клинику 2004 больных с сочетанной травмой таза отмечено повреждение типа А, у 80 (39,2%) — типа В, у 59 (28,9%) — типа С, соответственно в основной группе у 53 (32,1%), 62 (37,6%) и 50 (30,3%), в группе сравнения у 12 (30,8%), 18 (46,1%) и 9 (23,1%).
У 62 больных выявлена сочетанная травма таза и живота — 50 (30,3%) из 165 больных из основной группы, 12 (30,8%) из 39 больных из группы сравнения. У 7 (17,9%) больных из группы сравнения и у 27 (16,4%) из основной группы было повреждение паренхиматозных органов брюшной полости и внутрибрюшное кровотечение, в том числе типа, А соответственно у 3 (25%) и 13 (26%), типа B — у 6 и 19 (38%), типа С — у 3 и 18 (36%).
При переломах костей таза, как правило, выявляли забрюшинные гематомы различного размера. Дистальные гематомы локализовались от V поясничного позвонка до тазового дна и составляли 250—500 мл. Гемотрансфузии осуществляли только при выраженных снижениях гематологических показателей. При промежуточной локализации кровоизлияния распространяются от II до V поясничного позвонка, часто односторонние. Кровопотеря в этом случае может достигать 1000—1500 мл. Для выведения больного из шока обычно проводили гемотрансфузию. Большие кровоизлияния проксимальной локализации распространяются от поясничных позвонков до XII грудного позвонка, т. е. до уровня поджелудочной железы и всегда сопровождаются симптомами «острого живота». В таких случаях кровотечение принимает интенсивный характер, может достичь 2—3 л и более, а пациентам показан эквивалентный объем переливания компонентов крови (3 л и более). Трансфузию проводили многоэтапно в течение нескольких дней.
У 21 (33,9%) больного из 62 с ТСТ живота и таза выполнен лапароцентез, у 49 (79%) — лапаротомия (в том числе у 13 после лапароцентеза). У 56 (90,3%) больных проведено УЗИ, а у 5 (8,1%) потребовались повторное УЗИ и лапаротомия из-за повышения объема свободной жидкости в брюшной полости, причем у 23 больных заключение УЗИ было сомнительным и понадобилось КТ-обследование, в ходе которого было подтверждено наличие внутрибрюшного повреждения (диагностическая точность 100%).
У 13 (26,5%) из 49 больных из-за очень тяжелого общего состояния лапаротомия выполнена сразу, без предварительной лучевой диагностики. У 16 из 21 больного, которым выполнен лапароцентез, применены методы лучевой диагностики (УЗИ у 12, рентгенография у 4). У 17 (81%) из них лапароцентез завершен лапаротомией. У 12 больных на фоне пареза кишечника и сомнительных данных УЗИ после выведения из шока выполнена экскреторная урография, повреждение почек обнаружено у 8 из них.
У 7 (17,5%) из 40 больных в ходе лапаротомии выявлены повреждения печени и селезенки, у 4 (10%) — печени и желчного пузыря, у 2 (5%) — печени, желчного пузыря и селезенки, у 5 (12,5%) — печени и тонкой кишки, у 2 (5%) — печени и мочевого пузыря, у 7 (17,5%) — селезенки, у 4 (10%) — селезенки и тонкой кишки, у 2 (5%) — селезенки и толстой кишки, у 3 (7,5%) — изолированное повреждение почек, у 3 (7,5%) — мочевого пузыря, у 1 (2,5%) — отслоение плаценты.
У больных основной группы повреждения живота встречались чаще. У 12 (24%) из 50 больных отмечено повреждение средней, у 14 (28%) — тяжелой, у 18 (36%) — очень тяжелой, а у 6 (12%) — критически тяжелой степени. У 3 (25%) из 12 больных группы сравнения степень повреждения расценена как среднетяжелая, у 5 (41,7%) — как тяжелая, у 3 (25%) — как очень тяжелая, у 1 (8,3%) больного состояние признано критическим. Несмотря на то что в основной группе больных в тяжелом состоянии в целом много, летальность в ней составила 44,4%, тогда как в группе сравнения с меньшим количеством таких больных она достигла 55,6%.
Состояние 1 из 12 больных с сочетанными травмами живота и таза оценено как критическое, через 15 мин после поступления в клинику он умер. У 5 (45,5%) из 11 больных отмечен летальный исход. Состояние 6 из 50 больных основной группы оценено как критическое и через 3—5 мин после поступления в клинику они умерли. Лечение 16 (36,4%) больных из 44 завершилось смертью.
У 62 больных с сочетанной травмой живота и таза доминировали повреждения различных анатомических областей: живота у 15 (24,2%), черепа у 18 (29%), органов грудной клетки у 8 (13%), таза у 16 (25,8%), у 5 (8%) больных доминировала клиника травмы конечностей.
Для проведения запланированных мер проводили раннее выявление доминантных травм и определяли этапы лечения. Первый этап включал неотложную и кратковременную лапаротомию, остановку кровотечения и меры по предотвращению загрязнения брюшной полости содержимым полых органов. Временно закрывали лапаротомическую язву с целью профилактики компартментного синдрома. На втором этапе для полного и быстрого восстановления метаболических нарушений продолжали меры интенсивной терапии и реанимации. Начальные 24—36 ч после первой операции считали решающим этапом. После стабилизации физиологических показателей травмированных переходили к третьему этапу (программированной релапаротомии, повторной ревизии органов брюшной полости). На этом этапе осуществляли малоинвазивный остеосинтез нестабильных переломов. Критериями стабилизации состояния больных считали следующие показатели: систолическое артериальное давление 100 мм рт.ст., пульс 100 в минуту, гематокрит 30%.
Для иллюстрации эффективности тактики лечения при ТСТ приводим клиническое наблюдение.
Пострадавший А.Е., 26 лет, госпитализирован в отделение реанимации и интенсивной терапии в критическом состоянии с диагнозом: тяжелая сочетанная черепно-мозговая травма, ушиб головного мозга тяжелой степени, множественные закрытые переломы VII—XI ребер слева с частичным смещением фрагментов, закрытый пневмоторакс. Разрыв левого купола диафрагмы и сигмовидной кишки. Закрытые переломы левой лонной и седалищной костей. Закрытые диафизарные переломы левой плечевой и бедренной костей. Закрытые неосложненные переломы LI—LIV позвонков. Травматический шок III—IV степени. Как видно из представленных данных, у пострадавшего повреждены все 6 анатомических областей. По шкале AIS степень тяжести травм грудной клетки и живота соответствует 4 баллам, переломы левой плечевой и бедренной костей — 3 баллам, переломы костей таза и переломы LI—LIV позвонков — 2 баллам. В соответствии с индексом ISS тяжесть травмы и состояние пострадавшего оценены как крайне тяжелые, а вариант течения как декомпенсированный. На фоне интенсивной противошоковой терапии и мероприятий, направленных на поддержание витальных функций, в соответствии с концепцией damage control больному выполнена экстренная операция — лапаротомия, спленэктомия, ушивание участков разрыва сигмовидной кишки и диафрагмы, дренирование плевральной и брюшной полости. После надежной стабилизации показателей гомеостаза вследствие интенсивных реанимационных мероприятий, проводимых в течение 2—3 ч, пострадавшему выполнен малоинвазивный остеосинтез левой плечевой и бедренной кости. Через 21 день пациент в удовлетворительном состоянии выписан для амбулаторного лечения.
Заключение
У больных с сочетанными травмами живота и таза проведено лечение по принципу damage control, что привело к снижению летальности с 41,7 до 32% в основной группе больных.
У больных с повреждением таза типа, А (средняя степень тяжести по шкале İSS 17—25 баллов) может применяться любое хирургическое вмешательство. У больных с повреждениями таза типа, А и тяжестью повреждений 26—40 баллов по шкале İSS наряду с реанимационными манипуляциями могут производиться операции неотложного характера. При переломах типа В необходимо выполнять лишь неотложные операции, а при переломах типа С — только операции, направленные на спасение жизни больных. Эти операции осуществляются до и во время операции одновременно с гемотрансфузией и стабилизацией витальных функций. У больных с очень тяжелой степенью повреждений по İSS (41—49 и до 75 баллов), оцениваемой как критическая, независимо от типа тазовых повреждений могут проводиться только операции, направленные на спасение жизни больного. Остеосинтез костей таза возможен после относительной стабилизации витальных функций.
Таким образом, чем больше степень тяжести состояния больного при сочетанной травме, тем меньше времени должно быть потрачено на диагностические меры, чтобы как можно скорее приступить к хирургической остановке кровотечения, предотвращению легочной компрессии, декомпрессии (трепанации) черепа и т. д. Поэтому для быстрого обнаружения основных повреждений внутренних органов и серьезных повреждений опорно-двигательной системы должны быть реализованы специальные алгоритмы диагностических и лечебных мер. При наличии абсолютных показаний к операциям для спасения жизни больного дооперационное выяснение степени риска хирургического вмешательства переходит на второй план. У больных с сочетанными травмами обнаруженное повреждение можно лечить одновременно как хирургическим, так и консервативными методами. Но при этом хирург и реаниматолог должны выбрать путь с наименьшей вероятностью риска летального исхода и осложнений. Степень тяжести состояния пострадавшего, продолжающееся кровотечение, нарастающая дыхательная недостаточность, признаки черепно-мозговой дислокации требуют точной хирургической тактики. В таких случаях правильно выбранная оперативная тактика, последовательность и объем операций имеют большое значение для жизни больного.
Тяжелая сочетанная травма таза приводит к высокой летальности, сопровождается большим процентом осложнений, а функциональные результаты лечения часто по-прежнему остаются недостаточно хорошими [1, 3, 4, 7, 8]. Сложность диагностики повреждений таза при политравме препятствует адекватному лечению пострадавших и получению хороших функциональных результатов [1, 2, 4, 10]. При проведении диагностических мероприятий необходимо учитывать тяжесть состояния пострадавшего, чтобы не усугубить его, но при этом максимально полно выявить все повреждения [5, 11], поскольку необоснованный отказ от проведения дополнительных методов исследования ведет к неправильной диагностике типа перелома, недооценке степени нарушения стабильности тазового кольца и к выбору неправильной тактики лечения [6, 9]. Другим важнейшим вопросом в выработке тактики лечения пострадавших остается определение оптимального порядка хирургических пособий при политравме [5, 6]. Предпосылками для успешного лечения является также полная, точная и своевременная диагностика всех сочетанных повреждений [5].
Цель исследования - улучшение результатов лечения нестабильных повреждений тазового кольца у пострадавших с тяжелой сочетанной травмой.
Материал и методы
В основной группе - 320 пострадавших с сочетанной травмой таза (2005-2013 гг.) - применяли разработанные лечебно-диагностические методики. Группу сравнения составили 213 пострадавших с сочетанной травмой таза, поступивших в НИИ СП им. Н.В. Склифосовского в 1999-2004 гг. Обе группы (всего 533 пострадавших) были сравнимы по полу, возрасту, типу перелома костей таза и общей тяжести травмы. В основной группе применен разработанный лечебно-диагностический алгоритм, основанный на объективной оценке типа перелома костей таза (см. рисунок) и тяжести состояния пострадавшего (см. таблицу). Рисунок 1. Повреждения тазового кольца по классификации Tile-AO/ASIF. а - стабильный перелом (n=15, или 4,7%), б - ротационно-нестабильный перелом (n=217, или 67,8%), в - вертикально-нестабильный перелом (n=88, или 27,5%).
Первичную фиксацию таза бандажем непосредственно после поступления пострадавшего, госпитализацию всех пострадавших с переломом таза в реанимационное отделение, фиксацию задних отделов таза при вертикально нестабильных переломах С-рамой и комплексную методику восстановительного лечения применяли только у пациентов основной группы.
Минимально необходимое обследование включало рентгенографию груди, шейного и поясничного отделов позвоночника, таза, УЗИ плевральных и брюшной полостей по методике FAST (Focused Assessment with Sonography in Trauma). Это позволяло установить наличие внутреннего кровотечения и поставить показания к экстренному дренированию плевральной полости или лапаротомии. Объем дополнительного обследования определяли, исходя из тяжести состояния пострадавшего. При стабильном или пограничном состоянии проводили компьютерную томографию (КТ) костей таза и (по показаниям) живота. При нестабильном состоянии выполняли рентгенографию в дополнительных проекциях inlet-outlet, а КТ-исследование откладывали до стабилизации состояния пострадавшего до уровня пограничного. При критическом состоянии ограничивались рентгенографией в прямой проекции, дальнейшие исследования проводили после относительной стабилизации состояния пострадавшего. УЗИ с осмотром органов и структур брюшной полости и забрюшинного пространства проводили у пострадавших, находившихся в стабильном и пограничном состоянии.
Уретрографию выполняли при обнаружении крови в области наружного отверстия мочеиспускательного канала или трудности катетеризации мочевого пузыря. После исключения травмы уретры проводили катетер в мочевой пузырь и при наличии гематурии выполняли цистографию.
Результаты и обсуждение
Всем пострадавшим основной группы первичную фиксацию проводили матерчатым бандажем на фоне интенсивной терапии непосредственно после выявления клинических признаков нестабильности тазового кольца для создания горизонтальной компрессии таза.
Стержневые аппараты, надежно фиксирующие переднее тазовое полукольцо, недостаточно эффективны при полных повреждениях задних отделов таза, которые и вызывают вертикальную нестабильность. В таких ситуациях фиксацию заднего полукольца С-рамой проводили сразу после выявления вертикальной нестабильности таза по клиническим признакам и данным рентгенографии в прямой проекции при любой тяжести состояния пострадавшего.
При сочетанной черепно-мозговой травме наружная фиксация таза была проведена еще до начала трепанации черепа у 15 (4,7%) пострадавших.
При закрытой травме груди, осложненной гемо- или пневмотораксом, в комплекс реанимационных мероприятий включено дренирование плевральной полости с постоянной аспирацией по дренажу и реинфузия отмытых аутоэритроцитов у 55 (17,2%) пострадавших. Продолжающееся внутрибрюшное кровотечение являлось показанием к экстренной лапаротомии у 38 (11,9%) пострадавших. Операции по поводу повреждения органов груди и живота заканчивались наложением аппарата наружной фиксации (АНФ) для стабилизации поврежденных отделов переднего тазового полукольца у 93 (29,1%) пострадавших.
Проведение накостного остеосинтеза переднего полукольца в условиях повреждения нижних мочевыводящих путей сопровождается высоким риском развития гнойно-септических осложнений, поэтому у 18 (5,6%) таких пострадавших метод наружной фиксации переднего полукольца остался основным на всех этапах лечения. Остеосинтез заднего полукольца канюлированными винтами при переломе типа С провели у 7 (2,2%) пострадавших, находившихся в стабильном или пограничном состоянии. Значительное смещение ветвей лонных костей в полость малого таза являлось показанием к остеосинтезу верхних ветвей канюлированными винтами после репозиции отломков с дополнительной фиксацией АНФ у 2 (0,6%) пострадавших.
При открытом повреждении конечностей в 76 (23,8%) наблюдениях после остановки наружного кровотечения, временной иммобилизации перелома и промывания ран растворами антисептиков провели фиксацию таза АНФ, после чего выполнили первичную хирургическую обработку ран конечностей и остеосинтез наружным или внутренним фиксатором в зависимости от типа открытого перелома и степени повреждения мягких тканей.
Остеосинтез закрытых переломов костей конечностей провели при стабильном состоянии пострадавшего и фиксированном повреждении тазового кольца в 47 (14,7%) наблюдениях.
Повреждения таза типа А, являющиеся стабильными, в большинстве наблюдений не требовали оперативного лечения, однако при значительном смещении отломков лонных костей (тип А2) и крыла подвздошной кости (тип А1) в 15 (4,7%) наблюдениях был показан остеосинтез пластиной или винтами при стабильном состоянии пострадавшего.
Окончательную фиксацию заднего полукольца при повреждениях типа С остеосинтез канюлированными винтами выполнили в течение первых 3 сут при достижении стабильного или пограничного состояния у 88 (27,5%) пострадавших после демонтажа С-рамы при устраненном вертикальном смещении половины таза.
При повреждениях типа В и С демонтаж АНФ и погружной остеосинтез переднего полукольца таза пластиной провели в сроки от 3 до 12 сут при достижении стабильного состояния и отсутствии признаков острых воспалительных реакций у 189 (59,1%) пострадавших.
Всем пострадавшим с сочетанной травмой таза с момента поступления в стационар проводили профилактику тромбозов вен нижних конечностей, включавшую применение компрессионного трикотажа и антикоагулянтную терапию.
Комплексное восстановительное лечение, включавшее лечебную гимнастику, механотерапию, электростимуляцию, начинали еще в условиях реанимационного отделения после стабилизации общего состояния, как правило, на 2-й день.
Летальность в основной группе составила 8,4% (27 пострадавших), в группе сравнения - 12,2% (26 пострадавших). Основными причинами смерти пострадавших обеих групп в первые часы после поступления явились шок и кровопотеря, на 1-4-е сутки - отек и дислокация головного мозга, в сроки более 4 сут - полиорганная недостаточность, гнойно-септические и бронхолегочные осложнения.
Количество общих инфекционных осложнений снизилось с 20,3% в группе сравнения до 11,6% в основной группе, местных осложнений - с 12,6 до 8,7%. Раннее комплексное восстановительное лечение способствовало ускорению перевода больных основной группы на расширенный режим активности и снижению продолжительности госпитального этапа лечения с 46,1 до 35,5 сут.
Количество отличных и хороших функциональных результатов лечения (по шкале S. Majeed, 1989) увеличилось с 64,8% в группе сравнения до 78,9% в основной группе.
Таким образом, инструментальная диагностика при сочетанной травме таза должна соответствовать предполагаемому по механизму и клиническим данным объему повреждений и не утяжелять состояние пациента. Оптимальным следует считать использование этапной лечебной тактики с последовательным выполнением временной иммобилизации переломов (бандаж, С-рама, АНФ), а затем окончательного остеосинтеза. Оптимальным сроком для первичной иммобилизации таза бандажем является момент клинического обнаружения наличия нестабильного повреждения тазового кольца. Фиксацию заднего полукольца С-рамой необходимо выполнить сразу после диагностирования вертикальной нестабильности таза по клиническим признакам и данным рентгенографии в прямой проекции. Фиксацию переднего полукольца стержневым аппаратом следует провести немедленно после ликвидации угрожающих жизни повреждений груди и живота.
Замена внешней фиксации заднего полукольца С-рамой на погружной остеосинтез должна быть проведена в течение первых 3 сут при стабильном или пограничном состоянии пострадавшего. Заменить АНФ на погружной остеосинтез переднего полукольца таза возможно при стабильном состоянии пострадавшего. При травме нижних мочевыводящих путей метод наружной фиксации у всех пострадавших с нестабильным повреждением тазового кольца является основным на всех этапах лечения. Значительное смещение ветвей лонных костей служит показанием к остеосинтезу костей переднего полукольца канюлированными винтами с дополнительной наружной фиксацией. При вертикально нестабильных повреждениях таза у таких пострадавших наружная фиксация переднего полукольца должна сопровождаться фиксацией задних отделов канюлированными винтами.
Разработанная система лечения повреждений таза у пострадавших с множественной и сочетанной травмой позволила снизить летальность с 12,2 до 8,4%, уменьшить количество общих осложнений с 20,3 до 11,6%, местных осложнений с 12,6 до 8,7%, сократить срок стационарного лечения с 46,1 до 35,5 сут, увеличить количество отличных и хороших функциональных результатов лечения с 64,8 до 78,9%.
При успехах современной медицины и хирургии, в частности, летальность при травматических абдоминальных повреждениях остается на высоком уровне [1, 4, 5]. На сегодняшний день разработаны и общеприняты ключевые моменты хирургической тактики при открытых и закрытых повреждениях органов живота. В литературе наименее освещены тактические вопросы при таком явлении, как забрюшинное кровоизлияние (ЗК), хотя оно часто сопровождает травму живота и таза, а тактические ошибки зачастую ведут к возникновению осложнений вплоть до летального [2, 3]. Если при открытых ранениях с формированием ЗК тактический подход в основном однозначен и заключается в обязательной ревизии ЗК, то при закрытой, сочетанной травме живота тактика разнится. Все это делает дальнейшее изучение тактики при травматических ЗК актуальным.
Нами проведен ретроспективный анализ лечения 395 (66,3% всех пострадавших с закрытой травмой живота) пострадавших с ЗК, возникшим в результате закрытой травмы живота, в том числе и сочетанной, находившихся на стационарном лечении в Больнице скорой медицинской помощи Уфы с 1992 по 2012 г. Возраст пострадавших колебался от 16 до 72 лет. Давность получения травмы от 15 мин до 2 сут. Более 80% пострадавших были мужского пола. В состоянии алкогольного опьянения поступили 170 (43%) пострадавших. В результате избиения травму получили 109 (27,6%) пострадавших, вследствие дорожно-транспортного происшествия — 184 (46,6%) и в результате падения с высоты — 102 (25,8%). В 283 (71,6%) наблюдениях травма имела сочетанный характер. В состоянии средней тяжести было доставлено 274 (69,4%) пострадавших, в тяжелом — 108 (27,3%), в ясном сознании — 361 (91,4%), в оглушенном — 30 (7,6%), в сопоре и коме — 4 (1%) пострадавших.
Пострадавшие были разделены на 2 группы, однородные по общей тяжести повреждений: средний балл (M±m) по шкале Injury Severity Score в основной группе составил 25,1±1,45, в контрольной — 27,3±0,93 (р>0,05). В основную группу вошли 156 пострадавших, находившихся на лечении с 2005 по 2012 г., тактика ведения которых определялась лечебно-диагностическим алгоритмом (см. рисунок), разработанным нами с учетом данных анализа тактических ошибок при лечении ранее поступавших пострадавших с ЗК и имеющейся в клинике современной лечебно-диагностической аппаратуры.
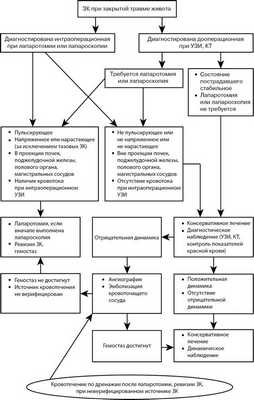
Лечебно-диагностический алгоритм ведения пострадавших с травматическими ЗК.
В случае диагностирования ЗК при лапароскопии или лапаротомии и наличии пульсирования, напряженности или признаков нарастания последней (кроме гематом, обусловленных переломами тазового кольца), а также расположения ЗК в проекции почек, поджелудочной железы, полого органа или магистральных сосудов ставили показания к ревизии ЗК через лапаротомный доступ при изначально выполненной лапароскопии. Определить показания к ревизии ЗК помогало выявление признаков кровотока при интраоперационном ультразвуковом исследовании (УЗИ), выполняемом с использованием прибора General Electric vivid e, датчиком GE i12L-R с частотой 3—11 МГц. При отсутствии во время операции указанных выше признаков ее завершали дренированием брюшной полости, далее проводили динамическое наблюдение за показателями гемодинамики, красной крови, выполняли УЗИ, а при необходимости компьютерную томографию (КТ) органов брюшной полости с целью контроля размеров ЗК, назначали консервативное лечение (обезболивание, гемостатики, стимуляция кишечника и т. д.). В до- и послеоперационном периоде ЗК диагностировали при УЗИ (ультразвуковой сканер LOGIQ-400 фирмы «General Electric» с использованием конвексного мультичастотного датчика со средней частотой 4 МГц) и КТ (двухспиральный томограф Hi Speed NX/I фирмы «General Electric»).
При стабильном состоянии и отсутствии признаков повреждения органов брюшной полости за пострадавшим также устанавливали наблюдение, назначали консервативное лечение. При отсутствии отрицательной динамики (снижение показателей красной крови, неустойчивая гемодинамика, увеличение размера ЗК по данным УЗИ и КТ) консервативное лечение продолжали. При выявлении признаков продолжающегося ЗК выполняли трансфеморальную ангиографию, в ходе которой при выявлении источника кровотечения предпринимали попытку эмболизации кровоточащего сосуда. Ангиографию выполняли на аппарате GE Innova 3100. При невозможности верифицировать источник кровотечения или достичь гемостаза производили лапаротомию, ревизию ЗК. В ряде наблюдений после лапаротомной ее ревизии в послеоперационном периоде по забрюшинным дренажам отмечалось продолжающееся кровотечение. В такой ситуации гемостаз достигали путем выполнения ангиографии, эмболизации кровоточащего сосуда.
Величину забрюшинной кровопотери определяли по формуле Moore в модификации нашей клиники, при этом для точности вместо уровня гемоглобина должного брали уровень гемоглобина крови, излившейся в брюшную полость при условии сопутствующего внутрибрюшного кровотечения и поступления пострадавшего в первые 2 ч от момента получения травмы:
где V зкп — объем забрюшинной кровопотери, m — масса тела (в граммах), Hb д — гемоглобин должный (уровень гемоглобина крови, излившейся в брюшную полость), Hb ф — гематокрит фактический (уровень гемоглобина периферической крови), V вбкп — объем крови, излившейся в брюшную полость. Все это в свою очередь позволило проводить более адекватно интенсивную терапию и судить об объеме ЗК.
Всем пострадавшим с ЗК проводили мониторирование интраабдоминального давления (ИАД), которое измеряли от 2 до 6 раз в сутки (в зависимости от тяжести состояния пострадавшего) в мочевом пузыре, а при трудностях его катетеризации в прямой кишке или в желудке. Первичное измерение выполняли манометром для измерения ИАД собственной конструкции (патент па полезную модель № 81629 по заявке № 2008144101 с приоритетом от 06.11.08), отличающимся портативностью, удобством в использовании и не зависящим от внешних источников электрического питания. Мониторирование ИАД в послеоперационном периоде проводили с помощью системы измерения ИАД (фирмы «Spiegelberg»), датчик которой в ряде наблюдений интраоперационно устанавливали в брюшную полость через дренажную трубку, а также путем пункции и катетеризации влагалища прямой мышцы с последующим измерением интрафасциального давления, соответствующего ИАД (патент на изобретение № 2471412 по заявке № 2011114428 с приоритетом от 13.04.11).
Лечение при наличии синдрома интраабдоминальной гипертензии, в ряде наблюдений сопровождавшего обширные ЗК, проводили согласно разработанному нами способу (патент на изобретение № 2405460 по заявке № 2009103385 с приоритетом от 02.02.09), включающему декомпрессивную лапаротомию, зондовую декомпрессию кишечника, перидуральную анестезию в послеоперационном периоде до купирования симптомов синдрома, внутривенное введение в послеоперационном периоде миорелаксанта в дозе, достаточной для устранения тонуса мышц передней брюшной стенки, на фоне искусственной вентиляции легких.
Остальных 239 пострадавших, поступивших до 2005 г., лечили без учета упомянутых выше показателей, без использования определенного алгоритма, описанных выше методов исследования и современных лечебно-диагностических мероприятий, таких как КТ и ангиография.
Статистическую обработку данных проводили с указанием числа наблюдений для каждого признака, расчетом средних величин (М), определением среднеквадратичного отклонения (s), средней ошибки (m). Вычисляли критерий Стьюдента (t) и определяли доверительный интервал для значений исследуемых показателей (M±m). При проведении межгруппового сравнительного анализа послеоперационных осложнений и летальности использовали методику углового преобразования Фишера. Проверку статистических гипотез осуществляли на уровне значимости α=0,05.
Результаты и обсуждение
Причиной формирования ЗК в 129 (32,7%) наблюдениях явился перелом костей тазового кольца, в 123 (31,1%) — повреждение почки, в 28 (7,1%) — повреждение корня брыжейки кишечника, в 16 (4%) — разрыв мочевого пузыря, в 16 (4%) — разрыв поджелудочной железы, в 12 (3%) — повреждение двенадцатиперстной кишки, в 12 (3%) — перелом поясничных позвонков с повреждением околопозвоночного венозного сплетения, в 8 (2%) — повреждение ободочной кишки, в 4 (1%) — повреждение нижней полой вены и аорты, в 12 (3%) наблюдениях имело место сочетание повреждения забрюшинно расположенных органов, в остальных 9,1% наблюдений источник ЗК не верифицирован. У 75 (19%) больных ЗК имело распространенный характер, у 79 (20%) — левостороннюю латеральную локализацию, у 63 (16%) — правостороннюю латеральную, у 134 (34%) — тазовую, у 12 (3%) — верхнемедиальную, у 12 (3%) — нижнемедиальную, у 20 (5%) — комбинированную. До операции ЗК диагностировано у 14 (5,9%) пострадавших контрольной и у 29 (18,6%) пострадавших основной группы, как правило, при УЗИ. В основной группе в 17 (10,9%) наблюдениях дооперационно ЗК выявили при КТ. У остальных ЗК диагностировали интраоперационно. У всех пострадавших шоковый индекс Альговера колебался от 0,3 до 3 и в среднем составлял 0,8±0,01, средняя расчетная кровопотеря у пострадавших основной группы составляла 729±94,5 мл.
Среди пострадавших группы контроля 232 (97,1%), а основной группы 140 (89,7%) были оперированы. Через лапаротомный доступ вмешательство выполнено 60 (42,9%) пострадавшим основной группы и 144 (62,1%) пострадавшим контрольной, лапароскопические операции — 53 (37,9%) и 53 (22,8%) пострадавшим соответственно, лапароскопия с конверсией на лапаротомию — 27 (19,2%) и 35 (15,1%) пострадавшим. Из неоперированных пострадавших в приемном отделении в течение 10 мин после поступления вследствие декомпенсированного необратимого травматико-геморрагического шока умерли 3 (1,3%) пострадавших контрольной и 1 (0,6%) пострадавший основной группы. Остальным неоперированным пострадавшим основной группы проводили консервативное лечение после постановки диагноза ЗК при УЗИ и КТ.
В основной группе 10 (6,4%) пострадавшим была выполнена ангиография, из них у 8 (5,1%) в ходе наблюдения отмечалась отрицательная динамика. Из этих 8 пострадавших гемостаз был достигнут путем эмболизации у 6. У остальных 2 пострадавших источник кровотечения во время ангиографии не был верифицирован, ввиду чего они были оперированы с целью ревизии органов брюшной полости. Следует отметить, что в 2 (1,3%) наблюдениях ангиография с эмболизацией кровоточащих сосудов выполнена после лапаротомии, ревизии органов забрюшинного пространства, так как при лапаротомии источник кровотечения не был верифицирован и в послеоперационном периоде открывалось кровотечение по дренажам.
У 47 (11,9%) пострадавших обеих групп выполнены сопутствующие операции, такие как трепанация черепа, торакотомия, фиксация переломов таза и конечностей, ампутация конечности. В 107 (68,6%) наблюдениях ЗК осложнилось интраабдоминальной гипертензией различной степени тяжести ввиду пареза кишечника, в 5 (3,2%) — синдромом интраабдоминальной гипертензии, что потребовало выполнения декомпрессивной лапаротомии.
Таким образом, можно сделать заключение, что забрюшинное кровотечение осложняет закрытую травму живота более чем в половине наблюдений и в 68,6% наблюдений сопровождается интраабдоминальной гипертензией вплоть до развития компартмент-синдрома. Предложенный алгоритм с использованием современных технологий позволяет выбрать правильную тактику лечения этой категории пострадавших и, как следствие, снизить показатели летальности и послеоперационных осложнений.
Читайте также:
- Сцедоспориоз и феогифомикоз - диагностика, лечение
- Лечение и прогноз обсессивно-компульсивных расстройств (ОКР)
- Иммунофенотипирование острых лейкозов - цели, задачи
- Рентгенограмма, КТ, МРТ при литических и бластических метастазах в шейные позвонки
- Модификаторы канцерогенеза. Активаторы развития раковой опухоли.
