Стенокардия при тиреотоксикозе. Токсическое действие тиреоидных гормонов на сердце
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Недостаточность сердца при тиреотоксикозе. Атеросклероз и инфаркт миокарда при тиреотоксикозе
Большинство авторов отмечают, что недостаточность сердца при тяжелом тиреотоксикозе развивается преимущественно у лиц пожилого возраста (после 40—50 лет) при отсутствии явно выраженных признаков кардиосклероза и без гипертонической болезни. Duckosel, Likoff, Levin, Goldsaudler и Wilson (1959) выделяют даже отдельную группу больных тиреотоксикозом с выраженными сердечными проявлениями (мерцательная аритмия, сердечная недостаточность). Из них в 9 секционных случаях не было обнаружено какой-либо самостоятельной сердечной патологии. Авторы указывают, что среди больных с сердечной недостаточностью преобладали женщины. Это отмечают и многие другие исследователи.
Поражения сердца являются наиболее частой причиной смерти больных тиреотоксикозом.
Развивающаяся при тиреотоксикозе сердечная недостаточность обычно носит характер I-II степени и отличается по клиническим проявлениям от обычной застойной недостаточности, возникшей при сердечных заболеваниях. Graettinger (1959), детально изучивший гемодинамические изменения у больных тиреотоксикозом с явлениями сердечной недостаточности, нашел, что артерио-венозная разница по кислороду у них меньше, чем у других сердечных больных, и продолжает оставаться уменьшенной даже после физической нагрузки. Несмотря на явления сердечной недостаточности, ударный объем сердца у больных тиреотоксикозом продолжал оставаться повышенным.
Таким образом, клинические наблюдения позволяют считать, что сам тиреотоксикоз без всякой предшествующей сердечной патологии может привести к развитию сердечной недостаточности.
С другой стороны, некоторые заболевания сердечно-сосудистой системы — атеросклероз коронарных артерий, инфаркт миокарда — наблюдаются сравнительно редко у больных с выраженным тиреотоксикозом. Экспериментально установлено задерживающее влияние гормонов щитовидной железы на развитие холестеринового атеросклероза у собак. В. В. Татарский и В. Д. Цинзерлинг отметили даже обратное развитие липоидных отложений в сосудах под влиянием тиреоидина.
Если комбинация тиреотоксикоза с коронарным атеросклерозом и наблюдается у некоторых больных, то чаше всего в этих случаях тиреотоксикоз развивается на фоне уже предшествовавшей сердечной патологии.
Lamberg (1961) нашел в литературе только 5 описаний развития инфаркта миокарда у больных тиреотоксикозом, однако при обследовании лиц старше 60 лет случаев, осложненных инфарктом миокарда, выявляется больше.
Большинство авторов (Danowski, 1962) и ряд других подчеркивают, что, несмотря на относительную редкость коронарного атеросклероза и инфаркта миокарда у больных тиреотоксикозом, стенокардия у них наблюдается довольно часто (до 20% случаев).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Стенокардия при тиреотоксикозе. Токсическое действие тиреоидных гормонов на сердце
Различия гипертиреоза и тиреотоксикоза. Сердечно-сосудистая система при тиреотоксикозе
Некоторые авторы предлагают отличать гипертиреоз от тиреотоксикоза, считая, что при гипертиреозе наблюдаются преимущественно симптомы, связанные с повышением тонуса симпатикуса без выраженных нарушений обменных процессов и проявлений интоксикации, тогда как при тиреотоксикозе на первый план выступают проявления токсикоза и со стороны сердца наблюдаются не только симптомы его перегрузки, но и явления дистрофии миокарда.
Нам представляется более правильным придерживаться классификации, предложенной В. Г. Барановым, и различать три степени выраженности тиреотоксикоза, так как повышенная продукция тиреоидных гормонов всегда нарушает постоянство внутренней среды организма и оказывает более или менее выраженный токсический эффект.
Нарушения функций сердечно-сосудистой системы при тиреотоксикозе любой степени обусловлены рядом факторов: с одной стороны, изменениями гемодинамики в связи с повышенными потребностями организма в снабжении кислородом; с другой стороны, повышенной секрецией катехоламинов в результате стимулирующего действия гормонов щитовидной железы на симпатический отдел нервной системы и повышенной чувствительностью миокарда к адреналину и норадреналипу. Несомненно, большую роль в повышенной возбудимости и реактивности сердечно-сосудистой системы играет и нарушенное состояние центральной нервной системы, свойственное гипертиреозу,— резкое преобладание процессов возбуждения и отставание тормозных процессов.
Повышенное количество гормонов щитовидной железы, несомненно, оказывает также и непосредственное влияние на все функции миокарда, а при длительном избыточном их выделении они могут оказывать и токсическое действие на миокард, вызывая развитие дистрофии миокарда с проявлениями недостаточности сердца.
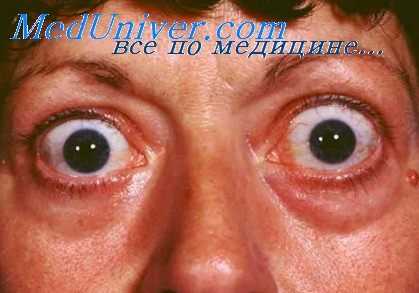
Повышенное образование гормонов щитовидной железы, оказывая стимулирующее действие на все виды обмена веществ, вызывает необходимость в усиленном снабжении организма кислородом, для осуществления которого требуются изменения ряда гемодинамических функций. Такими компенсаторными изменениями функций системы кровообращения, направленными на обеспечение организма кислородом, можно считать тахикардию, увеличение скорости кровотока, увеличение ударного и минутного объема сердца, усиление сердечных сокращений.
При этом периферические сосуды расширяются, что способствует усиленному потреблению кислорода тканями и в свою очередь вызывает понижение периферического сопротивления и увеличение массы циркулирующей крови.
Повышение венозного притока крови и увеличение массы циркулирующей крови являются лишней нагрузкой для сердца, работающего и без того с большим напряжением.
Одним из наиболее постоянных проявлений нарушения гемодинамики является увеличение минутного объема крови, отмеченное всеми авторами, изучавшими этот вопрос. За последнее время эти данные были подтверждены также и с помощью метода катетеризации сердца. Было установлено, что нарастание минутного объема идет параллельно повышению потребления кислорода. По данным Burnwill и Ерpinger (1957), ударный объем крови при тиреотоксикозе возрастает в большей степени, чем при других состояниях, требующих такого же увеличения потребления кислорода (например, мышечная работа). Несмотря на повышенное поглощение кислорода тканями, артерио-венозная разница при тиреотоксикозе уменьшается, и кровь возвращается к сердцу, будучи относительно богаче кислородом, чем в норме. Это отчасти объясняется, по мнению Burnwill и Eppinger, преимущественным увеличением периферического кровотока в кожных и мышечных сосудах, так как эти ткани поглощают относительно меньше кислорода, чем внутренние органы. Скорость кровотока у больных тиреотоксикозом резко нарастает параллельно увеличению основного обмена.
Рассмотрение клинических симптомов, связанных с нарушением деятельности сердца, необходимо проводить в зависимости от тяжести тиреотоксикоза.
Л. М. Гурова и А. А. Абрамова (1965) изучали частоту приступов стенокардии у 364 больных тиреотоксикозом и пришли к заключению, что ангинозные приступы наблюдались только у 33 больных (в 9% случаев), все больные были старше 30 лет. В большинстве случаев тиреотоксикоз развился у них на фоне уже имевшегося атеросклероза коронарных артерий.
По-видимому, развитие тиреотоксикоза у этих больных еще больше усиливало недостаточность коронарного кровообращения, так как при повышенной работе сердца их коронарный кровоток оказался неадекватным потребностям сердца Авторы приходят к заключению, что чем выраженнее и длительнее тиреотоксикоз, тем менее выражен у больных атеросклероз коронарных артерий.
Somerville и Levin (1950) описывают 24 больных тиреотоксикозом в сочетании с приступами стенокардии, у которых ангинозные боли ликвидировались на длительный срок (более 6 лет) после излечения тиреотоксикоза. Авторы считают, что стенокардия в этих случаях была обусловлена повышенной потребностью миокарда в кислороде при условии его напряженной работы.
При сопоставлении данных по коронарному кровотоку и поглощению кислорода Leight (1956) с соавторами пришел к заключению, что при этом наблюдается значительное увеличение поглощения кислорода и небольшое усиление коронарного кровотока.
Таким образом, на основании литературных данных и наблюдений, проведенных в нашей клинике, можно прийти к заключению, что во всех случаях тиреотоксикоза сердце в той или иной степени вовлекается в процесс. В начальных стадиях или в легких случаях повышение функции щитовидной железы проявляется только симптомами перегрузки сердца в связи с его постоянно повышенной и возбудимой деятельностью в условиях измененного метаболизма.
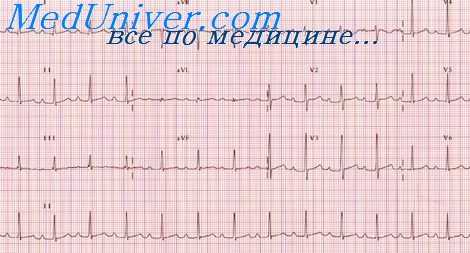
Изменения работы сердца проявляются стойкой тахикардией, начальными признаками гипертрофии желудочков и соответствующими ЭКГ и ВКГ-изменениями. В дальнейшем, при нарастании тяжести тиреотоксикоза или при истощении компенсаторных возможностей сердечно-сосудистой системы, развиваются дистрофия миокарда и явления сердечной недостаточности.
Недостаточность кровообращения является следствием ряда неблагоприятных обстоятельств, среди которых непрекращающаяся повышенная работа сердца в условиях нарушенного метаболизма играет ведущую роль. На функциональное состояние миокарда влияет также и непосредственное токсическое воздействие тиреоидных гормонов.
Следствием таких невыгодных условий метаболизма и токсического влияния гормонов является развитие не только дистрофии миокарда, но в дальнейшем и фиброза сердечной мышцы, которые клинически проявляются нарушениями основных функций миокарда: возбудимости и автоматизма в виде большой тахикардии и развития различных аритмий (мерцательной, пароксизмальной тахикардии, экстрасистолии), а также сократимости в виде проявлений сердечной недостаточности, отличающейся своеобразными характерными чертами.
Вполне понятно, что если тиреотоксикоз развивается на фоне уже существующей органической сердечной патологии (пороки сердца, ревмокардит, кардиосклероз), то явления сердечной недостаточности развиваются гораздо быстрее и будут более тяжелыми, так как суммируется действие двух патологических факторов.
- Вернуться в оглавление раздела "Кардиология"
Амиодарон-индуцированные тиреопатии
Амиодарон-индуцированные тиреопатии (АмИТ, АИТ) – это группа патологий щитовидной железы, вызванных продолжительным приемом противоаритмического препарата амиодарона. Течение часто бессимптомное, иногда развиваются слабые и умеренные признаки гипертиреоза (раздражительность, чувство жара, тахикардия, тремор) или гипотиреоза (зябкость, слабость, сонливость, быстрая утомляемость). Диагностика включает анализы крови на тироксин, трийодтиронин и тиреотропный гормон, сцинтиграфию и УЗИ с допплерографией щитовидной железы. При гипотиреозе назначается гормональная заместительная терапия, при тиреотоксикозе – тиреостатики или глюкокортикоиды.
МКБ-10
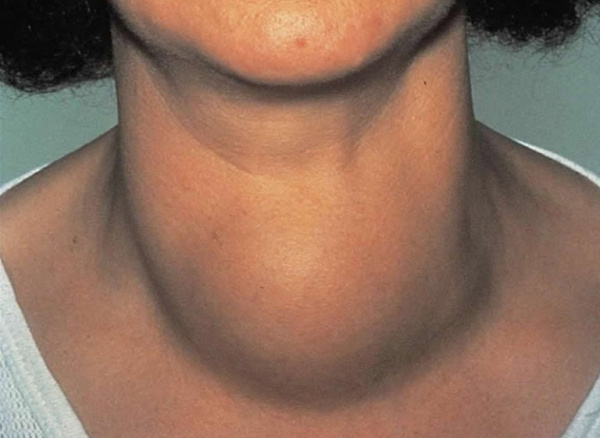
Общие сведения
Амиодарон относится к антиаритмическим лекарственным средствам, широко применяется в кардиологической практике при лечении тяжелых аритмий, предсердной и желудочковой экстрасистолии, WPW-синдрома, аритмии при коронарной и сердечной недостаточности. В числе побочных эффектов медикамента отмечаются гипер- и гипотиреоз или амиодарон-индуцированные тиреопатии. Синонимичные названия расстройств данной группы – амиодарон-индуцированные тиреоидиты, кордарон-индуцированные тиреопатии. Распространенность патологии среди пациентов, принимающих препарат, составляет около 30%. Гипертиреоз чаще регистрируется в регионах с йододефицитом, там его частота достигает 12%. Эпидемиология гипотиреоза выше в областях с умеренным потреблением йода, колеблется от 6 до 13%.
Причины АИТ
Амиодарон на 39% состоит из йода, является бензофурановым производным, по молекулярной структуре схожим с гормоном тироксином. Во время лечения этим препаратом организм ежедневно получает от 7 до 21 г йода при средней физиологической потребности 200 мкг/сут. Длительный прием амиодарона способствует нарушению обмена тиреоидных гормонов и тиреотропина, что проявляется гипо- или гипертиреозом. Характерная особенность данного лекарственного средства – способность накапливаться в печени и жировой ткани. Период его полувыведения из организма в среднем составляет 53-55 дней, поэтому амиодарон-индуцированные тиреопатии могут развиваться спустя 1-2 месяца после завершения курса терапии. В группе риска находятся женщины от 35-40 лет, люди пожилого и старческого возраста, а также лица с дисфункциями ЩЖ.
Патогенез
Под действием амиодарона изменяется метаболизм йодированных гормонов, регуляция их уровня гипофизом через ТТГ. Препарат нарушает превращение тироксина в трийодтиронин в тиреотропоцитах путем ингибирования фермента дейодиназы-II. Фермент дейодирует внутреннее кольцо тироксина, обеспечивает его конверсию в трийодтиронин, регулирует уровень метаболически инертной фракции Т3, поддерживает концентрацию этого гормона в нервной ткани. Амиодарон снижает чувствительность гипофиза к воздействию йодсодержащих гормонов. По этой причине у большинства пациентов в начале лечения обнаруживается легкое повышение тиреотропина при нормальном количестве тироксина и трийодтиронина – эутиреоидная гипертиреотропинемия.
С учетом патогенеза различают три вида амиодарон-индуцированных тиреопатий. При амиодарон-индуцированном тиреотоксикозе I типа гормональные изменения связаны с избыточным поступлением йода. Заболевание часто возникает на фоне предрасположенности к многоузловому зобу и функциональной автономности ЩЖ. Кордарон-индуцированные тиреопатии II типа более распространены, обусловлены токсическим влиянием препарата на тироциты. Развивается специфическая форма тиреоидита с деструктивным тиреотоксикозом. Третий вариант тиреопатии – гипотиреоз. Он диагностируется у лиц, в крови которых присутствуют антитела к тиреоидной пероксидазе, поэтому в качестве патогенетического механизма предполагается провокация аутоиммунного тиреоидита избытком йода.
Симптомы АИТ
Существует три варианта клинической картины тиреопатий, спровоцированных приемом амиодарона. При индуцированном гипотиреозе ярко выраженная симптоматика отсутствует. Большинство пациентов не замечает каких-либо изменений в самочувствии. Некоторые сообщают о появлении дневной сонливости и слабости, быстром нарастании утомления при выполнении привычной работы, периодическом возникновении зябкости. Объективно наблюдается снижение температуры тела, артериальная гипотония, замедление пульса, отечность, нарушения менструального цикла.
АмИТ 1 типа проявляется картиной развернутого гипертиреоза. Больные становятся раздражительными, беспокойными, тревожными, испытывают трудности с концентрацией внимания и запоминанием информации, выглядят забывчивыми, рассеянными. Развивается тремор, появляются приливы жара в теле, усиливается потоотделение и жажда. Пациенты тяжело переносят жару и духоту, теряют вес, плохо спят по ночам. АмИТ 2 типа часто имеет стертые симптомы, поскольку применение амиодарона устраняет признаки дисфункции сердечно-сосудистой системы, характерные для тиреотоксикоза. Зачастую клиническая картина представлена лишь мышечной слабостью и снижением массы тела.
Осложнения
Последствия терапии амиодароном обычно носят обратимый характер, после отмены медикамента функциональность ЩЖ возвращается к норме. Стойкие осложнения обусловлены воздействием избыточного количества гормонов Т3 и Т4 на сердце: ухудшается течение имеющихся аритмий, учащаются стенокардические приступы, появляется и усугубляется сердечная недостаточность. Тиреотоксикоз приводит к гиперчувствительности мышечных клеток сердца к воздействию адреналина, норадреналина, дофамина, что увеличивает риск желудочковых аритмий. Йодсодержащие гормоны оказывают непосредственное влияние на кардиомиоциты, изменяя их электрофизиологические свойства и провоцируя фибрилляцию предсердий. При длительном течении АмИТ первого типа возможно развитие дилатационной кардиомиопатии.
Диагностика
При подозрении на тиреопатию пациентов, принимающих амиодарон, направляют на консультацию к врачу-эндокринологу. На начальном этапе обследования специалист анализирует анамнез, уточняет продолжительность приема антиаритмического препарата, его дозировку, наличие патологий ЩЖ. Жалобы больных отсутствуют либо соответствуют картине гипо- или гипертиреоза. Для подтверждения диагноза и дифференциации различных типов тиреопатий применяются следующие методики:
- Тиреосцинтиграфия. Исследование радиоизотопами йода (сцинтиграфия щитовидной железы) назначается больным с тиреотоксикозом. Для АИТ-1 свойственен нормальный или усиленный захват препарата, при АИТ-2 обнаруживается сниженное накопление йода в железистой ткани.
- Эхография. По результатам УЗИ щитовидной железы и допплерографии при тиреопатиях типа 1 диагностируются признаки многоузлового зоба или аутоиммунного поражения железы с нормальным либо повышенным кровотоком. У больных с тиреопатиями типа 2 кровоток часто сниженный или не определяется.
- Анализ крови (гормоны и антитела). При гипотиреозе показатели Т4 заметно снижены, титр АТ-ТПО повышен. АмИТ 1 диагностируется по повышенному уровню Т3, Т4, ТТГ при развернутой клинической картине. Особенность АмИТ-2 – значительное повышение уровня Т4 (от 60 пмоль/л), умеренное повышение свободного Т3 в сочетании со слабовыраженной симптоматикой или на фоне бессимптомного течения.
Лечение АИТ
Тактика ведения пациента совместно определяется кардиологом и эндокринологом. Этиотропным направлением терапии является отмена амиодарона, однако во многих случаях это невозможно, поскольку прекращение приема препарата провоцирует желудочковую аритмию, сопряжено с риском развития жизнеугрожающих состояний. Задачей терапии становится нормализация уровня гормонов Т4 и Т3. Выбор методов зависит от формы заболевания:
- Гипотиреотические АмИТ. Манифестный гипотиреоз корректируется заместительной гормонотерапией. Больным назначаются препараты тироксина. Продолжительность лечения варьируется с учетом компенсаторных возможностей железы, выраженности аутоиммунного компонента, возможности отмены амиодарона.
- АмИТI. Проводится лечение тиреостатиками. Из-за избыточного поступления йода для подавления производства гормонов показаны большие дозы лекарственных средств.
- АмИТII. При деструктивных процессах в щитовидной железе используются глюкокортикостероиды, например, преднизолон. Продолжительность курса – до 3 месяцев.
- Смешанные АмИТ. При сочетании двух форм тиреотоксикоза наблюдается тяжелое течение болезни, требующее одновременного применения тиреостатиков и глюкокортикоидов. В процессе лечения устанавливают преобладающий тип тиреопатии, один из препаратов отменяют.
При неэффективности консервативного лечения тиреотоксикоза, спровоцированного амиодароном, необходимы радикальные меры, нацеленные на подавление гормональной функции ЩЖ. Выполняется тотальная тиреоидэктомия (хирургическое удаление железы). Пациентам с тяжелыми сердечными патологиями, являющимися противопоказанием к оперативному вмешательству, назначается радиойодтерапия, вызывающая гибель тиреоцитов.
Прогноз и профилактика
Исход амиодарон-индуцированных тиреоидитов в большинстве случаев благоприятный, особенно если существует возможность отмены противоаритмического лекарства. Гипотиреоз успешно компенсируется гормональной терапией, тиреотоксикоз – тиреостатиками, глюкокортикоидами. Для профилактики данного состояния больным, принимающим кордарон, один раз в полгода необходимо проводить исследование крови для определения уровня тиреотропного гормона, тироксина, трийодтиронина. Результаты лабораторных тестов позволяют эндокринологу оценить, насколько функциональна щитовидная железа, рассчитать риск развития тиреопатии.
2. Амиодарон-индуцированный тиреотоксикоз: диагностика и лечение/ Шевченко И.В., Караулова Ю.Л., Школьникова Е.Э.// Земский врач. – 2011.
3. Современные аспекты диагностики и лечения амиодарон – индуцированного тиреотоксикоза/ Платонова Н.М.// Кардиология. Спецвыпуск. 2016.
4. Состояния, вызванные приемом амиодарона, в практике кардиолога и эндокринолога/ Свириденко Н.Ю., Платонова Н.М., Молашенко Н.В., Голицин С.П., Бокалов С.А., Сердюк С.Е.// Лечащий врач. – 2004.
Тиреотоксическое сердце
Тиреотоксическое сердце – это синдром поражения сердечно-сосудистой системы у пациентов с тиреотоксикозом. Патология в основном возникает при Базедовой болезни, реже ее причинами становятся тиреоидиты, ТТГ-продуцирующие гипофизарные опухоли, новообразование щитовидной железы. Симптомы заболевания включают тахикардию и другие нарушения ритма сердца, признаки сердечной недостаточности. Для диагностики назначается ЭКГ и ЭхоКГ, исследование гормонального профиля, сцинтиграфия щитовидной железы. Лечение предполагает коррекцию эутиреоза, прием бета-блокаторов, антиаритмиков и других препаратов патогенетической терапии.
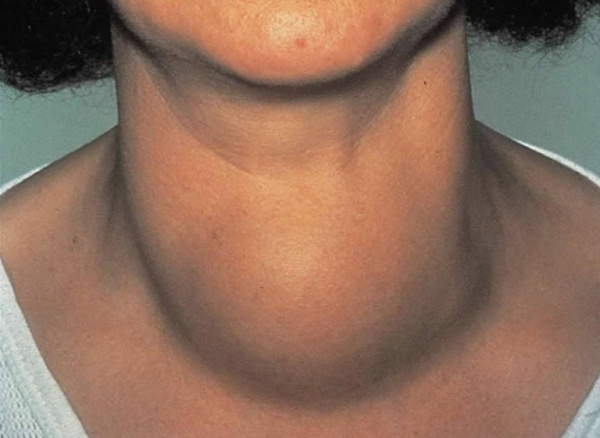
Негативное влияние избытка гормонов щитовидной железы (ЩЖ) на работу сердца было впервые установлено английским врачом К. Парри в 1785 г. В 1835 г. ирландский доктор Роберт Грейвс и немецкий специалист Карл фон Базедов описали тахикардию, сопряженную с увеличением щитовидной железы. Проявления тиреотоксического сердца разной степени интенсивности возникают у всех пациентов с токсическим зобом, тяжелые сердечно-сосудистые болезни наблюдаются у 12-68% больных. Риск кардиоваскулярных осложнений имеет прямую корреляцию со стажем тиреотоксикоза.
Причины
Тиреотоксическое сердце чаще всего развивается при диффузном токсическом зобе (ДТЗ, Базедовой болезни). В редких случаях заболевание возникает при других патологиях ЩЖ, сопровождающихся гипертиреозом:
- Базедова болезнь. Патология имеет аутоиммунную природу, характеризуется постоянной иммунной стимуляцией клеток щитовидной железы. В результате в крови увеличивается количество тиреоидных гормонов, которые становятся причиной повреждения миокарда.:
- Тиреоидит. При воспалении железистой ткани на фоне вирусного подострого тиреоидита или аутоиммунного тиреоидита Хашимото происходит разрушение части клеток органа. В этом случае гипертиреоз длится несколько недель или месяцев, поэтому поражения сердца носят функциональный характер.
- Опухоли. Явления тиреотоксикоза наблюдаются на фоне ТТГ-секретирующих новообразований гипофиза, токсической аденомы щитовидной железы. Крайне редко кардиальные патологии возникают у женщин со струмой яичника, вырабатывающей тиреоидные гормоны.
К независимым факторам риска относят позднюю диагностику эндокринных патологий, низкую приверженность пациентов к лечению, неправильную схему приема тиреостатиков. Симптомы кардиоваскулярных нарушений возможны у людей, которые бесконтрольно принимают синтетические тиреоидные гормоны. Заболевание чаще наблюдается у женщин со склонностью к аутоиммунным нарушениям, отягощенным семейным анамнезом.
При тиреотоксическом сердце наблюдается дистрофия миокарда, которая развивается под влиянием двух основных механизмов. Во-первых, при тиреотоксикозе отмечается персистирующая гиперфункция сердечной мышцы на фоне активации симпатического отдела вегетативной нервной системы. Во-вторых, тироксин и трийодтиронин обладают прямым токсическим воздействием на миокард.
Тиреоидные гормоны оказывают влияние на миокард на уровне ядер, регулируют поток ионов через клеточные мембраны, изменяют активность митохондрий. Молекулярные механизмы токсического воздействия реализуются через фосфолипид-зависимые протеинкиназы, комплекс кальдомодулин-Са, цМАФ-протеинкиназу. Повышение общего сосудистого сопротивления при тиреотоксикозе усиливает тяжесть возникших нарушений.
Патоморфологически определяется мозаичное нарушений структуры кардиомиоцитов, наличие разрушенных и интактных митохондрий в пределах одной клетки. Тиреотоксические влияние обуславливают развитие внутриклеточного отека, увеличение числа гликогеновых включений. При длительном существовании болезни возникают необратимые очаги миокардиофиброза.

Классификация
Согласно рекомендациям ВОЗ, кардиальная дисфункция при тиреотоксикозе определяется как подвид метаболической кардиомиопатии. При отсутствии соответствующего лечения тиреотоксикоза нарушения сердечной деятельности носят неуклонно прогрессирующий характер. В клинической кардиологии выделяют 3 стадии ремоделирования сердца у пациентов с тиреотоксикозом:
- Гиперкинетическая. Наблюдается на первом этапе тиреотоксического поражения, проявляется усилением силы и частоты сердечных сокращений. Для гиперкинетической фазы характерно увеличение фракции выбора до 65% при отсутствии органических изменений в миокарде.
- Нормокинетическая. На втором этапе происходит постепенное увеличение массы миокарда левого желудочка и расширение полостей сердца. Показатели сердечного выброса и другие функциональные параметры находятся в пределах нормы.
- Гипокинетическая. На третьем этапе тиреотоксического сердца сократительная функция резко снижается, развивается хроническая сердечная недостаточность. Нарушения сопровождаются выраженной дилатацией левого желудочка.
Симптомы тиреотоксического сердца
Самым частым проявлением болезни считается ощущение сердцебиения, которое обусловлено постоянной синусовой тахикардией. Человек испытывает чувство тяжести и тупые боли в области сердца, сильную слабость, быструю утомляемость при ходьбе и привычных бытовых действиях. Зачастую возникает одышка, возможно появление головокружений и предобморочных состояний.
При прогрессировании синдрома тиреотоксического сердца возникают сильные боли в левой половине грудной клетки, появляются отеки нижних конечностей, бывают приступы удушья и кашля. Некоторые пациенты испытывают распирание и увеличение живота, боли и тяжесть в правом подреберье. Шейные и периферические вены набухают и хорошо контурируются сквозь кожу.
Кардиальная симптоматика сопровождается типичными проявлениями тиреотоксикоза. Пациенты становятся раздражительными, эмоционально неустойчивыми, испытывают трудности с засыпанием. Расстройства пищеварения представлены частыми поносами и снижением аппетита. Возможно возникновение мелкоразмашистого тремора конечностей, мышечной слабости, нарушений двигательной активности.
Высокая ЧСС в покое, которая наблюдается у всех пациентов с тиреотоксическим сердцем, является предиктором риска фатальных состояний. При постоянной тахикардии в 3 раза возрастает вероятность острых транзиторных ишемических атак, инсультов, летальных желудочковых фибрилляций. У пациентов с сопутствующей артериальной гипертензией и ИБС наблюдается утяжеление течения заболеваний, снижение фармакологического контроля.
Серьезным осложнением заболевания является мерцательная аритмия, которая развивается у 28% больных. До 68% пациентов с длительным стажем тиреотоксического сердца сталкиваются с проявлениями сердечной недостаточности (СН). Вначале развивается СН по правожелудочковому типу, поскольку правые отделы сердца быстрее истощают свой функциональный резерв. При отсутствии медикаментозной коррекции формируется тотальная форма сердечной недостаточности.

При физикальном обследовании пациента у врача-кардиолога определяется усиление сердечных тонов, систолические шумы, акцент второго тона на легочной артерии. Перкуторно обнаруживается расширение границ сердца. Для определения характера и степени тяжести органо-функциональных нарушений применяется комплексная программа обследования, которая включает следующие методы:
- ЭКГ. По результатам электрокардиографии на начальном этапе болезни определяется синусовая тахикардия, повышение амплитуды зубцов. На более поздних стадиях возникают атриовентрикулярные или внутрижелудочковые блокады, удлинение интервала QT, инверсия зубца Т, что отражает процесс ремоделирования миокарда.
- ЭхоКГ. При ультразвуковом исследовании сердца выявляется последовательное повышение и снижение фракции выброса крови, при динамическом наблюдении обнаруживается постепенное расширение полостей желудочков. При проведении ЭхоКГ на гипокинетической стадии определяются признаки миодистрофического кардиосклероза.
- Сцинтиграфия ЩЗ. Радиоизотопное сканирование железы назначается для определения ее функциональной активности. По распределению радиоактивных изотопов удается выявить диффузные изменения или очаговые гормонально активные образования.
- Анализ миокардиальных маркеров. Для исключения острых повреждений миокарда проводится тропониновый тест, определяется содержание креатинфосфокиназы и лактатдегидрогеназы. Целесообразно выполнять анализ острофазовых показателей крови.
- Гормональные исследования. Для подтверждения тиреотоксического характера кардиальной патологии назначаются анализы на гормоны Т3, Т4 (их количество повышено) и гипофизарный ТТГ, уровень которого чаще снижен.
Дифференциальная диагностика
Признаки тиреотоксического сердца необходимо отличать от токсико-аллергических миокардитов, ревматических пороков клапанного аппарата, других вариантов метаболических кардиомиопатий. Дифференциальная диагностика проводится с самостоятельными формами артериальной гипертензии, ишемической болезни сердца, туберкулезной интоксикацией.
Лечение тиреотоксического сердца
Медикаментозная терапия направлена на достижение эутиреоидного состояния и максимально возможное купирование кардиологических симптомов. Основная группа используемых препаратов – антитиреоидные (тиреостатики), которые блокируют синтез гормонов ЩЖ. По мере снижения уровней Т3 и Т4 уменьшаются их негативные влияния на миокард. Комплексное лечение включает следующие группы медикаментов:
- Бета-адреноблокаторы. Большинству пациентов назначаются неселективные блокаторы, которые способствуют ликвидации тахикардии и других видов аритмий. При субклиническом тиреотоксикозе имеет смысл назначение селективных бета-адреноблокаторов, которые имеют длительный период полувыведения.
- Антиаритмические препараты. Наибольшей активностью при тиреотоксической кардиомиопатии обладают ингибиторы реполяризации, которые имеют слабое инотропное свойство. Для усиления эффекта терапию дополняют кардиометаболическими препаратами, витаминно-минеральными комплексами.
- Диуретики. Мочегонные препараты добавляются в схему лечения запущенной формы тиреотоксического сердца, которая сопровождается сердечной недостаточностью. Для поддержки работы органа также могут использоваться сердечные гликозиды в строго контролируемых дозах.
- Антикоагулянты. На фоне аритмий существует повышенный риск тромбообразования, который требует профилактического назначения антиагрегантов и антикоагулянтов. Поскольку при ДТЗ увеличивается плазменный клиренс факторов свертывания, связанных с витамином К, дозы препаратов должны быть меньше стандартных.
Исход заболевания напрямую зависит от успешности лечения причины тиреотоксикоза, комплаенса пациента, своевременности диагностики сердечной патологии. При достижении стойкого эутиреоза удается устранить аритмию и снизить риск кардиоваскулярных кризов. При развитии тотальной сердечной недостаточности прогноз неблагоприятный. Профилактика заключается в предупреждении, ранней диагностике и комплексном лечении патологий щитовидной железы.
2. Особенности сердечно-сосудистых нарушений при тиреотоксикозе/ С.Т. Зубкова// Диабетология. Тиреоидология. Метаболические расстройства. – №20/1. – 2015.
4. Сердечно-сосудистая система при тиреотоксикозе/ Аметов А.С., Коншева М.Ю., Лукъянова И.В.// Consilium medicus. – 2003. – Том 3. – № 11.
Читайте также:
- Катетеризация вен. Способы введения катетеров
- Спинномозговые грыжи. Закрытое расщепление позвонков
- Лимфоидные или плазмацитоидные дендритные клетки. Функции дендритных клеток
- Острая сердечно-сосудистая недостаточность при острых отравлениях. Шок при отравлении
- Методы ускорения выведения ртути из организма
