Субмакулярные операции при субфовеальных мембранах. Рекомендации
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
Комбинированная терапия хориоидальной неоваскулярной мембраны (ХНВМ). Рекомендации
Комбинированная терапия является привлекательной концепцией, однако подходит не всем пациентам. Комбинированная химиотерапия в онкологии используется, поскольку противоопухолевые препараты имеют узкий диапазон между терапевтической и токсической дозами, а также для обеспечения нескольких барьеров на пути эволюции раковых клеток.
Комбинированная терапия инфекционных заболеваний используется для лечения пациентов в тяжелом состоянии, когда возбудитель не идентифицирован, а несвоевременное лечение может привести к фатальным последствиям. Комбинированная терапия инфекционных заболеваний создает несколько барьеров для развития патологического процесса, однако, к сожалению, приводит к повышению резистентности микроорганизмов.
Фокальная и/или панретинальная лазерная коагуляция в сочетании с терапией антагонистами СЭФР очень эффективна при диабетической ретинопатии (ДРП) и в широком смысле слова может быть определена как комбинированная.
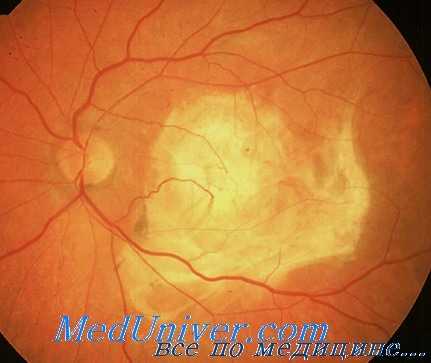
Терапия топическими НПВС (Nevanak) в комбинации с лазерной коагуляцией и антагонистами СЭФР эффективна для лечения диабетического макулярного отека (ДМО), поскольку воздействует на несколько патогенетических механизмов: СЭФР и воспаление. Многие врачи выступают за комбинированную терапию при хориоидальных неоваскулярных мембранах (ХНВМ), но, по мнению авторов книги, она применима в небольшом количестве случаев, так как монотерапия Луцентисом и Авастином обеспечивает хороший результат.
При проведении ФДТ необходимо интравитреально вводить стероиды, что примерно в 30% случаев приводит к развитию стероидной глаукомы и почти в 90% случаев - катаракты, в то же время терапия стероидами лишь в незначительном проценте случаев уменьшает необходимость применения антагонистов СЭФР.
Схема, предусматривающая вначале введение Луцентиса или Авастина с последующей поддерживающей терапией пегаптанибом натрия (Макуген), основана на предположении о том, что панингибирование СЭФР (Луцентис, Авастин) может приводить к повреждению нейронов, а супрессии так называемой патологической изоформы 165 СЭФР при этом может не происходить.
Однако при длительном проведении терапии, основанной на панин-гибировании СЭФР, не было выявлено каких-либо рисков у пациентов.
В настоящее время изучаются терапевтические возможности эпиретинальной радиотерапии 90Sr с помощью зонда NeoVista после выполнения витрэктомии. Для того чтобы этот метод был эффективным, также необходимо применение антагонистов СЭФР. Однако вследствие выполнения витрэктомии в 90% случаев у пациентов с ВМД прогрессирует катаракта, снижается эффективность антагонистов СЭФР из-за отсутствия СТ, которое обеспечивает их пролонгированное высвобождение, возникает риск развития отслойки сетчатки и лучевой ретинопатии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Субмакулярные операции при субфовеальных мембранах. Рекомендации
Хирургическое удаление субмакулярных кровоизлияний. Рекомендации
Субмакулярные кровоизлияния удаляют хирургическим путем с начала 1990-х годов. Результаты таких хирургических вмешательств широко варьируют и в основном зависят от первичной патологии и травмирования тканей во время процедуры. В ходе проведения ряда клинических исследований во время операции под сетчатку вводили тканевый активатор плазминогена (тАП), затем ожидали в течение примерно 45 мин, пока не происходило очевидное разжижение кровяного сгустка, после чего его аспирировали.
Менее инвазивным методом лечения считается смещение крови из макулярной зоны, однако в настоящее время нет данных рандомизированных клинических исследований, доказывающих эффективность данной техники. Авторы статьи не рекомендуют интравитреальное введение тАП.
У авторов есть положительный клинический опыт использования методики, разработанной Dr. Hilel Lewis, для смещения субмакулярного кровоизлияния из-под фовеа с целью уменьшения повреждения фоторецепторов в этой зоне. Незначительные субмакулярные кровоизлияния (небольшого объема, не вызывающие поднятие сетчатки фовеальной зоны) не требуют хирургического лечения, в таких случаях достаточно проводить монотерапию антагонистами СЭФР, которая приведет к их рассасыванию без ухудшения зрительных функций.
Массивные субмакулярные кровоизлияния (приводящие к поднятию сетчатки макулярной зоны из-за большого объема), наоборот, приводят к повреждению фоторецепторов зоны фовеа, и их необходимо удалять. Авторы статьи рекомендуют выполнять спектральную ОКТ всем пациентам, так как часто бывает трудно клинически идентифицировать отслойку ПЭС или кровоизлияния под ПЭС, которые могут имитировать клиническую картину подъема макулярной зоны вследствие обширного кровоизлияния.
Если по данным ОКТ определяется субфовеальная отслойка ПЭС или кровоизлияние под ПЭС с незначительным вышележащим субретинальным кровоизлиянием, авторы статьи не рекомендуют выполнять хирургическое удаление кровоизлияния, а проводить лечение антагонистами СЭФР, как было описано ранее. Только те пациенты, у которых по данным ОКТ определяется обширное субфовеальное кровоизлияние, должны быть подвержены хирургическому лечению.
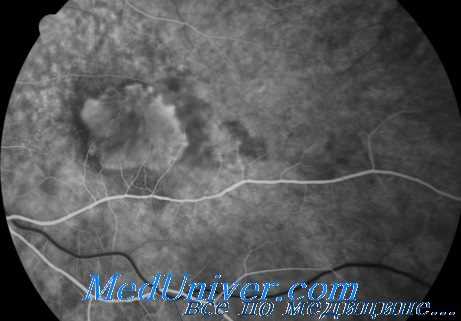
Другим важным клиническим показателем целесообразности выполнения хирургического вмешательства является промежуток времени между появлением первых симптомов и планируемой датой операции. Первоначально область субмакулярного кровоизлияния имеет темно-красный цвет, который через неделю по мере распада гемоглобина начинает изменяться на серый. К этому времени сгусток часто становится слишком плотным и его трудно перемещать, кроме того, часто уже наблюдается повреждение фоторецепторов.
Исходя из вышесказанного, важно приступить к хирургическому удалению субмакулярного кровоизлияния не позднее чем через 2 нед. после появления начальных симптомов, пока область кровоизлияния имеет темно-красный цвет.
Последовательность хирургических манипуляций является следующей. Выполняется 25G бесшовная центральная витрэктомия, если не произошла задняя отслойка стекловидного тела, то она осторожно создается. Затем в кровяной сгусток с помощью 38G полиамидной канюли (разработана специально для использования в таких случаях) или системы для введения вязких жидкостей (входит в конструкцию витреоретинальных систем Accurus и Constellation и позволяет хирургу управлять введением, нажимая на ножную педаль управления) вводится тАП.
При использовании системы для введения вязких жидкостей уровень вакуума должен быть не выше 12 мм рт.ст., чтобы предотвратить образование избыточного давления в субретинальном пространстве. Медленное, контролируемое введение до заполнения субретинального пространства тАП напоминает экссудативную отслойку сетчатки, которая возникает под макулярной зоной и распространяется вниз до нижней сосудистой аркады, что в свою очередь приводит к формированию траектории, по которой сгусток может быть легко перемещен.
Давность возникновения кровоизлияния очень важна, так как кровоизлияния, существующие в течение 2 нед., не поддаются хирургическому лечению таким методом. Аспирация субретинального кровоизлияния приводит к повреждению фоторецепторов наружного слоя сетчатки и апикальных отростков ПЭС, поэтому ее выполнения следует избегать. После успешного перемещения сгустка необходимо интравитреально ввести Авастин для лечения нижележащей хориоидальной неоваскулярной мембраны (ХНВМ).
Хирургическое лечение считается успешно выполненным, если в первый день после операции останется только незначительная часть крови под фовеа.
В 1991 г. Thomas и Kaplan сообщили о субмакулярном хирургическом вмешательстве по поводу субретинальной неоваскуляризованной мембраны, вторичной по отношению к синдрому предполагаемого гистоплазмоза глаз. Впоследствии этими авторами и многими другими хирургами этот метод применялся для лечения идиопатических субмакулярных мембран, мембран, вторичных по отношению к ВМД, и многих других патологических процессов.
Хотя в названии последних статей на сайте использовался термин «неоваскулярная мембрана», на самом деле выполняется удаление фиброваскулярного рубца. Общим для всех фиброваскулярных рубцов (мембран) является то, что они значительно больше, чем это определяется при ангиографии, предположительно, из-за сосудистого регресса в некоторых участках.
Сохранение жизнеспособности фоторецепторов и ПЭС является абсолютным требованием при рассмотрении вопроса о субмакулярном хирургическом вмешательстве. Мембрана действует как диффузный барьер между фоторецепторами и ПЭС, что приводит сначала к дегенерации наружных слоев сетчатки, а в конечном итоге к дегенерации ее внутренних слоев. Высвобождение в течение длительного периода времени железа из крови, присутствующей в субретинальном пространстве, приводит к токсическому действию на фоторецепторы внутренних слоев сетчатки.
В случае существования мембраны в течение более 6 мес. почти нет шансов улучшения зрительных функций пациента после ее удаления из-за необратимого повреждения фоторецепторов. Субретинальная мембрана типа I наблюдается при ВМД, она находится под ПЭС и не может быть удалена без удаления вышележащего ПЭС. Субретинальная мембрана типа II наблюдается при идиопатических поражениях и при гистоплазмозе, в этих случаях она находится на передней поверхности ПЭС, прогноз для пациентов с такой патологией является относительно хорошим.
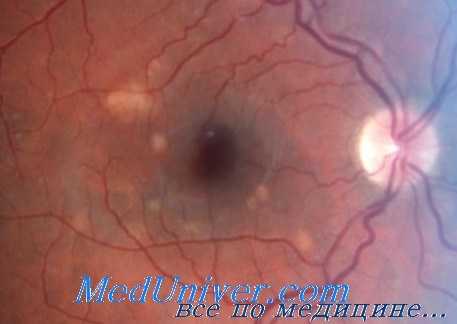
Антагонисты СЭФР являются препаратами первой линии терапии при всех хориоретинальных неоваскулярных мембранах (ХНВМ), однако субмакулярное хирургическое вмешательство эффективно только при наличии больших субфовеальных мембран без признаков подтекания.
При наличии субретинальных мембран у пациентов с ВМД прогноз зрительных функций после их удаления крайне неблагоприятный. Примерно у 20% пациентов происходит улучшение зрительных функций, у 60% зрительные функции остаются без изменения, а у 20% они ухудшаются. Плохие зрительные функции после выполнения субмакулярного вмешательства можно объяснить несколькими факторами:
а) продолжающимся диффузным поражением пигментнного эпителяи сетчатки (ПЭС);
б) высокой частотой рецидивов;
в) повреждением фоторецепторов и ПЭС вследствие процесса рубцевания и кровоизлияния;
г) хирургическим удалением ПЭС;
д) отсутствием хориокапилляров.
Чтобы во время удаления мембраны не произошло случайное удаление сегмента ПЭС, мембрана должна быть расположена между сетчаткой и ПЭС, а не под ним. Однако в большинстве случаев субретинальные мембраны при ВМД относятся к I типу и располагаются под ПЭС. Авторы статьи не выполняют субмакулярное хирургическое вмешательство у пациентов с ВМД с 1994 г. Постановка диагноза ВМД осуществляется не только на основании возраста пациента, но и наличия друз в пораженном и/или другом глазу.
Пациенту в возрасте 50 лет при наличии друз ставится диагноз ВМД, в то время как у 70-летнего пациента с односторонней субретинальной мембраной и отсутствием друз в обоих глазах, вероятнее всего, наблюдается идиопатическая субретинальная ХНВМ. Результаты исследования «Submacular Surgery Trial», опубликованные в ноябре 2004 г., свидетельствуют об отсутствии преимуществ выполнения субмакулярного хирургического вмешательства пациентам с ВМД, острота зрения которых 0,2 и выше.
При идиопатической патологии прогноз в послеоперационном периоде является наилучшим, хотя наиболее частым показанием к субмакулярному хирургическому вмешательству в центральной части США является гистоплазмоз. У немногих пациентов с миопией и свежим, четко ограниченным поражением среднего или крупного размера субмакулярное хирургическое вмешательство демонстрирует хорошие результаты. Пациенты со специфическими ангиоидными полосами сетчатки и травмами глаза, при которых возникает субретинальная мембрана, также являются кандидатами на оперативное лечение.
Техника операции при субфовеальных мембранах. Рекомендации
Витрэктомия выполняется для облегчения введения витреальных инструментов, а также для того, чтобы можно было осуществить замену жидкости воздухом. Агрессивные попытки вызвать задней отслойки стекловидного тела не являются необходимым, а, наоборот, потенциально опасным этапом лечения. Многие хирурги считают, что намеренное создание задней отслойки стекловидного тела (ЗОСТ) является необходимым этапом операции, а на самом деле данный шаг может привести к увеличению риска возникновения отслойки сетчатки и/или повреждения зрительного нерва.
Очень маленькое ретинотомическое отверстие выполняется 25G МВР-лезвием по внешнему краю мембраны, как правило, в верхневисочном квадранте. Нервные волокна следует отсепарировать друг от друга и выполнять ретинотомию в направлении, параллельном их ориентации, не пересекая их, аналогично выполнению разреза вдоль линий Лангера при пластических хирургических вмешательствах на лице.
Диатермия не используется, поскольку сосуды сетчатки при выполнении ретинотомии никогда не пересекаются и кровотечение не развивается. Диатермия может привести к возникновению дефектов слоя нервных волокон и стимулировать образование рубцов.
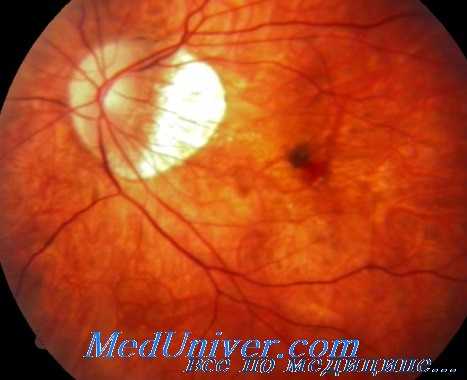
Для захвата передней поверхности наружного края мембраны используется 25G пинцет. По мнению авторов книги, при введении одной бранши пинцета под мембрану повышается вероятность повреждения ПЭС или хориокапилляров. Пики никогда не используются из-за риска отрыва пигментного эпителия сетчатки (ПЭС) и травмирования хориокапилляров с развитием кровотечения из них.
Методика захвата передней поверхности наружного края субретинальной мембраны окончатым пинцетом была разработана с целью уменьшения вероятности повреждения пигментного эпителия сетчатки (ПЭС), аналогично удалению ЭРМ. Перед удалением мембраны ВГД следует повысить до 60 мм рт.ст., используя для этого одну из консолей для подачи воздуха системы Constellation или увеличив высоту расположения флакона с инфузионным раствором, чтобы снизить риск развития кровотечения.
Затем мембрана медленно поворачивается для определения наличия участков ее прочной фиксации к сетчатке или пигментному эпителию сетчатки (ПЭС). Прочная фиксация является распространенной проблемой у пациентов, которым ранее выполнялась лазерная коагуляция, однако после внедрения в клиническую практику терапии антагонистами СЭФР она отмечается гораздо реже. Изменение направления тяги за мембрану, как правило, может решить эту проблему, хотя иногда для деламинации мембраны от сетчатки или ПЭС приходится использовать 25G изогнутые ножницы.
Мембрану следует удалять очень медленно, чтобы снизить риск возникновения разрыва сетчатки, кроме того, это позволяет наблюдать за состоянием сетчатки и ПЭС для предотвращения их повреждения. Если сетчатка отслаивается во время удаления субретинальной мембраны, для того чтобы мягко отодвинуть сетчатку от мембраны и придавить ее к ПЭС, можно использовать эндоосветитель. Аспирацию не следует выполнять через ретинотомическое отверстие из-за вероятности повреждения фоторецепторов и ПЭС при их смещении.
После удаления мембраны из субретинального пространства ее продолжают удерживать пинцетом и, осторожно надавливая ею, точно сопоставляют края ретинотомического отверстия и выдавливают СРЖ из субретинального пространства. После этого мембрану перемещают в передний отдел витреальной полости и приближают к витреотому. Мембрана удаляется с помощью витреотома с использованием коаксиального освещения операционного микроскопа.
Перемещение мембраны через периферическую часть СТ и плоскую часть цилиарного тела для удаления ее с помощью пинцета может вызывать витреоретинальные тракции с последующим формированием отслойки сетчатки. Гистологическое исследование мембран не является необходимым, так как их патоморфологические признаки хорошо изучены.
Замена жидкости воздухом используется для закрытия ретинотомического отверстия за счет эффекта поверхностного натяжения и устранения необходимости выполнения лазерной ретинопексии. Лазерная ретинопексия приводит к образованию скотомы из-за повреждения слоя нервных волокон, а также увеличивает риск образования новой неоваскуляризованной мембраны в местах лазеркоагулятов. Замена осуществляется с использованием витреотома для удаления жидкости и линзы Landers или другой аналогичной линзы с большим увеличением для визуализации в факичных или артифакичных глазах.
Насос системы Constellation или эквивалентный ему используется для подачи воздуха.
ВГД должно поддерживаться на уровне выше нормального во время закрытия операционной раны, чтобы предотвратить возникновение кровотечения. Ушивание конъюнктивы и субконъюнктивальное введение антибиотиков и стероидов выполняется, как это было описано в других статьях на нашем сайте.
Повторное оперативное лечение показано при наличии четко определяемой субретинальной мембраны у пациентов с улучшением зрительных функций после предыдущего успешного хирургического вмешательства.
Субретинальная неоваскулярная мембрана (СНМ) и ее лечение
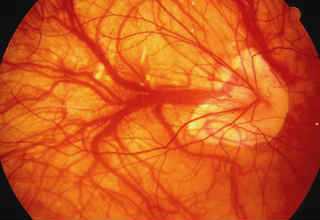
Основной причиной слабовидения и полной слепоты у лиц старшего и пожилого возраста, по данным эпидемиологических исследований, является возрастная макулярная дегенерация (ВМД). Заболевание имеет наследственную предрасположенность и, в первую очередь, поражает пигментный эпителий, а также хориокапилляры в центральной (макулярной) зоне сетчатой оболочки.
Подавляющее большинство (почти 90%) случаев утери зрения от ВМД обусловлено развитием экссудативной формы этого заболевания, по-другому называемой «влажной». Данная форма ВМД сопровождается чрезмерным ростом аномальных, новообразованных сосудов, прорастающих из хориокапиллярного слоя сосудистой оболочки сквозь дефекты в мембране Бруха под нейроэпителий и/или пигментный эпителий сетчатки. В офтальмологии подобное состояние получило название субретинальной (локализованной под сетчаткой) неоваскулярной мембраны (СНМ).
Новообразованные сосуды при СНМ имеют аномально слабую стенку, из-за чего под сетчатку начинает просачиваться жидкая часть крови, с отложением там липидов и холестерина. Зачастую эти сосуды рвутся, и возникают кровоизлияния, как правило, небольшие по объему и локальные, а в некоторых случаях и довольно значительные. Все это нарушает питание сетчатки и приводит к возникновению фиброза, когда прозрачная ткань сетчатки замещается соединительной. В исходе влажной формы ВМД формируется субретинальный рубец, из-за чего сетчатка перестает выполнять свои функции
К абсолютной слепоте центральная хориоретинальная дистрофия (ЦХРД) не приводит никогда. Но из-за появления в центральной части поля зрения темного пятна (абсолютной скотомы) у человека постепенно пропадает центральное зрение. Так как патологический процесс затрагивает лишь центральную часть (макулу), периферическое поле зрения остается сохранным. В исходе процесса остаточное зрение, как правило, составляет 0,1 (первая строчка таблицы) и пациент видит лишь «боковым зрением.
Патологический процесс всегда протекает индивидуально, но развитие СНМ «включает» временной фактор, который приобретает первостепенное значение. При этом, избежать полной потери зрения поможет только ранняя диагностика заболевания и своевременно начатое адекватное лечение, приводящее к длительной ремиссии или обратному развитию патологического процесса.
Методы лечения неоваскулярной мембраны
Среди методов лечения субретинальной неоваскулярной мембраны при влажной форме ВМД выделяют лазеркоагуляцию сетчатки (см. страницу «Операции на сетчатке глаза«) , транспупиллярную термотерапию (ТТТ), фотодинамическую терапию (ФДТ) и удаление СНМ хирургическим способом (см страницу «Хирургические операции на глазах«.
Однако за последние несколько лет терапия данного заболевания вышла на новый уровень, благодаря появлению эффективных лекарственных препаратов. Это препараты-ингибиторы выработки фактора эндотелиального роста сосудов (VEGF).
Ведь хотя причины возникновения СНМ до конца не изучены, из данных исследований последних лет ученые сделали вывод, что роль VEGF в ее развитии очень важна. Таким образом, фармакологические ингибиторы VEGF возможно являются новым и наиболее перспективным направлением в терапии данных патологий.

В современной клинической практике, сегодня уже широко применяют следующие препараты:
Мacugen® (Макуджен)
Это один из первых фармакологических ингибиторов VEGF, применяющийся в офтальмологии. Мacugen® или Макуджен (основное вещество пегаптаниб) позиционируется, как так называемый анти-VEGF аптамер. Лечение им помогает замедлить снижение остроты зрения пациентов с СНМ при влажной форме ВМД. Эффективность препарата сравнима с действием фотодинамической терапии. Он стал первым из препаратов данной группы, разрешенным FDA для интравитреального введения в полость стекловидного тела при лечении любых форм субретинальной неоваскулярной мембраны при возрастной макулодистрофии (2004 г.). Особенно хороший эффект от применения препарата Макуджен наблюдается на ранних стадиях ВМД.
Lucentis® (Луцентис)
Препарат Lucentis® или Луцентис (основное вещество ранибизумаб) действует как антиген-связующий фрагмент к VEGF антител мышей. Препарат является рекомбинантным, полученным одним из методов генной инженерии. Молекула ранибизумаба — высокоспецифичная часть антитела мыши к VEGF с низким молекулярным весом (48 кДа). Она может проникать сквозь все слои сетчатой оболочки к патологическому объекту блокируя рецепторы VEGF входящих в СНМ новообразованных сосудов. Lucentis — первый препаратом данной группы, терапия которым ведет к частичному восстановлению зрения, а не только к торможению его прогрессирующего снижения (стабилизация зрения в 95% случаев, повышение остроты зрения в 25-40% случаев). Положительные результаты клинических исследований позволили FDA утвердить Lucentis, как средство лечения субретинальной неоваскулярной мембраны при ВДМ (2006 г.).
Avastin™ (Авастин)
Бевацизумаб — действующее вещество препарата Avastin™ (Авастин), является полноразмерным антителом против любых изоформ (разновидностей) VEGF. Еще в 2004 году его стали активно использовать в онкологии при лечения рака прямой кишки и толстого кишечника.
Первый опыт применения Авастина у пациентов с влажной формой ВМД принадлежит американским исследователям Rosenfeld и Puliafito. Это произошло в 2005 году, когда положительные результаты от его применения были получены у пациентов с СНМ и прогрессирующим падением остроты зрения после поведения фотодинамической терапии и лечения Макудженом. Пациентам выполнялось 2-3 кратное введение Авастина внутривенно по 5 мг/кг с перерывом в две недели. При этом было достоверно зафиксировано проведением ОКТ повышение остроты зрения, а также уменьшение толщины сетчатки в зоне макулы.
Какое-то время целесообразность интравитреального введения препарата оставалась под сомнение. Ведь его молекулярная масса в несколько раз выше, чем у Макуджена и Луцентиса, и были сомнения насчет его способности проникать сквозь сетчатку. Но опубликованные в последующем результаты исследований убедительно доказали, что введенный в полость стекловидного тела бевацизумаб, легко проникать сквозь все слои сетчатой оболочки.
При внутривенном введении Авастина существует риск потенциально возможных побочных эффектов, уже описанных при применении его в онкологии. Среди них: повышение АД, носовые кровотечения, риск тромбоэмболии, протеинурия. Однако интравитреальные инъекции данного препарата буквально сводят на нет возможность возникновения указанных побочных эффектов, ведь применяемая доза в 400-500 раз меньше. В тоже время этот путь введения обеспечивает высокую концентрацию действующего вещества именно в месте поражения.
Введение Авастина в полость стекловидного тела осуществляют раз в 3-4 недели в дозировке 1,25 мг. По результатам многочисленных исследований такие инъекции повышают остроту зрения в 30-43% случаев и стабилизируют ее в 53-56% случаев. Положительный эффект от инъекций Авастина сводится к уменьшению толщины сетчатки в зоне макулы, что подтверждается данными ОКТ, а также к стабилизации объема СНМ и к уменьшению пропотевания флюоресцеина сквозь сосудистую стенку по данным ФАГ. Максимальная эффективность препарата бнаруживается с первых инъекций. При этом, степень выраженности ее не зависит проводимых ранее фотодинамической терапии и/или лечения Макудженом. По имеющимся данным, повторное ухудшение зрения, а также скопление в субретинальном пространстве жидкости после однократной инъекции Авастина возникает в 30% случаев примерно через 70-80 дней, что делает особенно актуальной своевременность следующей инъекции.
Наиболее частыми неприятными последствиями интравитреального введения Авастина бывают: транзиторная (преходящая) инъекция конъюнктивальных сосудов и кровоизлияние в зоне введения препарата. Возникновения системных побочных эффектов подобного способа введения до настоящего времени не отмечалось.
В странах Европы, как и в США показания к применению Авастина в офтальмологической практике до сих пор отсутствуют в официальном перечне и препарат применяется по т.н. системе «off-label». И все же, Авастин с каждым годом становится все более популярным в группе препаратов-ингибиторов VEGF. Не последнюю роль в этом играет и экономический фактор, ведь инъекции Авестина имеют самую низкую стоимость в сравнении со средствами аналогичного действия – Макудженом и Луцентисом, а также процедурами фотодинамической терапии.
За последние два года появилось немало публикаций с результатами исследований терапии препаратом Avastin у пациентов с субретинальной неоваскулярной мембраной при влажной форме ВМД. Однако, отдаленных результатов подобного лечения пока нет и ожидается не ранее, чем через 3-5 лет. Но все же, имеющийся уже сегодня высокий процент положительных результатов интравитреального введении группы ингибиторов VEGF говорит о том, что достаточно эффективный метод лечения экссудативной формы возрастной макулярной дегенерации наконец появился. Применение Авастина или какого-либо из иных препаратов–ингибиторов VEGF является сегодня методом выбора при лечении пациентов с ВМД, как альтернатива дорогостоящей процедуре фотодинамической терапии.
Читайте также:
