Свищи поджелудочной железы. Хирургическое лечение наружных свищей поджелудочной железы.
Добавил пользователь Cypher Обновлено: 30.01.2026
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Институт хирургии им. А.В. Вишневского, Москва
Причины возникновения и профилактика панкреатических свищей после резекционных операций на поджелудочной железе
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2014;(5): 79‑83
Ахтанин Е.А., Кригер А.Г. Причины возникновения и профилактика панкреатических свищей после резекционных операций на поджелудочной железе. Хирургия. Журнал им. Н.И. Пирогова. 2014;(5):79‑83.
Akhtanin EA, Kriger AG. Causes and prevention of pancreatic fistulas after pancreas resection. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2014;(5):79‑83. (In Russ.).
Заболеваемость раком поджелудочной железы (ПЖ) и хроническим панкреатитом увеличивается с каждым годом, что приводит к увеличению количества операций, выполняемых по поводу этих заболеваний [4]. Характерной особенностью хирургической панкреатологии является большое количество послеоперационных осложнений, причем на протяжении длительного времени этот показатель не имеет тенденции к снижению.
V. Hunt [24], проанализировав мировой опыт хирургических вмешательств на ПЖ с момента первой панкреатодуоденальной резекции (ПДР), выполненной A. Cadevilla в 1898 г., до 1940 г. выявил 124 операции на ПЖ. Летальность в то время составила 60%, 5-летняя выживаемость - лишь 3%. В последующие 30 лет летальность после ПДР снизилась до 5-11%, а показатель осложнений достиг 36% [16]. За последние годы в специализированных хирургических центрах летальность составляет не более 3-5%, однако показатель послеоперационных осложнений по-прежнему остается на уровне 30-60% [9] (уровень доказательности А).
Основным специфическим осложнением после резекционных операций на ПЖ является панкреатический свищ - ПС; уровень доказательности А [53]. Частота наружных ПС после ПДР колеблется от 0 до 30% [48]. При возникновении ПС возрастает риск развития септических осложнений и аррозионного кровотечения, значительно увеличивается длительность пребывания больного в стационаре и стоимость его лечения, неизбежно возрастает летальность [32, 59].
Причиной образования послеоперационного наружного ПС является несостоятельность швов панкреатодигестивного анастомоза или культи ПЖ после дистальной резекции. В результате панкреатический секрет поступает в брюшную полость и при наличии дренажной трубки выделяется наружу [40] (уровень доказательности А). Основной причиной возникновения несостоятельности швов является послеоперационный панкреатит, приводящий к некрозу паренхимы ПЖ в области анастомоза [3] (уровень доказательности С).
Под термином «панкреатический свищ» подразумевается поступление из брюшной полости отделяемого с повышенным содержанием амилазы [8]. M. Buchler и соавт. [11] считали подтверждением ПС наличие панкреатогенного отделяемого по дренажу в объеме 50 мл в сутки с большим содержанием амилазы крови через 1 и более дней после операции. По мнению других хирургов [46], о ПС можно говорить при наличии отделяемого в объеме более 10 мл в сутки с уровнем амилазы, в 3 раза превышающим норму на 5-е и более поздние сутки послеоперационного периода. A. Lowy и соавт. [36] предложили использовать термин «клинически значимый ПС», подразумевая под ПС наличие гипертермии более 38 °С, лейкоцитоза более 10·10 9 /л и признаков тяжелого сепсиса. Этот термин был введен с целью разделения бессимптомных, так называемых, «биохимических» ПС и ПС, протекающих с клиническими проявлениями.
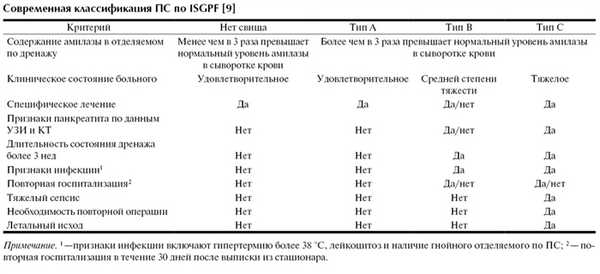
Согласно рекомендациям международной группы по изучению панкреатических свищей (ISGPF, 2005 г.), доказательством ПС считается наличие панкреатогенного отделяемого по дренажу с уровнем амилазы, в 3 раза превышающим ее нормальное содержание в сыворотке крови на 3-и и более поздние сутки послеоперационного периода [9] (уровень доказательности А). Согласно этому определению, ПС делятся на 3 типа (см. таблицу).
В настоящее время проводится множество исследований, направленных на идентификацию факторов риска возникновения ПС. Результаты этих исследований часто противоречат друг другу, что требует их критической оценки [13, 31, 35].
Предполагаемые факторы риска разделяют на 3 группы:
1) гистоморфологические особенности ПЖ (консистенция, липоматоз паренхимы, диаметр протока ПЖ);
2) индивидуальные особенности больного (возраст, пол, сопутствующие заболевания);
3) операционные факторы (длительность операции, кровопотеря, интраоперационное переливание крови, травматичность операции).
Консистенция ПЖ - один из наиболее изученных факторов риска развития ПС. При описании консистенции паренхимы ПЖ принято употреблять термин «мягкая» железа. Под ним подразумевается нормальное состояние ткани железы без ее фиброзного перерождения [17]. За счет сохраненной функциональной активности ПЖ в ответ на операционную травму неизбежно развивается острый панкреатит, а при краевом панкреонекрозе (в области панкреатодигестивного анастомоза или культи ПЖ при дистальной резекции) возникает несостоятельность швов анастомоза или культи ПЖ, ведущая к ПС [3, 50].
J. Denbo и соавт. [17] в мультицентровом исследовании, включавшем 2706 больных, которым была выполнена ПДР, отметили, что ПС чаще возникает при наличии «мягкой» культи ПЖ (уровень доказательности А).
Ожирение (высокий индекс массы тела - ИМТ) сопровождается липоматозом ПЖ, что усугубляет эффект «мягкой» железы. Жировая инфильтрация культи ПЖ делает ее склонной к разрывам во время формирования шва и завязывания узлов [21]. A. Mathur и соавт. [38] выяснили, что 40 больных с ПС после ПДР имели значительно большее количество интралобулярных, межлобулярных и диффузных отложений жира в ПЖ, чем больные без послеоперационного свища (уровень доказательности В).
E. Rosso и соавт. [51] установили, что риск развития послеоперационного ПС существенно возрастает при двух факторах: ИМТ более 25, а также степень жировой инфильтрации ПЖ больше 10%, даже при нормальном ИМТ. Выявлена зависимость между увеличением риска возникновения ПС и толщиной висцерального жира, превышающей 2 см [23] (уровень доказательности А). КТ или МРТ органов брюшной полости позволяет обнаружить патологическое отложение жира в ПЖ в виде жировой инфильтрации паренхимы либо отдельные участки отложения жира, схожие с липомой [47]. Предоперационное измерение содержания жира в ПЖ предлагается в качестве неинвазивного метода прогнозирования послеоперационных осложнений, в том числе ПС [33].
В отличие от «мягкой», «плотная» ПЖ характеризуется фиброзным перерождением паренхимы и низкой функциональной активностью, что существенно снижает вероятность возникновения послеоперационного панкреатита и облегчает формирование панкреатодигестивного анастомоза. В результате вероятность возникновения ПС снижается [10, 20, 26, 28, 41, 44, 54] (уровень доказательности А).
Диаметр просвета протока ПЖ считается существенным прогностическим фактором развития ПС после операций, сопровождающихся наложением панкреатодигестивных анастомозов. Многомерный анализ результатов лечения 300 больных показал, что ПС чаще формируются при «узком» (диаметр не более 3 мм) протоке ПЖ [41] (уровень доказательности В). Аналогичные результаты были отмечены и другими авторами [27, 48, 49]. В ходе одноцентрового, нерандомизированного исследования результатов 696 ПДР O. Belyaev и соавт. [10] установили, что в группе больных, у которых развился ПС, диаметр протока ПЖ в среднем был меньше, чем в группе больных без ПС (уровень доказательности С).
Для оценки вероятности возникновения ПС с помощью методов лучевой диагностики предложено определять индекс диаметра протока ПЖ - отношение диаметра протока ПЖ к поперечному размеру тела ПЖ. При индексе меньше 0,2 вероятность образования ПС достигает 45% [6] (уровень доказательности А).
Существует предположение, что развитие осложнений после резекционных операций на ПЖ может зависеть от пола больного. Н. Pitt [47] указывает, что у женщин послеоперационный свищ формируется реже. Есть сведения о том, что мужчины более подвержены появлению ПС [35, 61]. Изучение результатов 1239 ПДР показало, что мужской пол является значимым фактором, предрасполагающим к развитию ПС [28] (уровень доказательности А).
По мнению многих авторов, возраст не оказывает значимого влияния на частоту возникновения ПС [22]. Корреляция возраста с частотой возникновения ПС у больных старше 80 лет не была установлена [56]. Сопутствующие заболевания также не оказывают явного воздействия на частоту возникновения ПС [12].
Отмечена прямая связь между объемом операции и возникновением ПС - увеличение травматичности, длительности вмешательства, расширенная лимфаденэктомия увеличивают вероятность возникновения ПС [12, 62]. Для сокращения длительности операции при лапароскопических и робот-ассистированных дистальных резекциях ПЖ хирурги пересекают ПЖ с помощью степлеров. Этот метод пересечения железы обеспечивает надежный гемостаз, но не позволяет избежать появления ПС [18]. Трехрядные сшивающие аппараты более надежны в отношении как обеспечения гемостаза по линии шва, так и предотвращения образования ПС [58]. Основной причиной возникновения свищей при использовании степлеров является грубое раздавливание тканей ПЖ браншами сшивающего аппарата, что приводит к краевому некрозу паренхимы [29].
Формирование панкреатодигестивного анастомоза - ответственный этап операции, влияющий на вероятность возникновения ПС. Существует три варианта анастомозирования культи ПЖ: панкреатикоеюноанастомоз (ПЕА), панкреатикогастроанастомоз (ПГА), инвагинационные методики.
Каждый из указанных способов анастомозирования имеет сторонников и противников. Первые считают ПГА более надежным за счет хорошего кровоснабжения стенки желудка, близкого расположения задней стенки желудка и культи ПЖ, что уменьшает натяжение швов анастомоза [19, 55]. К преимуществу ПГА по сравнению с ПЕА относят факт отсутствия активации панкреатического сока в кислой среде желудка, что предотвращает аутолиз ткани в зоне анастомоза [37]. Мультицентровое исследование A. McKay и соавт. [39] показало меньшее количество ПС и других осложнений после формирования ПГА по сравнению с ПЕА (уровень доказательности А).
В то же время сторонники ПЕА приводят аргументированные данные, свидетельствующие об отсутствии значимых различий в частоте несостоятельности ПГА и ПЕА [7, 42, 62].
Инвагинационный метод используют при «мягкой» консистенции ПЖ либо при узком протоке ПЖ [5].
F. Chou и соавт. [15] провели сравнение стандартного и инвагинационного методов формирования ПЕА. Результаты их работы показали, что частота развития осложнений, в том числе ПС, а также послеоперационная летальность выше при использовании инвагинационной техники (уровень доказательности А).
Таким образом, единое мнение о преимуществе какого-либо вида анастомозирования отсутствует. Очевидно, что вопрос о способе формирования анастомоза должен решаться в индивидуальном порядке в зависимости от состояния ПЖ и предпочтения хирурга.
Способы профилактики возникновения ПС в хирургической панкреатологии всегда были и остаются актуальной проблемой. Идея ингибирования экзокринной секреции для предотвращения осложнений после операций на ПЖ впервые была озвучена в 1979 г. I. Klempa и соавт. [30]. В настоящее время применяют не соматостатин, а его аналоги, оказывающие пролонгированное действие. Наиболее востребованным стал синтетический пептид октреотид, являющийся производным соматостатина [2]. В сравнительном плане было изучено влияние на образование послеоперационных ПС другого мощного аналога соматостатина пролонгированного действия - вапреотид. Различий в частоте послеоперационных осложнений между 135 больными, получавшими вапреотид, и контрольной группой из 140 больных обнаружено не было [52]. Был сделан вывод о неэффективности данного препарата (уровень доказательности В).
Таким образом, до сих пор однозначного мнения об эффективности использования аналогов соматостатина при резекционных вмешательствах на ПЖ нет.
Биологические клеи были использованы даже для облитерации протока ПЖ как при ПДР, так и при дистальных резекциях ПЖ [57], однако желаемого эффекта не получено. В ряде исследований сообщается об увеличении количества осложнений [60] (уровень доказательности А).
Противоречивы результаты использования для профилактики ПС большого сальника. Ряд авторов сообщили о сокращении числа ПС при окутывании ПЕА или культи ПЖ лоскутом большого сальника [14]. В то же время анализ результатов 2597 ПДР, проведенный М. Tani и соавт. [58], показал, что обертывание анастомоза сальником увеличивает частоту образования у пациентов ПС (уровень доказательности А).
Стентирование протока ПЖ при формировании панкреатодигестивного анастомоза является довольно распространенным способом профилактики несостоятельности швов и возникновения ПС. Одно из первых исследований показало, что стентирование протока в области анастомоза снижает вероятность образования панкреатического свища, что послужило предпосылкой для изучения этого метода [63]. Его используют для наружного стентирования с выведением стента через стенку кишки, а также в качестве «потерянного» стента. Полученные результаты свидетельствует об отсутствии однозначного мнения. R. Poon и соавт. [48], G. Ramacciato и соавт. [50] сообщили об уменьшении количества ПС при стентировании протока ПЖ. Эффективность стентирования не подтверждена в исследовании, проведенном Т. Imaizumi и соавт. [25] (уровень доказательности В). К аналогичному выводу пришли J. Winter и соавт. [61] (уровень доказательности А).
Таким образом, панкреатические свищи остаются истинным «бичом» хирургии поджелудочной железы. Основными предрасполагающими факторами развития этого осложнения является «мягкая» консистенция паренхимы железы, узкий проток поджелудочной железы, травматичность операции, возрастающая при лимфаденэктомии. Фактором служит прорезывание швов, обусловленное, как правило, краевым панкреонекрозом. Способ формирования панкреатодигестивного анастомоза не имеет определяющего значения в профилактике возникновения панкреатического свища. Медикаментозное подавление секреции поджелудочной железы, использование медицинских клеев, стентирование области анастомоза не позволяют добиться убедительных положительных результатов.
Для улучшения результатов резекционных операций на поджелудочной железе требуется дальнейший поиск методов прогнозирования возникновения панкреатического свища и методов надежной профилактики этого осложнения.
Свищи поджелудочной железы. Хирургическое лечение наружных свищей поджелудочной железы.
Свищи поджелудочной железы развиваются при нарушении целостности панкреатического протока. Преобладающее большинство панкреатических свищей являются наружными, или поджелудочно-кожными. Внутренние свищи с желудком, двенадцатиперстной или поперечной ободочной кишкой встречаются редко.
Наружные свищи поджелудочной железы обычно вызваны тремя причинами:
1. Проникающей или закрытой травмой поджелудочной железы.
2. Хирургическими вмешательствами на поджелудочной железе и прилегающих к ней органах.
3. Острым панкреатитом и его осложнениями. Травма поджелудочной железы обычно сопровождается повреждениями других органов брюшной полости, которые требуют неотложного хирургического вмешательства и определяют тип выполняемой хирургической операции.
Травматические повреждения поджелудочной железы разнообразны: гематома, разрыв, полный поперечный разрыв железы или разрушение части органа. Панкреатические свищи могут развиваться в результате хирургического вмешательства, острого панкреатита или псевдокисты, возникшей в результате травмы. Свищи травматического происхождения, через которые выделяется чистый панкреатический сок без активных ферментов, часто закрываются на фоне медикаментозной терапии.

Хирургическое вмешательство на поджелудочной железе может осложняться развитием панкреатического свища. Свищи, развившиеся после дистальной резекции поджелудочной железы, обычно закрываются спонтанно. Свищи, развившиеся вследствие панкреатодуоденальной резекции (операция Whipple) или панкреатоеюностомии (модификация Puestow— Gillesby), обычно вызывают более выраженные и продолжительные изменения, потомучто панкреатическая секреция активируется кишечным содержимым и желчью. Многие из этих свищей закрываются под действием медикаментозного лечения, но некоторые могут потребовать повторной операции. Свищи поджелудочной железы могут быть вызваны биопсией железы или энуклеацией инсуломы. Обычно они закрываются спонтанно. Некоторые свищи могут быть вызваны не хирургическими вмешательствами на поджелудочной железе, а операциями на соседних органах, как это наблюдается при резекции желудка по поводу пенетрирующих язв луковицы или постбульбарного отдела двенадцатиперстной кишки. Свищи могут также появляться в результате грубых хирургических манипуляций, приводящих к нарушению целостности фатерова сосочка. Важным источником происхождения панкреатических свищей является острая патология поджелудочной железы и ее осложнения, абсцессы, псевдокисты и т.д.
Свищи поджелудочной железы образуются, когда панкреатический секрет вьщеляется на кожу более даух дней. Некоторые авторы признают существование свища поджелудочной железы, если количество панкреатического секрета превышает 100 мл в день.
Диагностика свищей поджелудочной железы относительно легка благодаря характеристикам вытекающей жидкости и содержанию амилазы, которая в несколько раз выше, чем в крови. Панкреатическая жидкость имеет рН 8—8.6.
Jordan классифицирует свищи поджелудочной железы по отношению к количеству теряемого секрета следующим образом:
1. Малые свищи, когда потери панкреатической жидкости составляют менее 100 мл в день.
2. Средние свищи, когда ежедневная потеря составляет 100-700 мл.
3. Большие свищи, когда секреция превышает 700 мл в день.
Ежедневная потеря жидкости через некоторые свищи может достигать 1800 мл. Если жидкость является чистым панкреатическим соком, она обычно содержит от 20000 до 50000 ЕД амилазы по Somogyi. Если панкреатический секрет смешан с кишечным отделяемым, желчью или лимфой, он может содержать только 1000—5000 ЕД Somogyi. У обычных людей может выделяться от 600 до 1500 мл панкреатического секрета в день. Панкреатическая секреция продолжается даже при отсутствпп пищи в желудке, под действием блуждающего нерва и секретина, который вьщеляется при попадании желудочного сока в двенадцатиперстную кишку. Во время приема пищи количество секретина и объем панкреатической секреции также увеличиваются. Панкреатический сок не должен накапливаться в брюшной полости, даже если он чистый, поскольку это может привести к сепсису, перевариванию тканей, кровотечению и т. д. Когда это происходит, особенно в первые дни формирования свища, необходимо прочитать аспирапионную трубку, которая может быть закупорена сгусткамп или тромбами.
Если свищ полный, он будет дренировать весь панкреатический секрет наружу. Причиной образования полного свища является обструкция головной части панкреатического протока стриктурой или конкрементом. Полный свищ имеет очень мало шансов к закрытию под действием медикаментозного лечения. Неполные свищи имеют большую вероятность закрытия. Это утверждение, однако, не абсолютное, наблюдались свищи с большой потерей секрета, которая через несколько дней уменьшалась. С другой стороны, свищи со средней потерей секрета могут иметь небольшую тенденцию к закрытию под действием медикаментозного лечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
На протяжении последних трех десятилетий отмечается увеличение заболеваемости острым панкреатитом, растет и число травм поджелудочной железы, что закономерно сопровождается увеличением риска развития панкреатических свищей [5, 10, 16]. По данным различных авторов частота формирования наружного панкреатического свища (НПС) после перенесенного деструктивного панкреатита составляет 30-55%, после травмы поджелудочной железы - 12-40%. [1, 2, 8, 14]. Внутреннее свищевое отверстие формируется в результате разгерметизации протоковой системы поджелудочной железы. На формирование свищевого хода непосредственное влияние оказывает также характер хирургического вмешательства на поджелудочной железе (оментобурсостома, абдоминизация, внутренние и наружные дренирования кист поджелудочной железы) [4].
Длительно существующие панкреатические свищи способствуют прогрессированию фиброза паренхимы поджелудочной железы, формированию стойкой гипертензии в протоковой системе органа. Наличие функционирующего свища приводит к тяжелым нарушениям гомеостаза, истощению больных, сопровождается снижением качества жизни [3, 4, 9]. В 75-80% случаев внутреннее отверстие свища локализуется в теле и хвосте поджелудочной железы [1, 3, 6, 7, 8] .
Взгляды на тактику лечения наружных панкреатических свищей и кист неоднозначны. Показания к хирургическому и консервативному лечению остаются предметом дискуссий. Консервативное лечение пациентов с панкреатическими свищами предполагает длительную госпитализацию и продолжительный период долечивания в амбулаторных условиях. Хирургическая тактика в зависимости от клинической ситуации может быть реализована как с помощью малоинвазивных, так и с применением традиционных открытых хирургических вмешательств [1, 7, 11]. Предлагались различные варианты лечения панкреатических свищей: от резекции части железы, несущей свищ, до всевозможных способов пломбировки свища [11]. Несмотря на существующие разногласия по вопросам хирургического лечения, большинство исследователей единодушны в отношении необходимости секретолитической терапии при панкреатических свищах [3, 10, 12, 13].
Цель исследования - оценка эффективности применения препаратов соматостатина короткого и продленного действия для лечения наружных панкреатических свищей.
Материал и методы
В исследование вошли 24 пациента с наружными панкреатическими свищами, находившихся на лечении в КГБУЗ «Краевая клиническая больница» Красноярска, в период с 2011 по 2013 г. Мужчин было 16 (66,7%), женщин - 8 (33,3%), средний возраст больных составил 48,3±6,4 года. Этиологическими факторами фистулообразования в большинстве случаев явились последствия перенесенного панкреонекроза (85,7%), открытые травмы живота с повреждением поджелудочной железы (14,3%).
В работе использована классификация свищей ПЖ, предложенная А.П. Радзиховским (1985), где определяющим признаком является связь свища с системой панкреатических протоков [2]. Острыми считали свищи, развившиеся в раннем послеоперационном периоде, хроническими - имеющие сформированный свищевой ход (существующие более 3 мес). Истинными наружными панкреатическими свищами обозначали свищи, связанные с главным панкреатическим протоком, а также его крупными ветвями. В зависимости от локализации, последние подразделяли на боковые и терминальные. Наружные гнойно-панкреатические свищи исходили из инфицированной панкреатической или парапанкреатической полости или кисты, связанной с протоками 1-го и 2-го порядка.
Диагноз наружного панкреатического свища устанавливался на основании осмотра, клинических, биохимических, инструментальных методов исследования (УЗИ, ЭРХПГ, фистулоскопия, КТ). Обязательно исследовали активность амилазы и липазы в крови и отделяемом свища. При гнойно-панкреатических свищах отделяемое свищевого хода направляли на бактериологическое исследование.
Статистический анализ данных производился с помощью пакета прикладных программ Microsoft Office Excel-2010. Данные обработаны методом вариационной статистики с определением средней величины (М) и средней ошибки (m) для каждой группы с оценкой критерия достоверности (р) по Стьюденту при парных сравнениях (ДИ=95%). Проверку соответствия анализируемых параметров нормальному распределению проводили с помощью критерия Шапиро-Уилса. В случае отклонения от нормального распределения для сравнения данных использовали непараметрические критерии Вилкоксона. Достоверными считали различия при р
Результаты и обсуждение
Характер отделяемого зависел от типа свища. При истинных наружных панкреатических свищах отделяемое в большинстве случаев было прозрачным, дебет в 85% превышал 500 мл в сутки. При гнойно-панкреатических свищах отделяемое было мутным, содержало мелкие секвестры, мутный осадок, а суточный дебет составлял в среднем около 350 мл.
В зависимости от задач исследования больные были разделены на две группы. Группы были сопоставимы по полу, возрасту, характеру свища поджелудочной железы (см. таблицу). В исследование включались пациенты с острыми наружными свищами ПЖ.
Лечение острых панкреатических свищей было направлено на угнетение экзокринной панкреатической секреции, формирование свищевого хода, санацию свищевого хода, устранение повреждения кожи вокруг свищевого хода; коррекцию имеющихся нарушений белкового, углеводного, жирового, водно-электролитного, липидного обмена. По показаниям проводилась антибиотикотерапия.
Формирование наружного свищевого хода выполнялось путем своевременной установки дренажей, соответствующих диаметру свищевого хода, с обязательным этапным рентгенологическим и УЗИ- контролем. Гнойно-некротические свищи подвергались постоянной или фракционной санации с активной аспирацией отделяемого.
У больных 1-й группы (14 пациентов) для секретолитической терапии применялся препарат октреотид - синтетический аналог соматостатина короткого действия в стандартной дозировке 0,1 мг подкожно 3 раза в сутки. Пациентам 2-й группы (10 человек) лечение наружного панкреатического свища осуществлялась с помощью аналога соматостатина продленного действия (октреотид-депо) в дозе 20 мг внутримышечно 1 раз за весь период пребывания больного в хирургическом отделении.
Терапию препаратами синтетического аналога соматостатина короткого и продленного действия у больных 1-й и 2-й групп начинали с момента диагностики наружного панкреатического свища по описанной выше схеме.
Длительность курса секретолитической терапии у пациентов 1-й группы варьировала от 18 до 34 сут и составила, в среднем, 24±1,2 суток. Обычно перед инъекцией октреотида-депо пациентам необходимо вводить аналоги саматостатина короткого действия в стандартной дозировке на протяжении 3-5 сут. Однако у всех пациентов, вошедших в исследование, этиологическим фактором формирования наружных панкреатических свищей был острый панкреатит, базовая схема лечения которого включает секретолитическую терапию октреотидом. Поэтому необходимости подготовительного курса инъекций аналога соматостатина короткого действия у пациентов 2-й группы не было. Препарат октреотид-депо вводили внутримышечно однократно после подтверждения наличия наружного панкреатического свища. Повторные инъекции препарата аналога соматостатина продленного действия через 26 сут потребовались в одном случае у пациентки с истинным панкреатическим свищом, располагавшимся терминально. В последующем ей было выполнено оперативное вмешательство, с наложением панкреатикоеюноанастомоза.
Анализ эффективности терапии осуществляли с учетом объема и активности амилазы свищевого отделяемого, сроков заживления свища, наличия рецидива.

У пациентов первой группы с истинными панкреатическими свищами на фоне секретолитической терапии октреотидом короткого действия статистически значимое снижение дебета по свищу зафиксировано на 7-е сутки наблюдения (рис. 1). Рисунок 1. Динамика дебета истинного панкреатического свища у больных 1-й и 2-й групп (ДИ 95%).
Динамика изменений объема отделяемого из истинного панкреатического свища у больных второй группы на фоне применения аналога соматостатина продленного действия несколько отличалась от показателей, полученных у больных первой группы. Существенное снижение дебета по свищу происходило в среднем на 5-е сутки наблюдения (рис. 1).
Рецидивов образования свища у пациентов с истинными панкреатическими свищами в обеих группах зафиксировано не было.
У пациентов с гнойно-панкреатическими свищами количество отделяемого исходно было меньше, по сравнению с истинными свищами. В первые 12-14 сут после формирования свищевого хода в отделяемом преобладал воспалительный компонент (лейкоциты, мелкие секвестры, фибрин), активность амилазы была относительно невысокой. Вероятно, с этим связаны иные закономерности в динамике изменения дебета свищей у этих больных, в сравнении с пациентами с истинными панкреатическими свищами.
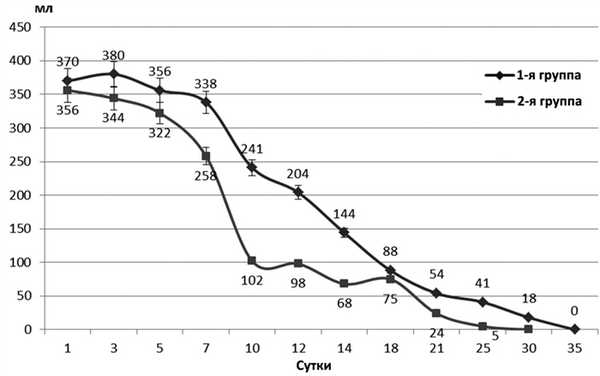
У пациентов 1-й группы, несмотря на секретолитическую терапию, на протяжении 7 суток объем отделяемого из свища оставался на относительно стабильном уровне. Начиная с 10-х суток наблюдения отмечено снижение суточного дебета, в эти же сроки менялся и характер отделяемого, которое становилось более прозрачным, а содержание амилазы в нем увеличивалось и достигало 8330±135 Ед/л (p<0,05). В дальнейшем, на протяжении 7-9 суток суточный дебет по свищу существенно не менялся, оставаясь на уровне 86,4±8,5 мл (p>0,05)(рис.2). Рисунок 2. Динамика дебета гнойно-панкреатических свищей у больных 1-й и 2-й групп (ДИ 95%).
Статистически значимое снижение объема свищевого отделяемого у 83,3% больных 1-й группы происходило на 21±2,3 сутки наблюдения. У одного больного интенсивное выделение секрета из свищевого хода наблюдалось на протяжении всего периода наблюдения. На контрольной фистулографии у этого больного сохранялась промежуточная полость до 2,5 см в диаметре, четкой взаимосвязи с протоковой системой ПЖ визуализировано не было. После закрытия свищевого хода больной был выписан. Через 7 мес у больного сформировалась псевдокиста ПЖ, что потребовало повторной госпитализации.
Выводы
На фоне применения соматостатина короткого действия в стандартной дозировке у больных с истинными панкреатическими свищами заживление свищевого хода происходит, в среднем, на 28±2,6 сут, у больных с гнойно-некротическими свищами - на 21±2,3 сут лечения. Неэффективность применяемой терапии отмечена у 25% больных с истинными свищами. Формирование псевдокисты произошло у одного больного с гнойно-панкреатической формой свища.
На фоне применения аналога соматостатина продленного действия заживление истинных панкреатических наружных свищей происходит в среднем на 19±1,8 сут, при гнойно-некротических свищах выделение секрета прекращается, в среднем, на 16,2±1,2 сут наблюдения. Эпизодов неэффективности консервативной терапии не выявлено. Формирование псевдокисты произошло также, как и в 1-й группе - у одного больного с гнойно-некротическим свищом.
Таким образом, применение аналога соматостатина продленного действия позволяет в более ранние сроки снизить дебет свищевого отделяемого, способствует уменьшению сроков заживления свища, в сравнении с соматостатином короткого действия в стандартной дозировке и достигнуть консервативного закрытия свища.
Хирургическое лечение наружных свищей поджелудочной железы. Операции при свищах поджелудочной железы.
Показаниями к оперативному лечению свищей поджелудочной железы являются следующие ситуации:
1. Свищ не имеет тенденции к закрытию.
2. Свищ вызывает серьезные метаболические изменения в организме пациента.
3. Пищеварительное действие панкреатического сока является причиной деструкции тканей, окружающих свищ.
4. Повреждения кожи становятся непереносимыми.
Хирургическое лечение свищей поджелудочной железы — сложная проблема, включающая множество аспектов, важнейшим из которых является наличие разнообразных клинических и морфологических особенностей, поэтому в лечении таких больных необходимо применять индивидуальный подход.
Хирургическое лечение наружных свищей поджелудочной железы состоит в изменении направления свищевого хода в пищеварительный гракт (в тощую кишку пли в желудок). Для этого было предложено несколько видов операций, заключающихся в анас-томозировании свища поджелудочной железы с тощей кишкой пли желудком. Необходимо выполнять анастомоз непосредственно с поверхностью поджелудочной железы, а не со свищевым ходом, как это было предложено многими авторами.

Свищевой ход не подходит для сшивания, потомучто он из-за своей хрупкости не имеет необходимой консистенции для удержания швов. По этой же причине его очень трудно выделить, не произведя одной или нескольких перфораций. Недостаточное кровоснабжение не гарантирует продолжительную и эффективную его проходимость. С другой стороны, мы полагаем, что свищевой ход должен выполнять роль проводника для быстрого установления локализации панкреатического отверстия свища. Очень часто поверхность поджелудочной железы вокруг отверстия свища уплотняется из-за вызванного свищом фиброзного процесса. Это позволяет более надежно наложить шов, формируя анастомоз с тощей кишкой или желудком.
Некоторые хирурги, сталкиваясь с дистальным свищом поджелудочной железы, возникшим в результате панкреатодуоденальной резекции, резецируют оставшийся сегмент поджелудочной железы, выполняя тотальную панкреатэктомию. Однако хорошо известно, как тяжело лечить диабет у пациентов после тотальной панкреатэктомии.
Прежде чем продолжить описание техники операций при свищах поджелудочной железы, полезно напомнить, что многие панкреатические свищи являются следствием ошибок хирургической техники или выбора неадекватного метода лечения заболеваний поджелудочной железы. Необходимо помнить, что большинство панкреатических свищей закрываются под действием грамотно проведенного медикаментозного лечения, и к хирургическим методам следует переходить только в случае его неэффективности.
При всех вмешательствах на поджелудочной железе необходимо использовать нерассасывающийся шовный материал, потому что медленно или быстро рассасывающиеся нити будут немедленно разрушены ферментами. После завершения операции на поджелудочной железе, прежде чем закрыть брюшную полость, необходимо оставить одну или две дренажные трубки на случаи, если в послеоперационном периоде несколько швов не выдержат. Таким образом, панкреатический секрет не будет растекаться по брюшной полости, а будет отводиться наружу через трубку для постоянной аспирации, образуя свищ, который позже уплотняется под действием фиброза.
Рентгенограмма свищевого хода у пациента 48 лет, который был оперирован по поводу псевдокисты поджелудочной железы: последняя включала головку и тело, но стенка кисты не достигла зрелости, необходимой для наложения анастомоза. Можно видеть расширенный проток поджелудочной железы и расположенный в протоке конец дренажной трубки. Рентгеноконтрастное вещество свободно поступает в двенадцатиперстную кишку. Среднесуточная потеря чистого сока поджелудочной железы составляет 600 мл. После 4-месячного наблюдения, которое не выявило тенденции к уменьшению количества отделяемого секрета, было рекомендовано хирургическое вмешательство.
Контроль свища поджелудочной железы. Лечение свищей поджелудочной железы.
Установив наличие свища, необходимо контролировать ежедневную потерю жидкости через него, а также характеристики дренируемой жидкости. Важно контролировать концентрацию амилазы и время эволюции плотного канала свища с целью определения времени проведения безопасной фистулографии. Периодически необходимо определять кулыуральные свойства секрета для установления степени обсеменения и типа микробов, чтобы подавить их адекватными антибиотиками. Важно получить фистулограм-мы в прямой и боковой проекциях для определения длины и траектории свища, а также для выяснения ее прямого плп непрямого соединения с протоком поджелудочной железы.
Они помогают установить, есть ли обструкция в некоторых секторах панкреатического протока или он полностью свободен.
Фистулография также позволит определить, проходит ли рентгеноконтрастное вещество в двенадцатиперстную кишку, имеет ли свищ единичные или множественные свищевые ходы. Фистулография позволит определить наличие в животе полости, связанной со свищом. Фистулографию следует выполнять не ранее, чем через 20—30 дней после возникновения свища, чтобы дать ему время сформироваться. Не всегда возможно увидеть панкреатический проток с помощью фистулографии. В таком случае нужно прибегнуть к ретроградной эндоскопической холангиопанкреатографии. Некоторые авторы рекомендуют выполнять оба эти исследования во всех случаях.
Другие предпочитают не выполнять ретроградную эндоскопическую холангиопанкреатографию из-за опасности инфицирования.
Более 70% пациентов с наружными свищами поджелудочной железы могут быть излечены с помощью медикаментозной терапии. Необходимо пытаться провести медикаментозную терапию во всех случаях до принятия решения об оперативном лечении, даже если закрытие свища может быть отложено на месяцы, а в некоторых случаях — на срок более года. Хирургическое лечение показано лишь тогда, когда очевидно, что правильно проведенное медикаментозное лечение неэффективно.

Обычно применяется следующее медикаментозное лечение:
1. Назогастральная интубация для уменьшения до минимума попадания желудочного сока в двенадцатиперстную кишку.
2. Назначение Н2-блокаторов для уменьшения секрепии кислоты в желудке.
3. Поддержание электролитного баланса.
4. Усиленное парентеральное питание для поддержания состояния питания пациента до формирования фиброзных стенок свищевого хода. Лишь после этого можно назначить пероральное питание, которое сначала будет состоять из простейшей диеты, дающей незначительные стимулы для секреции. Позднее переходят к более разнообразной диете. Нет необходимости слишком долго держать пациента на парентеральном питании, так как показано, что это не способствует закрытию свища.
5. Постоянная аспирация с помощью катетера, помещенного в свищевой ход.
6. Для уменьшения потерь секрета аспирированную жидкость можно возвращать назад через назогас-тральный зонд. После удаления назогастрального зонда Howard рекомендует смешивать панкреатический сок с виноградным для улучшения вкуса.
7. Некоторые авторы для уменьшения панкреатической секреции использовали фармакологические препараты. Одним из таких препаратов является соматостатин в дозе 250 мкг в час внутривенно. Другие авторы не установили никаких преимуществ при использовании соматостатина, так как он не сокращал период времени, необходимого для закрытия свища. Соматостатин уменьшает панкреатическую секрецию, но лишь временно. У некоторых пациентов такое непостоянство может привести к очевидному увеличению количества отделяемого секрета. Другие авторы сообщили о серьезных осложнениях. Williams и его коллеги утверждают, что октреотпда ацетат, являющийся аналогом соматостатина, эффективен при лечении панкреатических свищей, потому что он уменьшает секрецию панкреатического сока и может предотвращать формирование свищей поджелудочной железы.
В отличие от соматостатина, имеющего короткий период распада и поэтому требующего постоянного внутривенного введения, октреотида ацетат имеет более длительный период распада, поэтому его можно вводить подкожно три раза в день. Другие фармакологические препараты, такие как глюкагон, тербуга-лин и ацетазоламид, можно также использовать для этих целей, но с меньшим успехом.
8. Кожу пациентов со свищами поджелудочной железы необходимо постоянно защищать пастой или мазью, вплоть до излечения свища. Очень полезно к кожному отверстию свища прикреплять калоприемник. Необходимо избегать мацерации кожи всеми способами.
Когда свищ не сформирован, главной задачей врача является борьба за жизнь пациента, которая обычно в опасности. Когда это время прошло, основной задачей становится правильное ведение свища.
Читайте также:
