Связывание SRP с рецептором при закреплении белков на мембране ЭПР
Добавил пользователь Евгений Кузнецов Обновлено: 17.01.2026
- В гиалоплазме происходит связывание иРНК, кодирующей секреторный белок, с рибосомой и начинается синтез белковой цепи.
- Сначала синтезируется «сигнальная последовательность», богатая гидрофобными аминокислотами. Эта «сигнальная последовательность» в цитозоле узнается и происходит ее связь с «узнающей сигнал частицей», частица связывается после узнавания сигнального конца синтезирующейся молекулы белка с рибосомой, что приводит к полной остановке синтеза белка.
- На поверхности же мембраны ЭПР, обращенной к гиалоплазме, расположены интегральные рецепторные белки, соединяющиеся с SRP-частицами. В результате SRP-частица связывается со своим рецептором, одновременно она осуществляет связь данной рибосомы с мембраной ЭПР. Такая рибосома с SRP-частицей, блокирующей дальнейший рост полипептидной цепи, взаимодействует с большим белковым канальным комплексом - транслаконом. После связывания рибосомы с транслаконом происходит отделение SRP-частицы и синтезированный первичный пептид входит в канал, который образует транслакон. После этого возобновляется синтез полипептида, он удлиняется и его сигнальная последовательность вместе с растущей цепочкой оказываются внутри полости цистерны ЭПР.
- Таким образом, синтезируемый белок проходит сквозь мембрану ЭПР во время его синтеза, т.е. котрансляционно, одновременно с его трансляцией. Внутри полости ЭПР с помощью фермента (сигнальная петидаза) сигнальная последовательность отщепляется. После окончания синтеза вся белковая молекула оказывается в полости ЭПР, и в это время рибосома отделяется от транслакона и диссоциирует. После этого в транслаконе канал закрывается. Во время трансмембранного переноса растущей белковой цепи происходит ее связь с олигосахаридами (гликозилирование). В полости цистерн ЭПР белки претерпевают ряд дополнительных изменений: образуются дисульфидные связи, происходит их правильное сворачивание, а также сборка четвертичной структуры белков. Только белки с правильной конформацией в дальнейшем будут переноситься в зону аппарата Гольджи.
Клеточный центр: центриоли и диплосома.
Клеточный центр - немембр органоид всех эу клеток. Он представлен центросомой - плотной частицей, и центросферой - расходящимися от центросомы белковыми нитями. Большинство их являются микротрубочками, т.к. центросома выполняет функцию центра организации микротрубочек - в ней сконцентрированы белки, необходимые для начала синтеза микротрубочек.
- Центросомы клеток большинства животных и некоторых растений содержат еще один немембранный органоид - центриоли, которые были открыты в 1875 г. В. Флемингом.
- Центриоль - цилиндрическая частица. Ее основу составляют триплеты микротрубочек - 3 микротрубочки, последовательно соединенные боковыми поверхностями. 9 триплетов взаимодействуют друг с другом специальными белками и формируют стенку цилиндра. В центре цилиндра расположена белковая ось с девятью белковыми спицами, каждая из которых взаимодействует с одним триплетом и соседней спицей. Снаружи стенка покрыта центриолярным матриксом, на котором и располагается центр организации микротрубочек, функционирующий даже после разрушения центриоли.
- В каждой центросоме находятся две центриоли, расположенные перпендикулярно друг другу и называемые диплосомой. Перед делением клетки центриоли диплосомы расходятся, и рядом с каждой из них путем самосборки формируется вторая центриоль - образуются две диплосомы, которые в дальнейшем станут полюсами веретена деления.
- Функция центриолей: необходимы для формирования жгутиков и ресничек. После разрушении центриолей они не восстанавливаются и клетка теряет способность образовывать эти органоиды движения. У высших растений центриоли отсутствуют, поэтому у них нет клеток со жгутиками или ресничками.
Связывание SRP с рецептором при закреплении белков на мембране ЭПР
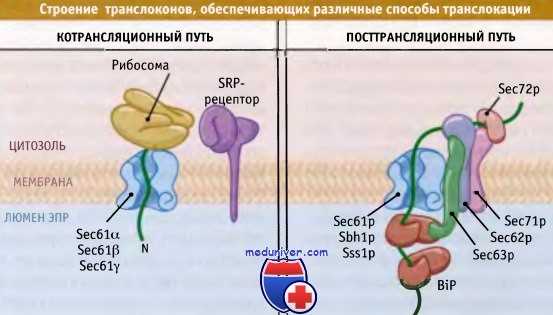
Посттрансляционная транслокация и транслоконы
• Посттрансляционная транслокация происходит независимо от рибосом и SRP
• Посттрансляционная транслокация широко распространена у дрожжей и в меньшей степени у высших эукариот
• Посттрансляционные транслоконы по составу отличаются от котрансляционных транслоконов, однако они представляют собой одни и те же каналы
При котрансляционной транслокации адресование и инициация транслокации белка происходят на очень раннем этапе синтеза новообразованной цепи. Это предотвращает формирование в цитозоле нативной структуры белка, не способной к транслокации. Другой путь транслокации включает полный синтез белка в цитозоле, где его молекула не приобретает нативной структуры, и поэтому может быть транслоцирована.
Такая посттрансляционная транслокация особенно характерна для одноклеточных эукариот, но может происходить и у высших. Эта форма транслокации не зависит от SRP и рибосом и отличается от котрансляционной транслокации по способу реализации и по механизму.
Первым свидетельством в пользу существования второго пути адресования и транслокации было наблюдение о том, что многие белки дрожжей способны к транслокации in vitro, даже после того, как сошли с рибосом. В соответствии с этим наблюдением показано: клетки S. cerevisiae, где отсутствует SRP, жизнеспособны, и многие белки сохраняют способность к транслокации в таких клетках.
Сейчас стало очевидным, что в нормальных условиях для некоторых дрожжевых белков используется только один из двух путей транслокации, однако во многих случаях эффективно используются оба.
Посттрансляционная транслокация характеризуется отсутствием цитозольного фактора, узнающего сигнальные последовательности. Использование того или иного пути транслокации, по-видимому, определяется степенью гидрофобности сигнальной последовательности, которая предоставляет способность взаимодействовать с SRP.
Различные белки взаимодействуют с одним и тем же каналом,
обеспечивая котрансляционную или посттрансляционную транслокацию.
При отсутствии взаимодействия трансляция не задерживается, и белок подвергается адресованию и транслокации уже после окончания синтеза.
Одно из последствий быстрого адресования при котрансляционной транслокации заключается в том, что в цитозоле у субстратов транслокации не образуется нативной структуры. До адресования длина пептида, выходящего из рибосомы, недостаточна для образования нативной структуры, и вместе с тем нативная структура не может образоваться в ограниченном пространстве канала.
Напротив, образование нативной структуры в цитозоле у посттрансляционно транслоцируемых субстратов ингибируется при их взаимодействии с шаперонами семейства hsp70. Эти белки используют энергию гидролиза АТФ для обратимого связывания с посттрансляционно измененными белками, тем самым предотвращая образование их нативной структуры или их агрегацию. При этом белки получают возможность взаимодействовать с каналом.
В посттрансляционной транслокации не участвует такой компонент, как SRP, который узнает сигнальную последовательность до момента ее позиционирования на мембране. Вместо этого белок транспортируется к транслокону с участием мультибелкового комплекса, который является частью посттрансляционного транслокона. Так же как и котрансляционный транслокон, он содержит тримерный комплекс Sec61.
Однако в посттрансляционном транслоконе также присутствуют четыре других белка (Sec62p, Sec63p, Sec71p и Sec72p). Эти белки образуют субкомплекс, большие домены которого открываются в цитозоль и в люмен. Один или несколько этих доменов участвуют в адресовании субстратов, хотя его механизм пока остается невыясненным.
Предполагается, что для транслокации белков через внешнюю мембрану хлоропластов также используется центральный канал, связанный с дополнительными белками. В общем, такой способ переноса белков через мембрану дает возможность гибко регулировать процесс транслокации субстратов и не использовать отдельные каналы для каждого типа белков. Сходным образом регулируется экспрессия генов факторами транскрипции, которые связываются только с промоторами определенных генов, включая и выключая транскрипцию путем взаимодействия с комплексом РНК-полимеразы.
После позиционирования цепи на транслоконе сигнальная последовательность узнается канальными белками, так же как это имеет место при котрансляционной транслокации. Поскольку адресование не зависит от SRP, этот этап приобретает особую важность, так как должен гарантировать отсутствие транслокации белков цитозоля. Так же как и при контрансляционной транслокации, к открытию канала при посттрансляционном переносе приводит узнавание сигнальной последовательности.
По-видимому, способность канала, а не SRP узнавать посттрансляционно позиционированную сигнальную последовательность позволяет предполагать, что, хотя связывание последовательности определяется ее гидро-фобностью, на ее узнавание оказывают влияние другие, пока еще неизвестные факторы.
Хотя система посттрансляционной транслокации широко представлена в клетках S. cerevisiae, данные, свидетельствующие о ее функционировании у высших эукариот, носят менее очевидный характер. Эта форма транслокации пока продемонстрирована in vitro лишь для очень небольших субстратов. В этих случаях образование стабильной нативной структуры в цитозоле маловероятно. Действительно ли эти субстраты in vivo позиционируются посттрансляционно, достоверно не установлено.
Однако у высших эукариот обнаружены гомологи белков Sec62p и Sec63p. Таким образом, возможно, что либо посттрансляционная транслокация происходит несколько по-другому, либо каналы и набор белков используются для других нужд у высших эукариот.
Элонгация новообразующейся цепи в люмен ЭПР не происходит до тех пор,
пока канал не узнал сигнальную последовательность и плотно не связал рибосому.
Вскоре после начала транслокации происходит модификация белковой молекулы,
и она приступает к приобретению нативной структуры.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сопряжение трансляции и транслокации белков из ЭПР
• Взаимодействие между транслоконом и сигнальной последовательностью приводит к открытию канала и к началу транслокации.
• Детали механизма транслокации варьируют для разных белков.
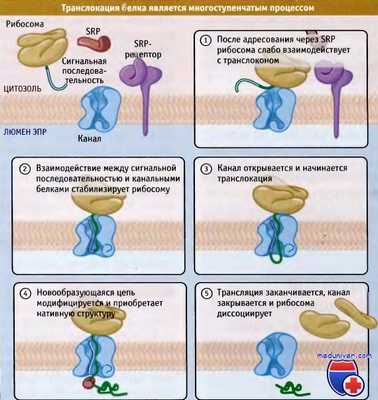
После адресования и причаливания растущей цепи белка, связанной с рибосомой, должен начаться транспорт полипептида через мембрану. Большинство данных об этом процессе получено при исследовании сравнительно небольшого количества модельных белков в бесклеточной системе транслокации. Эффективность переноса зависит от скоординированности взаимодействий между белковой цепью, каналом и рибосомой. Эти взаимодействия меняют структуру канала и его связывание с рибосомой и образующейся цепью.
После высвобождения сигнальной последовательности из SRP на мембране эндоплазматического ретикулума (ЭПР), единственной силой, удерживающей рибосому на мембране, является ее взаимодействие с каналом. Такого взаимодействия оказывается недостаточно, чтобы начать перенос новообразующейся цепи, минуя этап ее узнавания на мембране ЭПР. Этот этап необходим, поскольку независимо от субстрата трансляции сами по себе рибосомы обладают не очень высоким, но существенным сродством к каналу.
Если бы для начала транслокации достаточно было только взаимодействия рибосомы с транслоконом, то также могли бы начать переноситься белки цитозоля. Такая возможность предотвращается следующим за причаливанием этапом, на котором канал должен узнать сигнальную последовательность.
Рисунок ниже иллюстрирует изменения взаимодействия рибосомы с транслоконом при узнавании сигнальной последовательности. После причаливания и высвобождения SRP рибосома остается связанной с транслоконом лишь слабой связью. При этом сигнальная последовательность и остаток новообразующейся цепи ориентируются по направлению к цитозолю, но находятся в непосредственной близости от конца канала.
Вскоре после возобновления элонгации белковой цепи сигнальная последовательность узнается Sec61a. Предполагается, что для узнавания необходимо, чтобы сигнальная последовательность внедрилась в канал свернутой в виде петли, с N-терминальным концом, ориентированным в сторону цитозоля, а С-терминальным в сторону просвета ЭПР. При такой ориентации высвобождение белка с рибосомы в люмен ЭПР происходит через канал.
Узнавание сигнальной последовательности и начало ее поступления в канал представляют собой начальные этапы транслокации цепи. К ним, вероятно, также относятся смещение заглушки, закрывающей отверстие канала, и вставка в пору участка зрелой цепи (т. е. расположенного непосредственно после сигнальной последовательности). Как только это происходит, связь между рибосомой и каналом становится более прочной. После адресования все эти процессы, начиная с проникновения в пору сигнальной последовательности и до открытия канала, проходят очень быстро. Лишь небольшая дополнительная элонгация полипептида требуется, и описанные события завершаются задолго до того, как успеет синтезироваться большая часть белка.
Для того чтобы цепь секреторного белка могла начать транслоцироваться, необходимо, чтобы ее длина, расположенная вне рибосомы, составляла лишь около сорока аминокислот.
Если канал открылся, то большая часть секреторных белков переносится в люмен до окончания трансляции. Ранее было широко распространено мнение о том, что сила взаимодействия между рибосомой и транслоконом настолько велика, что эти компоненты прочно сцеплены друг с другом, чем предотвращается выход переносимой цепи в цитозоль. Однако многочисленными экспериментами было показано, что два компонента разделены промежутком, и, по крайней мере, в некоторых случаях часть цепи способна проходить через него в цитозоль.
Поскольку переносимые цепи имеют доступ в цитозоль, неизвестно, что побуждает их к переносу в люмен ЭПР, причем они действительно переносятся, а не просто падают. Одна возможность состоит в том, что взаимодействие с компонентами люмена ЭПР удерживает появившуюся цепь, не давая ей возможность выйти оттуда. Какой бы ни был этот механизм, считают, что субстрат транслокации предпочтительно мигрирует в люмен. Когда рибосома достигает стоп-кодона, цепь выходит в люмен, и канал закрывается, хотя точная последовательность этих событий пока неизвестна. Особенно непонятно, происходит закрытие канала после полного прохождения цепи или в результате диссоциации рибосомы.
Хотя перечисленные процессы представляют собой основные этапы транслокации, они варьируют от субстрата к субстрату. Например, различные сигнальные последовательности по-разному взаимодействуют с белками каналов и открывают их по разным механизмам. В свою очередь, способ узнавания последовательности влияет на последующий биогенез некоторых белков. Для переноса ряда белков, наряду с Sec61 и TRAM, необходимы факторы ER. У определенных белков транслокация начинается с одних и тех же основных этапов, но позже проходит совсем по-другому. Например, некоторые белки на какое-то время выходят из зазора между рибосомой и транслоконом, при этом большие участки цепи находятся в цитозоле до момента обратного входа в канал.
Поэтому, хотя процесс транслокации обладает рядом общих существенных черт, было бы чересчур упрощенным думать, что она является единым механизмом переноса для разных белков через мембрану. Более вероятно, что специфический путь, по которому белок переносится через транслокон, оказывает впоследствии определенное влияние на его биологическую активность; однако меру этого влияния мы пока не можем оценить.
Элонгация новообразующейся цепи в люмен ЭПР не происходит до тех пор,
пока канал не узнал сигнальную последовательность и плотно не связал рибосому.
Вскоре после начала транслокации происходит модификация белковой молекулы,
и она приступает к приобретению нативной структуры. Различные белки взаимодействуют с одним и тем же каналом,
обеспечивая котрансляционную или посттрансляционную транслокацию.
Последовательность SRP - частицы распознающей сигнал
• SRP связываются с сигнальными последовательностями
• Связывание SRP с сигнальной последовательностью замедляет трансляцию. Поэтому новообразующийся белок переносится на ЭПР в состоянии незавершенного синтеза и не обладая нативной структурой
• Структурная подвижность М домена SRP54 позволяет SRP узнавать различные сигнальные последовательности
Каким образом сигнальная последовательность направляет белок на ЭПР для последующей транслокации? Открытие SRP показало, что сигнальные последовательности узнаются при специфическом белок-белковом взаимодействии. SRP представляет собой маленькую рибонуклеопротеидную частицу, локализованную в цитозоле, которая содержит шесть полипептидов и небольшую молекулу РНК. Она связывается с сигнальной последовательностью новообразующегося белка, высвобождающегося из рибосомы, и тем самым дает возможность комплексу полипептид-рибосома осуществить взаимодействие с мембраной ЭПР.
Для узнавания сигнальной последовательности требуется только одна субъединица SRP. В соответствии со своей молекулярной массой она называется SRP54, и у многих видов ее структура консервативна, что подчеркивает важность механизма узнавания сигнальных последовательностей.
SRP54 содержит три отдельных домена:
• домен G, связывающий гуанозинтрифосфат (ГТФ) и гидролизующий его до гуанозиндифосфата (ГДФ);
• домен N, представляющий собой N-терминальный домен, который взаимодействует с G-доменом, и
• домен М, который является С-терминальным доменом, содержащим много остатков метионина.
Структура М-домена обеспечивает SRP возможность связываться с различными сигнальными последовательностями, которые ответственны за адресование белков На рисунке ниже представлен М-домен, содержащий несколько а-спиралей, вместе образующих бороздку, в которой и связывается сигнальная последовательность. Изнутри бороздка выстлана остатками метионина. Поскольку боковые цепи метионина обладают гидрофобностью и гибкостью, они действуют подобно гидрофобным ворсинкам и позволяют SRP54 связываться с различными гидрофобными участками, которые находятся в сигнальных последовательностях.
Две другие субъединицы SRP, SRP9 и SRP14, а также 7SPHK присоединяются к рибосоме, снижая скорость элонгации белковой цепи, вероятно, за счет непосредственного вмешательства в процесс связывания трансляционного фактора элонгации. Степень подавления элонгации варьирует от субстрата к субстрату, но во всех случаях подавление снимается только тогда, когда рибосома связывается с ЭПР, и происходит высвобождение SRP. Снижая скорость роста белковой цепи или приостанавливая ее синтез, SRP тем самым обеспечивают доставку новообразующегося полипептида к мембране до того момента, как с рибосомы сойдет большая часть белка.
Это делает маловероятным образование нативной структуры до момента поступления белковой цепи в канал и облегчает процесс переноса. Важность задержки трансляции также подтверждается данными о том, что in vitro белки обычно теряют способность к транлокации, если их узнавание SRP произошло уже после того, как синтезировалась значительная часть полипептидной цепи. Неясно, происходит ли остановка трансляции у всех организмов и даже характерна ли она для всех транслоцируемых белков одного организма. В некоторых случаях доставка новообразующегося белка к мембране происходит достаточно быстро, и тогда остановки трансляции не требуется.
Строение М-домена бактериального гомолога SRP54.
Остатки гидрофобных аминокислот обозначены зеленым и желтым цветом.
Эти остатки образуют поверхность глубокой бороздки, с которой, как предполагают, связываются сигнальные последовательности.
Слева представлен вид сбоку; справа — вид сверху. Сразу после выхода сигнальной последовательности с рибосом с ней связывается SRP,
происходит остановка трансляции, и комплекс рибосома-новообразующаяся цепь белка
связывается с мембраной ЭПР посредством взаимодействия с рецептором SRP.
• Причаливание (докинг) SRP к ее рецептору локализует рибосому и новообразующуюся цепь белка поблизости от транслокона
• Для причаливания необходимо связывание ГТФ и наличие гидролитической активности у SRP и ее рецептора
Узнавание новообразующейся цепи секреторного или мембранного белка при помощи SRP завершает только первую половину процесса адресования. Связавшись с SRP, белковая цепь должна позиционироваться на мембране ЭПР и транспортироваться к транслокационному каналу. В качестве промежуточного участника этого процесса выступает белковый комплекс, известный под названием SRP-рецептор (SR), который локализован на мембране ЭПР со стороны цитозоля.
SR представляет собой димер, состоящий из двух близких по строению субъединиц. Субъединица «альфа» ориентирована в сторону цитозоля (SR а), она взаимодействует с SRP, а «бета» (SR b) встроена в мембрану. Она взаимодействует с SR а и фиксирует ее на мембране ЭПР.
Подобно SRP54, каждая из субъединиц, SRa и SRb, содержит домен, ответственный за связывание и гидролиз ГТФ, и три этих белка образуют подсемейство ГТФ-аз. Ферментативная активность этих белков в отношении ГТФ играет критическую роль в адресовании белка на ЭПР и в его переносе в канал транслокации, а также в рециклировании SRP после прохождения адресования.
Как иллюстрирует рисунок ниже, для прохождения адресования необходимо, чтобы SRP и SR осуществляли скоординированное связывание и гидролиз ГТФ. Пока не выяснено, связывают ли SRP и SR а ГТФ до их ассоциации друг с другом или их взаимодействие приводит к связыванию ГТФ. В любом случае связанная с сигнальной последовательностью SRP и рибосома объединяются с SR. SR связывается с транслоконом, и объединение ГТФ с SRb, вероятно, облегчается субъединицей канала транслокации.
Более того, происходит связывание транслокона с комплексом «рибосома-растущая цепь». Таким образом, возникает продукт скоординированной ассоциации нескольких компонентов. В этом продукте SRP и обе субъединицы SR содержат связанный ГТФ. По-видимому, конформационные изменения, приводящие к гидролизу ГТФ под действием SRP и SR, возникают лишь в случае успешного образования комплекса, и как SRP, так и SR а способны взаимно активировать этот процесс, в результате чего их структура существенно меняется.
Рибосома также может ускорять гидролиз ГТФ в SRP и SR а. Изменения конформации приводят к высвобождению комплекса «рибосома-растущая цепь» из SRP и SR. В то же время за счет взаимодействия между рибосомой, каналом и белковой цепью последняя удерживается на месте и готова к транслокации.
Многократные взаимодействия белков и гидролиз нуклеотидов при адресовании, вероятно, обеспечивают необходимую скорость и степень точности этого процесса. Если при синтезе белка цитозоля рибосома располагается на мембране ЭПР поблизости от транслокона, то отсутствие ассоциации между SRP-SR свидетельствует о том, что белок находится здесь временно и не будет транслоцироваться. Аналогичным образом, если рибосома позиционирована на комплексе SR, который не связан с каналом, то взаимодействие не будет усилено из-за отсутствия связи рибосома-транслокон и транслокон-SR, поэтому гидролиз ГТФ происходить не будет. Таким образом, в отсутствие транслокона белковая цепь не будет освобождаться.
При высвобождении из SRP рибосома занимает транслокон. Это осуществляется при ее непосредственном взаимодействии с белками канала. При этом рибосома позиционируется непосредственно над входом в канал со стороны цитозоля, и новообразующийся полипептид транспортируется между рибосомой и каналом. Взаимодействие между ними сначала слабое, но может усиливаться, и существует на протяжении всего процесса транслокации.
Остается неясным один аспект адресования и транслокации. Каким образом присутствие нескольких рибосом на одной молекуле иРНК (полисома) влияет на адресование и сборку транслоконов. Если белок синтезировался с участием первой рибосомы на иРНК, позиционированной на ЭПР, то для остальных рибосом SRP должны быть не нужны, поскольку они уже были позиционированы около мембраны ЭПР.
Исследования, проведенные методом резонансного переноса энергии флуоресценции (FRET), который позволяет измерить расстояние между двумя молекулами, показали, что, несмотря на незначительные структурные различия между свободным и занятым транслоконом, канал остается собранным и готовым к транслокации, даже если не занят. Таким образом, взаимодействие SRP-SR может оказаться необходимым только для начального этапа адресования. После этого остальные рибосомы довольно быстро ассоциируют с транслоконами, и происходит узнавание сигнальной последовательности, что является как бы сверкой, которая обеспечивает уверенность в том, что каждый полипептид, подлежащий транслокации, действительно представляет собой секреторный или трансмембранный белок.
Строение М-домена бактериального гомолога SRP54.
Остатки гидрофобных аминокислот обозначены зеленым и желтым цветом.
Эти остатки образуют поверхность глубокой бороздки, с которой, как предполагают, связываются сигнальные последовательности.
Слева представлен вид сбоку; справа — вид сверху. Сразу после выхода сигнальной последовательности с рибосом с ней связывается SRP,
происходит остановка трансляции, и комплекс рибосома-новообразующаяся цепь белка
связывается с мембраной ЭПР посредством взаимодействия с рецептором SRP. SRP и ее рецептор связывают ГТФ,
высвобождая сигнальную последовательность и способствуя ее проникновению в канал транслокации.
После этого гидролиз ГТФ приводит к диссоциации SRP и рецептора.
Читайте также:
- Влияние гипофосфатемии на сердце. Воздействие ацетальдегида на сердце
- Зубцы электрокардиограммы. ЭКГ во взаимосвязи с сокращениями сердца
- Гнатодинамометрия. Определение жевательной активности.
- Показания для остеохондральной аутотрансплантации при повреждении голеностопного сустава
- Паралич лицевого нерва - паралич Белла. Токсичные для ушей лекарства
