Тахикардия при тиреотоксикозе. Тоны и шумы сердца при тиреотоксикозе
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Тахикардия при тиреотоксикозе. Тоны и шумы сердца при тиреотоксикозе
Из клинических проявлений нарушений функций сердца, свойственных начальному периоду тиреотоксикоза, наиболее характерным симптомом является тахикардия, ощущаемая больными как постоянное сердцебиение. Отличительной чертой тахикардии при тиреотоксикозе является ее постоянство и стойкость. Частота сердечных сокращений не меняется в состоянии покоя, и даже во сне пульс продолжает оставаться таким же частым (90—100 в 1 мин). Не происходит также и заметного, еще большего учащения пульса при физической нагрузке. Такое постоянство и стойкость тахикардии свидетельствуют о ее экстракардиальном происхождении и указывают на связь стойкого учащения сердечного ритма с влиянием катехоламииов.
Повышение тонуса симпатикуса и увеличение вследствие этого содержания катехоламииов в миокарде служат стойким стимулятором выработки сердечных импульсов. Характерной чертой такой тахикардии является отсутствие влияния на нее сердечных глюкозидов. Несмотря на постоянство этого симптома, в ряде случаев, особенно у мужчин, при выраженной типичной картине тиреотоксикоза тахикардия может отсутствовать. На нашем материале отсутствие тахикардии у больных тяжелым тиреотоксикозом наблюдалось преимущественно у мужчин. В большинстве случаев отсутствие тахикардии при выраженном тиреотоксикозе отмечается у лиц, занимавшихся до заболевания тяжелым физическим трудом или спортом.
Возможно, что в этих случаях многолетняя физическая тренировка и адаптация приспособительных функций сердца к компенсации повышенных требований к сердцу за счет вагусных реакций вызвали такие же компенсаторные реакции при повышенной работе сердца в условиях тиреотоксикоза.
Пульс обычно хорошего наполнения, в ранних стадиях заболевания ритмичен, нередко носит характер celer et altus. Такой характер пульса обусловлен, с одной стороны, повышением ударного объема сердца, что вызывает подъем систолического (максимального) давления, с другой стороны, расширение периферических сосудов вызывает понижение диастолического (минимального) давления, что проявляется значительным увеличением пульсового давления и придает пульсу черты, свойственные p. celer. Несмотря на возбужденную и повышенную работу сердца, усиление сердечного толчка находят довольно редко, по данным сотрудников В. Г. Вогралика (1963), — только в 8% случаев.
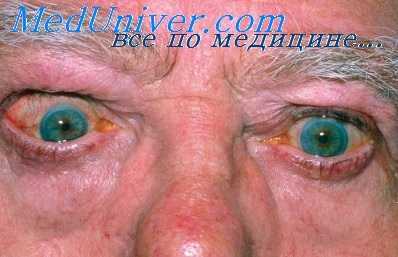
При перкуссии границы сердца в начале заболевания и в леченых случаях тиреотоксикоза определяются в пределах нормы или незначительно увеличенными влево. При тяжелом тиреотоксикозе можно наблюдать расширение границ сердца влево и вверх. При аускультации определяются громкие четкие тоны, довольно часто выслушивается систолический шум, носящий черты функционального шума, меняющегося при перемене положения тела. По нашим наблюдениям, систолический шум выслушивается в 60% случаев. Наличие функционального систолического шума было подтверждено и фонокардиогра-фическими данными (А. Г. Салимьянова). М. В. Спиридонова (1962) отмечает систолический шум у 59% больных с выраженным тиреотоксикозом.
Примерно на такой же процент систолического шума указывает и И. С. Шницер (1956) —58%. В нашей клинике ассистентом А. Г. Салимьяновой было обследовано фонокардиографически 150 больных тиреотоксикозом с различной тяжестью состояния. Систолический шум, по данным ФКГ, наблюдается при любой степени выраженности тиреотоксикоза. Ему присущи определенные характерные особенности: возникновение через 0,2—0,03 сек после первого тона, большая выраженность его в точке Боткина по сравнению с верхушкой и убывающий характер. На легочной артерии систолический шум обычно имел наибольшую амплитуду. Все это дает основание считать, что его возникновение скорее связано с гемодинамическими изменениями, а не с недостаточностью митрального клапана.
А. М. Гуровой и В. Е. Герцен (1965) удалось зарегистрировать систолический шум на ФКГ у 3/4 случаев больных тиреотоксикозом. После лечения шум может исчезнуть.
Авторы отмечают также повышение амплитуды I тона, что расценивается как его усиление. В 1/4 случаев установлено укорочение Q—I тон. У большинства больных отмечено укорочение механической систолы, которая удлинялась после антитиреоидной терапии.
Большинство авторов объясняет появление систолического шума у больных тиреотоксикозом изменением тонуса папиллярных мышц в связи с нарушением иннервации. Н. Н. Савицкий (1963) считает, что тонус папиллярных мышц повышается в связи с избытком адреналина в миокарде у этих больных. В более тяжелых случаях при проявлениях дистрофии миокарда тоны сердца могут становиться приглушенными и даже глухими.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Различия гипертиреоза и тиреотоксикоза. Сердечно-сосудистая система при тиреотоксикозе
Некоторые авторы предлагают отличать гипертиреоз от тиреотоксикоза, считая, что при гипертиреозе наблюдаются преимущественно симптомы, связанные с повышением тонуса симпатикуса без выраженных нарушений обменных процессов и проявлений интоксикации, тогда как при тиреотоксикозе на первый план выступают проявления токсикоза и со стороны сердца наблюдаются не только симптомы его перегрузки, но и явления дистрофии миокарда.
Нам представляется более правильным придерживаться классификации, предложенной В. Г. Барановым, и различать три степени выраженности тиреотоксикоза, так как повышенная продукция тиреоидных гормонов всегда нарушает постоянство внутренней среды организма и оказывает более или менее выраженный токсический эффект.
Нарушения функций сердечно-сосудистой системы при тиреотоксикозе любой степени обусловлены рядом факторов: с одной стороны, изменениями гемодинамики в связи с повышенными потребностями организма в снабжении кислородом; с другой стороны, повышенной секрецией катехоламинов в результате стимулирующего действия гормонов щитовидной железы на симпатический отдел нервной системы и повышенной чувствительностью миокарда к адреналину и норадреналипу. Несомненно, большую роль в повышенной возбудимости и реактивности сердечно-сосудистой системы играет и нарушенное состояние центральной нервной системы, свойственное гипертиреозу,— резкое преобладание процессов возбуждения и отставание тормозных процессов.
Повышенное количество гормонов щитовидной железы, несомненно, оказывает также и непосредственное влияние на все функции миокарда, а при длительном избыточном их выделении они могут оказывать и токсическое действие на миокард, вызывая развитие дистрофии миокарда с проявлениями недостаточности сердца.
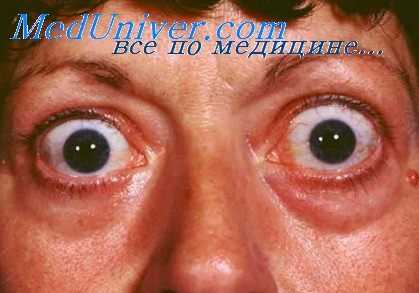
Повышенное образование гормонов щитовидной железы, оказывая стимулирующее действие на все виды обмена веществ, вызывает необходимость в усиленном снабжении организма кислородом, для осуществления которого требуются изменения ряда гемодинамических функций. Такими компенсаторными изменениями функций системы кровообращения, направленными на обеспечение организма кислородом, можно считать тахикардию, увеличение скорости кровотока, увеличение ударного и минутного объема сердца, усиление сердечных сокращений.
При этом периферические сосуды расширяются, что способствует усиленному потреблению кислорода тканями и в свою очередь вызывает понижение периферического сопротивления и увеличение массы циркулирующей крови.
Повышение венозного притока крови и увеличение массы циркулирующей крови являются лишней нагрузкой для сердца, работающего и без того с большим напряжением.
Одним из наиболее постоянных проявлений нарушения гемодинамики является увеличение минутного объема крови, отмеченное всеми авторами, изучавшими этот вопрос. За последнее время эти данные были подтверждены также и с помощью метода катетеризации сердца. Было установлено, что нарастание минутного объема идет параллельно повышению потребления кислорода. По данным Burnwill и Ерpinger (1957), ударный объем крови при тиреотоксикозе возрастает в большей степени, чем при других состояниях, требующих такого же увеличения потребления кислорода (например, мышечная работа). Несмотря на повышенное поглощение кислорода тканями, артерио-венозная разница при тиреотоксикозе уменьшается, и кровь возвращается к сердцу, будучи относительно богаче кислородом, чем в норме. Это отчасти объясняется, по мнению Burnwill и Eppinger, преимущественным увеличением периферического кровотока в кожных и мышечных сосудах, так как эти ткани поглощают относительно меньше кислорода, чем внутренние органы. Скорость кровотока у больных тиреотоксикозом резко нарастает параллельно увеличению основного обмена.
Рассмотрение клинических симптомов, связанных с нарушением деятельности сердца, необходимо проводить в зависимости от тяжести тиреотоксикоза.
Реполяризация сердца при тиреотоксикозе. Обменные процессы в сердце при тиреотоксикозе
Данные Н. П. Масловой соответствуют тому, что обнаружили Г. С. Айзен и З. И. Парахоняк (1965). Авторы описали в тяжелых случаях тиреотоксикоза нарушение процессов реполяризации в виде значительного снижения зубца Т и линии 5 — Т ЭКГ и уменьшение петли QRS на ВКГ, что свидетельствует об уменьшении электрического поля миокарда. Эти изменения можно отчасти связать с изменениями электролитного обмена, а отчасти с гипоксией миокарда.
Глубокие нарушения обменных процессов в миокарде отражаются на сократительных свойствах миокарда, о чем свидетельствуют данные БКГ и электрокимографии. Доказательством связи этих изменений с проявлениями тиреотоксикоза может служить факт их ликвидации после струмэктомии (Е. Л. Калинский, Л. С. Славина, В. И. Кандрор, 1965).
Клинические наблюдения получили полное подтверждение в эксперименте.
Н. П. Маслова и А. Г. Салимьянова в опытах на 30 кроликах с тиреотоксикозом, развившимся вследствие кормления животных тиреоидином (0,15 на 1 кг веса в течение 1 месяца), наблюдали на ЭКГ учащение ритма и увеличение вольтажа QRS, P и Т. На ВКГ у этих же кроликов отмечено увеличение петель QRS и Т (часто удлинение QRS), увеличение угла расхождения QRS и Т. Эти изменения можно было расценивать как проявления гиперфункции миокарда.
В дальнейшем через 1,5—2 месяца кормления кроликов той же дозой тиреоидина на ЭКГ намечалось уменьшение волн Т, реже волн Р и появление в некоторых случаях отрицательных зубцов Т. На ВКГ нередко появлялась пезамкнутость петель QRS и Т. Перечисленные изменения можно было расценивать как постепенное нарастание признаков гипертрофии левого желудочка.
Через 3 месяца наблюдений при продолжающемся кормлении животных тиреоидином на ЭКГ и ВКГ появлялись выраженные изменения, свидетельствующие о дистрофических процессах в миокарде. Вольтаж зубцов ЭКГ — Р, R и Т снижался, на ВКГ прослеживалось уменьшение площади петель QRS, P и Т, появлялась деформация, перекручивание петель.
В пользу повышения сократительных свойств миокарда с последующим развитием гипертрофии, а затем и дистрофических изменений свидетельствовали также и данные ФКГ, полученные А. Г. Салимьяновой у подопытных кроликов. У кроликов с явлениями тиреотоксикоза было установлено укорочение электрической систолы и увеличение интервала Q — I тон, что при наличии большой тахикардии указывает на повышение сократительной функции миокарда, по-видимому, связанной с инотропным влиянием катехоламинов.
Подтверждением развития гипертрофии миокарда при экспериментальном тиреотоксикозе могут служить также данные обследования общего количества белка и отдельных фракций в мышце сердца у кроликов с экспериментальным тиреотоксикозом. На нашей кафедре орд. А. В. Шабровым было обнаружено у подопытных кроликов увеличение общего количества белка, главным образом за счет миофибриллярных белков. Обе фракции, входящие в их состав,— актомиозин и фракция Т оказались повышенными по сравнению с контролем, особенно фракция Т.
Таким образом, увеличение общего белка происходило как за счет белков, непосредственно отвечающих засократимость миокарда, так и за счет фракции, обеспечивающей тонус сердечной мышцы.
Следовательно, клинические и экспериментальные данные указывают, что избыток гормонов щитовидной железы вызывает повышенную работу сердца — его гиперфункцию, которая приводит к развитию гипертрофии миокарда, а при более длительном и усиленном воздействии оказывает повреждающее влияние на сердечную мышцу, вызывая ее дистрофию.
При эффективном лечении больных с ранними проявлениями тиреотоксикоза ВКГ-признаки гиперфункции и даже проявления гипертрофии миокарда исчезают, тогда как проявления дистрофии обычно сохраняются. Большая часть наблюдаемых изменений связана, по-видимому, с воздействием катехоламинов, к которым сердечная мышца в условиях тиреотоксикоза становится особенно чувствительной.
Тиреотоксическое сердце
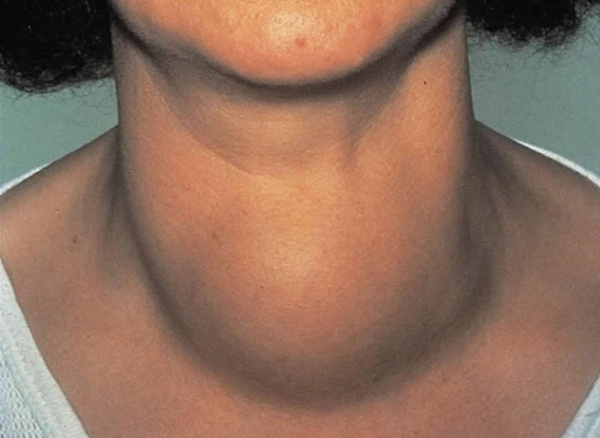
Тиреотоксическое сердце – это синдром поражения сердечно-сосудистой системы у пациентов с тиреотоксикозом. Патология в основном возникает при Базедовой болезни, реже ее причинами становятся тиреоидиты, ТТГ-продуцирующие гипофизарные опухоли, новообразование щитовидной железы. Симптомы заболевания включают тахикардию и другие нарушения ритма сердца, признаки сердечной недостаточности. Для диагностики назначается ЭКГ и ЭхоКГ, исследование гормонального профиля, сцинтиграфия щитовидной железы. Лечение предполагает коррекцию эутиреоза, прием бета-блокаторов, антиаритмиков и других препаратов патогенетической терапии.
МКБ-10
Общие сведения
Негативное влияние избытка гормонов щитовидной железы (ЩЖ) на работу сердца было впервые установлено английским врачом К. Парри в 1785 г. В 1835 г. ирландский доктор Роберт Грейвс и немецкий специалист Карл фон Базедов описали тахикардию, сопряженную с увеличением щитовидной железы. Проявления тиреотоксического сердца разной степени интенсивности возникают у всех пациентов с токсическим зобом, тяжелые сердечно-сосудистые болезни наблюдаются у 12-68% больных. Риск кардиоваскулярных осложнений имеет прямую корреляцию со стажем тиреотоксикоза.
Причины
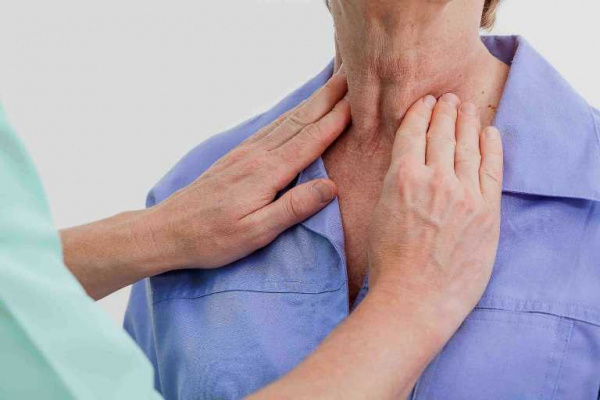
Тиреотоксическое сердце чаще всего развивается при диффузном токсическом зобе (ДТЗ, Базедовой болезни). В редких случаях заболевание возникает при других патологиях ЩЖ, сопровождающихся гипертиреозом:
- Базедова болезнь. Патология имеет аутоиммунную природу, характеризуется постоянной иммунной стимуляцией клеток щитовидной железы. В результате в крови увеличивается количество тиреоидных гормонов, которые становятся причиной повреждения миокарда.:
- Тиреоидит. При воспалении железистой ткани на фоне вирусного подострого тиреоидита или аутоиммунного тиреоидита Хашимото происходит разрушение части клеток органа. В этом случае гипертиреоз длится несколько недель или месяцев, поэтому поражения сердца носят функциональный характер.
- Опухоли. Явления тиреотоксикоза наблюдаются на фоне ТТГ-секретирующих новообразований гипофиза, токсической аденомы щитовидной железы. Крайне редко кардиальные патологии возникают у женщин со струмой яичника, вырабатывающей тиреоидные гормоны.
К независимым факторам риска относят позднюю диагностику эндокринных патологий, низкую приверженность пациентов к лечению, неправильную схему приема тиреостатиков. Симптомы кардиоваскулярных нарушений возможны у людей, которые бесконтрольно принимают синтетические тиреоидные гормоны. Заболевание чаще наблюдается у женщин со склонностью к аутоиммунным нарушениям, отягощенным семейным анамнезом.
Патогенез
При тиреотоксическом сердце наблюдается дистрофия миокарда, которая развивается под влиянием двух основных механизмов. Во-первых, при тиреотоксикозе отмечается персистирующая гиперфункция сердечной мышцы на фоне активации симпатического отдела вегетативной нервной системы. Во-вторых, тироксин и трийодтиронин обладают прямым токсическим воздействием на миокард.
Тиреоидные гормоны оказывают влияние на миокард на уровне ядер, регулируют поток ионов через клеточные мембраны, изменяют активность митохондрий. Молекулярные механизмы токсического воздействия реализуются через фосфолипид-зависимые протеинкиназы, комплекс кальдомодулин-Са, цМАФ-протеинкиназу. Повышение общего сосудистого сопротивления при тиреотоксикозе усиливает тяжесть возникших нарушений.
Патоморфологически определяется мозаичное нарушений структуры кардиомиоцитов, наличие разрушенных и интактных митохондрий в пределах одной клетки. Тиреотоксические влияние обуславливают развитие внутриклеточного отека, увеличение числа гликогеновых включений. При длительном существовании болезни возникают необратимые очаги миокардиофиброза.

Классификация
Согласно рекомендациям ВОЗ, кардиальная дисфункция при тиреотоксикозе определяется как подвид метаболической кардиомиопатии. При отсутствии соответствующего лечения тиреотоксикоза нарушения сердечной деятельности носят неуклонно прогрессирующий характер. В клинической кардиологии выделяют 3 стадии ремоделирования сердца у пациентов с тиреотоксикозом:
- Гиперкинетическая. Наблюдается на первом этапе тиреотоксического поражения, проявляется усилением силы и частоты сердечных сокращений. Для гиперкинетической фазы характерно увеличение фракции выбора до 65% при отсутствии органических изменений в миокарде.
- Нормокинетическая. На втором этапе происходит постепенное увеличение массы миокарда левого желудочка и расширение полостей сердца. Показатели сердечного выброса и другие функциональные параметры находятся в пределах нормы.
- Гипокинетическая. На третьем этапе тиреотоксического сердца сократительная функция резко снижается, развивается хроническая сердечная недостаточность. Нарушения сопровождаются выраженной дилатацией левого желудочка.
Симптомы тиреотоксического сердца
Самым частым проявлением болезни считается ощущение сердцебиения, которое обусловлено постоянной синусовой тахикардией. Человек испытывает чувство тяжести и тупые боли в области сердца, сильную слабость, быструю утомляемость при ходьбе и привычных бытовых действиях. Зачастую возникает одышка, возможно появление головокружений и предобморочных состояний.
При прогрессировании синдрома тиреотоксического сердца возникают сильные боли в левой половине грудной клетки, появляются отеки нижних конечностей, бывают приступы удушья и кашля. Некоторые пациенты испытывают распирание и увеличение живота, боли и тяжесть в правом подреберье. Шейные и периферические вены набухают и хорошо контурируются сквозь кожу.
Кардиальная симптоматика сопровождается типичными проявлениями тиреотоксикоза. Пациенты становятся раздражительными, эмоционально неустойчивыми, испытывают трудности с засыпанием. Расстройства пищеварения представлены частыми поносами и снижением аппетита. Возможно возникновение мелкоразмашистого тремора конечностей, мышечной слабости, нарушений двигательной активности.
Осложнения
Высокая ЧСС в покое, которая наблюдается у всех пациентов с тиреотоксическим сердцем, является предиктором риска фатальных состояний. При постоянной тахикардии в 3 раза возрастает вероятность острых транзиторных ишемических атак, инсультов, летальных желудочковых фибрилляций. У пациентов с сопутствующей артериальной гипертензией и ИБС наблюдается утяжеление течения заболеваний, снижение фармакологического контроля.
Серьезным осложнением заболевания является мерцательная аритмия, которая развивается у 28% больных. До 68% пациентов с длительным стажем тиреотоксического сердца сталкиваются с проявлениями сердечной недостаточности (СН). Вначале развивается СН по правожелудочковому типу, поскольку правые отделы сердца быстрее истощают свой функциональный резерв. При отсутствии медикаментозной коррекции формируется тотальная форма сердечной недостаточности.

Диагностика
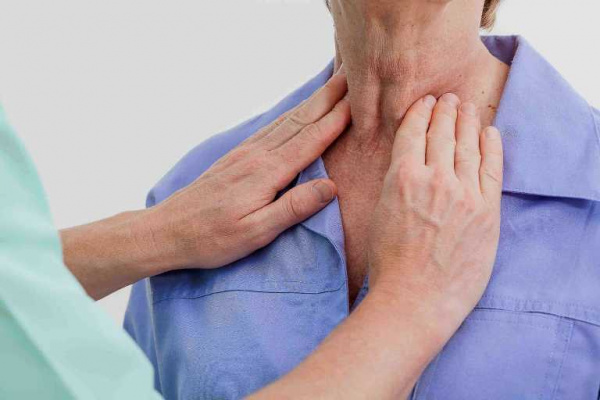
При физикальном обследовании пациента у врача-кардиолога определяется усиление сердечных тонов, систолические шумы, акцент второго тона на легочной артерии. Перкуторно обнаруживается расширение границ сердца. Для определения характера и степени тяжести органо-функциональных нарушений применяется комплексная программа обследования, которая включает следующие методы:
- ЭКГ. По результатам электрокардиографии на начальном этапе болезни определяется синусовая тахикардия, повышение амплитуды зубцов. На более поздних стадиях возникают атриовентрикулярные или внутрижелудочковые блокады, удлинение интервала QT, инверсия зубца Т, что отражает процесс ремоделирования миокарда.
- ЭхоКГ. При ультразвуковом исследовании сердца выявляется последовательное повышение и снижение фракции выброса крови, при динамическом наблюдении обнаруживается постепенное расширение полостей желудочков. При проведении ЭхоКГ на гипокинетической стадии определяются признаки миодистрофического кардиосклероза.
- Сцинтиграфия ЩЗ. Радиоизотопное сканирование железы назначается для определения ее функциональной активности. По распределению радиоактивных изотопов удается выявить диффузные изменения или очаговые гормонально активные образования.
- Анализ миокардиальных маркеров. Для исключения острых повреждений миокарда проводится тропониновый тест, определяется содержание креатинфосфокиназы и лактатдегидрогеназы. Целесообразно выполнять анализ острофазовых показателей крови.
- Гормональные исследования. Для подтверждения тиреотоксического характера кардиальной патологии назначаются анализы на гормоны Т3, Т4 (их количество повышено) и гипофизарный ТТГ, уровень которого чаще снижен.
Дифференциальная диагностика
Признаки тиреотоксического сердца необходимо отличать от токсико-аллергических миокардитов, ревматических пороков клапанного аппарата, других вариантов метаболических кардиомиопатий. Дифференциальная диагностика проводится с самостоятельными формами артериальной гипертензии, ишемической болезни сердца, туберкулезной интоксикацией.
Лечение тиреотоксического сердца
Медикаментозная терапия направлена на достижение эутиреоидного состояния и максимально возможное купирование кардиологических симптомов. Основная группа используемых препаратов – антитиреоидные (тиреостатики), которые блокируют синтез гормонов ЩЖ. По мере снижения уровней Т3 и Т4 уменьшаются их негативные влияния на миокард. Комплексное лечение включает следующие группы медикаментов:
- Бета-адреноблокаторы. Большинству пациентов назначаются неселективные блокаторы, которые способствуют ликвидации тахикардии и других видов аритмий. При субклиническом тиреотоксикозе имеет смысл назначение селективных бета-адреноблокаторов, которые имеют длительный период полувыведения.
- Антиаритмические препараты. Наибольшей активностью при тиреотоксической кардиомиопатии обладают ингибиторы реполяризации, которые имеют слабое инотропное свойство. Для усиления эффекта терапию дополняют кардиометаболическими препаратами, витаминно-минеральными комплексами.
- Диуретики. Мочегонные препараты добавляются в схему лечения запущенной формы тиреотоксического сердца, которая сопровождается сердечной недостаточностью. Для поддержки работы органа также могут использоваться сердечные гликозиды в строго контролируемых дозах.
- Антикоагулянты. На фоне аритмий существует повышенный риск тромбообразования, который требует профилактического назначения антиагрегантов и антикоагулянтов. Поскольку при ДТЗ увеличивается плазменный клиренс факторов свертывания, связанных с витамином К, дозы препаратов должны быть меньше стандартных.
Прогноз и профилактика
Исход заболевания напрямую зависит от успешности лечения причины тиреотоксикоза, комплаенса пациента, своевременности диагностики сердечной патологии. При достижении стойкого эутиреоза удается устранить аритмию и снизить риск кардиоваскулярных кризов. При развитии тотальной сердечной недостаточности прогноз неблагоприятный. Профилактика заключается в предупреждении, ранней диагностике и комплексном лечении патологий щитовидной железы.
2. Особенности сердечно-сосудистых нарушений при тиреотоксикозе/ С.Т. Зубкова// Диабетология. Тиреоидология. Метаболические расстройства. – №20/1. – 2015.
4. Сердечно-сосудистая система при тиреотоксикозе/ Аметов А.С., Коншева М.Ю., Лукъянова И.В.// Consilium medicus. – 2003. – Том 3. – № 11.
Миокардиодистрофия
Миокардиодистрофия – вторичное поражение миокарда, обусловленное метаболическими нарушениями и приводящее к дистрофии и дисфункции сердечной мышцы. Миокардиодистрофия сопровождается кардиалгией, перебоями сердечного ритма, умеренной тахикардией, быстрой утомляемостью, головокружением, одышкой. Диагностика миокардиодистрофии основывается на данных анамнеза и клиники, электрокардиографии, фонокардиографии, рентгенографии, эхокардиографии, МРТ, сцинтиграфии, биохимического исследования крови и др. Лечение миокардиодистрофии предполагает проведение патогенетической терапии кардиотрофиками и симптоматической терапии антиаритмическими, антигипертензивными препаратами, сердечными гликозидами и т. д.
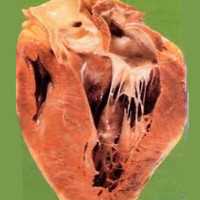
Термином «миокардиодистрофия» (вторичная кардиомиопатия, дистрофия миокарда) в кардиологии объединяют группу невоспалительных и недегенеративных поражений миокарда, сопровождающихся выраженным расстройством обменных процессов и значительным снижением сократительной способности сердечной мышцы. Миокардиодистрофия всегда является вторичным процессом, включающим дисметаболические, электролитные, ферментные, нейрогуморальные и вегетативные нарушения. Миокардиодистрофия характеризуется дистрофией миоцитов и структур проводящей системы сердца, что ведет к нарушению основных функций сердечной мышцы – сократимости, возбудимости, автоматизма, проводимости.
Миокардиодистрофия, особенно на своих начальных стадиях, имеет, как правило, обратимый характер, что отличает ее от дегенеративных изменений миокарда, возникающих при гемохроматозе и амилоидозе сердца.
Причины миокардиодистрофии
К миокардиодистрофии могут приводить самые различные внешние и внутренние факторы, нарушающие протекание обмена веществ и энергии в миокарде. Миокардиодистрофия может развиваться под влиянием:
- острых и хронических экзогенных интоксикаций (алкогольной, лекарственной, промышленной и др.), физических агентов (радиации, вибрации, перегревания);
- эндокринных и обменных нарушений (тиреотоксикоза, гипотиреоза, гиперпаратиреоза, сахарного диабета, ожирения, авитаминоза, синдрома Кушинга, патологического климакса);
- системных заболеваний (коллагенозов, нейромышечной дистрофии),
- инфекций (хронического тонзиллита и др.), болезней пищеварительной системы (цирроза печени, панкреатита, синдрома мальабсорбции).
Причинами миокардиодистрофии у новорожденных и детей раннего возраста могут быть перинатальная энцефалопатия, внутриутробные инфекции, синдром дезадаптации сердечно-сосудистой системы на фоне гипоксии.У спортсменов миокардиодистрофия может возникать в результате чрезмерного физического перенапряжения (патологическое спортивное сердце).
Различные неблагоприятные факторы вызывают расстройство электролитного, белкового, энергетического обмена в кардиомиоцитах, накопление патологических метаболитов. Изменения биохимических процессов в миокарде приводят к нарушению сократительной функции мышечных волокон, различным нарушениям ритма и проводимости, сердечной недостаточности. При устранении этиологического фактора трофические процессы в миоцитах могут полностью восстанавливаться. Однако при длительном неблагоприятном воздействии происходит гибель части кардиомиоцитов и их замещение соединительной тканью – формируется кардиосклероз.
Клинические формы миокардиодистрофии
Миокардиодистрофия при анемиях
Нарушения в миокарде развиваются при уменьшении гемоглобина до 90-80 г/л. На этом фоне развивается гемическая гипоксия, сопровождающаяся энергетическим дефицитом в миокарде. Анемическая миокардиодистрофия может возникать при железодефицитной и гемолитической анемии, при острой и хронической кровопотере, ДВС-синдроме.
Клиническими проявлениями миокардиодистрофии при анемии служат бледность кожных покровов, головокружение, одышка, тахикардия, усиление пульсации сонных артерий. Перкуторное исследование выявляет расширение границ сердца, свидетельствующее о гипертрофии миокарда. Аускультативно обнаруживаются громкие тоны сердца, систолические шумы над сердцем и сосудами, «шум волчка» на шейных сосудах. Сердечная недостаточность развивается при длительной анемии и неадекватном лечении.
Миокардиодистрофия при тиреотоксикозе
Под влиянием избыточного количества тиреоидных гормонов в сердечной мышце снижается синтез аденозинтрифосфорной кислоты (АТФ) и креатинфосфата (КФ), что сопровождается энергетическим, а затем и белковым дефицитом. В то же время, тиреоидные гормоны стимулируют активность симпатической нервной системы, вызывая увеличение ЧСС, минутного объема крови, скорости кровотока, ОЦК. В таких условиях изменение внутрисердечной гемодинамики не может быть подкреплено энергетически, что в итоге приводит к развитию миокардиодистрофии.
В клинике миокардиодистрофии при тиреотоксикозе преобладают аритмии (синусовая тахикардия, экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия). Длительный тиреотоксикоз вызывает хроническую недостаточность кровообращения, преимущественно по правожелудочковому типу, которая проявляется болями в области сердца, отеками, гепатомегалией. Иногда при тиреотоксикозе доминируют симптомы миокардиодистрофии, в связи с чем пациенты обращаются, в первую очередь, к кардиологу, а уже затем попадают к эндокринологу.
Миокардиодистрофия при гипотиреозе
Патогенетической основой миокардиодистрофии при гипотиреозе служит дефицит тиреоидных гормонов, ведущий к снижению активности метаболизма в миокарде. При этом в результате повышения проницаемости сосудов происходит задержка жидкости в миоцитах, что сопровождается развитием дисметаболических и электролитных нарушений (повышением содержания натрия и уменьшением калия).
Миокардиодистрофия при гипотиреозе характеризуется постоянными ноющими болями в сердце, аритмиями (синусовой брадикардией), блокадами (предсердной, атриовентрикулярной, желудочковыми).
Алкогольная и токсическая миокардиодистрофия
Считается, что к алкогольной миокардиодистрофии приводит ежедневный прием 80-100 мл этилового спирта на протяжении 10 лет. Однако при наследственном дефиците ряда ферментов, расщепляющих этанол, стрессах, частых вирусных инфекциях миокардиодистрофия может развиться и в более короткие сроки – за 2-3 года даже при употреблении меньших количеств алкоголя. Алкогольная миокардиодистрофия встречается преимущественно у мужчин 20—50 лет.
Токсическая миокардиодистрофия встречается у лиц, получающих длительную терапию иммунодепрессантами (цитостатиками, глюкокортикостероидами), НПВП, некоторыми антибиотиками, транквилизаторами, а также при отравлениях хлороформом, фосфором, мышьяком, угарным газом и т. д. Такие варианты миокардиодистрофии могут протекать в кардиалгической (болевой), острой аритмической, сочетанной и застойной формах.
Кардиалгическая форма миокардиодистрофии характеризуется щемящими или ноющими болями в грудной клетке, преходящим ощущением жара или зябкости конечностей, потливостью. Больных беспокоит общая слабость, быстрая утомляемость, снижение физической выносливости, головные боли.
Аритмическая форма миокардиодистрофии сопровождается тахикардией, нарушениями ритма и проводимости сердца (синусовой тахи- или брадикардией, экстрасистолией, блокадами ножек пучка Гиса), иногда - приступами фибрилляции и трепетания предсердий. При сочетанной форме миокардиодистрофии отмечаются аритмии и кардиалгии. Проявления застойной миокардиодистрофии обусловлены сердечной недостаточностью и включают одышку при напряжении, кашель, приступы сердечной астмы, отеки на ногах, гидроперикард, гидроторакс, гепатомегалию, асцит.
Тонзиллогенная миокардиодистрофия
Поражения миокарда при тонзиллите возникают у 30—60% пациентов. Тонзиллогенная миокардиодистрофия обычно развивается после серии перенесенных ангин, протекающих с высокой лихорадкой и интоксикацией. В клинике тонзиллогенной миокардиодистрофии превалируют жалобы на боли в области сердца интенсивного характера, выраженную слабость, неритмичный пульс, одышку, очаговую или диффузную потливость, субфебрилитет, артралгии.
Миокардиодистрофия физического перенапряжения
Развивается у спортсменов, выполняющих физические нагрузки, которые превышают их индивидуальные возможности. В этом случае поражению миокарда могут способствовать скрытые хронические очаги инфекции в организме - синусит, тонзиллит, аднексит и пр.; отсутствие полноценного отдыха между тренировками и т. д. В отношении патогенеза миокардиодистрофии физического напряжения выдвинуто ряд теорий: гипоксическая, нейродистрофическая, стероидно-электролитная.
Данный вариант миокардиодистрофии в основном проявляется симптомами общего характера: слабостью, вялостью, быстрой утомляемостью, угнетенным настроением, снижением интереса к спорту. Может возникать сердцебиение, покалывание в области сердца, перебои.
Климактерическая миокардиодистрофия
Развивается вследствие дисгормональных процессов у женщин в возрасте 45 – 50 лет. Климактерическая миокардиодистрофия проявляется болями в области сердца давящего, колющего или ноющего характера, иррадиирующими в левую руку. Кардиалгии усиливаются в связи с «приливами», сопровождаются ощущением жара, учащенным сердцебиением, повышенной потливостью. Сердечная недостаточность при климактерической миокардиодистрофии может развиться при имеющейся сопутствующей артериальной гипертензии.
Диагностика миокардиодистрофии
У пациентов с миокардиодистрофией в анамнезе обычно выявляются заболевания или патологические состояния, сопровождающиеся тканевым гипоксическим синдромом и нарушением метаболических процессов. Объективное исследование сердца обнаруживает нерегулярный пульс, приглушение сердечных тонов, ослабление I тона на верхушке, систолический шум.
При электрокардиографии регистрируются различные аритмии, нарушения процессов реполяризации миокарда, снижение сократительной функции миокарда. Проведение нагрузочных и фармакологических проб при миокардиодистрофии, как правило, дает отрицательные результаты. Фонокардиография обнаруживает изменения соотношения длительности электрической и механической систолы, появление галопного ритма и систолического шума на основании и верхушке, приглушение тонов сердца. С помощью эхокардиографии определяется расширение камер сердца, изменение структуры миокарда, отсутствие органической патологии.
Выявляемая при рентгенографии грудной клетки миопатическая конфигурация сердца, свидетельствует о глубоком поражении миокарда. Сцинтиграфия позволяет оценить метаболизм и перфузию миокарда, выявить очаговые и диффузные дефекты накопления как, указывающие на снижение числа функционирующих кардиомиоцитов.
К биопсии сердечной мышцы прибегают в сомнительных случаях, при неинформативности неинвазивных исследований. Дифференциальный диагноз миокардиодистрофии проводится с ИБС, миокардитами, атеросклеротическим кардиосклерозом, легочным сердцем, пороками сердца.
Лечение миокардиодистрофии
Комплексная терапия миокардиодистрофии складывается из лечения основного заболевания, патогенетической (метаболической) и симптоматической терапии. В связи с этим лечебная тактика при миокардиодистрофии определяется не только кардиологом, но и узкими специалистами – гематологом, отоларингологом, эндокринологом, ревматологом, гинекологом-эндокринологом, спортивным врачом. Больным рекомендуется щадящий физический режим, исключение вредных профессиональных воздействий, контакта с химикатами, приема алкоголя и курения.
Метаболическая терапия миокардиодистрофии предполагает назначение витаминов группы В, кокарбоксилазы, АТФ, препаратов калия и магния, инозина, анаболических стероидов и других препаратов, улучшающих метаболические процессы и питание сердечной мышцы.
При сердечной недостаточности показаны диуретики, сердечные гликозиды; при аритмиях – противоаритмические средства. При климактерической миокардиодистрофии назначается ЗГТ, седативные и гипотензивные препараты. Этиотропная терапия тонзиллогенной миокардиодистрофии требует интенсивного лечения тонзиллита вплоть до тонзиллэктомии.
Прогноз и профилактика миокардиодистрофии
Обратимость изменений миокарда при миокардиодистрофии зависит от своевременности и адекватности лечения основного заболевания. Исходом длительно протекающей миокардиодистрофии служит миокардиосклероз и сердечная недостаточность.
Предупреждение миокардиодистрофии основано на устранении текущих заболеваний, учете возраста и физической подготовки при занятиях спортом, отказе от алкоголя, исключении профессиональных вредностей, полноценном питании, обязательной санации очагов инфекции. Рекомендуются повторные медикаментозные курсы кардиотрофной терапии 2–3 раза в год.
Читайте также:
- Лечение заворота сигмовидной кишки. Консервативное и оперативное лечение заворота сигмовидной кишки.
- Отравление аларом (даминозидом) и его побочные эффекты
- Рентгенограмма, КТ, МРТ при чрезмыщелковом (надмыщелковом) переломе локтевого сустава
- МРТ-артрограмма при повреждении треугольного фиброзно-хрящевого комплекса запястья
- Проведение блокады срединного нерва
