Тактика при фиброваскулярной пролиферации стекловидного тела. Регматогенная отслойка сетчатки
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Основными факторами, приводящими к возникновению РОС, являются развитие ПВР и дистрофических изменений в области витреоретинального интерфейса. В то же время ПВР является и наиболее грозным осложнением РОС.
Пролиферативная витреоретинопатия – это фиброваскулярная пролиферация, которая характеризуется разрастанием фиброзной ткани на поверхности сетчатки, цилиарного и стекловидного тела, приводящая в последующем к отслойке сетчатки [29, 30, 69, 90, 146, 172, 219]. Термин ПВР был предложен в 1983 г. обществом ретинологов США [238]. Впервые Machemer R. с соавт. в 1975 г. указали, что не только деструкция стекловидного тела, но и пролиферативная витреоретинопатия в большинстве случаев является причиной образования разрывов сетчатки и ее отслойки [47, 166]. Также ПВР играет важную роль при рецидиве РОС [14, 17, 29, 154, 214]. Частота встречаемости ПВР при РОС составляет 5-10%, в 75% случаев она обнаруживается при рецидивах отслойки сетчатки [3, 84, 156, 162, 239]; чаще страдают молодые пациенты и пациенты с более поздними стадиями заболевания [74]. При развитии ПВР происходит нарушение гематоофтальмического барьера с миграцией и пролиферацией клеток ретинального пигментного эпителия, глиальных клеток сетчатки, гиалоцитов, макрофагов, фибробластов, продуцирующих биологически активные вещества (цитокины и факторы роста), с последующим синтезом коллагена, мембранообразованием и контракцией ткани сетчатки.
Взаимодействие этих структур в полости стекловидного тела является причиной формирования эпиретинальных мембран [175, 176, 180]. Образование разрыва и отслойки сетчатки стимулируют процесс ПВР [14, 35, 47]. Клетки пигментного эпителия, попадая в стекловидное тело, проходят путь дифференциации и трансформации. По данным литературы, они способны к пролиферативному росту и выработке коллагена, так как именно коллагены влияют на трансформацию клеток [165, 166]. Из вышеуказанного следует, что в патогенезе ПВР активную роль играют также клетки глии, которые расположены во всех структурах нервной системы, в том числе в сетчатке. Клетки глии проникают в стекловидное тело и под сетчатку за счет хемоаттрактантов, основным из которых является фактор роста тромбоцитов [133]. Эти клетки обнаруживаются в эпиретинальных мембранах, у пациентов с ПВР наряду с макрофагами и лимфоцитами в витреальной полости [59, 96, 97, 113]. Как известно, эти клетки способствуют клеточной пролиферации, но без них невозможен процесс заживления, который наблюдается у больных с ПВР. Фибробласты продлевают активность Т-лимфоцитов, участвующих в процессах фиброзирования.
Одной из основных причин неудач хирургического лечения регматогенной отслойки сетчатки является возникновение и прогрессирование ПВР в послеоперационном периоде. Распространяясь по сетчатке и ЗГМ, пролиферативная ткань формирует фиброз [28]. Активная пролиферация клеточных элементов приводит к формированию эпиретинальной мембраны, появлению складчатости сетчатки и развитию тангенциальных тракций. В 1971 году впервые A.M. Roth и R.Y. Foos описали один из механизмов развития ЭРМ [217]. Причиной развития ЭРМ по данной теории является патологическое влияние частичной отслойки ЗГМ при наличии ее адгезии к макуле. В ряде случаев вследствие более прочной фиксации ЗГМ к сетчатке, отслойка ЗГМ сопровождается тракционным воздействием на сетчатку, созданием дефектов во внутренней пограничной мембране, через которые происходит выход глиальных клеток на поверхность сетчатки с последующей их пролиферацией и образованием ЭРМ [186]. Данная теория хорошо объясняла механизм формирования как идиопатических ЭРМ, развивающихся без сопутствующих глазных заболеваний, так и вторичных по отношению к другой патологии органа зрения [16].
Развитие пролиферативной ткани является одним из тяжелых осложнений проникающих ранений глазного яблока [18, 19], регматогенной отслойки сетчатки [47]. Длительное время ЭРМ не вызывают нарушения структуры сетчатки [189]. Однако при прогрессировании процесса ЭРМ вызывают медленное ухудшение остроты и качества зрения, что выражается в искажении предметов, изменении их размеров. Это связывается с формированием складок сетчатки, эктопии fovea, макулярным отеком. В результате дальнейшего развития фиброза складки сетчатки подтягиваются к центру, что приводит к формированию воронкообразной отслойки сетчатки.
Развитие ПВР приводит к ряду структурных изменений, которые затрудняют проведение хирургического вмешательства и ухудшают анатомо-функциональные результаты лечения РОС [4, 34]. Однако ПВР развивается не только в заднем отделе глазного яблока, но и в переднем. Термин «передняя пролиферативная витреоретинопатия» был предложен в 1988 г. Lewis H. и Aaberg T. [171]. Передняя пролиферативная витреоретинопатия развивается на крайней периферии сетчатки в области основания СТ в виде круговой мембраны, которая, начинаясь от цилиарного тела и задней поверхности радужки, прикрепляется к сетчатке позади зубчатой линии [25, 62, 63]. Круговая мембрана образуется в результате пролиферативного роста клеток. Сокращаясь в результате фиброза, она начинает подтягивать сетчатку вперед и в силу этих тракций формируется круговая складка преэкваториальной сетчатки. Особенно часто передняя ПВР наблюдается при афакии и артифакии. Наиболее часто встречаемыми осложнениями при передней ПВР являются: гипотонический синдром, отслойка цилиарного тела и субатрофия глазного яблока. Эти осложнения развиваются при постоянном тракционном воздействии мембраны на цилиарное тело длительностью более 3 месяцев [95, 173, 175].
1.2.2. Классификация ПВР
Первая классификация ПВР была принята Retina Society Terminology Committee (США) в 1983 г., но эта классификация не содержит характеристики передней ПВР, субретинальных мембран, протяженности, количества и локализации разрывов [27, 238].
В классификации выделены 4 стадии ПВР:
• Стадия А (минимальная) – отмечаются небольшие помутнения СТ и наличие в нем гранул пигмента, на сетчатке нет фиксированных складок;
• Стадия В (умеренная) – на сетчатке имеется складчатость, сосуды на складках извитые, края разрывов завернуты;
• Стадия С (выраженная) – характеризуется наличием фиксированных складок сетчатки и делится на 3 подстадии:
1) С1 – фиксированные складки распространяются в пределах трех часовых меридианов (¼ окружности);
2) С2 – фиксированные складки распространяются на шесть часовых меридианов (½ окружности);
3) С3 – ПВР с фиксированными складками сетчатки в меридианах 9 часов (¾ окружности);
• Стадия D (массивная) – с наличием фиксированных складок сетчатки в четырех квадрантах глазного дна с формированием воронкообразной отслойки сетчатки – делится также на 3 подстадии:
1) D1 – складки сетчатки, занимая 4 квадранта, сходятся к ДЗН, напоминая широкую воронку;
2) D2 – конфигурация отслойки сетчатки напоминает воронку, но более узкую, чем D1. Складки не закрывают ДЗН;
3) D3 – воронкообразная отслойка сетчатка. Складки сужаются к центру и срастаются. ДЗН не офтальмоскопируется.
Новая классификация была предложена в 1991 году R. Machemer с соавт., которая учитывала все достижения ретинальной хирургии, но в практике используется реже [48, 180]. В ней выделяют 3 стадии. Стадии А и В, которые соответствуют классификации 1983 года. Далее в зависимости от расположения пролиферативных изменений по отношению к экватору на стадии С происходит разделение процесса на передний (anterior – СА) и задний (posterior – СР) тип. При СР 1-12 патологические изменения расположены кзади от экватора. На заднем гиалоиде отслоившегося стекловидного тела это приводит к формированию фокальных, диффузных или круговых фиксированных складок сетчатки, субретинальных тяжей. При СА 1-12 пролиферативный процесс развивается кпереди от экваториальной зоны. Цифры 1-12 означают количество секторов (в часах), подверженных ПВР [27, 168, 178] (Таблица 1).
Кпереди от экватора формируются фиксированные складки сетчатки; переднее смещение периферической сетчатки; плотное тяжистое стекловидное тело
На функциональный результат лечения РОС, помимо стадии ПВР, во многом влияют распространённость и вовлеченность в процесс макулярной области.
По степени распространённости отслойки различают:
- локальную, когда отслойка захватывает ¼ часть сетчатки;
- распространенную, при которой поражение охватывает половину от общего объема сетчатки;
- субтотальную – с поражением ¾ площади сетчатки глаза;
- тотальную, когда отслойка охватывает всё протяжение сетчатки.
По отношению к макулярной зоне:
- с захватом макулярной зоны,
- без захвата макулярной зоны.
Отслойка сетчатки с захватом макулярной зоны сетчатки имеет худший прогноз в отношении зрительных функций. При РОС развиваются гипоксия и ишемия фоторецепторов, что приводит к изменению фовеолярной микроструктуры, то есть в макуле индуцируется апоптоз фоторецепторов [77, 99].
В целом процесс восстановления структурно-функциональных взаимоотношений в заднем отрезке глаза после хирургического лечения РОС, осложненной ПВР, весьма сложен, характеристики его течения определяются целым рядом факторов и требуют дальнейшего изучения. По мнению большинства исследователей, диагностика РОС с использованием лишь стандартных методов обследования нередко не позволяет получить полную картину патологии [5, 67, 196, 215]. Для визуализации в послеоперационном периоде таких явлений, как фиксация волокон СТ к краям разрыва, к отслоенной сетчатке, при условии прогрессирования пролиферативного процесса, способствующего сокращению измененных волокон СТ, используются современные методы диагностики. По мнению ряда авторов, благодаря высокой разрешающей способности метод оптической когерентной томографии (ОКТ) при ведении рассматриваемой категории пациентов играет важную роль [81, 85, 196, 201].
Оптическая когерентная томография представляет собой метод, позволяющий оценить морфологию сетчатки с высокой микроскопической разрешающей способностью [135, 142, 198]. В 1996 году метод стал доступен для использования и крайне ценным для изучения структуры витреоретинальной поверхности. С помощью ОКТ подробно изучены морфологические изменения, происходящие во время отека сетчатки, детально визуализированы витреомакулярные тракционные изменения, эпиретинальные мембраны, из-за развития которых может понадобиться хирургическое лечение [8, 155, 198]. Одним из недостатков этой технологии является сложность выявления вышеуказанных состояний в условиях снижения прозрачности оптических сред глаза [134].
Ряд исследователей в своих работах показали возможность использования показателей ОКТ для прогнозирования исходов хирургического лечения у пациентов с РОС [85, 164, 189, 196].
В работе Wakabayashi T. с соавт. (2009) оценены микроструктурные изменения центральной области с помощью ОКТ после анатомически успешной операции [241]. В исследование включены 53 пациента (53 глаз), из них 15 глаз с РОС без вовлечения и 38 глаз с вовлечением макулы.
Оценивались максимально корригированная острота зрения после операции и микроструктурные изменения в макуле. На 33 глазах (62%) выявлена анатомическая патология в макуле: на 9 глазах (39%) были дефекты наружной пограничной мембраны; дефекты линии внутренние/наружные сегменты фоторецепторов – на 23 (43%), остаточная субретинальная жидкость – на 6 (11%), ЭРМ – на 12 (23%) и кистозный макулярный отек (КМО) – на 2 глазах (4%).
Также Dooley I. с соавт. (2014) оценили состояние наружного ядерного слоя сетчатки с помощью ОКТ, который составляют преимущественно тела фоторецепторов [111]. Авторы показали, что снижение послеоперационной толщины ядерного слоя у пациентов с РОС ассоциировано с худшим исходом в отношении зрительной функции. У 27 пациентов авторами был оценен спектральный скан ОКТ до и спустя 6 недель после лечения РОС.
Лечение включало использование комбинированной 20 G витрэктомии. Было установлено, что до операции среднее значение наружного ядерного слоя составило 94,1±31,1 мкм и было ниже по сравнению с соответствующим показателем в непораженных глазах (119,5±26,8 мкм). В послеоперационном периоде отмечалось увеличение показателя его толщины до 103,3±32,8 мкм.
В других работах выявлены целостность внутренней пограничной мембраны и толщина наружного зернистого слоя [73, 123], дренирование субретинальной жидкости во время операции [93], исходная высота отслойки сетчатки в макуле [169].
Метод ОКТ позволяет получать информацию об анатомии структуры сетчатки на микроскопическом уровне и для оценки результатов в лечении отслойки сетчатки.
Тактика при фиброваскулярной пролиферации стекловидного тела. Регматогенная отслойка сетчатки
Лекарства в лечении хориоидальных неоваскулярных мембран (ХНВМ). Эффективность
Лечение хориоидальных неоваскулярных мембран (ХНВМ) привозрастной макулярной дистрофии (ВМД), синдроме глазного гистоплазмоза, миопии и увеитах стало значительно более успешным за последние несколько лет. В целом развитие терапевтических методов идет по пути от простого наблюдения патологии к лазерной аблации, затем к субмакулярным хирургическим вмешательствам с использованием фотодинамической терапии (ФДТ) с интравитреальным введением стероидов или без него и, наконец, к современной антиангиогенной терапии антагонистами СЭФР.
Многие методы лечения, например применение интерферона al, талидомида, анекортава ацетата, брахитерапия, транспупиллярная термотерапия при скрытых хориоидальных неоваскулярных мембранах (ХНВМ) и наружная лучевая терапия, показали положительные результаты в ходе экспериментальных исследований, но данные проведенных рандомизированных клинических исследований не подтвердили их эффективность.
На фоне терапии пегаптанибом натрия (Макуген) и ФДТ (Визудин) наблюдается некоторое замедление темпов потери остроты зрения и иногда улучшение зрительных функций. Ранибизумаб (Луцентис), являющийся рекомбинантным приближенным к человеческому антигенсвязывающим фрагментом моноклонального антитела к СЭФР, был первым лекарственным средством, которое обеспечивало значительное и надежное повышение остроты зрения у части пациентов с хориоидальными неоваскулярными мембранами (ХНВМ).
По данным нескольких пилотных многоцентровых рандомизированных клинических исследований, улучшение зрительных функций пациентов после терапии Луцентисом было просто выдающимся по сравнению с результатами, полученными при использовании других методов лечения. Так, в 95% случаев удалось сохранить остроту зрения (потеря не более 2 линий или 25 букв по результатам ETDRS), у 30-40% пациентов наблюдалось улучшение зрительных функций и у 75% пациентов удалось достичь стабилизации патологического процесса.
Phillip Rosenfeld предложил использовать для лечения пациентов с хориоидальными неоваскулярными мембранами (ХНВМ) значительно менее дорогостоящий, чем Луцентис, бевацизумаб (Авастин), который представляет собой рекомбинантное приближенное к человеческому моноклональное антитело к СЭФР. Ретроспективные, проспективные и выполненные в последние годы небольшие рандомизированные клинические исследования, а также большой клинический опыт эпизодического применения Авастина показали результаты, аналогичные применению Луцентиса.
Национальный глазной институт США спонсировал клиническое исследование по сравнению эффективности Авастина и Луцентиса для лечения возрастной макулярной дистрофии (ВМД) по одному и тому же протоколу использования по мере необходимости (САТТ).
Большинство пациентов в настоящее время получают монотерапию либо Авастином, либо Луцентисом, в таких случаях следует оценить целесообразность ее сочетания с другими видами лечения (например, лазерной коагуляцией).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
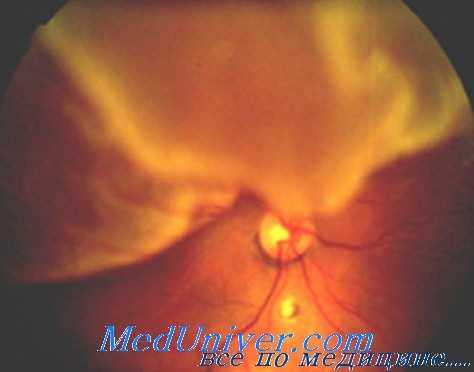
Если развивается фиброваскулярная пролиферация переднего основания стекловидного тела, то СЭФР и другие цитокины вызывают миграцию клеток и их пролиферацию на переднее основание стекловидного тела. Формирующаяся при этом мембрана приводит к образованию характерной кольцевой экваториальной тракционной отслойке сетчатки, а затем к тотальной отслойке сетчатки.
Данный процесс может быть диагностирован с помощью УЗИ, его наличие требует безотлагательного выполнения хирургического вмешательства. Наличие ретролентальной, ретро-ИОЛ или ретролентальной фиброваскулярной мембраны должно быть диагностировано как можно раньше, при биомикроскопии под углом с помощью щелевой лампы, чтобы обеспечить раннее оперативное лечение.
Для лечения необходимо выполнить ЭКЛ, удалить капсулу хрусталика и фиброваскулярную ретролентальную мембрану с биполярной диатермией резецированных краев, ЗЖВ с последующей долгосрочной тампонадой витреальной полости силиконовым маслом. Для профилактики дальнейшей неоваскуляризации необходимо выполнить обширную периферическую лазерную коагуляцию сетчатки.
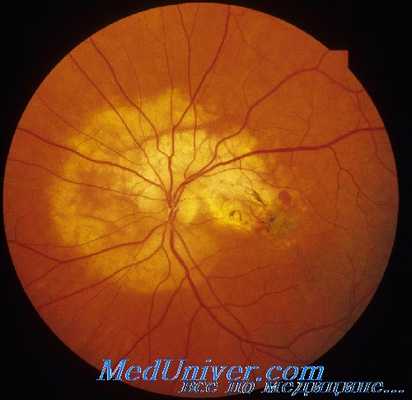
Регматогенная отслойка сетчатки
При пролиферативной диабетической ретинопатии (ПДР) периферическая регматогенная отслойка сетчатки возникает относительно редко. Если данный вид отслойки сетчатки происходит, как правило, он связан с разрывом сетчатки, не диагностированным во время предыдущей операции, или при ущемлении СТ в операционной ране. Отслойки сетчатки, возникающие после витрэктомии, обычно не могут быть устранены только путем пломбирования склеры.
Более высокая успешность лечения в таких случаях, как правило, достигается при выполнении ревизии витреальной полости для поиска остаточных тракций СТ или области рецидива глиальной пролиферации, ВД СРЖ, ЗЖВ, фокальной эндоскопической лазерной коагуляции и ЗВГВ или ЗВСМ.
Рецидив глиальной пролиферации
Эпиретинальные хирургические вмешательства, особенно с выполнением пилинга, могут привести к рецидиву глиальной пролиферации. Для рецидива глиальной пролиферации не нужен какой-либо витреальный субстрат (часто называемый «подложка»), глиальные клетки могут пролиферировать непосредственно на поверхности сетчатки. Фибрин из эпицентра ЭРМ может образовывать тяжи, вдоль которых начинают пролиферировать глиальные клетки.
Рецидивы глиальной пролиферации удаляются при помощи деламинации ножницами и внутреннне дренирование субретинальной жидкости (ВД СРЖ), ЗЖВ, эндоскопической лазерной коагуляции и долгосрочной тампонады витреальной полости силиконовым маслом для блокирования регматогенных отслоек сетчатки (при их наличии). Часто требуется ретинэктомия. Данные мембраны прочно фиксированы к сетчатке и не могут быть удалены методом пилинга.
Терапия окклюзии вен сетчатки антагонистами СЭФР. Эффективность авастина
Пролиферативная диабетическая ретинопатия (ПДР), окклюзия вен сетчатки (ОВС) и РН приводят к интравитреальному повышению уровня СЭФР (Lloyd Paul Aiello), чего не наблюдается на фоне отслойки сетчатки или пролиферативной витреоретинопатии (ПВР). СЭФР увеличивает проницаемость стенки сосудов и является мощным ангиогенным лигандом.
Пациентам со злокачественными новообразованиями этот препарат вводят внутривенно каждые 2 недели в гораздо более высокой дозировке, чем при интравитреальном введении, такая терапия приводит к удвоению частоты развития тромбоэмболии. Это является причиной некоторой озабоченности, но данных об увеличении количества случаев тромбоэмболии после интравитреального введения Авастина нет.
Большинство врачей выполняют инъекции Авастина примерно каждые 2 месяца, при этом методом ОКТ контролируется толщина макулярной зоны сетчатки. Интравитреальное введение Авастина пациентам с окклюзией ветвей центральной вены сетчатки (ОВЦВС) приводит к повышению остроты зрения на 0,1 в начале лечения и на 0,2 через 3 мес, а также к уменьшению толщины сетчатки в центре макулярной зоны на 25%.
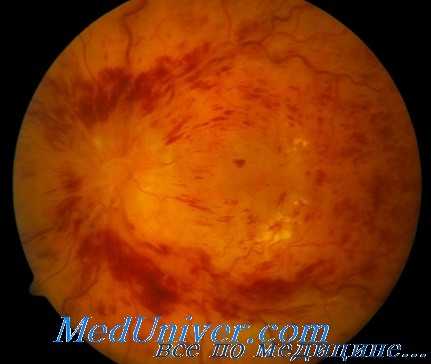
По данным множества литературных источников, интравитреальное введение Авастина при окклюзии центральной вены сетчатки (ОЦВС) приводит к кратковременному улучшению зрительных функций. Ранибизумаб (Луцентис) является единственным разрешенным к применению FDA антагонистом СЭФР, кроме обладающего минимальной эффективностью пегаптаниба натрия (Макуген), но он не одобрен для применения при окклюзии центральной вены сетчатки (ОЦВС).
Результаты ветви клинического исследования ранибизумаба при макулярном отеке на фоне диабетической ретинопатии (ДРП) (Ranibizumab for Edema of the Macula in Diabetes - READ), посвященной окклюзии вен сетчатки (ОВС), показывают расширение в два раза поля зрения пациентов после 3 ежемесячных инъекций. Авторы статьи наблюдали отличные результаты после интравитреального введения Авастина во всех случаях окклюзии ветвей центральной вены сетчатки (ОВЦВС) и окклюзии центральной вены сетчатки (ОЦВС), эффект развивался уже после первого введения, последующие инъекции выполнялись ежемесячно, пока не происходил регресс всех интраретинальных кровоизлияний, аксоплазматического стаза и отека в соответствии с рекомендациями Richard Spaide.
Часто подобное лечение приводит к полному разрешению окклюзии ветвей центральной вены сетчатки (ОВЦВС) и окклюзии центральной вены сетчатки (ОЦВС) даже без признаков наличия коллатералей. Интересно, что введение СЭФР экспериментальным животным вызывает развитие клинической картины окклюзии центральной вены сетчатки (ОЦВС).
Введение Авастина в переднюю камеру или витреальную полость приводит к быстрому и эффективному регрессу неоваскуляризации радужки, которая возникает вследствие тромбоза центральной вены сетчатки; эффект развивается в течение 48 ч после введения препарата и сохраняется не менее 4 нед.. Как правило, если при гониоскопии не обнаруживается рубцовое закрытие угла передней камеры, то также отмечается заметное снижение ВГД, предположительно, из-за регресса сосудов на поверхности трабекулярной сети и заметного снижения вязкости водянистой влаги (гораздо меньше белка «опалесценции»).
Авастин и, предположительно, любые антагонисты СЭФР должны использоваться совместно с периферической лазерной коагуляцией для создания долгосрочного эффекта на передний сегмент глаза и действия на неоваскуляризацию сетчатки, за исключением случаев хориоидальной неоваскулярной мембраны.
Интравитрсальное введение Авастина очень эффективно перед фокальной или секторальной лазерной коагуляцией, а также при лазерной коагуляции по методу решетки для уменьшения толщины сетчатки и необходимой энергии лазерного воздействия у пациентов с окклюзией центральной вены сетчатки (ОЦВС). Антагонисты СЭФР должны быть введены примерно за 1 нед. до проведения лазерной коагуляции.
Отслойка стекловидного тела
Отслойка стекловидного тела – это патологическое состояние, при котором нарушается взаимодействие между стекловидным телом и сетчаткой. Возникает в результате дегенеративных изменений в стекловидном теле, при наличии миопии высокой степени, воспалительных процессов или после травмы глаза. Выделяют полную или частичную отслойку. Клинически проявляется возникновением фотопсий, вспышек, молний при движении глазными яблоками. Для диагностики применяют офтальмометрию, визометрию, тонометрию, биомикроскопию, УЗИ глаза, измерение ПЗО. Лечение только хирургическое, заключается в проведении витрэктомии или энзимного витреолизиса.
Общие сведения
Отслойка стекловидного тела – это заболевание стекловидного тела, при котором в результате дегенеративных изменений происходит прогрессирующее ослабление базальной витреоретинальной адгезии. Стекловидное тело расположено в непосредственной близости от сетчатой оболочки глаза, что определяет важность и актуальность данной патологии. При отслойке стекловидного тела, в зависимости от силы витреомакулярной тракции, может произойти повреждение макулярной области, что является грозным осложнением, сопровождается потерей зрения, снижением трудоспособности и инвалидизацией. Патология возникает в возрасте старше 50 лет, чаще диагностируется у женщин, чем у мужчин. Взаимосвязи с расовой принадлежностью или страной проживания не отмечается.
Этиология
К этиологическим факторам развития отслойки стекловидного тела в офтальмологии относят пожилой возраст и наличие миопии высокой степени – после 50 лет начинают происходить дегенеративные изменения в структурах глаза, значительно снижаются витреоретинальная адгезия и количество коллагена в стекловидном теле. В качестве предрасполагающего фактора также рассматривают частые воспалительные заболевания сетчатой и сосудистой оболочек глаза. При данных патологиях рН изменяется в кислую сторону, происходят нарушения в клеточных структурах стекловидного тела, снижается уровень адгезии между внутренней пограничной мембраной и задней гиалоидной мембраной.
Вероятность развития отслойки стекловидного тела повышается при некоторых общих заболеваниях, в том числе – сахарном диабете, синдроме Марфана, патологии щитовидной железы. В результате гормональных расстройств, связанных с данными заболеваниями, в организме нарушается синтез гиалуроновой кислоты и гликозаминогликанов, в итоге меняется структура стекловидного тела, происходит отслойка. Кроме того, к числу обстоятельств, повышающих риск возникновения отслойки стекловидного тела, относят проникающие ранения и оперативное лечение глазного яблока.
Патогенез
Основной причиной развития отслойки стекловидного тела является нарушение взаимодействия задней гиалоидной мембраны (ЗГМ) стекловидного тела и внутренней пограничной мембраны (ВПМ) сетчатки глаза. Гиалоидная мембрана стекловидного тела состоит из коллагеновых волокон, гиалоцитов, особого белка фибронектина и ламинина (являются основой межклеточного матрикса). Она образует наружный слой стекловидного тела, который прилежит к сетчатке глаза. Внутренняя мембрана сетчатки содержит коллагеновые волокна, гиалуроновую кислоту, плазматическую мембрану клеток Мюллера сетчатой оболочки. Толщина пограничной мембраны сетчатой оболочки различна. Наименьшая толщина и более прочное соединение со стекловидным телом отмечаются вокруг сосудов сетчатой оболочки, диска зрительного нерва и макулярной области. На остальном протяжении выявляется утолщение мембраны и менее крепкое соединение.
В зависимости от проникновения витреальных фибрилл в слои ретины с одной стороны, наличием фибронектина и ламинина – с другой определяется сила контакта между стекловидным телом и сетчаткой глаза. С возрастом (чаще после 50 лет) происходит утолщение пограничной мембраны сетчатой оболочки, что снижает способность мюллеровских клеток вырабатывать межклеточное вещество и поддерживать его нормальный уровень. Это приводит к ослаблению витреоретинальной связи с последующим отслоением пограничной мембраны от гиалоидной, в результате развивается отслойка стекловидного тела.
Классификация
В зависимости от характера отслойки выделяют полное и частичное отделение стекловидного тела. При полной отслойке происходит отслойка стекловидного тела от ДЗН с формированием перипапиллярного пространства. Данный вид отслойки чаще встречается в молодом возрасте, когда гель стекловидного тела имеет более оформленную структуру, а отделяемая глиальная мембрана прозрачна. Кроме того, этот вид отслойки возникает при отделении стекловидного тела от ДЗН в результате проникновения воспалительного экссудата из хориоретинального очага (возможно – при заднем увеите) или наличия кровоизлияния между стекловидным телом и сетчатой оболочкой глаза.
Частичная отслойка стекловидного тела может развиваться в результате воспалительных заболеваний сетчатой оболочки глаза (хориоидиты, ретиниты), кровоизлияний в сетчатке, тромбозов или проникающих ранений глаза. Отделение происходит от основания стекловидного тела, позади хрусталика либо от места выхода ДЗН (при сохранении контакта на остальном протяжении). Патологическую отслойку стекловидного тела определяют в случаях соприкосновения стекловидного тела с сетчаткой только на периферии глазного дна. Причинами могут быть осложнения после оперативного удаления хрусталика, воспалительные заболевания сетчатки (хориоретинит) либо проникающие травмы глаза.
Симптомы и диагностика
Клинические проявления зависят от вида отслойки стекловидного тела. При полной отслойке пациент предъявляет врачу-офтальмологу жалобы на фотопсии, вспышки, молнии при движении глазными яблоками. В поле зрения могут возникать различные плавающие включения от «мушек» до крупных геометрических фигур. При частичной отслойке жалоб может не быть, иногда патология стекловидного тела становится случайной находкой. Поражение двустороннее, острота зрения не снижается. Из осложнений выделяют развитие регматогенной отслойки сетчатки или макулярного отверстия, которые происходят в результате патологической тракции стекловидного тела на область макулы. У пациентов с диабетической ретинопатией возможна полная отслойка сетчатой оболочки глаза.
Для диагностики используют стандартные методы обследования: определение остроты зрения, офтальмометрию, рефрактометрию, тонометрию, офтальмоскопию, биомикроскопию. Из дополнительных методик применяют определение переднезадней оси глаза (риск развития отслойки стекловидного тела увеличивается при ПЗО более 24 мм). Используют УЗИ глазного яблока (позволяет визуализировать структурные изменения в стекловидном теле, выявить наличие тракций или отслоек в сетчатой оболочке) и оптическую компьютерную томографию (дает возможность детально изучить состояние сетчатой оболочки, измерить толщину ЗГМ и ВПМ).
Лечение и профилактика
Лечение только хирургическое, проводится при наличии осложнений. Без клинических проявлений и жалоб пациента отслойка стекловидного тела не требует проведения специальных мероприятий. Развитие осложнений, таких как отслойка сетчатки, является показанием к оперативному вмешательству. Используют различные варианты витрэктомии с удалением задней гиалоидной мембраны. Кроме того, может применяться энзимный витреолизис – введение специального лекарственного вещества в стекловидное тело для изменения химических и физических свойств его молекул и ослабления витреоретинальной адгезии. Прогноз благоприятный только при своевременном обращении.
Профилактические мероприятия направлены на снижение риска развития осложнений. Необходимо адекватное лечение сопутствующих заболеваний, таких как сахарный диабет или патология щитовидной железы. Соблюдение диеты, отказ от алкоголя и курения благоприятно сказываются на прогнозе данной патологии. В список профилактических мероприятий также включают рациональный режим труда и отдыха для глаз, соблюдение техники безопасности для предупреждения травм органа зрения. При появлении симптомов отслойки стекловидного тела необходимо как можно скорее обратиться к офтальмологу для детального обследования.
Читайте также:
