Тканевая допплер-эхокардиография для диагностики жизнеспособного миокарда
Добавил пользователь Валентин П. Обновлено: 29.01.2026
1. Martynov A.I., Vasyuk Y.A., Iotschouk E.N., Sadulaeva I.A., Hadzegova A.B., Shkolnik E.L.. Dobutamine stress-echocardiography role in left ventricular contractility in patients with congestive heart failure assigned to trimetazidine. (Роль стресс-эхокардиографии с добутамином при оценке сократимости левого желудочка у пациентов с ХСН на фоне терапии триметазидином)// European congress of echocardiography.–Prague.–2002.– P. 135
2. Martynov A.I., Vasyuk Y.A., Iotschouk E.N., Shkolnik E.L.. Dobutamine stress-echocardiography role in left ventricular contractility in patients with congestive heart failure assigned to trimetazidine. (Роль стресс-эхокардиографии с добутамином при оценке сократимости левого желудочка у пациентов с ХСН на фоне терапии триметазидином).–Folia cardiologica.– 2002.–tom 9–Warsaw–P. 33.
3. Васюк Ю.А., Ющук Е.Н., Дударенко О.П., Хадзегова А.Б., Куликов К.Г., Мартынов А.И., Школьник Е.Л. Возможности противовоспалительной терапии пентоксифиллином в комплексном лечении хронической сердечной недостаточности //Материалы Российского национального конгресса кардиологов.- 2003.-С. 62.
4. Мартынов А.И., Васюк Ю.А., Куликов К.Г, Ющук Е.Н., Дударенко О.П., Школьник Е.Л. Влияние пентоксифиллина на вариабельность сердечного ритма у больных ХСН // Материалы ХI Национального Конгресса «Человек и лекарство».- 2004.- С. 244
5. Васюк Ю.А., Мартынов А.И., Куликов К.Г, Ющук Е.Н., Дударенко О.П., Е.Л. Школьник Роль вариабельности сердечного ритма в прогнозировании смертности больных ХСН "Материалы ХI Национального Конгресса «Человек и лекарство».- 2004.–С. 132
6. Васюк Ю.А., Довженко Т.В., Школьник Е.Л. Депрессии при хронической сердечной недостаточности ишемического генеза // Сердечная недостаточность.–2004.–Т. 5–№3.-С. 141-147
7. Васюк Ю.А., Дударенко О.П., Ющук Е.Н., Серова М.К. Возможности противовоспалительной терапии иммуномодулятором пентоксифиллином в комплексном лечении ХСН. // Материалы 1-го общероссийского съезда и V ежегодной конференции ОССН.–2004.-С. 24
8. Васюк Ю.А., Ющук Е.Н., Дударенко О.П., Школьник Е.Л., Серова М.В. Ингибитор синтеза фактора некроза опухоли пентоксифиллин в комплексной терапии ХСН. Материалы конференции «Достижения и трудности современной кардиологии».–2005.–С.36
9. Ющук Е.Н., Васюк Ю.А., Хадзегова А.Б., Филиппов П.Г., Иванова С.В., Школьник Е.Л., Куликов К.Г., Дударенко О.П. Эндотелиальная дисфункция при заболеваниях сердечно-сосудистой системы и методы ее коррекции // Клиническая фармакология и терапия.–2005.– Т. 14.–№ 3.– С. 85-88.
10. Васюк Ю. А., Хадзегова А.Б., Крикунов П.В., Иванова С.В., Ющук Е.Н., Школьник Е.Л. Место эхокардиографии в кардиологии неотложных состояний на догоспитальном этапе // Медицина критических состояний.– 2005.– №4.–С.17-23.
11. Васюк Ю.А., Хадзегова А.Б., Ющук Е.Н., Школьник Е.Л., Дударенко О.П., Серова М.К. Возможности метаболической терапии в комплексном лечении хронической сердечной недостаточности. Материалы VI конференции ОССН.–2005.–С. 135.
12. Васюк Ю.А., Дударенко О.П., Ющук Е.Н., Школьник Е.Л., Серова М.К. «Цитокиновая» модель патогенеза хронической сердечной недостаточности и возможности нового терапевтического подхода в лечении декомпенсированных больных // Рациональная фармакотерапия в кардиологии.–2006.–Т. 2.–№ 4.– С. 63-70.
13. Васюк Ю.А., Хадзегова А.Б., Ющук Е.Н., Крикунов П.В., Школьник Е.Л. Фармакологические пробы и стресс-эхокардиография с добутамином: диагностическое и прогностическое значение методики // Сердце.–2006.–№ 2.–С. 107-109
15. Vasyuk Y., Hadzegova A., Iouchtchouk E., Shkolnik E., Vahromeeva M. Vitko N. Effects of trimetazidine and mildronat on myocardial perfusion, metabolism and left ventricular function in patients with ischemic heart failure (Влияние триметазидина и милдроната на перфузию, метаболизм и функцию левого желудочка у больных сердечной недостаточностью, ишемического генеза)// European Journal of Heart Failure Supplements.–2006.–Vol. 5(1).–P. 42
17. Васюк Ю.А., Хадзегова А.Б., Ющук Е.Н., Школьник Е.Л., Витько Н.К., Вахромеева М.Н. Влияние триметазидина и милдроната на перфузию, метаболизм и сократимость миокарда левого желудочка у больных ХСН // Материалы Российского национального конгресса кардиологов.– 2006.–М. –С. 69
18. Vasyuk Y., Hadzegova A., Iouchtchouk E., Shkolnik E., Vahromeeva M., Vitko N. Metabolic management of heart failure with trimetazidine and mildronat: sensitivity and specificity of stress-echocardiography in patients with severe systolic dysfunction. (Метаболическая терапия хронической сердечной недостаточности триметазидином и милдронатом: чувствительность и специфичность стресс-эхокардиографии у пациентов с выраженной систолической дисфункцией) // Eur J Echocardiogr.–2006.–7 (suppl 1).– P. S10.
19. Васюк Ю.А., Довженко Т.В., Школьник Е.Л., Ющук Е.Н. Депрессия и хроническая сердечная недостаточность.–М.:Анахарсис, 2006.¬111 с.
20. Хадзегова А.Б., Школьник Е.Л., Копелева М.В., Ющук Е.Н., Лебедев Е.В., Васюк Ю.А. Ударно-волновая терапия - новое направление в лечении ишемической болезни сердца //Кардиология.–2007.–Т. 47.–№ 11.–С. 90-94.
21. Васюк Ю.А., Школьник Е.Л. Бета-блокаторы при артериальной гипертензии: конец эры всего класса или тень на плетень?// Журнал «Справочник поликлинического врача».–2007.–№7.–С. 24-28
22. Васюк Ю.А., Ющук Е.Н., Школьник Е.Л., Хадзегова А.Б., Садулаева И.А., Витько Н.К., Вахромеева М.Н. Сравнительное исследование эффективности триметазидина и милдроната при хронической сердечной недостаточности // Терапевтический архив.–2007.–Т. 79.–№ 2.– С. 51-58.
23. Васюк Ю.А., Довженко Т.В., Школьник Е.Л. Хроническая сердечная недостаточность и депрессия // Терапевтический архив.–2007.–Т. 79.–№ 10.– С. 54-60.
24. Васюк Ю.А., Школьник Е.Л. Cтарые принципы - новые горизонты в лечении ишемической болезни сердца // Кардиоваскулярная терапия и профилактика.–2007–Т. 6.–№ 1.–С. 92-98.
25. Васюк Ю.А., Довженко Т.В., Школьник Е.Л. Особенности патогенетической взаимосвязи депрессии и сердечно-сосудистых заболеваний // Психические расстройства в общей медицине.– 2007.– № 1.– С. 14-19.
26. Васюк. Ю.А., Школьник Е.Л. Бета-блокаторы при артериальной гипертензии: конец эры всего клсса или тень на плетень?// Журнал «Трудный пациент».–2007.–№8.–С. 5-8
27. Васюк Ю.А., Хадзегова А.Б., Ющук Е.Н., Крикунов П.В., Школьник Е.Л., Иванова С.В.. Клиническая интерпретация основных методов функциональной диагностики при ИБС и артериальной гипертензии. М.:Анахарсис, 2007.– 116 с.
28. Васюк Ю.А., Хадзегова А.Б., Ющук Е.Н., Крикунов П.В., Школьник Е.Л., Иванова С.В.. Основные принципы оценки диастолической функции сердца по данным тканевой допплерографии и векторного анализа скорости движения миокарда. М.:Анахарсис, 2007.– 51 с.
29. Дударенко О.П., Школьник Е.Л., Куликов К.Г., Серова М.К., Васюк Ю.А. Ингибитор синтеза фактора некроза опухоли-α пентоксифиллин в комплексной терапии хронической сердечной недостаточности // Рациональная фармакотерапия в кардиологии.–2008.–Т. 4.–№ 2.–С. 6-12.
30. Хадзегова А.Б., Школьник Е.Л., Копелева М.В., Вахромеева М.Н., Аронова Е.М., Колобов С.В., Васюк Ю.А. Возможности ударно-волновой терапии в лечении стабильной стенокардии // Сердце.–2008.–Т. 7.–№ 4.–С. 220-226.
31. Васюк Ю.А., Школьник Е.Л., Серова М.К., Шупенина Е.Ю., Школьник М.Н. Возможности статинов в патогенетической терапии хронической сердечной недостаточности // Русский медицинский журнал.–2008.–Т. 16.–№4.–С. 205-210
32. Васюк Ю.А., Шальнова С.А., Школьник Е.Л., Куликов К.Г. Исследование ПРИМА: триметазидин с модифицированным высвобождением действующего вещества в лечении пациентов со стабильной стенокардией, перенесших инфаркт миокарда. Эпидемиологический и клинический этапы //Кардиология.–2008.–Т.48.– №12.–С. 10-13.
33. Школьник М.Н., Васюк Ю.А., Перламутров Ю.Н., Школьник Е.Л. Современные представления об иммунопатогенезе псориаза: перспективы применения статинов // Клиническая дерматология и венерология.–2008.–№ 4.– С. 10-17.
34. Васюк Ю.А., Школьник Е.Л., Куликов К.Г., Лебедев Е.В., Шальнова С.А. Влияние терапии предукталом МВ на течение ХСН у больных стабильной стенокардией напряжения, перенесших острый инфаркт миокарда. Результаты исследования ПРИМА // Сердечная недостаточность.–2009.– Т. 10.– № 1.– С. 34-36.
35. Васюк Ю.А., Хадзегова А.Б., Е.Л. Школьник Место ударно-волновой терапии в лечении рефрактерной стенокардии // Медицинский вестник.–2009.–№9 (478).–С. 14-15
36. Васюк Ю.А., Хадзегова А.Б., Крикунов П.В., Ющук Е.Н., Иванова С.В., Садулаева И.А., Школьник Е.Л., Нестерова Е.А., Шупенина Е.Ю. Функциональная диагностика в кардиологии. Клиническая интерпретация. М.: Практическая медицина, 2009.¬ 310 с.
37. Васюк Ю.А., Шальнова С.А., Школьник Е.Л., Куликов К.Г. Ишемическая болезнь сердца в условиях реальной клинической практики. Результаты эпидемиологического этапа исследования ПРИМА: предуктал модифицированного освобождения в лечении пациентов со стабильной стенокардией, перенесших инфаркт миокарда // Consilium medicum.–2009.– том 13.–№5.–С. 122-126.
38. Hadzegova A.B., Shkolnik E., Kopeleva M.V., Krikunova O.V., Yuschuk E.N., Vasyuk Y.A. First experience of extracorporeal shock wave therapy in patients with ischaemic heart failure (Первый опыт использования ударно-волновой терапии у пациентов с хронической сердечной недостаточностью). European congress of Heart Failure.– 2009.– p.148
39. Vasyuk Y.A., Shkolnik E., Lebedev E.V. Ivabradine in the treatment of stable angina early after myocardial infarction. (Ивабрадин в лечении стабильной стенокардии в ранние сроки после острого инфаркта миокарда) European congress of Heart Failure.–2009.– p. 160
40. Vasyuk Y., Hadzegova A., Shkolnik E., Kopeleva M., Krikunova O., Yuschuk E. Tissue doppler velocity during dobutamine stress echocardiography is useful in predicting response of extracorporeal cardiac shock wave therapy. (Тканевая допплерэхокардиография при стресс-эхокардиографии предсказывает эффективность ударно-волновой терапии сердца) // Eur J Echocardiogr.–2009.–10 (suppl 2).–P.ii104-ii105
41. Хадзегова А.Б., Ющук Е.Н., Габитова Р.Г., Школьник Е.Л., Иванова С.В., Синицына И.А. Современный взгляд на функциональное состояние сердца при артериальной гипертензии: что нового? // Проблемы женского здоровья.–2010.–Т. 5.– № 3.– С. 46-50.
42. Васюк Ю.А., Хадзегова А.Б., Школьник Е.Л., Ющук Е.Н., Крикунова О.В. Cпособ лечения больных хронической сердечной недостаточностью ишемического генеза // Изобретения, полезные модели. Федеральная служба по интеллектуальной собственности, патентам и товарным знакам.–2010.– Бюл. №28
43. Васюк Ю.А., Хадзегова А.Б., Школьник Е.Л., Копелева М.В., Крикунова О.В., Ющук Е.Н., Аронова Е.М. Эффективность ударно-волновой терапии в лечении хронической сердечной недостаточности ишемического генеза // Кардиология.–2010.–№12.–С. 22-26
44. Васюк Ю.А., Школьник Е.Л., Лебедев Е.В. Возможности ингибитора If-каналов ивабрадина в комплексной лечении больных стабильной стенокардией, перенесших инфаркт миокарда// Кардиология.–2010.–Т. 50.–№5.–С. 13-18
45. Васюк Ю.А., Перламутров Ю.Н., Школьник М.Н., Школьник Е.Л. Возможности аторвастатина в комплексном лечении распространенного псориаза у больных АГ //Кардиология.–2010.– Т. 50.–№ 3.–С. 37-46.
46. Vasyuk Y., Hadzegova A., Shkolnik E., Kopeleva M., Krikunova O., Yuschuk E, Aronova E. Immediate and follow-up results of extracorporeal shock wave therapy in patients with ischemic heart failure. (Немедленные и отдаленные результаты ударно-волновой терапии сердца у больных хронической сердечной недостаточностью) // European Journal of Heart Failure Supplements.– 9:–P. S247.
47. Васюк Ю.А., Школьник Е.Л., Кудряков О.Н., Куликов К.Г. Влияние терапии триметазидином МВ на качество жизни у больных стабильной стенокардией напряжения, перненесших острый инфаркт миокарда. Результаты исследования ПРИМА// Кардиология.– 2010.–Т. 50.–№ 4.–С. 45-49.
48. Vasyuk Y.A., Hadzegova A.B., Shkolnik E.L., Kopeleva M.V., Krikunova O.V., Ivanova S.V., Iouchtchouk E.N., Aronova E.M. Initial clinical experience with extracorporeal shock wave therapy in treatment of ischemic heart failure (Первый клинический опыт применения ударно-волновой терапии сердца в лечении ишемической сердечной недостаточности)// Congestive Heart Failure.–2010.–Т. 16.–№ 5.–С. 226-230.
49. Школьник Е.Л. Перспективы применения ивабрадина в лечении больных с острым инфарктом миокарда // Consilium medicum.–2011.–том 13.–№1.–С. 69-74.
50. Васюк Ю.А., Шальнова С.А., Школьник Е.Л., Куликов К.Г. Исследование ПРИМА. Сравнение клинического эффекта триметазидина МВ у мужчин и женщин// Кардиология.– 2011.–№ 6.–С. 11-15.
ВОЗМОЖНОСТИ СТРЕСС-ЭХОКАРДИОГРАФИИ В ДИАГНОСТИКЕ ЖИЗНЕСПОСОБНОГО МИОКАРДА У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Обсуждают основные методы диагностики жизнеспособного миокарда у больных ишемической болезнью сердца. Приводят сведения о современных возможностях стресс-эхокардиографии и тканевой Допплер-эхокардиографии для выявления жизнеспособного миокарда.
Ключевые слова
Об авторах
врач-кардиолог отделения реанимации и интенсивной терапии кардиологического профиля
д.м.н., профессор кафедры кардиологии им. М.С. Кушаковского
заведующий отделением реанимации и интенсивной терапии кардиологического профиля
Список литературы
1. Alhaddad I.A., Kloner R.A., Hakim I. et al. Benefits of late coronary artery reperfusion on infarct expansion progressively diminish over time: relation to viable islets of myocytes within the scar. Am Heart J 1996;131(3):451-7.
2. Hochman J.S., Bulkley B.H. Expansion of acute myocardial infarction: an experimental study. Circulation 1982;65:1446–50.
3. Pirolo J.S., Hutchins G.M., Moore G.W. Infarct expansion: pathologic analysis of 204 patients with a single myocardial infarct. J Am Coll Cardiol 1986;7:349–54.
4. Bolognese L., Cerisano G., Buonamici P. et al. Influence of Infarct-Zone Viability on Left Ventricular Re-modeling After Acute Myocardial Infarction. Circulation 1997;96:3353-3359.
5. Nijland F., Kamp O., Verhorst P.M. et al. Myocardial viability: impact on left ventricular dilatation after acute myocardial infarction. Heart 2002;87:17-22.
6. Bogaert J., Maes A., Van de Werf F. et all. Functional Recovery of Subepicardial Myocardial Tissue in Transmural Myocardial Infarction After Successful Reperfusion an Important Contribution to the Improvement of Regional and Global Left Ventricular Function. Circulation 1999;99:36-43.
7. Bourdillon P., Broderick T.M., Williams E.S. et al. Early recovery of regional left ventricular function after reperfusion in acute myocardial infarction assessed by serial two-dimensional echocardiography. Am J Cardiol 1989;63:641-646
8. Zoghbi W.A., Marian A., Cheirif J.B. et al. Time course of recovery of regional function following thrombolysis in acute myocardial infarction (TIMI): Preliminary observations for the TIMI trial phase II. (abstract) J Am Coll Cardiol 1990;15:233A
9. Patel B., Kloner R.A., Przyklenk K. et al. Postischemic myocardial "stunning": A clinically relevant phenomenon. Ann Intern Med 1988;108:626-628
10. Sheehan F.H., Mathey D.G., Schofer J. et al. Factors that determine recovery of left ventricular function after thrombolysis in patients with acute myocardial infarction. Circulation 1985;71:1121-1128
11. Bolli R. Myocardial 'stunning' in man. Circulation 1992; 86; 1671-1691
12. Cornel J.H., Bax J.J., Elhendy A. et al. Agreement and disagreement between "metabolic viability" and "contractile reserve" in akinetic myocardium. J Nucl Cardiol 1999;6(4):383–388.
13. Bax J.J., Wijns W., Cornel J.H. et al. Accuracy of currently available techniques for prediction of functional recovery after revascularization in patients with left ventricular dysfunction due to chronic coronary artery disease: comparison of pooled data. J Am Coll Cardiol 1997;30(6):1451–1460.
14. Litvinov M.M., Prokhorovich I.S., Bochkova I.M. et al. Assessment of myocardial viability by positron emission tomography with rubidium — 82. Meditsinskaya radiologiya i radiatsionnaya bezopasnost' 1997;42(3):13–18. Russian (Литвинов М.М., Прохорович И.С., Бочкова И.М. и соавт. Оценка жизнеспособности миокарда с помощью позитронно–эмиссионной томографии с рубидием — 82. Медицинская радиология и радиационная безопасность 1997;42(3):13–18).
15. Underwood S.R., Bax J.J., vom Dahl J. et al. Imaging techniques for the assessment of myocardial hibernation Report of a Study Group of the European Society of Cardiology. Eur Heart J 2004; 25(10):815-836
17. Tillisch J., Brunken R., Marshall R. et al. Reversibility of cardiac wall-motion abnormalities predicted by positron emission tomography. N Engl J Med 1986;314:884–888.
18. Bonow R.O. Identification of viable myocardium. Circulation 1996; 94:2674–2680.
19. Ragosta M., Beller G.A., Watson D.D. et al. Quantitative planar rest-redistribution Tl-201 imaging in detection of myocardial viability and prediction of improvement in left ventricular function after coronary bypass surgery in patients with severely depressed left ventricular function. Circulation 1993;87:1630–1641.
20. Pohost G.M., Alpert N.S., Ingwall J.S. et al. Thallium redistribution: mechanisms and clinical utility. Semin Nucl Med 1980;20:70–93.
21. Bailey I.K., Griffith L.S.E., Rouleau L. Tl–201 myocardial perfusion imaging at rest and during exercise. Comparison of sensitivity to ECG in coronary artery disease. Circulation 1977; 55:80–87.
22. Chernov V.I., Lishmanov Yu.B., Vesnina Zh.B. et al. Quantitative evaluation of myocardial perfusion scintigraphy with thallium-199 in patients with coronary artery disease. Meditsinskaya radiologiya i radiatsionnaya bezopasnost' 1999;44(3):46–50. Russian (Чернов В.И., Лишманов Ю.Б., Веснина Ж.Б. и соавт. Количественная оценка результатов перфузионной сцинтиграфии миокарда с таллием–199 у больных ИБС. Медицинская радиология и радиационная безопасность 1999;44(3):46–50).
23. Perrone–Filardi P., Pace L., Rastaro M. Assessment of myocardial viability in patients with chronic coronary artery disease: resting 4 hour – 24 hour 201 thallium tomography vs dobutamine echocardiography. Circulation 1996;94:2712–2719.
24. Kiser J.W. Prediction of myocardial viability: Tl–201 versus sestamibi versus teboroxime compared with FDG uptake. Clin Nucl Med 1998;23(7):432–436.
25. Le Feuvre C., Baubion N., Auby N. Assessment of reversible dyssynergic segments after acute myocardial infarction: dobutamine echocardiography vs Thallium – 201 single photon emission computed tomography. Am Heart J 1996;131:668–675.
26. Naruse H. Comparison of accuracy of various Tl–201 reinjection imaging protocols to detect myocardial viability. Ann Nucl Med 1996;10:119–126.
27. Scherrer–Crosbie M. Usefulness of redistribution images in viability detection after acute myocardial infarction. Am J Cardiol 1996;77:922–926.
28. Weintraub W.S., Hattori S., Aggarwal J.B. The relation between myocardial blood flow and contraction by myocardial layer in the canine left ventricle during ischemia. Circulation Res 1981; 48:430–438.
29. Lieberman A.N., Weiss J.L., Jugdutt B.I. Two–dimensional echocardiography and infarct size: relationship of regional wall motion and thinning to the extent of myocardial infarction. Circulation 1981;63:739–746.
30. Lualdi J.C., Douglas P.S. Echocardiography for the assessment of myocardial viability. J Am Soc Echocardiogr 1997;10(7):772–780.
31. Pierard L.A., Hoffer E.P. Role of stress echocardiography in heart failure. Am J Cardiol 1998;81(12):33G– 35G.
32. Aronov D.M., Lupanov V.P. Functional tests in cardiology. Kardiologiia1996; 36 (8) :94-102. Russian (Аронов Д.М., Лупанов В.П. Функциональные пробы в кардиологии. Кардиология 1996;36(8):94–102).
33. Belenkov Yu.N. Non-invasive diagnosis of coronary artery disease. Cardiology 1996; 36 (1) :4-12. Russian (Беленков Ю.Н. Неинвазивные методы диагностики ИБС. Kardiologiia 1996;36(1):4–12).
34. Armstrong W.F. Stress echocardiography: introduction, history and methods. Prog Cardiovasc Dis 1997;39(6):499–522.
35. Meyer L., Curry G., Donsky M. et al. Influence of dobutamine on hemodynamics and coronary blood flow in patients with and without coronary artery disease. Am J Cardiol 1976; 38:1–12.
36. McGillem M.J., De Boe S.F., Friedman H.Z. The effect of dopamine and dobutamine on regional function in presence of rigid coronary stenosis and subcritical impairment of reactive hyperaemia. Am Heart J 1988;115: 970–977.
37. Fung A.Y., Gallagher K.P., Buda A.J. The physiologic basis of dobutamine as compared with dipyridamole stress interventions in the assessment of critical coronary stenosis. Circulation 1987;76:943– 951.
39. Secknus M., Marwick T. Evolution of dobutamine echocardiography protocols and indications: safety and side effects in 3011 studies over 5 years. J Am Coll Cardiol 1997;29: 1234–1240.
40. Beckmann S., Bocksch W., Muller C., Schartl M. Does dobutamine stress echocardiography induce damage during viability diagnosis of patients with chronic regional dysfunction after myocardial infarction? Schweiz Med Wochenschr 1997; 127(48):2008–2013.
42. Salustri A., Elhendy A., Garyfallidis P. Prediction of improvement of ventricular function after first acute myocardial infarction using low dose dobutamine stress echocardiography. Am J Cardiol 1994;74:853– 856.
44. Pagano D. Predictive value of dobutamine echocardiography and positron emission tomography in identifying hibernating myocardium in patients with postischaemic heart failure. Heart 1998;79(3):281– 218.
45. Poldermans D. Safety and utility of atropine addition during dobutamine stress echocardiography for the assessment of viable myocardium in patients with severe left ventricular dysfunction. Eur Heart J 1998;19(11):1712–1720.
46. Bonow R.O. Identification of viable myocardium. Circulation 1996;94:2674–2680.
47. Smart S.C., Sawada S., Ryan T. Low dose dobutamine stress echocardiography detects reversible dysfunction after trombolytic therapy of acute myocardial infarction. Circulation 1993;91:663–670.
48. Kaul S. There may be more to myocardial viability than meets the eye. Circulation 1995;92:2790– 2793.
49. Sabja P.J., Powers E.R., Ragosta M. An association between collateral blood flow and myocardial viability in patients with recent myocardial infarction. N Engl J Med 1992;372:1825–1831.
50. Main M.L., Grayburn P.A., Landau C. Relation of contractile reserve during low dose dobutamine stress echocardiography and angiographic extent and severity of coronary artery disease in the presence of left ventricle dysfunction. Am J Cardiol 1997;79:1309–1313.
51. Perrone-Filardi P., Pace L., Prastaro M. Assessment of Myocardial Viability in Patients With Chronic Coronary Artery Disease. Rest–4-Hour–24-Hour 201Tl Tomography Versus Dobutamine Echocardiography. Circulation 1996;94:2712-2719.
52. Panza J.A., Dilsizian V., Laurienzo J.M. et al. Relation between thallium uptake and contractile response to dobutamine: implications regarding myocardial viability in patients with chronic coronary artery disease and left ventricular dysfunction. Circulation 1995;91:990–998.
53. Maes A., Flameng W., Nuyts J. Histological alterations in chronically hypoperfused myocardium: correlation with positron emission tomography findings. Circulation 1994;90: 735–745.
54. Cornel J.H., Bax J.J., Elhendy A. et al. Agreement and disagreement between "metabolic viability" and "contractile reserve" in akinetic myocardium. J Nucl Cardiol 1999;6(4):383–388.
55. Baumgartner H., Porenta G., Lau Y.K. et all. Assessment of myocardial viability by dobutamine echocardiography, positron emission tomography and thallium-201 SPECT. Correlation with histopathology in explanted hearts. J Am Coll Cardiol 1998; 32:1701-1708.
56. Armstrong W.F. Stress echocardiography: introduction, history and methods. Prog Cardiovasc Dis 1997; 39(6):499–522.
57. Madler C., Payne N., Wilkenshoff U. Non-invasive diagnosis of coronary artery disease by quantitative stress echocardiography:optimal diagnostic models using off-line tissue Dopplerin the MYDISE study. Eur Heart J 2003;24:1587-94.
58. Cain P., Baglin T., Case C. et al. Application of tissue Doppler to interpretation of dobutamine echocardiography and comparison with quantitative coronary angiography. Am Coll Cardiol 2001;87:525-31.
59. Miyatake K., Yamagishi M., Tanaka N. et al. New method for evaluating left ventricular wall motion by color-coded tissue Doppler imaging: in vitro and in vivo studies. J Am Coll Cardiol 1995;25:717– 724.
60. Tsutsui H., Uematsu M., Shimizu H. et al. Comparative usefulness of myocardial velocity gradient in detecting ischemic myocardium by a dobutamine challenge. J Am Coll Cardiol 1998;31:89–93.
61. Dandel M., Lehmkuhl H., Knosalla C. et al. Strain and Strain Rate Imaging by Echocardiography – Basic Concepts and Clinical Applicability. Current Cardiology Reviews 2009; 5: 133-148.
62. Marwick T.H., Cheuk-Man Yu., Jing Ping Sun. Myocardial Imaging: Tissue Doppler and Speckle Tracking. Oxford: Blackwell Publishing; 2007.
63. D’Hooge J., Heimdal A., Jamal F. et al. Regional strain and strain rate measurements by cardiac ultrasound: principles, implementation and limitations. Eur J Echocardiogr 2000; 1(3): 154-70.
64. Yip G.W., Ommen S.R. Tissue doppler imaging in coronary artery disease. Heart views 2002; 3(1):
65. Voigt J.U., Exner B., Schmiedehausen K. et al. Strain-rate imaging during dobutamine stress echocardiography provides objective evidence of inducible ischemia. Circulation 2003;107:2120–6.
66. Hoffmann R., Altiok E., Nowak B. et al. Strain rate measurement by doppler echocardiography allows improved assessment of myocardial viability inpatients with depressed left ventricular function. J Am Coll Cardiol 2002;39;443-449.
67. Hanekom L., Jenkins C., Jeffries L. et al. Incremental Value of Strain Rate Analysis as an Adjunct to Wall-Motion Scoring for Assessment of Myocardial Viability by Dobutamine Echocardiography: Follow-Up Study After Revascularization. Circulation 2005;112;3892-3900.
68. Picano E., Lattanzi F., Orlandini A. et al. Stress echocardiography and the human factor: the importance of being expert. J Am Coll Cardiol 1991;17:666–669.
Эхокардиография (ЭхоКГ) с допплерографией и цветным картированием
Эходопплеркардиография — это инструментальный метод исследования сердца и кровеносных сосудов, при котором применяются ультразвуковые технологии.
Оформите заявку на услугу, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Эходопплеркардиография — это инструментальный метод исследования сердца и кровеносных сосудов, при котором применяются ультразвуковые технологии. Как и при «рутинных» (М-режимной и двухмерной) эхокардиографиях (ЭхоКГ), данная методика использует высокочастотные звуковые волны, чтобы создать изображение сердца. Но помимо этого, чтобы определить скорость и направление кровотока, она дополняется эффектом Допплера.
Эхокардиография с допплерометрией, допплеровская эхокардиография — другие названия этой процедуры.
Основные режимы визуализации, применяемые при УЗИ сердца
Ультразвуковое исследование сердца в основном используется для получения двухмерного изображения этого органа и близлежащих магистральных сосудов. А также с помощью этой методики можно оценить скорость и направление кровотока, что требует применение эффекта Допплера. В зависимости от того, как обрабатывается и отображается на мониторе эхо-сигнал, различают следующие режимы ЭхоКГ:
- Двухмерный (2D режим). На монитор выводится изображение сердца в разрезе (в двух измерениях). Данный способ является основным при визуализации этого органа, позволяет детально рассмотреть анатомические отклонения и аномальные движения миокарда, клапанов.
- М-режим (M-mode). Это «усеченный» вариант предыдущего, при котором используется для анализа только одномерное изображение. Основное внимание уделяется одной из линий 2D трассировки, что позволяет более детально исследовать движения створок клапанов и сердечной мышцы.
Для облегчения выявления турбулентного движения (завихрений) существует порог скорости, выше которого происходит изменение цвета (во многих аппаратах это зелены). «Мозаичный» узор на участке турбулентного потока позволяет легко установить регургитацию (смену направления движения), что помогает определить степень недостаточности клапанов.
Наличие режимов визуализации сердца не означают, что для каждого из них необходим отдельный УЗИ аппарат. Все современные ультразвуковые приборы для эхокардиографии способны воспроизвести данные режимы. Для этого врачу необходимо только «переключить тумблер» или поменять датчик.
Для получения “полной картины заболевания” обычно используется сочетание нескольких методов визуализации следующих структур:
- клапанов;
- четырех камер сердца;
- перегородок между ними;
- перикарда;
- внутрисердечных масс;
- миокарда.
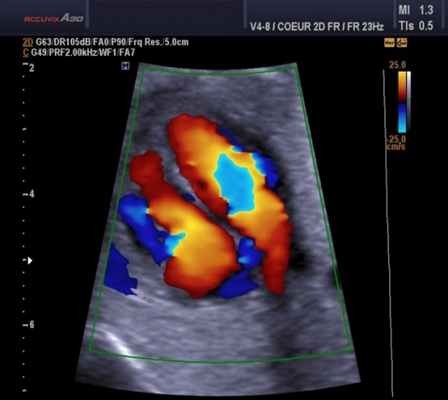
Так, например, эхокардиография с допплерометрией и цветным допплеровским картированием (ЦДК), которая является сочетанием 2D и М-режимов с допплерометрией, очень полезна при оценке митрального стеноза. Первые два способа визуализации позволяют заподозрить кальцификацию клапана (аномальное движение его створок).
Допплерометрия демонстрирует при этой патологии повышенную скорость кровотока (признак сужения) и может быть использована для оценки «эффективной площади отверстия» (степени выраженности стеноза).
Эхокардиография наиболее полезна при диагностики следующих патологий:
- пороках сердца: при дисфункции клапана, для контроля за протезами;
- при нарушениях функции левого желудочка: используется для выяснения причины (постинфарктный кардиосклероз, кардиомиопатия и т. д.) и определения фракции выброса (ФВ);
- мерцательной аритмии — оценка структурной причины, риска тромбоэмболии и предполагаемого ответа на кардиоверсию;
- хронической сердечной недостаточности;
- кардиомиопатиях;
- инфекционном эндокардите: включает оценку поражения клапанов, а также степень тяжести гемодинамических нарушений;
- после ишемического инсульта головного мозга с целью определения возможной сердечной причины образования эмболов;
- перикардиальной патологии — наличия жидкости в околосердечной сумке; с помощью эхокардиографии (под ее контролем) можно безопасно удалить перикардиальную жидкость при тампонаде сердца;
- патологии грудного отдела аорты: аневризма, расслоение.
Информация, которая предоставляется с помощью ЭхоКГ, чрезвычайно полезна для врачей при диагностике различных состояний, связанных с сердечно-сосудистыми заболеваниями. Тем не менее, очень важно, чтобы «клиент» понимал, что существует множество «нюансов», которые влияют на правильную постановку диагноза, связанных с эхокардиографией.
Опыт врача, проводящего исследование, вид используемого оборудования — факторы, влияющие на точность диагностики. Неправильно проведенное ультразвуковое исследование, как правило, приводит к избыточному назначению ненужных тестов или даже хирургических вмешательств.
Преимущества и недостатки допплерометрии сердца
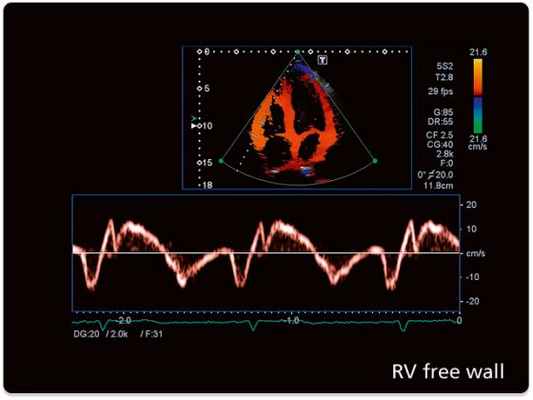
ЭхоКГ способна определить направление кровотока, измерить скорость движения крови и сердечной стенки, если она дополняется эффектом Доплера. Одним из недостатков эхокардиографии с допплеровским анализом является то, что для получения точных результатов ультразвуковой луч и поток крови должны быть максимально параллельны, что ограничивает возможность исследовать некоторые отделы сердца.
Измерение скоростных характеристик позволяет оценить:
Допплерэхокардиография позволяет измерить все вышеперечисленные параметры, которые очень важны при оценке детской сердечной патологии (врожденные пороки) без использования инвазивной процедуры — катетеризации сердца. Помимо этого, назначение эхокардиографии с допплеровским анализом ребенку не несет никакой угрозы по сравнению с компьютерной томографией, где используется рентгеновское излучение.
Как ЭхоКГ выполняется (совместно с допплерометрией)
Эхокардиография считается довольно простой медицинской процедурой, не требующей серьезной подготовки. Во время исследования пациента размещают на кушетке. Оператор держит в руке датчик (устройство, напоминающее компьютерную мышь), медленно его перемещает по коже грудной стенки исследуемого. Предварительно врач наносит на кожу специальный гель, чтобы облегчить передвижение датчика. В процессе исследования доктор может попросить перевернуться на тот или иной бок, задержать дыхание на несколько секунд. Процедура обычно длится от 30 до 60 минут.
Эхокардиографию иногда сочетают со стресс-тестом. Сначала выполняют ЭхоКГ в состоянии покоя, а затем повторяют ее во время физических упражнений. Это помогает определить функциональные изменения в сердечной мышце в период перенапряжения. Отклонения могут косвенно указывать на заболевания коронарных артерий.
Трансэзофагеальная ЭхоКГ — методика ультразвукового исследования, которая позволяет более детально просмотреть некоторые отделы сердца (которые плохо визуализируются при обычной, трансторакальной), а также часто используется для получения изображения во время операции на этом органе. Как правило, оно проводится под действием внутривенного наркоза. Тонкий зонд проводится по пищеводу до уровня расположения сердца.
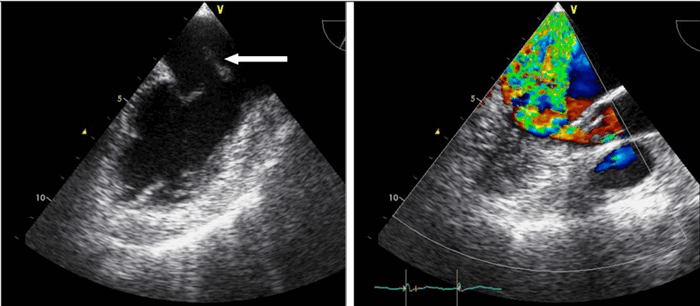
На сегодняшний день эхокардиография с допплеровским анализом — это неотъемлемая составляющая полного ультразвукового исследования сердца, позволяющая поставить правильный диагноз.
Методы сердечно-сосудистой визуализации в диагностике ишемической болезни сердца

Данная статья посвящена современным методам сердечно-сосудистой визуализации для диагностики ишемической болезни сердца (ИБС). Методы ядерной кардиологии, стресс-эхокардиография, мультиспиральная компьютерная томография и магнитно-резонансная томография обладают высокими показателями чувствительности и специфичности в верификации коронарной патологии. Они рекомендуются пациентам с промежуточной предтестовой вероятностью ИБС на основании оценки клинической симптоматики и факторов риска. Дополнительно у больных с ИБС современные методы визуализации полезны для оценки жизнеспособности миокарда.
Ключевые слова
Полный текст
Введение Одной из важных проблем современной медицины является ишемическая болезнь сердца (ИБС) вследствие высокой заболеваемости и смертности [1, 2]. Этим обусловлено особое внимание кардиологов к применению диагностических методов при данной патологии [3]. Прогресс медицинской диагностики способствовал развитию методов сердечно-сосудистой визуализации (ССВ), основанных на разных физических принципах (рентгеновское излучение, ультразвук, ядерно-магнитный резонанс и т.д.) [4]. В современных международных рекомендациях сформулирована важность знания практическими кардиологами возможностей и ограничений каждого диагностического метода, показаний к их применению [5]. Данная статья посвящена методам ССВ, использующимся для диагностики ИБС. Общая характеристика методов ССВ для диагностики ИБС Методы визуализации для диагностики ИБС условно можно разделить на те, которые позволяют оценивать коронарные артерии (КА) и миокард (табл. 1). В первом случае методы визуализации дают возможность выявить признаки атеросклеротического поражения КА [6]. В другом - анализируется функция миокарда на фоне пробы с физической или фармакологической нагрузкой, т.е. провокации ишемии миокарда [7]. «Золотым стандартом» диагностики коронарной патологии является коронароангиография (КАГ) [8]. Основными недостатками являются ее инвазивность и более высокая стоимость по сравнению с другими методами диагностики ИБС [8, 9]. Появившийся в последние годы и нашедший применение в интервенционной кардиологии метод внутрисосудистого коронарного ультразвука не стал альтернативой традиционной КАГ в диагностике ИБС по тем же причинам - относительно высокая стоимость и инвазивность [2]. Другой реальной возможностью оценки КА является применение мультиспиральной компьютерной томографии (МСКТ) [10, 11]. Даже без контрастирования КА с помощью МСКТ можно оценивать выраженность внутрисосудистого отложения кальция, так называемый скрининг коронарного кальция [12]. Коронарный кальциноз количественно характеризуют с помощью кальциевого индекса Агатстона [2]. Поскольку причиной отложения кальция в коронарных сосудах, за исключением пациентов с почечной недостаточностью, является атеросклероз, данный параметр может быть полезен в оценке коронарного риска [12]. Однако данный показатель не дает возможности адекватно определить степень стенозирования КА [2]. Даже при тяжелом кальцинозе не обязательно будет гемодинамически значимый стеноз артерии, а индекс коронарного кальция, равный нулю, не исключает стенозов КА у лиц с клинической симптоматикой [13]. Для более точной оценки структуры КА с помощью МСКТ необходимо внутривенное контрастирование [14, 11]. Хорошее пространственное разрешение позволяет получать качественное изображение коронарного русла [15] с высокой точностью выявления стенотического поражения (чувствительность 95-99%, специфичность 64-83%) [2]. Несомненными преимуществами МСКТ-визуализации КА по сравнению с КАГ являются меньшая стоимость и отсутствие необходимости катетерного вмешательства [8, 9]. Ограничениями МСКТ в диагностике ИБС являются необходимость в соответствующей современной аппаратуре (64-спиральный компьютерный томограф), возможность корректной оценки пациентов без тахикардии, тяжелого ожирения, способных задерживать дыхание [15]. Кроме того, тяжелый кальциноз КА может отрицательно влиять на точность МСКТ [16]. Другая группа методов ССВ, применяемых для диагностики ИБС, оценивает изменения миокарда при нагрузке. В их основе лежит концепция «ишемического каскада» [17]. Согласно этой теории у пациента со стенотическим поражением коронарного русла повышение потребности миокарда в кислороде в ходе увеличения нагрузки сначала ведет к появлению нарушений метаболизма, его перфузии, далее возникают нарушения кинетики миокарда в виде ухудшения диастолической и систолической функций [18, 19]. Только в самом конце этого ишемического каскада появляются электрокардиографические признаки ишемии и ангинозные боли [17], соответственно, совмещение нагрузочной пробы с визуализацией миокарда делает пробу более чувствительной к выявлению ишемии, по сравнению со стандартной регистрацией электрокардиограммы (ЭКГ) [2]. Стресс-эхокардиография (стресс-ЭхоКГ) Среди методов визуализации, которые используются в диагностике кардиальной патологии, и в частности ИБС, лидирующие позиции занимает стресс-ЭхоКГ как наиболее доступный и безопасный метод [9, 20]. С помощью стресс-ЭхоКГ можно оценивать как структурные, так и функциональные параметры сердца [21]. ЭхоКГ-исследование в покое, согласно европейским рекомендациям, должно выполняться у всех пациентов с подозрением на ИБС, поскольку может дать информацию о других причинах боли в грудной клетке, диастолической и глобальной систолической функциях левого желудочка (ЛЖ), а также нарушениях локальной сократимости миокарда (гипокинезия, акинезия, дискинезия), связанных с ишемией [2]. Локализация зон нарушений кинетики миокарда при ИБС, как правило, соответствует бассейнам пораженных КА [22]. Нарушения региональной сократимости могут быть стабильными (например, акинезия в зоне рубцовых изменений после перенесенного инфаркта миокарда) либо преходящими - при кратковременной ишемии [7, 23]. В то же время у больных с ИБС в условиях покоя сократимость миокарда может быть сохранена, даже при наличии измененной конечной части желудочкового комплекса на ЭКГ. Поэтому применение ЭхоКГ для диагностики ИБС подразумевает совмещение ее с нагрузочной пробой - стресс-ЭхоКГ [20]. В качестве стресс-агентов могут использоваться физические нагрузки на велоэргометре, тредмиле, введение фармакологических препаратов (добутамина, дипиридамола), чреспищеводная электрокардиостимуляция предсердий [24]. Противопоказания к стресс-ЭхоКГ являются стандартными для нагрузочных тестов, используемых для провокации ишемии миокарда [25]. В ходе исследования записывают видеоизображения одного или нескольких сердечных циклов ЛЖ в стандартных ультразвуковых позициях в фиксированных точках протокола (покой - каждая ступень нагрузки - отдых) [26]. Полученные «клипы» одинаковых позиций на разных этапах исследования сопоставляют между собой и выполняют посегментный анализ сократимости [24]. Ухудшение сократимости на фоне стресс-теста при исходной нормокинезии может свидетельствовать о наличии ишемии миокарда [7]. Выраженность диссинергии оценивается в баллах в зависимости от ее выраженности (нормокинезия - 1, гипокинезия - 2, акинезия - 3, дискинезия - 4) [22]. На основе полуколичественной оценки кинетики миокарда в баллах может быть рассчитан интегральный индекс нарушения локальной сократимости (отношение суммы баллов к количеству оценивавшихся сегментов миокарда), который в норме составляет 1,0. Его увеличение на фоне нагрузочной пробы свидетельствует о развитии диссинергии миокарда, которая может быть вызвана ишемическими изменениями [21]. Данное диагностическое исследование может выполняться в учреждениях, соответствующих определенным требованиям: наличие специально обученного персонала с достаточным опытом проведения ЭхоКГ и нагрузочных проб, ультразвуковой аппаратуры, имеющей программу для стресс-ЭхоКГ, аппаратуры для дозированного применения нагрузки (велоэргометр, тредмил) [21]. Чувствительность стресс-ЭхоКГ с физической нагрузкой в диагностике ИБС, по данным ряда исследований, составляет 80-85%, а специфичность - 80-88% [2]. В то же время нельзя не отметить и ряд недостатков стресс-ЭхоКГ. К ним относится зависимость точности оценки кинетики стенок ЛЖ и степени их утолщения в систолу от качества визуализации эндокарда. В связи с этим возможны трудности при интерпретации пробы у лиц, страдающих эмфиземой легких, ожирением, а также имеющим структурные изменения грудной клетки [21]. Для решения данной проблемы используются специальные контрастные вещества [2, 27]. Согласно современным рекомендациям контрастная стресс-ЭхоКГ должна выполняться в тех случаях, когда два или более соседних сегмента ЛЖ плохо визуализируются в покое [28]. Имеются также данные о том, что применение контраста во время стресс-ЭхоКГ повышает точность диагностики ИБС [29]. К недостаткам стресс-ЭхоКГ также относится полуколичественный подход к оценке локальной сократимости миокарда (табл. 2), поэтому на результаты оказывает влияние субъективный фактор опыта и внимания врача, выполняющего исследование [26]. Частично проблема субъективности ЭхоКГ-анализа региональной кинетики миокарда может быть решена с помощью тканевой допплерографии, позволяющей рассчитать для отдельных сегментов ЛЖ значения скорости движения, скорости деформации (strain rate) и деформации (strain) миокарда [30, 31]. Имеются данные в пользу высокой информативности стресс-ЭхоКГ, дополненной тканевой допплерографией [32, 33, 34]. В то же время тканевая допплерография миокарда имеет свои ограничения: ее результаты зависят от угла сканирования, погрешность в измерения вносят смещение соседних участков миокарда и движения всего сердца [22, 35]. В последние годы изучаются возможности применения для количественной оценки кинетики миокарда при стресс-ЭхоКГ анализа деформации миокарда на основе методики спекл-трекинг (speckle-tracking) [36, 37]. Данная методика не является допплерографической и поэтому лишена указанных для тканевой допплерографии недостатков [38]. Однако унифицированные нормативы оценки локальной сократимости миокарда с помощью спекл-трекинга на сегодняшний день отсутствуют [22]. Магнитно-резонансная томография (МРТ) сердца с нагрузкой Для диагностики ИБС, в частности выявления нарушений кинетики миокарда, обусловленных ишемией, может использоваться МРТ сердца с фармакологической нагрузкой [19]. Нагрузочная МРТ (или стресс-МРТ) с добутамином основана на тех же принципах оценки сократительного резерва, что и стресс-ЭхоКГ, и проводится по аналогичному протоколу [39]. В то же время нагрузочная МРТ имеет свои преимущества - высокое пространственное разрешение и хорошую воспроизводимость [20]. Стресс-МРТ может рассматриваться в качестве альтернативного диагностического метода у лиц с некачественной визуализацией сердца при ЭхоКГ [19]. Противопоказаниями к выполнению МРТ сердца являются наличие у пациента клаустрофобии или присутствие в его организме инородных металлических объектов [39]. Методы радиоизотопной диагностики Важную роль в обследовании пациентов с коронарной патологией играют радиоизотопные методы - перфузионная сцинтиграфия миокарда, однофотонная эмиссионная компьютерная томография (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ) [40]. В ходе таких исследований внутривенно вводится радиофармпрепарат (РФП), который с током крови поступает по коронарным сосудам в миокард [41]. Регионы миокарда без нарушения кровоснабжения идентифицируются по равномерному распределению РФП, в то время как зоны ишемизированного миокарда и участки рубцовой ткани характеризуются снижением включения РФП в виде дефектов перфузии [25]. Для оценки перфузии миокарда с помощью ОФЭКТ используются РФП на основе 99mТс и хлорид таллия 201Tl [42]. Совмещение исследования с нагрузочной пробой позволяет у больных с ИБС выявить зоны гипоперфузии, обусловленные снижением захвата изотопа во время нагрузки, по сравнению с его захватом в покое на фоне нарушения коронарного кровообращения [2]. Для анализа зон кровоснабжения миокарда КА разработана унифицированная схема деления ЛЖ на сегменты в виде мишени [25], позволяющая сопоставлять локализацию выявленных нарушений перфузии с результатами других методов визуализации (нарушения сократимости миокарда при стресс-ЭхоКГ) [22]. На данной схеме верхушка ЛЖ расположена в центре, а его основание (базальные сегменты) - по периферии (см. рисунок). РФП, используемые для ПЭТ-визуализации (18F-FDG), дают возможность оценивать метаболизм миокарда [43]. Дополнительно ПЭТ позволяет количественно характеризовать кровоток в мл/мин/г миокарда, что способствует выявлению микрососудистых нарушений [44]. Техническим преимуществом ПЭТ перед ОФЭКТ является более высокая разрешающая способность и коррекция ослабления фотонного излучения мягкими тканями [2]. Однако ПЭТ как более дорогой метод визуализации, чем ОФЭКТ, значительно реже используется для диагностики ИБС. Применение ультракороткоживущих изотопов также является ограничением распространения ПЭТ в клинической практике [39]. Совершенствование технологий лучевой диагностики способствовало появлению гибридных технологий визуализации [45, 46]. Внедрение гибридных сканеров, которые сочетают ОФЭКТ или ПЭТ с компьютерной томографией - КТ (ОФЭКТ/КТ, ПЭТ/КТ) или МРТ (ПЭТ/МРТ) может дать дополнительные возможности для комплексной оценки структурных и функциональных изменений сердца у пациентов с коронарной патологией [2]. Клинический выбор методов ССВ для первичной диагностики ИБС Результаты многочисленных исследований свидетельствуют о высокой точности методов ССВ (табл. 3), поэтому потенциально каждый из них может быть использован в диагностике ИБС [2]. Таблица 3. Характеристики методик, используемых для диагностики ИБС [2] Методика Чувствительность, % Специфичность, % Стресс-ЭКГ с физической нагрузкой 45-50 85-90 Стресс-ЭхоКГ с физической нагрузкой 80-85 80-88 Стресс-ЭхоКГ с добутамином 79-83 82-86 Стресс-МРТ с добутамином 79-88 81-91 Стресс-ОФЭКТ с физической нагрузкой 73-92 63-87 Стресс-ОФЭКТ с вазодилататором 90-91 75-84 Стресс-ПЭТ с вазодилататором 81-97 74-91 МСКТ КА 95-99 64-83 Таблица 4. Клиническая ПТВ у пациентов со стабильным болевым синдромом в грудной клетке [2] Возраст Типичная стенокардия Атипичная стенокардия Неангинозная боль Мужчины Женщины Мужчины Женщины Мужчины Женщины 30-39 59 28 29 10 18 5 40-49 69 37 38 14 25 8 50-59 77 47 49 20 34 12 60-69 84 58 59 28 44 17 70-79 89 68 69 37 54 24 Более 80 93 76 78 47 65 32 Таблица 5. Показания для диагностики ИБС с помощью методов ССВ [47] Методы визуализации Бессимптомный пациент (скрининг) Симптомный пациент Низкая ПТВ85% КАГ IIIA IIIA IIbA IA Контрастная МСКТ КА IIIB IIIC IIaB IIIB СтрессЭхоКГ IIIA IIIA IA IIIA Стресс-МРТ IIIB IIIC IA IIIB Стресс-ОФЭКТ IIIA IIIA IA IIIA Стресс-ПЭТ IIIB IIIC IA IIIB Комбинированная или гибридная визуализация IIIC IIIC IIaB IIIB В то же время такие характеристики, как чувствительность и специфичность, не всегда позволяют точно определить, как данный метод диагностики будет работать в конкретной клинической ситуации. В этой связи получил распространение подход к выбору диагностики ИБС на основе так называемой предтестовой вероятности (ПТВ) [2, 47]. Основными детерминантами ПТВ являются возраст, пол и характеристика симптомов (табл. 4), позволяющие охарактеризовать сердечно-сосудистый риск и клинические особенности у данного пациента [48]. Результаты исследований свидетельствуют о том, что чувствительность и специфичность методов ССВ, которые применяются в настоящее время, составляют около 85% (табл. 3). Поэтому их результаты в 15% случаев могут быть ложными. Отсюда следует, что уменьшить количество неправильных заключений можно в том случае, если не выполнять методы визуализации у лиц с низкой ПТВ85% [2]. Поэтому в европейских рекомендациях указано, что применение методов ССВ для диагностики ИБС у этих категорий пациентов нецелесообразно [2, 47]. В случае ПТВ85% наоборот - что имеется гемодинамически значимое стенотическое поражение коронарного русла. Лицам с высокой ПТВ показано выполнение КАГ (табл. 5). Лицам с ПТВ 15-65% для диагностики ИБС в качестве метода 1-го ряда рационально использовать ЭКГ-нагрузочную пробу [2]. Стресс-методики визуализации рекомендуются в качестве начального метода диагностики ИБС при промежуточной ПТВ [47] (табл. 5), преимущественно с ПТВ 65-85% [2]. Исключение составляют лица без типичной стенокардии со сниженной сократимостью ЛЖ (фракция выброса менее 50%), которым также показано выполнение данных диагностических тестов [2]. Дополнительным показанием к назначению методов ССВ для диагностики ИБС могут быть изменения на ЭКГ, которые затрудняют интерпретацию во время нагрузки (исходные изменения реполяризации при гипертрофии ЛЖ, полная блокада левой ножки предсердно-желудочкового пучка, электролитные расстройства, действие лекарственных средств и др.) [26]. При выборе нагрузки для стресс-теста с визуализацией следует отдавать предпочтение физической, а не фармакологической нагрузке [2]. Диагностические возможности методов ССВ у больных с верифицированной ИБС Методы ССВ находят применение и у лиц с верифицированной ИБС. Согласно европейским рекомендациям метод визуализации, совмещенный с нагрузочной пробой, может использоваться для функциональной оценки стенозов КА, выраженность которых по данным КАГ определена как промежуточная [2]. Кроме того, стресс-методики визуализации целесообразно выполнять лицам, перенесшим операцию реваскуляризации миокарда, с наличием клинической симптоматики ИБС [2]. Еще одним важным направлением применения диагностических методов у больных с ИБС является идентификация особых обратимых форм ишемической дисфункции миокарда - гибернации и станнирования [49], которые обозначают термином «жизнеспособный миокард» [50]. Принципы, лежащие в основе неинвазивной диагностики жизнеспособного миокарда с помощью разных методов ССВ, представлены в табл. 6. Дифференцирование участков обратимой ишемической дисфункции миокарда от рубцовой ткани имеет важное практическое значение для планирования лечебных мероприятий [51]. Согласно европейским рекомендациям реваскуляризация миокарда у больных с ИБС, у которых фракция выброса ЛЖ
Читайте также:
