Тотальный аномальный дренаж легочных вен. Гемодинамика при аномальном дренаже легочных вен.
Добавил пользователь Skiper Обновлено: 07.01.2026
Обязательным компонентом порока является ДМЖП и смещение клапанного аппарата трехстворчатого клапана в полость левого желудочка.
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Маленькие размеры правого желудочка.
- Передняя створка трикуспидального клапана пересекает МЖП во время диастолы.
- Визуализация эхосигналов от клапанного аппарата трикуспидального клапана в полости левого желудочка.
- Перерыв эхосигнала от межжелудочковой перегородки.
- Дилатация левого желудочка и левого предсердия.
Двухмерная эхоКГ:
- Гипоплазия полости правого желудочка.
- Смещение правого атриовентрикулярного кольца и подклапанного аппарата в левый желудочек.
- Непосредственная визуализация дефекта межжелудочковой перегородки.
- Выявление сопутствующих аномалий.
Допплер-эхоКГ:
- Оценка состояния легочного кровотока.
- Оценка величины систолического градиента между желудочками.
Дифференциальный диагноз:
Открытый общий атриовентрикулярный канал.
Аномальный дренаж легочных вен (АДЛВ)
- А. Частичный АДЛВ - одна или две легочные вены впадают в правое предсердие или системные вены (рис.87). Этому пороку всегда сопутствует ДМПП.
- Б. Тотальный АДЛВ - 4 легочные вены впадают либо в правое предсердие или, что чаще, в общий коллектор (камеру), располагающуюся позади левого предсердия впадает в коронарный синус, левую безымянную вену или портальную вену (рис.88).
Тотальный
аномальный дренаж
легочных вен
в коронарный синус.
Дефект
межпредсердной
перегородки (схема).
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Объемная перегрузка правого желудочка.
- Парадоксальное движение межжелудочковой перегородки.
- Увеличение экскурсии трикуспидального клапана.
- Малые размеры левого предсердия.
- Уменьшенный или нормальный размер левого желудочка.
- Эхосвободное пространство позади левого предсердия.
Двухмерная эхоКГ:
- Визуализация дефекта межпредсердной перегородки или открытого овального окна.
- Прямая визуализация общей легочной венозной камеры в виде эхосвободного пространства позади левого предсердия.
Допплер эхоКГ:
- Обнаружение турбулентного потока через межпредсердную перегородку.
- Большая А-волна и дополнительная позитивная волна между пиками S и D на допплеровской кривой трикуспидального клапана.
- При аномальном дренаже легочных вен в верхнюю полую вену допплеровская кривая в этом сосуде имеет увеличенную S волну, в нижней полой вене регистрируется нормальный поток крови.
- При аномальном дренаже в нижнюю полую вену допплеровская кривая в этом сосуде имеет задержку S волны, в верхней полой вене регистрируется нормальный поток крови.
Дифференциальный диагноз:
- Аномальный дренаж легочных вен должен быть заподозрен, когда величина лево-правого сброса через межпредсердный дефект не соответствует маленькому левому предсердию.
- Идиопатическая аневризма правого предсердия.
- Веноокклюзивная болезнь легочных сосудов.
- Трехпредсердное сердце.
Трехпредсердное сердце
Дополнительная камера в левом предсердии, разделяющая его полость на две части: полость, принимающую легочные вены и собственно полость левого предсердия (рис.89).
Трехпредсердное
сердце.
Вторичный дефект
межпредсердной
перегородки (схема).
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Дилатация правого желудочка.
- ЭхоКГ-паттерн легочной гипертензии.
- Нормальный ЭхоКГ-паттерн митрального клапана (дифференциальный признак от надклапанного митрального кольца).
- Уменьшение полости левого желудочка.
Двухмерная ЭхоКГ:
- Фибромышечная перегородка в левом предсердии, разделяющая полость на две неравные части.
- ЭхоКГ-паттерн легочной гипертензии (см).
Допплер эхоКГ:
- Оценка степени стеноза отверстия, соединяющего две камеры левого предсердия.
- Оценка легочной гемодинамики.
Дифференциальный диагноз:
- Надклапанное митральное кольцо.
- Тотальный аномальный дренаж легочных вен.
- Опухоль левого предсердия.
Врожденная аневризма левого предсердия
Врожденный дефект, проявляющийся аневризматической дилатацией левого предсердия без заболеваний левого желудочка или митрального клапана (рис.90).
Врожденная
аневризма левого
предсердия.
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Выраженная дилатация переднезаднего размера левого предсердия.
- Нормальный ЭхоКГ-паттерн митрального клапана (может быть пролапс митрального клапана).
Двухмерная ЭхоКГ:
- Большое объемное образование, связанное с левым предсердием.
- Может быть сдавление стенки левого желудочка аневризматическим телом.
- Изменение позиции камер сердца из-за смещения их объемным образованием.
Допплер-ЭхоКГ:
- Оценка запирательной функции митрального клапана.
- Оценка легочной гемодинамики.
Дифференциальный диагноз:
- Врожденная недостаточность митрального клапана.
- Митральный стеноз.
- Рестриктивная кардиомиопатия.
- Гипертрофическая кардиомиопатия с маленькой полостью левого желудочка.
Открытый артериальный проток
Проток отходит от аорты на уровне левой подключичной артерии и впадает в ствол легочной артерии в месте его деления на две ветви (рис.91).
Открытый
артериальный проток
(схема).
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Дилатация левого желудочка.
- Объемная перегрузка левого желудочка.
- Дилатация левого предсердия (увеличение отношения диаметра левого предсердия к диаметру аорты).
- Объемная перегрузка левого предсердия.
Двухмерная ЭхоКГ:
Прямая визуализация протока из надгрудинного доступа в виде эхосвободного пространства между нисходящей аортой и легочной артерией.
Открытый
артериальный
проток.
Допплер-ЭхоКГ:
- Диастолический турбулентный поток в легочной артерии.
- Реверсия диастолического потока в нисходящей аорте.
Дифференциальный диагноз:
- Дефект аортолегочной перегородки.
- Дефект межжелудочковой перегородки с недостаточностью аортального клапана.
- Артериовенозная фистула системная.
- Артериовенозная фистула коронарных сосудов.
- Прорыв синуса Вальсальвы в правое предсердие или правый желудочек.
- Аномальное отхождение левой коронарной артерии от легочной артерии.
Дефект аортолегочной перегородки
Дефект
аортолегочной
перегородки (схема).
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Дилатация левого желудочка.
- Объемная перегрузка левого желудочка.
- Дилатация левого предсердия (увеличение отношения диаметра левого предсердия к диаметру аорты).
- Объемная перегрузка левого предсердия.
Двухмерная ЭхоКГ:
- Непосредственная визуализация перерыва эхосигнала от аортолегочной перегородки из надгрудинного или высокого парастернального доступа в проекции длинной оси.
- Выявление сопутствующих аномалий (наблюдаются в 50% случаев): ОАП, ДМЖП, коарктация аорты, подклапанный стеноз аорты.
- Выявление осложнений порока: легочная гипертензия.
Допплер-ЭхоКГ:
- Диастолический турбулентный поток в легочной артерии.
- Реверсия диастолического потока в нисходящей аорте.
Дифференциальный диагноз:
- Открытый артериальный проток.
- Дефект межжелудочковой перегородки с недостаточностью аортального клапана.
- Артериовенозная фистула системная.
- Артериовенозная фистула коронарных сосудов.
- Прорыв синуса Вальсальвы в правое предсердие или желудочек.
- Аномальное отхождение левой коронарной артерии от легочной артерии.
Врожденный стеноз аорты
Клапанный стеноз
аорты.
Постстенотическая
дилатация
восходящей аорты
(схема).
Стеноз аорты подразделяют на следующие формы:
- Клапанный врожденный стеноз (рис.94).
- Подклапанный аортальный стеноз
- А. дискретный мембранозный стеноз.
- Б. дискретный фибромышечный субаортальный стеноз.
- В. туннельный субаортальный стеноз.
- Надклапанный стеноз аорты.
- Двухстворчатый аортальный клапан со стенозированием.
В 20% случаев врожденному стенозу аорты сопутствуют ОАП, коарктация аорты, ДМЖП, стеноз легочной артерии.
Клапанный врожденный стеноз (см. аортальный клапанный стеноз)
Примечание: если сращены все 3 полулунные створки, то определяется узкое центральное отверстие, при срастании 2-х створок (встречается чаще) отверстие в просвете аорты располагается асимметрично.
Подклапанный стеноз аорты дискретный мембранозный
Сразу под клапаном аорты расположена тонкая фиброзная мембрана (рис.95).
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Частичное раннесистолическое прикрытие аортального клапана.
- Систолическое трепетание аортального клапана.
- Наличие дополнительных сигналов в выходном тракте левого желудочка.
- Сужение выходного тракта левого желудочка.
- Переднесистолическое движение передней митральной створки.
- Гипертрофия левого желудочка.
- Задержка открытия митрального клапана.
Двухмерная ЭхоКГ:
- Фиброзная мембрана сразу под аортальным клапаном, пролабирующая в выходной тракт левого желудочка в диастолу (рис.96).
- Узкий выходной тракт левого желудочка.
Допплер-ЭхоКГ:
- Увеличение пикового систолического потока в восходящей аорте свыше 1,5м/с.
- Наличие систолического градиента (свыше 5 мм рт.ст.).
Подклапанный
перимембранозный
стеноз аорты.
Дифференциальный диагноз:
- Асимметричная гипертрофическая кардиомиопатия с обструкцией выходного тракта левого желудочка (идиопатический гипертрофический субаортальный стеноз): при дискретном стенозе обычно наблюдается частичное раннесистолическое прикрытие аортального клапана (в среднем через 0,05 с), при ИГСС - среднесистолическое (в среднем через 0,14 с от момента открытия аортального клапана)
Подклапанный стеноз аорты дискретный фибромышечный
Образован фиброзномышечным кольцом, обычно локализуется более дистально от аортального клапана, чем при дискретном мембранозном стенозе, приблизительно 1 см и более.
ЭхоКГ критерии
Одномерная ЭхоКГ:
Те же признаки, что и при дискретном мембранозном стенозе.
Двухмерная ЭхоКГ:
- Визуализация туннельного сужения выходного тракта левого желудочка за счет фибромышечного кольца (рис.97-98).
- Двухстворчатый аортальный клапан (наблюдается в 70% случаев).
Подклапанный стеноз
аорты дискретный
фибромышечный:
туннельное сужение
выходного тракта
левого желудочка
за счет
фибромышечного
кольца.
Подклапанный
дискретный
фибромышечный
стеноз аорты.
Допплер-ЭхоКГ:
Те же признаки, что и при дискретном мембранозном стенозе аорты.
Дифференциальный диагноз:
- Гипертрофическая кардиомиопатия.
- Эктопическое крепление трабекулы в выходном тракте левого желудочка.
Надклапанный стеноз аорты
Выделяют три типа:
1) мембранозный (фиброзная диафрагма непосредственно над аортальными створками),
2) типа песочных часов
3) гипоплазия восходящей аорты (сужение на протяжении восходящей аорты сразу над устьями коронарных артерий) (рис.99).
Надклапанный
стеноз аорты.
Мембранозный надклапанный стеноз аорты
Двухмерная ЭхоКГ:
- Непосредственная визуализация мембраны над аортальными створками с центрально расположенным отверстием.
- Симметричная гипертрофия левого желудочка.
- Фиброэластоз эндокарда (развивается вторично к дефициту коронарного кровотока).
Допплер-ЭхоКГ:
- Систолический поток выше места сужения превышает 1,5 м/с.
- Систолический градиент свыше 5 мм рт. ст.
Дифференциальный диагноз:
ИГСС (подклапанный мышечный стеноз при надклапанном стенозе аорты может развиться вторично из-за компенсаторной гипертрофии перегородки).
Надклапанный стеноз аорты типа песочных часов (рис.100)
Надклапанный стеноз
аорты типа песочных
часов.
Двухмерная ЭхоКГ:
- Обнаружение сужения восходящей аорты типа песочных часов. Характерно, что диаметр постстенотической аорты нормальный или даже уменьшенный, но не дилатированный.
- Симметричная гипертрофия левого желудочка.
- Фиброэластоз эндокарда.
Допплер-ЭхоКГ:
Те же признаки, что и при мембранозном надклапанном стенозе аорты.
Гипоплазия восходящей аорты
Двухмерная эхоКГ:
- Непосредственная визуализация сужения восходящей аорты сразу над коронарными створками.
- Симметричная гипертрофия левого желудочка
- Фиброэластоз эндокарда.
Допплер-ЭхоКГ:
Те же признаки, что и при мембранозном надклапанном стенозе аорты.
Примечание: Надклапанные стенозы аорты нередко сочетаются с синдромом Вильямса (лицо "Эльфа").
Тотальный аномальный дренаж легочных вен
Слово «аномальный» означает «неправильный». При этом пороке легочные вены (а их четыре), которые должны впадать в левое предсердие, в него не впадают, т.е. не соединяются с ним. Вариантов их неправильного впадения достаточно много.
Бывает «частичный» аномальный дренаж – это когда одна или две из четырех вен впадают в правое предсердие (наиболее частый вариант), и в подавляющем большинстве случаев он сочетается с дефектами межпредсердной перегородки, и мы говорили об этом в главе о ДМПП.
Полный или тотальный аномальный дренаж легочных вен (ТАДЛВ) — это совсем другое. При этом пороке все четыре легочные вены от обоих легких соединяются в один широкий сосуд-коллектор. Этот коллектор окисленной в легких артериальной крови не срастается с левым предсердием, как должно быть, а соединяется с венозной системой организма, обычно через большую вену. Артериальная кровь, таким образом, минуя сердце, попадает в большие вены и в правое предсердие. Только здесь, пройдя через дефект межпредсердной перегородки она окажется там, где ей надо быть изначально – в левом предсердии, и дальше совершает обычный путь по большому кругу кровообращения. Представить себе, что такое вообще может быть, трудно. Но дети с этим пороком рождаются доношенными, а сердце некоторое время справляется с такой ситуацией. Однако это время может быть очень коротким.
Во-вторых, в этой левой половине сердца значительная часть крови — просто венозная, т.е. неокисленная, и она снова будет нагнетаться в большой круг. У ребенка, таким образом, в артериях начинает циркулировать частично венозная кровь, и он становится «синим», т.е. цвет кожи, а особенно — кончиков пальцев и слизистых (губ, рта) — синюшный. Это — цианоз, и о его причинах, проявлениях и последствиях позже поговорим особо.
При полном аномальном дренаже цианоз может быть не очень выражен, но он есть, и это, как правило, заметно вскоре после рождения.
В большей части случаев состояние детей с полным аномальным дренажем легочных вен оказывается «критическим» с самого начала жизни. Если ничего не предпринимать, то они погибнут уже через несколько дней или месяцев.
Хирургическое лечение существует, и результаты сегодня вполне обнадеживающие. Операция достаточно сложная, выполняется на открытом сердце и заключается в том, что общий коллектор легочных вен сшивается с левым предсердием, а отверстие в медпредсердной перегородке закрывают заплаткой. Таким образом после операции восстанавливается нормальное кровообращение по двум разделенным кругам .
Иногда допустим и экстренный вариант — расширение дефекта при зондировании в качестве первого, жизнеспасающего этапа, который позволяет несколько отсрочить основное вмешательство.
Мы не станем касаться здесь многих деталей, связанных с различными видами порока и методов его исправления. Но хотим только подчеркнуть, что дети с этим пороком нуждаются в немедленной специализированной помощи, которая сегодня совершенно реальна.
Отдаленные результаты операции достаточно хорошие — ведь основной порок устранен. Однако дети должны быть под наблюдением кардиологов потому, что возможны осложнения в виде нарушений ритма или сужения легочных вен в местах наложения швов (это происходит из-за того, что сердце, перенесшее такую большую операцию, продолжает расти). И снова хотим подчеркнуть: этот ребенок — не инвалид. Он должен вести абсолютно нормальный образ жизни, и чем раньше сделана операция, тем быстрее все забудется.
Особенности легочного кровотока и системной гемодинамики у пациентов с тотальным аномальным дренажем легочных вен
Настоящий обзор посвящен вопросам гемодинамики при тотальном аномальном дренаже легочных вен. Отражены особенности строения легочного венозного возврата, легочной и системной гемодинамики при различных типах порока, механизмы формирования обструкции. Показаны основные диагностические проблемы и задачи, в том числе на пренатальном уровне. Обсуждены принципы, результаты и нерешенные вопросы хирургического лечения порока, требующие дальнейшего изучения.
Ключевые слова
Об авторах
Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр имени В. А. Алмазова» Министерства здравоохранения Российской Федерации
Россия
Морозов Александр Александрович – кандидат медицинских наук, кардиохирург
197341, Санкт-Петербург, ул. Аккуратова, д. 2
Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Детская городская больница № 1»; Федеральное государственное бюджетное образовательное учреждение высшего образования «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Министерства здравоохранения Российской Федерации
Россия
Мовсесян Рубен Рудольфович – доктор медицинских наук, профессор, член-корреспондент РАН, заведующий отделением кардиохирургии ДГБ № 1 Санкт-Петербурга, профессор кафедры педиатрии и детской кардиологии СЗГМУ им. И. И. Мечникова, главный детский кардиохирург Комитета по здравоохранению Санкт-Петербурга
198205, Санкт-Петербург, ул. Авангардная, д. 14 , лит. А, 195067, Санкт-Петербург, Пискаревский пр., д. 47
Список литературы
1. Laux D, Fermont L, Bajolle F et al. Prenatal diagnosis of isolated total anomalous pulmonary venous connection: a series of 10 cases. Ultrasound Obstet Gynecol. 2013;41:291– 297. Doi: 10.1002/uog.11186.
2. Ross FJ, Joffe D, Latham GJ. Perioperative and Anesthetic Considerations in Total Anomalous Pulmonary Venous Connection Seminars in Cardiothoracic and Vascular Anesthesia. 2017;21(2):138–144. Doi: 10.1177/1089253216672012. Epub 2016 Sep 29.
3. Darling RC, Rothney WB, Craig JM. Total pulmonary venous drainage into the right side of the heart: report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab Invest. 1957;6:44–64.
4. Sinzobahamvya N, Arenz C, Brecher AM et al. Early and long-term results for correction of total anomalous pulmonary venous drainage (TAPVD) in neonates and infants. Eur J Cardiothorac Surg.1996;10:433–438.
6. Padalino MA, Cavalli G, De Franceschi M et al. Surgical outcomes of total anomalous pulmonary venous connection repair: a 22-year experience. J Card Surg. 2014;29:678–685. Doi: 10.1111/jocs.12399.
7. Seale AN, Uemura H, Webber SA et al. Total anomalous pulmonary venous connection: morphology and outcome from an international population-based study. Circulation. 2010;122:2718–2726. Doi: 10.1161/CIRCULATIONAHA.110.940825. Epub 2010 Dec 6.
8. Chowdhury UK, Airan B, Malhotra A et al. Mixed total anomalous pulmonary venous connection: anatomic variations, surgical approach, techniques, and results. J Thorac Cardiovasc Surg. 2008;135:106–116. Doi: 10.1016/j.jtcvs.2007.08.028.
9. Hancock Friesen CL, Zurakowski D, Thiagarajan RR et al. Total anomalous pulmonary venous connection: an analysis of current management strategies in a single institution. Ann Thorac Surg. 2005;79:596–606. Doi: 10.1016/j.athoracsur.2004.07.005.
10. Haworth SG, Reid L. Structural study of pulmonary circulation and of heart in total anomalous pulmonary venous return in early infancy. British Heart Journal. 1977;39:80–92. Doi: 10.1136/hrt.39.1.80.
13. Hlavacek AM, Shirali GS, Anderson RH. Pulmonary venous abnormalities. In: Anderson RH, Baker EJ, Redington A, Rigby ML, Penny D, Wernovsky G, editors. Paediatric Cardiology. London: Churchill Livingstone; 2009:497–522.
14. Kalantre AA, Champaneri B, Kottayil B, Vaidyanathan B. «Hemodynamic vice» of the right-sided ascending vertical vein in the setting of supracardiac total anomalous pulmonary venous connection in a neonate: Anatomic-embryological correlation. Ann Pediatr Cardiol. 2017;10(1):104–106. Doi: 10.4103/0974-2069.187091.
15. Kirklin JW, Barrat-Boyes BG. Total anomalous pulmonary venous connection. In: Kirklin JW, Barrat-Boyes BG. Cardiac surgery. N-Y: John Wiley and Sons, 1986;499–523.
16. Whight CM, Barrat-Boyes BG, Calder AL et al. Total anomalous pulmonary venous connection. Long-term results following repair in infancy. J Thorac Cardiovasc Surg. 1978; 75:52–63.
18. Graham TP Jr, Jarmanki JM, Canent RVJr. Left heart volume characteristics with a right ventricular volume overload: total anomalous pulmonary venous connection and large atrial septal defect. Circulation. 1972;45:389–396. Doi: 10.1161/01.CIR.45.2.389.
20. Bove KE, Geiser EA, Meyer RA. The left ventricle in anomalous pulmonary venous return: morphometric analysis of 36 fatal cases in infancy. Arch Pathol. 1975;99:522–528.
22. Misumi H, Imai Y, Ishihara K et al. Pre and postoperative left ventricular volume and function in infants and children with total anomalouspulmonary venous return. Kyobu geka. The Japanese journal of thoracic surgery. 1993;46(11):926–930.
26. Seale AN, Carvalho JS, Gardiner HM et al. Total anomalous pulmonary venous connection: impact of prenatal diagnosis. Ultrasound Obstet Gynecol 2012;40:310–318. Doi: 10.1002/uog.11093. Epub 2012 Aug 9.
27. Tongsong T, Luewan S, Jatavan P et al. A Simple Rule for Prenatal Diagnosis of total anomalous pulmonary venous return. J Ultrasound Med. 2016;35:1601–1607. Doi: 10.7863/ultra.15.08016. Epub 2016 Jun 7.
28. Kim TH, Kim YM, Suh CH. et al. Helical CT angiography and three-dimensional reconstruction of total anomalous pulmonary venous connections in neonates and infants. AJR Am J Roentgenol. 2000;175(5):1381–1386. Doi: 10.2214/ajr.175.5.1751381.
29. Shen Q, Pa M, Hu X, Wang J. Role of plain radiography and CT angiography in the evaluation of obstructed total anomalous pulmonary venous connection. Pediatr Radiol. 2013;43(7):827–835. Doi: 10.1007/s00247-012-2609-6. Epub 2013 Jan 23.
30. Miller WW, Rashkind WJ, Miller RA. et al. Total anomalous pulmonary venous return: effective palliation of critically ill infants by balloon atrial septostomy. Circulation. 1967; Suppl. II 35–36:189.
31. Bu’Lock FA, Jordan SC, Martin RP. Successful balloon dilatation of ascending vein stenosis in obstructed supracardiac total anomalous pulmonary venous connection. Pediatr Cardiol. 1994;15(2):78–80. Doi: 10.1007/BF00817612.
33. Kilgore A, Lucas V, Collins T, Snyder CS. Stent implantation as a stabilization technique in supracardiac total anomalous pulmonary venous connection. Catheter Cardiovasc Interv. 2006;68:629–631. Doi: 10.1002/ccd.20705.
34. Lo-A-Njoe SM, Blom NA, Bokenkamp R, Ottenkamp J. Stenting of the vertical vein in obstructed total anomalous pulmonary venous return as rescue procedure in a neonate. Catheter Cardiovasc Interv. 2006;67:668–670. Doi: 10.1002/ccd.20715.
35. Rothman A, Galindo A, Evans WN. Temporary Transumbilical Stenting of the Ductus Venosus in Neonates with Obstructed Infradiaphragmatic Total Anomalous Pulmonary Venous Return. Pediatr Cardiol. 2011;32:87–90. Doi: 10.1007/s00246-010-9810-x. Epub 2010 Oct 12.
36. Muller WH Jr. The surgical treatment of transposition of the pulmonary veins. Ann Surg. 1951;134(4):683–693.
37. Shumacker HBJr, King H. A modifed procedure for complete repair of total anomalous pulmonary venous drainage. Surg Gynecol Obstet. 1961;112:763.
38. Williams GR, Richardson WR, Campbell GS. Repair of total anomalous pulmonary venous drainage in infancy. J Thoraс Cardiovasc Surg. 1964;47:199–204.
41. Seale AN, Uemura H, Webber SA et al. Total anomalous pulmonary venous connection: outcome of postoperative pulmonary venous obstruction. J Thorac Cardiovasc Surg. 2013;145:1255–1262. Doi: 10.1016/j.jtcvs.2012.06.031. Epub 2012 Aug 11.
42. Lacour-Gayet F, Rey C, Planché C. Pulmonary vein stenosis. Description of a sutureless surgical procedure using the pericardium in situ. Arch Mal Coeur Vaiss. 1996;89(5):633–636.
43. Lacour-Gayet F, Zoghbi J, Serraf AE. et al. Surgical management of progressive pulmonary venous obstruction after repair of total anomalous pulmonary venous connection. J Thorac Cardiovasc Surg. 1999;117(4):679–887. Doi: 10.1016/S0022-5223(99)70287-4.
44. Yun TJ, Coles JG, Konstantinov IE et al. Conventional and sutureless techniques for management of the pulmonary veins: Evolution of indications from postrepair pulmonary vein stenosis to primary pulmonary vein anomalies. J Thorac Cardiovasc Surg. 2005;129(1):167–174. Doi: 10.1016/j.jtcvs.2004.08.043.
Тотальный аномальный дренаж легочных вен. Гемодинамика при аномальном дренаже легочных вен.
Тотальный аномальный дренаж легочных вен. Гемодинамика при аномальном дренаже легочных вен.
Частота порока составляет 0,06 на 1000 живорожденных, около 1,5% среди всех ВПС, около 1,5% среди критических ВПС. Порок нередко сочетается с другими врожденными патологиями (общее предсердие, единственный желудочек, аномалии положения сердца, экстракардиальные пороки развития).
Анатомия аномального дренажа легочных вен. Варианты соединения легочных вен с правыми отделами могут быть весьма разнообразными. Столь же многочисленны классификации порока, основывающиеся на его эмбриологических, анатомических, гемодинамических характеристиках.
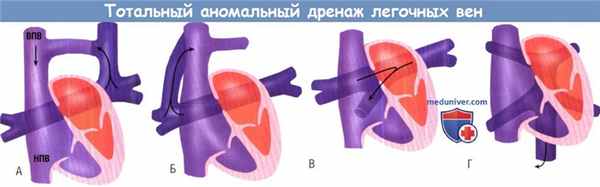
Анатомические варианты тотального аномального дренажа легочных вен:
супракардиальный вариант, при котором легочные вены дренируются либо через вертикальную вену (А),
либо непосредственно в верхнюю полую вену (ВПВ) с расположением устья коллектора вблизи устья непарной вены (Б).
(В) Кардиальный вариант дренирования через коронарный синус в правое предсердие.
(Г) Инфракардиальный вариант дренирования, осуществляемый через вертикальную вену в воротную вену или нижнюю полую вену (НПВ).
При тотальном аномальном дренаже легочных вен большое значение имеют анатомические обструкции, определяющие физиологию, клинику и прогноз порока. Они могут иметь место на уровне самих коллекторов, на уровне межпредсердной перегородки или быть связаны с внешними сдавлениями. К последним относятся обструкции в месте впадения в верхнюю полую вену, при прохождении коллектора между левой легочной артерией и левым бронхом или правой легочной артерией и трахеей, на уровне диафрагмы, печеночных синусоидов или венозного протока. Нарушения оттока из легочных вен могут встречаться при любом типе дренажа, однако в 80% случаев они сопровождают инфракардиальный тип.
Фетальная ЭхоКГ при аномальном дренаже легочных вен. Так как визуализация аномальных легочных вен у плода представляет значительные трудности, пренатальное выявление порока — чрезвычайная редкость. Опорными моментами диагностики могут быть увеличение правых отделов сердца относительно левых и легочной артерии относительно аорты, нарастающие со сроком гестации. На ранних сроках увеличение правых отделов сопровождает преимущественно супракардиальный вариант порока. Если коллектор легочных вен впадает в нижнюю полую вену, то благодаря евстахиевой заслонке значительная часть крови все равно перенаправляется в левое предсердие и дилатация правых отделов возникает только в поздние сроки беременности. Аналогичная картина наблюдается при большом ДМПП. Для исключения диагноза ТАДЛВ необходимо выявить, используя цветное доплеровское картирование, хотя бы одну легочную вену, впадающую в левое предсердие.
Тотальный аномальный дренаж легочных вен. Гемодинамика при аномальном дренаже легочных вен.
Корниенко Н.А. 1 Чаплыгина Е.В. 1 Каплунова О.А. 1 Корниенко А.А. 2 Каракозова Е.А. 1 Балышев О.О. 1 Марайкин В.О. 1
2 ГБУ РО «Ростовская областная клиническая больница», отделение хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции»
Знание развития легочных вен облегчает понимание морфофункциональных особенностей пациентов с различными формами транспозиции легочных вен, механизмов формирования обструкции легочного венозного кровотока и нарушения гемодинамики, что актуально для совершенствования лечения и повышения качества жизни пациентов. Цель работы – на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий. На основании изучения данных литературы систематизированы имеющиеся сведения об аномалиях развития легочных вен, уточнены основные этапы развития легочных вен в антенатальном периоде развития. Процесс, в котором недифференцированная спланхническая легочная сеть консолидирует в легочные вены, объясняет большинство их вариантов и аномалий. Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития – от незаращения овального отверстия до сложных пороков развития, включающих аномальный дренаж легочных вен, когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.
1. Чаплыгина Е.В., Корниенко Н.А., Каплунова О.А., Корниенко А.А. Особенности анатомического строения задненижнего отдела правого предсердия у людей различных конституциональных типов // Морфология. 2013. Т. 144. № 6. С. 33-36.
4. Eidem B.W., Cetta F., O′Leary P.W. Echocardiography in Pediatric and Adult Congenital Heart Disease. Philadelphia, 2009. 500 p.
5. Русаков Д.Ю., Вологдина Н.Н., Тулаева О.Н. Развитие исчерченной сердечной мышечной ткани в стенках полых и легочных вен // Журнал анатомии и гистопатологии. 2015. Т. 4. № 3. С. 105-105. DOI: 10.18499/2225-7357-2015-4-3-105-105.
7. Farmer C.G. Evolution of the vertebrate cardio-pulmonary system. Annu Rev Physiol. 1999. Vol. 61. P. 573–592. DOI: 10.1146/annurev.physiol.61.1.573.
8. Van den Berg G., Moorman A.F.M. Development of the Pulmonary Vein and the Systemic Venous Sinus: An Interactive 3D Overview. PLoS One. 2011. Vol. 6. no 7. Р. e22055. DOI: 10.1371/journal.pone.0022055.
9. Ho M.-L., Bhalla S., Bierhals A., Gutierrez F. MDCT of partial anomalous pulmonary venous return (PAPVR) in adults. Journal of Thoracic Imaging. 2009. Vol. 24. no 2. P. 89-95. DOI: 10.1097/RTI.Ob013e318194c942.
10. Kirklin J.W., Barratt-Boyes B.G. Total anomalous pulmonary venous connection. In Kirklin J.W., Barratt-Boyes B.G. (eds). Cardiac Surgery. Fourth Edition. Saunders. 2013. P. 1182-1208.
11. Haghigh Z.O., Sadeghpour A., Alizadehasl A. Isolated right sided anomalous pulmonary venous connection associated with significant right ventricular enlargement and intact interatrial septum. J. Cardiovasc Thorac Res. 2012. Vol. 4. no 4. P. 123-124. DOI: 10.5681/jcvtr.2012.029.
12. Podzolkov V.P., Chiaureli M.R., Kovalev D.V., Zaets S.B. Repair of isolated partial anomalous pulmonary venous connection of the right upper pulmonary veins to the left vertical vein. Interactive CardioVascular and Thoracic Surgery. 2016. Vol. 23. no 3. P. 501-502. DOI: 10.1093/icvts/ivw151.
14. Клинические рекомендации. Тотальный аномальный дренаж легочных вен. МКБ 10: Q26.2. Ассоциация сердечно-сосудистых хирургов России. 2016.
15. Клинические рекомендации: Частичный аномальный дренаж легочных вен (ЧАДЛВ), МКБ 10: Q26.3. Ассоциация сердечно-сосудистых хирургов России. 2016.
16. Schmiady M., Valsangiacomo-Buechel E., Hübler M., Dave H. Significance of preoperative imaging in children with total anomalous pulmonary venous connection. European Heart Journal. 2017. Vol. 38. Is. 26. P. 2040. DOI: 10.1093/eurheart/ehw515.
17. Graig J.M., Darling R.C., Rothney W.B. Total pulmonary venous drainage into the right side of the heart: report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab. Invest. 1957. Vol. 6 (1). P. 44-64.
18. Купряшов А.А. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен. В кн.: Бокерия Л.А., Шаталов К.В. (ред.). Детская кардиохирургия: руководство для врачей. ФГБУ "НМИЦССХ им. А. Н. Бакулева" МЗ РФ, 2016. С. 294-312.
19. Бокерия Л.А., Беришвили Д.О., Нефедова И.Е., Баринштейн Д.Б., Степаничева О.А. Хирургическая коррекция транспозиции магистральных артерий с тотальным дренажем легочных вен в портальную вену // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2019. Т. 20. № 1. С. 77-80. DOI: 10.24022/1810-0694-2019-20-1-77-80.
20. Абдуллаев Ф.З., Багиров И.М., Казимзаде Н.Дж., Шихиева Л.С., Байрамов Р.Б., Рустамова Я.К., Самедов Р.Р. Коррекция тотального аномального дренажа легочных вен у взрослых больных // Кардиология и сердечно-сосудистая хирургия. 2015. № 6. С. 74-79. DOI: 10.17116/kardio20158674-79.
Известно, что в структуре общей заболеваемости и смертности в мире доминируют сердечно-сосудистые заболевания. Врожденные пороки развития по частоте занимают 4-е место среди причин летальности у детей до 5 лет, составляя при этом 13%. Появление высокотехнологичных диагностических методов, таких как компьютерная и магнитно-резонансная томография, электроанатомическое картирование, расширило возможности не только клиницистов, но и морфологов [1, 2].
Наряду с лечением приобретенных нарушений работы сердечно-сосудистой системы современная кардиология все большее внимание уделяет диагностике и лечению врожденных пороков развития сердца и сосудов. Одним из методов лечения является транспозиция легочных вен, когда легочные вены имеют атипичное расположение и место впадения [3].
Несмотря на единичные работы, посвященные развитию исчерченной сердечной мышечной ткани в стенках легочных вен [4, 5], нет работ, систематизирующих сведения о развитии и аномалиях легочных вен.
Цель работы – на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий.
Известно, что во время раннего эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения, связанного с передними кардинальными и желточно-брыжеечными венами, но не связанного с сердцем (рис. 1) [6].
Выпячивание левого предсердия соединяется с сосудистым руслом легких общей легочной веной. Общая легочная вена, также называемая легочным венозным коллектором, полностью соединяется с нижним отделом левого предсердия в течение первого месяца внутриутробного периода развития. При присоединении легочной вены связи спланхнического сплетения исчезают. Легочная вена, вначале единая, делится на две вены – левую и правую легочные вены. В свою очередь, обе эти вены делятся на две ветви, предназначенные для каждой половины легких, так что потом в левое предсердие впадают четыре самостоятельные легочные вены.
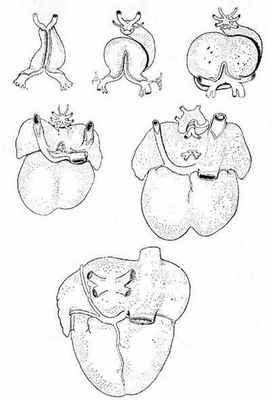
Рис. 1. Шесть стадий развития сердца, отражающих изменение отношений венозного синуса и впадающих в сердце крупных вен; вид сзади [6]
Известны основные принципы развития легочных вен. На ранних эмбриональных стадиях развития имеется сосудистое сплетение, окружающее первичную кишку. Одновременно с образованием дыхательной системы из выпячивания первичной кишки, от общего сосудистого сплетения отделяются отток венозной крови от органов пищеварительной системы и отток от органов дыхательной системы [7].
Филогенетически легочные вены возникают как самостоятельные сосуды, отводящие кровь из зачатков легких [4]. Они сходятся в общий ствол, несущий кровь в левое предсердие с дорзальной стороны. По мере роста сердца этот ствол постепенно врастает в стенку предсердия, а из четырех его притоков образуются легочные вены.
В период эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения [4], которое не имеет связи с сердцем, однако соединяется с передними кардинальными и желточно-брыжеечными венами (рис. 2А).
По данным B.W. Eidem et al. [4], выпячивание левого предсердия соединяется с сосудистым руслом легких легочным венозным коллектором (общей легочной веной), который полностью соединяется с левым предсердием в течение первого месяца внутриутробного периода развития (рис. 2Б). При этом присоединении связи спланхнического сплетения, т.е. кардинальных и желточно-брыжеечных вен, с предсердием исчезают (рис. 2С). Легочная вена, вначале единая, делится на парные легочные вены (рис. 2Д). Эти вены также делятся на две ветви, каждая из них самостоятельно впадает в левое предсердие. Аномалии количества легочных вен проявляются их уменьшением до трех или двух или появлением добавочных легочных вен с нормальным или аномальным дренажом [3].
Исторически предметом дискуссий является связь между легочной веной и системными венозными притоками. Широко обсуждался вопрос: становится ли легочная вена непосредственно связанной с левым предсердием? Выполненные Van den Berg [8] исследования показали, как развивается легочная вена при отделении от большого венозного сплетения, расположенного в мезодерме спланхноплевры и простирающегося от сердца к печени, что предполагает развитие венозного полюса сердца и возникновение клинических проявлений аномального дренажа легочных вен (АДЛВ). Системные венозные притоки, напротив, развиваются латерально на стыке между висцеральной и соматической мезодермой из мезенхимы, окружающей общие кардинальные вены. Концепция Van den Berg [8] формирования легочной вены из этого большого спланхнического сплетения предлагает полезную информацию о развитии венозного полюса сердца, клинических проявлениях аномального легочного венозного возврата и проливает свет на эволюционные аспекты развития сердца.
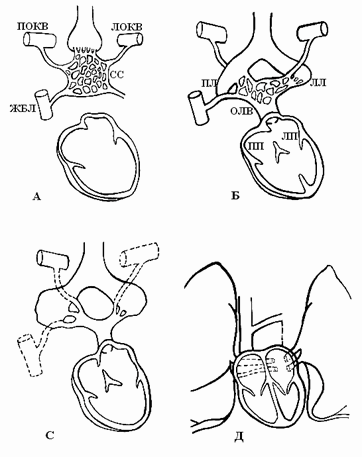
Рис. 2. Развитие легочных вен [4]. ЛОКВ – левая общая кардинальная вена, ПОКВ – правая общая кардинальная вена, ЖБВ – желточно-брыжеечная вена, ОЛВ – общая легочная вена, ЛП – левое предсердие, СС – спланхническое сплетение, ЛЛ, ПЛ – зачатки левого и правого легких
Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития – от незаращения овального отверстия до сложных пороков развития, включающих АДЛВ [9], когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие.
При формировании АДЛВ левые легочные вены соединяются с левой плечеголовной веной, венечным синусом, развивающимися из левой кардинальной вены [10, 11], а правые – с полыми венами или с правым предсердием. Спланхническое сплетение располагается по центру эмбриона, что объясняет возможность оттока крови от легких слева или справа в систему правой кардинальной вены. Наиболее часто такой аномальный сброс формируется от верхних долей легких [10, 12].
При АДЛВ наблюдаются увеличение легочного кровотока и перегрузка правой половины сердца [13]. АДЛВ может также входить в состав комбинированных пороков сердца [6].
АДЛВ может быть тотальным (ТАДЛВ) или частичным (ЧАДЛВ). При ТАДЛВ все легочные вены впадают в другие вены или в правое предсердие [4, 14, 15]. Развитие ТАДЛВ связано с нехваткой выпячивания легочных вен от задней поверхности левого предсердия для соединения с легочно-венозным сплетением, окружающим легочные ростки. За небольшим исключением обязательным компонентом, позволяющим поддерживать гемодинамику при ТАДЛВ, являются дефект межпредсердной перегородки или открытое овальное окно [13].
Выделяют 4 формы ТАДЛВ [4]: 1) кардиальная форма – легочной венозный коллектор впадает в венечный синус сердца или в правое предсердие (рис. 3-1); 2) подкардиальная форма – легочной венозный коллектор впадает в нижнюю полую вену (рис. 3-2); 3) надкардиальная форма – легочные вены впадают в коллектор, а он – в левую плечеголовную вену (рис. 3-3); 4) смешанная форма – два легочных венозных коллектора впадают в правое предсердие или в полые вены.
Помимо этого, каждая из анатомических форм ТАДЛВ с различной частотой встречаемости может сопровождаться обструкцией легочного венозного возврата, что оказывает решающее влияние на состояние гемодинамики и клинические проявления порока< [15]. ТАДЛВ составляет 1,5–3% случаев в общей структуре аномалий развития сердца [10]. ТАДЛВ редко встречается у людей старше 18–20 лет, что связано с высокой частотой смертности в раннем детстве (50% детей погибают в первые 3 месяца и более 80% – к концу первого года жизни ребенка) [15].
Данный порок формируется посредством атрезии справа или слева крупной ветви общего легочного сплетения [9].
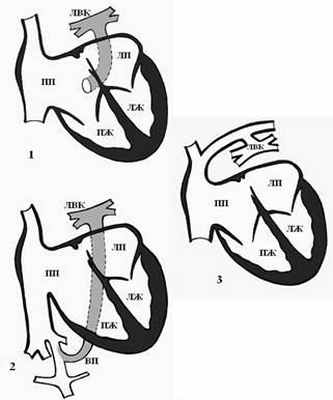
Рис. 3. Формы тотального аномального дренажа легочных вен [4]: 1 – кардиальная форма – в венечный синус, 2 – подкардиальная форма – в нижнюю полую вену, 3 – надкардиальная форма – в левую плечеголовную вену. ЛВК – легочный венозный коллектор, ЛПВ – левая плечеголовная вена, ВПВ – верхняя полая вена, ВП – венозный проток, ПП – правое предсердие, ПЖ – правый желудочек, ЛП – левое предсердие, ЛЖ – левый желудочек
Легочные вены могут впадать в правое предсердие, венечный синус, притоки полых вен [14, 15]. По данным различных исследователей, частота встречаемости ЧАДЛВ колеблется от 0,7% до 9,4% и составляет около 2/3 всех случаев аномального дренажа легочных вен [12, 16]. Половина пациентов с изолированным ЧАДЛВ способны дожить до 30–40 лет [12].
При ЧАДЛВ в функциональном аспекте принципиальны анатомические особенности левой части сердца. Такие изменения, естественно, отражаются на состоянии системной гемодинамики, что вызывает снижение размеров левого предсердия [10, 11].
Наиболее распространенной классификацией ЧАДЛВ является классификация R.S. Darling et al. [17], в основе которой, как и при ТАДЛВ, лежит анатомический принцип уровня впадения легочных вен. Выделяют четыре типа порока:1) супракардиальный, когда легочные вены впадают в левую безымянную, верхнюю полую вены или в одну из их ветвей; 2) кардиальный – дренирование всех или части легочных вен в полость правого предсердия; 3) инфракардиальный – часть легочных вен впадает в венозный сосуд, расположенный ниже сердца; 4) смешанный.
Пациентам с подозрением на ЧАДЛВ показано выполнение МРТ для оценки анатомических особенностей легочных вен, особенно при неубедительных результатах ЭхоКГ [18].
Катетеризация сердца с ангиографией показана при подозрении на легочную гипертензию или для выявления сопутствующих аномалий сердца [18, 19].
Единственным способом устранения ТАДЛВ является ее кардиохирургическая коррекция [19, 20]. Несмотря на современные достижения в области хирургической техники, не существует универсального подхода к выбору оптимальной хирургической коррекции сложных вариантов аномального дренажа легочных вен [3, 13, 19]. Общая хирургическая летальность при изолированном ТАДЛВ достигает 16% [15], летальность при коррекции ЧАДЛВ не превышает 1–2% [3]. Основным осложнением и основной причиной повторной операции в хирургии ТАДЛВ является возникновение легочной венозной обструкции [3].
Заключение. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.
Читайте также:
