Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Ферменты, или энзимы — это специфические белки, которые в организме человека выполняют роль биокатализаторов. Другими словами, ферменты являются универсальными помощниками, которые способны ускорять все биохимические реакции нашего с Вами организма, сами при этом не вступая в химическое взаимодействие.
Для чего это надо? Всё гениальное просто! Дело в том, что наш организм представляет собой сложную высокоорганизованную биологическую систему, в нём единовременно протекают сотни биохимических реакций. Эти процессы весьма сложны и сами по себе проходить не могут. Именно тогда и начинают действовать ферменты. Они помогают той или иной реакции протекать в нужной последовательности, которая заложена в нас природой. Основное место их пребывания — это различные клетки нашего организма.
У здорового человека ферментативный состав сыворотки крови относительно постоянный, при заболевании уровень ферментов значительно повышается, так как происходит повреждение клеточной стенки и высвобождение их в системный кровоток.
Исследование ферментативного состава крови применяют во врачебной практике для решения различного рода задач. Они могут быть связаны с установлением предварительного и заключительного диагноза, для проведения дифференциальной диагностики, оценки тяжести заболевания, определения эффективности подобранной терапии, прогноза на выздоровление.
Основной функцией, которая имеет огромнейшее значение, является избирательность действия ферментов, т.е. один вид ускоряет только одну, «свою» реакцию. Врачи научились определять, какие ферменты изменяются при той или иной патологии. Рассмотрим наиболее часто определяемые ферменты сыворотки крови.
Аспартатаминотрансфераза (АСТ).
Данный фермент располагается почти во всех клетках организма, однако излюбленным местом его локализации являются сердце, печень, меньше его в почках и мышцах. У здоровых людей уровень АСТ в крови незначительный. При появлении симптомов заболевания печени или сердца он проникает в кровь, в связи с чем повышение в сыворотке этого фермента является отличным показателем патологии данных органов.
Наиболее высокие показатели (до 100 раз превышающие норму) могут быть при заболеваниях, для которых характерна массивная гибель клеток печени: инфекционных вирусных гепатитах, токсических поражениях печени. Значительное увеличение его также отмечается при онкологии печени, метастазах, циррозе. Повышение уровня АСТ может наблюдаться при сепсисе и септических состояниях. Особенно большие значения встречаются при остром инфаркте миокарда, при хирургических операциях на сердце.
Приём некоторых лекарственных препаратов, обладающих токсичным действием на печень, тоже может вызвать увеличение показателя.
Снижение концентрации аспартатаминотрансферазы в сыворотки крови встречается редко и особого диагностического значения не имеет.
Аланинаминотрансфераза (АЛТ).
Вторым ферментом после АСТ, по частоте назначения врачом, следует АЛТ или аланинаминотрансфераза. Этот энзим встречается во многих клетках нашего организма, но наибольшая концентрация его определяется в клетках печени, почках, в меньшем количестве — в сердце, поджелудочной железе и скелетной мускулатуре.
Концентрация АСТ в сыворотки крови здоровых людей невелика, у мужчин уровень фермента несколько больше, чем у женщин. Однако при повреждении или гибели клеток, которые богаты этим ферментом, например, печени или почки, происходит резкое увеличение, так сказать, «выброс» АЛТ в кровеносную систему. Это будет чётко отображаться в крови при биохимическом исследовании фермента.
Так как АЛТ реагирует на повреждение органов наиболее быстро, намного быстрее, чем пациент пожалуется на болезненные ощущения врачу, его активно используют для ранней диагностики заболевания.
Исследование сыворотки крови на АЛТ, врач обычно назначает при острых и хронических состояниях органов брюшной полости, при онкологической патологии. Прием лекарственных препаратов, обладающим токсическим действием на клетки печени, употребление алкоголя, наркотических веществ также могут многократно повысить уровень АЛТ. Так как данный фермент не обладает особо выраженной специфичностью, то увеличение концентрации АЛТ не всегда отображает повреждения только печени, а может быть связано с заболеванием других органов.
Также нужно знать, что при проведении некоторых медицинских манипуляциях (внутримышечные инъекции), при активной физической нагрузке, может увеличиваться активность АЛТ в крови.
Некоторые пациенты активно применяют БАДы (биологически активные добавки), как следствие — повышение концентрации АЛТ. Нужно упомянуть и про любителей фастфуда: при постоянном систематическом употреблении жирной пищи уровень «печёночных» ферментов увеличивается. Поэтому рекомендовано перед сдачей анализа на АЛТ, АСТ и др. воздержаться от приёма таких продуктов.
Лактатдегидрогеназа (ЛДГ).
Лактатдегидрогеназа (ЛДГ) представляет собой цинксодержащий фермент, который участвует процессе окисления молочной кислоты. Этот фермент достаточно распространён в наше организме, его можно встретить в почечной ткани, в сердце, в скелетной мускулатуре и, конечно, в печени.
В организме здорового человека встречаются пять разных форм — изоферментов. Они отличаются по химическому строению, расположению в организме. В зависимости от преобладающей формы обмена веществ в органе — анаэробный (бескислородный) или аэробный (с присутствием кислорода), можно определить ту или иную форму ЛДГ. Так, например, сердце, мозг, почки, где преобладает аэробный обмен веществ, находятся изоферменты ЛДГ1 и ЛДГ2, а в печени и в скелетной мускулатуре -изоферменты ЛДГ4 и ЛДГ5. Таким образом, зная какой изофермент преобладает в сыворотке крови, можно на ранних стадиях выявить заболевание.
При болезнях, связанных с повреждением и разрушением клеток, уровень ЛДГ в крови увеличивается. Однако, несмотря на то, что повышение концентрации фермента не указывает на конкретную патологию (болезнь), определение его совместно с другими биохимическими показателями помогает в диагностике инфаркта миокарда, мышечной дистрофии и др.
Увеличение концентрации ЛДГ в сыворотке крови может определяться и при некоторых физиологических состояниях: у новорождённых детей, беременных женщин, а также при активном занятии спортом.
Повышение концентрации лактатдегидрогеназы в сыворотке крови может наблюдаться:
- при сердечно-сосудистых заболеваниях (инфаркт миокарда, ИБС, миокардит и др.);
- при патологии системы кроветворения, при которых возможно спонтанное разрушение эритроцитов (гемолиз), встречается при гемолитической, мегалобластической, серповидно-клеточной анемиях, эритремиях;
- при онкологии различной локализации (рак печени, лимфома, лейкозы, рак поджелудочной железы, метастазы);
- при заболеваниях печени (вирусные, острые и хронические гепатиты, цирроз печени);
- при болезнях почек (инфаркт почки, хронический и острый гломерулонефрит);
- при патологии скелетной мускулатуры и костной системы (мышечная дистрофия и атрофия, различные травмы, ушибы, разрывы мышц, переломы костей различных отделов).
Гамма-глютамилтранспептидаза (у-ГТП).
Гамма-глютамилтранспептидаза – это фермент, который определяется в мембранах клеток печени и желчевыводящих путей, он способен ускорять ряд биохимический реакций. В крови уровень y-ГТП незначителен. Увеличение его концентрации в крови происходит вследствие разрушения клеток. Однако нужно знать, что в норме происходит самообновление клеток, поэтому невысокая постоянная концентрация его в сыворотке крови является нормой. Если разрушается большое количество клеток, что не физиологично, тогда активность фермента может возрастать многократно.
Исследование крови на y-ГТП – это один из самых чувствительных тестов в отношении непроходимости желчевыводящих путей и застоя желчи (холестаза). Концентрация y-ГТП в сыворотке крови при застойных явлениях, связанных с нарушением оттока желчи, например, наличии камней в желчновыводящих протоках, увеличивается на много раньше, чем активность других ферментов.
Определение активности только у-ГТП не даёт полной картины патологии печени или желчного пузыря и его протоков. Для постановки диагноза необходимо назначение определения уровня других ферментов, которые участвуют в обмене веществ и находятся в печени. Также нужно учитывать особенности организма; у мужчин уровень у-ГТП выше, чем у женщин, приём лекарственных препаратов, употребление жирной пищи и алкоголя может активизировать образование этого фермента.
у-ГТП можно определить не только в печени и в желчевыводящих путях, он также определяется и в других органах, например, в поджелудочной железе, простате, почках. Следует учитывать, что многообразие механизмов увеличения концентрации у-ГТП требует очень внимательной и тщательной трактовки причин гиперферментемии (повышение концентрации ферментов в крови). Выявление увеличения активности у-ГТП вынуждает искать причину этого состояния. Таким образом, как тест, который способен «отсеивать» и помогает наблюдать за течением известного патологического процесса, биохимическое исследование сыворотки крови на активность у-ГТП просто незаменимо в клинической диагностике.
Повышение уровня у-ГТП в основном определяют при подозрении на:
- внутри- и внепеченочный застой желчи (холестаз);
- заболевание печени (острый вирусный гепатит и хронический гепатит, токсическое воздействие на печень (прием алкоголя, наркотиков);
- острые и хронические панкреатиты (воспаление поджелудочной железы);
- инфекционный мононуклеоз;
- гормональные заболевания (гипертиреоидизм, сахарный диабет);
- патология почек (острый и обострение хронического гломерулонефрита, хроническая почечная недостаточность, острый и хронический пиелонефрит);
- онкология различной локализации (рак поджелудочной железы, простаты, печени) и её метастазы;
- хроническая алкогольная и наркотическая зависимость.
Снижение уровня у-ГТП в основном диагностического значения не имеет.
Щелочная фосфатаза.
Щелочная фосфатаза (ЩФ) — это фермент сыворотки крови, который широко представлен в тканях человека. Наибольшее его количество содержится в слизистой кишечника, остеобластах (молодых клеток кости, которые образуют межклеточное вещество или матрикс), стенках желчных протоков, в плаценте и у кормящих матерей в лактирующей молочной железе.
Фермент локализуется вне клетки, а точнее на её мембране и участвует в транспорте фосфора.
Щелочную фосфатазу костной ткани образуют остеобласты, которые лежат на поверхности костного «скелета» (матрикса) в месте, где интенсивно формируется кость. Благодаря тому, что фермент располагается вне клетки, в процессе отложения солей кальция (кальцификации) можно отследить прямую связь между болезнью кости и увеличением количества щелочной фосфатазы в крови. Соответственно, в детском возрасте концентрация этого фермента увеличивается до полового созревания, а у пожилых людей активность щелочной фосфатазы наоборот снижается.
Активность щелочной фосфатазы печени чаще всего увеличивается из-за повреждения клеток печени (гепатоцитов) или вследствие нарушения оттока желчи.
При разрушении гепатоцитов повышение концентрации щелочной фосфатазы (ЩФ) занимает ведущую роль в качестве диагностического маркера при диагностике вирусных, аутоиммунных гепатитов, а также при токсическом повреждениях печени. Транспорт желчи нарушается, как правило, вследствие закупорки желчных протоков (например, желчном камне), сужении или стазе печёночных протоков, разрушении желчных протоков при циррозе печени или нарушения оттока желчи в мелких желчновыводящих протоках, которое может развиться при приёме лекарственных препаратов.
Иногда активность щелочной фосфатазы увеличивается при одновременном воздействии нескольких механизмов повреждения.
Концентрация щелочной фосфатазы, например, при вирусном гепатите, в отличие от АЛТ и АСТ, остаётся в норме или повышается незначительно. Резко повышается её активность при отравлениях токсическими веществами, особенно алкоголем при алкоголизме.
Очень высокая концентрация фермента определяется у женщин с патологией беременности (преэклампсией, эклампсией), что связано с повреждением плаценты. Снижение ее активности может быть причиной недоразвития плаценты.
Причины увеличения концентрации щелочной фосфатазы:
- заболевания печени (цирроз печени, различные гепатиты), желчного пузыря и желчевыводящих путей;
- онкология поджелудочной железы, желудочно-кишечного тракта (ЖКТ), печени, а также метастазы других органов в печень;
- инфекционный мононуклеоз;
- поражение костной ткани (рахит, болезнь Педжета, рак кости (остеосаркома), метастазы в кость, остеомаляция – патологическое размягчение кости, вызванное недостаточным поступлением кальция;
- гормональные заболевания, например, гиперпаратиреоз – это гормональное заболевание, которое связанно с повышенным образованием паратгормона, вследствие чего из кости «вымывается» кальций;
- заболевания желудочно-кишечного тракта (язвенный колит, болезнь Крона, другая патология кишечника).
Снижения уровня активности фермента может наблюдаться при тяжёлых формах анемий, при массивной гемотрансфузии (переливании крови), заболеваниях щитовидной железы, при некоторых врожденных болезнях, связанных с усвоением кальция и фосфора, а также при патологии беременности.
Альфа-амилаза.
Альфа-амилаза (α-амилаза, alpha amylase) — фермент пищеварения, который ускоряет расщепление сложных углеводов (крахмала, гликогена) до мономеров, т.е. более простых химических соединений (мальтозы, глюкозы). Больше всего в организме человека амилазы содержится в поджелудочной и слюнных железах. Соответственно в сыворотке крови человека определяется а-амилаза двух видов: панкреатическая (Р-тип), которая синтезируется поджелудочной железой, и слюнная амилаза (S-тип) — слюнными железами.
Определение концентрации и степени активности а-амилазы в сыворотке крови имеет важное клинико-диагностическое значение. Так, увеличение активности а-амилазы в 2 и более раза можно расценивать как симптом поражения ткани поджелудочной железы. Относительно небольшое увеличение концентрации фермента в сыворотке даёт основание предположить появление патологии поджелудочной железы, однако такое состояние может быть связано и с воспалительными процессами других органов.
Так как источником а-амилазы P-типа является только поджелудочная железа, то определение активности панкреатической амилазы в сыворотке крови является органоспецифическим тестом.
В свою очередь а-амилаза S-типа может образовываться во многих органах. Помимо слюнных желёз определить её активность можно в слезе, амниотической жидкости, яичках и др.
Определение а-амилазы имеет важное клинико-диагностическое значение в диагностике и мониторинге острых и обострении хронических панкреатитов. Тем не менее, повышенная концентрация уровня а-амилазы в сыворотке крови может присутствовать не только при панкреатитах (воспаление поджелудочной железы), но также и при почечной недостаточности, при воспалительных и онкологических заболеваниях легких, слюнных желез.
Итак, увеличение а-амилазы в крови наблюдается при следующих состояниях:
- заболевания поджелудочной железы (острый и хронический панкреатит);
- заболевания, связанные с нарушением оттока панкреатического сока (закупорка протока опухолью, камнем, спайками);
- доброкачественными (киста поджелудочной железы) и злокачественными опухолями;
- инфекционными заболеваниями (эпидемический паротит или «свинка»);
- после хирургических вмешательств;
- при патологии лёгких;
- при заболеваниях слюнных желез и др.
Снижение а-амилазы встречается редко и чаще всего связано с хирургическим удалением либо всей поджелудочной железы, либо её части.
Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.
Лактатдегидрогеназа (ЛДГ) общая – внутриклеточный гликолитический фермент, который участвует в обратимом превращении лактата в пируват и содержится в большинстве тканей организма.
Синонимы русские
Дегидрогеназа молочной кислоты.
Синонимы английские
Lactate dehydrogenase, Total, Lactic dehydrogenase, LDH, LD.
Метод исследования
УФ кинетический тест.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Лактатдегидрогеназа (ЛДГ) – цинксодержащий внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
Существует пять разных форм (изоферментов) ЛДГ, которые отличаются молекулярной структурой и расположением в организме. От того, какая из пяти преобладает, зависит основной способ окисления глюкозы – аэробный (до CO2 и H2O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью родства того или иного изофермента и пировиноградной кислоты. Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ-1 и ЛДГ-2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Изоферментная активность в скелетных мышцах (в порядке убывания): ЛДГ-5, ЛДГ-4, ЛДГ-3. Для печени наиболее характерен изофермент ЛДГ-5, меньшая активность у ЛДГ-4. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5.
При заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается. В связи с этим она является важным маркером тканевой деструкции. Несмотря на то что увеличение активности фермента не указывает на какую-то определенную болезнь, его определение в комплексе с другими лабораторными анализами помогает в диагностике инфаркта легкого, мышечной дистрофии и гемолитической анемии. Повышенная активность ЛДГ может выявляться у новорождённых, беременных и после интенсивных физических нагрузок.
При дифференциальной диагностике миопатий данный анализ помогает уточнить патофизиологические механизмы заболевания. Так, при нарушении мышечной функции, связанной с нейрогенными заболеваниями, ЛДГ не повышается, но при повреждении мышц из-за эндокринных и метаболических патологий активность ЛДГ увеличивается.
Активность ЛДГ в крови может возрастать вследствие многих злокачественных новообразований, при эффективном лечении она снижается, что иногда применяют для динамического наблюдения за онкологическими больными.
Инфаркт миокарда
Остается открытым вопрос своевременной постановки диагноза - ведь именно от этого зависит начало эффективных лечебных мер. Для того, чтобы определить наличие инфаркта, используется ряд методик, включая оценку клинической картины, инструментальные и лабораторные методы.
Клиническая картина патологии
Симптомы инфаркта могут быть разнообразными. Первый и главный признак - давящая боль за грудиной, которая имеет сжимающий характер, нередко пациент отмечают, что она жгучая и очень интенсивная. Боль возникает на высоте эмоционального напряжения или физической нагрузки. Её резкое возникновение приводит к общей слабости, перебоям в дыхании.
Кроме боли могут наблюдаться следующие симптомы:
- тошнота;
- потеря сознания;
- слабость;
- повышенная потливость;
- бледность.
Боль, как правило, локализуется за грудиной, но может иррадиировать в левую руку, плечо, межлопаточную область, челюсть, верхнюю часть живота. Это зависит от локализации некроза.
Различают клинические формы инфаркта:
- Астматическая. У пациента наблюдается сухой кашель, одышка, боль в груди.
- Абдоминальная. Боль размещена в верхней части живота, наблюдается сильная тошнота.
- Аритмическая. Наблюдается сбой сердечного ритма, слабость, кратковременная потеря сознания.
- Церебральная. У пациента появляются жалобы на выраженную головную боль.
Есть бессимптомные формы инфаркта, они наблюдаются при сахарном диабете, а также у пациентов, которые злоупотребляют алкоголем. В таком случае может наблюдаться общая слабость и нарушения сознания, но нет типичной боли, которая характерна для инфаркта.
Современные методы диагностики
Если возникли подозрения на счет инфаркта, есть анамнестические данные про ишемическую болезнь сердца и характерные клинические признаки, врач назначает диагностическую программу. Она состоит из таких методов:
- электрокардиограмма;
- лабораторная диагностика.
Рассмотрим подробнее данные методы исследования.
Электрокардиограмма представляет собой графическое изображение проведения импульса по волокнам миокарда. Если за счет некроза проводимость нарушена - это отобразится на записи. По изменениям на ЭКГ можно различить локализацию зоны некроза. Также, на графике можно увидеть фазу инфаркта - острую или подострую.
Общий анализ крови
В общем анализе крови не наблюдается специфических изменений и поэтому на его основе нельзя выставить диагноз. При инфаркте развивается лейкоцитоз, который возникает через несколько часов после начала процесса и достигает максимума к концу суток. Повышенный показатель удерживается несколько дней и постепенно возвращается к норме. Лейкоциты не повышаются сильно, как, например, при инфекционной патологии, что позволяет провести дифференциальную диагностику. Это важно при атипичной клинической картине инфаркта миокарда, когда врач может подозревать несколько патологий. В общем анализе крови можно также увидеть повышенный показатель СОЭ, который остается таким на протяжении нескольких недель. Повышаются и эозинофилы, они остаются повышенными около недели.
Биохимический анализ крови
1. Аланинаминотрансфераза (АЛТ)
Показатель разрушения гепатоцитов и кардиомиоцитов. Повышается при гепатитах различной этиологии, инфаркте, токсических поражениях внутренних органов. АЛТ - это активный компонент обмена веществ в печени, фермент, который ускоряет метаболизм аминокислот. Наибольшая концентрация вещества находится в клетках печени, почек, сердца, а также в скелетной мышечной ткани. Так как его локализация - цитоплазма, в кровь он выходит при разрушении клеточной мембраны. Чем массивнее участок разрушения, тем выше концентрация фермента в крови. Пик активности фермента при инфаркте - 12 часов.
Повышение или нормализация уровня АЛТ - маркер состояния пациентов различного профиля с заболеваниями внутренних органов и мягких тканей. В зависимости от заболевания АЛТ может повышаться умеренно или остро, например, наивысшая степень концентрации наблюдается при гепатитах.
При инфаркте применяется коэффициент де Ритиса, который состоит из сопоставления активности АСТ и АЛТ. Если показатель превышает норму, это говорит об инфаркте, а если ниже её значения - возможно развился некроз почечной ткани или активная фаза гепатита. Естественно, на основании показателя АЛТ не происходит постановка диагноза. Для этого применяются более специфические маркеры. Уровень трансаминаз проверяют в общем биохимическом анализе, для дифференциальной диагностики и контроля общего состояния пациента.
2. Аспартатаминотрансфераза (АСТ)
Маркер состояния тканей сердца, печени. Повышается при вирусных гепатитах, токсических поражениях тканей сердца и гепатоцитов. применяется также при профилактическом обследовании, при необходимости подтвердить или исключить инфаркт. Это вещество ответственно за обмен аминокислот в клетках, поэтому наибольшее его количество находится в клетках печени, сердца, скелетных мышцах и эритроцитах. Если клетки данных органов повреждены - происходит выход трансаминазы в кровь, где можно обнаружить её повышение. Есть допустимый уровень фермента в крови, ведь клетки органов периодически разрушаются, но при патологических состояниях этот показатель возрастает в разы и десятки раз. Пик максимальной концентрации в крови - через 12 часов после начала инфаркта. Применяется также сравнение показателей АЛт и АСТ. Каждый из этих ферментов повышается при отдельных патологиях, а при инфаркте оценивается их соотношение. АСТ не является специфическим показателем при инфаркте, он дополняет общую картину лабораторного исследования.
3. Креатинкиназа MB
Это вещество является изоферментом, маркером состояния сердечной мышцы. Принимает участие в метаболизме креатина и креатинфосфата. Это вещество содержится только в миокарде, поэтому повышается при его заболеваниях - миокардитах, инфаркте, рабдомиолизе, перикардитах. Уровень вещества является маркером при острой и подострой фазе процесса. Кратковременное увеличение показателя наблюдается при хирургических вмешательствах на сердце, что отражает реакцию миокарда на лечение. Максимум концентрации при инфаркте наблюдается через 12 часов после начала. Высокая активность говорит о значительном размере участка поражения. Сравнивают повышение данной фракции КФК с общим показателем вещества по организму. В принципе, оценка уровня КФК МВ применяется для ранней диагностики поражения миокарда, а также для дифференциации состояния с другими заболеваниями. Повышение маркера может говорить, кроме инфаркта, о таких состояниях, как шок, отравления и интоксикации, инфекционные поражения тканей сердца.
4. Тропонин I
Белок, который в высоком количестве содержится в скелетных мышцах и миокарде. Существуют разновидности этого белка, которые отвечают за разные фазы сокращения мышц. Все эти белки являются кардиоспецифическими и говорят о состоянии миокарда. Повреждение миоцитов сердца приводит к выходу вещества в кровь, где его можно обнаружить с помощью лабораторного исследования. Площадь некроза влияет на уровень повышения показателя тропонинов в крови. Тропонин I является наиболее чувствительным и специфическим при инфаркте. Повышенный тропонин удерживается в течении 5-6 дней после начала патологического процесса.
5. Миоглобин
Это белок, который находится в мышечных клетках и содержит молекулы железа. Аналогичен по строению с гемоглобином - железосодержащим белком крови. Функция миоглобина также похожа - он транспортирует кислород в миоциты, клетки мышц. При некрозе происходит разрушение мышечных клеток, миоглобин освобождается и попадает в кровоток, где его и можно обнаружить. Белок из крови выводится вместе с почками. Определить его в крови можно уже через несколько часов после начала патологического процесса, в течении 2-3 суток его все еще можно определить. Этот маркер реагирует одним из первых, что повышает его диагностическую ценность. При некротических изменениях он повышается в 7-10 раз, в зависимости от площади участка некроза. Для сравнения, период пикового повышения остальных маркеров - 12 часов, тогда как для миоглобина - 6 часов. Так же быстро происходит и нормализация анализов. Они могут оставаться повышенными дольше суток если наступили осложнения, например, расширение участка некроза. Иногда случаются новые очаги, тогда миоглобин повышается снова, что требует динамического контроля показателя. Важен также отрицательный результат исследования, что, в сопоставлении с клинической картиной позволяет исключить патологию. Кроме инфаркта, миоглобин может говорить о синдроме длительного сдавления. патологии мышц, воспалительных процессов.
Что может влиять на результат?
На результаты анализов влияет время проведения диагностики, которое прошло с момента начала заболевания. Также, изменения зависят от распространенности зоны некроза, локализации процесса. Многие лабораторные показатели, которые наблюдаются при инфаркте, могут сопровождать и другие патологические состояния. К примеру, трансаминазы повышаются при заболеваниях внутренних органов, нарушении функции печени, гепатитах различной этиологии, на фоне употребления алкоголя. Тропонин повышается при воспалительных процессах в миокарде. Креатинкиназа и миоглобин могут колебаться при нарушении структуры мышечной ткани, рабдомиолизе, различных воспалительных процессах, миозитах. Многие их этих показателей остаются повышенными после перенесенного хирургического вмешательства, что следует учитывать при сборе анамнеза у пациента.
Если есть такая возможность, анализ желательно сдавать натощак, перед сдачей крови из вены стоит немного отдохнуть. Хорошо, если до исследования удается исключить употребление алкоголя, никотина и физические нагрузки. Нужно сказать врачу, какие препараты принимались, так как они также могут отразиться на результатах анализов.
Своевременная диагностика инфаркта позволяет вовремя начать лечение. В случае с инфарктом, это особенно важно, так как счет времени идет иногда на часы. Эффективная терапия или хирургическое вмешательство могут продлить жизнь пациента, улучшить её качество и снижают риск осложнений. Необходимо доверять свое здоровье проверенным медицинским учреждениям, где есть условия для точной диагностики за короткий срок.
Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.
Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.
Трансаминазы - ACT и АЛТ - обладают весьма низкой специфичностью и чувствительностью в диагностике ИМ и не рекомендуются к использованию как маркеры ИМ. К примеру, рост ACT часто выявляется и при поражениях печени, и при панкреатитах, и при ТЭЛА, после приема больших доз алкоголя, после внутримышечного введения ЛС. Определение трансаминаз — дешевый метод, но требуется выполнять такие правила: анализ крови должен быть сделан в течение первых 6 ч, а затем в динамике (через 12, 18 и 24 ч).
В этих условиях значительно чаше регистрируется увеличение трансаминаз, имеющее диагностическое значение. Если сделан только один анализ (при поступлении больного в стационар), то его результатам не следует доверять. Надо помнить о том, что выход трансаминаз происходит дискретно, в связи с расширением зоны некроза (который имеет определенный темп нарастания). Так, ACT (ее много в скелетных мышцах) повышается через 6—12 ч, пик наблюдают на 2-е сутки, а нормализацию — в конце 1-й (а то даже и в начале 2-й) недели.
Лактатдегидрогеназа (ЛДГ) также содержится во многих органах (и в немалом количестве). Суммарная ЛДГ (имеется 5 изоэнзимов) — поздний маркер ИМ, она реагирует позже, чем остальные ферменты. Ее определение обычно производят у больных, поздно поступающих в стационар (через 48—72 ч от начала ИМ). Изофермент ЛДГ] (его много в сердце) информативнее, ибо его уровень повышается раньше, чем суммарная ЛДГ, а кроме того, может увеличиваться на фоне ее нормальных значений. Обычно ЛДГ определяют, когда видят, что повышена КФК.
Уже с 4—6-го ч (а иногда и со 2-го ч) инфаркт миокарда на фоне нормальных значений СОЭ начинает появляться лейкоцитоз — обычно до 12—15-10 /л, нередко со сдвигом формулы влево. Уровень лейкоцитоза лучше, чем лихорадка, отражает размеры некротического очага. Высокий лейкоцитоз (более 20-10 /л) — неблагоприятный прогностический признак. Лейкоцитоз обычно сохраняется 3—4 дня и к концу 1-й недели снижается, если нет осложнений. В тяжелых случаях он длится более 10 дней (особенно, если появляются осложнения).
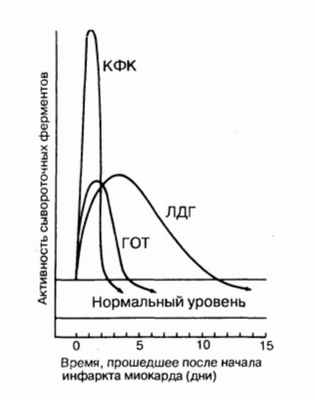
Динамика сывороточных ферментов после типичного инфаркта миокарда.
КФК - креатинфосфокиназа; ЛДГ - лактатдегидрогеназа; ГОТ - глутаматрксалоацетаттрансаминаза.
Со 2-го дня инфаркт миокарда постепенно, медленно начинает повышаться СОЭ (максимум до 30 мм/ч). Пик ее значений отмечается между 12-м днями (к этому времени число лейкоцитов нормализуется — феномен «ножниц»), потом СОЭ нормализуется. Если она превысила 30 мм/ч — «жди осложнений ИМ».
Со 2-го дня инфаркт миокарда (иногда уже через 4—8 ч) начинает увеличиваться и температура тела (как неспецифический ответ на некроз миокарда) до невысоких цифр (37,3—38,0 °С), держится в течение 5—6 дней и нормализуется обычно к 6—10-му дню. Интенсивность лихорадки и ее длительность индивидуальны, зависят от обширности ИМ и реактивности организма в целом. Температурной кривой, характерной для ИМ, нет. Обычно (но не всегда) чем больше зона ИМ, тем выше лихорадка (кроме КШ, когда лихорадки нет).
Появление лихорадки после ангинозного приступа является важным диагностическим симптомом инфаркта миокарда (отличает его от Ст) и должно настораживать врача. Длительное сохранение ее указывает на формирование осложнений ИМ (тромбоэндокардит, затяжное течение).
Сохраняет свое некоторое диагностическое значение и рост показателей острой фазы воспаления — СРП, фибриногена, сиаловых кислот, альфа2- и у-глобулинов.
Для достоверного диагноза инфаркта миокарда необходимо иметь 2 или 3 надежных критерия. Возможны разные комбинации трех ведущих критериев ИМ, поэтому в каждом конкретном варианте необходим свой минимум обследований. ЭКГ-признаки ИМ могут и отсутствовать, поэтому ИМ нужно ставить всегда с учетом динамики клинических симптомов.
Что могут сказать о сердце анализы.
Что такое анализы? Анализы – это подтверждение или исключение того или иного заболевания, о котором сложилось мнение после клинического осмотра пациента. При их помощи врач узнает, что именно мешает вашему организму нормально жить и работать, каково состояние отдельных его органов и систем.
Итак, о чем же говорят эти самые анализы, если появились боли в области сердца. Важное значение в диагностике заболеваний, связанных с повреждением миокарда, имеет определение ферментов, содержащихся внутри клеток. И в зависимости от того какие и сколько клеток гибнет, будут изменяться и их значения.
Показатели биохимического анализа крови:
АЛТ (аланинаминотрансфераза): до 68Е/л, при оценке уровня данного фермента, стоит учитывать, что он содержится не только в миокарде, но в большей степени, в печени, поэтому АСТ и АЛТ всегда определяют вместе, что помогает в разграничении поражения сердца и печени. Сроки повышения АЛТ аналогичные АСТ.
АСТ (аспартатаминотрансфераза): до 45Е/л, данный фермент в большом количестве содержится в миокарде, и его повышение, в большинстве случаев, говорит о повреждении кардиомиоцитов – мышечных клеток сердца; повышение АСТ в сыворотке крови наблюдается при инфаркте миокарда (95-98%) случаев уже через 6-12 часов от начала заболевания. Максимальное возрастание отмечается на 2-4 сутки, и на 5-7 сутки уровень фермента приходит к норме. Имеется четкая зависимость между цифрами АСТ и величиной очага некроза сердечной мышцы. Поэтому при величине некроза менее 5мм диаметром, возможно сохранение уровня этого фермента в пределах нормы, что тоже надо учитывать.
ЛДГ (лактатдегидрогеназа) и составляющие этот показатель фракции: до 250Ед/л, считается специфическим маркером при ОИМ, возрастание активности изофермента ЛДГ1 и ЛДГ2 даже при нормальных показателях общей активности ЛДГ свидетельствует о наличии мелких некрозов в сердечной мышце. При ОИМ ее уровень возрастает быстро на 2-4 сутки, и нормализуется только на 2 –3 неделе. Уровень ЛДГ позволяет получить ценную информацию о ИМ на всем протяжении заболевания. Другие фракции ЛДГ3 и ЛДГ4 – ферменты легочной ткани, ЛДГ5 – печени.
тропонин-тест: до 0,4 мкг/л. Тропонин является специфическим сократительным белком, входящим в структуру сердечной мышцы и мышц скелета. Этот тест является диагностическим маркером при подозрении на острое повреждение клеток миокарда, является одним из ключевых результатов при постановке диагноза «острый инфаркт миокарда»;
миоглобин: 12-92 мкг/л. Белок мышечной ткани, участвующий в процессе дыхания клетки. В случае появления его в крови, расценивается как продукт распада мышечной ткани сердца или скелета, при соответствующей клинике, может указывать на омертвение (некроз) очага мышечной ткани сердца, поэтому тоже считается специфическим маркером этой патологии.
Показатели АЛТ, АСТ, КФК, КФК-МВ, ЛДГ, миоглобина и тропонинового теста тесно корелируют с размерами очага некроза в сердечной мышце, и поэтому имеют не только диагностическое, но и прогностическое значение.
Кислая фосфатаза: 67-167 нмоль/(с·л), повышается в активности у больных с тяжелыми, осложненными ИМ, преимущественно трансмуральными;
С-реактивный белок (СРБ): до 0,5 мг/л, его обнаружение свидетельствует о наличии в организме патологического процесса, в частности воспалительного или некротического. Он относится к белкам так называемой «острой фазы». Резко положительная реакция на СРБ указывает на тяжесть течения воспалительного процесса.
сиаловые кислоты: 2,0-2,36ммоль/л, содержание сиаловых кислот может увеличивается при эндокардите, ИМ;
элктролиты, главным образом представлены ионами К+(норма 3,6 – 5,2 ммоль/л), Na+(норма 135 – 145 ммоль/л), Cl-(норма 100 – 106 ммоль/л), Ca2+ (норма 2,15-2,5 ммоль/л). Повышенное количество калия в сыворотке может сопровождаться клинически нарушением ритма сердечной деятельности, что подтверждается при выполнении ЭКГ. Может развиться атриовентрикулярные блокада проводящей системы сердца, развиться синдром преждевременного возбуждения желудочков, мерцание желудочков, и такое грозное нарушение, как остановке сердца. Поэтому больным с нарушениями ритма сердца необходимо контролировать содержание в организме ионов К+. С другой стороны, снижение калия в крови также может привести к неблагоприятным последствиям у этих пациентов – гипорефлексии миокарда. Снижение уровня ионов натрия может сопровождаться развитием недостаточности сердечно-сосудистой системы, поскольку соотношение ионов К+ и Na+, как регуляторов процессов в клетке, находится в постоянном взаимодействии и уменьшение одно, приводит к увеличению другого иона. Гиперхлоремия наблюдается у пациентов с заболеванием почек, и может также привести к развитию сердечно-сосудистой недостаточности;
липидный спектр, ассоциируется у простого человека со словом «холестерин». В данном случае определяются вещества (липопротеиды различной плотности, триглицериды), которые участвуют в обмене холестерина (ХС) (норма в крови – 3,1 – 5,2 ммоль/л). Кроме значения общего холестерина, важным показателем является коэффициент атерогенности (норма до 4), который показывает соотношение «хороших» и плохих» липидов, участвующих в обмене жиров и холестерина, и угрозу развития или прогрессирования атеросклероза и всеми вытекающими последствиями. Увеличение фракций липопротеидов и триглицеридов может быть как физиологическим состоянием (алиментарного характера), так и патологическим состоянием. Повышение липидов свойственно распространенному атеросклерозу, ожирению сопровождающего и обуславливающего артериальную гипертензию. А вернее будет сказать, что это нарушение работы внутренних органов и промежуточных звеньев обмена липидов и триглицеридов, выраженное в повышение показателя атерогенности, обуславливает отложение холестерина в сосудах различного диаметра, отложению «запасного жира», что и ведет к вышеперечисленным болезням. Поэтому при распространенном атеросклерозе, в этом анализе крови, можно увидеть повышенные значения ß-липопротеидов и общего холестерина. Вместе с тем, можно увидеть снижение концентрации фосфолипидов. Но и при этом необходимо учитывать то, что имеются возрастные колебания жиров в крови.
коагулограмма – анализ, по которому можно посмотреть «вязкость» крови, или другими словами, существует ли угроза образования тромбов, что может привести к образованию тромбов с различной локализацией, что в свою очередь может осложниться тромбоэмболией легочной артерии, при которой отмечается мгновенная смерть. Либо наоборот посмотреть, насколько высока вероятность кровотечения и сможет ли оно самостоятельно остановится, после операции, например, по протезировании клапана сердца.
Любой анализ или исследования дают врачу дополнительную информацию, помогающую точнее поставить диагноз, определить стадию заболевания, назначить лечение. Контролировать, течение болезни, эффективность назначенного лечения, а также обеспечивать безопасность терапии также помогают анализы. Но иногда требуется дополнительные исследования, подтверждающие или дополняющие результаты прошлых анализов.
Федорова Любовь Алексеевна – врач первой категории, терапевт, кардиолог медицинского центра «Тет-а-тет».
Читайте также:
