Трансплантация стволовых клеток при болезнях накопления и талассемии
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Трансплантация стволовых клеток при болезнях накопления и талассемии
В основе болезней накопления лежат мутации одиночных генов, обусловливающие недостаточность тех или иных ферментов и накопление токсических продуктов обмена веществ. В результате прогрессируют неврологические нарушения или развивается смертельная патология внутренних органов. Некоторые болезни накопления (например, адренолейкодистрофия) поддаются диетотерапии, другие (например, болезнь Гоше типа I и III) — заместительной ферментной терапии, но в большинстве случаев такого рода лечение невозможно. ТКСК формирует в костном мозге источник нужных ферментов в виде клеток моноцитарно-фагоцитарной системы печени (купферовские клетки), головного мозга (микроглия), кожи (клетки Лангерганса), скелета (остеокласты), легких (легочные макрофаги) и лимфатических узлов (гистиоциты).
Эффективность трансплантации кроветворных стволовых клеток (ТКСК) при разных болезнях накопления неодинакова. При адренолейкодистофии, метахроматической лейкодистрофии, глобоидноклеточной лейкодистрофии, синдроме Гурлер ТКСК дает хорошие результаты, тогда как при синдромах Санфилиппо и Гунтера эффект значительно хуже. Риск смертности при трансплантации с использованием клеток от совместимых сибсов составляет 10%, но при неродственной ТКСК от несовместимых доноров достигает 37%. Трансплантацию необходимо проводить еще до развития необратимых повреждений тканей и возникновения явных неврологических симптомов.
Трансплантация стволовых клеток при талассемии
Результаты трансплантации кроветворных стволовых клеток (ТКСК) при талассемии зависят от наличия у больных гепатомегалии, портального фиброза и нарушенной утилизации железа. Больных с отсутствием этих факторов риска относят к классу 1, при наличии одного или двух таких факторов — к классу 2, а при наличии всех трех — к классу 3. Число переливаний крови, уровень ферритина в плазме, степень гемосидероза, концентрация железа в печени и спленомегалия на эффективность ТКСК не влияют.
В Италии трансплантацию кроветворных стволовых клеток (ТКСК) от HLA-идентичных родственников была проведена более чем 500 больным с талассемией в возрасте 16 лет и старше. В тех случаях, когда трансплантацию осуществляли до развития гепатомегалии или портального фиброза, БРВ достигла 90%.
Трансплантация кроветворных стволовых клеток (ТКСК) улучшала состояние больных талассемией и в случаях не слишком обширного печеночного гемосидероза и портального фиброза. В США после HLA-идентичной родственной ТКСК жили без рецидива 17 из 27 больных детей; одному потребовалась повторная трансплантация, а еще у 5 после отторжения трансплантата развился рецидив; общая выживаемость составила 81 %. При наличии HLA-идентичных родственников ТКСК следует проводить на ранних стадиях заболевания. Сходные показатели БРВ были получены и при неродственной ТКСК от тщательно подобранных доноров, хотя в этих случаях осложнения возникали несколько чаще.
Болезни которые можно лечить с помощью стволовых клеток
Именно на этом сайте в 2003 году впервые появилась информация о лечении стволовыми клетками крови, которая была разделена на три больших раздела:
Также важно понимать различия двух методик лечения:
- - пациент получает стволовые клетки от совместимого донора, это может быть сиблинг (брат или сестра), либо неродственный донор. - пациент получает свои собственные стволовые клетки.
Когда родители передают стволовые клетки в общедоступный банк, они тем самым помогают пациентам по всему миру, которые ищут неродственного донора для аллогенной трансплантации. Когда родители сохраняют пуповинную кровь в семейном банке, они дают ребенку воспользоваться стволовыми клетками для аутологичной трансплантации, либо же ближайш родственники (родители, братья, сестры) могут использовать эти стволовые клетки для аллогенной трансплантации.
В нижеприведенном списке содержатся сведения обо ВСЕХ методах лечения, где используются стволовые клетки, вне зависимости от того, откуда они были получены – из костного мозга, периферической крови или пуповинной крови.
Данная страница была разработана Фрэнсис Вертер, Алексеем Берсеневым и Педро Сильва Коуто ©2016-2022.
Стандартные методы лечения
Эти методы лечения применяются в случае болезней, при которых трансплантация кроветворных клеток (трансплантация гемопоэтических стволовых клеток – ТГСК) применяются как стандартные, общепризнанные.
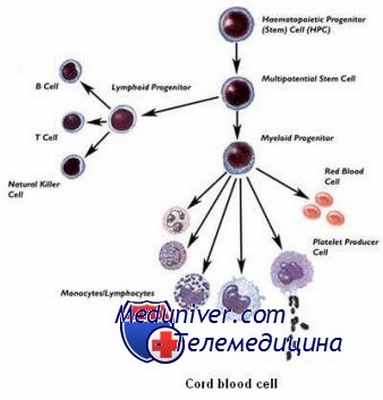
При некоторых заболеваниях это – единственный метод лечения, а в других случаях они могут быть использованы, когда терапия первой линии не дала результата, или же течение болезни оказалось очень агрессивным. Большинство заболеваний, при которых ТГСК является терапией выбора – это патология клеток крови. Процесс пролиферации, то есть развития зрелых клеток крови из стволовых клеток представлен на рисунке сбоку (нажмите, чтобы увеличить), также вы можете почитать о видах клеток иммунной системы подробнее. В США, большинство страховых компаний оплачивают пересадку стволовых клеток в том случае, если это «стандартная терапия» при заболевании, которым страдает пациент.
Лейкоз это вид рака крови, задействованы при этом лейкоциты или белые кровяные тельца.
| Диагноз | Аллогенная | Аутологичная |
| Острый лимфобластный лейкоз (ОЛЛ) | X | |
| Острый миелобластный лейкоз (ОМЛ) | X | |
| Острый бифенотипичный лейкоз | X | |
| Острый недифференцированный лейкоз | X | |
| Хроничекий лимфолейкоз (ХЛЛ) | X | |
| Хронический миелолейкоз (ХМЛ) | X | |
| Ювенильный хронический миелоидный лейкоз (ЮХМЛ) | X | |
| Ювенильный миеломоноцитарный лейкоз (ЮММЛ) | X |
Миелодиспластический синдром также носит название предлейкемии (состояния, которое предшествует лейкозу)
| Диагноз | Аллогенная | Аутологичная |
| Рефрактерная анемия | X | |
| Рефрактерная анемия с кольцевидными сидеробластами (сидеробластная анемия) | X | |
| Рефрактерная анемия с избытком бластов | X | |
| Рефрактерная анемия с избытком бластов в стадии трансформации | X | |
| Хронический миеломоноцитарный лейкоз (ХММЛ) | X |
Лимфома это вид злокачественной опухоли из лейкоцитов, которые циркулируют в крови и в лимфатических сосудах.
| Диагноз | Аллогенная | Аутологичная |
| Лимфома Ходжкина (лимфогранулематоз) | X | X |
| Неходжкинская лимфома (лимфома Беркитта) | X |
Другие нарушения пролиферации клеток крови
| Диагноз | Аллогенная | Аутологичная |
| Анемия это дефицит эритроцитов (красных кровяных телец) или нарушение их функции | ||
| Апластическая анемия | X | |
| Анемия Фанкони ((Первая трансплантация стволовых клеток из пуповинной крови была выполнена в 1988 году пациенту с анемией Фанкони, это – наследственное заболевание)) | X | См. исследования генной терапии |
| Врожденная дизэритропоэтическая анемия | X | |
| Пароксизмальная ночная гемоглобинурия (ПНГ) | X | |
| Наследственная патология эритроцитов Эритроциты содержат гемоглобин, их функция – перенос кислорода в организме. | ||
| Серповидноклеточная анемия | X | |
| Большая бета-талассемия (также известна под названием анемия Кули) | X | |
| Анемия Даймонда-Блекфена | X | |
| Парциальная красноклеточная аплазия | X | |
| Наследственные болезни тромбоцитов Тромбоциты это клетки, которые необходимы для свертывания крови. | ||
| Амегакариоцитоз / врожденная тромбоцитопения | X | |
| Тромбастения Гланцмана | X | |
| IНаследственные болезни иммунной системы: тяжелый комбинированный иммунодефицит (ТКИД) | ||
| ТКИД с дефицитом аденозиндеаминазы(АДА-ТКИД) | X | |
| ТКИД, сцепленный с Х-хромосомой | X | |
| ТКИД, при котором отсутствуют Т- и В-лимфоциты | X | |
| ТКИД, при котором отсутствуют Т- лимфоциты, В-лимфоциты нормальные | X | |
| Синдром Оменна | X | |
| Наследственные болезни иммунной системы: нейтропении | ||
| Инфантильный генетический агранулоцитоз (синдром Костманна) | X | |
| Миелокатексис | X | |
| Наследственные болезни иммунной системы: другие | ||
| Атаксия-телеангиоэктазия | X | |
| Синдром обнаженных лимфоцитов | X | |
| Общий вариабельный иммунодефицит (ОВИД) | X | |
| Синдром ДиДжорджи | X | |
| Гемофагоцитарный лимфогистиоцитоз | X | |
| Дефицит адгезии лимфоцитов | X | |
| Лимфопролиферативные заболевания | X | |
| Лимфопролиферативные заболевания, сцепленные с Х-хромосомой (Чувствительность к вирусу Эпштейн-Барр) | X | |
| Синдром Вискотта-Олдрича | X | |
| Миелопролиферативные заболевания | ||
| Острый миелофиброз | X | |
| Сублейкемический миелоз (миелофиброз) | X | |
| Истинная полицитемия | X | |
| Эссенциальная тромбоцитопения | X | |
| Патология фагоцитов клеток иммунной системы, которые поглощают и уничтожают чужеродные организмы. | ||
| Синдром Чедиак-Хигаси | X | |
| Хронические гранулематозные заболевания | X | |
| Дефицит актина в нейтрофилах | X | |
| Ретикулярный дисгенез | X | |
| Злокачественные опухоли костного мозга | ||
| Множественная миелома | X | X |
| Плазмоклеточный лейкоз | X | X |
| Макроглобулинемия Вальденстрема | X | X |
Трансплантация при наследственных заболеваниях иммунной системы и других органов
| Диагноз | Аллогенная | Аутологичная |
| Гипоплазия хряща - волос | X | |
| Эритропоэтическая порфирия (болезнь Гюнтера) | X | |
| Синдром Германски- Пудлака | X | |
| Синдром Пирсона | X | |
| Синдром Швахмана – Даймонда | X | |
| Системный мастоцитоз | X |
Трансплантация при наследственных метаболических заболеваниях
| Диагноз | Аллогенная | Аутологичная |
| Мукополисахаридозы (МПС) – болезни накопления | ||
| Синдром Гурлера (МПС-IH) | X | |
| Синдром Шейе (МПС-IS) | X | |
| Синдром Хантера (МПС-II) | X | |
| Синдром Санфилиппо (МПС-III) | X | |
| Синдром Моркио (МПС-IV) | X | |
| Синдром Марота-Лами (МПС-VI) | X | |
| Синдром Слая (Дефицит бета-глюкуронидазы) | X | |
| Муколипидоз II (I-клеточная болезнь) | X | |
| Лейкодистрофии | ||
| Адренолейкодистрофия (АЛД) | X | |
| Болезнь Краббе (глобоид-клеточная лейкодистрофия) | X | |
| Метахроматическая лейкодистрофия | X | |
| Болезнь Пелицеуса-Мерцбахера | X | |
| Лизосомальные болезни накопления | ||
| Болезнь Ниманна-Пика | X | |
| Болезнь Сандхоффа | X | |
| Болезнь Волмана | X | |
| Другие наследственные метаболические болезни | ||
| Синдром Лёш-Нихена | X | |
| Остеопетроз | X |
Солидные опухоли, которые происходят не из органов кроветворения и иммунной системы.
| Диагноз | Аллогенная | Аутологичная |
| нейробластома | X | |
| Медуллобластома | X | |
| ретинобластома | X |
Методы лечения в рамках клинических исследований
«Клиническое исследование» - это исследование, которое проводятся на людях для оценки тех методов лечения, которые не считаются стандартными. Исследования, проходящие в США, представлены на сайте ClinicalTrials.gov, на котором существует база данных с поисковой системой, также на сайте есть информация о множестве международных исследований.
Клиническое исследование на человеке в США всегда представлено фазами:
- Фаза 1: Это исследование безопасности лекарственного препарата, чтобы убедиться, что его применения хорошо переносится.
- Фаза 2: Более крупное исследование для сравнительной оценки эффективности нового метода лечения со стандартным методом лечения.
- Фаза 3: Еще более крупное исследование для изучения влияния различных параметров (например дозы и способа применения препарата) и отслеживания побочных эффектов до вывода препарата на рынок.
- Фаза 4: Постмаркетинговое исследование – для получения дополнительной информации о рисках, преимуществах и оптимальном режиме применения препарата.
Неврологические расстройства
(обратите внимание – ссылки на английском языке – оригинальные исследования)
| Диагноз | Аллогенная | Аутологичная |
| Аутизм | Фаза 2 Фаза 1 | |
| Церебральный паралич | Фаза 2 | Фаза 2 Фаза 2 Фаза 1 Фаза 2 |
| Потеря слуха (приобретенная сенсоневральная тугоухость) | Фаза 2 | |
| Гипоксически-ишемическая энцефалопатия ( (HIE) | Фаза 1 | |
| Повреждения спинного мозга | Наблюдение Фаза 2 |
Аутоиммунные болезни
| Диагноз | Аллогенная | Аутологичная |
| Боковой амиотрофический склероз (ALS) | Наблюдение Фаза 1 | Фаза 1 |
| Болезнть Крона | Фаза 2 плацента Фаза 3 Prochymal Фаза 2 Athersys | Фаза 3 ASTIC |
| Сахарный диабет 1 типа | Фаза 2 | Фаза 1 |
| Реакция трансплантат против хозяина (GvHD) | Фаза 3 Prochymal у детей Фаза 3 Prochymal у взрослых | |
| Одновременная трансплантация почек и стволовых клеток | Фаза 2 | |
| Волчанка | Фаза 1 | review of trials Фаза 2 |
| Рассеянный склероз | Обзор исследований Фаза 1, news | |
| Ревматоидный артрит | Фаза 2 placenta | |
| Системная склеродермия | Фаза 1 | Наблюдение Фаза 2 SCOT Фаза 2 CD34+ |
Болезни сердечно-сосудистой системы
| Диагноз | Аллогенная | Аутологичная |
| Врожденные пороки развития | ||
| Поддержка при различных операциях на открытом сердце | Фаза 1 | |
| Синдром гипоплазии левых отделов сердца (HLHS) | Фаза 1 | |
| Растущие протезы сосудов | Фаза 1, story | |
| Ишемия | ||
| Критическая ишемия конечностей | Фаза 2 | Фаза 2 Фаза 2 Фаза 3 BMAC |
| Компартмент-синдром (боевая травма) | Фаза 1 | |
| Ишемический инсульт | Фаза 2 placenta | Фаза 3 |
| Ишемическая болезнь сердца | Meta-Analysis | |
| Восстановление миокарда | ||
| Острый инфаркт миокарда | Наблюдение Фаза 3 BAMI | |
| Кардиомиопатия | Наблюдение | Фаза 1 Texas Heart Inst. Фаза 3 |
Генная терапия наследственных заболеваний
Обратите внимание, что в этом списке представлены только те методы генной терапии, в которых используются гемопоэтические стволовые клетки. Имеется множество других клинических исследований в области генной терапии, некоторые из них посвящены тем же самым заболеваниям, путь введения при этом может быть другой (внутримышечные инъекции, внутримозговые инъекции и другое)
| Диагноз | Аллогенная | Аутологичная |
| Адренолейкодистрофия | Фаза 2 bluebird bio | |
| Хронические гранулематозы (сцепленные с Х-хромосомой) | Фаза 1 | |
| Анемия Фанкони | Фаза 1, news | |
| ВИЧ | Фаза 1 Calimmune Фаза 1 Hutch | |
| Метахроматическая лейкодистрофия | Фаза 1 Milan | |
| Тяжелый комбинированный иммунидефицит | Фаза 1 X-linked SCID Boston Фаза 1 X-linked SCID St. Jude Фаза 1 X-linked SCID Paris Фаза 1 ADA-SCID UCLA Фаза 1 ADA-SCID Duke | |
| Серповидно-клеточная анемия | planned trial | |
| Талассемия | Наблюдение Фаза 1 St. Jude Фаза 1 MSK Фаза 1 bluebird bio | |
| Синдром Вискотта-Олдрича | Фаза 1 Фаза 1 Milan |
Ортопедия
| Диагноз | Аллогенная | Аутологичная |
| Операции при альвеолярных расщелинах неба | Gintuit FDA-одобрение (НЕ гемопоэтические стволовые клетки) | publication Фаза 1 |
| Протезирование хрящей коленного | Cartistem KFDA-одобрение | Фаза 2 IMPACT |
Разное
| Диагноз | Аллогенная | Аутологичная |
| Бронхолегочная дисплазия (BPD) | Фаза 2 Pneumostem | |
| Буллезный эпидермолиз | публикация, наблюдение | |
| ВИЧ, также известен под названием СПИД | Фаза 1 Hutch Berlin patient PubMed & NPR | |
| Лизосомальные болезни накопления | Внутриутробное переливание крови через пуповину |
Экспериментальные методы лечения
These are diagnoses for which stem cell treatments are being studied either in the laboratory with cell cultures or in animals that mimic the human disease. The experimental therapies are not yet in human clinical trials. In experimental research, it is often not clear whether an eventual therapy, if developed, would be Autologous or Allogeneic.
Due to the explosion of stem cell research and the difficulty keeping track of which studies are promising, this section does not have a list.
Трансплантация стволовых клеток при болезнях накопления и талассемии

Заместитель главного редактора
Чухловин А. Б. (Санкт-Петербург, Россия)
Фезе Б. (Гамбург, Германия)
Новик А. А. (Москва, Россия)
Редакционная коллегия
Алейникова О. В. (Минск, Беларусь)
Алянский А. Л. (Санкт-Петербург, Россия)
Анагносту А. (Бостон, США)
Андреефф М. (Хьюстон, США)
Бaйков В. (Санкт-Петербург, Россия)
Баранов В. С. (Санкт-Петербург, Россия)
Бархатов И. М. (Санкт-Петербург, Россия)
Баум К. (Ганновер, Германия)
Бахер У. (Гамбург, Германия)
Билько Н. М. (Киев, Украина)
Борсет М. (Трондхейм, Норвегия)
Быков В. Л. (Санкт-Петербург, Россия)
Бюхнер Т. (Мюнстер, Германия)
Вестенфельдер К. (Солт-Лейк-Сити, США)
Вилесов А. Д. (Санкт-Петербург, Россия)
Вислофф Ф. (Осло, Норвегия)
Дини Дж. (Генуя, Италия)
Дризе Н. (Москва, Россия)
Галибин О. В. (Санкт-Петербург, Россия)
Ганзер А. (Ганновер, Германия)
Гранов Д. А. (Санкт-Петербург, Россия)
Звартау Э. Э. (Санкт-Петербург, Россия)
Зверев О. Г. (Санкт-Петербург, Россия)
Зубаровская Л. С.(Санкт-Петербург, Россия)
Иванов Р. А. (Москва, Россия)
Климко Н. Н. (Санкт-Петербург, Россия)
Коза В. (Пльзень, Чехия)
Кольб Х. (Мюнхен, Германия)
Коноплева М. (Хьюстон, США)
Крегер Н. (Гамбург, Германия)
Маликов А. Я. (Санкт-Петербург, Россия)
Менткевич Г. Л. (Москва, Россия)
Михайлова Н. Б. (Санкт-Петербург, Россия)
Наглер А. (Тель Хашомер, Израиль)
Неворотин А. И. (Санкт-Петербург, Россия)
Немков А. С. (Санкт-Петербург, Россия)
Нет Р. (Гамбург, Германия)
Остертаг В. (Гамбург, Германия)
Палутке М. (Детройт, США)
Румянцев А. Г. (Москва, Россия)
Савченко В. Г. (Москва, Россия)
Смирнов А. В. (Санкт-Петербург, Россия)
Тец В. В. (Санкт-Петербург, Россия)
То Б. (Аделаида, Австралия)
Тотолян А. А. (Санкт-Петербург, Россия)
Усс А. Л. (Минск, Беларусь)
Феррара Дж. (Энн Арбор, США)
Фиббе В. (Лейден, Нидерланды)
Штамм К. (Берлин, Германия)
Эвераус Х. (Тарту, Эстония)
Эгеланд Т. (Осло, Норвегия)
Эльстнер Е. (Берлин, Германия)
Эмануэль В. Л. (Санкт-Петербург, Россия)
Промежуточный отчёт
Элиана Глюкман, Хэл Е. Броксмайер, Арлин Д. Ауэрбах, Генри С. Фридман, Гордон У. Дуглас, Агнес Девержи, Элен Эсперо, Доминик Тьерри, Жерар Соси, Пьер Лен, Скотт Купер, Денис Инглиш, Джоан Кюртцберг, Юдифь Бард, Эдвард А. Бойз
Обзорные статьи
Аравинд Рамакришнан, Биверли Дж.Торок-Шторб
Якуб Толар, К.Скотт Бэйкер, Пол Дж. Орчард
Л. Барроуз, Э. Вулфри
Митчелл Э. Хорвитц, Нельсон Чао
Форум
Промежуточный отчёт
Восстановление гемопоэза у больного анемией Фалькони с помощью пуповинной крови HLA-идентичного сиблинга
Элиана Глюкман, Хэл Е. Броксмайер, Арлин Д. Ауэрбах, Генри С. Фридман, Гордон У. Дуглас, Агнес Девержи, Элен Эсперо, Доминик Тьерри, Жерар Соси, Пьер Лен, Скотт Купер, Денис Инглиш, Джоан Кюртцберг, Юдифь Бард, Эдвард А. Бойз
Клинические проявления анемии Фанкони, аутосомной рецессивной болезни, включают прогрессирующую панцитопению, предрасположенность к злокачественным опухолям и развитию аномалий, не связанных с гемопоэзом. Гиперчувствительность к кластогенным эффектам – разрывам хромосом под действием препаратов, способствующих сшивке цепей ДНК, таких как диэпоксибутан, используется как диагностический признак генотипа анемии Фанкони, как пре- так и постнатально. Пренатальное
HLA-типирование даёт возможность установить, является ли плод HLA-идентичным больному сиблингу.
Мы описываем здесь восстановление гемопоэза у мальчика с тяжёлой формой анемии Фанкони, которому была введена криоконсервированная пуповинная кровь сестры, не поражённой, по данным пренатального тестирования, данным заболеванием, имевшей нормальный кариотип и HLA-идентичный фенотип.
Ключевые слова
анемия, апластическая терапия, консервация крови, анемия Фанкони, женская особь, плодная кровь, HLA антигены, трансплантация гемопоэтических стволовых клеток, тестирование гистосовместимости, человек, мужская особь, беременность, пренатальный диагноз, дети дошкольного возраста
Обзорные статьи
Трансплантация гемопоэтических стволовых клеток является единственной возможностью потенциального излечения при тяжелой талассемии, в том числе при гомозиготной β-талассемии и тяжелой талассемии с гемоглобином E/β. При заболевании 1-го или 2-го классов риска всем детям должна проводиться трансплантация, если они имеют HLA-идентичных братьев или сестер, и такую трансплантацию следует осуществлять как можно раньше. Пересадка клеток пуповинной крови от братьев или сестер рекомендуется детям с заболеванием 1-го или 2-го классов риска, если имеются в наличии адекватные количества клеток пуповинной крови от младших сиблингов.
Трансплантация костного мозга детям 3-го класса риска и взрослым больным с применением соответствующих режимов кондиционирования дает лучшие результаты по сравнению с теми, которые получаются при использовании пуповинной крови. Мы рекомендуем, однако, чтобы больные и их семьи могли обсудить в подробностях возможные факторы риска и преимущества лечения, и трансплантация должна проводиться только мотивированным пациентам, которые имеют четкое понятие обо всем процессе. Новые надежды связаны с возможным успехом гаплоидентичной трансплантации, но требуются дальнейшие исследования для подтверждения предыдущих результатов.
Ключевые слова
талассемия, клинические факторы риска, трансплантация гемопоэтических стволовых клеток, показания, преимущества
Обзорные статьи
Аравинд Рамакришнан, Биверли Дж.Торок-Шторб
Успешность трансплантации гемопоэтических стволовых клеток зависит от приживления плюрипотентных гемопоэтических стволовых клеток (ГСК) и регулируемой пролиферации и созревания коммитированных родоначальных клеток. В целом, существует согласие в том, что эти процессы не могут возникать без соответствующей среды, которую обеспечивает компетентное микроокружение костного мозга. Оно состоит как из негемопоэтических клеток, так и клеток гемопоэтического происхождения, и впоследствии, после аллогенной трансплантации ГСК, становится химерным, содержащим стромальные клетки реципиента и макрофаги донора.
Ключевые слова
гемопоэтическое микроокружение, стромальные клетки, трансплантация, ниша стволовых клеток, единицы микроокружения, моноцит/макрофаг
Обзорные статьи
Якуб Толар, К.Скотт Бэйкер, Пол Дж. Орчард
В данной обзорной статье представлены сведения о трансплантации гемопоэтических стволовых клеток (ТГСК) у детей с врожденными метаболическими болезнями накопления (ВМБН), и о нерешенных вопросах ТГСК при этих состояниях. Обсуждаются как миелоаблативные, так и менее интенсивные режимы кондиционирования. Показана выгода стандартизированного подхода к ТГСК при болезни Хурлера и ранней адренолейкодистрофии (АЛД) головного мозга. Режимы кондиционирования со сниженной интенсивностью могут оказаться более успешными в плане снижения смертности и развития осложнений, особенно у больных с развивающимся неврологическим дефектом. В ситуациях с ТГСК при наследственных заболеваниях можно ожидать, что потенциальные доноры-сибсы могут быть носителями мутации данного гена. Нерешенная проблема состоит в том, может ли альтернативный донор иметь преимущество в сравнении с сибсом, который может быть носителем заболевания. Обычно применяют стволовые неродственные донорские клетки из различных источников (костного мозга, периферических клеток, пуповинной крови) с хорошими результатами. Рассматривается эффективность энзим-заместительной терапии по сравнению с ТГСК в качестве подходящего лечения при менее тяжелых формах мукополисахаридозов (МПС), и ТГСК признано стандартом терапии для больных с тяжелыми клиническими формами МПС типа I. В противоположность синдрому Хурлера, ТГСК не выявила существенного влияния у больных с тяжелым МПС типа II (синдром Хантера), т.е. дети с тяжелой формой МПС типа II, по-видимому, не имеют преимуществ в нейрокогнитивном развитии при ТГСК. Что касается метахроматической или глобоидноклеточной лейкодистрофии, то данные об эффективности ТГСК здесь более скудные. Получение четких данных об исходах ТГСК у больных с ВМБН оказалось сложной задачей из-за редкости этих заболеваний, вариабельности их генотипов и фенотипов, различий в источниках стволовых клеток, кондиционирующих режимах и оценке «успешных» результатов. Дальнейшие исследования установят полезность комбинированной терапии с/без трансплантации, включая субстратное ингибирование, терапию шаперонами, энзимотерапию и т.д. Кроме того, интерес к неонатальному скринингу обеспечит раннее вмешательство в течение этих болезней, т.к. это очень важно для получения оптимальных результатов. Наконец, модификация процедуры ТГСК или применение селективно размножающихся клеточных популяций, или обработка цитокинами могут усилить приживление микроглии, что может существенно облегчить достаку энзимов в центральную нервную систему. В это отношении будут важны многоцентровые исследования с общим подходом и оценкой клинических исходов.
Ключевые слова
наследственные болезни накопления, мукополисахаридозы, трансплантация гемопоэтических клеток, режимы кондиционирования, клинический эффект
Обзорные статьи
Л. Барроуз, Э. Вулфри
Центр раковых исследований Фреда Хатчинсона и Университет Вашингтона, Сиэтл, США
Трансплантация гемопоэтических клеток (ТГСК) является средством лечения первичных синдромов иммунодефицита (ПСИД), представляющих собой группу заболеваний, первично нарушающих один из ростков, например, лимфоидный или миелоидный. В целом, применение различных кондиционирующих режимов ТГСК зависит от типа ПСИД. Некоторые синдромы, вызывающие глубокий иммунодефицит, могут и не требовать кондиционирования. Возможно, однако, что существует иммунный барьер даже в случаях тяжелого комбинированного иммунодефицита (ТКИД), особенно в ситуации с расхождением по HLA или при гаплоидентичной ТГСК. Например, донорский В-клеточный химеризм менее вероятен при дефиците γ-цепей (X-сцепленный ТКИД), поскольку клетки больного занимают нишу В-клеток, нежели при синдромах без В-клеток (например при дефиците аденозиндезаминазы. Иммунный дефект может быть исправлен путем частичного восстановления нормальных иммунных клеток, другими словами – может и не требоваться полный донорский химеризм поврежденной клеточной субпопуляции. Эта концепция может служить дальнейшим доводом в пользу ограничения интенсивности кондиционирующего режима.
ТКИД включает в себя широкий круг врожденных дефктов, которые в каждом случае приводят к глубокому иммунодефициту как Т-, так и В-клеточной функции. Индивидуальные генетические дефекты ведут к развитию разнообразных фенотипов, и, поскольку цель ТГСК состоит в восстановлении как Т-, так и В-клеточных функций, то фенотип ТКИД должен приниматься в расчет, наряду со степенью различий донора и реципиента. Другие биологические факторы, ассоциированные с фенотипом ТКИД могут влиять на барьер приживления, такие, как НК-клетки больного, которые могут выжмивать после интенсивных кондиционирующих режимов.
Одной из проблем в анализе исходов ТГСК у больных ТКИД является относительная редкость этого заболевания, что требует больших многоцентровых программ. Недавние исследования показали, что наиболее важным фактором лучшего приживления после HLA-идентичной пересадки от сибса является более юный возраст в момент ТГСК. Факторами, существенно связанными с лучшим выживанием, после гаплоидентичных трансплантаций были: B+ фенотип больных ТКИД, защищенная (асептическая) среда обитания, и отсутствие легочных инфекций до ТГСК.
Внедрение неонатального скрининга и диагностика in utero позволили рано выявлять ТКИД и, тем самым, способствуют лечению в раннем возрасте.
Синдромы с первичным Т-клеточным иммунодефицитомс (ПТКИД) могут быть дифференцированы от ТКИД по снижению, но не полному отсутствию Т-клеточной функции, или же по отсутствию Т-клеточной активности при наличии функций В-лимфоцитов или НК-клеток. Аллогенная пересадка костного мозга остается единственным исцеляющим методом лечения, доступным для таких заболеваний. Независимо от донорских факторов, у больных с ПТКИД наблюдаются худшие клинические исходы, по сравнению с другими типами ИДС. Хотя опасные для жизни инфекции могут быть в раннем возрасте менее частыми, у детей с ПТКИД часто развивается органная патология из-за хронических инфекций, в особенности болезни легких до проведения ТГСК.
ТГСК при синдроме Вискотт-Олдрича дает больным значительные шансы на выживание. Показано, что достижение полного донорского химеризма является здесь благоприятным фактором. В целом, однако, многочисленные исследования при ИДС показывают, что кондиционирование низкой интенсивности создает условия для приживления донорских клеток при меньшей заболеваемости по сравнению со стандартными режимами, что является важным фактором для больных, у которых может быть неприемлемо высоким риск от проведения обычных трансплантаций.
Ключевые слова
первичные иммунодефициты, тяжелый комбинированный иммунодефицит (ТКИД), первичные Т-клеточные дефициты, трансплантация гемопоэтических стволовых клеток (ТГСК), кондиционирующие режимы, клинические исходы
Трансплантация костного мозга
Пересадка костного мозга – признанный метод в лечении многих заболеваний. В особенности, в онкологии в некоторых случаях он оказывается единственной возможностью спасти жизнь больного.
Костный мозг находится внутри тазовых костей и расширенных концов трубчатых костей и отвечает за образование клеток крови. Красные кровяные клетки, эритроциты, переносят кислород ко всем органам и тканям, белые кровяные тельца, лейкоциты, обеспечивают иммунитет против инфекций, а тромбоциты участвуют в свертывании крови. В результате некоторых заболеваний и определенных воздействий костный мозг теряет способность к кроветворению и нуждается в замене, трансплантации.
К настоящему времени в мире выполнено более 50 000 процедур трансплантации костного мозга, каждый год выполняется до 5000 новых процедур.
ПРИМЕНЕНИЕ
Вот некоторые заболевания, при которых проводится трансплантация: тяжелые апластические анемии (нарушения кроветворения), талассемии, врожденные иммунодефициты, болезни накопления (болезнь Гоше, мукополисахаридозы), лейкозы, злокачественные неходжкинские лимфомы, болезнь Ходжкина, множественная миелома. Трансплантация также выполняется после лучевой или химиотерапии, необходимой при широком спектре злокачественных заболеваний. Интенсивное подавление иммунитета при тяжелых ауотоиммунных заболеваниях, например, системной красной волчанке, склеродермии или рассеянном склерозе, также требует трансплантации костного мозга.
Перед процедурой выполняется общий анализ крови, анализ мочи, флюорография, ЭКГ, УЗИ органов брюшной полости и эхокардиография, электроэнцефалография, функциональное исследование легких и, в отдельных случаях, компьютерная томография.
СОБСТВЕННЫЙ ИЛИ ДОНОРСКИЙ?
В зависимости от источника костного мозга различают несколько видов трансплантации: аутогенную (клетки костного мозга самого пациента, полученные до химио- или лучевой терапии), изогенную (от однояйцевого близнеца) или аллогенную (от другого человека, лучше от родственника I степени родства). Аутогенная трансплантация выполняется только в том случае, если костный мозг не поврежден в результате злокачественных заболеваний. Если же выполняется трансплантация костного мозга от другого индивида, необходимо совпадение по так называемым поверхностным антигенам лейкоцитов, HLA, human leukocyte antigens. Совпадение определяется методом молекулярно-генетического исследования образцов крови. Несовпадение по этим антигенам вызывает тяжелые реакции отторжения, а также реакцию «трансплантат-против-хозяина». В настоящее время допустима трансплантация при несовпадении максимум 1 лейкоцитарного антигена. Для пациентов, у которых нет подходящих родственников, существует возможность поиска донора в национальных и международных базах данных. В зависимости от распространенности требующихся антигенов поиск донора обычно занимает от 1 до 12 месяцев, примерно для 30% пациентов подходящий донор находится внутри семьи.
ЗАБОР КОСТНОГО МОЗГА
Для трансплантации ценен не сам по себе костный мозг, а гемопоэтические стволовые клетки крови (клетки - предшественницы кроветворения), содержащиеся в нем. Эти клетки в небольшом количестве имеются и в периферической крови. Поэтому забор этих клеток может производиться двумя путями - непосредственно из костного мозга или из периферической крови. В первом случае требуется пункция костного мозга из гребня подвздошной кости под общим или местным наркозом. Операция длится около 30 минут. Но в последние годы популярность приобрел второй, более совершенный, метод - забор гемопоэтических клеток из крови. Для увеличения количества гемопоэтических клеток в крови донор накануне принимает специальный препарат. Процедура забора клеток из крови длится 5-6 часов. Однако собственной крови донор теряет мало - кровь просто «перекачивается» из вены одной руки в вену другой, проходя процедуру отделения необходимых для трансплантации стволовых клеток. При этом анестезии не требуется, все проходит в амбулаторных условиях.
ТРАНСПЛАНТАЦИЯ
Когда пациенту пересаживается изъятые из кости клетки костного мозга, говорят о трансплантации костного мозга. Если пересаживают гемопоэтические стволовые клетки, взятые из периферической крови, то речь ведут о трансплантации стволовых клеток крови. Перед трансплантацией выполняется так называемое кондиционирование (подготовка) пациента, которая заключается в удалении возможных остаточных клеток опухоли и в подавлении собственного иммунитета для профилактики реакции отторжения. Такая подготовка зависит от основного заболевания и включает химиотерапию или химиотерапию в комбинации с лучевой терапией. Если получены собственные клетки до химио- или лучевой терапии, они замораживаются при температуре -195°С и сохраняются до подходящего момента.
Трансплантация производится путем внутривенного введения.
ВОЙНА МИРОВ
Несмотря на точность подбора донора, при отсутствии соответствующего лечения возникает реакция «трансплантат против хозяина». В отличие от реакции отторжения (хозяин против трансплантата) в этом случае сильные, иммунокомпетентные клетки пересаженного костного мозга атакуют ослабленные ткани и органы реципиента. Острая реакция может наступать в течение 80 дней после трансплантации и затрагивает кожу, печень, кишечник и иммунную систему. В настоящее время для профилактики этой реакции во всем мире применяется циклоспорин А или такролимус в комбинации с метотрексатом, согласно протоколу, разработанному профессором Райнером Шторбом (Rainer Storb) еще в 1986 году.
В СТЕРИЛЬНЫХ УСЛОВИЯХ
В период иммунологической реконструкции, то есть восстановления иммунитета, необходимо избегать больших скоплений людей, носить защитную маску при контакте с чужими людьми или детьми младше 10 лет, ограничить контакт с домашними животными и исключить из рациона сырые продукты. Такой период длится при аутогенной трансплантации 3 месяца, при аллогенной – может затягиваться до 2 лет. После завершения этого периода необходимо обновить прививки против дифтерии, столбняка, полиомиелита, менингоэнцефалита и пневмококков.
О стволовых клетках
Стволовая клетка - это первооснова организма. Развитие всех тканей и органов организма (клетки сердца, печени, кожи, головного мозга и т.д.), начинается именно с неё, - со стволовой клетки. Также стволовые клетки являются основой для регенерации тканей, и обеспечивают восстановление повреждённых участков организма.
Лечебные технологии с использованием стволовых клеток из года в год занимают всё более высокую ступень в терапии широкого ряда онкологических, гематологических, соматических (неврология, эндокринология, кардиология, сосудистая хирургия) заболеваний.Каждый человек на самом начальном этапе жизни представляет собой одну единственную клетку, которая образовалась в момент оплодотворения яйцеклетки сперматозоидом.Из этой клетки в дальнейшем образуется все, что есть в нашем теле. Клетки продолжают делиться и через несколько суток формируется ранний эмбрион – бластоциста, состоящий из нескольких десятков эмбриональных стволовых клеток.
Именно эти клетки дают начало следующему поколению стволовых клеток – гемопоэтических и стромальных.
Гемопоэтические стволовые клетки.
При заболеваниях крови у человека поражается кроветворная ткань, которая не способна воспроизводить адекватное количество клеток крови, необходимое для нормального функционирования организма. В настоящее время в современной медицине не существует медикаментозных препаратов для восстановления нормального кроветворения. В таких случаях единственным методом лечения является трансплантация костного мозга.
Но в этой области медицины существует ряд проблем: - неполная совместимость генотипов донора и реципиента, - частое развитие реакции трансплантата против хозяина, - проблема по подбору доноров, - время, затраченное на подбор донора, - дорогостоящая стоимость «подготовки» донора к трансплантации.
Современная медицина нашла способ избежать эти проблемы – это трансплантация гемопоэтических стволовых клеток пуповинной крови. Преимущества: - полная совместимость, - практически отсутствует реакция трансплантата против хозяина, - нет необходимости ожидания, поиска донора,- относительно небольшая стоимость образца для трансплантации.
Сегодня стволовые клетки применяются при многих заболеваниях:
Гематологические и иммунные заболевания
Лейкемия. В 2010 году в США стволовые клетки были трансплантированы 18 720 пациентам, страдающим раком крови, в России их получили только 485 больных. В 2011 году 44 790 мужчинам и женщинам был поставлен диагноз «лейкемия». 21 870 человек умерли от этой болезни. У них был шанс на спасение — пересадка стволовых клеток пуповинной крови.
Лимфома. Трансплантация стволовых клеток пуповинной крови существенно облегчает восстановление после химиотерапии.
Серповидно-клеточная анемия. 1 528 000 человек страдают от этой болезни в России и странах СНГ. Помочь им могут стволо¬вые клетки пуповинной крови.
Миеломная болезнь. Только трансплантация стволовых клеток пуповинной крови помогает при миеломной болезни.
Иммунодефицитные состояния. «Для некоторых угрожающих жизни первичных иммунодефицитов. трансплантация стволовых клеток дает шанс полного и устойчивого излечения». Национальный институт детского здоровья и развития человека США.
Талассемия. Облегчить течение этого распространенного наследственного генного нарушения могут стволовые клетки пуповинной крови.
ВИЧ. Генная терапия с использованием образцов стволовых клеток крови пуповины, содержащих наследственную устойчивость к ВИЧ, - перспективное средство лечения.
Негематологические заболевания, при которых для лечения используют стволовые клетки пуповинной крови
Сахарный диабет. 11 360 000 взрослых и детей в России (8% населения) страдают сахарным диабетом. Стволовые клетки пуповинной крови применяются при осложнениях сахарного диабета
Ишемическая болезнь сердца. Стволовые клетки пуповинной крови способны восстановить миокард и работу коронарных сосудов.
Хронические гепатиты и циррозы печени. Регенеративная терапия стволовыми клетками пуповинной крови является современным восстановительным средством при этих заболеваниях.
Болезнь Крона и неспецифический язвенный колит. Терапия стволовыми клетками пуповинной крови является высокоэффективным средством облегчения страданий при этих патологиях.
Болезнь Альцгеймера. Стволовые клетки пуповинной крови - единственная надежда на терапию болезни Альцгеймера.
Болезнь Паркинсона. В комплексной терапии болезни Паркинсона используются стволовые клетки пуповинной крови.
Детский церебральный паралич. Терапия стволо¬выми клетками пуповинной крови показала хорошие результаты в облегчении состояния детей с ДЦП.
Боковой амиотрофический склероз. Стволовые клетки пуповинной крови способны повлиять на течение заболевания.
Рассеянный склероз. Рассеянный склероз ведет к инвалидности. Помощь пациентам возможна благодаря трансплантации стволовых клеток пуповинной крови.
Повреждения позвоночника. Восстановление поврежденного спинного или головного мозга возможно при применении стволовых клеток пуповинной крови.
Инсульт. Средством восстановления при инсультах является клеточная терапия.
Мышечная дистрофии. При этом заболевании эффективны методы клеточной терапии.
Читайте также:
