Трепанобиопсия костного мозга при миелодиспластических синдромах (МДС)
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
1 ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого Минздрава России»
Приведенный опыт лечения больной с миелодиспластическим синдромом высокотехнологичными препаратами, ингибирующим метилирование ДНК – децитабином (Дакоген) и иммуномодулирующим препаратом леналидомидом, представляет собой интерес в связи с тем, что ведение больных с миелодиспластическим синдромом все еще является нерешенной задачей. Подход к лечению МДС должен быть индивидуальным и основываться на группе риска больного, возрасте, соматическом статусе. При выявлении цитогенетических поломок (в частности делеции 5 q хромосомы) преимущество в отношении повышения качества жизни даёт эпигенетическая терапия децитабином. Лечение дакогеном действительно обладает клинической эффективностью, вызывая высокий уровень общего ответа на терапию у больной миелодиспластическим синдромом, так как позволяет исключить потребность в гемотрансфузиях, снизить количество осложнений, связанных с переливанием донорской крови. Но как показала практика, после достаточно продолжительной ремиссии МДС, достигнутой на фоне применения дакогена, возможен рецидив заболевания. Леналидомид был назначен по поводу рецидива заболевания, который развился через 14 месяцев ремиссии. Опыт лечения больной МДС подтверждает высокую эффективность леналидомида в лечении этой патологии. Положительный эффект леналидомида наблюдался через 6 месяцев от начала терапии. У больной исчезла потребность в гемотрансфузиях, нормализовались показатели эритроцитарного и гранулоцитарного ростков, повысились цифры тромбоцитов, уменьшился процент делеции 5q. Это позволило повысить выживаемость больной и тем самым увеличить время до прогрессирования заболевания.
2. Аллогенная трансплантация гемопоэтических стволовых клеток при миелодиспластических синдромах и клиническое значение гиперэкспрессии гена WT1 / Н.Н. Мамаев, А.В. Горбунова, ТЛ. Гиндина [и др.] // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. – 2014. – № 7 (4). – С. 550-562.
5. Савченко В.Г., Паровичникова Е.Н., Кохно А.В. и др. Национальные клинические рекомендации по диагностике и лечению миелодиспластических синдромов взрослых (2015г.) / В.Г.Савченко, Е.Н. Паровичникова, А.В. Кохно // Гематология и трансфузиология. – М.: Медицина, 2016. –Т. 61. – № 51(4). – 32 с.
Миелодиспластический синдром (МДС) – гетерогенная группа заболеваний системы крови, сопровождающихся цитопенией, дисмиелопоэзом и трансформацией в острый лейкоз [1]. По сведениям зарубежных гематологов заболеваемость МДС составляет 4-5 случаев на 100 тыс. населения в год. К пожилому возрасту встречаемость МДС увеличивается до 20-50 случаев на 100 тыс. человек в год. Поэтому МДС остается одной из актуальных проблем для врачей всех специальностей [1].
Среди аномалий кариотипа чаще выявляют делецию 5q и трисомию хромосомы 8. Миелодиспластический синдром довольно быстро трансформируется в острый миелобластный лейкоз (ОМЛ), сокращает продолжительность жизни пациента. Риск перехода в острый лейкоз достаточно высок [2, 3, 4]. В случае отказа от лечения срок жизни пациента не более 5,7 года в зависимости от уровня степени прогрессирования заболевания. Срок трансформации в ОМЛ составляет соответственно 0,2 и 9,4 года. Различного рода инфекционные заболевания, тяжелые кровотечения, переход в ОМЛ, как правило, являются причинами летального исхода [3]. Верификация миелодиспластического синдрома сложна, занимает длительный период времени, так как в ходе диагностики приходится исключать заболевания, которые протекают с подобными изменениями в гемограмме и миелограмме. Для подтверждения диагноза Миелодиспластический синдром необходимые исследования это: мазок периферической крови, исследование аспирата костного мозга, трепанобиопсия, цитогенетическое исследование, флуоресцентная гибридизация in situ (FISH). В этих исследованиях необходимо оценить дисплазию в клетках миелоидных ростков кроветворения, подсчитать количество бластных клеток и кольцевых сидеробластов, охарактеризовать фиброз, определить особенности кариотипа, выявить определенные хромосомные аномалии.
Убрать зависимость от регулярной процедуры переливания крови, отсрочить перерастание заболевания в ОМЛ, рост выживаемости, нормализация состава клеток крови, привести к нормальному качество жизни – вот основные цели лечения миелодиспластического синдрома [3].
Терапия МДС в настоящее время зависит от группы риска по IPSS. Терапия Миелодиспластического синдрома включает в себя трансплантацию аллогенных стволовых клеток, применение интенсивной и низкодозной химиотерапии, гипометилирующих препаратов, использование иммуномодулирующих и иммуносупрессивных препаратов, а также гемопоэтических факторов роста. К методам лечения Миелодиспластического синдрома относятся трансфузии тромбоцитов, эритроцитов с хелаторной терапией, а также спленэктомия. В качестве кандидатов на алло-ТГСК должны рассматриваться больные 65-70 лет с МДС промежуточного-2 или высокого риска по IPSS или промежуточного-1 риска с большим количеством бластных клеток или неблагоприятными цитогенетическими аномалиями [1]. Но смертность пациентов с МДС, связанная с трансплантацией, по данным ЕВМТ, составила от 30 % до 50 % у больных моложе 20 лет и старше 40 лет соответственно. Кроме того, опыт выполнения алло-ТГСК у больных МДС в РФ ограничен возрастом 65 лет [5].
Высокодозная химиотерапия предпочтительна для 2 больных без подходящего донора моложе 65 лет, имеющих в костном мозге 10 % и 2 более бластных клеток, без неблагоприятных цитогенетических аберраций [5]. Низкодозная химиотерапия (в основном МДЦ) является терапией выбора для пожилых больных, а также у больных с нормальным кариотипом или благоприятными аберрациями. Гипометилирующие препараты (азацидин и децитабин) вызывают ингибирование ДНК-метилтрансферазы, фермента, отвечающего за метилирование вновь синтезируемой ДНК. Эти препараты применяются у больных МДС промежуточного-2 или высокого риска по IPSS, которые не являются кандидатами для интенсивной химиотерапии или алло-ТГСК, или у больных, не входящих в цитогенетическую группу плохого прогноза, но не имеющих потенциального донора стволовых [5].
Препараты, стимулирующие эритропоэз (эпоэтин a и b, дарбэпоэтин a), более эффективны у больных МДС низкого и промежуточного-1 риска по IPSS. Применение эритропоэтинов позволяет уменьшить анемический синдром, улучшить качество жизни больных, снизить потребность в заместительной терапии эритроцитарной массой. Сочетанное применение эритропоэтинов и Г-КСФ наиболее эффективно у больных РА с кольцевыми сидеробластами, при отсутствии ответа на монотерапию ЭПО.
Иммуносупрессивная терапия (комбинация антитимоцитарного глобулина и циклоспорина А или монотерапия любым из этих препаратов) считается наиболее эффективной у больных с Миелодиспластическим синдромом младше 60 лет, низкого риска по IPSS с гипоклеточной морфологией костного мозга и небольшим периодом предшествующей трансфузионной терапии [5].
Спленэктомия проводится у больных МДС с гипоплазией кроветворения в любом возрасте, после не эффективной комбинированной иммуносупрессивной терапии и при отсутствии признаков прогрессии МДС.
В настоящее время имеются клинические данные по применению иммуномодулирующих препаратов (талидомид и леналидомид) при лечении МДС. Леналидомид – модифицированное производное талидомида, обладает иммуномодулирующим, противовоспалительным, цитостатическим и антиангиогенным действием. В исследованиях была доказана высокая эффективность леналидомида у больных МДС с del (5q). Препарат обладает прямым цитостатическим действием на патологический клон клеток с del (5q) и стимулирующим на нормальные клетки эритропоэза. В 2011 г. в исследованиях было установлено, что при назначении леналидомида 10 мг/ сутки с 1 по 21 день каждые 28 дней у больных с МДС в 56 % случаев наблюдалась полная независимость от гемотрансфузий, а цитогенетический ответ был получен у половины больных [5]. В настоящее время считается, что лечение леналидомидом рекомендуется трансфузионнозависимым больным МДС с del (5q) или с увеличением числа бластных клеток, из группы низкого или промежуточного-1 риска по IPSS, которые не являются кандидатами на терапию эритропоэтинами или не получили эффекта от их применения.
В 2011 году мы публиковали статью [1] о собственном опыте лечения больной с МДС препаратом, ингибирующим метилирование ДНК – децитабином (дакогеном). В настоящей статье мы хотим рассказать о дальнейшей судьбе этой больной и нашем опыте лечения ее в последующем иммуномодулирующим препаратом – леналидомидом.
Больная Л., 1952 г.р., наблюдалась в поликлинике у гематолога с 2002 по 2008 год. Впервые в 2002 году у пациента выявилась анемия (в пределах 100-90 г/л). До 2005 г. пациент принимала препараты железа, витамины группы В. В 2005 году анемия усугубилась, гемоглобин стойко снизился до 70-80 г/л, без каких либо изменений на фоне лечения. В пунктате костного мозга выявлены умеренные изменения – гиперклеточный пунктат, в котором были равномерно увеличены все ростки миелопоеза с нарушением вызревания. В мазке бластов 1,6 %, с равномерным выраженным мегалобластоидным компонентом. В ходе дифференциальной диагностики причин анемического синдрома (онкопатология, аутоиммунный процесс и т.д.), причин упорной рефрактерной анемии, не выявлено.
В апреле 2008 года для уточнения диагноза и лечения больная была госпитализирована в гематологическое отделение ГКБ №7, где при повторном исследовании костного мозга на фоне сужения красного ростка найдено 30 % сидеробластов, кольцевидные формы 18 %. Проведена трепанобиопсия – жировая ткань и костномозговые элементы в соотношении 2:1, 3:1, т.е. отмечалось уменьшение кроветворных элементов. Данных за миело- и лимфопролиферацию не обнаружено. В ходе полученных данных у пациента диагностирован миелодиспластический синдром по типу рефрактерной анемии с кольцевидными сидеробластами, с промежуточной группой, с риском 1. Больной в связи с выраженным анемическим синдромом неоднократно проводились переливания эритроцитарной взвеси, в терапии использовался эпоэтин альфа из расчета 10 000 млн. МЕ 3 раза в неделю длительным курсом, в том числе в составе амбулаторной терапии.
В сентябре 2009 г. впервые проведено цитогенетическое исследование костного мозга, выявлен кариотип женщины, мозаичный вариант со структурными перестройками по типу делеции 5 q –del (5) (q31; q35). В миелограмме белый росток несколько угнетен, бластов 4,1 %. Красный росток представлен нормобластами 30,2 %; мегалобластами 1 %; соотношение белого и красного ростков 2,2:1; индекс созревания эритробластов 0,93; полихромазия, мегакариоцитов 8 на100 полей зрения.
Диагноз был скорректирован как миелодиспластический синдром по типу рефрактерной анемии с изолированной делецией 5q, промежуточная группа риска -1 (по IPSS), тяжёлое течение.
При отсутствии эффекта от проводимой терапии, привязанность к частым переливаниях крови и ее компонентов, наличие хромосомной абберации -del(5), больной была назначена терапия новым высокотехнологичным препаратом для эпигенетической терапии миелодиспластического синдрома – децитабином.
С октября 2009 по март 2010 года проведены 5 курсов лечения Дакогеном 50 мг № 5 в вену на фоне сопроводительной терапии.
Было проведено 5 курсов лечения дакогеном, получена клинико-гематологическая ремиссия, нормализовались показатели крови, пациентке удалось отказаться от частых трансфузий крови. Ремиссия продолжилась 14 месяцев. В течение этого времени пациент находился на учете у врача гематолога в поликлинике. Терапия заболевания полностью отсутствовала. Удалось добиться стабилизации показателей красной крови: гемоглобин оставался в пределах 120 г/л, но при проведении контрольного исследования кариотипа костного мозга хромосомная аномалия клеток стабильно обнаруживалась (del (5) (q31; q35).
С весны 2011 года началось снижение гемоглобина до 105 г/л. В контрольной гемограмме в июне 2011 г. снижение гемоглобина до 85 г/л.
С 2011 по 2013 г. госпитализации в гематологическое отделение 1 раз в 2-3 месяца, с проведением гемотрансфузий эритроцитарной взвеси № 3-4, введением стимуляторов эритропоэза.
В октябре 2013 г. при контрольном цитогенетическом исследовании костного мозга делеция 5q сохраняется.
С 2014 г. госпитализируется практически ежемесячно для проведения гемотрансфузий № 3-4 на фоне введения стимуляторов эритропоэза.
С декабря 2015 года, согласно национальным клиническим рекомендациям, пациентке было начато лечение леналидомидом 25 мг 2 раза в неделю. На фоне приема отмечала периодически кожные реакции (уртикарные высыпания по телу, «летучие», разной интенсивности, без строгой связи с приемом препарата, купирующиеся приемом антигистаминных средств). В последующем больная госпитализировалась в отделение еще дважды (в январе и апреле 2016 г.) с клинико-гематологическим ухудшением (анемические жалобы, в гемограмме гемоглобин 59 г/л, лейкоциты 1,69 тыс., тромбоциты 64 тыс., сегментоядерные 43 %, моноциты 6 %, лимфоциты 4 %, эозинофилы 5 %, бласты 1 %, ретикулоциты 3 ‰, СОЭ 41 мм/ч). Проводилась гемокомпонетная терапия на фоне стимуляторов эритропоэза.
В июне 2016 г. – в гемограмме лейкоцитов 1,9 тыс., гемоглобин 113 г/л, эрироцитов 2,88 млн, тромбоцитов 40 тыс., палочкоядерных лейкоцитов 2 %, сегментоядерных 31 %, эозинофилов 3 %, лимфоцитов 56 %, моноцитов 8 %, ретикулоцитов 56 ‰, СОЭ 13 мм/ч. Очагов инфекции, геморрагического синдрома нет.
В июле 2016 г. – лейкоцитов 3,6 тыс, гемоглобин 133 г/л, эритроцитов 3,30 млн, тромбоцитов 52 тыс., сегментоядерных 46 %, эозинофилов 2 %, лимфоцитов 46 %, моноцитов 6 %, ретикулоцитов 34 ‰, СОЭ 9 мм/ч.
В августе 2016г. проведено рестадирование, констатирована ремиссия (нормализация гемоглобина и эритроцитов, увеличение числа лейкоцитов, отсутствие анемического и геморрагического синдромов). В миелограмме (15.08.2016) – бластов 1,4 %, эритробластов 0,8 %; пунктат гиперклеточный, преобладает эритропоэз, в гранулопоэзе присутствует тенденция к нарушению вызревания. Мегакариоцитов 4-6 в поле зрения. Цитогенетическое исследование 18.08.2016 г. – при стандартном кариотипировании обнаружена делеция 5q(q13q33) в 1 метафазе из 20. При исследовании FISH делеция 5(q33) обнаружена в 20 % ядер.
Стимуляторы эритропоэза были отменены. Ленолидомид 25мг х 2 раза в неделю, больная получала до декабря 2016 года. Последнее цитогенетическое исследование проведено в марте 2017 года: делеция 5q(q13q33) в 3 метафазах из 20. При исследовании FISH делеция 5(q33) выявлена в 11 % ядер. В апреле 2017 г. в анализе крови гемоглобин 146 г/л, эритроциты 49 млн, лейкоциты 31тыс., тромбоциты 47 тыс.
Больная продолжает наблюдаться амбулаторно, она активна, жалоб не предъявляет, анемического, геморрагического синдромов, очагов инфекции нет. В последнем анализе крови от августа 2017 года со стороны эритроцитарного и лейкоцитарного ростков отклонений от нормы не наблюдается, остается умеренная тромбоцитопения (гемоглобин 138 г/л, эритроциты 4,01 млн, лейкоциты 6,4 тыс., тромбоциты 74 тыс., лейкоцитарная формула без патологии, СОЭ 12 мм/час). В миелограмме пунктата клеточный дисморфизм представлен преимущественно за счет гранулоцитопоэза, эритробластов 1,8 %, мегакариоцитов 1-2 в препарате.
МДС остается одной из актуальных проблем в гематологии, так как характеризуется низкой продолжительностью жизни пациентов и быстрой трансформацией в острый лейкоз. В последнее время разрабатываются новые подходы к лечению этого заболевания с целью увеличения продолжительности и улучшения качества жизни пациентов. В частности, была выявлена высокая эффективность гипометелирующих препаратов, а в последствие иммуномодулирующего препарата (леналидомида) у больных МДС с делецией 5q. Но клинических наблюдений по назначению леналидомида у больных МДС на сегодняшний день недостаточно, не ясной, например, остается оптимальная продолжительность терапии леналидомидом, нет достаточной информации, касающейся безопасности этого метода лечения. Наш опыт лечения больной МДС с делецией 5q также подтверждает высокую эффективность леналидомида в лечении этой патологии. Наша пациентка получала леналидомид 25 мг х 2 раза в неделю в течение года. Препарат был назначен по поводу рецидива заболевания, который развился через 14 месяцев ремиссии, достигнутой на терапии дакогеном. Положительный эффект леналидомида наблюдался через 6 месяцев от начала терапии. У больной исчезла потребность в гемотрансфузиях, нормализовались показатели эритроцитарного и гранулоцитарного ростков, повысились цифры тромбоцитов, уменьшился процент делеции 5q. Нежелательных явлений в процессе лечения леналидомидом у больной не наблюдалось, за исключением появления легких кожных реакций (уртикарные высыпания без строгой связи с приемом препарата, купирующиеся приемом антигистаминных средств). Исходя из вышесказанного, можно сделать вывод, что метод лечения леналидомидом больных МДС с делецией 5q обладает высокой эффективностью и безопасностью.
Трепанобиопсия костного мозга при миелодиспластических синдромах (МДС)
Трепанобиопсия костного мозга при миелодиспластических синдромах (МДС)
Трепанобиопсия костного мозга позволяет охарактеризовать общую клеточность, определить топографию клеточных элементов гемопоэза разных уровней дифференцировки, архитектонику стромы, различные реактивные изменения. Исследование материала трепанобиопсии позволяет расширить информацию о кроветворении, полученную при пункции. По сравнению с исследованием аспирата костного мозга этот метод выявляет фиброз, более точно оценивает клеточность костного мозга, а также может обнаружить дополнительные признаки дисплазии гемопо-этических клеток разных ростков кроветворения. Однако только на основании данных трепанобиопсии нельзя установить вариант миелодиспластического синдрома.
В 1986 г. В. Frisch и R. Bartl разработали классификацию миелодиспластического синдрома на основании гистологических критериев. Эта классификация не нашла применения, однако полученные результаты стали широко использоваться в качестве дополнительных диагностических признаков заболевания: наличие незрелых клеток-предшественников в расширенных синусах, отека и эритроцитарных экстравазатов, ретикулинового фиброза, плазмоцитоза, железосодержащих макрофагов и скоплений лимфоидных клеток в виде узелков. Характерным гистологическим признаком миелодиспластического синдрома считается атипичная локализация мие-лоидных предшественников — АЛМП (ALIP) в виде утраты паратрабекулярной локализации миелоидных предшественников и расположения их в центральных отделах костномозговых синусов.
Исследования лимфоидных узелков показали, что они встречаются в четверти случаев, их наличие ассоциировано с низким уровнем гемоглобина (р = 0,03) и ретикулиновым фиброзом (р = 0,01). Лимфоциты узелков имеют обычную морфологию и экспрессируют CD20.
Дальнейшие гистологические исследования (анализ 1895 трепанобиоптатов 575 больных миелодиспластическим синдромом) существенно не дополнили представления о морфологической картине костного мозга, однако в очередной раз продемонстрировали важность проведения трепанобиопсии и позволили детально охарактеризовать «гипопластический» и «фиброзный» гистологические варианты заболевания, представляющие существенные трудности для дифференциальной диагностики миелодиспластического синдрома.
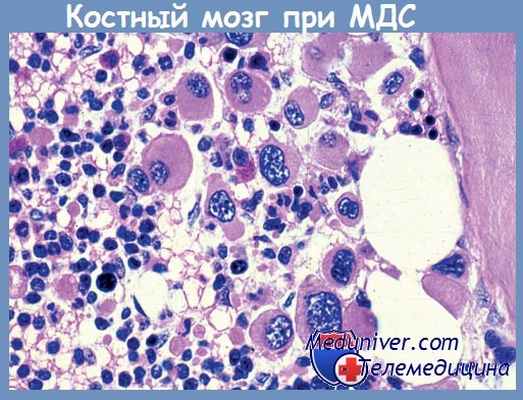
По данным A. Georgii и соавт., в большинстве случаев у больных обнаруживался гиперклеточный костный мозг (75,2 %), реже — нормоклеточный (14,4 %) и гипоклеточный (10,4 %). Основой выделения авторами «гипопластического» варианта являлось снижение числа гемопоэтических клеток менее 30 % относительно жировой ткани. У женщин этот вариант миелодиспластического синдрома встречался достоверно чаще, чем гиперклеточный (57% и 43% соответственно). Дисплазия клеток гранулоцитарного и эритроидного ростков диагностировалась в равной степени.
У большинства пациентов с гипопластическим миелодиспластическим синдромом обнаруживалась морфологическая картина, обозначенная авторами как «миелит». Она была представлена гиперплазией эндотелия капилляров и сопровождалась инфильтрацией тучными клетками, лимфоцитами, плазматическими клетками и тельцами Русселля (Russell bodies, синоним — «фуксинофильные тельца» — плазматические клетки с гиперпродукцией и задержкой в них иммуноглобулинов). При гипопла-стическом МДС выявлялся фиброз костного мозга, который встречался достоверно реже по сравнению с гиперпластическим вариантом. Среди показателей крови отмечено только достоверно более выраженное уменьшение уровня тромбоцитов при гипопла-стическом варианте миелодиспластического синдрома по сравнению с гиперпластическим.
По данным Н. Maschek и соавт. (исследование трепанобиоптатов 352 больных), среди ФАБ-вариантов гипопластический миелодиспластический синдром чаще встречался при РА. Прогноз при гипопластическом МДС существенно не отличался от других вариантов, отмечена только тенденция к большей продолжительности жизни.
«Фиброзный» вариант миелодиспластического синдрома устанавливается при выявлении в материале трепанобиопсии прежде всего ретикулиновых или, значительно реже, коллаге-новых волокон. Существует 3 степени выраженности фиброза. Первая характеризуется наличием ретикулиновых волокон, образующих тонкопетлистую сеть, вторая — утолщенными волокнами, формирующими пучки, третья — большим числом пучков ретикулиновых волокон и присутствием коллагеновых волокон. Ретикулиновые волокна выявляют методом серебрения. Третья степень фиброза при миелодиспластическом синдроме (МДС) встречается достаточно редко (по данным A. Georgii и соавт. — у 18 % из 575 больных). В целом, по данным литературы, частота обнаружения фиброза костного мозга при миелодиспластическом синдроме (МДС) колеблется от 6 % до 65 %, что может объясняться разными критериями выделения этого гистологического варианта и различиями в используемых методах исследования.
Для фиброзного варианта характерна гиперплазия и дисплазия клеток мегакариоцитарного ростка. По данным Н. Maschek и соавт., при этом варианте достоверно чаще обнаруживались хромосомные аномалии, были более выраженными анемия и тромбоци-топения. Среди ФАБ-вариантов фиброзный МДС чаще встречался при ХММЛ. При фиброзном варианте отмечена относительно короткая продолжительность жизни — медиана выживаемости 9—10 мес. По данным других исследователей, она может быть существенно больше — 29 мес.
Следует иметь в виду, что иногда встречаются нарушения гемопоэза, которые могут сопровождаться увеличением размеров селезенки и наличием лабораторных показателей, характерных для хронических миелопролиферативных заболеваний, в сочетании с признаками миелодиспластического синдрома (МДС). В подобных ситуациях используют термин классификации ВОЗ 2001 г. — миелодис-пластическое/миелопролиферативное заболевание неклассифицируемое. Его диагностические признаки указаны в статьях по дифференциальной диагностике.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Миелодиспластический синдром
Миелодиспластический синдром (МДС) – группа гематологических заболеваний, обусловленных нарушением работы костного мозга по воспроизведению одного или более типов клеток крови: тромбоцитов, лейкоцитов, эритроцитов. У людей, страдающих МДС, костный мозг, компенсируя естественный процесс уничтожения клеток крови селезенкой, не в состоянии воспроизвести их в нужном количестве. Это приводит к увеличению риска инфекций, кровоточивости и анемии, которая также проявляется усталостью, одышкой или сердечной недостаточностью. Развитие МДС может носить как спонтанный характер (без видимых причин), так и быть обусловленным использованием химиопрепаратов, облучения. Последний вариант МДС часто называют «вторичным», и хотя встречается он гораздо реже, хуже поддается лечению. Подавляющее большинство случае «первичного» МДС развивается у людей старше 60 лет, в детском возрасте болезнь встречается редко.
Клиническая картина МДС
В подавляющем большинстве пациенты обращаются за помощью с жалобами на усталость, утомляемость, одышку при физической нагрузке, головокружения – симптомами, связанными с развитием анемии. Остальным же пациентам диагноз устанавливается случайно, при лабораторном тестировании анализов крови, сделанных по другим причинам. Реже диагноз устанавливается при лечении инфекции, геморрагического синдрома, тромбоза. Такие признаки, как потеря веса, немотивированная лихорадка, болевой синдром, также могут быть манифестацией МДС.
Диагностика МДС базируется, прежде всего, на лабораторных данных, которые включают:
- полный клинический анализ крови;
- цитологическое и гистологическое исследования костного мозга;
- цитогенетический анализ периферической крови или костного мозга для выявления хромосомных изменений.
Обязательные диагностические мероприятия при МДС
В обязательный перечень диагностических мероприятий входят:
- Каждому пациенту должно быть проведено морфологическое исследование аспирата, взятого из костного мозга. Это требуется, однако, не является необходимым у пожилых пациентов, у которых установление диагноза МДС не изменяет тактику лечения или тяжесть состояния не позволяет провести исследование. Только на основании морфологического исследования диагноз МДС поставить невозможно – минимальные диагностические критерии не всегда ясны. Трудности возникают, потому что множество реактивных нарушений связано с дисплазией кроветворения, а умеренные диспластические изменения часто отмечаются у здоровых людей с нормальной кровью.
- Каждому пациенту должна быть выполнена трепанобиопсия костного мозга. Гистология костного мозга служит дополнением к уже полученной морфологической информации, следовательно, биопсия должна быть выполнена во всех случаях подозрения на МДС.
- У всех пациентов должен быть выполнен цитогенетический анализ.
Хромосомные нарушения подтверждают присутствие патологического клона и являются определяющими при решении вопроса о наличии МДС или реактивных изменений.
Классификация МДС основывается на количестве и типе бластных клеток, а также наличии хромосомных изменений, при этом тип МДС у пациента по мере развития заболевания может изменяться в сторону прогрессирования, вплоть до развития острого миелобластного лейкоза у 10% пациентов. Это система классификации используется ВОЗ.
Возможно, самая полезная система клинической классификации для МДС – Международная Прогностическая Система (IPSS). Эта модель была разработана для оценки таких переменных категорий как возраст, тип бластных клеток, генетические изменения. На основании этих критериев было выявлено 4 группы риска – низкий, промежуточный 1, промежуточный 2 и высокого риска.
Рекомендации по лечению основываются именно на отношении пациента к какой-либо из групп риска. Так пациент с низким уровнем риска может жить много лет прежде, чем потребуется лечение МДС, в то время как человек с промежуточным или высоким риском обычно нуждается в немедленном начале лечения.
Всемирная организация здравоохранения (ВОЗ), основываясь на уровнях доказательности, издала предложения о новой классификации МДС.
- Рефрактерная анемия (РА)
- Рефрактерная цитопения с мультилинейной дисплазией (РЦМД)
- Миелодиспластический синдром с изолированной del (5q)
- Миелодиспластический синдром неклассифицируемый (МДС-Н)
- Рефрактерная анемия с кольцевидными сидеробластами (РАКС)
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС)
- Рефрактерная анемия с избытком бластов-1 (РАИБ-1)
- Рефрактерная анемия с избытком бластов-2 (РАИБ-2)
В настоящее время нет никакого иного способа радикального лечения МДС кроме пересадки костного мозга, хотя существует множество схем для контроля симптомов, осложнений и улучшения качества жизни.
Рекомендации NCCN предлагают, чтобы выбор лечения был основан на возрасте пациента, оценке возможности пациента выполнять нормальные ежедневные задачи и группе риска.
- Высокоинтенсивная терапия требует стационарного лечения и включает интенсивную полихимиотерапию и трансплантацию стволовых клеток.
- Лечение низкой интенсивности включает методы, не требующие длительного стационарного лечения, проводящиеся в амбулаторных условиях или в условиях дневного стационара, – низкодозная химиотерапия, иммунодепрессивная, заместительная терапии.
- Пациенты моложе 61-летнего возраста с минимальными признаками и находящиеся в группе промежуточного риска 2 или высокого риска (ожидаемое выживание 0.3-1.8 года) требуют высокоинтенсивной терапии.
- Пациенты низкой или промежуточной 1 категории (ожидаемое выживание 5-12 лет) лечатся терапией с низкой интенсивностью.
- Пациенты моложе 60-летнего возраста с хорошим статусом и ожидаемым выживанием между 0.4 и 5 годами обычно лечатся схемами низкой интенсивности, хотя могут рассматриваться как кандидаты для высокоинтенсивной терапии, включая трансплантацию.
- Для пациентов с ограниченным сроком жизни рекомендуются поддерживающая и симптоматическая терапии и/или методы лечения низкой интенсивности.
Лечение низкой интенсивности
Поддерживающая терапия является важной частью лечения, и учитывает, как правило, пожилой возраст пациентов, она включает симптоматическую терапию, направленную на поддержание уровня лейкоцитов, тромбоцитов, эритроцитов. Эта терапия призвана улучшить качество жизни и продлить её продолжительность.
- Трансфузия эритроцитарной массы необходима для купирования анемического синдрома. При необходимости неоднократных и массивных трансфузий возникает риск перегрузки железом, что требует использование хелатной терапии.
- Переливание тромбоцитов требуется для профилактики или купирования кровоточивости и, как правило, не ведёт к отдаленным осложнениям.
- Гемопоэтические ростовые факторы – белки, способствующие росту и развитию клеток крови, их использование позволяет сократить потребность в заместительных трансфузиях. Однако много пациентов с МДС не отвечают на ростовые факторы. Гранулоцитарный колониестимулирующий фактор (G-CSF) или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) могут увеличивать количество нейтрофилов, однако терапия только ими одними не рекомендуется. Рекомбинантный эритропоэтин (EPO, Procrit ® , Epogen ® ) способствует увеличению числа эритроцитов и уменьшает зависимость от гемотрансфузий приблизительно у 20% пациентов с МДС.
Комбинированная химиотерапия, используя G-CSF наряду с EPO, может быть более эффективной, чем использование одного только EPO, особенно у людей из низкой группы риска при пониженном фоновом уровне EPO в сыворотке.
Иммунодепрессивные препараты могут быть эффективны у пациентов с гипопластическим типом кроветворения. Некоторые из этих пациентов, особенно молодые с ранней стадией болезни и гипоплазией, отвечают на иммунодепрессивные методы лечения, которые противостоят иммунной атаке на костный мозг. Использование иммунодепрессивной терапии может позволить 50-60% пациентам с HLA DR2 типом ткани прекратить заместительную терапию.
Схемы иммунодепрессивных методов лечения включают антитимоцитарный глобулин (ATG) и циклоспорин. ATG обычно используется в качестве внутривенной инфузии один раз в день в течение 4 дней, в то время как циклоспорин обычно назначает перорально (приём таблеток) на длительное время, до развития тяжелых осложнений или прогрессирования МДС на фоне лечения. Наиболее частыми осложнениями терапии ATG можно считать сывороточную болезнь, купируемую назначение стероидных гормонов.
Производные талидомида – препарата, стимулирующего иммунную систему и его аналоги (Revlimid ® , lenalidomide), – успешно используются в лечении других гемобластозов (лимфомы, множественная миелома).
Lenalidomide особенно эффективен у пациентов с анемией из низкой или промежуточной 1 групп МДС с повреждением 5 хромосомы (синдром 5q минус).
Низкие дозы цитостатиков в монорежиме могут быть рекомендованы для людей с промежуточным или высоким риском, которые не являются кандидатами для высокодозной терапии в силу различных причин.
- Цитарабин – наиболее широко изученный препарат, хотя частота достижения полной ремиссии при его использовании ниже 20%.
- Децитабин (Dacogen ® ) – современный, весьма эффективный препарат, использование которого сопряжено с высоким риском осложнений.
Терапия МДС высокой интенсивности
Пациенты с промежуточным или высоким риском при МДС подлежат терапии режимами химиотерапии аналогично используемым для лечения острого миелобластного лейкоза ОМЛ. Однако это лечение рекомендуется относительно молодым людям (моложе 60 лет), с хорошим жизненным статусом и при отсутствии HLA-идентичного донора. Этот тип лечения лучше не применять у лиц старше 60 лет, а также при низком жизненном статусе или большом числе цитогенетических нарушений, так как сопряжен с тяжелыми осложнениями.
У некоторых пациентов поддерживающая терапия может обеспечить тот же результат, что и химиотерапия, но с более низким риском осложнений или токсичности. Некоторые пациенты добиваются большего успеха при проведении только симптоматической терапии осложнений МДС (анемии, инфекции, кровоточивости), не пытаясь излечить саму болезнь.
Как ранее упоминалось, трансплантация стволовых клеток является единственным видом лечения, который может привести к длительной ремиссии. Однако осложнения терапии могут превалировать над возможным эффектом. В прошлом пациентов старше 50 лет не рассматривали как кандидатов для такого лечения. Достижения последних пятнадцати лет позволили отодвинуть возрастную планку до 60 лет и старше. Однако приблизительно 75% пациентов с МДС на момент установки диагноза уже старше 60 лет, таким образом, обычная трансплантация может быть предложена только малой части пациентов.
Трансплантация рекомендуется для людей с промежуточным 1, промежуточными 2 и высоким риском моложе 60 лет и наличием идентичного донора, но не для пациентов с низкой группой риска. Хотя есть существенный шанс на получение ремиссии у пациентов из группы риска (60%), весьма высоки (более 40%) связанные с пересадкой смертельные случаи и частота рецидивирования в течение 5 лет. Возможно использование неродственных доноров, но в этой ситуации возраст пациента является важным фактором в успехе лечения.
Использование режимов пониженной интенсивности при трансплантации расширяет категории пациентов, которым можно провести это лечение, но долгосрочные результаты еще нуждаются в оценке. Пока создается впечатления о повышенной частоте рецидивов по сравнению со стандартной подготовкой к трансплантации.
У пациентов с МДС средняя продолжительность жизни зависит от категории риска и возраста. Есть значительные вариации течения болезни от пациента к пациенту, особенно в группе низкого риска.
Руководитель отделения гематологии
Медицинского центра Банка России,
кандидат медицинских наук
Колганов Александр Викторович
Миелодиспластический синдром (МДС)
Миелодиспластический синдром (МДС) представляет собой группу заболеваний, характеризующихся цитопенией в периферической крови, дисплазией гемопоэтических клеток-предшественников, гиперклеточностью или гипоклеточностью костного мозга и высоким риском развития острого миелолейкоза Острый миелолейкоз (ОМЛ) При остром миелолейкозе (ОМЛ) злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долго живущих клеток-предшественниц миелоидного ряда вызывает появление. Прочитайте дополнительные сведенияЕжегодное число людей в Соединенных Штатах с диагнозом миелодиспластический синдром (МДС) неизвестно. Согласно некоторым оценкам, это число составляет около 10 000, в то время как по другим оценкам оно намного выше. МДС чаще всего диагностируется у пациентов в возрасте 70 лет.
Патофизиология МДС
Миелодиспластические синдромы представляют собой группу заболеваний клональных гемопоэтических стволовых клеток, объединенных наличием различных мутаций гематопоэтических стволовых клеток, чаще всего в генах, участвующих в сплайсинге РНК. Миелодиспластические синдромы характеризуются неэффективным и диспластическим гемопоэзом и включают в себя следующее:
Рефрактерная анемия: анемия с ретикулоцитопенией; нормальный или гиперклеточный костный мозг с эритроидной гиперплазией и дизэритропоэзом; содержание бластных клеток составляет ≤ 5% ядросодержащих клеток костного мозга
Рефрактерная анемия с кольцевыми сидеробластами: то же, что и рефрактерная анемия с ретикулоцитопенией, за исключением того, что кольцевые сидеробласты составляют > 15% ядросодержащих клеток костного мозга
Рефрактерная цитопения с мультилинейной дисплазией: цитопения не определяется только эритроцитами;имеет место выраженная дисплазия предшественников лейкоцитов и мегакариоцитов
Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами с наличием кольцевых сидеробластов, которые составляют > 15% ядросодержащих клеток костного мозга
Рефракторная анемия с избытком бластов (РАИБ) (RAEB en.): цитопения ≥ 2 клеточных линий с морфологическими аномалиями гематопоэтических клеток; гиперцеллюлярный костный мозг с дизэритропоэзом и дисгранулопоэзом; разрушает от 5 до 9% (RAEB-I) или от 10 до 19% (RAEB-II) ядросодержащих клеток костного мозга.
Миелодиспластический синдром неклассифицированный: МДС, который не попадает ни в одну из определенных категорий
МДС с изолированной делецией 5q: обычно тяжелая анемия и тромбоцитоз с делецией длинного плеча пятой хромосомы.
Хронический миеломоноцитарный лейкоз (ХММЛ) и ювенильный миеломоноцитарный лейкоз (ЮММЛ): смешанные миелодиспластические/миелопролиферативные новообразования; абсолютный моноцитоз (> 1000/мкл [> 1/л]) крови; значительное увеличение количества предшественников моноцитов в костном мозге
Хронический нейтрофильный лейкоз: характеризуется нейтрофилией, гибридным геном BCR-ABL1 и отсутствием филадельфийской хромосомы.
Этиология миелодиспластического синдрома неизвестна. Риск повышается с возрастом из-за приобретенных соматических мутаций, которые могут способствовть клональной экспансии и доминированию определенных гемопоэтических стволовых клеток, и, возможно, посредством воздействия внешних токсинов, таких как бензин, ионизирующие излучение и химиотерапевтические препараты (особенно продолжительные или интенсивные курсы лечения, а также с использованием алкилирующих агентов, гидроксимочевины или ингибиторов топоизомеразы). Часто присутствуют хромосомные аномалии (например, делеции, дупликации, структурные аномалии).
Костный мозг может быть гиперклеточным или гипоклеточным Неэффективный гемопоэз приводит к анемии (встречается наиболее часто), нейтропении, тромбоцитопении, или к комбинации этих патологий, вплоть до аплазии костного мозга. У пациентов со значительной рефрактерной или хронической анемией в конечном итоге развивается перегрузка железом ввиду переливания крови и/или повышенной абсорбции железа с кишечника.
Нарушение клеточной продукции также сопровождается изменениями морфологии клеток в костном мозге и крови. Иногда развивается экстрамедуллярный гемопоэз, приводящий к гепатомегалии и спленомегалии. Во время МДС может развиваться миелофиброз Первичный Миелофиброз Первичный миелофиброз (ПМФ) – это хроническое миелопролиферативное новообразование, которое характеризуется фиброзом костного мозга, спленомегалией и анемией с наличием ядросодержащих и каплевидных. Прочитайте дополнительные сведения . Классификация основана на данных общего анализа крови и исследований костного мозга, а также учитывается кариотип и мутация. Клон МДС имеет тенденцию к трансформации в острый миелолейкоз Острый миелолейкоз (ОМЛ) При остром миелолейкозе (ОМЛ) злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долго живущих клеток-предшественниц миелоидного ряда вызывает появление. Прочитайте дополнительные сведенияСимптомы и признаки МДС
Симптомы миелодиспластического синдрома зависят от наиболее пораженной клеточной линии и могут включать бледность, слабость и утомляемость (анемия), лихорадку и инфекции (нейтропения), повышенную склонность к кровоизлияниям, петехиям и кровоточивости из слизистых оболочек (тромбоцитопения). Спленомегалия и гепатомегалия не редкость.
Миелодиспластический синдром: причины, симптомы, лечение
Термин « миелодиспластический синдром » (сокращённо МДС) объединяет различные патологии, при которых обнаруживаются цитопения (понижение концентрации форменных элементов крови), дисплазия (неправильное развитие) гемоцитобластов (предшественников кровяных клеток), гипоклеточность или гиперклеточность костного мозга.
Причины болезни
Ученые предполагают, что спровоцировать миелоидный синдром способен также парвовирус В19.
Повышают риск возникновения патологии постоянная работа с некоторыми химическими веществами (пестицидами, бензином, органическими растворителями), неблагоприятная экологическая ситуация, курение, некоторые врожденные и наследственные болезни.
Под влиянием повреждающих факторов в стволовых клетках возникают мутации, которые способствуют развитию МДС. Постепенно они накапливаются, способствуя переходу болезни в лейкоз.
Симптомы патологии
Признаки МДС зависят от того, дефицит каких кровяных клеток испытывает организм.
Выделяют 3 группы клинических проявлений:
- Анемический синдром . Наблюдается при пониженной концентрации эритроцитов либо гемоглобина. Кожа и слизистые приобретают бледный окрас, в ушах появляется шум. Человек страдает от головокружений и одышки. Он становится раздражительным, быстро устает, даже минимальные физические нагрузки причиняют усиленное сердцебиение.
- Геморрагический синдром . Следствие уменьшения числа тромбоцитов. Сопровождается усиленной кровоточивостью: носовыми, десневыми, желудочно-кишечными, маточными кровотечениями, кровоизлияниями.
- Лейкопения . Развивается при снижении уровня лейкоцитов. В результате ослабляется иммунная система, что способствует присоединению различных инфекций, повышению температуры тела.
У некоторых пациентов в число симптомов миелодиспластического синдрома входят увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия).
Диагностика МДС
Основной метод диагностики миелодиспластического синдрома – исследование крови. При МДС возможно понижение как одного показателя, так и их комбинация. Диагноз ставят только при устойчивой (не менее полугода) цитопении, если не найдены другие причины.
Если возникает подозрение на миелодиспластический синдром, делают трепанобиопсию и пункцию костного мозга. Полученный биоматериал подвергают гистологическому и цитологическому исследованию.
Чтобы исключить другие причины цитопении, пациента направляют на дополнительные лабораторные и инструментальные исследования, которые могут включать:
- биохимическое исследование крови;
- определение маркеров воспаления;
- исследование концентрации гормонов щитовидной железы;
- ультразвуковое исследование щитовидной железы, простаты, органов, расположенных в брюшной полости и в области малого таза; ; ;
- эзофагогастродуоденоскопию.
Цитопения сопровождает различные заболевания. Поэтому важно исключить другие причины: рак, аутоиммунные заболевания, хронические инфекции, нарушение гемопоэза, отравление бензином или тяжелыми металлами, нехватку меди, избыток цинка, побочное действие лекарств.
Лечение МДС
Выбор способа лечения зависит от степени и прогрессирования цитопении, группы риска, имеющихся сопутствующих заболеваний.
В зависимости от числа бластов, цитопений , выявленных генетических изменений выделяют 4 группы риска: высокий, промежуточный 1, промежуточный 2, низкий.
Единственный действенный метод лечения, обеспечивающий лечение , – пересадка костного мозга.
Все остальные способы направлены на ослабление неприятной симптоматики, предотвращение осложнений, улучшение качества жизни. Но из-за высокого риска осложнений, включая возможность смертельного исхода, отсутствия доноров трансплантацию предлагают только 5-10% больных. Обычно пересадку стволовых клеток рекомендуют пациентам моложе 65 лет с промежуточным -2 и высоким риском при наличии идентичного донора.
Выделяют 3 основные способа лечения:
- Высокоинтенсивная терапия, включающая пересадку стволовых клеток и полихимиотерапию . Назначают пациентам, входящим в группу высокого или промежуточного риска 2. При проведении химиотерапевтической терапии применяют эпигенетические модуляторы Азацитидин и Децитабин (облегчают симптоматику, предотвращают переход в острый миелолейкоз), иммуномодулятор Леналидомид ( блокирует ангиогенез опухолевых клеток , уменьшает потребность в переливании крови).
- Низкодозная химиотерапия в комбинации с заместительной и иммуносупрессивнойтерапией . Проводят при низком и промежуточном риске 1.
- Симптоматическое и поддерживающее лечение . Позволяет повысить качество жизни и увеличить ее продолжительность.
o При анемическом синдроме назначают эритропоэтины , вливают эритроцитарную массу. Но при неоднократном проведении процедуры возможна перегрузка железом, что требует хелатной терапии.
o Чтобы купировать либо предотвратить кровоточивость, прибегают к трансфузии тромбоцитов.
o При гипопластическом типе кроветворения эффективное действие оказывают иммунодепрессанты, которые защищают костный мозг от иммунной атаки.
В клинике Спиженко лечение подбирают индивидуально для каждого пациента в соответствии с международными рекомендациями и утвержденными протоколами.
Читайте также:
