Трофобласт. Кровоток в плаценте
Добавил пользователь Alex Обновлено: 27.01.2026
Все чаще признается, что именно структурные аномалии и функциональные изменения плаценты могут оказывать неблагоприятное влияние на развитие сердца плода. В этой статье мы рассматриваем роль плаценты и возможное влияние плацентарной недостаточности на плод с врожденным пороком сердца (ВПС). Сердце плода и плацента напрямую связаны, потому что они развиваются одновременно с общими регуляторными и сигнальными путями. Более того, и плацента-ассоциированные осложнения чаще встречается у беременных, вынашивающих плод с ВПС, и ответная реакция плода на плацентарную недостаточность может привести к постнатальному сохранению ремоделированного сердца. Механизмы, лежащие в основе этой оси взаимодействия плацента–плод, потенциально включают генетические факторы, окислительный стресс, хроническую гипоксию и/или ангиогенный дисбаланс. Таким образом, кровообращение мать–плацента–плод имеет решающее значение в понимании формирования ВПС. Необходимо изучение изменяющихся факторов, участвующих в этих процессах, для ранней идентификации, визуализации, количественной оценки плацентарной недостаточности и разработке новых пренатальных путей терапии в популяции пациентов с ВПС.
Ключевые слова
Для цитирования:
For citation:
Введение / Introduction
На сегодняшний день врожденные пороки сердца (ВПС) являются наиболее распространенными врожденным дефектами, выявляемыми у 1 % новорожденных [1]. Из них только в 15 % случаев ВПС связаны с генетическими аномалиями, к остальным причинам относятся эпигенетические факторы или факторы окружающей среды [2]. Таким образом, формирование и развитие плаценты играет важную роль, связывающую мать и плод.
Нормальное развитие плаценты зависит от адекватной имплантации, иммунотолерантности матери, правильного формирования плацентарного ложа, достаточной оксигенации и обмена веществ через плаценту, который обеспечивается гемохориальной плацентацией. Для этого необходима соответствующая трансформация материнских спиральных артерий миометрия трофобластом при его инвазии. В результате формируется оптимальный контакт между маткой и плацентой и хорошо развитая сосудистая сеть, которая напрямую зависит от удачной инвазии трофобласта, процессов васкулогенеза и ангиогенеза.
Органогенез сердца и плаценты плода происходит одномоментно. Дифференциация эмбриональной сердечной трубки происходит на 3-й неделе после овуляции, а сердцебиение возникает к 4-й неделе [3]. К этому моменту фетоплацентарное кровообращение состоит из двух компонентов: один направлен к желточному мешку (желточное кровообращение), а другой к плаценте (кровообращение хориона) [4]. Желточное кровообращение формируется первым, и его функция является наиболее важной при развитии сердца плода. Фетальная часть плаценты называется хорионом, где артерии хориона берут свое начало из пуповины и кровоснабжают капиллярное ложе плаценты (ворсинки хориона). В течение 5-й недели беременности, когда происходит васкуляризация плаценты, участки кровообращения хориона наблюдаются в мезенхиме ворсинок плаценты [5]. Ремоделирование и изменения в сосудистом сопротивлении плаценты происходят в конце I триместра, когда плацента окончательная сформирована.
Плацента несет уникальную функцию, потому что она одновременно является как поставщиком кислорода и питательных веществ для развивающегося плода, так и своеобразным барьером для внешних факторов, которые могут иметь огромное влияние на плод. Пути развития обоих органов включают общие гены, питательные микроэлементы (такие, как фолаты) и сходные факторы роста, такие как фактор роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) [6]. Недостаток этих общих компонентов может привести к аномалиям развития плаценты и/или сердца плода.
Аномалия плаценты / Placental abnormalities
Нарушения развития на ранней стадии могут иметь длительный эффект на структурную целостность самой плаценты. Изменения плацентарного кровообращения могут привести к аномальной форме плаценты, неправильному прикреплению пуповины (краевое, оболочечное), изменениям в схеме разветвления сосудов хориона и снижению сосудистой емкости капиллярного ложа плаценты [7]. То же самое определяется и при изменениях в сосудах хориона, которые могут предрасполагать к тромботической васкулопатии у плода, увеличивая риск развития ВПС в 6 раз [8]. Эти изменения плацентарной гемодинамики могут повлиять на кровообращение плода в вене и артериях пуповины [8][9].
Изучение плацент после родов показало связь между аномалиями плаценты и ВПС. Широкое исследование, проведенное N.B. Matthiesen с соавт. в Дании, показало, что некоторые ВПС связаны с более низкой массой плаценты, что также может влиять на рост плода [10]. Были внедрены единые критерии и термины для описания макроскопического поражения плаценты и микроскопического анализа ее изменений [11]. Например, хорионангиоз – это сосудистое изменение ворсинок хориона в плаценте, которое характеризуется гиперплазией, увеличением капиллярной плотности ворсинок в определенной области в результате гипоксии тканей. J. Rychik с соавт. продемонстрировали патологические изменения плаценты в 120 случаях, включающих несколько видов ВПС, в большинстве случаев которых наблюдалось снижение соотношения плаценты к массе тела новорожденного [12]. Также определялись тромбоз (41 %), хорионангиоз (18 %), инфаркт (17 %) и незрелые ворсинки (15 %). Изменения веса плаценты, незрелость ворсинок с пониженной васкуляризацией и повышенное отложение фиброза также наблюдались в плацентах беременностей с синдромом гипоплазии левых отделов сердца [13].
По гипотезе D.J. Barker, здоровье и предрасположенность к заболеваниям в будущем предопределяются именно внутриутробным периодом [14]. Были даже предложены новые теории, основанные на плацентарном происхождении ряда хронических заболеваний: так, например, низкая масса плаценты, задержка роста плода и низкая масса тела при рождении были связаны с гипертонией и сердечно-сосудистыми заболеваниями во взрослом возрасте [15]. Неизвестно, оказывает ли воздействие плацента на растущее сердце плода с индукцией генетических аномалий, структурных изменений плаценты или нарушениями кровотока в пуповине. По данным некоторых исследований выявлено, что воздействие на плаценту окислительного стресса вызывает ферментативное подавление уровня сероводорода. Сероводород поддерживает клетки гладких мышц сосудов, и было высказано предположение, что снижение передачи сигналов сероводорода ведет к ремоделированию сосудистого сопротивления плаценты. Также показано, что лечение сероводородом предотвращает эти изменения, предполагая способность модулировать реакцию плаценты на стресс [16–18].
Изучение патогенетических механизмов развития аномалий плаценты и их связи с формированием обструктивных ВПС – крайне актуальная задача, найдя решение которой отчасти появится понимание патогенеза ВПС. На данном этапе известно, что некоторые факторы пренатального риска могут предрасполагать плод к развитию ВПС, однако точная причина ВПС до сих пор неизвестна. Несмотря на то что послеродовой анализ плацент позволил выявить аномалии плаценты при ВПС, пренатальная оценка структуры плаценты и кровотока в утробе матери необходима для углубления понимания функции плаценты. В отличие от других органов, таких как почки или сердце, в настоящее время не существует лабораторных тестов или методов визуализации, которые в первую очередь количественно определяли бы функцию плаценты. Ультразвуковая визуализация позволяет нам исследовать вторичные показатели функции плаценты, такие как паттерны кровотока в пуповине плода по доплерометрии. Однако у плодов с ВПС сами пороки развития сердца могут изменять характер кровотока, что ограничивает значимость исследования при доплерометрии как показателя «здоровья» плаценты [19]. Доказанная связь плацентарных аномалий с обструктивными ВПС позволит изменить тактику в отношении пороков сердца, трактуя необходимость дальнейшего поиска модифицируемых факторов, играющих роль в развитии ВПС, и диагностических методов выявления нарушений плаценты во время беременности, коррекция которых поможет улучшить отдаленные результаты в данной группе пациентов.
Ангиогенез и преэклампсия / Angiogenesis and preeclampsia
Плацента и сердце плода являются сосудистыми органами, что предполагает особую важность ангиогенеза для их параллельного развития. В своем исследовании M.W. Russell с соавт. показали влияние проангиогенных генов на нарушение роста плода с ВПС [20]. В других работах выявлено, что маркеры хронической гипоксии, ангиогенный фактор VEGF и антиоксидантная активность были значительно повышены в тканях миокарда плодов с ВПС по сравнению с группой контроля [21][22]. Кроме того, уровень плацентарного фактора роста (англ. placental growth factor, PlGF) в материнской плазме снижался при беременностях плодами с ВПС. Авторы предположили, что гипоксия плаценты из-за аномального ангиогенеза могла привести к нарушению развитию сердца. Механизм, с помощью которого данный ангиогенный дисбаланс приводит к функциональной недостаточности плаценты и специфической связи с ВПС, требует дальнейшего изучения.
Другой причинной связью между плацентой и ВПС может служить преэклампсия (ПЭ), которая определяется как начало гипертензии и протеинурии (или дисфункция органов-мишеней) после 20 нед беременности. Патогенез ПЭ сложен, многофакторен и требует дальнейших исследований. Наиболее вероятными являются дисфункция эндотелия матери и аномальное развитие плаценты с ее функциональной недостаточностью, которая высвобождает медиаторы в материнское кровообращение (предположительно, это растворимые ангиогенные факторы), что приводит к характерным изменениям. Популяционное исследование, в котором анализировались данные Медицинского регистра родов Норвегии, показало, что ПЭ с ранним началом (до 34-й недели) в значительной степени связана с риском серьезных ВПС, в частности, с риском атриовентрикулярных дефектов (в 15 раз выше) [23]. Это исследование показывает представление о кардиоплацентарной оси взаимодействия; однако роль ангиогенного дисбаланса между плодом, плацентой и матерью до сих пор не определена.
Дисбаланс циркулирующих ангиогенных факторов – характерная черта ПЭ; PlGF и растворимая Fms-подобная тирозинкиназа-1 (англ. soluble Fms-like tyrosine kinase-1, sFlt-1) были внедрены в качестве биомаркеров функции плаценты и ПЭ. Текущие данные предполагают, что PlGF и sFlt-1 вырабатываются плацентой. При беременности, осложненной ПЭ, изменяется как их циркулирующий уровень, так и экспрессия в плаценте. Однако in vivo не выявлено выделение их плацентой при беременности человека. Более того, есть доказательства того, что экстраплацентарные ткани могут вносить вклад в циркулирующие уровни PlGF и sFlt-1 при нормальной и преэкламптической беременности [24].
Особенности клеточного взаимодействия в системе мать–плод / Features of cellular interactions in the mother–fetus system
Имплантация и плацентация во время беременности являются основой для нормального развития плода и здоровой беременности. Во время этих процессов происходит взаимодействие фетальных и материнских клеток, среди которых клетки трофобласта и различные типы децидуальных клеток, таких как макрофаги, дендритные клетки, мезенхимальные клетки и др. Обнаружено, что клетки трофобласта и натуральные киллеры – NK-клетки (англ. natural killer cells, NK cells) играют основную роль во взаимодействии в системе мать–плод и ответственны за успешную имплантацию и сохранение здоровой беременности [25].
Децидуальные NK-клетки расположены вдоль спиральных артерий матки, и помимо основной задачи в виде иммунной защиты, они ответственны за производство ряда факторов, необходимых для нормального развития плацентарного ложа [26]. В исследовании С. Tayade с соавт. показана роль PlGF у мышей, нулевых по его экспрессии. Так, PlGF, обычно экспрессируемый маточными NK-клетками и клетками трофобласта, участвует в пролиферации маточных NK-клеток и возможно в их дифференцировке [27]. Аналогично этому у людей децидуальные NK-клетки продуцируют хемокины, факторы роста, цитокины и ангиогенные факторы, важные для нормального развития и сохранения взаимодействия в системе мать–плод [28].
Клетки трофобласта и децидуальные NK-клетки взаимодействуют между собой разными путями. Известно, что трофобласт, будучи запрограммирован на инвазию, дополнительно получает сигнал от децидуальных NK-клеток через экспрессию хемокиновых рецепторов (CXCR1, CXCR3) на трофобласте [26]. Клетки трофобласта совершают эндоваскулярную инвазию, приобретают фенотип эндотелиальных клеток и находятся в прямом контакте с материнским кровотоком; при этом трофобласт экспрессирует хемокины (CXCL12), которые привлекают NK-клетки и способствуют их специфической миграции в децидуальную оболочку [29].
NK-клетки являются специализированными иммунными клетками врожденной иммунной системы, однако обладают свойством приобретенного иммунитета – памятью иммунных клеток. Учитывая этот факт, в исследовании М. Gamliel с соавт. сравнивали децидуальные NK-клетки при первой и повторных беременностях и заметили, что децидуальные NK-клетки последних отличаются уникальным транскриптом, эпигенетической подписью, а также в значительно большем количестве продуцируют ангиогенные факторы (интерферон-γ и VEGF-α) и цитокины, которые усиливают ремоделирование плацентарного ложа [30]. Такие клетки были названы децидуальными NK-клетками, обученными во время беременности (англ. Pregnancy Trained decidual NK cells, PTdNKs). В дополнение к перекрестному взаимодействию матери и плода, данные клетки характеризуются высокой экспрессией рецепторов натуральных киллеров (NKG2C) и лейкоцитарных иммуноглобулиноподобных рецепторов (англ. leukocyte immunoglobulin-like receptors, LILRB1), которые связывают лиганды HLA-G и HLA-E, экспрессированные на трофобласте [31]. Предполагается, что PTdNK-клетки, сохраняясь в эндометрии, «помнят» первую беременность и при последующих беременностях действуют с большей эффективностью для ремоделирования плацентарного ложа, улучшая плацентацию, что снижает риск развития ПЭ.
Заключение / Conclusion
Плацента играет критически важную роль в развитии сердца плода, а гемодинамика мать–плацента–плод может быть ключом к улучшению нашего понимания ВПС. Наши текущие знания о патологиях плаценты в основном основаны на патологических образцах и вторичных показателях здоровья плаценты. Чтобы обнаружить плацентарную недостаточность на ранних сроках беременности, необходимо улучшить нашу способность оценивать функцию плаценты в утробе матери. Необходимы дальнейшие исследования для определения взаимосвязи между структурой плаценты, паттернами пренатального кровотока и неблагоприятными эффектами плацентарных аномалий на плоды с различными типами ВПС. Это позволит нам распознать пренатальную адаптацию в задержке роста и послеродовое ремоделирование сердечно-сосудистой системы. Дальнейшие исследования должны быть сосредоточены на выявлении факторов, поддающихся изменению, и разработке новых пренатальных путей терапии для улучшения долгосрочных результатов в популяции пациентов с ВПС из группы высокого риска.
Список литературы
6. Neufeld G., Cohen T., Gengrinovitch S., Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999;13(1):9–22.
Об авторах
ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации
Россия
к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики,
197341 Санкт-Петербург, ул. Аккуратова, д. 2
ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации
Россия
д.м.н., директор Института перинатологии и педиатрии,
197341 Санкт-Петербург, ул. Аккуратова, д. 2
ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации
Россия
врач акушер-гинеколог, младший научный сотрудник НИЛ оперативной гинекологии Института перинатологии и педиатрии,
197341 Санкт-Петербург, ул. Аккуратова, д. 2
ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Россия
д.м.н., профессор РАН, профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
0179 Тбилиси, ул. Мераба Костава, д. 38
ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации
Россия
врач, детский кардиолог отделения детской кардиологии,
197341 Санкт-Петербург, ул. Аккуратова, д. 2
к.м.н., руководитель по медицинским и научным вопросам, 127006 Москва, ул. Садовая-Триумфальная, д. 4–10;
врач-невролог, 143081 Московская область, Одинцовский район, Лапино, 1-ое Успенское шоссе, д. 111
ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Министерства здравоохранения Российской Федерации
Россия
Трофобласт. Кровоток в плаценте
Трофобласт. Кровоток в плаценте
Отношения ворсинок к эндометрию и к материнской кровеносной системе являются следствием ранней инвазионной активности и последующей специализации, которую мы только что проследили. При развитии беременности ворсинки сильно увеличиваются в размерах, и сложность их разветвления возрастает. Они растут над дискоидальной областью chorion frondosum не равномерно, а группами, примерно по 15—16 штук. Эти участки концентрации ворсинок называются котиледонами.
Находящиеся между ними материнские ткани менее глубоко эрозированы и носят название плацентарных перегородок (септ). Между перегородками концы большинства ворсинок расположены свободно в пространстве, «вырытом» в слизистой оболочке матки. Концы других ворсинок вступают в контакт с тканями матки на дне углублений. На этом этапе своего развития быстро растущие концы ворсинок имеют большое количество клеток, составляющих основу цитотрофобласта с синтрофобластом, образующим непостоянную оболочку.
Эта измененная часть ворсинки, еще не имеющая сосудов, обычно называется клеточным столбиком. Едва эти столбики вступят в контакт со слизистой оболочкой матки, как трофобластические элементы, разрастаясь, покрывают эрозированную поверхность материнских тканей. В результате материнская кровь, проникая в губчатые участки плаценты из кровяных синусов, вскрытых инвазирующим хорионом, вступает в сеть непостоянных полостей, покрытых как со стороны плода, так и со стороны тканей матери трофобластом.
При дальнейшем развитии некоторые из ворсинок оказываются особенно тесно связанными с материнской тканью. Трофобласт над их концами исчезает и соединительная ткань дистальных концов этих якорных ворсинок оказывается соединенной с соединительной тканью эндометрия. Большинство ворсинок продолжает лежать более или менее свободно в углублениях decidua basalis.
Материнская кровь попадает в пространство вокруг ворсинок из бесчисленных мелких кровеносных сосудов, вскрытых в ходе эрозионного процесса. После оттока этой крови в вены матки она заменяется кровью, поступающей из артерий матки, и в результате ворсинки постоянно погружены в свежую материнскую кровь.

При изучении в высшей степени схематического изображения, представленного на рисунке, следует остерегаться далеких от реальности представлений. На срезах находят спутанную сеть ветвящихся ворсинок, сильно перемешанных с сохранившимися частями эндометрия, имеющими непостоянную форму. Обширные же на схеме «кровяные озера» оказываются лишь крошечными щелями между тканями матери и плода. Кровь, которой омываются ворсинки, не изливается в отводящие ее широко открытые сосуды, а последние не имеют такого вида, как показано на схеме.
На самом деле происходит постоянное просачивание крови в губчатую ткань плаценты из мириадов мелких сосудов, стенки которых в той или иной степени были повреждены под воздействием растущего трофобласта. Медленное движение крови способствует более полному обмену веществ между кровеносными системами плода и матери, но параллельно оно создает особый риск, связанный с вероятностью свертывания крови.
Несомненно, к кровотечению из полностью или частично вскрытых сосудов добавляется просачивание плазмы и лимфы из неповрежденных материнских сосудов в прилежащие ткани. Несмотря на все эти детали, упрощенная схема, представленная на рисунке, прекрасно подчеркивает значение сложных связей между тканями плода и матери, наблюдаемых в плаценте.
Необходимо только постоянно иметь в виду, что структуры, представленные там в схематическом виде, в действительности гораздо более многочисленны, сложны и запутаны. Общая поверхность ворсинок в полностью сформированной плаценте равняется 7 (Dodds) — 14,7 m2 (Dees-Mattingly), т. е. площади, достаточной для обмена веществ между плодом и матерью. Следует подчеркнуть, что в ходе беременности никогда не происходит непосредственного соприкосновения кровеносных систем плода и матери.
Кровеносная система плода с самого момента своего возникновения является замкнутой системой. По отношению к обмену веществ ворсинки хориона находятся точно в таком же положении, как и ворсинки кишечника. Они омываются средой, из которой извлекают вещества, могущие быть адсорбированными их кровеносными сосудами. Но весь обмен в обоих случаях должен осуществляться в результате диффузии и адсорбции через эндотелиальные стенки кровеносных сосудов и покрывающие их соединительную ткань и эпителий. Однако эту параллель не стоит проводить слишком далеко, так как в кишечнике мы имеем дело лишь с односторонним переносом веществ.
В плаценте же происходит не только абсорбция питательных веществ и кислорода из материнского кровообращения, но и возврат в материнскую кровь углекислоты и азотистых продуктов метаболизма эмбриона. Иначе говоря, плацента должна осуществлять для эмбриона функции, которые во взрослом организме выполняются легкими, желудочно-кишечным трактом и почками.
- Вернуться в оглавление раздела "Акушерство."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Плацентарная недостаточность
Итак, плацента – это важный орган, который образуется только во время беременности. Образуется плацента из хориона - зародышевых оболочек плода. В самом начале беременности ворсины хориона – выросты оболочки - равномерно покрывают всю поверхность плодного яйца, начиная со второго месяца беременности с одной стороны плодного яйца ворсины начинают удлиняться, увеличиваться в размерах и формируют плаценту.
Внутри ворсин течет кровь малыша, а снаружи они омываются кровью матери. Между кровотоком мамы и малыша расположен всего один слой клеток, который и играет роль барьера между организмом матери и ребенка. Благодаря этой мембране кровь матери и плода не смешивается.
Однако в последние годы стало известно, что клетки крови плода все-таки проникают через плацентарный барьер в кровоток матери и благодаря этому стало возможным проведение генетических анализов и определение хромосомных аномалий, резуса фактора и пола плода по крови беременной женщины (неинвазивный пренатальный тест).
В плаценте происходит постоянный обмен веществ между мамой и ребенком. Из материнской крови к плоду поступает кислород и питательные вещества, от плода обратно к матери углекислый газ и продукты обмена, подлежащие выведению из организма.
Плацентарный барьер выполняет иммунологическую функцию, поскольку пропускает некоторые защитные антитела – клетки крови, обеспечивающие борьбу с инфекционными агентами, кроме того он является непроницаемым для некоторых вредных веществ, вирусов и бактерий. К сожалению, плацентарный барьер легко преодолевают наркотические вещества, алкоголь, никотин, компоненты многих лекарств и некоторые вирусы.
Важной функцией плаценты является выработка гормонов и биологически активных веществ. В первую очередь это гормоны, важные для успешного вынашивания беременности, например хорионический гонадотропин, плацентарный лактоген, эстрогены и др.
К сожалению, не всегда все складывается вполне благополучно. В силу самых различных причин на разных сроках беременности могут происходить отклонения в развитии и функционировании плаценты. Изменения эти никогда не проходят бесследно для мамы и малыша, а зачастую имеют грозные последствия.
Если плацента перестает выполнять свои функции в полной мере, развивается так называемая плацентарная недостаточность. По сути, она заключается в ухудшении кровообращения в системе мать-плацента-плод.
Виды и причины плацентарной недостаточности
Врачи различают острую и хроническую плацентарную недостаточность:
Острая плацентарная недостаточность
Это состояние, требующее экстренного вмешательства врачей. Она характеризуется стремительным ухудшением плацентарного кровотока. Острая плацентарная недостаточность возникает в основном в результате отслойки плаценты или гибели отдельных участков ткани плаценты например при образовании тромбов в сосудах. Причиной отслойки может послужить травма живота, антифосфолипидный синдром.
Фосфолипиды – это сложные жиры, которые входят в состав оболочек всех клеток организма. В ряде случаев иммунная система организма вырабатывает большое количество антител к некоторым собственным фосфолипидам и белкам, связывающим эти липиды. Они называются антифосфолипидные антитела и при взаимодействии с клетками организма вызывают повреждение клеток и активацию свертывающей системы крови, что приводит к тромбообразованию.
Антифосфолипидный синдром является самой частой причиной тромботических осложнений при беременности, в том числе причиной отслойки плаценты и острой плацентаной недостаточности.
Вызвать отслойку плаценты может также тяжелое течение гестоза – грозного осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Острая плацентарная недостаточность развивается при отслойке более 2/3 поверхности плаценты.
В случае развития острой плацентарной недостаточности необходимо максимально быстро провести операцию кесарева сечения для сохранения жизни малыша и мамы.
Хроническая плацентарная недостаточность
Значительно чаще у беременных женщин встречается хроническая плацентарная недостаточность. В этом случае происходит нарушение формирования и созревания плаценты, уменьшается маточно-плацентарный и плодово-плацентарный кровотоки, ограничивается газообмен и обмен веществ в плаценте, снижается синтез плацентарных гормонов. Все эти изменения определяют недостаточное поступление кислорода и питательных веществ малышу, вызывают задержку роста и развития плода.
Причинами плацентарной недостаточности чаще всего являются перенесенные аборты, особенно хирургический аборт при первой беременности, курение, при этом количество и крепость выкуриваемых сигарет значения не имеют, поскольку на формировании неполноценных сосудов плаценты негативное действие оказывает табачный дым, а не никотин.
В группу риска по развитию плацентарной недостаточности входят также женщины с хроническими заболеваниями, такими как артериальная гипертензия, железодефицитная анемия, пиелонефрит, сахарный диабет, заболевания щитовидной железы.
В последние годы наблюдается значительный рост плацентарной недостаточности, вызванной бактериями, вирусами, грибами. Причиной этого может быть как острая инфекция, перенесенная будущей мамой во время беременности, так и активация хронического инфекционного процесса в организме беременной женщины.
Немаловажное значение в формировании хронической плацентарной недостаточности играет патология матки: эндометриоз, пороки развития матки (седловидная, двурогая). Фактором риска врачи считают также миому матки. Безусловно, целый ряд лекарственных средств оказывает неблагоприятное влияние на формирование плаценты и развитие плода. В настоящее время определен список препаратов, не разрешенных к применению во время беременности.
Также большое значение в развитии плацентарной недостаточности имеет тромбофилия – повышенная склонность организма к образованию сгустков крови - тромбов в сосудах.
В некоторых случаях плацентарная недостаточность может быть обусловлена наличием хромосомных нарушений у плода, в частности при синдромах Дауна (наличие дополнительной 21 хромосомы у плода) или синдроме Эдвардса (дополнительная 18 хромосома у плода) уже в ранние сроки беременности диагностируется нарушение функции плаценты.
Следует отметить, что среди осложнений беременности, наиболее часто приводящих к развитию хронической плацентарной недостаточности, существенным фактором является преэклампсия (или поздний гестоз) – это осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Независимо от факторов, способствующих развитию плацентарной недостаточности, в основе ее лежат нарушения кровообращения в маточно-плацентарном комплексе, приводящие к нарушению всех функций плаценты. Следовательно, симптомы хронической плацентарной недостаточности будут обусловлены недостатком поступления кислорода и питательных веществ к плоду.
Это прежде всего, задержка внутриутробного развития плода – отставание размеров плода и замедление темпов его роста. Часто имеют место изменение двигательной активности плода. Сначала может быть некоторое усиление движений, а затем уменьшение. Нарушение защитной функции плаценты приводит к внутриутробному инфицированию плода под действием проникающих через плаценту патогенных (болезнетворных) микроорганизмов. Плод, развитие которого происходит в условиях плацентарной недостаточности, в значительно большей степени подвержен риску травматизации в родах, у них отмечается нарушение адаптации к внеутробной жизни, повышенная заболеваемость в первый год жизни.
По времени возникновения врачи разделяют плацентарную недостаточность на раннюю и позднюю.
Ранняя (или первичная) плацентарная недостаточность
Развивается до 16 недель беременности. Она возникает уже на этапе формирования плаценты и связана с заболеваниями беременной женщины, имеющимися до беременности, к примеру с патологией матки, хронической артериальной гипертензией, эндокринологическими заболеваниями. При этом происходит формированием неполноценных сосудов в плаценте.
Поздняя (или вторичная) плацентарная недостаточность
Возникает после 16 недель беременности и чаще всего связана с заболеваниями, возникшими уже во время беременности. Чаще всего это железодефицитная анемия (то есть снижение концентрации гемоглобина и железа в крови), гестационный сахарный диабет (то есть нарушение усвоения организмом глюкозы, возникшее на фоне беременности), перенесенные вирусные и бактериальные инфекции.
Важным является подразделение плацентарной недостаточности на компенсированную и декомпенсированные формы.
Компенсированная плацентарная недостаточность
Развивается, к примеру, при угрозе прерывания беременности и нетяжелых формах позднего гестоза, в случае, если эти осложнения успешно поддаются медикаментозной коррекции.
Декомпенсированная плацентарная недостаточность
Вызывает развитие задержки развития плода, хронической внутриутробной гипоксии, вплоть до гибели плода.
Диагностика плацентарной недостаточности
Лечить уже развившуюся плацентарную недостаточность практически невозможно, поэтому врачи активно стремятся выявлять беременных женщин, угрожаемых в отношении формирования нарушений функции плаценты. Если плацентарная недостаточность выявляется в 3 триместре беременности, эффективного лечения, к сожалению, не существует. Поэтому очень активно в настоящее время применяются все способы выявления в ранние сроки беременности тех женщин, в формировании плаценты которых произошли нарушения.
В первую очередь, при постановке на учет по беременности выявляют максимально значимые факторы риска – курение, перенесенные аборты, отягощенную наследственность (низкий вес при рождении, склонность к тромбозам), наличие хронических заболеваний сердца, сосудов, сахарного диабета.
Профилактические мероприятия против развития плацентарной недостаточности особенно актуальны и необходимы до 16-17 недель беременности, когда происходит формирование структур плаценты.
Значимую помощь в оценке риска развития плацентарной недостаточности оказывает пренатальный скрининг, который проводится в 11-14 недель беременности. Он проводится для выявления синдромов Дауна, Эдвардса и др. хромосомных болезней у плода. В настоящее время самым актуальным является проведение комплексного ранний скрининг беременной на прогнозирование риска развития плацентарной недостаточности, преэклампсии и внутриутробной задержки развития плода. Поскольку данный вид диагностики относится к самым современным и передовым, к сожалению, он пока не включен в перечень услуг, предоставляемых в женской консультации в рамках ОМС, но доступен всем желающим в центрах пренатальной диагностики.
Определение белков, вырабатываемых плацентой
В первую очередь проводят определение белка РАРР-А, он является также маркером хромосомных аномалий плода. Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Второй гормон плаценты, который помогает в оценке рисков плацентарной недостаточности – PIGF (плацентарный фактор роста). Его концентрация в крови снижается задолго до первых проявлений плацентарной недостаточности. Его определение применяют не настолько широко, как PAPP-A, но тем не менее многие лаборатории уже включили данный белок в пренатальный скрининг 1 триместра. Крайне важное значение при проведении скрининга 1 триместра имеет измерение кровотоков в сосудах матки. Однозначно доказано, что сужение сосудов матки, определяемое при исследовании, свидетельствует о неполноценности формирования плаценты, которое будет ухудшаться с увеличением срока беременности и приведет к снижению питания малыша и снабжения его кислородов, то есть к развитию плацентарной недостаточности и задержки развития плода. При нормальных размерах маточных сосудов в 11-14 недель беременности риск тяжелой плацентарной недостаточности ничтожно мал.
Следующее обязательное скрининговое ультразвуковое исследование проводится в 20-21 неделю беременности. При этом обязательно проводят измерения плода, чтобы оценить, нет ли отставания в росте. Ведь при кислородном голодании замедляются темпы роста плода и размеры его начинают отставать от нормы для каждого срока беременности. Кроме того врач обязательно оценивает состояние и зрелость плаценты. Во время УЗИ проводится также допплерометрия сосудов матки для выявления ранних изменений, предшествующих клиническим проявлениям плацентарной недостаточности.
У пациенток, относящихся к группе высокого риска кроме УЗИ и допплерометрии проводят также суточное мониторирование колебаний артериального давления, определение количества белка в анализе мочи, собранном за сутки, оценивают показатели системы свертывания крови.
Третье УЗИ проводится всем будущим мамам в 30–34 недели беременности. Врач измеряет окружность головы и живота крохи, длину костей его ручек и ножек, и вычисляет предполагаемый вес плода. Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
Допплерометрия
Допплерометрия сосудов плаценты и пуповины (метод исследования скоростей кровотоков в этих сосудах) так же позволяет оценить самочувствие малыша. Доктор исследует кровоток в артериях матки, пуповины, сердца и мозга ребенка. Это исследование позволяет определить, хорошо ли работает плацента, нет ли признаков нехватки кислорода у малыша, или развития гестоза у мамы. При снижении скорости кровотока в каком-либо сосуде можно говорить о нарушениях питания плода различной степени тяжести.
Вовремя проведенное обследование позволяет выявить начальные стадии дефицита кровоснабжения. В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
Кардиотокография
Это важный метод оценки состояния плода. Проводится КТГ при сроке беременности 33 недели и более, поскольку только на этом этапе внутриутробного развития малыша устанавливается полноценная регуляция деятельности сердечно-сосудистой системы плода центрами спинного и головного мозга. Запись сердцебиений плода проводят в течение 20–40 минут, а при необходимости исследование может быть продлено до 1,5 часов.
Аппарат регистрирует и записывает частоту сердцебиений малыша. Врач акушер-гинеколог оценивает кривую записи сердцебиений, эпизоды урежения и резкого учащения частоты сердечных сокращений плода и на основании этих данных делает заключение о том, насколько комфортно малыш чувствует себя в животе у мамы. К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
Лечение плацентарной недостаточности
Специфических способов лечения плацентарной недостаточности в настоящее время не существует, поскольку нет лекарственных препаратов, которые избирательно улучшают маточно-плацентарный кровоток. Именно поэтому все меры борьбы с плацентарной недостаточностью направлены на профилактику. Если пациентка относится к группе высокого риска по развитию плацентарной недостаточности, с раннего срока беременности ей назначают лекарственные препараты, эффективность которых хорошо доказана и которые предупреждают раннее развитие выраженных нарушений функции плаценты.
Если во время проведения дополнительных методов оценки состояния плода выявляются начальные нарушения поступления кислорода к малышу, проводится медикаментозное лечение, направленное на увеличение притока крови и кислорода через плаценту и обязательные контрольные обследования на фоне проводимой терапии. Если изменения серьезные и малыш испытывает выраженный дефицит кислорода и питательных веществ, состояние его страдает, то в таких случаях проводится экстренное родоразрешение.
Фетоплацентарный кровоток у многорожавших женщин с синдромом задержки развития плода Текст научной статьи по специальности «Клиническая медицина»
Результаты исследования выявили значительное повышение индексов периферического сосудистого сопротивления в маточной артерии у многорожавших женщин с неосложнённым течением беременности, что свидетельствует о нарушении кровообращения в маточно-плацентарном звене системы "мать-плацента-плод". При этом осложнении беременности и развитии синдрома внутриутробного развития плода, эти изменения усиливаются и выявляются уже во всех звеньях этой системы.
Похожие темы научных работ по клинической медицине , автор научной работы — Байматова З.К.
Допплерометрия кровотока и перинатальные исходы при плацентарной недостаточности у женщин с привычным невынашиванием
Состояние фетальной гемодинамики и закономерности её изменений в условияхантенатальной гипоксии и задержки внутриутробного развития плода
Оценка влияния препарата «Хофитол» на состояние маточноплацентарного кровотока у многорожавших женщин при фетоплацентарнои недостаточности, развившейся на фоне гестоза
Foetoplacenta Blood Current in Polydelivery Women with Syndrom of Delay of Foetus Growth
The result of investigations indicated important increasing the indexes of peripherial vessel resistence in uterine artery in polydelivery women with normal pregnant that testifies the alterations of circulation in system "mother-placenta-foetus" which are than more than strong.
Текст научной работы на тему «Фетоплацентарный кровоток у многорожавших женщин с синдромом задержки развития плода»
ФЕТОПЛАЦЕНТАРНЫЙ КРОВОТОК У МНОГОРОЖАВШИХ ЖЕНЩИН С СИНДРОМОМ ЗАДЕРЖКИ РАЗВИТИЯ ПЛОДА
Научно-исследовательский институт акушерства, гинекологии и перинатологии МЗ РТ
Результаты исследования выявили значительное повышение индексов периферического сосудистого сопротивления в маточной артерии у многорожавших женщин с неосложнён-ным течением беременности, что свидетельствует о нарушении кровообращения в маточно-плацентарном звене системы " мать-плацента-плод". При этом осложнении беременности и развитии синдрома внутриутробного развития плода, эти изменения усиливаются и выявляются уже во всех звеньях этой системы.
Ключевые слова: фетоплацентарный кровоток, гестационные осложнения, синдром внутриутробного развития плода
Введение. Снижение перинатальной заболеваемости и смертности остаётся в последние годы одной из актуальных проблем акушерства. Однако, успешное развитие перинатальной медицины невозможно без широкого использования современных методов ранней диагностики страдания плода (1).
Отставание темпов роста плода представляет собой итог глубоких сосудистых изменений и прогрессирующего снижения плацентарного кровотока вследствие недостаточного контакта спиральных артерий матки с элементами трофобласта (2,3).
Недостаточность плаценты, как правило, проявляется снижением маточного и плодово-плацентарного кровообращения. Совершенствование ультразвуковых методов исследования позволяет диагностировать ранние стадии нарушения кровообращения в плаценте, начинать адекватную терапию до развития клинических проявлений плацентарной недостаточности (4,6).
Цель исследования: изучение особенностей гемодинамики в системе мать-плацента-плод у многорожавших женщин с синдромом задержки развития плода.
Материалы и методы исследования. В работе представлены результаты исследования гемодинамики в системе " мать-плацента-плод" у 50 многорожавших женщин с задержкой внутриутробного развития плода с анемией, сердечно-сосудистыми заболеваниями, заболеваниями почек и гестационными осложнениями и 70 практически здоровых женщин. Исследование было проведено в клинике ТНИИ АГиП МЗ РТ за период с января по сентябрь 2008 г. Изучалась гемодинамика в маточной артерии, артерии пуповины и средней мозговой артерии плода в сроках гестации 30-32 недели и 36-40 недель. Использовались качественные параметры кровотока, характеризующие периферическое сопротивление: систоло-диастоличес-кое соотношение (СДО), индекс резистентности (ИР), пульсационный индекс (ПИ) (7,8).
Индексы кровотока в артерии пуповины при неосложнённом течении беременности показали тенденцию к уменьшению численных значений СДО, ИР и ИП по мере её прогрессирова-ния. Так, СДО в сроке 30-32 недели составил 2,17±0,02, ИР-0,59±0,01,ПИ- 0,94±0,02, а в сроке гестации 36-40 недель СДО составил 2,24±0,02, ИР-0,63±0,01, ПИ-0,72±0,01.
В маточной артерии, в отличие от артерии пуповины, значения систоло-диастолического соотношения, индекс резистентности и пульсационный индекс по мере прогрессирования беременности не снижались, а возрастали. Так, СДО с 1,84±0,02 в 30 недель вырос до 2,146±0,05 в 36-40 недель, ИР-4,6±0,04 и 0,64±0,01, ПИ 0,73±0,01 и 0,79±0,03. Это свидетельствует о нарушении маточно-плацентарного кровотока многорожавших женщин даже при неосложнённом течении беременности (5).
Результаты исследования кровотока в средней мозговой артерии плода при неосложнён-ном течении беременности показали, что в течение III триместра беременности отмечается уменьшение численных значений индексов периферического сосудистого сопротивления (ПСС). Так, СДО с 4,56±0,09 в сроке гестации 30-32 недели снизилось до 4,01±0,08 в сроке доношенной беременности. Эти изменения отражают интенсивный рост сосудистой сети и перераспределение гемодинамики для лучшего снабжения мозга.
При присоединении гестационных осложнений и развитии СЗРП значения индексов ПСС не снижались, а наоборот, повышались и сопровождались появлением дикротической выемки в спектре кровотока. Так, в маточной артерии значения СДО колебались в пределах от 1,94±0,02 до 2,45±0,1, ИР - от 0,48±0,01 до 0,63±0,01, ПИ - от 0,73±0,01 до 1,01±0,04.
Аналогичная картина выявлена и в артерии пуповины. Но следует отметить, что в маточных артериях степень повышения индексов СДО и ПИ больше, чем в артерии пуповины. Это может свидетельствовать о том, что гестационные осложнения у многорожавших женщин ведут к нарушению маточно-плацентарного звена системы "мать-плацента-плод", и, как следствие, к развитию СЗРП.
Нарушения кровотока в средней мозговой артерии плода носят иной характер. Индексы мозгового кровотока при осложнённом течении беременности значительно снижены, соответственно СДО составило 3,24±0,15, ИР-0,68±0,01, ПИ-1,31±0,03, что отражает механизм усиления церебральной перфузии в условиях гипоксии. Это является проявлением компенсаторной реакции при централизации кровообращения, обеспечивающего относительную стабильность мозговой гемодинамики.
У 7 многорожавших женщин с синдромом задержки внутриутробного развития плода исследование гемодинамики было проведено повторно после курса лечения в стационаре, у 5 из которых, был достигнут положительный эффект.
Индексы гемодинамики в маточной артерии, артерии пуповины и в средней мозговой артерии в результате лечения снизились, хотя и не достигли нормативных показаний. Отсутствие достаточного влияния терапии на состояние кровотока, на наш взгляд, обусловлено выраженностью исходных нарушений кровотока в системе мать-плацента-плод.
Вывод. Таким образом, результаты нашего исследования выявили значительное повышение индексов периферического сосудистого сопротивления в маточной артерии у многоро-жавших женщин с неосложнённым течением беременности, что свидетельствует о нарушении кровообращения в маточно-плацентарном звене системы "мать-плацента-плод". При этом осложнении беременности и развитии синдрома внутриутробного развития плода эти изменения усиливаются и выявляются уже во всех звеньях этой системы.
1. Абдуллаева Н.Ш., Миракилова М.М. Период ранней адаптации у детей, родившихся с ЗВУР // 49 Научн. практ. конф. ТГМУ им. Абуали ибни Сино "Адаптация, стресс, здоровье". Душанбе. 2001. С.10-14
2. Аржанова О.Н. и соавт. Плацентарная недостаточность, диагностика и лечение// С-Пб., Нордиедиздат. 2000. С. 31
4. Вафоева Н.В. Применение лазерного излучения в комплексной терапии плацентарной недостаточности. Автореф. канд. дисс. Душанбе. 2002
5. Зубжицкая Л.Б., Кошелева Н.Г., Семёнов В.В. Иммуноморфологическое состояние плаценты при акушерской патологии. С-Пб. 2005. С. 262-263
6. Серов В.Н. Плацентарная недостаточность // Трудный пациент. 2005. № 3(2). С. 17-20
7. Сидорова И.С., Макаров И.О. Фетоплацентарная недостаточность. Клинико-диагности-
ческие аспекты. М. 2005. С.124
8. Стрижаков А.Н., Игнатко И.В., Рыбин М.В. Принципы патогенетической терапии при нарушениях состояния плода на фоне осложнённого течения беременности. Вопр. гинекол. аку-ш.и перинатол. 2006. № 5(3). С. 5-14
Ч,араёни хуни фетоплатсентари дар занх,ои бисёрзоида бо алоими боздории инкишофи чанин З.К. Бойматова
Натичах,ои тад;и;оти мо баландшавии хеле зиёди индексх,ои (зарибх,ои) муковимати хун-рагии канориро дар шараёни бачадони занони валуд (бисёрзоида) бо чараёни муътадили х,оми-ладори муайян намуданд, ки аз ихтилоли хунгардиш дар банди бачадону машимии силсилаи "модар-машима-чанин" шах,одат медих,ад. Ин тарйиротх,о дар сурати оризаи х,омиладори ва вусъати алоими инкишофи батнии чанинро ;ави мегардонанд ва кариб дар х,амаи бандх,ои ин силсила зох,ир мешаванд.
FOETOPLACENTA BLOOD CURRENT IN POLYDELIVERY WOMEN WITH SYNDROM OF DELAY OF FOETUS GROWTH
The result of investigations indicated important increasing the indexes of peripherial vessel resistence in uterine artery in polydelivery women with normal pregnant that testifies the alterations of circulation in system "mother-placenta-foetus" which are than more than strong.
Key words: foetoplacenta blood current, syndrome of delay of foetus growth
ОСОБЕННОСТИ МЕТАБОЛИЧЕСКОГО СИНДРОМА У ЖЕНЩИН В ПЕРИОД
Таджикский институт последипломной подготовки медицинских кадров
Артериальную гипертензию, формирование которой приходится на перименопаузальный период, необходимо рассматривать совместно с метаболическими изменениями (инсулино-резистентность, дислипопротеинемия, андроидное ожирение), происходящими в организме женщины. Менопаузальный метаболический синдром является весомым фактором риска кардиоваскулярных заболеваний.
Ключевые слова: метаболический синдром, артериальная гипертензия, дислипопротеи-немия, инсулинорезистентность, ожирение
Введение. Артериальную гипертензию (АГ), формирование которой приходится на пери-менопаузальный период, необходимо рассматривать совместно с метаболическими изменениями, происходящими в организме женщины. Большинство авторов связывает их с гипоэст-рогенемией. Учитывая вышесказанное [4], необходимо употреблять термин "менопаузаль-
Оценка формирующегося маточно-плацентарного кровотока у пациенток с угрозой прерывания на фоне дефицита прогестерона в I триместре беременности
Кафедра акушерства и гинекологии ГБОУ ВПО Российский национальный исследовательский медицинский университет имени Н.И. Пирогова Минздрава России, Москва;
Кафедра ультразвуковой диагностики ГБОУ ВПО Российский национальный исследовательский медицинский университет имени Н.И. Пирогова Минздрава России, Москва
Цель исследования. Определение зависимости формирования маточно-плацентарного кровотока при угрозе прерывания беременности в I триместре на фоне нормального уровня содержания прогестерона в крови и при гипопрогестеронемии.
Материал и методы. В исследование включена 91 первобеременная пациентка, в сроке гестации 8–12 недель. Пациентки с беременностью, протекающей на фоне угрозы прерывания (n=64) составили I группу, с неосложненным течением беременности (n=27) – II. В обеих группах проведено определение уровня прогестерона в крови. На основании полученных данных I группа была разделена на две подгруппы: IА – c низким уровнем содержания прогестерона в крови (менее 25-го перцентиля) (n=21); IВ – c нормальным уровнем прогестерона (от 25-го до 75-го перцентиля) и повышенным (более 75-го перцентиля) (n=43). С целью оценки маточно-плацентарного кровотока всем пациенткам проводилось трансвагинальное ультразвуковое исследование с допплерографией, трехмерным изображением в реальном времени.
Результаты. На фоне дефицита содержания прогестерона в крови по сравнению с пациентками с нормальным уровнем прогестерона было зафиксировано достоверное повышение показателей кривых кровотока спиральных артерий (р=0,0001) и сосудов желтого тела (р=0,0001), а также снижение объема хориона (р=0,026), индекса васкуляризации хориона (р=0,028) и объема желтого тела (р=0,025). Различий в показателях кривых кровотока маточных артерий и яичниковых артерий по группам не обнаружено.
Заключение. Состояние системы «мать-плацента-плод» определяется параметрами кривых кровотока спиральных артерий и артерий желтого тела, а также объемом хориона, его васкуляризацией, и объемом желтого тела. Нарушение кровотока в спиральных артериях и изменение кровотока в артерии желточного мешка могут рассматриваться как основной допплерометрический признак угрожающего выкидыша и возможных осложнений гестационного процесса в более поздние сроки.
Проблема самопроизвольного прерывания беременности на ранних сроках остается одной из самых актуальных на сегодняшний день [1]. По данным ряда авторов, частота прерывания беременности в I триместре составляет 50%, во II триместре – около 20%, в III триместре – до 30% [2]. Такое проявление состояния угрозы прерывания беременности, как тонус миометрия, наиболее неблагоприятен в I триместре, когда происходит инвазия трофобласта и начинается формирование плаценты, так как нарушение этих процессов оказывает влияние на дальнейшее течение беременности. В основе физиологически протекающей плацентации в I триместре одну из ведущих ролей играют спиральные артерии. Они представляют собой терминальную часть сосудистого русла матки и проникают в зону, где происходит имплантация эмбриона и формирование плаценты [3]. Трансформация спиральных артерий заключается в дилатации и формировании трофобластических «пробок», которые закрывают просветы этих сосудов, но постепенно рассеиваясь к 12-й неделе беременности, обусловливают начало материнского кровотока в межворсинчатом пространстве плаценты. Патологическая плацентация обусловлена отсутствием трофобластических «пробок» в узких просветах большинства спиральных артерий в результате снижения инвазии трофобласта [4]. Это определяет преждевременный материнский кровоток и повышение концентрации кислорода в межворсинчатом пространстве плаценты, что на ранних этапах беременности повреждает уязвимое хориальное дерево, вызывая развитие ретроплацентарных и/или субхориальных гематом, спонтанные выкидыши [5]. Достаточный уровень прогестерона – это ключевой фактор в обеспечении адекватного процесса имплантации плодного яйца и развития нормальной беременности. Еще до оплодотворения прогестерон вызывает децидуальные превращения эндометрия и готовит его к имплантации, способствует росту и развитию миометрия, его васкуляризации, поддерживает миометрий в состоянии покоя путем нейтрализации действия окситоцина, снижения синтеза простагландинов. Прогестерон улучшает условия миграции трофобласта в I триместре путем стимуляции роста и ремоделирования спиральных артерий, подавляя сократительную активность миометрия [6].
Морфологические периоды развития хориона, а затем плаценты, достаточно хорошо изучены и описаны, в том числе с помощью эхографических методик, а применение трехмерных технологий эхографии в сочетании с режимом энергетического допплера позволяет более точно оценивать степень развития сосудистой сети органа [7, 8]. При исследовании различных участков хориона – краевых и центральных – установлено, что в сроки беременности до 11 недель гетероморфизм кровотока в хорионе не выражен, достоверных отличий в кровоснабжении краевых и центральных участков не выявлено. После 12 недель беременности проявляется сосудистый гетероморфизм – индекс васкуляризации в центральной зоне хориона выше, чем в периферических участках [8].
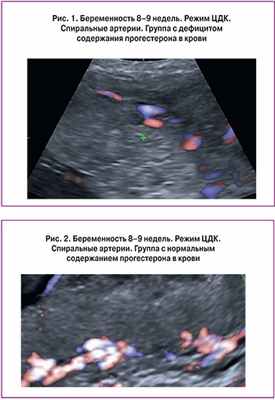
В литературе сообщается о возможности прогнозирования исхода беременности на основании измерения диаметра желтого тела и оценки его морфологии [9], однако данные о взаимосвязи концентрации прогестерона и состояния маточно-плацентарного кровотока противоречивы и разрознены.
Цель нашего исследования – определение зависимости формирования маточно-плацентарного кровотока при угрозе прерывания беременности в I триместре на.
Читайте также:
