Тромбопоэтин. Нормальный гемостаз
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Сосудистые факторы снижают кровопотерю, обусловленную травмой, с помощью механизма локальной вазоконстрикции (немедленная реакция на повреждение) и компрессии поврежденных кровеносных сосудов путем экстравазации крови в окружающие ткани. При повреждении сосудистой стенки происходят адгезия и агрегация тромбоцитов и генерация фибриновых полимеров из фибриногена; взаимодействие тромбоцитов с фибрином формирует тромб.
Тромбоциты
Ток крови, благодаря предотвращению агрегации тромбоцитов и расширению интактных кровеносных сосудов, сохраняется с помощью различных механизмов, к которым относятся высвобождаемые эндотелиальными клетками простациклин и оксид азота. Производство этих медиаторов прекращается при повреждении эндотелия сосудистой стенки. В этих условиях происходят адгезия тромбоцитов к поврежденной интиме сосудистой стенки и формирование тромбоцитарных агрегатов. Начальная адгезия тромбоцитов к волокнам коллагена связана с фактором Виллебранда (ФВ), который был предварительно секретирован и связан стимулированными эндотелиальными клетками. ФВ взаимодействует с рецепторами на поверхности тромбоцитарной мембраны (гликопротеин Ib/IX). Тромбоциты, которые зацепились за стенки сосуда, подвергаются активации. При этом тромбоциты высвобождают медиаторы агрегации, включая аденозин дифосфат (АДФ), из накопительных вакуолей.
Другие биохимические изменения, происходящие в результате активации тромбоцитов, включают
Гидролиз мембранных фосфолипидов
Мобилизацию внутриклеточного кальция
Фосфорилирование внутриклеточных белков
Арахидоновая кислота преобразуется в тромбоксан A2; эта реакция требует участия циклооксигеназы тромбоцитов и необратимо ингибируется аспирином и обратимо многими НПЗП (нестероидными противовоспалительными препаратами).
АДФ, тромбоксан A2 и другие медиаторы провоцируют агрегацию дополнительных тромбоцитов к поврежденному эндотелию и активируют их. Тромбоцитарные рецепторы АДФ включают рецептор P2Y12, который посылает сигналы для подавления аденилатциклазы, уменьшает уровень циклического аденозин монофосфата (цАМФ) и способствует активации рецептора гликопротеина IIb/IIIa (образующегося на поверхности мембраны активированного тромбоцита из гликопротеинов IIb и IIIa). Фибриноген связывается с гликопротеиновым комплексом IIb/IIIa расположенных рядом тромбоцитов и соединяет их друг с другом.
Сборка и активация коагуляционных комплексов и образование тромбина проходят на поверхности тромбоцитов. Тромбин превращает фибриноген в мономеры фибрина, а мономеры фибрина полимеризуются в полимеры фибрина, которые соединяют агрегированные тромбоциты в тромбоцитарно-фибриновые гемостатические пробки.
Плазменные факторы свертывания
Факторы свертывания крови воздействуют друг на друга на поверхности тромбоцитов и эндотелиальных клеток с целью производства тромбина, который превращает фибриноген в фибрин. Фибрин укрепляет тромб за счет формирования гемостатической пробки и ее закрепления.
При внутреннем пути свертывания фактор XII, высокомолекулярный кининоген, прекаликреин и активированный фактор XI (фактор XIa) взаимодействуют для производства активированного фактора IХa из фактора IX. Фактор IХa затем взаимодействует с фактором VIIIа и прокоагулянтными фосфолипидами (присутствуют на поверхности активированных тромбоцитов, эндотелиальных клеток и клеток тканей) для создания комплекса, активирующего Х.
При внешнем пути фактор VIIа и тканевой фактор (ТФ) непосредственно активируют фактор Х (и, возможно, также фактор IX – см. рисунок Пути свертывания крови Метаболические механизмы свертывания крови [Pathways in blood coagulation] и таблицу Компоненты реакции свертывания крови Составляющие реакций свертывания крови [Components of Blood Coagulation Reactions]).
Многие (или большинство) коагуляционных протеинов вырабатываются в эндотелиальных клетках сосудов, включая эндотелиальные клетки, выстилающие синусоиды печени. Некоторые коагуляционные белки также могут вырабатываться другими типами клеток (например, тканевым фактором фибробластами).
Метаболические механизмы свертывания крови
Активация внутреннего или внешнего пути стимулирует общий путь свертывания, что приводит к образованию фибринового сгустка. Общий путь активации состоит из трех шагов:
Протромбиназа вырабатывается на поверхности активированных тромбоцитов, эндотелиальных и других тканевых клеток. Протромбиназа представляет собой комплекс из фермента, фактора Ха и кофактора, фактора Va на поверхности прокоагулянтного фосфолипида.
Протромбиназа расщепляет протромбин до тромбина.
Тромбин стимулирует создание мономеров и полимеров фибрина из фибриногена и активирует растворимый фактор VIII и фактор XI. Тромбин также активирует фактор XIII – фермент, катализирующий образование более сильных ковалентных связей между мономерами фибрина.
Ионы кальция требуются для большинства реакций образования тромбина и, соответственно, кальций-хелатирующие агенты (например, цитрат, этилендиаминтетрауксусная кислота) используются в качестве антикоагулянтов в условиях in vitro. Витамин К-зависимые факторы свертывания крови (факторы II, VII, IX и X) в норме связываются с фосфолипидами с помощью кальциевых мостиков для участия в процессе свертывания крови. Реакции коагуляции не могут протекать должным образом при отсутствии витамина К. Витамин К-зависимые регуляторные белки свертывания включают протеины С, S и Z.
Хотя пути свертывания крови достаточно полезны для понимания механизмов и лабораторной оценки коагуляционных нарушений, в естественных условиях в процессе коагуляции не участвуют фактор XII, прокалликреин или высокомолекулярный кининоген. У людей с наследственным дефицитом этих факторов отсутствуют нарушения гомеостаза. У людей с наследственным дефицитом фактора XI может наблюдаться легкое или умеренное нарушение свертываемости крови. In vitro растворимый фактор XI может быть активирован тромбином. Однако между уровнем плазматического фактора XI и вероятностью или степенью кровотечения устойчивая связь отсутствует. Растворимый фактор IX может активироваться in vitro как фактором XIa, так и фактором VIIa/комплексами тканевого фактора.
В естественных условиях инициирование внешнего пути возникает, когда повреждение кровеносных сосудов приводит кровь к контакту с тканевым фактором на мембранах клеток в пределах и в окружении сосудистой стенки. Контакт с тканевым фактором запускает образование комплекса фактор VIIa/тканевой фактор, который активирует фактор X (и, возможно, фактор IX, внутренний фактор). Фактор IXa в комбинации со своим кофактором, фактором VIII на поверхности фосфолипидной мембраны также генерирует фактор Ха. Активация фактора X комплексами фактора IXa/VIIIa необходима для нормального гемостаза. Необходимость этого процесса для факторов VIII и IX объясняет, почему при гемофилии Гемофилия Гемофилия является общим наследственным нарушением свертываемости крови, вызванным недостатком фактора свертывания крови VIII или IX. Частоту и тяжесть кровотечений определяет степень дефицита. Прочитайте дополнительные сведения типа А (дефицит фактора VIII или фактора IX) или типа В (дефицит фактора IX) возникает кровотечение. Активация фактора X комплексами фактор VIIa/тканевой фактор на внешнем пути свертывания не генерирует достаточное количество тромбина (и фибрина) для предотвращения кровотечения у пациентов с тяжелыми формами гемофилии А или В.
Тромбопоэтин. Нормальный гемостаз
Тромбопоэтин. Нормальный гемостаз
Тромбоциты формируются в костном мозге путем отделения от больших многоядерных клеток, называемых мегакариоцитами, которые, подобно другим гемопоэтическим клеткам, являются производными гемопоэтических стволовых клеток. Тромбопоэтин является основным фактором роста, регулирующим образование тромбоцитов. Это гликопротеин с молекулярной массой 65-85 кДа, представленный во многих клетках, но в большей степени в гепатоцитах.
Тромбопоэтин стимулирует образование тромбоцитов в костном мозге посредством активации c-mpl-рецепторов на клетках-предшественниках или тромбоцитах. Тромбопоэтин обладает «склеивающим» эффектом в отношении тромбоцитов (он потенцирует коллагениндуцированную агрегацию тромбоцитов), c-mpl-рецепторы используют сигнальные пути JAK/STAT, Ras/MAPK и фосфатидилинозитол-3-киназы, чтобы способствовать пролиферации клеток-предшественников мегакариоцитов и их созревание в мегакариоциты. Тромбопоэтин был впервые обнаружен в человеческой моче, а его рекомбинантная форма (PEG-rHuMGDF) получена экспрессией в человеческих клетках. Тромбопоэтин используют в терапии первичной и вторичной тромбоцитопении.
Нормальный гемостаз представляет собой тонкий баланс между свертывающей, противосвертыва-ющей и фибринолитической системами в кровеносных сосудах. Повреждение сосудистой стенки запускает сложный ряд событий, вовлекающих тромбоциты, эндотелиальные клетки и свертывающие белки, который приводит к образованию тромбоцитарно-фибринового сгустка. В то же время физиологические антикоагулянты и фибринолитические системы активируются продуктами коагуляционного каскада, чтобы предотвратить избыточное тромбообразование (т.е. тромбоз).
Тромбоциты играют решающую роль в гемостазе. В норме тромбоциты не взаимодействуют с эндотелием сосудов. Тем не менее, когда клетки эндотелия повреждены, тромбоциты прикрепляются к месту повреждения посредством адгезии гликопротеиновых рецепторов тромбоцитов к субэндотелиальному коллагену. Адгезированные тромбоциты подвергаются активации и дегрануляции, высвобождая несколько веществ, таких как тромбоксан А2, аденозиндифосфат (АДФ), адреналин и серотонин. Эти вещества активируют и привлекают дополнительные тромбоциты к образованию тромбоцитарного тромба.
Активированные тромбоциты предоставляют фосфолипидную контактную поверхность для поддержки конгломерата фактора Ха, активированного комплекса (включающего фактор IХа, тромбоцит-связанный фактор VIIIa и кальций) и протромбиназного комплекса (включающего фактор Ха, тромбоцит-связанный фактор Va и кальций), которые совместно усиливают образование тромбина. Образованный тромбин активирует дополнительные тромбоциты и запускает каскад коагуляции.
Активация тромбоцитов агонистами, такими как АДФ и тромбоксан А2, особенно тромбином, ведет к конформационной активации гликопротеинового рецептора IIb/IIIа на их поверхности. Активированные гликопротеиновые рецепторы II/IIIа обеспечивают функциональное связывание частей фибриногена и других адгезивных молекул, таких как фактор Виллебранда (WF) и фибронектин.
Связывание бивалентной молекулы фибриногена с гликопротеиновыми рецепторами IIb/IIIа на поверхностях соседних тромбоцитов формирует тромбоцитарные агрегаты. Таким образом, активация гликопротеинового рецептора IIb/IIIа является конечным путем агрегации тромбоцитов согласно агонистическому типу.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гемостаз новорожденных
Резюме. В периоде новорожденности система гемостаза претерпевает ряд изменений, обусловливающих ее меньшую устойчивость. Особенно это проявляется у недоношенных и детей с малой массой тела к сроку гестации. Одним из повреждающих факторов, действующих на систему гемостаза, является инфекционно-воспалительный процесс. Современные интегральные методы оценки гемостаза, такие как тромбоэластография и тромбодинамика, наиболее полно отражают состояние свертывающей системы.
Ключевые слова: гемостаз, новорожденные, тромбодинамика, тромбоэластография
Summary. In the neonatal period, the hemostatic system undergoes a number of changes, causing its less stability. This is especially evident in premature and low-weight children by the time of gestation. One of the damaging factors affecting the hemostatic system is the infectious-inflammatory process. Modern integral methods of hemostasis assessment, such as thromboelastography and thrombodynamics, most fully reflect the state of the coagulation system.
Key words: hemostasis, newborns, thrombodynamics, thromboelastography
Новорожденные составляют группу высокого риска тромботических и геморрагических осложнений. Механизмы, лежащие в основе их возникновения, до конца не поняты. Гемостатический баланс у новорожденных отличается от такового у взрослых и представляет собой развивающийся процесс. Концентрация белков плазмы также отличается у новорожденных по сравнению с детьми старшей возрастной группы и взрослыми и подвергается быстрому созреванию в течение первых шести месяцев жизни. Факторы свертывания крови материнского происхождения не способны пересечь плацентарный барьер. В периоде новорожденности система гемостаза претерпевает ряд изменений, обусловливающих ее меньшую устойчивость. Особенно это проявляется у недоношенных и детей с малой массой тела к сроку гестации. Тем не менее, несмотря на наличие количественных и качественных отличий практически всех параметров системы гемостаза от параметров у взрослых, здоровые новорожденные в целом имеют клинически нормальный функциональный гемостаз без тенденции к коагулопатии или тромбозу. По-видимому, система гемостаза у новорожденных находится в некотором альтернативном балансе, который отличается от баланса гемостаза у взрослых. Вопрос об устойчивости этого баланса по-прежнему остается открытым. Из-за особенностей гемостаза у новорожденного лабораторная диагностика нарушений этой системы затруднена, и лечащий врач вынужден ориентироваться исключительно на клиническую картину, которая в большинстве случаев проясняется после того, как тромбогеморрагическое осложнение уже развилось и прогрессирует.
Поддержание крови в жидком состоянии в рамках сосудистого русла осуществляется взаимодействием пяти компонентов. К ним относятся коагуляционный каскад, тромбоциты, сосудистая стенка, противосвертывающие компоненты и система фибринолиза. Начало свертывания связано с взаимодействием тканевого фактора с активированным VII фактором. Этот комплекс активирует Х фактор, что и запускает весь коагуляционный каскад. Исследования, посвященные выявлению свободно циркулирующего тканевого фактора (в виде микровезикул, несущих тканевой фактор на поверхности), показали, что его концентрация в крови новорожденного превышает концентрации, обнаруживаемые в периферической крови взрослых, примерно в 1,5 раза. Неясно, является ли этот тканевой фактор следствием травматичности самих родов и последующего перерезания пуповины или это некий механизм, возникающий у плода еще до момента родов и призванный защитить ребенка от травм во время прохождения родовых путей. Оценку состояния плазменного звена гемостаза проводят путем измерения отдельно прокоагулянтных и антикоагулянтных компонентов с помощью тестов времени свертывания при добавлении различных активаторов. Основные тесты - протромбиновое время (ПВ), активированное частичное тромбопластиновое время (АЧТВ) и тромбиновое время (ТВ) [1, 2]. Становление гемостаза у плода представлено в таблице.
Таблица. Неонатальный гемостатический баланс
| Повышенная концентрация в плазме и раннее развитие факторов | Недостаточная концентрация в плазме и замедленное развитие факторов | Фетальные молекулярные формы с приобретением функции свертывания | Фетальные молекулярные формы с утратой функции свертывания |
| Прокоагулянтные факторы - V, VIII, XIII | Витамин-К-зависимые факторы II, VII, IX, X, протеин С, протеин S | Фактор Виллебранда | Фибриноген, плазминоген/плазмин |
| Фактор Виллебранда, уровень тромбоцитов | Антитромбин, ингибитор тканевого фактора | - | - |
| Тканевой фактор | Активируемый тромбином фибринолитический ингибитор | - | - |
| Тромбомодулин | - | - | - |
Тромбоциты - клетки крови, участвующие во множестве процессов, на их поверхности находится многообразный рецепторный аппарат, в цитоплазме - гранулы, содержащие разнообразные биологически активные вещества. Основная задача тромбоцитов - осуществление сосудисто-тромбоцитарного гемостаза за счет образования тромбоцитарной пробки и ретракции тромба. Морфологическую основу тромба составляют тромбоциты и нити фибрина, именно они обеспечивают конечный этап остановки кровотечения. Таким образом, без их минимально необходимого содержания в крови полноценная остановка кровотечения невозможна. Различия между новорожденными и взрослыми наблюдаются уже на этапе производства тромбоцитов. Несмотря на то что основные этапы тромбоцитопоэза (продукция тромбопоэтина, пролиферация предшественников мегакариоцитов, дифференциация и созревание мегакариоцитов путем эндомитоза и цитоплазматических изменений, продукция и выход тромбоцитов в кровоток) представлены в равной мере и у новорожденных, и у взрослых, существуют качественные различия на каждом этапе [1, 3]. Концентрация тромбопоэтина (основного стимулирующего агента тромбоцитопоэза) в крови повышена у здоровых новорожденных по сравнению со здоровыми взрослыми. Мегакариоциты, генерируемые фетальными и неонатальными предшественниками, значительно меньше и обладают более низкой плоидностью, чем взрослые мегакариоциты. У мегакариоцитов новорожденных также значительно снижена скорость производства тромбоцитов в расчете на отдельный мегакариоцит, что, вероятнее всего, является следствием их малого размера. Концентрация тромбоцитов в периферической крови новорожденных обычно находится в пределах 100-450х10 9 /л, что несколько шире нормального диапазона у взрослых. Традиционно уровень концентрации тромбоцитов менее 150х10 9 /л у новорожденных определяется как тромбоцитопения, однако показатели от 100 до 150х10 9 /л достаточно часто встречаются у относительно здоровых детей (в большинстве случаев у недоношенных новорожденных) и редко приводят к каким-либо клиническим осложнениям. Встречаемость тромбоцитопении обратно пропорциональна гестационному возрасту новорожденного и варьирует в широких пределах - от 1 до 80% в зависимости от изучаемой популяции (доношенные здоровые новорожденные, все новорожденные, новорожденные с осложнениями). Подсчет количества тромбоцитов в периферической крови - пока единственный объективный лабораторный критерий принятия решения о профилактике кровотечения, несмотря на то что во многих исследованиях корреляции между концентрацией тромбоцитов у новорожденных и частотой кровотечений не обнаружено Наличие пациентов с кровотечениями при значениях концентрации тромбоцитов в пределах 50-100х10 9 /л при нормальной коагулограмме и, наоборот, с тромбоцитопенией менее 50х10 9 /л, протекающей без клинических проявлений, говорит о том, что, возможно, имеет значение не только количество тромбоцитов, но и их качество. Выявление функциональной активности тромбоцитов с помощью проточной цитометрии напрямую дает полную информацию о функциональном состоянии тромбоцитов и их способности к активации в присутствии агонистов. Тест основан на цитофлуориметрической детекции специфических антител и иных маркеров, меченых флуорофорами и связывающихся с поверхностными антигенами, и позволяет оценить состояние тромбоцитов в покое и при активации, выявить нарушения различных их функций: адгезии агрегации, секреции разных типов гранул, прокоагулянтной активности. Существуют противоречивые данные относительно вопроса о том, является ли поверхностное количество гликопротеина Ib (ГП Ib, рецептор фактора Виллебранда - vWF, который обеспечивает адгезию тромбоцитов на поврежденный субэндотелий) и общего (неактивированного) гликопротеина IIb-IIIa (ГП Ilb-IIIa, рецептор фибриногена и vWF, обеспечивает формирование тромбоцитарного агрегата) у новорожденных более низким, равным или увеличенным по сравнению со взрослыми [1, 3, 4]. Основное значение имеет не общее количество ГП IIb-IIIa, а его способность переходить в состояние с высокой аффинностью (активированную форму), что является критическим этапом в образовании агрегата тромбоцитов и позволяет образовывать фибриногеновые «мостики» между соседними тромбоцитами. Агрегометрия наряду с подсчетом тромбоцитов в периферической крови -наиболее распространенный тест, оценивающий состояние тромбоцитарного звена гемостаза. Обычно активатор тромбоцитов (АДФ, коллаген, ристацитин и др.) добавляют в богатую тромбоцитами плазму, при этом степень агрегации определяют по степени увеличения светопропускания в процессе агрегации тромбоцитов. Кроме того, существуют приборы, позволяющие определять агрегацию тромбоцитов в цельной крови по изменению электрического импеданса. Применение агрегометрии в неонатологии сильно ограничено в первую очередь чисто техническими проблемами, связанными с маленьким объемом циркулирующей крови и, как следствие, невозможностью забора нужного объема образца из периферической вены. Исследования, проведенные на пуповинной крови, показывают, что агрегация тромбоцитов с широким спектром агонистов (АДФ, коллаген, эпинефрин) снижена у новорожденных по сравнению со взрослыми.
После восстановления целостности сосудистой стенки наличие тромботических масс в просвете сосуда становится ненужным и опасным. Их удаление - задача системы фибринолиза. Биохимический результат фибринолиза - появление так называемых продуктов деградации фибрина. Выделяют два их основных вида: растворимые фибринмономерные комплексы и Д-димер. Несмотря на низкую концентрацию фетального плазминогена в плазме и его сниженную активацию, фибринолиз новорожденных энергичный. Постнатальная утрата фибринолитической активности недоношенных новорожденных с респираторным дистресс-синдромом коррелирует с тяжестью заболевания. Концентрация Д-димеров в крови новорожденных существенно повышена сразу после рождения и имеет тенденцию к снижению в течение первого месяца жизни, однако может оставаться повышенной на протяжении всего периода детства. Повышенное содержание продуктов деградации фибрина и высокая концентрация Д-димеров наблюдаются у 65% здоровых младенцев с нормальными сроками гестации, предположительно в ответ на родовой стресс или перерезание пуповины. Таким образом, ориентация на показатели концентрации Д-димеров при прогнозировании или диагностике тромбогеморрагических осложнений у новорожденных ненадежна [1].
Локальные и скрининговые тесты фиксируют изменения активности/концентрации отдельных компонентов системы гемостаза, но не показывают, насколько эти локальные изменения повлияли на итоговую способность плазмы к образованию сгустка.
Современные интегральные методы оценки гемостаза, такие как тромбоэластография (рис. 1) и тромбодинамика (рис. 3), наиболее полно отражают состояние свертывающей системы.
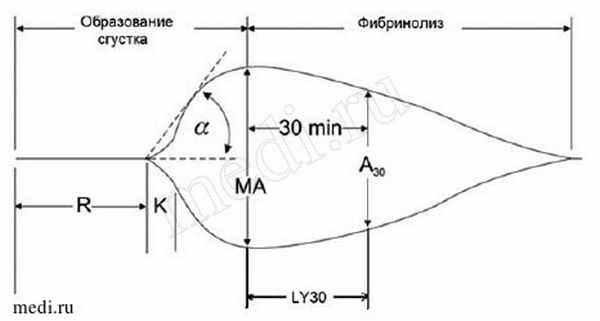
Рис. 1. Тромбоэластография
Фаза инициации, интервал R, усиление К, фаза распространения характеризуются углом, а показатель МА характеризует состояние фибриногена и тромбоцитов, выведение средней кривой. На рисунке 2 представлен гиперфибринолиз.
Рис. 2. Гиперфибринолиз
| R min 5,6 9-27 | K min 1,8 2-9 | Angle deg 65,6 22-58 | MA mm 33,1 44-64 | PMA *0* | G d/sc 2,5 3,6-8,5 | EPL % 57,9 0-15 | A mm 3,3 |
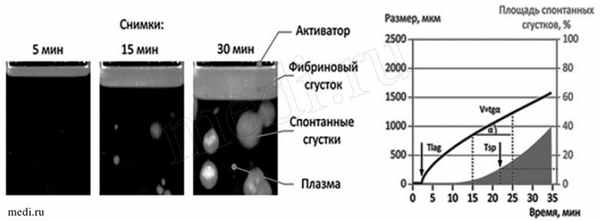
Рис. 3. Тромбодинамика
Тромбодинамика с помощью видеомикроскопии позволяет регистрировать образование фибринового сгустка, инициированного иммобилизованным на поверхности тканевым фактором. При этом сгусток первоначально формируется на активирующей поверхности, а затем распространяется в плазме.
Такой подход позволяет учитывать пространственную гетерогенность свертывания крови in vivo, т.е. тот факт, что начало и распространение свертывания происходят в пространственно разделенных областях [2]. Этот тест показал высокую чувствительность к гипо- и гиперкоагулянтным нарушениям, а также к терапии антикоагулянтами.
Внедрение глобальных тестов в рутинную клиническую практику в неонатологии требует проведения большего количества клинических исследований, но для новорожденных, баланс гемостаза которых отличается от такового у взрослых даже в норме, применение глобальных тестов может решить проблему неинформативности стандартных тестов в области предикции тромбогеморрагических осложнений, а также контроля антикоагулянтной и прокоагулянтной терапии.
Являются ли новорожденные более склонными к кровотечению или тромбозу? При ненарушенном балансе в системе гемостаза доношенного новорожденного кровотечения и тромбозы возникают редко. У больных детей часто возникают нерегулируемая генерация тромбина, коагулопатия потребления и повышенная скорость образования тромба. Наличие септического процесса - самые частые факторы, коррелирующие с тромбозом в отделениях интенсивной терапии, так как инфекция способствует активации свертывания, а катетер создает очаг распространения тромба [1]. Протромботическая тенденция возникает в случае гипоксии, ацидоза при респираторном дистресс-синдроме у недоношенных новорожденных. Активация свертывания ассоциирована также с гемолитической анемией, синдромом повышенной вязкости и сахарным диабетом у матери, в редких случаях при резком повышении уровня лейкоцитов и тромбоцитов. Кровотечение у новорожденных детей обычно связано с коагулопатией потребления.
Тромбоциты в крови
Тромбоциты – это клетки крови, которые отвечают за один из этапов свертывания крови и образование тромбов. В неактивном состоянии они имеют дисковидную, немного вытянутую форму, из-за чего их называют «кровяными пластинками». Они лишены ядра и имеют относительно небольшой размер (2-3 микрона в диаметре), что делает их самыми маленькими клетками в крови. Доля тромбоцитов составляет не более 1% от всех форменных элементов.
Синонимы: PLT, platelets, кровяные пластинки, Thrombocyte, platelet count, PC
Откуда берутся тромбоциты в крови?
Тромбоциты появляются в костном мозге, так же как и эритроциты и большая часть белых кровяных телец (лейкоцитов). Они формируются из очень крупных клеток костного мозга, называемых мегакариоцитами. По мере того, как мегакариоциты развиваются, они подвергаются процессу фрагментации, который приводит к высвобождению более 1000 тромбоцитов на один мегакариоцит. Доминирующим гормоном, контролирующим развитие мегакариоцитов, является тромбопоэтин. Срок жизни одной кровяной пластинки составляет порядка 7-12 дней, после чего они распадаются в селезенке или печени.
Основная роль тромбоцитов в организме человека – прекращение кровотечения, гемостаз. При нарушении целостности сосуда они активируются: приобретают сферическую форму, а на их поверхности появляются отростки (псевдоподии). Далее тромбоциты контактируют с поврежденной внутренней оболочкой кровеносного сосуда (эндотелием). С помощью этих отростков они прикрепятся к месту повреждения сосуда и скрепляются между собой, образуя тромб. Таким образом тромбоциты предотвращают кровопотерю.
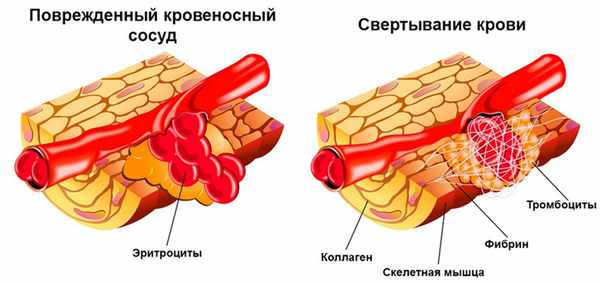
Рисунок 1. Свертывание крови. Изображение: pvproductions / Depositphotos
Дополнительно тромбоциты предотвращают попадание инфекционных агентов в кровоток, выделяя лизоцим и В-лизин. Также они принимают участие в доставке питательных веществ для эндотелия. За счет выделения фактора роста эти клетки крови помогают восстанавливать сосудистую стенку. Имеются данные, согласно которым тромбоциты принимают активное участие в работе иммунитета.
Как происходит активация тромбоцитов?
В норме тромбоциты движутся вдоль сосудистой стенки, будто осматривая ее. При нарушении целостности сосуда в кровь попадает белок коллаген, с которым тромбоцит взаимодействует при помощи специального рецептора. При этом происходит целый каскад реакций внутри тромбоцита, за счет чего выделяется ряд веществ, а сама клетка меняет форму. Одновременно с этим кровяные пластинки начинают прикрепляться к месту повреждения и соединяться между собой, образуя первичный тромб¹.
Анализ крови на тромбоциты
Измерение уровня тромбоцитов в крови проводится в рамках общего клинического анализа крови (ОАК).
В российских государственных больницах и поликлиниках на бумажных бланках уровень тромбоцитов подписан соответствующим словом – тромбоциты. В автоматизированных анализаторах иностранного происхождения наиболее распространенное обозначение – PLT, сокращенно от platelets.
Единица измерения тромбоцитов – количество клеток на объем крови. Чаще всего используют множитель 10 9 /л (10 в 9 степени на литр крови), например 200×10 9 /л.
Показания к анализу
Общий анализ крови, в который входит определение уровня тромбоцитов, проводится всем пациентам, которые обращаются за помощью в медицинское учреждение, проходят профилактический осмотр или готовятся к операции.
Измерение уровня тромбоцитов может проводиться и в других случаях:
- Необъяснимые кровотечения и образование подкожных гематом.
- Кровоточивость десен, частые носовые кровотечения.
- Обильные, длительные менструации.
- Подозрение на злокачественную опухоль.
- Сердечно-сосудистые заболевания.
- Некоторые патологии желудочно-кишечного тракта, которые могут осложняться кровотечением, например, язва желудка и двенадцатиперстной кишки.
- Заболевания почек, например, гломерулонефрит.
- Подозрение на заболевания системы крови, в том числе – лейкозы.
Подготовка к анализу
Измерение уровня тромбоцитов проводится в той же капиллярной крови, которая набирается для ОАК. Соответственно, подготовка к анализу основывается на общих правилах для клинического (общего) анализа крови. Это включает в себя такие требования и рекомендации:
- Отказ от приема пищи перед сдачей крови. Кровь для ОАК набирается натощак, как правило, в первой половине дня. Для получения достоверных результатов между последним приемом пищи и забором крови должно пройти не менее 8 часов. В экстренных случаях ОАК может проводиться спустя 4 часа после легкого перекуса яблоком, чаем или несладкой кашей без молока и сахара.
- Минимизация физических и эмоциональных нагрузок. При возможности непосредственно перед процедурой лучше 10-15 минут спокойно отдохнуть у кабинета или в холле медучреждения.
- Исключение употребления алкоголя за сутки до сдачи крови и табачных изделий – за 1-2 часа.
- По возможности забор крови должен проводиться спустя 10-14 дней с момента прекращения приема медикаментов. Если это невозможно, необходимо предупредить об этом лаборанта, который будет оценивать результаты анализа.
Какие препараты могут влиять на уровень тромбоцитов в крови?
Целый ряд медикаментов различных областей применения может влиять на показатели тромбоцитов крови. Чаще к ним относятся:
- Антибиотики.
- Противоаллергические средства (антигистаминные).
- Некоторые нестероидные противовоспалительные препараты (НПВП), которые используются для подавления воспаления и снятия боли: ацетилсалициловая кислота, ибупрофен.
- Лекарства, использующиеся в лечении артериальной гипертензии, в том числе блокаторы кальциевых каналов (верапамил).
- Средства для снижения уровня холестерина крови (статины).
- Медикаменты, предотвращающие внутрисосудистое свертывание крови и образование тромбов (антикоагулянты).
- Антидепрессанты и другие средства, используемые для лечения психических нарушений.
- Средства для улучшения потенции (силделафил).
Нормы тромбоцитов в крови
Точные показатели нормы тромбоцитов в крови для детей и взрослых колеблются в зависимости от аппаратуры и реактивов, которые используются в лаборатории. Как правило, рядом с полученными результатами указывается нормальное значение для пациента. В большинстве случаев нормой тромбоцитов в крови для взрослых мужчин и женщин принят интервал от 150 до 400×10 9 /л¹.
| Возраст | Референсные значения |
| Меньше 10 дней | 99-421×10 9 /л |
| 10 дней – 1 месяц | 150-400×10 9 /л |
| 1-6 месяцев | 180-400×10 9 /л |
| 6 месяцев – 1 год | 160-390×10 9 /л |
| 1-5 лет | 150-400×10 9 /л |
| 5-10 лет | 180-450×10 9 /л |
| 10-15 лет | 150-450×10 9 /л |
| Больше 15 лет | 150-400×10 9 /л |
Причины повышения количества тромбоцитов
Увеличенное количество тромбоцитов в крови (свыше 400×10 9 /л) называется тромбоцитозом. Это состояние может быть нормальной реакцией организма на физические нагрузки (реактивный тромбоцитоз) или одним из признаков заболевания. Наиболее распространенными причинами тромбоцитоза являются:
- Злокачественные опухоли костного мозга и других органов.
- Истинная полицитемия.
- Железодефицитная анемия.
- Кровотечения и сильная кровопотеря.
- Травмы внутренних органов.
- Острые и хронические инфекционные заболевания, в том числе – туберкулез.
- Почечная недостаточность.
- Удаление селезенки.
- Аутоиммунные патологии, в том числе – ревматоидный артрит и системная красная волчанка.
- Воспалительные заболевания желудочно-кишечного тракта.
- Наследственная склонность к тромбоцитозу.
В некоторых случаях стабильно высокий уровень тромбоцитов является вариантом нормы. В таких случаях говорят о первичном или эссенциальном тромбоцитозе. Точная причина этого явления неизвестна².
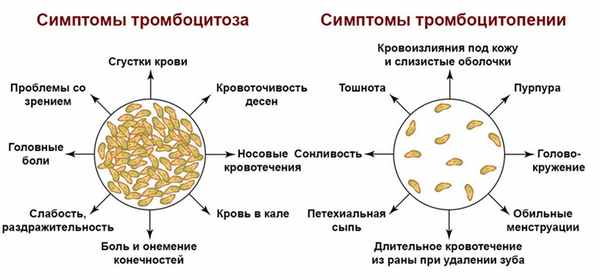
Рисунок 2. Симптомы тромбоцитоза и тромбоцитопении. Изображение: mikrostoker / Depositphotos
Причины пониженных тромбоцитов
Снижение уровня тромбоцитов крови называется тромбоцитопенией. Как правило, она является тревожным симптомом и требует принятия терапевтических мер. Основные причины тромбоцитопении:
- Тяжелые заболевания печени: цирроз, гепатиты.
- Тромбоцитопеническая пурпура или болезнь Верльгофа. Вариант геморрагического диатеза, при котором снижается уровень тромбоцитов.
- Гемолитико-уремический синдром или болезнь Гассера. Болезнь, при которой помимо снижения уровня тромбоцитов, происходит распад эритроцитов и формируется острая почечная недостаточность.
- Химиотерапия, проводимая при злокачественных опухолях.
- Прием некоторых медикаментов: клотримазол, гепарин.
- Малярия.
- Злоупотребление алкоголем.
- Патологии костного мозга, лейкозы.
- Заболевания щитовидной железы: тиреотоксикоз, гипотиреоз.
- Спленомегалия (увеличение селезенки).
- Синдром диссеминированного внутрисосудистого свертывания.
Также снижение уровня тромбоцитов ниже 150-400×10 9 /л возможно при беременности. Однако это состояние считается физиологической нормой.
Донорство тромбоцитов
Наиболее распространенный вариант донорства – сдача цельной крови. Однако практикуется и донорство только тромбоцитов. Кровь берется из одной руки и попадает в специальный аппарат. В нем тромбоциты отделяются от других компонентов крови, которые возвращаются в сосудистое русло донора через другую руку. Этот цикл повторяется несколько раз. Таким образом один донор может внести количество тромбоцитов, которое обычно получается от пяти анализов цельной крови. Суммарно такая процедура может помочь спасти трех людей³.
Последствия отклонения уровня тромбоцитов от нормы
Поскольку основная роль тромбоцитов в организме – это участие в свертывании крови, при резком изменении их уровня наблюдаются изменения в этом процессе.
Последствия тромбоцитоза
При повышении уровня тромбоцитов выше 600×109/л значительно увеличивается риск внутрисосудистого образования тромбов. Это, в свою очередь, является фактором риска для инфаркта миокарда, инсультов и нарушений кровоснабжения других внутренних органов.
Связь уровня тромбоцитов с сердечно-сосудистыми заболеваниями
Риск развития сердечно-сосудистых патологий больше связан с функцией тромбоцитов, чем с их количеством. Например, даже нормальное количество тромбоцитов, склонных к агрегации («слипанию»), может увеличить вероятность инфаркта или инсульта. Поэтому помимо измерения уровня тромбоцитов используют и другие тесты на свертываемость крови.
Последствия тромбоцитопении
При снижении уровня тромбоцитов в крови ниже 150×109/л возникает патологическая кровоточивость. Это проявляется кровотечениями из десен и носа. Даже при незначительных ударах возникают большие экхимозы (синяки), суставные гематомы (кровоизлияния в полость сустава). Также на коже наблюдаются небольшие красные точки (петехии). Женщины жалуются на обильные, продолжительные менструальные выделения. При сильном снижении уровня тромбоцитов возможно развитие внутренних кровотечений.
Как снизить количество тромбоцитов в крови?
В первую очередь важно идентифицировать причину тромбоцитоза. Реактивный тромбоцитоз не нуждается в коррекции. Если резкое повышение уровня тромбоцитов связано с какой-либо патологией, ключевую роль в коррекции играет лечение первичного заболевания.
Поскольку высокий уровень тромбоцитов в крови связан с внутрисосудистым образованием тромбов, при этом состоянии необходимо обязательно проконсультироваться с доктором: лечащим специалистом или гематологом. Только врач может правильно подобрать коррекцию с учетом индивидуальных особенностей пациента.
Способствовать снижению уровня тромбоцитов в крови могут следующие средства и рекомендации:
- Медикаменты, в первую очередь – ацетилсалициловая кислота.
- Потребление достаточного количества жидкости за день.
- Добавление в рацион большего количества овощей: томатов, свеклы, кабачков, чеснока и лука.
- Увеличение потребления свежих фруктов и ягод: гранатов, вишни, апельсинов, винограда.
- Добавление или увеличение количества оливкового масла и рыбьего жира.
Важную роль также играет здоровый образ жизни: правильное питание, нормализация режимов работы и отдыха, минимизация стрессов, умеренные физические нагрузки, отказ от употребления табачных изделий.
Лекарственные травы
Снизить уровень тромбоцитов крови также могут лекарственные травы, в том числе – гинко билоба. В состав этого растения входят терпеноиды, которые снижают вязкость крови и предотвращают образование кровяных сгустков. Это средство может использоваться как в виде растворов или капсул, так и отваров из листьев растения.
Как повысить количество тромбоцитов в крови?
Так же как и тромбоцитоз, дефицит тромбоцитов в крови должен коррелироваться под контролем врача с учетом причины его возникновения. При риске развития кровотечений основу терапии составляют медикаментозные средства, в том числе: этамзилат, аминокапроновая кислота, тромбопоэтин. В критических ситуациях может проводиться переливание тромбоцитарной массы.
При незначительном снижении уровня тромбоцитов, а также в качестве вспомогательного средства проводится коррекция рациона. При этом в него включаются следующие продукты:
- Изделия из ржаной муки и твердых сортов пшеницы.
- Отварное мясо курицы и куриный бульон.
- Нежирные сорта рыбы в виде отварного мяса или котлет.
- Орехи, в том числе – миндаль и арахис.
- Зеленые яблоки, болгарский перец, морковь.
- Салаты из свежих овощей на основе растительного масла.
При этом важно прекратить прием медикаментов, которые могут снижать уровень кровяных пластинок или заменить их. При этом решение о смене принимаемых лекарств должен принимать лечащий специалист.
PRP-терапия
PRP-терапия (Patelet Rich Plasma) – это метод лечения суставов, связок, сухожилий, костей собственной плазмой крови человека (аутоплазмой), обогащенной тромбоцитами. За счет наличия в кровяных пластинках фактора роста они стимулируют естественный процесс восстановления поврежденных тканей. Однако для достижения ощутимого результата количество тромбоцитов должно быть довольно большим. Поэтому цель такой терапии – увеличение концентрации тромбоцитов при минимизации количества эритроцитов ⁴ .
Заключение
Тромбоциты – один из важнейших форменных элементов крови, ключевая функция которых – формирование кровяных сгустков и остановка кровотечений. Но важно отметить, что колебания их уровня нельзя оценивать изолированно. Трактовать результаты любых анализов, в том числе и уровень тромбоцитов в крови, следует в комплексе с состоянием человека, имеющимися у него заболеваниями или принимаемыми медикаментами. Поэтому при выявлении отклонений от нормы не стоит пытаться самостоятельно провести какое-либо лечение – лучше обратиться за помощью к специалисту.
Издательский дом Питер

Единственный в мире Музей Смайликов
Самая яркая достопримечательность Крыма
5.4. Тромбоциты
Принято считать, что нормальный гемостаз достигается за счет кооперации и взаимодействия двух самостоятельных систем свертывания крови:
— клеточной системы, состоящей из тромбоцитов.
Конечным результатом активации гуморальной системы свертывания крови является образование фибринового сгустка, или красного тромба, в то время как реакция тромбоцитов, сопровождаемая клеточной адгезией и агрегацией, приводит к образованию тромбоцитарной пробки, или белого тромба. Хотя эти две системы свертывания, как правило, рассматриваются отдельно, следует понимать, что фактически их функции тесно переплетаются. Растворимые факторы свертывания (например, фибриноген и фактор Виллебранда) имеют большое значение для нормальной функции тромбоцитов, и, наоборот, тромбоциты являются важными поставщиками прокоагулянтных белков и необходимым катализатором ряда реакций в растворимой системе свертывания крови.
Нестимулированные тромбоциты представляют собой небольшого размера (диаметр 3,6±0,7 мкм) дискообразной формы безъядерные фрагменты ме-гакариоцитарной цитоплазмы, циркулирующие в периферической крови. В норме их содержание составляет от 150 до 400х10 12 /л. Тромбоциты играют важную роль в воспалительной реакции и в репарации тканей, а также в ате-рогенезе. Около 30 % тромбоцитов сконцентрированы в селезенке и являются своеобразным резервом для быстрой мобилизации в случае необходимости. Остальные тромбоциты 7-12 дней циркулируют в периферической крови.
Благодаря внедрению переливаний тромбоцитарной массы стало возможным широкое использованием высоких доз цитотоксических препаратов и трансплантации костного мозга при злокачественных заболеваниях. Можно надеяться, что открытие и клонирование тромбопоэтина (физиологического регулятора образования тромбоцитов) позволит снизить потребности в трансфузиях тромбоцитарной массы и поможет ученым более детально изучить нормальную активность этих самых маленьких клеток крови.
Мегакариоцитопоэз
Тромбоциты, наименьшие по размеру форменные элементы крови, образуются из самых крупных костномозговых клеток — мегакариоцитов. До образования тромбоцитов последовательно проходят 4 стадии:
— экспоненциальное увеличение количества лимитированных стволовых клеток за счет митотического деления клеток;
— серийная репликация ядра без деления клеток (т.е. эндоредуплика-ция или полиплоидизация);
— созревание цитоплазмы мегакариоцита;
— отделение тромбоцитов от мегакариоцита.
Каждый из этих 4 процессов может влиять на скорость образования тромбоцитов и выведения их из костного мозга в периферическую кровь.
В созревающем мегакариоците цитоплазма, увеличиваясь в объеме, заполняется а-гранулами, плотными гранулами, а также обширной сетью переплетенных мембранных каналов и тубул, которая называется демаркационной мембранной системой (ДМС). Размер полностью созревших мегакариоцитов варьирует от 20 до 50 мкм. Они составляют приблизительно 0,04 % ядросо-держащих костномозговых клеток. Для них характерны объемная розовая цитоплазма с большим количеством гранул и эксцентрично расположенное компактное ядро с несколькими долями,
Процесс терминальной стадии тромбоцитопоэза недостаточно изучен. Возможно, что в ответ на некий сигнал мегакариоциты трансформируются в паукообразные клетки, от которых отходит множество длинных нитевидных отростков (протромбоцитов) с равномерными очагами констрикции. Протром-боциты входят в костномозговые синусоиды и там фрагментируют на тромбоциты, возможно, благодаря сдвигающей силе кровотока. Хотя терминальная стадия тромбоцитопоэза ограничивается только наиболее зрелыми мега-кариоцитами, она представляет собой регулируемый процесс. После резкого увеличения периферической потребности в тромбоцитах незамедлительно выявляется увеличение объема этих клеток, что отражает изменения в механизме образование тромбоцитов.
Гуморальная регуляция продукции тромбоцитов
В стабильных условиях количество циркулирующих тромбоцитов поддерживается в определенном контролируемом узком диапазоне. Но при патологических состояниях, приводящих к ускоренному потреблению тромбоцитов, их образование костным мозгом может быть в 8 раз больше нормы. Такое увеличение происходит за счет стимуляции образования мегакариоцитов и увеличения их плоидности, размера и скорости созревания. При исследовании причин тромбоцитопении ключевые патогенетические факторы могут быть найдены в костном мозге. При повышенном количестве костномозговых мегакариоцитов можно полагать, что тромбоцитопения вызвана потреблением тромбоцитов в периферической крови или ретикулоэндотелиальной системе (или секвестрации селезенкой).
Более 30 лет тому назад предположили, что образование тромбоцитов контролируется фактором, циркулирующим в плазме, получившим впоследствии название «тромбопоэтин», концентрация которого увеличивается в ответ на
194 Глава 5. Физиология крови
тромбоцитопению. Однако как специфический цитокин, регулирующий ге-мопоэз, тромбопоэтин идентифицировали в 1994 г., когда была определена его аминокислотная последовательность и его ген был клонирован.
Тромбопоэтин, — специфический стимулирующий регулятор развития мегакариоцитов и образования тромбоцитов. Он действует как на уровне коммитированной мегакариоцитарной стволовой клетки, так и на уровне развивающегося мегакариоцита. Тромбопоэтин (другие обозначения: ТПО, Mpl-лиганд, фактор роста и развития мегакариоцита, мегапоэтин) продуцируется в основном печенью, и только незначительное количество его мРНК определяется в почках. В противоположность другим гемопоэтическим ци-токинам, тромбопоэтин, видимо, не регулируется на уровне генной транскрипции. Даже при тяжелой тромбоцитопении, вызываемой в эксперименте ускоренным потреблением тромбоцитов или угнетением их образования, уровень мРНК ТПО в печени почти не отличается от нормы. Полагают, что тромбопоэтин продуцируется печенью с постоянной скоростью, и его стимулирующий эффект обусловлен количеством молекул, не связанных с рецепторами ТПО циркулирующих тромбоцитов. Такая модель требует подтверждения, однако с ее помощью можно объяснить, почему тромбоцитопения, вызванная депонированием тромбоцитов в селезенке при стабильном их содержании, не приводит к компенсаторной стимуляции тромбоцитопоэза.
В меньшей степени, чем тромбопоэтин, или не столь специфически стимулируют образование тромбоцитов и многие другие гемопоэтические цитоки-ны. Интерлейкин-3 (ИЛ-3), мультилинейный гемопоэтический фактор роста, стимулирует митотическую экспансию и начальное развитие мегакариоцитарной коммитированной стволовой клетки, но оказывает незначительное действие на мегакариоцитарную эндоредупликацию и созревание цитоплазмы. Напротив, ИЛ-6 и ИЛ-11 оказывают тромбоцитопоэтическое действие, стимулируя в умеренной степени постмитотические фазы развития мегакариоцита.
В состоянии покоя тромбоцит представляет собой дискообразную клетку с гладкой цитоплазматической мембраной, поддерживаемой кольцом из микротрубочек (рис. 19). Несмотря на небольшой размер (2-4 мкм), тромбоцит представляет собой сложный структурный и функциональный комплекс, участвующий не только в формировании гемостатической пробки, но и во многих других звеньях гемостаза. Мембрана клетки инвагинирует и соединяется с сетью многочисленных каналов, так называемой открытой каналикуляр-ной системой (ОКС), которая тесно переплетена внутри тромбоцита. Обнаружено, что центральные каналы этой системы соединяются с внеклеточным пространством тромбоцита и ОКС экспрессирует те же гликопротеины, что и клеточная мембрана. Вторая система внутренней оболочки (плотная тубуляр-ная система), которая, как полагают, образуется из эндоплазматического ре-
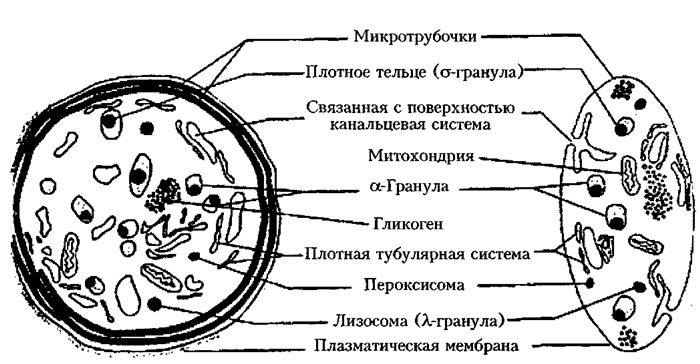
Рис. 19. Структура тромбоцита (справа - поперечный разрез) [Bentfeld-Barker M. E., Bainton D. F., 1982].
196 ______________ ___Глава Б. Физиология крови
тикулума мегакариоцита, не зависит от О КС и не соединяется с внеклеточным пространством. Сократительные микрофиламенты распространяются от субмембранного пространства по всей цитоплазме тромбоцита и обусловливают изменения его формы, которые происходят во время активации клетки. В цитоплазме неактивированных тромбоцитов можно обнаружить 4 вида гранул:
Наиболее многочисленные а-гранулы содержат тромбоцитспецифические (тромбоцитарный фактор роста, тромбоцитарный фактор 4, |3-тромбоглобулин, тромбоспондин) и тромбоцитнеспецифические пептиды, способствующие и модулирующие коагуляцию, воспаление, иммунитет и восстановление тканей. Плотные гранулы, названные так из-за внешнего вида при электронной микроскопии, представляют собой богатое хранилище АДФ и серотонина — веществ, способствующих агрегации тромбоцитов, антиагреганта АТФ и Са 2+ — основного кофактора коагуляции. Лизосомные гранулы содержат гидролитические ферменты, а пероксисомы — каталазу (табл. 24).
Наружная клеточная оболочка и ОКС усеяны гликопротеинами, играющими важную роль в адгезии и агрегации тромбоцитов (табл. 25). Эти молекулы состоят из наружных доменов, действующих в качестве рецепторов, которые связываются с внеклеточными адгезивными гликопротеинами (фибриногеном, коллагеном, фактором Вилленбранда), и трансмембранных пеп-тидов, которые фиксируют гликопротеины и трансдуцируют процессы активации тромбоцитов и изменения их формы (см. далее). Большинство тром-боцитарных гликопротеинов, за исключением гликопротеинового комплекса Ib-IX, являются членами интегринового семейства генов. На тромбоцитарных оболочках имеются рецепторы для физиологических медиаторов активации тромбоцитов (включая АДФ, адреналин, серотонин и тромбоксан А2) и для Fc-части иммуноглобулинов. Также на мембране тромбоцита экспрессирова-ны антигены системы АВО, системы HLA класса I (но не класса II), специфические антигены тромбоцитов человека (human platelets antigen — НРА) и другие антигены, способные вызвать образование антител.
Функции тромбоцитов:
— запуск немедленного гемостаза за счет адгезии и агрегации тромбоцитов, что приводит к образованию тромбоцитарной пробки;
— местное выделение вазоконстрикторов для уменьшения кровотока в пораженном участке;
— катализ реакций гуморальной системы свертывания с образованием в итоге фибринового сгустка;
— инициирование процесса репарации тканей;
Таблица 24 Компоненты ос-гранулы тромбоцита и их предполагаемые функции
Компонент
Тромбоцитарный фактор роста (ТрФР)
Репарация за счет усиления деления фибробластов
Нейтрализация гепарина, воспалительный процесс
Воспаление, репарация ткани Свертывание, адгезия тромбоцитов Свертывание, агрегация тромбоцитов Свертывание Антикоагулянт Связывание гормонов, токсинов, лекарственных препаратов
Таблица 25
Тромбоцитарные гликопротеины и их лиганды
ФВ, фибронектин, витронектин
Нестимулированные тромбоциты циркулируют в виде гладких дискоид-ных клеток с незначительной метаболической активностью. Такие тромбоциты не вступают в значимое взаимодействие с другими форменными элементами периферической крови или с монослоем эндотелиальных клеток, который выстилает эндоваскулярное пространство.
Физиологическая активация тромбоцитов начинается только тогда, когда поврежден сосудистый эндотелий и обнажен субэндотелиальный внеклеточный матрикс. Ежедневно на поддержание целостности сосудистой стенки расходуется от 7 до 10х10 9 /л тромбоцитов (около 17-20 % от общей потери тромбоцитов). При повреждении эндотелия воздействию подвергается кол-
198 Глава 5. Физиология крови
лаген, другие белки внеклеточного матрикса, а также микрофибриллы, фиксирующие большие мультимеры фактора Виллебранда (которые синтезируются и секретируются эндотелиальными клетками). Рецепторный гликопро-теин Ib (ГП Ib) тромбоцитарной мембраны связывается специфически с фактором Виллебранда (ФВ), который вторично (другим участком) связывается с ГП IIb/IIIa тромбоцитарной мембраны. Субэндотелиальный коллаген связывается с рецептором мембранного ГП 1а. Адгезия тромбоцитов, обеспечивая гемостаз в незначительной степени, инициирует процесс тромбоцитарной активации, который приводит к существенному изменению формы тромбоцитов, секреции содержимого плотных и ос-гранул, агрегации тромбоцитов с образованием гемостатической тромбоцитарной пробки.
Из вышеизложенного ясно, почему у пациентов с дефицитом фактора Виллебранда (болезнь Виллебранда) или с отсутствием гликопротеина Ib — тромбоцитарного рецептора к фактору Виллебранда (болезнь Бернара-Су-лье) — нарушен процесс адгезии тромбоцитов к коллагену.
Изменение формы представляет собой раннее и обратимое проявление активации тромбоцитов, которое опосредовано внутриклеточной системой сократительных микрофиламентов. В тромбоцитарной мембране возникают волны возбуждения и из них выходит большое количество коротких нитевидных псевдоподий или филоподий, создавая на мембране открытую ка-наликулярную систему. В результате этого процесса значительно увеличивается площадь поверхности тромбоцитарной мембраны, на которой происходит катализ реакций гуморальной системы свертывания крови, а также может произойти стабилизация тромбоцитарных агрегатов. Активация тромбоцитов также приводит к конформационному изменению в ГП lib/Ilia, которое способствует связыванию фибриногена с тромбоцитарной мембраной, что служит предпосылкой для агрегации тромбоцитов. С инициированием активации тромбоцитов внутриклеточные органеллы собираются в центр клетки за счет сокращения микротубулярного кольца, после чего следует слияние мембран плотных и а-гранул друг с другом, клеточной мембраны тромбоцита и мембраны ОКС. Это слияние приводит к экзоцитозу гранулярных компонентов в наружную микросреду, так как внутренние каналы ОКС соединяются с внеклеточным пространством. За счет экзоцитоза белок мембраны а-гранулы Р-селектин (синонимы: GMP-140, PADGEM) перемещается с внутренней поверхности гранулы в ОКС и наружную оболочку клетки. Происходят такие биохимические реакции, как синтез тромбоксана А2 за счет арахидоната, секретируемого из мембраны плотной тубулярной системы, и синтеза тромбоцит-активирующего фактора (ТАФ) — сложной липидной молекулы. Тромбоксан А2, нестабильный член семейства простаг-ландинов, является сильным проагрегантом и вазоконстриктором, а ТАФ усиливает реакцию агрегации тромбоцитов и служит мощным активатором ней-трофилов. С началом активации тромбоцитов секретируемые АДФ, серото-
нин и тромбоксан А2 активируют близлежащие тромбоциты. Этот аутоамп-лифицирующий каскад активации тромбоцитов, синтез тромбоксана А2, выделение содержимого гранул приводят к образованию тромбоцитарного агрегата, прошитого фибриногеном, который образует мостик рецепторов ГП Ilb/IIIa на мембранах соседних тромбоцитов. Фибриногеновый мостик существенно стабилизируется тромбо-спондином — другим компонентом а-гранул, освобождаемым при активации тромбоцитов. Генерация тромбина как продукта гуморального коагуляционного каскада усиливает агрегацию тромбоцитов, поскольку тромбин является еще одним мощным агонистом тром-боцитарной агрегации.
У лиц с отсутствием или дисфункцией гликопротеина Ilb/IIIa (тромба-стения Гланцмана) агрегация с участием фибриногена не происходит.
Происходит не только активация тромбоцитов тромбином, но и тромбоциты в значительной степени способствуют генерированию тромбина, катализируя и обеспечивая факторы для реакций гуморального коагуляционного каскада. Известно, что мегакариоциты синтезируют и депонируют в а-гранул ах коагуляционные факторы V, VIII, XIII, ФВи фибриноген. Эти факторы свертывания крови выбрасываются в микросреду с активацией тромбоцитов и экзоцитозом, повышающим их концентрацию на местном уровне. Внеклеточные адгезивные гликопротеины — фибронектин, остеонектин и витронектин — также депонируются в тромбоцитарных сс-гранулах и сек-ретируются при активации тромбоцитов.
Тромбоцитарные мембраны играют важную роль в запуске специфических реакций свертывания. Липопротеин мембраны, так называемый фактор 3, является важным катализатором при активации фактора X факторами 1Ха и VIII и при образовании протромбиназы за счет взаимодействия между факторами Ха и V. Тромбоцитарная мембрана может также играть важную роль во взаимодействии других растворимых факторов свертывания с целью достижения оптимальной реактивности. И наоборот, активированные тромбоциты ограничивают коагуляционный каскад. Мембрана активированного тромбоцита связывает тромбин и тромбомодулин, компонент а-гранул, которые вместе вызывают активацию антикоагуляционного протеина С. а-Гранулы также поставляют в микросреду активатор тканевого плазминогена.
Тромбоциты участвуют в воспалительном процессе и репарации тканей. Тромбоцитарyые а-гранулы поставляют мощные цитокины, тромбоцитарный фактор роста и трансформирующий фактор роста (3 (ТФР-Р) в очаг поврежденной ткани. Тромбоцитарный фактор роста служит сильнодействующим стимулятором пролиферации фибробластов и клеток гладких мышц, в то время как трансформирующий фактор обладает как стимулирующими, так и ин-гибирующими рост свойствами. Тромбоцитарный фактор 4 и р-тромбогло-булин — два других тромбоцитспецифических белка а-гранул, члены небольшого семейства индуцибельного гена, играющие определенную роль в коагу-
200 Глава 5. Физиология крови
ляции, воспалительной реакции и клеточном росте. Наконец, тромбоциты контактируют с системой гуморального иммунитета. Как указывалось ранее, тромбоцитарные мембраны имеют рецепторы для Fc-участка молекулы IgG и связывают иммунные комплексы и агрегированный IgG. Обнаружено, что покоящиеся тромбоциты поглощают иммуноглобулин за счет эндоцитоза и хранят его в а-грануле, чтобы позже секретировать путем экзоцитоза.
Важно помнить, что средний объем тромбоцитов (СОТ) изменяется обратно пропорционально их количеству, а тромбоцитарная масса в кровообращении у индивидуума весьма постоянна. Объем тромбоцита коррелирует со средней плоидностью мегакариоцитов и возрастает при ускоренном образовании тромбоцитов. Наличие большого количества крупных тромбоцитов или мегакариоцитов в мазке периферической крови больных с тромбоцитопенией считается диагностическим маркером тромбоцитопении потребления.
Читайте также:
