Удаление катетеров экстракорпоральной мембранной оксигенации (ЭКМО)
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Рекомендации по проведению экстракорпоральной мембранной оксигенации ( ЭКМО) у больных в критических состояниях.
по материалам R.K. Firmin and H.M. Killer
Perfusion; 1999 Jul. Vol 14 Issue 4 P 291-7
Показания к проведению экстракорпоральной мембранной оксигенации.
Теоретически, ЭКМО может быть использована для лечения любого больного с потенциально обратимым легочным, сердечным или сердечно-легочным поражением. На практике, это оборачивается необходимостью разделения больных на тех, кто достаточно тяжело болен, чтобы оправдать затраты на ЭКМО, и тех, кто слишком тяжело болен, чтобы ЭКМО могла повлиять на исход. попробуйте ответить для себя на следующие вопросы:
1) является ли данная сердечно-легочная патология потенциально обратимым состоянием?
2) насколько сохранны другие органы и системы ? - особенно это касается ЦНС
3) не противопоказанна ли в данном случае гепаринизация?
4) насколько вероятна положительная динамика в результате дальнейшего лечения
Одним из основных факторов при выборе кандидата на ЭКМО является повреждающее действие на легкие ИВЛ с высокими инспираторными давлениями. Поэтому, длительность проводившейся ИВЛ считается важным критерием при отборе больных для ЭКМО. Для взрослых больных и детей старших возрастных групп длительность ИВЛ более 7 суток предлагают считать противопоказанием для ЭКМО. Этот критерий подтверждается результатами независимых исследований.
При использовании ЭКМО в для поддержки кровообращения наилучших результатов удается достигать при правожелудочковой недостаточности, вызванной гипертензией малого круга, и сопутствующей гипоксии. На практике, показания к ЭКМО при сердечной недостаточности ограничиваются 3 основными группами:
1) после операции на сердце по поводу врожденного порока
2) обеспечение переходного периода при трасплантации сердца или сердца с легкими
3) при миокардите или синдроме отторжения транспланта
При определении показаний к ЭКМО в этих группах больных необходим особо тщательный подход, так как на современной уровне кардиальной хирургии состояния с малым сердечным выбросом, резистентные к инотропной поддержке , является редкостью и часто указывают на незамеченную или неустраненную проблему. Применение ЭКМО в подобной ситуации способно затруднить диагностику.
Контур для проведения ЭКМО.
Контур для проведения ЭКМО в целом подобен контуру сердечно - легочного шунта в аппарате искусственного кровообращения, с тем отличием, что контур ЭКМО предназначен для длительного функционирования и поддержания нормотермии. Трубки и их соединения организованы так, что избежать формирования зон стаза. ЭКМО используется только на фоне гепаринизации низкими дозами.
Самым важными компонентом контура является оксигенатор: все остальное направлено на поддержание его функции. Стандартное устройство, созданное Avecor по проекту Kolobow, не претерпело существенных изменений с 1970 года. Производятся размеры колеблется от 0,4 до 4,5 кв. м. Авторы используют оксигенаторы Ultrox ( Avecor), которые имеют аналогичное устройство. Размер применяемого оксигенатора зависит от двух факторов: веса больного и применяемого доступа -- вено-венозного или артерио-венозного. При использовании вено-венозного доступа требуется в 2 раза большая площадь газообмена, чем при применении артерио-венозного. У новорожденных широко используются оксигенаторы Jostra. Medtronic производит оксигенаторы с сорбированным на стенках гепарином, которые также используются у взрослых больных, но по-прежнему страдают утечкой плазмы, что является общей проблемой всех капиллярных оксигенаторов.
Неотъемлемой частью большинства контуров являются теплообменники, подогревающие перфузируемую кровь. Их лучше размещать после оксигенатора и как можно ближе к больному.
Большинство клиник , применяющих ЭКМО, используют роликовые насосы ( напр. Cobe Stockert). Незначительное количество клиник использует центрифуги, обычно Biomedicus (Medtronic). При использовании роликовых насосов, качество трубок контура является критическим для длительной работы. В наибольшей степени для этих целей подходят трубки Supertygon S65HL ( Norton Performance Plastics). При длительной ЭКМО важно избегать чрезмерной окклюзии трубки (при неправильной регулировке насоса), что может привести к перерезанию контура. Трубки контура не рекомендуется использовать повторно из-за опасности разрыва.
При использовании насосов центрифужного типа очень важно контролировать давление притока или иметь систему серво-регуляции , так как высокая частота вращения вызывает сильную кавитацию и гемолиз при снижение венозного пассажа.
Существует и третий тип насоса - перистальтический (Sofracob), изготавливаемый во Франции, но малораспространенный в других странах. Недавно созданный M Pump ( Avecor) также основан на перистальтическом принципе. Этот тип может оказаться перспективным для длительного применения.
Большинство центров используют заранее собранные контуры, которые собираются по их заказу.
Подготовка контура к работе.
Существует много вариантов подготовки к работе контура для ЭКМО. Однако, существует несколько основополагающих принципов. Перед перфузией жидкими средами необходимо продуть контур углекислым газом. Это предотвращает образование мелких пузырьков при начале жидкостной перфузии. Дальнейшая подготовка идет в три этапа. Первый этап - промывка контура 20% раствором альбумина, который образует белковую выстилку внутренней поверхности контура, что делает его более совместимым с кровью. Затем, контур полностью заполняется кристаллоидным раствором ( напр. раствором Гартмана или Плазмалитом А). Необходимо добиться полного вытеснения воздушных пузырьков из всех узлов контура после чего добавляют гепаринизированную кровь. Для небольших педиатрических контуров обычно достаточно 1 единицы крови. Более крупные контуры, используемые во взрослой практике забирают 2 единицы крови. Кислотно-щелочное равновесие получившегося первичного раствора корригируют 8,4% бикарбонатом или трис-буфером. Также, к первичному раствору добавляется кальций во избежание угрозы гиперкалиемии, которая часто развивается.
Сосудистый доступ для ЭКМО
Для проведения ЭКМО можно использовать вено-венозную канюляцию (ВВК) или вено-артериальную ( ВАК ). Вено-артериальная перфузия предпочтительна при скомпрометированном миокарде. При изолированном поражении легких ВВК обычно вполне адекватна. Точная установка и подгонка размера канюль играет главную роль в обеспечении адекватного тока и минимального гемолиза.
Современные канюли имеют тонкие стенки и иногда армируются во избежание перегибов. У детей неонатального периода , которым выполняется вено-артериальная перфузия, отлично себя показали армированные катетеры Biomedicus ( Medtronic) размером от 8 до 14 Fr. Для вено-венозного доступа обычно используют двухпросветную канюлю размером от 12 до 15 Fr. Для установки вено-артериального доступа у детей и взрослых требуется хирургический разрез, в то время как, вено-венозный доступ у взрослых может быть налажен путем чреcкожной пункции и последующего проведения канюли по проводнику.
Существенным дефектом канюляции может быть кровотечение из области расположения канюли, которого можно избежать практически во всех случаях кроме реканюляции у пациентов после неудачной попытки отключения от аппарата искусственного кровообращения.
Удаление артерио-венозной канюли требует хирургической операции. Вено-венозные канюли могут быть удалены без операции, надо только наложить шов на кожу.
Пациенты с ЭКМО нуждаются в постоянном наблюдении специалиста, способного быстро установит и устранить неполадки в функционировании контура, обнаружить развивающиеся осложнения. Чаще всего это либо лечащий врач, либо специально подготовленный анестезист.
Газообмен и гемодинамика.
Вено-артериальная и вено-венозная ЭКМО сопровождаются различными гемодинамическими эффектами. При вено-артериальной ЭКМО сердечный выброс состоит из суммы сердечного выброса пациента и экстракорпорального кровотока. Поскольку артериальная кровь представляет из себя смесь крови с различной сатурацией из мембранного оксигенатора и легких, то лучше всего мониторировать эффективность кислородного транспорта, измеряя сатурацию венозной крови. Венозная сатурация более 70% свидетельствует об адекватной оксигенации организма. Во время вено-венозной перфузии поток через аппарат ЭКМО не влияет на сердечный выброс. Поэтому смешивание крови с различной сатурацией происходит в венозном отделе сосудистой системы, что соответствует обычным физиологическим условиям. Для контроля оксигенации у таких пациентов достаточно мониторинга газов крови.
Увеличение кровотока через ЭКМО ведет к увеличению доставки кислорода. Для увеличения элиминации углекислого газа требуется увеличить промывание наружной поверхности оксигенатора свежим газом.
Необходимость предоставления легким относительного покоя сегодня очевидно. При ЭКМО , поддерживая легкие в расправленном состоянии, стремятся избежать их перерастяжения. Поэтому используются малые дыхательные объемы, низкая частота. Пример типичных настроек режима CMV при ЭКМО: инспираторное давление 20 см вод.ст., FiO2=0.3, ПДКВ 10 см вод.ст., частота вентиляции 10 в минуту.
Особенности ведения больных с ЭКМО
Необходим тщательный контроль водного баланса: ограничение объема инфузий, использование по мере надобности диуретиков и гемофильтрации.
Для предотвращения тромбирования контура необходима гепаринизация. Для мониторинга ежечасно выполняют тест на активированное частичное тромбопластиновое время, которое желательно удерживать в пределах 160-200 секунд у стабильного больного. Если больной теряет кровь, то необходимо дальнейшее сокращение АЧТВ, что можно достичь введением апротинина ( 1 мл/кг болюсно с дальнейшей инфузией 1 мл/кг час ). Гемоглобин должен поддерживаться на достаточно высоком уровне, рекомендуют не менее 140 г/л. Поскольку основная кровопотеря у больных на ЭКМО идет за счет крови забранной для анализа, то количество выполняемых анализов с забором крови должно быть минимальным. В контуре постоянно идет расход тромбоцитов и организм нуждается в целенаправленном восполнении тромбоцитов, рекомендуемый уровень не менее 75 000 Г/л у стабильных больных.
Представленные рекомендации базируются на материале, полученном при лечении 522 больных: 192 новорожденных, 161 детей, 169 взрослых. Взрослые больные продемонстрировали наибольшую выживаемость при синдроме острого легочного повреждения (68%) и при сепсисе (78 %). Наихудшие показатели выживаемости наблюдаются сердечной недостаточности у взрослых (42%). Очевидно, что ЭКМО может применяться во всех возрастных группах, не увеличивая существенно уровень ятрогении при соблюдении вышеизложенных рекомендаций.
При необходимости вы можете получить у нас данные по использованию ЭКМО у этих больных , организованные по нозологии и возрастным группам.
Экстракорпоральная мембранная оксигенация (ЭКМО)
Экстракорпоральная мембранная оксигенация (ЭКМО) - метод, который гарантирует постоянное поддержание параметров газообмена (достаточное поступление кислорода и удаление углекислого газа) с возможностью снижения пикового давления вдоха, дыхательного объема, частоты дыханий, фракции кислорода в дыхательной смеси у пациентов на искусственной вентиляции легких. Таким образом, ЭКМО буквально замещает функцию легких, в отличие от искусственной вентиляции легких, и уменьшает или даже полностью нивелирует ее негативное влияние на легочную ткань.
Hill и соаворы представили первый успешный случай использования экстракорпоральной мембранной оксигенации у взрослого пациента с острым респираторным дистресс-синдром в 1972 году. Bartlett и соаворы представили первый случай, когда новорожденный выжил благодаря применению ЭКМО в 1976 году.
Показания к проведению ЭКМО у взрослых пациентов представляют собой модифицированные критерии «немедленного» и «отсроченного» включения в исследование ЭКМО, которое проводилось в США: «немедленные» показания - PaO2≤50 мм рт.ст. более 2 ч при FiO2=100; PEEP≥5 см вод.ст; «отложенные» показания - PaO2≤50 мм рт.ст. более 12 ч при FiO2 = 60; PEEP≥5 см вод.ст.; неэффективность максимально интенсивного лечения в течение 48 час.
(FiO2 – фракция кислорода в смеси, которая вдыхается, PaO2- парциальное давление кислорода в артериальной крови, РЕЕР – положительное давление в конце выдоха).
Низкопоточное вено-венозное (ВВ) ЭКМО выполняется следующим образом – с помощью двух катетеров, один из которых имплантирован в нижнюю полую вену, происходит забор крови, которая пропускается через оксигенатор (устройство, где кровь насыщается кислородом и удаляется углекислый газ), а оксигенированная (насыщенная кислородом) кровь возвращается в верхнюю полую вену через катетер, который устанавливается в правую яремную вену. Через оксигенатор пропускается чистый кислород, поток газа устанавливается в соответствии с целевым значением давления углекислого газа в артериальной крови. Оксигенация проводится как через собственные легкие, так и с помощью оксигенатора (или исключительно с помощью оксигенатора). Описанная техника – один из вариантов проведения экстракорпоральной мембранной оксигенации, экстракорпоральный контур может использоваться в других модификациях.
Чаще всего необходимость в таком лечении возникает у пациентов с тяжелыми пневмониями (воспалением легких), острым повреждения легких (например, вследствие искусственной вентиляции или при сочетанных поражениях почек и легких и др.), при остром респираторном дистресс синдроме в случае неэффективности максимальной применяемой традиционной терапии в течение 2-х суток показано проведение ЭКМО терапии. При отсутствии необходимости в замещении функции сердца более безопасным методом считается ВВ ЭКМО. При необходимости одновременной поддержки функции сердца (или его замещение) и функции легких используют вено-артериальное (ВА) ЭКМО или экстракорпоральную поддержку жизни.
Схематическое изображение экстракорпорального контура при ЭКМО
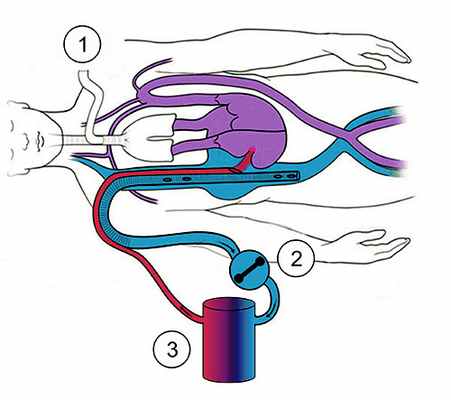
(1) - ИВЛ-аппарат
(2) - Оксигенаторы
(3) - Роликовая помпа
Поскольку ЭКМО поддерживает жизнедеятельность организма пациента до восстановления функции легких, то есть дает время дождаться эффекта от лечения, понятны причины популярности этого метода в ведущих клиниках мира. Частота проведения ЭКМО, которая обеспечивает выживаемость около 60% практически безнадежных пациентов увеличивается каждый год (в 2014 году было проведено 1000 пациенто/лет ЭКМО, что в более чем в 10 раз больше чем в 2008 году).
Современное оборудование и более чем 5-летний опыт специалистов клиники EuReCa в применении экстракорпоральной мембранной оксигенации для лечения пациентов с острым респираторным дистресс синдром, посткардиотомическим синдромом и тяжелыми позагоспитальными и госпитальными пневмониями позволяет надеяться на благоприятный исход лечения даже таких тяжелых и опасных заболеваний.
Программа лояльности
Программа лояльности
Во время консультации врач может рекомендовать провести дообследования. В случае, если пациент будет проходить их в нашей клинике, стоимость некоторых услуг будет ниже.
Программа лояльности
При направлении семейного или профильного врача другого медицинского учереждения. Пациенту необходимо взять направление, историю болезни и, желательно, контактные данные врача для возможности прямой связи.
Удаление катетеров экстракорпоральной мембранной оксигенации (ЭКМО)
Удаление катетеров экстракорпоральной мембранной оксигенации (ЭКМО)
Показания:
1. Устранение ЭКМО после восстановления функций легких.
2. Устранение ЭКМО в связи с осложнениями (например, неостанавливающимся кровотечением или невозможностью восстановления функций легких).
Противопоказания. Прекращение всех мер интенсивной терапии и получение согласия на аутопсию. Обычно удаляют катетеры во время аутопсии.
Меры предосторожности:
1. Пациенту следует ввести миорелаксанты во время удаления венозного катетера во избежание воздушной эмболии.
2. В связи с повышенной ломкостью возможен разрыв сосудов. Необходимо обеспечить запас крови.
3. Следует отложить удаление катетера на 12-24 ч при высоком риске рецидива легочной гипертензии (например, тяжелой врожденной диафрагмальной грыжи).
Персонал, оборудование и лекарства для удаления катетеров
I. Персонал. Тот же, что и для катетеризации. В данном случае не нужны медицинские работники, занимающиеся заполнением системы.
б) Нестерильное. То же, что и для катетеризации.
в) Лекарственные средства:
1. Фентанил (10-20 мкг/кг).
2. Векурония бромид (0,2 мг/кг). Используют миорелаксанты короткого действия в связи с относительно небольшой продолжительностью процедуры. Их применение позволяет перевести новорожденного на спонтанное дыхание в короткие сроки после удаления катетера и облегчить отвыкание от ИВЛ.
3. Ксилокаин с адреналином (0,25% раствор).
4. Тромбин для местного применения.
5. Протамина сульфат (
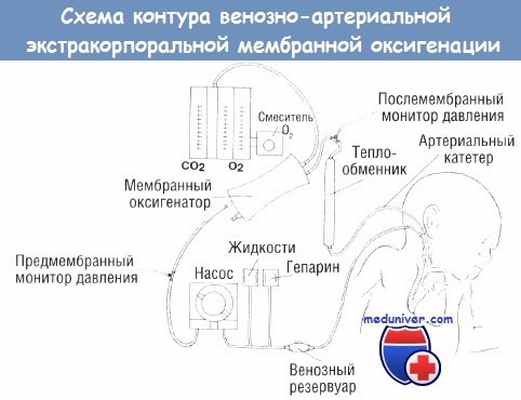
Схема контура венозно-артериальной экстракорпоральной мембранной оксигенации.
Отток крови из правого предсердия в мешок контура с током через мембранное легкое, теплообменник и возврат крови в дугу аорты через катетер сонной артерии.
Методика удаления катетеров экстракорпоральной мембранной оксигенации (ЭКМО)
Пластика сосуда после удаления катетера не описана в этой статье.
1. Укладывают пациента, разгибают шейный отдел, подкладывая валик под плечи.
2. Вводят фентанил в целях релаксации перед применением векурония. В связи с риском воздушной эмболии при удалении венозного катетера следует исключить самостоятельное дыхание во время манипуляции. В случае недостаточного эффекта после введения двух доз векурония используют панкуроний.
3. Изменяют параметры ИВЛ. Увеличивают частоту дыхания до 40-50 в минуту, пиковое давление выдоха до 20-25 см вод.ст. в зависимости от движений грудной клетки и FiО2 до 0,3-0,4 после введения миорелаксанта.
4. Обрабатывают кожу шеи и отграничивают операционным бельем, как для катетеризации.
5. Вводят 0,25% ксилокаин с адреналином.
6. Срезают и снимают викриловый шов.
7. Удаляют рассасывающуюся желатиновую губку, обнажая катетеры и сосуды. При наличии катетера в луковице яремной вены его удаляют, в первую очередь для лучшего обзора при удалении вено-венозного катетера ЭКМО.
8. Перед извлечением катетера из луковицы яремной вены следует снять с него зажим. После пациента отключают от шунта. Следует помнить, что удаление катетера при включенном шунте без зажима приведет к попаданию воздуха в контур. В случае венозно-артериального ЭКМО обычно удаляют первым венозный катетер, поскольку он наиболее легкодоступен.
9. Тупым путем катетер отделяют от окружающих тканей.
10. На вену накладывают лигатуру шелком 2-0, с помощью которой путем потягивания можно остановить кровотечение.
11. На вену накладывают зажим Сотинского для стабилизации катетера.
12. Накладывают лигатуру шелком 2-0 проксимальнее зажима.
13. Рассекают шелковый шов, фиксирующий катетер в вене, с помощью скальпеля. Две проксимальные лигатуры следует снять в месте, где они пересекают сосудистую петлю («тапочек»).
14. Просят специалиста по ЭКМО отключить пациента от контура ЭКМО.
15. Мониторируют витальные функции и насыщение кислородом для оценки адекватности параметров ИВЛ. Во время отключения пациента от контура ЭКМО параметры вентиляции могут быть увеличены.
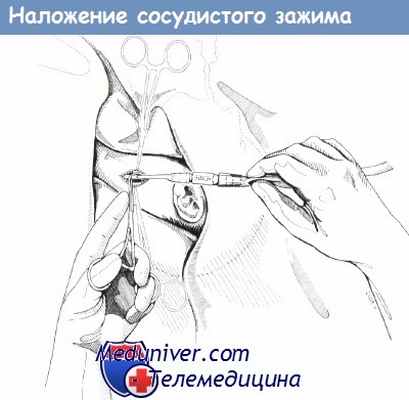
Наложение сосудистого зажима Сатинского перед удалением катетера для экстракорпоральной мембранной оксигенации.
16. Пока хирург надавливает на печень и удаляет катетер, аппарат ИВЛ удерживают в состоянии вдоха. Невыполнение этих мероприятий может привести к воздушной эмболии.
17. Восполняют любую значимую кровопотерю.
18. Удаляют шелковый (2-0) шов-держалку и завязывают шов проксимальнее зажима Сатинского. Снимают зажим Сатинского.
19. Выделяют и удаляют артериальный катетер. Процедура удаления катетера та же, что и венозного катетера, за исключением того, что не требуется удержания на вдохе.
20. Назначают протамин в дозе 1 мг внутривенно после удаления обоих катетеров. Если нет кровотечения, введение протамина необязательно.
21. Орошают рану стерильным физиологическим раствором и коагулируют кровоточащие сосуды.
22. При желании тампонируют рану пропитанной тромбином рассасывающейся желатиновой губкой и ушивают разрез на шее подкожными швами викрилом 4-0.
23. Снимают швы, удерживающие катетер позади ушной раковины.
24. Наносят мазь с повидон-йодом на разрез и накладывают повязку полупроницаемым прозрачным материалом.
Осложнения удаления катетера:
1. Разрыв сосуда, для устранения которого может потребоваться стернотомия.
2. Избыточная кровопотеря.
3. Венозная воздушная эмболия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Роль экстракорпоральной мембранной оксигенации в современной медицине и перспективы ее применения в органном донорстве
Неуклонно возрастает число больных, нуждающихся в трансплантации почки. Потребность в донорских органах остается высокой. В настоящей работе проанализированы теоретические аспекты, а также клиническая эффективность применения экстракорпоральной мембранной оксигенации в программе трансплантации почки при кондиционировании асистолических доноров.
Экстракорпоральная мембранная оксигенация (ЭКМО) – современная форма органозаместительных технологий. В основе метода лежит оксигенация венозной крови с одновременным удалением из нее углекислоты вне тела пациента (экстракорпорально), а затем ее возврат в кровоток [1].
Метод ЭКМО стали использовать в 1970 г. в качестве сердечно-легочной поддержки для лечения тяжелой формы дыхательной недостаточности. Первоначально применение метода было основано на заборе крови из артерии пациента с ее последующим возвратом в венозное русло (веноартериальный метод ЭКМО). Лечение при помощи ЭКМО начиналось на поздних стадиях заболевания в связи с неизученностью на тот момент возможных осложнений применения методики. Первые результаты ЭКМО были опубликованы в 1979 г. W. Zapol и соавт. [2]. Коллектив авторов пришел к выводу, что применение методики возможно при сердечно-легочной недостаточности в период дисфункции органов не более 5 дней. В связи с этим метод был рекомендован для лечения новорожденных с острым респираторным дисстресс-синдромом и персистирующей легочной гипертензией, сепсисом [3].
С 1980-х гг. частота применения ЭКМО для лечения дыхательной недостаточности новорожденных увеличилась.
В результате ЭКМО была признана стандартной процедурой для лечения дыхательной недостаточности у детей.
В 1994 г. A.H. Morris и соавт. [4] в своем исследовании обосновали положительный эффект применения ЭКМО для лечения респираторного дисстресс-синдрома у взрослых.
В других работах [5, 6] авторами выявлено снижение уровня летальности, а также отдаленный положительный эффект лечения дыхательной недостаточности с применением ЭКМО.
Постепенно ЭКМО из процедуры «последней надежды» стала стандартным методом лечения с четкими показаниями и противопоказаниями; в результате совершенствования аппаратуры появилась возможность для проведения процедуры в различных клинических ситуациях. Во многих странах мира в медицинской практике наряду с термином ЭКМО используется аббревиатура ECLS (extracorporeal life support – экстракорпоральное жизнеподдержание). Транспортировка реанимационных больных, находящихся в критическом состоянии, с применением ЭКМО стала обычным явлением. Возросла частота совместного использования ЭКМО и других экстракорпоральных методик проведения интенсивной терапии с применением одного контура (гипотермия, гемодиализ, плазмаферез) [7]. В настоящее время существует масса вариантов процедуры ЭКМО, что расширяет спектр показаний к ее выполнению.
Главный эффект от проведения ЭКМО – повышение доставки кислорода к органам и тканям и удаление углекислого газа. В зависимости от конкретной клинической ситуации врач может самостоятельно регулировать скорость потока в контуре для достижения адекватного газообмена, контролируя сатурацию крови [3, 8].
Некоторые медицинские центры рекомендуют поддерживать сатурацию крови у взрослых пациентов на уровне 80%, в то время как в других учреждениях рекомендованный уровень составляет 90%. Различия в значениях показателей обусловлены размером катетеров и стратегией канюляции центральных сосудов. Так, например, для лечения дыхательной недостаточности обычно используют вено-венозный метод канюляции. При этом уровень потребности кислорода пропорционален сердечному выбросу, осуществляемому через экстракорпоральный контур. Веноартериальный метод ЭКМО применяется в случаях, когда при замещении респираторной функции требуется использование циркуляторной поддержки.
Для проведения канюляции необходимым условием служит расположение катетера в крупном сосуде или полости сердца, что повышает риск развития осложнений. Осложнения экстракорпоральной мембранной оксигенации включают гемолиз, кровотечения, тромбоэмболию, осложнения сосудистого доступа, а также инфекционные осложнения [3]. Неисправности оборудования ЭКМО встречаются крайне редко и имеют только историческое значение [9].
В генезе некоторых осложнений играет роль тип привода насоса. При применении роликового насоса в системе возможно образование сгустков, а при использовании насосов центрифужного типа – развитие гемолиза [10]. Стандартная линия для проведения ЭКМО состоит из катетеров для сосудистого доступа, роликового или центрифужного насоса, оксигенатора, системы поддержания температуры. Особенности контроля давления в системе зависят от типа привода. При использовании центрифужного насоса обычно измеряют давление входа и давление возврата. А при применении роликового насоса давление измеряется до и после прохождения оксигенатора.
Обязательным условием предотвращения тромбообразования в системе контура служит использование коагулянтов во время про.
Способ канюляции бедренной вены для проведения вено-артериальной экстракорпоральной мембранной оксигенации
Изобретение относится к медицине, а именно к реаниматологии и экстракорпоральному кровообращению. При канюляции бедренной вены для проведения вено-артериальной экстракорпоральной мембранной оксигенации (ВА ЭКМО) под ультразвуковым и/или рентгенологическим контролем выполняют чрескожную пункцию бедренной вены в бедренном треугольнике. Затем выполняют катетеризацию бедренной вены однопросветным катетером с наружным диаметром 16G. Далее через установленный катетер вводят проводник для установки канюли. По проводнику последовательно вводят дилататоры, расширяя канал в подкожной жировой клетчатке и пункционное отверстие в сосудистой стенке. Сначала вводят сосудистые дилататоры с наружным диаметром 12-18F, а затем дилататор в форме усеченного конуса («конусный» дилататор), имеющий прямолинейную и дугообразную части, при этом дугообразная часть имеет радиус кривизны 45-55 мм, длину 110-120 мм, и расположена со стороны заостренного конца дилататора. Наружный диаметр «конусного» дилататора в области соединения прямолинейной и дугообразной частей составляет 12-14 мм, а в области заостренного конца 3-5 мм. Введение «конусного» дилататора осуществляют в антеградном направлении. Его располагают так, чтобы при прохождении под пупартовой связкой вогнутая сторона дугообразной части была отвернута от поверхности кожи. После удаления «конусного» дилататора по проводнику устанавливают в просвет бедренной вены в антеградном направлении канюлю с наружным диаметром 23-25F и присоединяют ее к венозной магистрали ВА ЭКМО. Способ позволяет снизить травматичность, упростить и повысить надежность канюляции бедренной вены для проведения ВА ЭКМО. 1 ил., 1 пр.
1. Способ канюляции бедренной вены для проведениия вено-артериальной экстракорпоральной мембранной оксигенации (ВА ЭКМО), характеризующийся тем, что под ультразвуковым и/или рентгенологическим контролем выполняют чрескожную пункцию бедренной вены в бедренном треугольнике; затем выполняют катетеризацию бедренной вены однопросветным катетером с наружным диаметром 16G, далее через установленный катетер вводят проводник для установки канюли, по этому проводнику последовательно вводят дилататоры, расширяя канал в подкожной жировой клетчатке и пункционное отверстие в сосудистой стенке, причем сначала вводят сосудистые дилататоры с наружным диаметром 12-18F, а затем дилататор в форме усеченного конуса («конусный» дилататор), имеющий прямолинейную и дугообразную части, при этом дугообразная часть имеет радиус кривизны 45-55 мм, длину 110-120 мм, и расположена со стороны заостренного конца дилататора, наружный диаметр которого в области соединения прямолинейной и дугообразной частей составляет 12-14 мм, а в области заостренного конца 3-5 мм; введение «конусного» дилататора осуществляют в антеградном направлении, причем его располагают так, чтобы при прохождении под паховой связкой вогнутая сторона дугообразной части была отвернута от поверхности кожи; после удаления «конусного» дилататора по проводнику устанавливают в просвет бедренной вены в антеградном направлении канюлю с наружным диаметром 23-25F и присоединяют ее к венозной магистрали ВА ЭКМО.
2. Способ по п. 1, отличающийся тем, что наружный диаметр «конусного» дилататора у нерабочего торца составляет 14-16 мм.
4. Способ по п. 1, отличающийся тем, что при длине дугообразной части 120 мм, наружном диаметре 4 мм в области заостренного конца и 12 мм в области соединения дугообразной и прямолинейной частей последний уменьшается на 2 мм каждые 30 мм длины дугообразной части.
Изобретение относится к медицине, а именно к реаниматологии и экстракорпоральному кровообращению. Способ может быть использован в специализированных отделениях реанимации и интенсивной терапии, занимающихся вспомогательным кровообращением при проведении вено-артериальной экстракорпоральной мембранной оксигенации (ВА ЭКМО).
ВА ЭКМО является методом экстракорпоральной поддержки кровообращения и применяется для коррекции грубых нарушений насосной функции сердца при наличии или отсутствии сопутствующих расстройств газообменной функции легких. С целью экстракорпоральной поддержки кровообращения чаще применяется периферическая ВА ЭКМО, основанная на заборе и возврате крови через канюли, установленные в периферические сосуды. При этом наиболее часто используется канюляция бедренных сосудов.
Известен следующий способ для канюляции бедренной вены, включающий следующие этапы: пункцию v. femoralis; проведение металлического проводника-направителя, расширение подкожного канала и пункционного отверстия в сосудистой стенке с помощью расширителей; проведение периферической канюли, надетой на пластиковый стилет, по металлическому проводнику-направителю; удаление стилета и проводника с одновременным пережатием канюли магистральными зажимами; деаэрацию канюли; присоединение канюли к соответствующей магистрали контура ВА ЭКМО [Napp L.С.,Пункция бедренной вены в бедренном треугольнике не составляет технических трудностей, т.к. в верхней трети бедра v. femoralis расположена поверхностно - в подвздошно-гребешковой ямке (fossa ileopectinea), под поверхностным листком широкой фасции (fascia lata). Однако последующее проведение венозной канюли через сосудистую лакуну (lacuna vasorum) может быть затруднено вследствие ригидности ограничивающих ее связок. Сосудистая лакуна (lacuna vasorum), в которой проходит бедренная вена, - ограничена: спереди - паховой (пупартовой) связкой, сзади - lig. pectineale (старое название lig. pubicum Cooperi), снаружи - подвздошно-гребенной дугой, а изнутри - lig. lacunare. Сосудистая лакуна имеет треугольную форму, в ней находятся бедренная артерия и вена, n. genitofemoralis, лимфатический узел и клетчатка.
Неудачные попытки канюляции бедренной вены приводят к образованию гематомы, разрыву бедренной вены, формированию ложного хода с возможным ранением бедренной артерии.
Техническая проблема заключается в обеспечении адекватного, атравматичного доступа к бедренной вене при ее канюляции для проведения периферической ВА ЭКМО.
Технический результат заключается в снижении травматичности, упрощении, техническом удобстве и повышении надежности канюляции бедренной вены для проведения ВА ЭКМО за счет создания адекватного доступа к бедренной вене в области сосудистой лакуны бедра, упрощения проведения канюли в этой области путем дополнительного расширения канала в подкожной жировой клетчатке и пункционного отверстия при помощи оригинального «конусного» дилататора, обеспечения соответствия формы дилататора естественному (анатомическому) ходу бедренной вены в сосудистой лакуне.
Сущность изобретения заключается в следующем.
При канюляции бедренной вены для проведения ВА ЭКМО под ультразвуковым и/или рентгенологическим контролем выполняют чрескожную пункцию бедренной вены в бедренном треугольнике. Затем выполняют катетеризацию бедренной вены однопросветным катетером с наружным диаметром 16G. Далее через установленный катетер вводят проводник для установки канюли. По проводнику последовательно вводят дилататоры, расширяя канал в подкожной жировой клетчатке и пункционное отверстие в сосудистой стенке. Сначала вводят сосудистые дилататоры с наружным диаметром 12-18F, а затем дилататор в форме усеченного конуса («конусный» дилататор), имеющий прямолинейную и дугообразную части, при этом дугообразная часть имеет радиус кривизны 45-55 мм, длину 110-120 мм, и расположена со стороны заостренного конца дилататора. Наружный диаметр «конусного» дилататора в области соединения прямолинейной и дугообразной частей составляет 12-14 мм, а в области заостренного конца 3-5 мм. Введение «конусного» дилататора осуществляют в антеградном направлении. Его располагают так, чтобы при прохождении под пупартовой связкой вогнутая сторона дугообразной части была отвернута от поверхности кожи. После удаления «конусного» дилататора по проводнику устанавливают в просвет бедренной вены в антеградном направлении канюлю с наружным диаметром 23-25F и присоединяют ее к венозной магистрали ВА ЭКМО.
В частном случае наружный диаметр «конусного» дилататора у нерабочего торца составляет 14-16 мм, а длина прямолинейной части составляет 85-95 мм.
Одним из вариантов предлагаемого «конического» дилататора является дилататор с длиной дугообразной части 120 мм, наружным диаметром 4 мм в области заостренного конца и 12 мм в области соединения дугообразной части с прямолинейной частью, который уменьшается на 2 мм каждые 30 мм длины дугообразной части.
Таким образом, нам удалось обеспечить надежное прохождение канюли для ВА ЭКМО под паховой связкой, исключив ее сдавление ригидными связками сосудистой лакуны бедра за счет использования оригинального «конусного» дилататора с дугообразным отделом, соответствующим ходу бедренной вены под паховой связкой и в области сосудистой лакуны.
Способ осуществляется следующим образом.
Может быть использован набор для катетеризации магистрального сосуда, включающий: проводник (диаметр 0,81 мм, длина 60 см); однопросветный катетер 16G (длина 20 см); пункционный набор для ЭКМО (MEDOS Insertion kit for medos® venous femoral cannula).
При канюляции бедренной вены для проведении ВА ЭКМО под ультразвуковым и/или флюороскопическим контролем выполняют чрезкожную пункцию бедренной вены.
Бедренную вену находят ниже паховой связки посредством пальпации в центре воображаемого отрезка между верхней передней подвздошной остью и лонным сочленением. Вена расположена параллельно и медиальнее артерии. Пункцию проводят в асептических условиях под местной анестезией. Вводят иглу в бедренный треугольник ниже паховой складки (на 1-2 поперечных пальца ниже пупартовой связки). Вена расположена на 1-2 см медиальнее пальпируемой артерии.
Затем устанавливают в просвет вены однопросветный сосудистый катетер 16G. Через однопросветный катетер вводят проводник-направитель в антеградном направлении.
Затем по проводнику производят последовательную дилатацию подкожного канала и пункционного отверстия в сосудистой стенке при помощи набора стандартных дилататоров для ВА ЭКМО с наружными диаметрами: 12F, 14F, 18F.
После чего выполняют дополнительную дилатацию при помощи «конусного» дилататора, используя проводник, введенный в вену, с последующим введением венозной канюли для ЭКМО (23-25F). Общий вид «конусного» дилататора с направителем представлен на фигуре.
Используют дилататор в форме усеченного конуса - «конусный» дилататор, имеющий прямолинейную и дугообразную части, при этом дугообразная часть имеет радиус кривизны 45-55 мм, длину 110-120 мм и расположена со стороны заостренного конца дилататора. Наружный диаметр «конусного» дилататора в области соединения прямолинейной и дугообразной частей составляет 12-14 мм, а в области заостренного конца 3-5 мм.
Введение «конусного» дилататора осуществляют в антеградном направлении. Его располагают так, чтобы при прохождении под пупартовой связкой вогнутая сторона дугообразной части была отвернута от поверхности кожи. Дугообразную часть «конусного» дилататора проводят на 5-7 мм выше уровня пупартовой связки. После удаления «конусного» дилататора по проводнику устанавливают в просвет бедренной вены в антеградном направлении канюлю с наружным диаметром 23-25F и присоединяют ее к венозной магистрали ВА ЭКМО.
В качестве «конусного дилататора может быть использован, например, дилататор для чрезкожной пункционной трахеостомии из трахеостомического набора ULTRA PERC® Portex.
Для доказательств возможности реализации заявленного назначения и достижения указанного технического результата приводим следующие данные.
Пациент N, диагнозом: Застойная сердечная недостаточность. Дилатационная кардиомиопатия. Относительная недостаточность МК и ТК. Двусторонний гидроторакс ХСН НК 2Б. ФК 3
В связи с декомпенсацией по основному заболеванию (бивентрикулярной сердечной недостаточностью, почечной недостаточностью, анасаркой) было принято решение о постановке системы ВА ЭКМО.
Постановка ВА ЭКМО выполнена в операционной, в условиях многокомпонентной общей анестезии.
Для индукции анестезии использовали: пропофол 0,9±0,2 мг/кг, фентанил 2,8±0,9 мкг/кг, рокурония бромид 1,1±0,1 мг/кг. Во время операции поддержание анестезии осуществляли пропофолом (целевая концентрация 1,5±0,3 мкг/мл), фентанилом. В качестве кардиотонической терапии использовали: допамин 4,3±2,5 мкг/кг/мин, добутамин 4,4±1,9 мкг/кг/мин.
Ведение анестезиологических и кардиотонических препаратов проводили автоматическими дозаторами Perfusor Compacts (BBraun, Германия) с помощью анестезиологической станции FM Contoller (BBraun, Германия).
Искусственную вентиляцию легких (ИВЛ) проводили аппаратом Kion (SiemensElema АВ, Швеция) с FiO2 от 0,4-0,9 до 8,5±0,3 мл/кг и уровнем положительного давления конца выдоха (ПДКВ) 3-5 см вод. ст.
Для мониторинга гемодинамики использовали модульную мониторную систему Agilent М1167А (Phillips). Регистрировали: АД ср. - среднее артериальное давление (мм рт.ст.); ЧСС - частоту сердечных сокращений (уд./мин); ДПП - давление правого предсердия (мм рт.ст.); СДЛА - систолическое давление легочной артерии (мм рт.ст.); ДЛА ср. - среднее давление легочной артерии (мм рт.ст.); ДДЛА - диастолическое давление легочной артерии (мм рт.ст.); ЗДЛА - заклинивающее давление легочной артерии (мм рт.ст.). Сердечный выброс (СВ, л/мин) определяли методом непрерывной термодилюции и непрерывную термодилюционную волюмметрию правого желудочка проводили с помощью мониторов Explorer (Baxter Healthcare Corporation, США), Vigilance CEDV, Vigilance II (Edwards Lifeciences LLC, США), применяли волюметрические катетеры Swan-Ganz EJECTION FRACTION Cath (93A-435H-7.5F) (Edward Swan-Ganz ® REF Volumetric TD Catheter, Baxter Healthcare Corporation, США). Для транспищеводного ЭХОКГ исследования использовали аппарат Sonos 7500 (Phillips, США).
После обработки операционного поля 5% раствором йодоната, выполнили катетеризацию бедренной вены однопросветным сосудистым катетером 16G. Через катетер ввели проводник-направитель в антеградном направлении. Затем выполнили последовательную дилатацию пункционного отверстия и дополнительную дилатацию при помощи «конусного» дилататора с последующим введением венозной канюли для ВА ЭКМО (25F) в соответствии с предлагаемым способом. Удалили стилет и проводник с одновременным пережатием канюли магистральными зажимами; присоединили канюлю к соответствующей магистрали контура ВА ЭКМО. Осложнений, технических сложностей при проведении канюляции бедренной вены не отмечали.
Предложенный способ был использован у 5 пациентов при проведении ВА ЭКМО, которым впоследствии выполнена успешная трансплантация сердца. Осложнений при проведении канюляции бедренной вены не было. Все пациенты выжили.
Читайте также:
