Устройство слухового стволового импланта
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Этапы и техника слуховой стволовой имплантации
а) Анатомические особенности слуховой стволовой имплантации. Мишенями для установки электродной решетки ABI являются дорсальные и вентральные улитковые ядра. Хотя ядра прикрыты ножками мозжечка, поверхностные ориентиры являются полезными для идентификации этой области. Часто, однако, эти структуры могут быть нарушены опухолью.
На рисунке ниже показаны основные структуры понтомедуллярного соединения и вид операционного поля при транслабиринтном доступе. Важные ориентиры включают рукавообразное окончание латерального кармана, формирующего отверстие Лушки, снизу корешок языкоглоточного (IX) черепно-мозгового нерва, и кверху от отверстия — корешки преддверно-улиткового и лицевого нервов.
Обычно интактное сосудистое сплетение указывает на вход в латеральный карман (отверстие Лушки), а сосудистая полоска косо пересекает корень бокового кармана, указывая на поверхность вентрального улиткового ядра. Эти структуры могут четко не идентифицироваться, если большая опухоль нарушает латеральную поверхность моста и мозга. В таких случаях можно проследить остаток восьмого черепно-мозгового нерва до входа в боковой карман. Девятый черепно-мозговой нерв также может использоваться как ориентир бокового кармана.
Впадину, которая иногда видна между восьмым и девятым черепно-мозговым нервом, не следует путать с входом в латеральный карман.
В самом кармане и на верхнем крае обнаруживаются дорсальные и вентральные кохлеарные ядра. Электродную решетку устанавливают в карман для обеспечения позиционной стабильности. Электрическая стимуляция вентральных ядер, основных переключателей импульсов восьмой пары черепно-мозговых нервов и большей части восходящих слуховых путей, возможно, является основным источником слуховых ощущений, даже учитывая, что некоторая часть решетки также располагается рядом с дорсальными улитковыми ядрами.
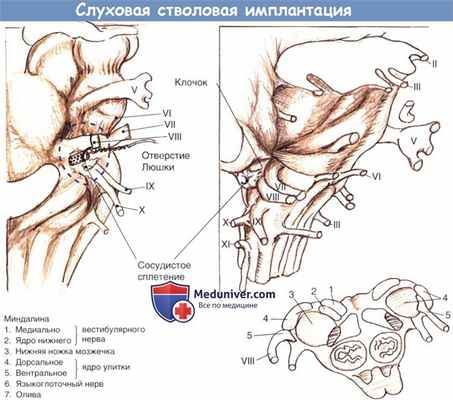
Схема области кохлеарных ядер, показывающая взаиморасположение разных ориентиров.
Отмеченная пунктиром область приблизительно соответствует операционному обзору.
Электродная решетка полностью установлена в правильное положение.
б) Хирургические особенности слуховой стволовой имплантации. Транслабиринтная краниотомия обеспечивает лучший доступ для удаления опухолей и обзора латерального кармана четвертого желудочка. Выполняется удаление акустической опухоли транслабиринтным доступом по обычной методике, за исключением дополнительной установки записывающих электродов для вызванных электричеством слуховых потенциалов ствола мозга (EABR) и любой активности VII и IX черепно-мозговых нервов. Также, как правило, используется обычный заушный разрез, а устройство размещают в кармане в височной области.
Профилактически во время индукции наркоза внутривенно вводят антибиотик, например, 3 г цефуроксима (Zinacef®, GalaxoSmithKline). Мониторинг EABR позволяет подтвердить, что электродная решетка установлена в правильное положение. Может потребоваться небольшая настройка решетки, чтобы минимизировать ответы, вызванные активацией неслуховых нервных структур. Для мониторинга EABR подкожные игольчатые электроды вводятся в область макушки, над седьмым шейным позвонком, а также на уровне роста волос на затылке.
Для электромиографической записи неслуховой активации проводится мониторинг лицевого нерва по обычной методике, а в мышцы глотки (мягкого неба) той же стороны устанавливают биполярные электроды для мониторинга активности IX черепно-мозгового нерва.
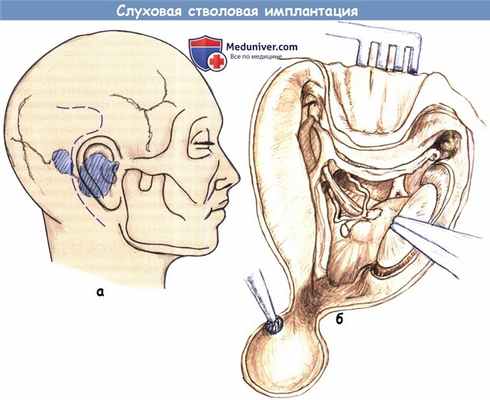
а - Расположение разреза по отношению к планируемому месту ресивера/стимулятора.
Продолжение кверху может не выполняться, а имплантат располагаться в подкожном кармане.
б - Схема операционного поля после выполненной транслабиринтной краниотомии,
высверлены ложе для ресивера/стимулятора и борозды для его проводов.
в) Техника слуховой стволовой имплантации. Удаление опухоли проводится обычным способом посредством транслабиринтной краниотомии. После полного удаления опухоли и адекватного гемостаза определяют место для размещения внутреннего ресивера кзади и кверху от мастоидальной полости, височную мышцу в этой области отделяют от теменной части и иссекают. Используя копию ресивера/стимулятора в качестве шаблона, округлую часть кортикальной кости в этой области уплощают режущими борами, и формируется проход для размещения проводов между ложем имплантата и мастоидальной полостью. На другой стороне ресивера/стимулятора наносят туннелирующие отверстия для швов, который после этого фиксируется нейлоновыми швами.
Эти действия проводятся перед размещением электродной решетки, поэтому манипуляции с проводами не влияют на положение электродов. Как только внутренний ресивер имплантирован, для гемостаза может применяться только биполярная коагуляция, поскольку прохождение тока через имплантат к стволу мозга при монополярной коагуляции представляет потенциальную опасность.
Положение латерального кармана может быть подтверждено истечением спинномозговой жидкости (СМЖ), когда анестезиолог проводит продувание среднего уха по методу Вальсальвы. Эту технику следует оставлять для последней проверки после локализации входа в латеральный карман по обычным ориентирам, поскольку СМЖ быстро дренируется и преимущества этой техники при многократном выполнении пробы Вальсальвы теряются.
После идентификации отверстия Лушки электродная решетка, надетая на иглу Rosen вводится в латеральный карман электродами кверху. С опытом мы обнаружили, что имплантат функционирует лучше, а неслуховые побочные эффекты менее выражены, если электроды полностью установлены в латеральный карман. После установки выбранные электроды в решетке активируют, чтобы определить их позицию относительно улитковых ядер.
Электродная решетка фиксируется при помощи небольшого куска тефлонового материала, которым тампонируют вход в латеральный карман. Впоследствии врастающая соединительная ткань окончательно стабилизирует решетку в ее положении. Провода электродов располагают в мастоидальной полости и костном ложе. Затем слуховую трубу и среднее ухо тампонируют оксицелюллозой (Surgicel®) и мышцей. Для облитерации дефекта в мастоидальной полости используют внутрибрюшной жир.
В это время магнит в ресивере/стимуляторе удаляют, для обеспечения возможности проведения МРТ. Поскольку магнит в ресивере/стимуляторе во время имплантации обычно отсутствует, определение положения ресивера/стимулятора во время начальной стимуляции может быть проблематичным. Неправильное расположение катушки наружного трансмиттера в подобных случаях может приводить к ложному впечатлению об отказе устройства или невозможности стимуляции. Теперь мы всегда отмечаем татуировкой центр позиции круглой антенны ресивера/стимулятора во время операции для облегчения последующего поиска. Разрез закрывают послойно без установки дренажей.
в - Схема установленного ресивера/стимулятора.
г - Схема электродной решетки слухового стволомозгового имплантата, введенной в латеральный карман. Схематическое изображение имплантата, проводов электродов и жира,
расположенных на своих местах, перед закрытием кожи.
г) Послеоперационное ведение. Послеоперационное ведение после слуховой стволомозговой имплантации сходно с ведением после обычных краниотомий при удалении акустических неврином. Большая мастоидальная повязка оставляется на три дня. Тщательное внимание к любому промоканию повязки обеспечивает быструю идентификацию истечения СМЖ из заушной раны. Устройство обычно активируют первый раз через 4-8 недель после имплантации. Это обеспечивает отсутствие отека кожного лоскута, покрывающего ресивер/стимулятор, который мог бы помешать адекватному достижению сигналом имплантата. При непосредственном использовании пациенты после имплантации должны брить эту область и накладывать тонкую полоску и металлический диск («удерживающий» диск), на котором держится магнитная катушка трансмиттера.
Пациент или помощник должен уметь контролировать правильное и устойчивое положение катушки трансмиттера над ресивером/стимулятором имплантата. Во многих случаях жалобы на плохой сигнал или снижение качества звука оказываются связанными с неправильным положением удерживающего диска.
д) Послеоперационные осложнения слуховой стволовой имплантации. Наиболее значимым осложнением в раннем послеоперационном периоде является истечение СМЖ. В противоположность обычным транслабиринтным операциям, при которых жидкость обычно истекает носовым путем через слуховую трубу, электрод ABI и провода создают путь, по которому СМЖ может проходить под кожным лоскутом. Мы отметили, что частота истечения СМЖ значительно снизилась после перехода на полностью имплантируемые ресиверы от чрезкожных коннекторов, использовавшихся в одноканальных ABI. Предотвращение истечения начинается с тщательного сближения краев твердой мозговой оболочки.
Хотя отверстие в твердой мозговой оболочке не может быть закрыто герметично, его края должны быть сближены насколько это возможно, а для закрытия остаточного дефекта в твердой мозговой оболочке используются полоски абдоминального жира.
Для заполнения слуховой трубы и среднего уха обычно применяются Surgicel® и мышца, а для тампонады мастоидальной полости — аутогенный жир. Поверх жира, для удержания его на месте, располагают титановую сетку. Наконец, многослойное закрытие раны уменьшает риск истечения СМЖ через разрез.
Это более безопасный путь лечения истечения СМЖ, чем хирургическая ревизия и повторная тампонада раны. Менингит может возникать как спонтанно, так и вследствие послеоперационного истечения СМЖ. Это редкое осложнение при быстром выявлении отвечает на антибиотикотерапию и прекращение истечения СМЖ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
«Проект: Аудиология» - сборник научно-практических материалов для профессионалов в области аудиологии и слухопротезирования, включающий материалы конференций, статьи по кохлеарной имплантации, отоневрологии и законодательные акты по сурдологии.

Слуховой стволомозговой имплантант (ABI, auditory brainstem implant) представляет собой модифицированный кохлеарный имплант, и предназначен для электрической стимуляции кохлеарных ядер ствола мозга пациента.
ABI был разработан специально для пациентов с заболеванием, известным как нейрофиброматоз II типа (НФ-2). НФ-2 характеризуется наличием двусторонних вестибулярных шванном. Сама опухоль или хирургическое удаление опухоли часто приводит к значительному поражению слухового нерва, поэтому кохлеарная имплантация не является методом выбора для этих пациентов. После удаления опухоли электродный массив ABI вводится в латеральный карман четвёртого желудочка и размещается на поверхности вентрального и дорсального кохлеарных ядер. Стимулируя слуховые нервные структуры в пределах кохлеарного ядра, ABI передаёт важную информацию о частоте, амплитуде и временных характеристиках звуков.
Дизайн и функционирование ABI подобны многоканальному кохлеарному импланту, за исключением различий в дизайне стимулирующего электродного массива 5. Программирование устройства ABI отличается от программирования кохлеарного импланта по некоторым важным аспектам.
В статье внимание сфокусировано на многоканальной высокочастотной системе ABI производства MED-EL.
Техническое описание системы C40+ ABI
Система состоит из многоканальной имплантируемой части и речевого процессора.
Имплантируемые части системы C40+ ABI включают в себя ABI-стимулятор (приёмник/передатчик), активный электродный массив и референтный электрод.

Стимулятор
Приблизительные размеры стимулятора С40+ 3,5 х 2,4 см, толщина менее 0,4 мм. Все электронные компоненты помещены в твёрдый и компактный керамический корпус (Рисунок 1), в котором герметично запаяны электронная схема и мощный микрочип. Корпус импланта и электроника ABI аналогична тем, которые используются в кохлеарном импланте С40+.
Рисунок 1. Слуховой стволомозговой имплант.
Активный электродный массив ABI.
От стимулятора отходит активный электродный массив, который состоит из 12 активных платиновых контактов, запаянных в овальную силиконовую капсулу-пластинку в форме весла с размерами (5,5 х 3,0 х 0,6) мм (Рисунок 2, середина). На обратной стороне силиконовой капсулы имеется сеточка из дакрона (синтетическая нерассасывающаяся нить), которая облегчает фиксацию электродного массива.
Рисунок 2. Электроды слухового стволомозгового импланта (MED-EL, Combi 40+R). (Верх): Четырёхканальный тест-электрод для локализации кохлеарного ядра. (Середина): Двенадцатиканальный активный электрод, который будет имплантирован.

Электродный массив преформирован идущими поперёк платиновыми проводками. Это позволяет так сформировать этот элемент, чтобы он подходил к контуру (поверхности) кохлеарного ядра (Рисунок 3).
Рисунок 3. Активный электродный массив слухового стволомозгового импланта.
Референтный электрод
Референтный электрод в форме листа клевера идентичен тому, который используется в кохлеарном импланте C40+ (Рисунок 2, низ).
Внешними компонентами ABI производства MED-EL являются заушный речевой процессор TEMPO+ (Рисунок 4) или карманный речевой процессор CIS PRO+.
Рисунок 4. Полностью заушный речевой процессор TEMPO+.
Речевой процессор разработан для того, чтобы кодировать акустические сигналы окружающей среды, которые собираются микрофоном. Акустический сигнал преобразовывается в электрический сигнал и превращается в паттерн электрических импульсов в соответствии с используемой стратегией кодирования речи. От речевого процессора закодированные электрические импульсы передаются через передающую катушку, через интактную (неповреждённую) кожу к импланту. Электроника декодирует сигналы, полученные внутренней вторичной катушкой. Эти сигналы передаются затем активному электродному массиву, и кохлеарное ядро стимулируется.
В ABI MED-EL используется стратегия обработки речи CIS (continuous interleaved sampling, стратегия высокочастотной непрерывной выборки), разработанная в 90-х годах XX столетия Вильсоном (Wilson) с партнёрами. С этим устройством возможна высокочастотная симуляция с максимумом в 18180 имп./с. Максимальная частота стимуляции на канал составляет 515/с при 12 активных электродах. Режим стимуляции является монополярным, против референтного электрода, который помещается под височную фасцию.
Показания, отбор кандидатов для ABIs
Когда стволомозговая имплантация только начиналась, ABIs использовались почти исключительно только у пациентов с нейрофиброматозом II типа, которые потеряли слух до или во время удаления двусторонней вестибулярной шванномы. Позже показания в Европе для ABI стали включать аплазию кохлеарного нерва (в том числе и вследствие атрезии внутреннего слухового прохода) и выраженную мальформацию улитки у детей, а также полную оссификацию улитки или разрыв кохлеарного нерва из-за травмы у взрослых 9.
При отборе должна учитываться индивидуальная мотивация пациента для повторных послеоперационных процедур настройки и его/её готовность к ежедневным занятиям с устройством. Пациенты должны быть полностью информированы о возможных результатах чтобы избежать любого разочарования, которое может отразиться на их общей мотивации или готовности к сотрудничеству. Кандидаты должны иметь нормальный уровень интеллектуального развития. Проявления основной болезни не должны помешать процессу настройки или реабилитации. По мнению некоторых авторов, НФ-2 типа Wischard, при котором есть выраженные признаки и симптомы и уменьшенная продолжительность жизни, не должен считаться противопоказанием. За и против имплантации при этом подтипе НФ-2 должны взвешиваться у каждого конкретного пациента. Если пациент в физическом и психическом плане способен и согласен пройти все необходимые послеоперационные процедуры настройки и реабилитации и имеет хорошую поддержку со стороны семьи, нет никакой причины отказывать ему/ей в шансе улучшить слух. [10].
Периост и фасция височной мышцы рядом с ним отводятся кпереди чтобы сформировать второй слой, который прикроет имплант. Кость вскрывается в ретромастоидальной области и обнажается твёрдая мозговая оболочка за сигмовидным и ниже поперечного синусов. Полушария мозжечка отводятся после дренирования цереброспинальной жидкости (ЦСЖ) при вскрытии базальных цистерн. Арахноидальная оболочка, покрывающая опухоль, вскрывается, на опухоль накладывается зажим и она постепенно удаляется. В зависимости от размера опухоли и интраоперационных находок, внутренний слуховой проход рассверливается до, во время или после удаления экстрамеатальной порции опухоли. После полного удаления опухоли каудальные черепно-мозговые нервы выделяются из арахноидальной оболочки. Открываются флоккулюс мозжечка и хориоидное сплетение бокового кармана четвертого желудочка. Доступ к отверстию Люшка (Luschka) облегчается поворотом головы в сторону опухоли. В отверстие Люшка вводится четырёхполярный стимулирующий тест-электрод (Рисунок 2, верх) и размещается в латеральном кармане четвёртого желудочка, на поверхности кохлеарного ядра. Главная цель – вентральное кохлеарное ядро.
Расположение тест-электрода ABI выполняется в соответствии с анатомическими ориентирами, которые доступны обзору хирурга. Анатомические ориентиры, использующиеся для размещения импланта, включают корешок VIII нерва, языкоглоточный нерв, лицевой нерв и хориоидальное сплетение, а также вход в латеральный карман (латеральная апертура, отверстие Люшка (Luschka)), где все эти структуры сходятся (Рисунки 6-8). При операции, когда практически всегда ствол мозга искажён опухолью, отверстие Люшка расположено выше IX нерва. IX нерв обычно находится в фиксированном анатомическом положении, приводящем практически всегда в отверстие Люшка. Кроме того, важна луковица яремной вены, потому что её расположение может очень сильно варьироваться.
Рисунок 6. Анатомия кохлеарных ядер: анатомический препарат (левая сторона) показывает внутренний слуховой канал (IAC), VIII и IX черепно-мозговые нервы, сходящиеся ко входу в латеральный карман (отверстие Люшка), где имеется сплетение (Т). Показана локализация вентрального (VCN) и дорсального (DCN) кохлеарных ядер. С = каудально; D = дорсально; R = рострально; V = вентрально.

Рисунок 7. На гистологическом препарате показаны область латерального кармана четвёртого желудочка (Ve), VII (VIIn), VIII (VIIIn), IX (IXn) черепно-мозговые нервы и взаимоотношения между вентральным кохлеарным ядром (VCN), дорсальным кохлеарным ядром (DCN), нижней ножкой мозжечка ICP) и вестибулярными ядрами (VN). Также показаны мозжечок (CE) и нижние оливы (IO). A = кпереди; Р = кзади.
Рисунок 8. Показана область имплантации на препарате. Электрод (Е) виден в латеральном кармане в области кохлеарного ядра; отверстие Люшка (Luschka) окружено (обрисовано) VIII (VIIIn) и IX (IXn) черепно-мозговыми нервами; ножки мозжечка (Се) ограничивают его сверху; хориоидальное сплетение (Ch) обычно выходит из бокового кармана. С = каудально; D = дорсально; R = рострально; V = вентрально.

В затылочно-теменной области выше поперечного синуса формируется костное ложе для приёмника-передатчика (стимулятора) – таким образом, чтобы приёмник/передатчик был погружён в кость по крайней мере на половину своей толщины, на ~ 2 мм. Внимательно следят за тем, чтобы не повредить внутренний кортикальный слой кости. Приёмник/передатчик фиксируется звёздчатым швом, позже он покрывается фасцией и периостом, после чего кожный лоскут укладывается на место и ушивается двумя слоями швов.
Затем тест-электрод в латеральном кармане ещё раз проверяется. Измерения EABR в каждом из вариантов режима биполярной стимуляции в пределах расположения четырёх электродов повторяют, пока результаты всех возможных биполярных комбинаций из четырёх контактов не покажут адекватные волны EABR. После этого тест-электрод удаляют и из стерильной упаковки извлекают 12-ти-канальный электродный массив ABI (Рисунок 2, середина, Рисунок 3) (активный электрод). Затем активный электродный массив размещают в соответствии с положением, намеченным регистрацией EABR при помощи тест-электрода. Перед тем как зафиксировать активный электрод, с него проводится окончательная запись EABR (Рисунок 10).
Рисунок 10. ABR: акустические ABR (а), электрические EABR у пользователя кохлеарным имплантом (b), электрические EABR у пациента с ABI (c)
Хотя КТ-сканирования достаточно для контроля за пациентами с ABI, большинство пациентов требуют проведения МРТ в связи с их основным заболеванием (НФ-2). Тайссл (Teissl) с сотрудниками, затем Хохмайр (Hochmair) (Университет Инсбрука, 2001) показали, что МРТ при 0,2 и 1,5 Т не оказывает никакого отрицательного влияния на импланты MED-EL [10, 16].
Доктора Уильям Хауз (William House) и Уильям Хитцельбергер (William Hitselberger) первыми использовали одноканальный имплант, получивший в дальнейшем название ABI, для электрической стимуляции кохлеарного ядра у пациента с НФ-2 в 1979 году 2. Перед имплантацией было доказано, что электрическая стимуляция кохлеарного ядра у людей могла приводить к слуховым ощущениям. Первое устройство ABI состояло из пары шаровидных электродов, которые помещались в толщу кохлеарного ядра. Управлял электродами модифицированный слуховой аппарат Bosch. Однако, эта пара электродов смещалась и вызывала неслуховые побочные эффекты. При операции-ревизии в 1981 году этому пациенту в латеральный карман четвёртого желудочка, на поверхность кохлеарного ядра, был имплантирован электродный массив в форме весла с двумя электродами. Вплоть до 1991 года использовался этот тип электродов и все созданные в последнее время электродные массивы использовали его как прототип и имплантируются также в латеральный карман. С тех пор устройство претерпело несколько модификаций – каналов стало больше (теперь доступны системы с от 8 до 21 каналов) 28, разработаны новые стратегии кодирования звукового сигнала, появляются новые варианты электродов, такие как пенетрирующий ABI. Главной движущей силой для усовершенствования был успех операций кохлеарной имплантации. Другими предпосылками стали развитие микрохирургической техники, интраоперационного мониторинга и нейроанестезии. Также произошли изменения и в отношении хирургов: они больше не удовлетворены просто удалением акустической невриномы, сейчас они хотят сохранить функцию. Первоначально это желание относилось к лицевому нерву, сейчас оно распространяется и на кохлеарный нерв [17].
ABI MED-El был разработан и произведён в ходе сотрудничества инженеров MED-EL Инсбрукского университета, Австрия, и Вюрцбургского университета, Германия на основе кохлеарного импланта Combi 40/40+ (компания MEDEL, Инсбрук, Австрия), который был оценён в европейском мультицентровом клиническом исследовании [18]. Не так давно MED-EL разработан ABI нового поколения – Pulsar i100 ABI.
Стволомозговой имплант фирмы Cochlea был разработан совместно компанией Cochlear, House Ear Institute (Лос-Анджелес, Калифорния, США) и Медицинским Исследовательским Институтом (Хантингтон, США). Авторами считаются Роберт Шеннон и Дералд Брекмен. 20 октября 2000 г. изделие было одобрено FDA (Управлением по контролю за продуктами и лекарствами США).
Исследования не стоят на месте. Ранние исследования электрической стимуляции нижних бугров четверохолмия у человека не обеспечивали ощущения звука [19]. Однако Коллетти (Colletti) и др. [20, 23] недавно имплантировал электроды в нижние бугры четверохолмия пациенту с двусторонним дефектом слухового нерва вследствие удаления вестибулярной шванномы, продемонстрировав, что электрическая стимуляция нижних бугров четверохолмия действительно может обеспечить восприятие звука и некоторую разборчивость речи.
В House Ear Institute (Лос-Анджелес, Калифорния, США) и Huntington Medical Research Institute (Пасадена, Калифорния, США) в сотрудничестве с производителем, Cochlear Corporation, с целью улучшения точности стимуляции слуховых нейронов ствола мозга разрабатывается и проходит испытания PABI (пенетрирующий ABI), состоящий из двух электродных массивов: 12-ти-электродного поверхностного массива и 10-ти-электродного массива с игольчатыми микроэлектродами, который размещается в толще вентральной порции кохлеарного ядра. Считается, что микростимуляция с игольчатыми электродами обеспечит активацию малых скоплений тонотопических групп нейронов в глубоких слоях с восприятием целого диапазона частот (высот звука) [21].
К настоящему времени в мире устройство ABI получили более 500 пациентов. Операции активно проводятся в институтах Европы, США, Ближнего Востока, Азии.
Возможные осложнения, побочные эффекты
Кроме осложнений, непосредственно связанных с имплантацией, а именно: хирургических повреждений нижележащих черепно-мозговых нервов, сосудистых повреждений или геморрагий в области ствола мозга, в литературе описано развитие на 7-20 день после операции псевдомембраноцеле. Поскольку важно расстояние между передающей катушкой и имплантированным передатчиком, это осложнение нужно лечить, даже если оно (лечение) не требовалось бы неимплантированным пациентам [10].
Описан случай развития у пациента гидроцефалии, которая потребовала вентрикулоперитонеального шунтирования через 2 месяца после первой операции [10]. У этого пациента была глиома в области brachium pontis мозжечка на контралатеральной от операции стороне и бессимптомная солидная и кистозная глиома нижних отделов ствола мозга, которые, возможно, нарушали циркуляцию цереброспинальной жидкости.
Несмотря на хорошие интраоперационные EABR, иногда только несколько слуховых электродов может функционировать после операции. Это может быть связано с движением (перемещением, смещением) электродного массива после операции или, в некоторых случаях, корешок VIII нерва, возможно, временно давал хорошие ответы EABRs в операционной, но после его атрофии ответы не регистрировались [15].
При подключении речевого процессора и первых его настройках крайне важно следить за жизненными показателями пациента; подключение и настройку следует делать в отделении интенсивной терапии или в присутствии анастезиолога-реаниматолога, т.к. в литературе описаны случаи стимулирования блуждающего нерва, что может привести к остановке сердца [15].
Как было показано в ходе психофизиологического тестирования во время первичной настройки ABI, более 90% пользователей слухового стволомозгового импланта испытывают какие-либо неслуховые побочные эффекты [22]. Они появляются после подключения речевого процессора и активации импланта. К ним относятся покалывание в горле, покалывание или подёргивание в туловище или в верхних и/или нижних конечностях, раздражение лицевого нерва, подёргивание глаз или рта, размытость (нечёткость) полей зрения, затруднения при глотании или боль. Неслуховые эффекты могут быть уменьшены или устранены путём регулирования программных параметров или выключением канала [14].
Восстановление слуха с использованием стволомозговых имплантов у пациентов с НФ-2 и другими состояниями, при которых нарушена целостность слухового нерва – это надёжная и многообещающая процедура для тех, кто иначе был бы полностью глухим.
Кохлеарная имплантация: особенности внутреннего уха
Кохлеарный имплант (внутреннее ухо) является результатом новейшей технологии и предназначен для лиц с нарушенным слухом. Он разработан с целью улучшения слуха и повышения коммуникативных способностей пациентов, у которых обычные слуховые аппараты либо улучшают слух незначительно, либо не улучшают вообще.
Что такое кохлеарный имплант
Кохлеарный имплант не является простым усиливающим устройством, подобным слуховому аппарату. Прибор состоит из речевого процессора, направленного микрофона/передатчика, приемника/стимулятора, многоканальной электродной системы, которая хирургически устанавливается в ухе. Кохлеарный имплант позволяет пациентам слышать широкое разнообразие звуков и лучше их дифференцировать.
Речевой процессор имеет тонкую настройку, индивидуально устанавливаемую в соответствии со слуховыми возможностями пациента. Он программируется специалистом при помощи компьютера. Каждый электрод четко настраивается на определенную частоту и громкость в соответствии со слуховыми ощущениями конкретного пациента. Результатом является оптимальный слух для каждого пациента. Если со временем возникают изменения слуха, речевой процессор может быть перенастроен в соответствии с запросом конкретного пациента.
Кому поможет кохлеарный имплант
- У кого отсутствует слух на оба уха.
- Кому не помогают слуховые аппараты.
- Кто ранее слышал.
- Кто не имеет другой серьезной патологии.
- Кто имеет поддержку членов семьи и друзей.
- Кто решил стать членом слышащего общества.
Принцип работы кохлеарного импланта
Многие люди имеют глухоту, обусловленную повреждением внутреннего уха. Однако у большинства из них сохранены волокна слухового нерва. Эти волокна способны посылать сигналы (звук) в мозг при стимуляции электрическим током.
Кохлеарный имплант осуществляет электрическую стимуляцию сохранившихся волокон слухового нерва, обеспечивая тем самым слуховые ощущения. Уровень слуха, который может ожидаться, варьирует от одного пациента к другому. Больные могут рассчитывать на лучшее понимание собеседника за счет комбинации повышенных слуховых возможностей и более быстрого и точного считывания с губ.
Преимущества кохлеарного импланта
- Восстановленный уровень слухового восприятия.
- Возможность определять наличие различных звуков.
- Улучшение в определении нормальных, ежедневно присутствующих окружающих звуков, таких как: стук в дверь, или дверной звонок, звуки мотора или гудка автомобиля, телефонные звонки, собачий лай и фоновая музыка.
- Повышенная способность к распознаванию речи с подкреплением считывания с губ.
- Около половины пациентов имеют значительное улучшение в распознавании речи без считывания с губ, а также способны общаться по телефону без применения специального кода.
Ограничения при применении кохлеарного импланта
Имплантация этого устройства может сопровождаться риском, связанным с хирургическим вмешательством, осуществляемым под общей анестезией, нарушением или повреждением лицевого нерва, ригидностью и потерей чувствительности в заушной области, а также заметным изменением ушного шума.
Результаты варьируются в каждом конкретном случае, поэтому важно иметь в виду, что слышимые звуки не будут такими же, как при нормальном слухе. Кроме того, возможны сложности при скоплении людей или при различении тонких звуков, подобных музыке. Слышать на больших расстояниях не представляется возможным.
Успех оперативного лечения зависит от правильного формирования речевых навыков и данных комплексного аудиологического исследования. Кохлеарная имплантация показана при двусторонней нейросенсорной тугоухости высокой степени и нарушении функции слуховых клеток, данных сурдопедагогического обследования.
В ГУТА КЛИНИК вы можете провести все обязательные для кохлеарной имплантации исследования слуха:
Все вышеперечисленные исследования вы можете провести в один день. Кохлеарная имплантация в Гута-Клиник не проводится.

Автор
Паукова Марина Владимировна , Сурдолог-оториноларинголог
Кохлеарные импланты Medel
Компания MED-EL уже более 30 лет является одним из мировых лидеров в области разработки слуховых имплантов.
Компания Медель стояла у истоков кохлеарной имплантации и первый имплант Medel был произведен в 1975 году. Выпускаемые компанией имплантируемые устройства позволяют компенсировать любую степень и форму потери слуха, когда слуховой аппарат неэффективен.
Удобные, простые в эксплуатации импланты MED-EL, разработаны на основе глубоких научных исследований и технологически передовых решений, направленных на улучшение функций слуха. Среди выпускаемых фирмой устройств - кохлеарные импланты, системы для акустической коррекции слуха, стволовые импланты и импланты среднего уха. С каждой новой разработкой улучшается качество слышимости звука и упрощается эксплуатация имплантов Медель. Компанией разработаны различные реабилитационные программы адаптации пациентов к слуховым имплантам, в том числе и специальные детские программы, помогающие малышам осваивать окружающий мир.
Среди новейших разработок компании MED-EL - результат многолетних научных исследований, кохлеарные импланты CONCERTO, PULSARCI100 и SONATATI100. Они основаны на новом технологическом достижении компании - электронной платформе I100, передающей звуковую информацию на слуховой нерв с максимальной точностью. Эта электронная платформа позволяет пациентам оценить преимущества наиболее эффективной и на сегодняшний день самой быстрой стратегии передачи звукового сигнала.
Высокая надежность и биосовместимость PULSARCI100 достигается благодаря керамическому корпусу, имеющему толщину 4 мм, а оснащенный титановым корпусом SONATATI100, является одним из самых миниатюрных слуховых имплантов. С кохлеарным имплантом Synchrony стала возможной и безопасной МРТ-диагностика.
Мощный и надежный кохлеарный имплант CONCERTO передает информацию к электродным контактам в улитке с большой точностью и высокой скоростью. Являясь самым маленьким и легким титановым имплантом в мире, CONCERTO рассчитан на продолжительный срок службы и разработан в строгом соответствии со стандартами безопасности.
Заушные речевые процессоры OPUS1 и OPUS2 - на современном рынке самые маленькие, тонкие и легкие, обеспечивающие комфорт и удобство в повседневной жизни. Их компактная модульная конструкция идеально подходит как взрослым, так и детям самого раннего возраста.
Интерфейсом между кохлеарным имплантом MED-EL и нервными волокнами внутреннего уха является электродная матрица. Мягкие и гибкие электродные матрицы MED-EL специально разработаны компанией для очень нежного ввода, чтобы чувствительные структуры улитки не были повреждены. Благодаря тройной технологи Triformans происходит стимуляция волосков по всей длине улитки при сохранении ее структуры, что позволяет пациентам с кохлеарными имплантами Медель слышать весь диапазон звуков.
Ученые работают над этим. Перспективные инновационные методы восстановления слуха
Еще несколько десятилетий назад кохлеарная имплантация казалась фантастикой. Сегодня же в мире около полумиллиона человек используют вживленные слуховые протезы, их число увеличивается ежегодно на тысячи человек! И никого это не удивляет. Что может предложить современная наука людям с потерей слуха сегодня и завтра? Рассказывает Евгения Григорьева – врач сурдолог-оториноларинголог медицинского центра «МастерСлух-Астрахань».

Наука не стоит на месте
Электрический слух: от первой стимуляции улитки до наших дней
Над тем, чтобы помочь неслышащим людям хотя бы немного ориентироваться в мире звуков, врачи и ученые начали биться еще в XIX веке. Но тогдашний уровень развития технологий и медицины не позволял говорить об имплантации. В разных странах вплоть до середины XX века проводились только эксперименты с электрической стимуляцией слухового нерва.
В 1961 году в США врач Уильям Хаус первым разработал одноканальный слуховой аппарат, чьи электроды подключались непосредственно к улитке. Испытателями стали три пациента-добровольца и, судя по всему, остались довольны.
Многоканальный аппарат, стимулирующий улитку с разных точек, появился спустя десятилетие. Это заслуга представителя Мельбурнского университета Грэма Кларка. Вживление подобного прибора пациенту было произведено в 1978 году там же, в Австралии. Первым носителем стал житель Мельбурна Род Сондерс.
А спустя несколько лет на волне успеха разработок по борьбе с глухотой в стране появилась компания Cochlear, до сих пор являющаяся одним из мировых лидеров по производству медицинского слухового оборудования.
В 1985 году на базе австралийских разработок подобная имплантация была разрешена FDA (американским Управлением по санитарному надзору, аналогом нашего Роспотребнадзора) сначала взрослым, а в 1990 году – детям старше двух лет.
В СССР долго велись свои разработки, однако ученым так и не удалось опередить другие страны в области кохлеарной имплантации. Многоканальные кохлеарные импланты впервые были применены в 1991 году, когда сотрудники НИИ аудиологии и слухопротезирования провели две операции используя кохлеарные импланты системы Cochlear.
В 1997 году к программе подключился НИИ уха горла носа и речи Санкт-Петербурга.
Спустя восемь лет – Московский НИИ оториноларингологии.
Естественно, возможности медицины 1980-х, самого конца XX века и первой половины XXI несопоставимы.
Вместе с ростом технологий, кохлеарная имплантация развивается огромными темпами!
- У людей исчез страх перед имплантами. Раньше многие опасались вживлять технику, сегодня это считается даже круто.
- Снизился возраст пациентов. Если известно, что ребенок родился глухим или его слух снижается очень быстро, а собственных возможностей организма не хватает для компенсации, то операцию стараются провести как можно раньше, чтобы не пострадало развитие малыша. Малышам проводят КИ уже на 6 - 8 месяц жизни.
- Современные приборы комфортны (есть даже полностью беспроводные), позволяют различать тончайшие оттенки звуков, способны подключаться к смартфону, компьютеру, телевизору и другим умным устройствам. Часть функций регулируется авоматически и автоматика “умнеет” с каждым новым поколением устройств.
- С каждым годом не только сами импланты и процессоры становятся миниатюрнее, удобнее, совершеннее. Операции эволюционируют в сторону большей безопасности и малотравматичности. Медицина стремится к сохранению резидуального, то есть остаточного слуха. На каком бы уровне он не находился.
Широкие возможности для узких показаний
Вы, вероятно, удивитесь, но среди имплантов, позволяющих лучше слышать, есть не только кохлеарные. Просто о них меньше говорят, они реже используются, зачастую – технически сложнее.
Импланты среднего уха. По своему виду и функционалу похожи на кохлеарные, но их применяют пациенты с проблемами среднего уха (например, хроническими средними отитами) – люди, которые не могут пользоваться обычными слуховыми аппаратами. В отличие от КИ, имплант среднего уха устанавливается до улитки, а снаружи будет такой же настраиваемый звуковой процессор.
Стволомозговая имплантация – способ восстановления слуха для людей, у которых есть противопоказания к кохлеарной имплантации или ее проведение нецелесообразно. Показания здесь еще более узкие: отсутствие или повреждение слухового нерва в результате травмы или удаления опухоли. У детей чаще всего встречается полная оссификация (окостенение) улитки, когда невозможно использовать кохлеарный имплант, потому что он вживляется в улитку. Стволомозговой же имплант внедряется в кохлеарные ядра. Но это уже совсем другой, более сложный уровень операции. Воздействие ведется на подкорневые центры мозга. Первые подобные операции начали проводиться только в 1992 году, а в России – в 2014-м. Период реабилитации пациентов дольше и намного сложнее, чем после кохлеарной имплантации, прооперированные люди медленнее адаптируются к новым слуховым ощущениям.
Системы с электроакустической стимуляцией. В них одновременно используются две технологии: кохлеарная имплантация и слуховые аппараты. Подобные приборы предназначены для людей с частичной глухотой, например когда слух сохранен на низких частотах или не воспринимаются только высокие звуки. Такие пациенты безо всяких медицинских приборов могут почти идеально слышать в одной акустической обстановке (тихие разговоры, мужские голоса и т. п.) но в другой (когда вокруг шумно или разговаривают в основном женщины и дети высокими голосами) – вообще никак.
Импланты костной проводимости. Эти медицинские приборы могут быть показаны детям, родившимся с аномалиями развития наружного и среднего уха, а также взрослым пациентам с хроническими средними отитами или когда нет возможности иными способами улучшить слух. В данных системах используется костное проведение звуков, т. е. звуковые колебания передаются по костям черепа непосредственно в улитку и далее в слуховые проводящие пути.
Наши специалисты работают с разными проблемами со слухом, каждая требует тщательной диагностики. Если именно имплантация лучше всего поможет в вашем случае, мы направим на операцию, расскажем о возможностях в этой области. Обращайтесь в центры «МастерСлух».
Имплантация – не потолок в развитии
Кохлеарная имплантация – один из самых эффективных, а в большинстве случаев единственно возможный метод реабилитации пациентов с тяжелыми нарушениями слуха, шанс для таких людей жить максимально полноценной жизнью. Но какой бы удобной и продвинутой ни была технология, это, по сути, протезирование, вынужденная замена природного слуха, потому что иначе человек вообще не слышит.
Современным ученым кажутся перспективными разработки, направленные не на компенсацию утраченных возможностей органа чувств, а на его полное восстановление. И да – когда-то это казалось такой же фантастикой, как и вживление электродов.
В первую очередь речь о внедрении стволовых клеток, по сути, строительного материала для клеток всего организма. В случае с потерей слуха стволовые клетки теоретически могут заменить утраченные, полностью разрушенные внутренние волосковые клетки улитки. Работы в этом направлении сегодня активно ведутся. Но пока нет речи о том, чтобы полностью восстановить таким образом слух. Ближайшая цель – внедрить сам метод наряду с медикаментозным, как более эффективный. Например, известно, что после некоторых заболеваний (в том числе очень распространенных, респираторных, включая коронавирус) у человека могут отмирать волосковые клетки улитки. И они не восстанавливаются! Если вовремя начать гормональную терапию, процесс можно остановить, но не обратить. Стволовые клетки же дадут широкие возможности именно для восстановления, так как, упрощенно говоря, превратятся в необходимые волосковые.
Мечты генетиков – самовосстановление нарушенного или отсутствующего слуха. В настоящее время известно около 100 генов в нашем организме, отвечающих за работу органов слуха. Генетическая терапия на всех стадиях жизни человека может помочь. Есть высокая вероятность, что через 50 лет мы перестанем считать кохлеарную имплантацию продвинутым методом, а о слуховых аппаратах вообще забудем и сможем возвращать полностью утраченный слух. Безоперационно будем помогать родившимся с полным отсутствием слуха малышам или корректировать проблему еще на эмбриональной стадии.
Расскажите или сохраните себе:
Еще в разделе “О слухе”

Лето, солнце, жара… слух
Берегите уши на отдыхе. Особенно детские. Иначе вместо пляжа, моря и курортных развлечений будете лечить отит, покупать лекарства и ходить по поликлиникам. Читать далее →
Что нужно знать о тимпанометрии каждому пациенту сурдолога
Тимпанометрия – один из тестов, входящих в комплекс обследований – импедансометрию, который еще называют «золотым стандартом аудиологического обследования». Читать далее →

Музыка и другие звуки против тиннитуса
Не панацея, конечно, но во многих случаях – это реальная возможность спастись от раздражающего шума и звона в ушах. Читать далее →
Читайте также:
- Врожденная гладкомышечная гамартома. Диффузная гладкомышечная гамартома. Поперечнополосатые гамартромы.
- Хирургическая анатомия печени - топография сегментов
- Ушивание стенки трахеи при трахеопищеводном свище.
- Бронхиальная астма и микроциркуляторные нарушения.
- ЭхоКГ при врожденной недостаточности трехстворчатого клапана
