Вакцина против вируса Эбола
Добавил пользователь Владимир З. Обновлено: 10.01.2026
Вирус Эболы вызывает острое тяжелое заболевание, которое часто оказывается летальным в отсутствие лечения. Впервые БВВЭ заявила о себе в 1976 году в ходе 2 одновременных вспышек в Нзаре (сейчас Южный Судан), и в Ямбуку, ДРК. Вторая вспышка произошла в селении рядом с рекой Эбола, от которой болезнь и получила свое название.
Вспышка в Западной Африке в 2014-2016 гг. является самой крупной и сложной вспышкой Эболы со времени обнаружения этого вируса в 1976 году. В ходе этой вспышки заболели и умерли больше людей, чем во всех остальных вспышках вместе взятых. Она также распространяется между странами, начавшись в Гвинее и перекинувшись через сухопутные границы в Сьерра-Леоне и Либерию. Нынешняя вспышка 2018–2019 гг. в восточных районах ДРК имеет чрезвычайно сложный характер, в том числе потому, что принятие ответных мер в области общественного здравоохранения всерьез затрудняется небезопасной обстановкой.
Семейство вирусов Filoviridae включает 3 рода: Лловиу, Марбург и Эбола. Выделены 6 видов Эболы: Заир, Бундибуджио, Судан, Рестон и Таи форест и Бомбали. Вирус, вызвавший нынешнюю вспышку в ДРК и вспышки 2014–2016 гг. в Западной Африке, относится к виду Zaire ebolavirus. Первые три из них — вирусы Эбола Бундибуджио, Заир и Судан — ассоциируются с крупными вспышками в Африке.
Полагают, что естественными хозяевами вируса Эбола являются фруктовые летучие мыши семейства Pteropodidae. Эбола попадает в популяцию человека в результате тесного контакта с кровью, выделениями, органами или иными жидкостями организма инфицированных животных, например шимпанзе, горилл, фруктовых летучих мышей, обезьян, лесных антилоп и дикобразов, обнаруженных мертвыми или больными во влажных лесах.
Эбола затем распространяется в результате передачи от человека человеку при тесном контакте (поврежденных кожные покровов или слизистой оболочки) через:
- кровь или физиологические жидкости заболевшего Эболой или умершего от нее лица;
- предметы, загрязненные физиологические жидкостями (такими как кровь, кал, рвота) заболевшего Эболой лица, или тело умершего от нее пациента.
Медработники часто заражаются при оказании помощи пациентам с подозреваемой или подтвержденной БВВЭ. Это происходит в результате тесных контактов с пациентами при недостаточно строгом соблюдении норм инфекционного контроля.
Погребальные обряды, которые включают в себя прямой контакт с телом умершего, также могут в передаче вируса Эбола.
Люди остаются заразными до тех пор, пока их вирус находится в организме.
Симптомы
Инкубационный период, то есть временной интервал от момента заражения вирусом до появления симптомов составляет от 2 до 21 дня. Инфицированный Эболой человек не может распространять болезнь до момента появления симптомов. Симптомы БВВЭ могут наступать внезапно и включают в себя:
- лихорадку
- слабость
- мышечные боли
- головную боль
- боль в горле
За этим следуют:
- рвота
- диарея
- сыпь
- нарушения функций почек и печени и
- в некоторых случаях, как внутренние, так и внешние кровотечения (например, выделение крови из десен, кровь в кале).
- Лабораторные тесты выявляют низкие уровни белых кровяных клеток и тромбоцитов наряду с повышенным содержанием ферментов печени.
Диагностика
Бывает трудно отличить БВВЭ от других инфекционных болезней, например малярии, тифоидной лихорадки и менингита. Для подтверждения того, что симптомы вызваны вирусом Эбола, проводятся следующие исследования:
- энзим-связывающий иммуносорбентный анализ с захватом антител (ELISA);
- тесты на выявление антигенов;
- реакция сывороточной нейтрализации;
- полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР);
- электронная микроскопия;
- изоляция вируса в клеточных культурах.
При выборе диагностических тестов необходимо принимать во внимание технические спецификации, уровни заболеваемости и распространенности болезни и социальные и медицинские последствия результатов тестирования. Диагностические тесты, которые прошли процедуру независимой и международной оценки
настоятельно рекомендуются к использованию.
Рекомендуемые ВОЗ на сегодняшний день тесты включают следующие:
Автоматизированные и полуавтоматизированные тесты методом амплификации нуклеиновых кислот (NAT) для регулярной диагностики.
Экспресс-тесты по выявлению антигенов для использования в отдаленных районах с отсутствием доступа к NAT. Эти тесты рекомендуется использовать в целях скрининга в качестве компонента эпиднадзора, однако реактивные тесты необходимо подтверждать методом NAT.
Предпочтительные образцы для диагностики:
Цельная кровь, собранная в ЭДТК у живых пациентов с симптомами.
Образец жидкости из ротовой полости, хранимый в универсальной транспортной среде и собранный у скончавшихся пациентов или в случае, когда сбор крови не возможен.
Образцы, взятые у пациентов, представляют чрезвычайно высокую биологическую опасность; лабораторное тестирование неинактивированных образцов следует проводить в условиях максимальной биологической изоляции. Во время национальных и международных перевозок все биологические образцы должны быть помещены в системы тройной упаковки.
Лечение
Поддерживающая терапия с пероральным или внутривенным введением жидкости и лечением конкретных симптомов повышает выживаемость. Апробированного лечения БВВЭ пока не существует. Однако в настоящее время проводится оценка ряда потенциальных средств лечения, включая продукты крови, иммунные и лекарственные терапии.
В ходе нынешней вспышки Эболы 2018–2019 гг. в ДРК в соответствии со сводом этических принципов, разработанных в консультации с экспертами на местах и из ДРК, впервые проводится многокомпонентное рандомизированное контролируемое исследование для оценки эффективности и безопасности лекарственных средств, применяемых для лечения пациентов с Эболой.
Вакцины
Вакцина rVSV-ZEBOV применяется в ходе текущей вспышки Эболы 2018–2019 гг. в ДРК. Первоначальные данные указывают на высокую эффективность данной вакцины. Стратегическая консультативная группа экспертов ВОЗ заявила о необходимости оценки дополнительных вакцин против Эболы.
Профилактика и контроль
Качественные меры борьбы со вспышками опираются на комплекс мероприятий, а именно ведение больных, эпиднадзор и отслеживание контактов, качественную лабораторную службу, безопасные погребения и социальную мобилизацию. Важное значение в успешной борьбе со вспышками имеет вовлечение местных сообществ. Эффективным способом сокращения передачи болезни среди людей является повышение информированности о факторах риска заражения БВВЭ и мерах индивидуальной защиты (включая вакцинацию). В обращениях по вопросам сокращения рисков должны акцентироваться следующие факторы:
- Снижение риска передачи инфекции от диких животных человеку в результате контактов с инфицированными фруктовыми летучими мышами, обезьянами/приматами, лесными антилопами и дикобразовыми и потребления их сырого мяса.
- Снижение риска передачи инфекции от человека человеку в результате прямого или тесного контакта с людьми, имеющими симптомы БВВЭ, особенно с жидкостями их организма. При уходе за больными в домашних условиях необходимо надевать перчатки и надлежащие средства индивидуальной защиты. После посещения больных в больницах и ухода за больными в домашних условиях необходимо регулярно мыть руки.
- Меры по сдерживанию вспышек, включающие быстрое и безопасное погребение умерших, выявление лиц, возможно имевших контакты с кем-либо из числа зараженных Эболой, мониторинг состояния здоровья людей, имевших контакты с больными, в течение 21 дня, важность разделения здоровых и больных людей с целью предупреждения дальнейшей передачи, важность надлежащего соблюдения гигиены и поддержания чистоты.
- Для снижения риска возможной передачи инфекции половым путем — в связи с тем, что такой риск не может быть исключен, мужчины и женщины, выздоровевшие после Эболы, должны воздерживаться от всех видов секса (включая анальный и оральный секс), по меньшей мере, в течение трех месяцев после появления симптомов заболевания. Если воздержание от секса невозможно, рекомендуется использовать мужские или женские презервативы. Рекомендуется избегать контактов с физиологическими жидкостями и мыть руки с мылом. ВОЗ не рекомендует изолировать выздоравливающих пациентов мужского и женского пола с негативными результатами теста крови на вирус Эбола.
- Для снижения риска возможной передачи инфекции половым путем ВОЗ, исходя из данных подробного анализа проводимых исследований и выводов Консультативной группы ВОЗ по реагированию на болезнь, вызванную вирусом Эбола, рекомендует мужчинам перенесшим БВВЭ, практиковать безопасный секс и соблюдать правила гигиены в течение 12 месяцев после появления симптомов заболевания или до тех пор, пока не будет получено два негативных результата теста спермы на вирус Эбола. Рекомендуется избегать контактов с физиологическими жидкостями и мыть руки с мылом. ВОЗ не рекомендует изолировать выздоравливающих пациентов мужского и женского пола с негативными результатами теста крови на вирус Эбола.
Помощь лицам, выздоровевшим после БВВЭ
У выздоровевших после Эболы лиц наблюдается ряд медицинских осложнений, в том числе нарушений психического здоровья. Вирус Эбола может длительно сохраняться в некоторых физиологических жидкостях, включая сперму. Лица, перенесшие Эболу, нуждаются в комплексной поддержке для решения возникающих у них проблем медицинского и психосоциального характера, а также для минимизации риска дальнейшей передачи вируса Эбола. В целях удовлетворения этих потребностей целесообразно организовать специальную программу оказания помощи выздоровевшим после Эболы лицам.
Дополнительную информацию можно найти в Руководстве по оказанию клинической помощи лицам, перенесшим болезнь, вызванную вирусом Эбола.
Известно, что вирус Эбола сохраняется в иммунопривилегированных частях тела некоторых людей, перенесших болезнь, вызванную вирусом Эбола. Эти части тела включают семенники, внутреннюю часть глаз и центральную нервную систему. У женщин, инфицированных во время беременности, вирус сохраняется в плаценте, околоплодной жидкости и эмбрионе. У женщин, инфицированных во время грудного вскармливания, вирус может сохраняться в грудном молоке.
Исследования вирусной устойчивости свидетельствуют о том, что у небольшой процентной доли выздоровевших людей результаты тестирования методом полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) некоторых физиологических жидкостей могут оставаться позитивными на вирус Эбола на протяжении более 9 месяцев.
Необходимы дополнительные данные эпиднадзора и дальнейшие исследования в отношении рисков, связанных с передачей половым путем, и, в частности, в отношении наличия жизнеспособного и трансмиссивного вируса в семенной жидкости в течение длительного времени. На основании имеющихся фактических данных, ВОЗ предлагает следующие временные рекомендации:
- Все лица, выжившие после Эболы, и их половые партнеры должны пройти консультирование в целях соблюдения практики безопасного секса до получения дважды отрицательного результата теста семенной жидкости. Выжившим лицам должны предоставляться презервативы.
- Мужчинам, выжившим после Эболы, следует предлагать проводить тестирование семенной жидкости через три месяца после начала заболевания и затем, в случае положительных результатов теста, каждый месяц до получения дважды отрицательного результата теста семенной жидкости на вирус с помощью ПЦР-РВ с недельным интервалом между тестами.
- Лица, выжившие после Эболы, и их половые партнеры должны
- После получения отрицательного результата теста лица, выжившие после Эболы, могут безопасно возобновить нормальную половую жизнь, не опасаясь передачи вируса.
- На основе анализа дополнительных данных, полученных в результате продолжающихся научных исследований, и итогов обсуждения Консультативной группой ВОЗ по реагированию на болезнь, вызванную вирусом Эбола, ВОЗ рекомендует, чтобы мужчины, перенесшие болезнь, вызванную вирусом Эбола, практиковали безопасный секс и соблюдали гигиену в течение 12 месяцев после появления симптомов заболевания или до тех пор, пока не будут получены два негативных результата теста их семенной жидкости на вирус Эбола.
- До получения дважды отрицательного результата теста семенной жидкости на вирус Эбола выжившие после этой болезни должны соблюдать надлежащие правила гигиены рук и личной гигиены, незамедлительно и тщательно моясь водой с мылом после любого физического контакта с семенной жидкостью, в том числе после мастурбации. В течение этого периода следует соблюдать осторожность в обращении с использованными презервативами и утилизировать их безопасным образом в целях недопущения контакта с семенной жидкостью.
- В отношении всех выживших лиц, их партнеров и семей следует проявлять сочувствие и уважать их достоинство.
Деятельность ВОЗ
ВОЗ преследует цель предотвратить вспышки Эболы, обеспечивая эпиднадзор за болезнью, вызываемой вирусом Эбола, и оказывая поддержку странам, подвергающимся риску, в разработке планов обеспечения готовности. Документ "Эпидемия болезни, вызываемой вирусами Эбола и марбургской лихорадки: обеспечение готовности, предупреждение, контроль и оценка" обеспечивает общее руководство по борьбе против вспышек болезней, вызванных вирусами Эбола и марбургской лихорадки.
Ответные меры ВОЗ при обнаружении вспышки включают в себя содействие в таких областях, как налаживание взаимодействия с местным населением, выявление заболевших, отслеживание контактов, проведение вакцинаций, ведение пациентов, организация лабораторного обслуживания, обеспечение инфекционного контроля, материально-технического снабжения и учебных мероприятий, а также помощь в организации достойного захоронения умерших.
ВОЗ подготовила подробные рекомендации по вопросам профилактики инфекции, вызываемой вирусом Эбола, и борьбы с ней:
Таблица: Хронология вспышек болезни, вызванной вирусом Эбола
* В это число входят предполагаемые, возможные и лабораторно подтвержденные случаи.
ГамЭвак Вакцина векторная против лихорадки Эбола - инструкция по применению
Активное вещество : смесь (1:1) рекомбинантных псевдоаденовирусных частиц, экспрессирующих ген GP вируса лихорадки Эбола, и рекомбинантных псевдоаденовирусных частиц, экспрессирующих ген NP вируса лихорадки Эбола, в суммарном количестве (2,5±1,25)х10 11 частиц в 0,5 мл буферного раствора.
Количество активных рекомбинантных псевдоаденовирусных частиц, экспрессирующих ген GP вируса Эбола, - (2,5±1,5)х10 8 акт.ед./дозу; количество активных рекомбинантных псевдоаденовирусных частиц, экспрессирующих ген NP вируса Эбола, - (2,5±1,5)х10 8 акт.ед./дозу. (Количество активных рекомбинантных псевдоаденовирусных частиц определяют в монополуфабрикатах препарата до добавления буферного раствора).
Вспомогательные вещества : трис(гидроксиметил)аминометан - 1,211 мг, натрия хлорид - 4,38 мг, сахароза - 25,0 мг, полисорбат-80 - 0,0005 мл, магния хлорида гексагидрат - 0,203 мг, этанол 95% - 0,005 мл, ЭДТА динатриевая соль - 0,0373 мг, вода для инъекций до 0,5 мл.
В состав вакцины входит один препарат 0,5 мл (1 доза).
Описание
Бесцветный, слегка опалесцирующий раствор.
По внешнему виду вакцина представляет собой столбик замороженной гомогенной жидкости с горизонтальным мениском, при оттаивании - однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакодинамика:
Вакцина получена биотехнологическим методом при котором не используется патогенный для человека вирус лихорадки Эбола.
Основой вакцины являются рекомбинантные векторы в которые встроен только один отдельный ген гликопротеина GP вируса лихорадки Эбола.
При введении вакцины в организм (внутримышечная инъекция) векторы приникают в клетки организма и происходит экспрессия белка GP вируса лихорадки Эбола в результате чего происходит формирование высокого уровня специфического иммунитета против лихорадки Эбола. Таким образом "живой" или инактивированный вирус лихорадки Эбола при получении вакцины не используется и в состав вакцины не входит.
Эффективность препарата обусловлена входящими в него компонентами.
Препарат представляет собой вакцину способствующую формированию высокого специфического иммунитета против лихорадки Эбола. После проведения вакцинации эффект развивается в течение 28 дней. У 100% пациентов после вакцинации определяются титры антител к вирусу Эбола. Длительность сохранения иммунитета изучена в течение 3 недель после второй вакцинации.
Показания:
Профилактика лихорадки Эбола у взрослых не менее чем за 28 дней до предполагаемого контакта с возбудителем иммунитет сохраняется в течение 21 дня после второй вакцинации.
Противопоказания:
Препарат не назначают при гиперчувствительности к какому-либо компоненту вакцины или аллергической реакции наблюдавшейся при предыдущем введении вакцины.
Вакцинация не проводится при наличии клинических проявлений острых инфекционных заболеваний и обострений хронических инфекционных заболеваний сопровождающихся лихорадкой при острых аллергических состояниях.
С осторожностью:
При хронических заболеваниях печени и почек выраженных нарушениях функции щитовидной железы и других заболеваний эндокринной системы (сахарный диабет) тяжелых заболеваниях системы кроветворения эпилепсии и других заболеваний ЦНС инфаркт миокарда в анамнезе миокардиты эндокардиты перикардиты ишемическая болезнь сердца.
Беременность и лактация:
Способ применения и дозы:
Вакцина предназначена только для внутримышечного введения.
Строго запрещено внутривенное введение препарата.
Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча) в дозировке 05 мл при невозможности - в любую другую мышцу.
Вакцинацию проводят с соблюдением правил асептики: перед вскрытием ампулы рекомендуется обработать крышку флакона 70% этиловым спиртом также спиртом обрабатывают место инъекции. Хранение вскрытого флакона не допускается. Для вакцинации используют одноразовые шприцы.
В день проведения вакцинации пациент должен быть осмотрен врачом. Обязательным является общий осмотр и измерение температуры тела в случае если температура превышает 37 градусов Цельсия вакцинацию не проводят.
Вакцинацию проводят в два этапа с промежутком три недели.
В местах где проводится вакцинация должны быть средства противошоковой терапии (в соответствии с Приказом МЗ СР РФ от 04.092006 № 626 "Об утверждении стандарта медицинской помощи больным анафилактическим шоком неуточненным"). После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Не пригоден к применению препарат во флаконах с нарушенной целостностью и маркировкой при изменении физических свойств (мутность интенсивное окрашивание наличие хлопьев) при истекшем сроке годности неправильном хранении.
Побочные эффекты:
Представленный ниже профиль безопасности основан на данных полученных в ходе клинических исследований.
У части вакцинированных в первые двое-трое суток после вакцинации могут развиться кратковременные общие (непродолжительный гриппоподобный синдром характеризующийся ознобом повышением температуры тела артралгией миалгией астений общим недомоганием головной болью) и местные (болезненность в месте инъекции гиперемия отечность) реакции.
Реже могут наблюдаться тошнота снижение аппетита увеличение регионарных лимфоузлов.
Возможно развитие аллергических реакций у некоторых пациентов.
Возможно кратковременное (7 дней) повышение уровня печеночных трансаминаз креатинина и креатинфосфокиназы в сыворотке крови.
Большинство нежелательных явлений имели легкую или среднюю степень тяжести обычно развивались в 1-2 сутки после вакцинации и разрешались в течение 3 последующих дней.
Ниже приведены сведения о частоте встречаемости местных и общих поствакцинальных реакций (с указанием диапазона соответствующего показателям полученных в рамках настоящего исследования):
- как "Очень частые - 1/10 назначений (≥ 10%)" могут быть выделены следующие нежелательные явления: болезненность в месте инъекции гипертермия головная боль гиперемия в месте инъекции; транзиторное повышение уровня креатининфосфокиназы АЛТ в сыворотке крови.
*При этом в 278% случаев для купирования гипертеримического синдрома требовалось применение жаропонижающих лекарственных средств.
- как "Частые - 1/100 назначений (≥ 1% но < 10%)": боли в мышцах боли в суставах потливость слабость; транзиторное повышение уровня креатининфосфокиназы в сыворотке крови тошнота увеличение регионарных лимфоузлов снижение аппетита отечность или припухлость в месте введения препарата сыпь.
При развитии побочных явлений может быть применена симптоматическая терапия: применение ангигистаминных и жаропонижающих лекарственных средств.
Если любые из указанных в инструкции побочных эффектов усугубляются или Вы заметили любые другие побочные эффекты не указанные в инструкции сообщите об этом врачу.
Передозировка:
Случаи передозировки не описаны.
Взаимодействие:
Нет данных о возможном взаимном влиянии при совместном использовании с другими лекарственными препаратами.
ГамЭвак-Комби Комбинированная векторная вакцина против лихорадки Эбола - инструкция по применению
Активное вещество: рекомбинантные частицы на основе вируса везикулярного стоматита, экспрессирующие ген GP вируса Эбола в дозе (2,5±1,5)х10 7 акт.ед. в 0,5 мл буферного раствора.
Вспомогательные вещества: трис(гидроксиметил)аминометан - 0,605 мг, ЭДТА динатриевая соль - 0,168 мг, сахароза - 50,0 мг, вода для инъекций до 0,5 мл.
Компонент Б содержит:
Активное вещество: рекомбинантные псевдоаденовирусные частицы, экспрессирующие ген GP вируса Эбола (2,5±1,25)х10 11 частиц в 0,5 мл буферного раствора. Количество активных рекомбинантных псевдоаденовирусных частиц, экспрессирующих ген GP вируса Эбола, - (4,5±2,5)х10 8 акт.ед./дозу.
Вспомогательные вещества: трис(гидроксиметил)аминометан -1,211 мг, натрия хлорид - 4,38 мг, сахароза - 25,0 мг, полисорбат-80 - 0,0005 мл, магния хлорида гексагидрат - 0,203 мг, этанол 95% - 0,005 мл, ЭДТА динатриевая соль - 0,0373 мг, вода для инъекций до 0,5 мл.
По внешнему виду вакцина представляет собой столбик замороженной гомогенной жидкости с горизонтальным мениском, при оттаивании - однородный, бесцветный или с желтоватым оттенком, слегка опалесцирующий раствор.
Характеристика:
Вакцина получена биотехнологическим методом при котором не используется патогенный для человека вирус лихорадки Эбола. Основой вакцины являются рекомбинантные векторы в которые встроен только один отдельный ген гликопротеина GP вируса лихорадки Эбола.
При ведении вакцины в организм (внутримышечная инъекция) векторы приникают в клетки организма и происходит экспрессия белка GP вируса лихорадки Эбола в результате чего происходит формирование высокого уровня специфического иммунитета против лихорадки Эбола. Таким образом "живой" или инактивированный вирус лихорадки Эбола при получении вакцины не используется и в состав вакцины не входит.
Иммунологические свойства: вакцина индуцирует формирование гуморального и клеточного иммунитета против геморрагической лихорадки Эбола обеспечивает защитный уровень специфических антител.
Фармакодинамика:
Препарат представляет собой вакцину способствующую формированию высокого специфического иммунитета против лихорадки Эбола. После проведения вакцинации эффект развивается в течение 28 дней. У 100% пациентов после вакцинации определяются титры антител к вирусу Эбола. Длительность сохранения иммунитета изучена в течение 3 недель после вакцинации компонентом Б.
Профилактика лихорадки Эбола у взрослых не менее чем за 28 дней до предполагаемого контакта с возбудителем.
Длительность сохранения иммунитета изучена в течение 3 недель после вакцинации компонентом Б.
Строго запрещено внутривенное введение препарата.
Вакцинацию проводят с соблюдением правил асептики: перед вскрытием ампулы рекомендуется обработать крышку флакона 70% этиловым спиртом также спиртом обрабатывают место инъекции.
Хранение вскрытого флакона не допускается. Для вакцинации используют одноразовые шприцы.
В день проведения вакцинации пациент должен быть осмотрен врачом: обязательным является общий осмотр и измерение температуры тела в случае если температура превышает 37 градусов Цельсия вакцинацию не проводят.
Вакцинацию проводят в два этапа: вначале компонентом А затем через 3 недели компонентом Б.
В местах где проводится вакцинация должны быть средства противошоковой терапии (в соответствии с Приказом М3 СР РФ от 04.092006 № 626 "Об утверждении стандарта медицинской помощи больным анафилактическим шоком неуточненным"). После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Реже могут наблюдаться тошнота диспепсия снижение аппетита увеличение регионарных лимфоузлов.
Возможно развитие аллергических реакций у некоторых пациентов возможно кратковременное (7 дней) повышение уровня печеночных трансаминаз креатинина и креатинфосфокиназы в сыворотке крови.
- как " Очень частые - 1/10 назначений (≥ 10%) " могут быть выделены следующие нежелательные явления: болезненность в месте инъекции гипертермия головная боль боли в суставах; транзиторное повышение уровня креатинина АЛТ ACT в сыворотке крови.
*При этом в 714% случаев для купирования гипертеримического синдрома требовалось применение жаропонижающих лекарственных средств.
- как " Частые - 1/100 назначений (≥ 1% но < 10%) ": боли в мышцах потливость гиперемия в месте инъекции; транзиторное повышение уровня креатининфосфокиназы в сыворотке крови.
- как " Нечастые - 1/1000 назначений (≥ 01% но < 1%) ": тошнота увеличение регионарных лимфоузлов диспепсия снижение аппетита отечность или припухлость в месте введения препарата.
При развитии побочных явлений может быть применена симптоматическая терапия : применение ангигистаминных и жаропонижающих лекарственных средств.
Влияние на способность управлять трансп. ср. и мех.:
Форма выпуска/дозировка:
Упаковка:
Компонент А - раствор для внутримышечного введения 05 мл (1 доза) в стеклянном флаконе.
Компонент Б - раствор для внутримышечного введения 05 мл (1 доза) в стеклянном флаконе.
В картонной пачке содержится 1 флакон компонента А и 1 флакон компонента Б.
Условия хранения:
Препарат годен в течение 1 года после выпуска при условии хранения в оригинальной упаковке вдали от действия прямых солнечных лучей придерживаясь температурного режима от минус 16 до минус 20°С.
Перед введением препарат необходимо достать из холодильной камеры и выдержать при комнатной температуре до полного размораживания не боле 30 минут перед употреблением - встряхнуть.
Не допускается повторное замораживание и оттаивание препарата!
Срок годности:
Не использовать препарат после истечения сроки годности указанного на упаковке.
Условия отпуска
Производитель
ФГБУ "НИЦЭМ имени почетного академика Н.Ф. Гамалеи" Министрерства зравоохранения РФ (Филиал "Медгамал" ФГБУ "НИЦЭМ имени почетного академика Н.Ф. Гамалеи" Министрерства зравоохранения РФ)(ФГБУ "НИЦЭМ им. Н.Ф.Гамалеи" Минздрава России (Филиал "Медгамал" ФГБУ "НИЦЭМ им. Н.Ф.Гамалеи" Минздрава России), 123098, г. Москва, ул. Гамалеи, д.18, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Филиал "Медгамал" ФГБУ "НИЦЭМ имени почетного академика Н.Ф. Гамалеи" Министрерства зравоохранения РФ
ГамЭвак-Комби Комбинированная векторная вакцина против лихорадки Эбола - цена, наличие в аптеках
Указана цена, по которой можно купить ГамЭвак-Комби Комбинированная векторная вакцина против лихорадки Эбола в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
ЭпиВакЭбола - вакцина для профилактики лихорадки Эбола на основе пептидных антигенов - инструкция по применению
Суспензия белого цвета при отстаивании разделяется на два слоя: верхний- прозрачная. бесцветная жидкость; нижний-осадок белого цвета, легко разбивающийся при встряхивании.
Характеристика препарата
Вакцина представляет собой химически синтезированные пептидные антигены белков вируса Эбола, конъюгированные с белком-носителем и адсорбированные на алюминийсодержащем адъюванте (алюминия гидроксиде).
Фармакотерапевтическаи группа:
Иммунобиологические свойства
Вакцина для профилактики лихорадки Эбола на основе пептидных антигенов ЭпиВакЭбола способствует выработке иммунитета против вируса Эбола после двукратного подкожного применения с интервалом 21-28 дней.
Показания к применению
Активная профилактика лихорадки Эбола:
- у взрослых, проживающих в странах энзоотичных по данному заболеванию;
- у лиц, работающих с возбудителем лихорадки;
- у медицинских работников, имеющих контакт с кровью, выделениями, другими жидкостями и органами инфицированного человека;
- у лиц, выезжающих за рубеж в страны энзоотичные по данному заболеванию.
Противопоказания
- Гиперчувствительность к компонентам препарата (гидроокиси алюминия и другим); Тяжелые формы аллергических заболеваний;
- Острые инфекционные и неинфекционные заболевания, хронические заболевания в стадии обострения - прививки проводят не ранее чем через месяц после выздоровления (ремиссии). При нетяжелых ОРВИ, острых кишечных заболеваниях вакцинацию проводят после нормализации температуры;
- Злокачественные заболевания крови и новообразования;
- Беременность и период грудного вскармливания;
- Детский возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности.
Меры предосторожности при применении
Учитывая возможность развития аллергических реакций немедленного типа (анафилактический шок, отек Квинке, крапивница) у особо чувствительных лиц, за привитыми необходимо обеспечить медицинское наблюдение в течение 30 мин. Места проведения прививок должны быть обеспечены средствами противошоковой терапии. Если после введения первой дозы вакцины для профилактики лихорадки Эбола на основе пептидных антигенов ЭпиВакЭбола развилась аллергическая реакция, вводить вторую дозу вакцины запрещается!
Все лица, подлежащие прививкам, должны быть обследованы врачом с учетом анамнестических данных. С целью выявления противопоказаний врач в день прививки проводит опрос и осмотр прививаемых с обязательной термометрией. При температуре выше 37 °С вакцинацию не проводят. За правильность назначения прививки отвечает врач. С осторожностью применять при тромбоцитопении, нарушении свертываемости крови.
Применение при беременности и в период грудного вскармливания
Вакцину не следует вводить во время беременности.
Применение в период грудного вскармливания не изучено, клинических исследований не проводилось.
Способ применения и дозы
Не вводить внутривенно!
Вакцину вводят двукратно, подкожно с интервалом 21-28 дней, в дозе 0,5 мл (1 доза), в верхнюю треть наружной поверхности плеча - в область дельтовидной мышцы.
Перед применением ампулу с вакциной необходимо выдержать при комнатной температуре в течение нескольких минут. Непосредственно перед применением ампулу встряхивают. Ампулу следует осмотреть на предмет наличия посторонних частиц и/или изменения внешнего вида. При обнаружении посторонних включений и/или изменении внешнего вида вакцина подлежит уничтожению.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики: перед вскрытием ампульный нож, шейку ампулы протирают ватой, смоченной 70 % этиловым спиртом, вскрывают ампулу, набирают вакцину в шприц одноразового применения и удаляют из шприца избыток воздуха. Спиртом протирают кожу в месте инъекции. Препарат во вскрытой ампуле хранению не подлежит.
Проведенную прививку регистрируют в установленных учетных формах с указанием даты введения препарата, дозы, номера серии и наименования предприятия-производителя.
Побочное действие
Часто: болезненность, гиперемия, уплотнение и отек в месте введения;
Нечасто: инфильтрат в месте введения.
Часто: повышение температуры тела > 37,0 °С, головная боль, недомогание, слабость. Аллергические реакции:
Часто: повышение иммуноглобулинов класса Е;
Нечасто: повышение С реактивного белка.
Если любые из указанных в инструкции побочных эффектов усугубляются или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка.
Случаи передозировки не установлены.
Взаимодействие с другими лекарственными препаратами
Нет данных о возможном взаимном влиянии при совместном использовании с другими лекарственными средствами и продуктами.
Влияние на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния вакцины на способность к управлению автомобилями и другими механизмами не проводились.
Особые указания
Конкретное решение о необходимости проведения прививок больным с хроническими заболеваниями, злокачественными болезнями крови и новообразованиями и т. п., проживающих в энзоотичных районах по лихорадке Эбола, зависит от степени риска заболевания. Уничтожение неиспользованной вакцины осуществлять в соответствии с требованиями СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами». Класс А (эпидемиологически безопасные отходы, по составу приближенные к ТБО).
Форма выпуска
Суспензия для подкожного введения, 0,5 мл (1 доза).
По 0,5 мл вакцины в ампуле. В пачке по 10 ампул, скарификатор ампульный (если необходимо), инструкция по применению.
Срок годности
Препарат с истекшим сроком годности применению не подлежит.
Условия хранения
Хранить при температуре от 2 до 8°С. Хранить в недоступном для детей месте.
Условия транспортирования
Транспортировать при температуре от 2 до 8°С. Не замораживать!
Для лечебно-профилактических учреждений.
ЭпиВакЭбола - вакцина для профилактики лихорадки Эбола на основе пептидных антигенов - цена, наличие в аптеках
Указана цена, по которой можно купить ЭпиВакЭбола - вакцина для профилактики лихорадки Эбола на основе пептидных антигенов в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
Вакцины для прародины человечества
От лихорадки Эбола теперь существует четыре прививки: две американские и две российские

Сергей Нетёсов, доктор биологических наук, профессор, заведующий лабораторией биотехнологии и вирусологии факультета естественных наук Новосибирского государственного университета, член-корреспондент РАН
Африканский вирус оказался более актуальным, чем российские
Нынешняя вспышка лихорадки Эбола в Конго объявлена чрезвычайной. Остановить и локализовать там эпидемию сейчас пытаются вакцинацией населения вакцинами американских компаний Merck & Co. (MSD) и Johnson & Johnson, а на подходе еще две вакцины — обе российские, созданные в московском НМИЦ «НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи» Минздрава России и в новосибирском ГНЦ ВБ «Вектор» Роспотребнадзора.
Почему он Эбола
Возбудитель лихорадки — вирус Эбола — впервые был обнаружен в 1976 году во время вспышки болезни в районе реки Эбола, протекающей между тогдашним Заиром (ныне Демократическая Республика Конго) и Суданом.
Если рассмотреть хронику создания вакцины против вируса Эбола и современное состояние дел в этой области в мире и в России, то становится понятным, как это поможет всем нам.
Начало
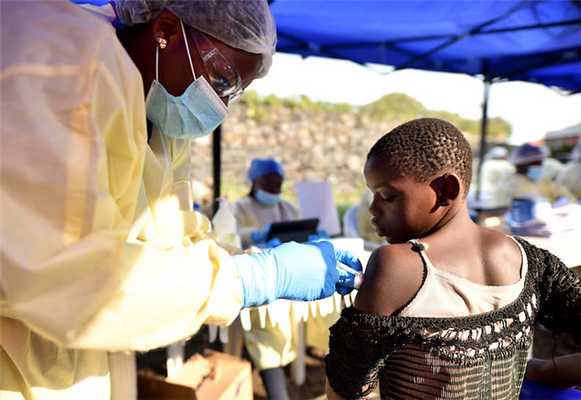
Вирус Эбола был впервые идентифицирован в 1976 году во время крупной вспышки вызванного им заболевания в Судане и тогдашнем Заире (теперь Демократическая Республика Конго; ДРК). Поскольку такие вспышки позднее случались не каждый год и их охват в несколько последующих лет был намного меньше, то ученые ограничились в те времена лишь разработкой иммуноферментных диагностикумов на ее маркеры.
Правда, основные фундаментальные исследования были проведены, в том числе секвенирование генома этого возбудителя, причем российские ученые здесь были одними из первых, включая вашего покорного слугу.
В 1990-е, а особенно в 2000-е годы масштаб и число вспышек заметно увеличились, и некоторые лаборатории в США и Канаде начали разработки и вакцинных препаратов, и средств лечения, а также диагностикумов нового типа на основе полимеразной цепной реакции. Однако для проведения полного цикла доклинических испытаний вакцинных препаратов необходимы весьма значительные средства, а с учетом особой опасности этой инфекции значительную часть таких работ необходимо проводить в лабораториях высшего, четвертого уровня биобезопасности. Ввиду этих причин полного цикла доклинических исследований перспективных, кандидатных, как говорят специалисты, вакцин против Эбола-вирусной инфекции до 2014 года так и не было завершено ни в одной из лабораторий мира.
Природный резервуар вируса
По самым последним данным, природным резервуаром вируса Эбола вернее всего являются фруктоядные летучие мыши. Три вида таких мышей (Hypsignathus monstrosus, Epomops franqueti и Myonycteris torquata) могут быть носителями вируса без признаков заболевания. Из 24 видов растений и 19 видов позвоночных, экспериментально зараженных вирусом Эбола, удалось заразить только летучих мышей. Причем они не заболели, а просто несли в себе вирус в течение долгого времени. В обследовании в 2002–2003 годах 1030 животных, включая 679 летучих мышей из Габона и Республики Конго, только 13 фруктоядных мышей несли этот вирус. Кроме того, фрагменты вируса Эбола выделяли из тканей некоторых умерших западноафриканских равнинных горилл и центральноафриканских шимпанзе, которые иногда питаются фруктоядными летучими мышами. Что еще более важно, фрагменты РНК вируса Эбола были выявлены у клинически здоровых летучих мышей разных видов. Это означало, что летучие мыши могут быть носителями вируса без признаков заболевания, то есть хроническими носителями. А это и есть главное условие поддержания циркуляции вируса Эбола в природе.
Ускорение
Неожиданная по размаху, месту возникновения и продолжительности вспышка этого заболевания 2014 года в Гвинее, Сьерра-Леоне и Либерии сдвинула ситуацию с места. И уже в конце 2015 года несколько лабораторий и научно-исследовательских институтов в США, Канаде и некоторых других странах объявили о завершении доклинических испытаний нескольких кандидатных, вакцинных препаратов.
О создании прототипной вакцины объявили и у нас в России. Первыми были публикации группы ученых из НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи Министерства здравоохранения России о разработке живой вакцины на основе рекомбинантного аденовируса. Однако к этому времени и сама вспышка закончилась, так что испытывать эти вакцины в полевых условиях реальной эпидемии стало негде.
Начиная с 2016 года и до настоящего времени можно отследить серию публикаций по результатам работ о создании и испытаниях пептидной вакцины «ЭпивакЭбола», выполненных в ГНЦ вирусологии и биотехнологии «Вектор» Роспотребнадзора. В 2018 году были завершены ее доклинические исследования, и далее проведен первый этап клинических испытаний на добровольцах-россиянах.
В том же 2018 году, и опять неожиданно, началась вспышка Эбола-вирусной инфекции в ДРК. Как оказалось, один из вакцинных препаратов, разработанный на основе рекомбинантного живого вируса везикулярного стоматита, прошел к этому времени ограниченные клинические испытания в США.
Как передается вирус Эбола
От человека к человеку вирус передается при попадании вируссодержащих жидкостей от больных людей или инфицированных животных на слизистые оболочки или на микротравмы на коже. У больных и умерших концентрация этого вируса в крови и на слизистых оболочках необычайно велика и достигает 10 млн вирусных частиц на 1 мл. Поэтому близкое общение с больным с большой вероятностью приводит к заражению. Наконец, уже выздоровевший человек может нести в себе вирус (в семени мужчин, в грудном молоке женщин) до одного года после выздоровления.
Читайте также:
