Венесуэльский энцефаломиелит лошадей. Возбудитель венесуэльского энцефаломиелита лошадей
Добавил пользователь Morpheus Обновлено: 27.01.2026
Инфекционный энцефаломиелит был известен в США еще в прошлом веке и регистрировался под разными названиями — цереброспинальный менингит, кормовое отравление, канзасская чума лошадей, ботулизм и др. Некоторое время эту болезнь рассматривали как болезнь Борна.
Окончательно как вирусную инфекцию эту болезнь расшифровали благодаря открытию ее возбудителя — вируса в 1931 г. (К. F. Meyer, С. М. Haring, Howitt). Особенно широко ИЭМ лошадей распространился в 30—40-е годы. По данным Shahan и Giltner (1945), с 1930 по 1944 г. заболело около миллиона лошадей, из них погибло около 300 тыс. Отмечена выраженная цикличность в эпизоотическом течении американского инфекционного энцефаломиелита.
При дальнейшем изучении этиологии и особенностей течения болезни в разных зонах США была установлена циркуляция разных вариантов вируса восточного, более вирулентного, вызывающего тяжелое течение болезни и очень высокую смертность у животных и человека, и западного, несколько менее вирулентного вируса (Ховитт, 1937). В 1938 г. обнаружен венесуэльский вариант вируса, который был открыт и дифференцирован Бэком и Быковым (С. Е. Beck и R. W. Wyckoff). Таким образом, клинически однотипно протекающий ИЭМ в США вызывается по меньшей мере тремя разными вирусами, которые довольно точно дифференцированы иммунологическими методами: серологически по РСК, в опытах перекрестной нейтрализации гомологичными иммунными воротками, в опытах перекрестной иммунизации. Ранее ли варианты обозначали как разные типы, позже их по предложению I. Casals (1952) описывают как самостоятельные виды.
В период 1937—1942 гг. вначале серологическими методами (обнаружение соответствующих антител), а далее экспериментально было установлено заболевание лошадей, вызванное вирусом Сан-Луи, ранее считавшимся только вирусом энцефалита человека — трансмиссивной нейроинфекции, передающейся комарами. Западный ПЭМ лошадей (WEE) регистрировали в основном в западных штатах (преимущественно к западу от реки Миссури), а также в Аргентине и Канаде. Восточный ИЭМ (ЕЕЕ) отмечался на востоке страны, а также в Мексике, Панаме, Бразилии и на Кубе. В Республике Куба была отмечена вспышка ИЭМ лошадей в 1969 г. Выделен вирус, сходный с возбудителем восточного американского ИЭМ (В. А. Василенко, Армандо Фердинандес Мартинез, Мария Херрера Альварес и др., 1971).
В некоторых штатах США (Иллинойс и др.), а также в Венесуэле, Колумбии, Эквадоре у больных лошадей был выявлен венесуэльский вирус ИЭМ. В 1972 г. появились новые очаги венесуэльского энцефалита (VEE) в Эквадоре, Гватемале, Никарагуа, Гондурасе. Вирус был выделен в Эквадоре у 10 человек и 4 лошадей. В названной зоне проводится вакцинация лошадей против VEE (данные МЭБ, 1972 г.)
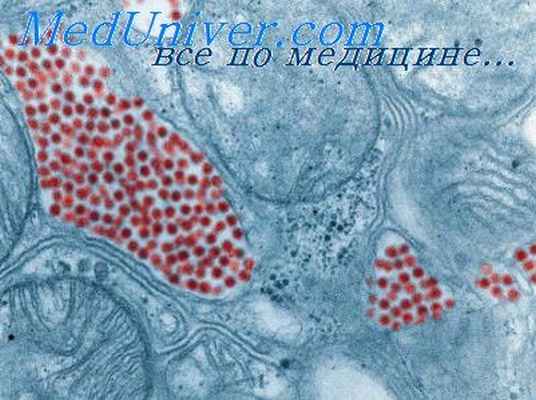
Величина частиц вирусов западного и восточного ИЭМ, установленная в электронном микроокопе, раина 39,6—58,8 ммк. Вирус округлой формы, проходит через фильтры Беркефельда N, V и W, Зейтца, Мандлера и коллодийные фильтры с порами диаметром 66 ммк.
Вирусы западного, восточного, венесуэльского энцефаломиелитов можно культивировать на 10—11-дневных куриных эмбрионах при заражении их в хориоаллантоис, аллантоис и амниотическую полости и в тело эмбриона. Эмбрионы гибнут обычно через 15—24 часа. Хорошей лабораторной моделью служат мыши-сосунки, однодневные цыплята. Этими тестами пользуются при выделении вируса из мозга павшей или убитой лошади. Мышам и цыплятам вирус вводят интрацеребрально. Западный вирус вызывает заболевание мышей обычно через четыре дня, восточный — через 40 часов. К обоим вирусам восприимчивы морские свинки, белые мыши, крысы, кролики, хомяки, голуби, белки, обезьяны, собаки и др. К восточному вирусу, помимо названных животных, восприимчивы также овцы, кошки, ежи и перепелки.
Следует отметить, что к вирусам ИЭМ особо чувствительны морские свинки, которые заболевают после интрацеребрального заражения через 1—3 дня. Вирус у них можно в определенный период (лихорадка) обнаружить в крови. Вирус венесуэльского энцефаломиелита также патогенен для большинства названных животных. К вирусам американского ИЭМ восприимчивы многочисленные виды млекопитающих и птиц, которые наряду с комарами (Aedes aegypti, Aedes triseriatus et al.) с клещами (Dermacentor andersoni, Dermanyssus gallinae et al.) составляют резервуар вирусов ИЭМ в природе. В частности, установлено носительство вируса восточного энцефаломиелита в Мериланде английскими воробьями и кудахтающими куропатками (R. I. Byrne, 1961). Западный вирус был выделен у голубей из секрета зоба.
Как было указано выше, при выделении и идентификации вирусов ИЭМ заражают 10—11-дневные куриные эмбрионы. В них за одни сутки накапливается вирус до уровня вирулентности 10 -6 (особенно при пассажах). Вирусы американского ИЭМ успешно выращивали также в культуре ткани куриного эмбриона, в суспензии ткани мозга эмбриона мыши, в ткани эмбриона живородящей рыбы гамбузии и других клеточных культур (Р. К. Olitsky, R. Сох).
В литературе имеется большой материал по экспериментальному заражению лошадей вирусами американского ИЭМ. Еще в 30-х годах Мейер, Херст, Шеген и Джильтнер и др., вводя лошадям вируссодержащий материал (мозговая суспензия больных лошадей и инфицированных морских свинок, в отдельных случаях их кровью) различными методами, вызвали их заболевание. Интрацеребральное заражение во всех случаях (за редким исключением) вызывало заболевание лошадей с симптомами, соответствующими естественному течению болезни. Особый интерес представляют дальнейшие исследования Кислинга и др. (R. Е. Kissling, 1954) по воспроизводству болезни подсаживанием для кормления зараженных вирусом комаров. Из шести лошадей заболело три, проявившие признаки нарушения функции центральной нервной системы, причем у всех животных были обнаружены вируснейтрализующие антитела. Важно указать, что во многих опытах экспериментального заражения у подопытных лошадей обнаруживали вирус в крови через 24—48 часов после заражения.
Теория о передаче вирусов ИЭМ комарами возникла в 1933 г., когда Кельсеру (R. A. Kelser) впервые удалось при помощи искусственно инфицированных комаров Аеdes aegypti перенести вирус западного типа от морской свинки па морскую свинку, от последней на лошадь и с лошади опять па лошадь. Прошло около 40 лет. За это время американские исследователи провели много опытов для уточнения важных моментов в вопросах о роли гематофагов в переносе вирусных энцефалитов. Установлены основные резервести и переносчики каждого вируса (комары Aedes sollicitans, A. nigromaculis, A. dorsalis et al.), определены сроки и титры накопления вирусов в организме комаров, особенности виремии у лошадей, инфицированных птиц и лабораторных животных. Однако все еще нет ответа на ряд таких противоречивых фактов, как, например, отсутствие заболеваемости среди лошадей при обнаружении вирусов у комаров в данной зоне, циркуляция у комаров вируса, гетерологичного вирусу, выделенному в данный момент от больных животных, появление отдельных вспышек ИЭМ зимой. Начиная с 1941 г. Сивертон и др., Ховитт и др., Ривс и др. установили носительство и возможность переноса вирусов ИЭМ различных видов клещами Dermacentor Andersoni, Dermanyssus gallinae et al.
Большинство авторов полагают, что основными поставщиками вирусов для гематофагов являются не столько лошади, сколько дикие птицы и, возможно, куры, фазаны, голуби, воробьи. Следует считать, что резервуаром инфекта могут служить некоторые дикие млекопитающие, в частности суслики, у которых удалось обнаружить возбудителя ИЭМ западного типа.
Несмотря на утвердившееся мнение, что вирусы ИЭМ передаются гематофагами, в литературе встречаются высказывания о контактной передаче болезни (заражение интраназальное и через рот).
Инкубационный период у лошадей при экспериментальном интрацеребральном заражении продолжается 3—8 дней, при заражении в естественных условиях — примерно 1—3 недели. У заболевших лошадей повышается температура тела до 41°. Через 18—36 часов лихорадка исчезает. В конечном периоде болезни температура часто субфебрильна. Клиническая картина, особенно по нервной симптоматике, мало отличается от наблюдающейся при ИЭМ, протекающем в СССР (см. ниже). Как отличие следует отметить отсутствие при американских формах ИЭМ желтушности, или слабую ее выраженность у большинства больных. Болезнь, как правило, протекает остро от 3 до 8 дней. Смертельность в среднем достигает 50%, при заболевании энцефаломиелитом восточного типа значительно выше, чем при заболевании западным.
Важным моментом в диагностике американского ПЭМ является иммунодиагностика, направленная не только на подтверждение вирусной этиологии изучаемого случая болезни, но также для дифференцирования типа действующего вируса. К методам этой диагностики относятся: реакция нейтрализации, реакция задержки (подавления или ингибиции) гемагглютинации, реакция связывания комплемента. При изучении западного ИЭМ Доби и др. (R. В. Doby et al., 1966) пришли к заключению о высоком диагностическом значении реакции ингибиции гемагглютинации. Так, уже в первые 4 дня с начала болезни при помощи этой реакции удалось подтвердить правильность диагноза на вирусный энцефалит в 96,4%, а при помощи РСК — лишь в 71,4% случаев. На фоне циркулировавшего в штате вируса западного энцефаломиелита авторы серологически установили у трех лошадей инфекцию, вызванную вирусом Сан-Луи. Из указанного видно, что серодиагностика ИЭМ заслуженно приобретает важное практическое значение.
Патологоанатомические изменения при американском ИЭМ не характерны. Отмечают сочность лимфатических узлов, желтушность, слабые дегенеративные и воспалительные изменения, а иногда появление интрануклеарных включений, напоминающих в некоторой степени тельца Иеста в ганглиозных клетках мозга.
Важнейшим разделом учения об американском ИЭМ является иммунология. Ее основой является установленное в 30-х годах антигенное различие циркулирующих па американском континенте вирусов ИЭМ различных видов. Это обстоятельство имеет весьма важное значение в эпидемиологическом и эпизоотологическом аспектах, а также для создания специфических диагностических препаратов, иммунсывороток и вакцин, гомологичных действующему в данной зоне вирусу.
Идентификацию вируса при помощи видоспецифических диагностических сывороток и соответствующих антигенов проводят реакцией нейтрализации (на мышах либо на культуре клеток куриных фибробластов), методом торможения (ингибиции) гемагглютинации (HI) и РСК. Гипериммунизацией лошадей получали лечебную сыворотку (Меир, Рекорде и др.). Она эффективна в ранней стадии болезни, ее вводят внутривенно. Большое значение приобрела активная иммунизация формолэмбрионвакциной против соответствующего вида вируса — восточного или западного. Вакцина была предложена в 1938 г. Бирдом, Финкельштейном, Сили и Быковым (J. W. Beard, Н. Finkelstein, Sealy, R. Wycoff). Вакцину стали широко применять на практике. Только до 1940 г. было привито около 3 млн. лошадей в неблагополучных и угрожаемых по ИЭМ очагах.
Венесуэльский энцефаломиелит лошадей. Возбудитель венесуэльского энцефаломиелита лошадей
Венесуэльский энцефаломиелит лошадей. Возбудитель венесуэльского энцефаломиелита лошадей
Венесуэльский энцефаломиелит лошадей (ВенЭЛ) — природно-очаговый трансмиссивный вироз, распространяемый комарами в американском регионе, протекающий обычно в виде остролихорадочного заболевания с лимфопенией и иногда с развитием менингоэнцефаломиелита.
Вирус выделен в 1938 г. СЕ. Beck и R.W.G. Wyckoff, а также V Kubes, F.A. Rios из мозга лошади, погибшей во время эпизоотии болезни в Венесуэле. У человека заболевание впервые было описано в 1943 г. как результат внутрилабораторного заражения.
Возбудитель — Venezuelan equine encephalitis virus относится к роду Alfavirus семейству Togaviridae и обладает общими для альфавирусов свойствами. VEEV образует антигенный комплекс VEE из 6 подтипов, имеющих ряд вариантов с различным распространением и медицинским значением: 1АВ — IF (Южная Америка); II — Everglades virus (Флорида, США), IIL4 —Mucumbo (Бразилия, Суринам, Тринидад); ШВ — Tonate virus (Южная Америка); IV — Pixuna virus (Южная Америка), V — Cabassou virus (Южная Америка); VI — AG80-663 virus (Африка).
Наибольшее медицинское значение имеют I и П подтипы VEEV. 1AB и 1С наиболее вирулентны и относятся к эпизоотическим вирусам, IАВ подтип вируса является наиболее патогенным для человека, Everglades virus вызывает спорадические заболевания у людей в штате Флорида (США). Подтипы ID, IE и IF являются энзоотическими и циркулируют между птицами и мелкими животными в межэпизоотический период.
Венесуэльский энцефаломиелит лошадей — природно-очаговая трансмиссивная инфекция. Основным резервуаром вирусов являются лесные грызуны, меньшее значение имеют птицы, обезьяны и другие животные Несмотря на развитие у больных людей высокоинтенсивной виремии и наличие вируса в носоглоточной слизи, роль человека как источника инфекции не установлена.
Механизм заражения — кровяной трансмиссивный, реализуемый при кровососании комаров. В энзоотической циркуляции вируса между животными основную роль играют комары Culex spp. (подрод Melanoconion). эпизоотическая циркуляция вирусов обеспечивается другими комарами (Culex spp., Aedes spp.,Mansonia spp., Psorophora spp., Deinocerites spp. и др.).
В связи с сохранением вирулентности вирусов в аэрозоле может наблюдаться внутрилабораторное заражение. Отмечены случаи вертикальной передачи вируса у беременных.
Заболевания обычно регистрируются в летний сезон, особенно в жаркий период после интенсивных тропических ливней, когда формируется многочисленная популяция комаров.
Контингентами высокого риска заражения являются сельские жители, в особенности молодые лица и дети, проживающие в лесной местности энзоотических регионов. У взрослых людей инфекция часто протекает бессимптомно, что подтверждает высокая частота серопозитивных результатов среди населения в очагах инфекции.
Эпидемии венесуэльского энцефаломиелита лошадей с десятками тысяч больных наблюдались во многих странах Южной Америки в 20-х-70-х годах XX столетия, в 1971 г. возникла эпидемия в США, где в 1992-1995 гг. вновь отмечены эпидемические вспышки болезни. С 1995 г эпидемии болезни с охватом до 100 000 человек (летальность 0,2%) вновь регистрируются в Южной Америке (Венесуэла, Колумбия), что связано с распространением нового эпизоотического варианта вируса.
Очаги венесуэльского энцефаломиелита лошадей сохраняются на юге США (Флорида), в Мексике, в Центральной Америке (Гватемала, Гондурас, Коста-Рика, Никарагуа, Сальвадор, Тринидад), в Южной Америке (Аргентина, Бразилия, Венесуэла, Колумбия, Перу).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Особенности циркуляции вируса венесуэльского энцефаломиелита лошадей (обзор)
В обзоре рассмотрены некоторые особенности циркуляции вируса венесуэльского энцефаломиелита лошадей (ВЭЛ). Энзоотические штаммы вируса ВЭЛ в настоящее время играют все возрастающую роль как этиологические агенты заболеваний у людей. Большинство случаев ВЭЛ у людей в эндемичных регионах в межэпидемический период вызваны инфицированием вирусом ВЭЛ подтипа ID, который включает в себя 6 генотипов. От людей выделены генотипы Колумбия/Венесуэла, Панама/Перу и Перу/Боливия подтипа ID вируса ВЭЛ. Возможность возникновения новых эпидемических вспышек ВЭЛ обусловлена мутациями штамма ID подтипа в IС подтип, который и представляет в настоящее время потенциальную угрозу как этиологический агент заболевания.
Ключевые слова
Об авторах
Список литературы
1. Аdams A.P., Navarro-Lopez R., Ramirez-Aguilar F.J., Gonzalez I.L., Leal G., Flores-Mayorga J.M., Travassos da Rosa A.P., Saxton-Shaw K.D., Singh A.J., Borland E.M., Powers A.M., Tesh R.B., Weaver S.C., Estrada-Franco J.G. Venezuelan equine encephalitis virus activity in the gulf Coast region of Mexico, 2003-2010. PLoS Nedl. Trop. Dis. 2012; 6(11):e1875. doi: 10.1371/journal.pntd.0001875.
2. Agular P.V., Greene I.P., Coffey L.L., Medina G., Moncayo A.C., Anishchenko M., Ludwig G.V., Turell M.J., O’Guinn M.L., Lee J., Tesh R.B., Watts D.M., Russell K.L., Hice C., Yanoviak S., Morrison A.C., Klein T.A., Dohm D.J., Guzman H., Travassos da Rosa A.P., Guevara C., Kochel T., Olson J., Cabezas C., Weaver S.C. Endemic Venezuelan equine encephalitis in northern Peru. Emerg. Inf. Dis. 2004; 10(5):880-8.
3. Agular P.V., Adams A.P., Suarez V., Beingolea L., Vargas J., Manock S., Freire J., Espinoza W.R., Felices V., Diaz A., Liang X., Roca Y., Weaver S.C., Kochel T.J. Genetic characterization of Venezuelan equine encephalitis virus from Bolivia, Ecuador and Peru: identification of a new subtype ID lineadge. PLoS Nedl. Trop. Dis. 2009; 3(9):e514. doi: 10.1371/journal.pntd.0000514.
4. Brault A.C., Powers A.M., Weaver S.C. Vector infection determinants of Venezuelan equine encephalitis virus reside within the E2 envelope glycoprotein. J. Virol. 2002; 76:6387-92.
5. Centers for Disease Control and Prevention. Venezuelan equine encephalitis - Colombia, 1995. MMWR. Morb Mortal Wkly Rep. 1995; 44:721-4.
6. Ferro C., Boshell J., Moncayo A.C., Gonzalez M., Ahumada M.L., Kang W., Weaver S.C. Natural enzootic vectors of Venezuelan equine encephalitis virus, Magdalena Valley, Colombia. Emerg. Infect. Dis. 2003; 9:49-54.
7. Mangiafico J.A., Rossi C.A., Ludwig G.V. Isolation and identification of Venezuelan equine encephalitis virus from a human in Panama. Am. J. Trop. Med. Hyg. 2002; 67:112-3.
8. Manock S.R., Jacobsen K.H., de Brevo N.B., Russell K.L., Negrete M., Olson J.G., Sanchez J.L., Blair P.J., Smalligan R.D., Quist B.K., Espín J.F., Espinoza W.R., MacCormick F., Fleming L.C., Kochel T. Etiology of acute undifferentiated febrile illness in the Amazon Basin of Ecuador. Am. J. Trop. Med. Hyg. 2009; 81:146-51.
10. Navarro J.-C., Medina G., Vasquez C., Coffey L.L., Wang E., Suárez A., Biord H., Salas M., Weaver S.C. Postepizootic persistence of Venezuelan equine encephalitis virus, Venezuela. Emerg. Infect. Dis. 2005; 11(12):1907-15.
11. Oberste M.S., Fraire M., Navarro R., Zepeda C., Zarate M.L., Ludwig G.V., Kondig J.F., Weaver S.C., Smith J.F., Rico-Hesse R. Association of Venezuelan equine encephalitis virus subtype IE with two equine epizootics in Mexico. Am. J. Trop. Med. Hyg. 1998; 59:100-7.
12. Oberste M.S., Weaver S.C., Watts D.M., Smith J.F. Identification and genetic analysis of Panama-genotype Venezuelan equine encephalitis virus subtype ID in Peru. Am. J. Trop. Med. Hyg. 1998; 58:41-6.
13. Ortiz D.I., Anishchenko M., Weaver S.C. Susceptibility of Psorophora confinnis (Diptera: Culicidae) to infection with epizootic (subtype IC) and enzootic (subtype ID) Venezuelan Equine encephalitis viruses. J. Med. Entomol. 2005; 42:857-63.
14. Powers A.M., Oberste M.S., Brault A.C., Rico-Hesse R., Schmura S.M., Smith J.F., Kang W., Sweeney W.P., Weaver S.C. Repeated emergence of epidemic/epizootic Venezuelan equine encephalitis from a single genotype of enzootic subtype ID virus. J. Virol. 1997; 71:6697-705.
15. Quiroz E., Aguilar P.V., Cisneros J., Tesh R.B., Weaver S.C. Venezuelan equine encephalitis in Panama: fatal endemic disease and genetic diversity of etiologic viral strains. PLoS Nedl. Trop. Dis. 2009; 3:1-7.
18. Scherer W.F., Cupp E.W., Lok J.B. Intestinal threshold of an enzootic strain of Venezuelan equine encephalomyelitis virus in Culex (Melanoconion) taeniopus mosquitoes and its implication to vector competency and vertebrate amplifying hosts. Am. J. Trop. Med. Hyg. 1981; 30:862-9.
19. Turell M.J., Jones J.W., Sardelis M.R., Dohm D.J., Coleman R.E., Watts D.M., Fernandez R., Calampa C., Klein T.A. Vector competence of Peruvian mosquitoes (Diptera: Culicidae) for epizootic and enzootic strains of Venezuelan equine encephalomyelitis virus. J. Med. Entomol. 2000; 37:835-9.
20. Vilcarromero S., Aguilar P.V., Halsey E.S., Laguna-Torres V.A., Razuri H., Perez J., Valderrama Y., Gotuzzo E., Suarez L., Cespedes M., Kochel T.J. Venezuelan equine encephalitis and 2 human deaths, Peru. Emerg. Infect. Dis. 2010; 16(3):553-6. doi: 10.3201/eid1603.090970.
21. Walton T.E., Grayson M.A. Venezuelan equine encephalomyelitis. In: Monath T.P., editor. The Arboviruses: Epidemiology and Ecology. Boca Raton Florida: CRC Press; 1988. Vol. IV. P. 203-31.
22. Watts D.M., Callahan J., Rossi C., Oberste M.S., Roehrig J.T., Wooster M.T., Smith J.F., Cropp C.B., Gentrau E.M., Karabatsos N., Gübler D., Hayes C.G. Venezuelan equine encephalitis febrile cases among humans in the Peruvian Amazon River region. Am. J. Trop. Med. Hyg. 1998; 58:35-40.
23. Weaver S.C., Salas R., Rico-Hesse R., Ludwig G.V., Oberste M.S., Boshell J., Tesh R.B. Re-emergence of epidemic Venezuelan equine encephalomyelitis in South America. VEE Study Group. Lancet. 1996; 348:436-40.
24. Weaver S.C. Recurrent emergence of Venezuelan equine encephalomyelitis. In: Scheld W.M., Hughes J. Emerging infections 1. Washington: ASM Press; 1998. P. 27-42.
25. Weaver S.C., Ferro C., Barrera R., Boshell J., Navarro J.C. Venezuelan equine encephalitis. Ann. Rev. Entomol. 2004; 49:141-74.
Венесуэльский энцефаломиелит лошадей
Венесуэльский энцефаломиелит лошадей (син.: венесуэльский энцефалит лошадей) – острое трансмиссивное антропозоонозное нейроинфекционное заболевание. Характеризуется лихорадкой, синдромом общей инфекционной интоксикации, поражением ЦНС, иногда развитием очаговой пневмонии.
Этиология. Возбудитель – арбовирус семейства тогавирусов рода альфа-вирусов, группы А. Диаметр вириона – от 40 до 120 нм, геном представлен односпиральной РНК.
Эпидемиология. Заболевание первоначально представляло собой болезнь лошадей и других млекопитающих. Признаки инфекции у человека были обнаружены в Венесуэле, Колумбии, Эквадоре, Панаме, Суринаме, Гвиане, Гватемале, Гондурасе, Мексике, Бразилии, Аргентине, Перу, Флориде, Техасе, на Кюрасао и в Тринидаде. Каждый подтип вируса венесуэльского энцефаломиелита лошадей имеет собственного энзоотического переносчика. Наиболее распространен энзоотический цикл между комарами Culex и лесными грызунами. Энзоотические переносчики вируса инфицируют людей, посещающих влажные тропические леса или болота, сборщиков каучука, военнослужащих, дислоцированных в эндемичных районах. Во время эпизоотии переносчиками вируса служат многие виды комаров, в частности Aedes , Mansonia, Psorophora . Вирус имеет широкий спектр хозяев среди диких млекопитающих, включая обезьян капуцинов, крыс, мышей, опоссумов, американских зайцев, лис и летучих мышей, которые инфицируются естественным путем. Кроме лошадей, болеют также крупный рогатый скот и свиньи в Мексике, козы и овцы в Венесуэле. Вирус хорошо размножается в организме млекопитающих, создавая высокий титр антител в крови. Так, у инфицированных лошадей их содержание в 1 мл крови может достигать 10 мышиных летальных доз при внутрибрюшинном введении. Несмотря на то что в естественных условиях вирусом венесуэльского энцефаломиелита лошадей могут быть инфицированы 29 видов диких птиц (чаще это цапли, гнездящиеся колониями, и связанные с ними виды), остается неизвестным, достаточен ли уровень вирусемии у этих птиц для инфицирования комаров-переносчиков. В первые 3 дня заболевания вирусемию выявили у 60 % больных. Уровни вирусемии при этом были достаточно высоки, для того чтобы человек мог выступать в качестве резервуара инфекции. У некоторых больных вирус удается изолировать из смывов со стенок глотки, что указывает на возможность передачи инфекции от человека к человеку.
Имеющиеся в настоящее время данные позволяют предположить, что естественным переносчиком является комар, а первичным резервуаром – либо дикие, либо домашние наземные млекопитающие. Однако в естественных условиях инфекция может наблюдаться и без участия членистоногих переносчиков. Известны случаи лабораторного заражения, явившегося результатом вдыхания аэрозолей.
Патогенез. Вирус проникает в организм человека через поврежденную кожу или слизистую оболочку дыхательных путей. После укуса комара возбудители попадают в лимфу или через поврежденные сосуды кожи – в кровь. В период вирусемии они достигают нервной системы, вызывая в нервных клетках дегенеративные изменения. Вирусемия продолжается в среднем до 5 дней. Одновременно поражаются другие внутренние органы, в том числе клетки поджелудочной железы. Восприимчивы к заболеванию люди всех возрастных групп. Перенесенное заболевание оставляет прочный иммунитет. Патологоанатомическая картина характеризуется изменениями в ЦНС, свойственными энцефалитам.
Клиническая картина. Инкубационный период варьирует от 2 до 5 дней, после чего внезапно появляются головная боль, лихорадка (часто сопровождающаяся ознобами), недомогание, миалгии, тошнота, рвота, понос, боли в горле. В большинстве случаев инфекция протекает в виде нетяжелого острого фебрильного заболевания, не сопровождающегося неврологическими осложнениями. У части больных развиваются признаки воспаления мозговых оболочек (серозный менингит), фотофобии, судороги, нарушения сознания, тремор и диплопия. Наблюдаются мозжечковые и вестибулярные расстройства, парезы глаз двигательных нервов, исчезают брюшные рефлексы, появляются симптомы Бабинского, Гордона, Оппенгейма. Описаны и более тяжелые проявления болезни. В этих случаях быстро развиваются признаки менингоэнцефаломиелита, кома и наступает смерть.
У 30 % больных увеличиваются лимфатические узлы. Первоначально число лейкоцитов остается в пределах нормы; 80 % из них составляют нейтрофильные гранулоциты. На 3-й день у 30 % больных развивается лейкопения. В СМЖ обнаруживают плеоцитоз с незначительным повышением концентрации белка при нормальном содержании глюкозы. В дальнейшем в крови определяются лейкопения, анэозинофилия, сдвиг в сторону молодых нейтрофилов, моноцитоз.
Период реконвалесценции отличается длительной астенизацией, остаточными нарушениями функций соматической и вегетативной нервной системы, которые сохраняются до 3 мес. и дольше.
Диагностика. Диагноз ставят на основании эпидемиологического анамнеза, клинических признаков (лихорадка, миалгии, оболочечные симптомы, другие неврологические расстройства), лабораторных данных (лейкопения, анэозинофилия, моноцитоз). Подтверждают его выделением вируса из крови, СМЖ и носоглоточных смывов (проводится в специально оборудованных боксах ввиду его высокой контагиозности). В острой стадии болезни этими материалами заражают подкожно или интрацеребрально белых мышей, а также хориоаллантоисную оболочку куриных эмбрионов. Серологическая диагностика основывается на исследовании парных сывороток в РТГА, РСК и РН вируса гомологичными сыворотками.
Дифференциальная диагностика проводится с другими арбовирусными инфекциями, проявляющимися главным образом лихорадкой, недомоганием, головной болью и миалгией (флеботомная лихорадка, колорадская клещевая лихорадка, лихорадка долины Рифт).
Лечение. Применяется комплексное патогенетическое лечение. Как можно раньше после начала заболевания вводят внутримышечно по 3 – 6 мл противоэнцефалитного лошадиного иммуноглобулина в течение 2 – 3 дней подряд. В первый день препарат вводят дважды с интервалом 10 – 12 ч.
Прогноз. Летальность – в пределах 0,4 – 0,7 %; главным образом среди детей. В большинстве случаев наблюдаются полное выздоровление с обратным развитием неврологической симптоматики, длительная астенизация.
Профилактика и мероприятия в очаге. Профилактические мероприятия направлены на истребление переносчиков (комаров) и иммунизацию людей и домашних животных живой вакциной. При этом иммунизируют только лиц, работающих в эндемичных регионах и подвергающихся риску заражения по роду профессиональной деятельности. Эффективность существующих вакцин у людей невысока. Более эффективны вакцины, предупреждающие заболевание у лошадей. В очагах необходимо выявлять все случаи заболевания с обязательной изоляцией заболевших, поскольку не исключается воздушно-капельный путь передачи инфекции.

Вирус венесуэльского конского энцефалита
Вирус венесуэльского лошадиного энцефалита , венесуэльского лошадиного энцефалита является возбудитель оригинальный вирус передается от комаров и вызывает к венесуэльского лошадиного энцефалита или энцефаломиелита . Вирус может поражать все виды лошадей, такие как лошади , ослы и зебры . После заражения лошади могут внезапно умереть или проявить прогрессирующие нарушения центральной нервной системы . Люди также могут заразиться этой болезнью. Здоровые взрослые , которые заражаются вирусом могут иметь flu- как симптомы , такие как высокая температура и головная боль. Люди с ослабленной иммунной системой, маленькие дети и пожилые люди могут серьезно заболеть или умереть от этого заболевания.
Вирус, вызывающий заболевание, в основном передается комарами, которые кусают инфицированное животное, а затем кусают другое животное или человека. Скорость распространения болезни зависит от подтипа вируса и плотности популяций комаров. В некоторых регионах энзоотические подтипы вызывают эндемические заболевания. Обычно эти серотипы не распространяются на другие местности. Энзоотические подтипы связаны с циклом передачи вируса от грызунов к комарам. Эти формы вируса могут вызывать болезни человека, но обычно не влияют на здоровье лошадей.
С другой стороны, эпизоотические подтипы могут быстро распространяться среди больших популяций. Эти формы вируса очень патогенны для лошадей, а также могут влиять на здоровье человека. Лошади, а не грызуны, являются основными видами животных, переносчиками болезни. Затем у пораженных лошадей в кровеносной системе вырабатывается огромное количество вируса. Когда кровососущее насекомое питается этими животными, оно улавливает вирус и передает его другим животным или людям. Хотя другие животные, такие как крупный рогатый скот, свиньи и собаки, могут быть инфицированы, они обычно не проявляют признаков болезни и не способствуют ее распространению.
Вириона имеет сферическую форму , и его диаметр составляет приблизительно 70 нм. Он имеет липидную мембрану с поверхностным гликопротеином и белками, распределенными по внешнему краю. Материалы ядра окружены нуклеокапсидом изокаэдрической симметрии T = 4 и диаметром примерно 40 нм.
Резюме
Подтипы вирусов
Серологические тесты, проведенные на этом вирусе , показали наличие шести различных подтипов (от I до VI). Им были даны имена от таких подтипов, как Mucambo, Tonate и Pixuna. Внутри подтипа I существует семь различных вариантов, и три из этих вариантов, A, B и C, являются эпизоотическими штаммами.
Эпидемии вируса венесуэльского конского энцефалита
Использовать как биологическое оружие
Когда американская программа биологического оружия закончилась в 1969 году, вирус был одним из семи вирусов, которые использовались для разработки биологического оружия, производимого промышленным способом.
Недавняя информация
В апрель 2009 г. , Медицинский научно-исследовательский институт инфекционных заболеваний армии США в Форт-Детрике сообщил, что образцы вируса венесуэльского энцефалита лошадей были обнаружены пропавшими без вести во время инвентаризации образцов, хранящихся в исследовательском центре. Также сообщалось, что образцы, вероятно, были среди тех, которые были уничтожены в результате неисправности морозильной камеры.
Читайте также:
