Влияние алкилирующих соединений на ядра клеток. Мишени алкилирующих соединений
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
В патохимической классификации химические вещества данной группы именуются алкилирующими ядами. Под алкилированием понимается процесс вытеснения молекулой яда функциональных групп белка вообще и нуклеопротеидов в особенности.
Различают алкилирующее действие общее и избирательное. К общим алкилирующим агентам относятся вещества, имеющие один или несколько активных радикалов следующего строения:
1) производные сернистого иприта: R _ S _ CH2 _ CH2 _ Cl
2) производные азотистого иприта:
5) эфиры метансульфокислоты:
Ко второй группе кожно-резорбтивных ядов относятся так называемые тиоловые яды. Это такие вещества, которые избирательно алкилируют только тиоловые группы метаболитов тканей. Подобные свойства проявляют соединения трехвалентного мышьяка, и ряд металлоорганических соединений.
Существует три теории механизма действия, которые необходимо рассматривать в совокупности.
1. Механизм действия ипритов основан на вытеснении молекулой яда водородных групп у атома азота азотистых оснований нуклеопротеидов (нуклеотическое действие).
Как известно, дезоксирибонуклеиновая кислота (ДНК) представляет собой цепь дезоксирибонуклеотидов, которые в свою очередь, состоят из пентозного сахара, остатка фосфорной кислоты и азотистого основания. Согласно многочисленным исследованиям, наибольший интерес представляет реакция ипритов с азотистыми основаниями ДНК (аденин-тимин, гуанин-цитозин). Алкилирующие вещества охотнее всего вступают в реакцию с гуанином. Алкилирование гуанина приводит к появлению неустойчивого четвертичного азота. В результате сахарно-фосфорно-азотистый каркас ДНК распадается, что приводит к деполимеризации нуклеопротеидов.
2. Механизм действия основан на внутриклеточной активизации молекулы иприта с образованием в клетке ониевых соединений и в последующем активных радикалов (лучеподобное действие) [Родневич].
При исследовании гидролиза иприта было показано, что в начале гид
ролиза образуются так называемые ониевые соединения (ониевые ионы). Сернистый иприт при гидролизе образует сульфониевые ионы, а азотистый иприт этиленимониевые ионы. Эти ионы обладают большой реакционной способностью, благодаря чему их сравнивают с продуктами радиолиза воды. Ониевые ионы могут вступать во взаимодействие с азотом пуринового ядра аденина и гуанина, входящих в структуру нуклеиновых кислот, и алкилировать их и даже «сшивать» цепи нуклеиновых кислот. В результате этого взаимодействия весьма существенно расстраивается функционирование нуклеиновых кислот, что приводит к нарушению синтеза белка, и к подавлению регенерации тканей. Следствием повреждения ДНК является нарушение хромосомного аппарата, и изменение наследственных признаков.
Кроме того, ониевые кислоты могут вызывать появление ионов Н, ОН, НО2, которые также весьма реакционноспособны и оказывают действие на клетки тканей, которое напоминает повреждающее действие ионизирующих излучений.
Однако, между действием ипритов и проникающей радиацией имеются существенные отличия. Р.К. Лякявичус (1967) приводит данные, показывающие, что ядра клеток более чувствительны к иприту, чем к проникающей радиации.
При воздействии проникающей радиации на ядра клеток наблюдаются и хромосомные, и хроматидные аберрации. При действии ипритов наблюдаются только хроматидные аберрации. Цитогенетические эффекты ипритов наблюдаются не ранее, чем через 8 часов, а при облучении они обнаруживаются почти сразу. Кислород не отягощает интоксикации алкилирующими соединениями, а при воздействии ионизирующего излучения количество аберраций в присутствии кислорода возрастает.
3. Теория мостиковых связей (аллергогенное действие). Механизм действия основан на блокировании полипептидной цепи ипритным «замком».
Иприты с двумя или тремя хлорэтильными радикалами более активны. чем с одним хлорэтильным радикалом. Следовательно, бифункциональные иприты взаимодействуют с метаболитом двумя концами своей молекулы, как бы сшивая метаболит, как бы запирая на «замок», образуя мостиковую связь в полипептидном стержне или в нуклеотиде. Имеет место полимеризация ипритных молекул после соединения их с белками. Понятно, что такие белки будут лишены своих реакционных способностей и, по-видимому, они-то и становятся аутоантигенами, определяя некоторые аллергические эффекты ипритов.
Варианты повреждения ДНК ипритом:
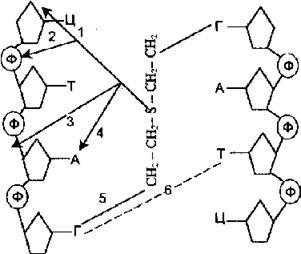
1. Отщепление азотистых оснований.
2. Взаимодействие с остатком фосфорной кислоты.
3. Разрыв цепи ДНК.
4. Взаимодействие с азотистыми основаниями.
5. Сшивание 2-х спиральной цепи ДНК.
6. Ошибка спаривания азотистых оснований.
Действие ипритов на ДНК ведет к токсигенетическим нарушениям, что проявляется:
1) нарушение митозов (цитостатическое действие);
2) нарушение синтеза белков и ферментов;
3) злокачественным повреждением клеток (бластомогенное действие);
4) нарушение развития эмбрионов и плода (тератогенное действие);
5) нарушением иммунитета;
6) нарушением генетических признаков клеток (мутагенное действие).
Особенности механизма действия алкилирующих ядов
с избирательным действием (люизит)
В лабораториях Питерса (Англия) и А.И. Черкеса (Киев) было показано. что соединения с трехвалентным мышьяком охотно вступают в реакцию со свободными аминокислотами, имеющими сульфгидрильные группы (цистеин):
Однако более устойчивую связь трехвалентный мышьяк образует с полипептидами:
Проникая в ткани, люизит повреждает те ферментные системы, которые богаты тиоловыми группами. Наиболее ранимой оказалась пируватокси дазная система, в которую входит липоевая кислота, имеющая две тиоловые группы.
По мнению Питерса (1963). А. И. Черкеса (1964), дигидролипоевая кислота, является первичным объектом воздействия группы тиоловых ядов. Гидролазы (в том числе и холинэстеразы), оксидазы (пируватоксидазная система) и дегидрогеназы, ряд ферментов АТФ, наконец, холинорецепторы содержат тиоловые группы и могут повреждаться при проникновении в ткани люизита.
Кроме того при действии тиоловых ядов отмечается отсутствие лучеподобного действия.
Влияние алкилирующих соединений на ядра клеток. Мишени алкилирующих соединений
Токсичность карбаматов. Алкилирующие соединения
Острая токсичность различных карбаматов варьирует от высокотоксичных до слаботоксичных и практически нетоксичных. Для крыс LD50 составляет от менее 1 до 100 и 1000 мг/кг массы тела. Для некоторых метилсодержащих карбаматов величина LD50 в 20 раз выше, чем эффективная доза. Это означает, что ранние симптомы отравления могут проявляться до абсорбции летальной дозы.
Нафтиловые (севин и др.) и крезиловые (дикрезил и др.) эфиры метилкарбаминовой кислоты менее токсичны для теплокровных животных, чем производные метил- и диметилкарбаминовых кислот, в молекуле которых содержатся гетероциклические радикалы (пиролан и др).
Острая, дермальная токсичность карбаматов характеризовалась в основном слабой и средней выраженностью. Исключение составил высокоопасный препарат алдикарб.
Карбаматы легко проникают через неповрежденную кожу, слизистые оболочки, дыхательные пути и пищеварительный тракт. Как правило, метаболиты менее токсичны по сравнению с исходным карбаматом. Инсектициды - производные метил- и диметилкарбаминовой кислоты - подвергаются окислению либо гидролизуются и выводятся из организма в виде парных соединений с серной и глюкуроновой кислотами. Первый этап метаболизма карбаматов — гидролиз с переходом в карбаминовую кислоту, которая распадается на двуокись углерода (С02) и соответствующие амины.
N-метиловые карбаматы проходят через изоционаты сразу, в то время как гидролизе N-диметиловых соединений промежуточный продукт вместе с ионом гидроксила образует спирт и N-диметилзамещенную кислоту.
Реакции окисления (при участии оксидаз смешанной функции) включают гидроксилирование ароматического кольца, О-деалкилирование, N-метилгидроксилирование, N-диалкилирование, окисление алифатических групп в цепи, сульфоксидацию в соответствующие сульфоны. Конъюгирование в организме млекопитающих приводит к образованию О- и N-глюкуронидов, сульфатов и производных меркаптуровой кислоты.
Производные карбаминовой кислоты слабо аккумулируются в тканях животных. Остатки карбаматов определяются в печени, почках, мозге, жировых и мышечных тканях. Период полураспада в организме крыс составляет 3—8 ч. Выделяются в основном с мочой и фекалиями.

Алкилирующие соединения
Алкилированием в органической химии называют реакции, сопровождающиеся введением алкильного радикала в структуру нуклеофильных реагентов. К последним относят амины, меркаптаны, спирты, нуклеиновые основания и другие соединения.
Типичными алкилирующими соединениями являются галоидные алкилы (йодистый метил, бромистый метил и др.), реакцию которых с нуклеофильными реагентами, например с меркаптанами и аминами, описывают уравнениями 1 и 2:
RX + HSR6' -> RSR + ХН. (1)
RX + H2NR' -> RNH-R + ХН, (2)
Реакционная способность олефинов зависит от электронного и пространственного влияния заместителей у атомов углерода, находящихся в сопряжении с кратными связями. Индукционные и мезомерные эффекты заместителей у атомов углерода в олефинах влияют на степень поляризации кратных связей, что определяет реакционную способность соединений и механизмы реакции. Этим можно объяснить, почему "несимметричные" алкены, как правило, более реакционноспособны, чем их симметричные аналоги. Например, изобутилен более реакционноспособен по отношению к нуклеофильным реагентам, чем бутен-2 (симметричный изомер). Природа заместителей также влияет на направление атаки нуклеофила и состав продуктов реакции. Так, при реакции изобутилена с нуклеофильным реагентом, имеющим подвижный атом водорода (H-Nu), нуклеофильная группа присоединяется к наиболее гидрированному атому углерода (правило Марковникова).
Аналогично реакции с акролеином (уравнение 5) реакция нуклеофильного реагента с перфторизобутиленом (ПФИ) также проходит "против" правила Марковникова.
Приведенные примеры свидетельствуют о значимости понимания механизмов и скоростей реакций алкилирующих соединений с нуклеофильными реагентами. В соответствии с этими представлениями становится понятным, почему ПФИ обладает высокой реакционной способностью по отношению к нуклеофильным группам биомишеней и высокой физиологической активностью при ингаляции (LQ50 — 1,5 мг-мин/л).
К алкилирующим агентам относятся также соединения, содержащие активированные кратные связи, в частности раздражающие вещества, такие как акролеин, хлорацетофенон, вещества "CS", "CR" и др.
В указанных выше реакциях в качестве нуклеофильных реагентов использовались соединения, содержащие подвижный атом водорода. В таких случаях реакции алкилирования формально можно рассматривать как реакции замещения атома водорода в нуклеофильном реагенте на алкильный радикал.
Подобные реакции возможны при алкилировании нуклеиновых основаии ипритами и другими алкилирующими агентами, что является причиной мутаций.
В организме эти реакции, катализирующиеся ферментами из класса трансфераз, играют важную роль при защите организма от чужеродных веществ в результате образования ониевых соединений, растворимых в воде.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Местное действие алкилирующих соединений. Общерезорбтивное действие алкилирующих соединений
Различают местное, рефлекторное и общерезорбтивное действие алкилирующих соединений. При количественной оценке местного и рефлекторного действия обычно используют концентрационные характеристики токсического действия. Общерезорбтивное действие оценивают, как правило, величинами токсических доз (при относительно коротких экспозициях — минуты, десятки минут).
Местное действие алкилирующих соединений проявляется в развитии патологических процессов в местах их нанесения (аппликация). При этом типичны поражения ипритом кожи, слизистых оболочек глаз и верхних дыхательных путей.
Эпидермис кожи человека — сложная биомембрана гетерогенного строения. Гидратированные волокна альфа-спиралей белка кератина чередуются с липидным матриксом эпидермиса. Вещества, хорошо растворяющиеся в липидах (иприты и др.), быстро (минуты) поступают в верхние слои эпидермиса и сальные железы. Накопление вещества в базальных клетках проходит медленнее.
В соответствии с законом Фика скорость поступления них зависит от концентрации вещества в эпидермисе и степени сродства вещества к структурным элементам рогового слоя эпидермиса человека, что в общем виде пропорционально коэффициенту распределения вещества в системе липид — вода (lg P по подходам Ганга). В этом отношении наибольшую опасность представляют случаи, когда липидофильные алкилирующие соединения попадают на значительную площадь кожи и в большом количестве. По мере поступления вещества в базальные клетки эпидермиса происходит их поражение.
Иприты и их аналоги ингибируют ферменты углеводного обмена (гексокиназу, НАД и др.), блокируя гликолиз и процессы тканевого дыхания в клетках, вызывают мутации хромосом ядер базальных клеток, нарушая их митозы. Клетки базального слоя эпидермиса кожи гибнут. Гибнут также клетки эндотелия кровеносных капилляров эпидермиса под базальной мембраной. Жидкая часть крови (плазма) поступает в пространство между базальным и роговым слоем, на коже образуются "пузыри", характерные для действия ипритов и других алкилирующих соединений' на кожу человека.

Общерезорбтивное действие алкилирующих соединений
Иприты и другие алкилирующие соединения поступают в ткани внутренних органов с кровью через органы дыхания, кожу, слизистые оболочки глаз, верхних дыхательных путей и ЖКТ. Наибольшую опасность представляет поступление ОВ через органы дыхания ингаляционным путем.
При поступлении паров и мелкодисперсного аэрозоля (частицы размером 5—10 мкм и менее) в органы дыхания алкилирующие соединения проникают через стенки альвеол на большой поверхности («70—100 м2) и быстро поступают в кровь через легочные капилляры. С артериальной кровью вещество в доли секунд поступает в сердце, а затем в ткани внутренних органов.
При проникновении в клетки тканей внутренних органов иприты и другие алкилирующие соединения нарушают процессы тканевого дыхания (ингибируя гексокиназу и другие ферменты углеводного обмена) и вызывают нарушение генетического аппарата клеток.
Клетки, подвергшиеся воздействию ипритов и других алкилирующих соединений, оказывающих мутагенное действие, имеют системы защиты генетического аппарата на молекулярном уровне в виде так называемых репарационных процессов. В ходе этих процессов, направленных на восстановление первичного генетического материала, "специфические" ферменты (они разные в клетках различных организмов) вырезают "поврежденные" фрагменты и восстанавливают структуру ДНК и РНК. Это требует определенного времени.
Если скорость репарационных процессов оказывается меньше скорости деления клеток, то возникшие мутации приводят к тяжелым последствиям. Клетка с поврежденным генетическим аппаратом не может делиться либо дочерние клетки становятся нежизнеспособными. Вот почему при общерезорбтивном действии ипритов и других алкилирующих соединений в первую очередь страдают клетки тех тканей и органов.
Вместе с тем способность аналогов ипритов и других алкилирующих соединений вызывать хромосомные мутации и гибель быстроделящихся клеток используют химики и фармакологи при создании противоопухолевых препаратов.
Наиболее типичными представителями алкилирующих соединений являются иприты, применяемые в качестве боевых отравляющих веществ.
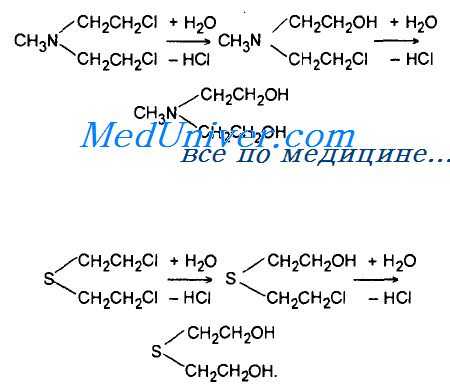
Рассмотрим в качестве примера механизм гидролиза аналога азотистого иприта — бис(2-хлорэтил)метиламина — "эмбихина". Эти реакции можно рассматривать как реакции нуклеофильного замещения у атома углерода, находящегося в р-положении к атому азота (или серы) по типу SN2-механизма. Скорость гидролиза растворенного иприта при избытке воды высокая: среднее время гидролиза иприта при 25 С — 8,5 мин в дистиллированной воде и 60 мин в морской. Высокая гидролитическая устойчивость иприта связана не с низкой реакционной способностью растворенного иприта, а с его низкой растворимостью в воде (0,07 %).
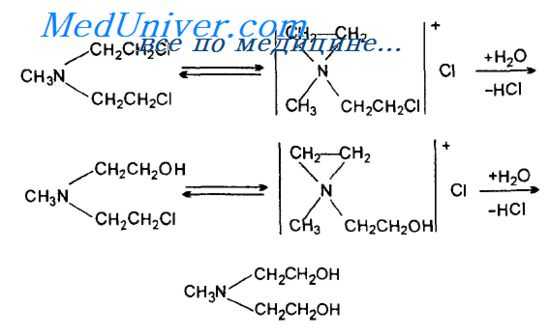
Изучение механизмов реакции показало, что гидролиз аналога азотистого иприта эмбихина проходит через образование промежуточных этйлениминовых структур, которые взаимодействуют с водой при большой скорости:
В данном случае отмечается SN1-механизм, при котором образование этиленаммониевых структур является стадией, определяющей скорость реакции. Аналогичным образом установлена возможность образования этиленнсульфониевых структур и в случае серного иприта.
Образование подобных структур зависит от электронных и пространственных эффектов других заместителей у атома азота (серы), что определяет филирующие свойства подобных соединений.
Накопленные в середине 50-х годов данные о высокой реакционной способности структур, содержащих этилениминные группы, были использованы при синтезе противоопухолевых препаратов.
Выше были рассмотрены основные типы алкилирующих соединений и взаимодействие их с нуклеофильными реагентами. Скорость подобных реакций различается на порядки в зависимости от строения алкилирующих соединений, нуклеофильных реагентов и условий реакции (температура, рН, природа растворителя и другие факторы). Исследованию этих процессов посвящены многие работы в области химии и токсикологии алкилирующих соединений.
Мишени алкилирующих соединений
Под биохимическими мишенями в токсикологии обычно понимают молекулярные структуры — ферменты, рецепторы.
Основные биомишени алкилирующих соединений — аминокислоты, пептиды, белки, нуклеиновые кислоты, липиды и другие биологически важные соединения. Помимо взаимодействия с нуклеофильными группами активных центров, алкилирующие соединения реагируют с группами, не входящими в активные центры ферментов, но имеющие важное значение в поддержании третичной и четвертичной структуры белков. Так, установлено, что с одной молекулой папаина реагирует 17 молекул иприта, из которых большинство реагируют вне активного центра фермента.
При взаимодействии ипритов и других алкилирующих соединений с нуклеиновыми кислотами возможно алкилирование нуклеиновых (как правило, пуриновых) оснований с образованием ониевых соединений. Молекула гуанина алкилируется по атому азота в положении 7 с образованием четвертичного заряженного соединения. В последующем имеет место разрыв N-гликозидной связи с депуринизацией нуклеотида.
В этом состоит молекулярный механизм мутации при действии ипритов, диметилсульфата и других алкилирующих соединений. "Выпавшее" из молекулы ДНК в результате алкилирования пуриновое основание может замещаться другим основанием ("точечная мутация"), что проявляется при репликации и транскрипции НК. В клетках существуют системы ферментативных процессов (ДНК-полимеразы, лигазы и др.), направленные на восстановление нативных молекул НК. В том случае, если одновременно имеет место алкилирование двух нуклеиновых оснований, расположенных рядом (либо одно над другим в одной цепи ДНК, либо в противоположных цепях ДНК), то в результате их алкилирования и последующей депуринизации образуются более серьезные дефекты в двойной спирали ДНК, восстановление которых в ходе репарационных процессов затруднено. Вот почему бис-алкилирующие соединения (иприты и их аналоги, соединения типа ТЭФ и др.) обладают более выраженными мутагенными свойствами.
Помимо взаимодействия с нуклеиновыми основаниями, важную роль играют взаимодействия иприта с ферментами углеводного обмена, коферментами дегидрогеназ (НАД, НАДФ и др.), гексокиназой и другими ферментами, что приводит к блокаде гликолиза.
Биомишени, на которые направлено действие алкилирующих соединений, находятся в разных тканях, расположенных на различных стадиях контакта с веществом и проникновения его в организм, что в совокупности со свойствами веществ важно при формировании "биоответа" в виде функциональных нарушений организма и симптомов интоксикации.
Алкилирующие средства
Одними из первых в качестве противоопухолевых средств стали применять производные бис-(бета-хлорэтил)амина.
Поводом к использованию этих соединений послужили данные, полученные в 40-х годах XX в. во время второй мировой войны, когда подробно изучалось влияние на организм боевых отравляющих веществ: иприта (или бис-бета-хлорэтилсульфида) и азотистого иприта (или трихлорэтиламина). Уже ранее, в 1919 г., установили, что азотистый иприт вызывает выраженную лейкопению и аплазию костного мозга. Дальнейшие исследования показали, что азотистый иприт оказывает специфическое цитотоксическое влияние на лимфоидные ткани и обладает противоопухолевой активностью при лимфосаркоме у мышей. Клинические испытания трихлорэтиламина были начаты в 1942 г., что явилось началом эры современной химиотерапии опухолей.
В настоящее время в медицинской практике используются менее токсичные производные бис-(бета-хлорэтил)амина (сарколизин, хлорамбуцил, циклофосфамид, эмбихин и др.). Вслед за бис-(бета-хлорэтил)аминами были получены цитостатические алкилирующие соединения других химических групп: этиленимины и этилендиамины (тиофосфамид), алкилированные сульфонаты, производные метансульфоновой кислоты (бусульфан), триазены, препараты платины, нитрозомочевины (ломустин, кармустин, фотемустин, нитрозометилмочевина) и др.
В основе механизма действия алкилирующих веществ лежит образование в нейтральных или щелочных растворах высокореактивных четвертичных аммониевых (или им подобных) катионов, образующих ковалентные связи с нуклеофильными соединениями, в т.ч. с такими биологически важными группами, как фосфатные, аминные, сульфгидрильные, имидазольные и др. Цитотоксическое действие алкилирующих соединений обусловлено, в первую очередь, алкилированием структурных элементов ДНК (пуринов, пиримидинов) и РНК (в меньшей степени), в результате чего нарушается стабильность, вязкость, целостность нитей ДНК и РНК, жизнедеятельность клеток, блокируется участие различных групп в метаболических реакциях, нарушается митотическое деление и репликация клеток. Клетки при воздействии алкилирующих соединений останавливаются в G1 фазе и не входят в S-фазу. Высокой чувствительностью к этим веществам обладают ядра клеток гиперплазированных (опухолевых) тканей и лимфоидной ткани.
Большая часть хлорэтиламинов применяется при гемобластозах (лимфогранулематоз, лимфо- и ретикулосаркома, хроническая лейкемия). Одним из первых препаратов данной группы, синтезированных на заре химиотерапии, является сарколизин, который активно использовался в 60-х годах прошлого века при метастатической семиноме, саркоме Юинга, миеломной болезни, лимфо- и ретикулосаркомах. В настоящее время из группы хлорэтиламинов наиболее широко применяются циклофосфамид и ифосфамид. Эти лекарственные средства нашли свое место при ряде солидных новообразований — раке яичника, молочной железы, саркомах мягких тканей, мелкоклеточном раке легкого. Циклофосфамид используется также при гемобластозах — остром лимфолейкозе, множественной миеломе.
Этиленимины (тиотепа, дипин, бензотэф, Имифос и др.) по механизму действия близки к производным бис-(бета-хлорэтил)амина. Они блокируют митотическое деление клеток, образуя поперечные связи между цепями молекулы ДНК, что препятствует ее репликации. Область применения этих лекарственных средств в связи с появлением новых противоопухолевых препаратов несколько сократилась. Уже вышли из клинической практики отдельные препараты этой группы — тиодипин и дийодбензотэф. В настоящее время из производных этиленимина в основном используется тиотепа.
Механизм противоопухолевого действия производных платины (карбоплатин, цисплатин) связан со способностью к бифункциональному алкилированию нитей ДНК, ведущему к длительному подавлению биосинтеза нуклеиновых кислот и гибели клеток.
Производные платины не обладают специфичностью в отношении клеточного цикла, действуют в фазе G0, на первом этапе тормозят синтез ДНК, РНК и белка, а на втором образуются метаболические продукты, действующие только на синтез ДНК.
Появление платиновых производных в конце 70-х годов прошлого века значительно изменило представление о возможностях химиотерапии злокачественных новообразований.
Лекарственные средства из группы производных нитрозомочевины также обладают широким спектром цитотоксической активности. Противоопухолевый эффект (цикло- и фазонеспецифичный) обусловлен переносом алкильных групп на нуклеофильные центры ДНК, РНК, белков и алкилированием их молекул, что приводит к гибели опухолевой клетки. Отличительной особенностью препаратов данной группы является их способность проходить через ГЭБ и отсутствие перекрестной резистентности с производными хлорэтиламинов и этилениминов. Они эффективны при первичных и метастатических опухолях головного и спинного мозга.
Производные метансульфоновой кислоты (бусульфан и др.), применяемые при обострениях хронического миелолейкоза, подвергаются внутримолекулярной циклизации с образованием иона этиленимина, способного прямо или через образование карбокатиона переносить алкильную группу на клеточные структуры. Действуют в первой половине фазы G1, в начале и в конце S и G2 фаз, синхронизируя фазы клеточного цикла раковых клеток. Высокореактивные группы бусульфана образуют с нуклеофильными центрами ДНК и РНК прочные ковалентные связи. При этом сшиваются витки и спирали ДНК, утрачивается возможность ее репликации, происходят разрывы цепей, наступают митотические блоки, учащаются мутации.
Наряду со специфическим тормозящим влиянием на опухоли, алкилирующие соединения, как и другие противоопухолевые средства, действуют на другие ткани и системы организма, что обусловливает их побочные эффекты. Одним из основных побочных эффектов является угнетающее влияние на кроветворение в результате взаимодействия с нуклеопротеидами клеточных ядер кроветворных тканей. Возникает лейкопения, тромбоцитопения, анемия, что требует специального внимания и точного регулирования доз и режима применения препаратов. С целью повышения эффективности и переносимости противоопухолевых препаратов используют дополнительные лекарственные средства. Так для стимуляции кроветворения применяют цитокины — гранулоцитарно-макрофагальный и гранулоцитарный колониестимулирующие факторы (филграстим, молграмостим), а также ряд интерлейкинов и эритропоэтин. Необходимо учитывать, что угнетение гемопоэза усиливается при комбинированных схемах лечения — сочетании нескольких противоопухолевых препаратов, лучевой терапии и др.
При применении хлорэтиламинов, платиновых производных часто наблюдается тошнота, рвота, потеря аппетита, диарея. Для купирования данных эффектов используют антагонисты серотониновых 5-HT3рецепторов и блокаторы дофаминовых D2рецепторов. При попадании на кожу и слизистые оболочки возможно раздражающее действие и развитие абсцессов, при введении растворов под кожу возможна некротизация тканей.
Одной из характерных особенностей противоопухолевых препаратов является их иммунодепрессивное действие, которое может ослабить защитные силы организма и облегчить развитие инфекционных осложнений. Для предупреждения возможных инфекций, обусловленных подавлением иммунитета, возможно использование антибиотиков.
Следует отметить, что применение алкилирующих соединений, как и других противоопухолевых препаратов, осуществляется только по назначению врача-онколога и в специализированном лечебном учреждении. В зависимости от особенностей заболевания, его течения, эффективности и переносимости применяемых противоопухолевых препаратов могут меняться схема их применения, дозы, сочетание с другими препаратами.
Читайте также:
- Сопряженные функции сосудов. Резистентная функция сосудов. Емкостная функция сосудов. Обменная функция сосудов.
- Рекомендации для раннего обнаружения сахарного диабета.
- Семиотика в стоматологии. Симптомы и синдромы стоматологических заболеваний
- Лучевая диагностика оссификации желтой связки
- Лампэктомия (широкое иссечение) молочной железы
