Влияние тетраэтилсвинца на микроциркуляцию глаза
Добавил пользователь Алексей Ф. Обновлено: 09.01.2026
Цель: изучение нового, почти не освещенного в литературе, вопроса, касающегося характера поражения органа зрения тетраэтилсвинцом.
1. Тетраэтилсвинец – мощный антидетонатор, широко применяющийся в народном хозяйстве. При изучении токсических свойств ТЭС не исследованным оставался вопрос о характере его влияния на орган зрения.
2. В результате многолетних клинических наблюдений и экспериментальных исследований нами впервые установлено, что ТЭС обусловливает развитие своеобразной формы глаукомы. При поражении ТЭС глаукома развивается как один из симптомов общей интоксикации, поэтому является токсической глаукомой.
3. У наблюдаемых 1-5 лет 563 человек, в возрасте 20-50 лет, бывших в контакте с ТЭС от года до 25 лет, были установлены изменения в общем состоянии организма. Различные сосудистые нарушения имелись у 34,6% обследованных. По данным ЭКГ, изменения ритма сердечной детальности установлены у 45 из 58 человек. Из 131 обследуемого кислотность желудочного содержимого была повышена у 38,2%, снижение ее и ахилия наблюдалась у 25,2%. Язвенная болезнь желудка и двенадцатиперстной кишки выявлена у 12 из 563 человек. Гликемические кривые ирритативного типа с замедленной гипогликемической фазой были у 66 из 82 человек. Полученные нами данные дополняют клинику ТЭС интоксикации новыми сведениями.
4. Подозрение на глаукому определялось у 218 из 563 человек (38,7%). Профилактическими обследованиями на протяжение пяти лет наблюдения установлена зависимость нарушения регуляции офтальмотонуса от времени пребывания в контакте с ТЭС и от степени поражения им. Изменения в регуляции офтальмотонуса наблюдались у 23,9% лиц, находившихся в контакте с ТЭС до года, у 39,6% со сроком 3-5 лет и у 49,4%, бывших в контакте 6-20 лет и больше. Регуляция офтальмотонуса была нарушена у 66,9% лиц с хронической ТЭС интоксикацией и у 29,9% лиц, у которых интоксикации установлено не было. Зависимость установленных изменений в характере ЭК подтверждена данными статистического анализа.
5. При обследовании в стационаре методом динамического исследования регуляции офтальмотонуса у 88 из 130 наблюдавшихся лиц диагностирована начальная, либо развития, компенсированная, субкомпенсированная и декомпенсированная токсическая глаукома. У 20 человек был оставлен диагноз подозрения на глаукому.
6. Характер развития токсической глаукомы зависит от общего состояния здоровья лиц, находившихся в контакте с ТЭС. Обострение интоксикации усугубляет нарушение регуляции офтальмотонуса. Разобщение контакта и общеукрепляющее лечение благоприятно влияют на течение токсической ТЭС глаукомы. Пилокарпин при ТЭС интоксикации оказывает слабое влияние на регуляцию офтальмотонуса.
7. Изменения в регуляции офтальмотонуса при ТЭС интоксикации стойкие. Токсическая глаукома у 53 человек прослежена на протяжении 3-5 лет. Выраженного характера нарушения в регуляции внутриглазного давления наблюдались даже спустя 1-2 года после полного прекращения контакта с ТЭС.
8. ТЭС при общем характере действия поражает сосуды глаза. При обследовании 563 человек сужение сосудов сетчатки установлено у 11,0%, расширение физиологической экскавации и перемещение сосудистого пучка в темпоральную сторону – у 21%, отек сетчатки – у 1,9%. Отечного характера кольцевидные ангиоскотомы имелись у 43 из 65 обследованных. Доказательством зависимости сосудистых расстройств в глазу от ТЭС интоксикации является частое развитие их у лиц, длительно находившихся в контакте с ТЭС, и при наличии токсической глаукомы.
9. ТЭС обусловливает повышение давления в центральной артерии сетчатки. В среднем оно равнялось 50,8 (±9,05) мм. При среднем уровне офтальмотонуса 25,5 (±3,59) мм разница обоих давлений была высокая – 25,3 (±7,88) мм. Большая разница давлений обеспечивала нормальный баланс питания сетчатки. Повышение давления в центральной артерии сетчатки являлось проявлением местной гипертензии.
10. В результате нарушения кровообращения в сосудах глаза и расстройства регуляции офтальмотонуса при сроке наблюдения 3-5 лет снижение остроты зрения было отмечено у 27 человек (4,8%) и сужение периферических границ поля зрения – у 22 человек (4,0%). У 11 человек с токсической глаукомой наблюдалось развитие гиперметропии (0,5-2,0 диоптрии).
11. При помощи разработанного нами метода хронического поражения животных ТЭС впервые получена модель токсической ТЭС глаукомы. Экспериментальные исследования велись на 257 животных. В эксперименте у животных, как и в клинике у больных, нарушение регуляции офтальмотонуса явилось одним из проявлений общей ТЭС интоксикации.
12. У здоровых кроликов уровень офтальмотонуса не превышал 24,0 мм, колебания его составляли 1,0-4,0 мм. У тех же животных, подвергавшихся действию ТЭС, внутриглазное давление повышалось до 35,0 мм и больше, колебания его достигали 15,0-20,0 мм. Нарушения регуляции офтальмотонуса были стойкими и удерживались 4-6 месяцев после прекращения затравки животных.
13. У здоровых кроликов офтальмотонус и холинэстеразная активность сыворотки крови характеризуются постоянными величинами. Исследованием на 58 животных доказано, что под влиянием ТЭС активность холинэстеразы снижается, уровень офтальмотонуса повышается и суточные его колебания увеличиваются. Нарушения регуляции офтальмотонуса не находятся в прямой связи со степенью угнетения активности холинэстеразы.
14. ТЭС повышает проницаемость мембран глаза. Методом нефелометрического исследования на 43 животных установлено, что, в сравнении со здоровыми, у пораженных ТЭС животных повышается (на 47-79%) концентрация белка в камерной влаге. Количество белка во влаге глаз животных, пораженных ТЭС, зависит от степени интоксикации.
15. ТЭС обусловливает гиперсекрецию влаги и нарушает ее обмен. Методом аппланационной тонографии на 40 животных установлено, что, в сравнении со здоровыми, у пораженных ТЭС животных минутный объем камерной влаги в среднем повышается с 0,94 (±0,63) до 2,74 (±1,37) мм. Истинный уровень офтальмотонуса повышается в среднем с 10,7 (±3,0) до 12,2 (±2,5) мм. Секреция и обмен камерной влаги зависят от степени интоксикации.
16. Под влиянием ТЭС интоксикации нарушается реактивность нервнорефлекторного аппарата, регулирующего офтальмотонус. В сравнении с контролем, у животных, пораженных ТЭС, уровень офтальмотонуса под влиянием пилокарпина повышался в 33,0%, адреналина – в 27,3% и атропина – в 13,3% исследований. Сокращение подъема ЭК под влиянием пилокарпина было в 21,7%, адреналина – в 24,3% и атропина – в 31,7% исследований. Неадекватный характер реакций на пилокарпин и частое повышение офтальмотонуса под влиянием адреналина и атропина у пораженных ТЭС животных соответствует результатам исследования нагрузочно-разгрузочных проб у больных с начальной глаукомой.
17. Лабильность состояния внутриглазного давления, повышенное количество белка в водянистой влаге, сосудистые нарушения в глазу, жалобы больных и др. являются доказательством застойного характера установленной нами токсической ТЭС глаукомы.
18. Нарушение регуляции внутриглазного давления при наличии вегетативных расстройств, повышенное количество камерной влаги при отсутствии изменений в путях ее оттока и длительное сохранение зрительных функций и др. указывают на гиперсекреционный характер застойной токсической глаукомы, которая развивается при ТЭС интоксикации.
19. Впервые установленная нами токсическая ТЭС глаукома является вторым примером глаукомы с известной этиологией. В отличие от бенгальской, токсическая ТЭС глаукома развивается при наличии общих сосудисто-вегетативных нарушений в организме и при поражении нервнорефлекторного аппарата, регулирующего офтальмотонус.
20. В план общих профилактических мероприятий, направленных на предупреждение ТЭС интоксикации, должны быть включены разработанные нами предложения, необходимые для профилактики возможного развития токсической ТЭС глаукомы.
21. Развитие химической промышленности связано с освоением и внедрением в производство новых веществ. Характер их действия на орган зрения еще недостаточно изучен. Исследования, направленные на выявление химических факторов, способствующих развитию глаукомы, изучение характера их действия и профилактические мероприятия должны помочь в борьбе с таким тяжелым заболеванием, как глаукома, которая до настоящего времени является одной из главных причин слепоты и инвалидности.
Влияние тетраэтилсвинца на микроциркуляцию глаза
Поражение сетчатки, зрительного нерва тетраэтилсвинцом
При профосмотрах у лиц, подвергавшихся длительному воздействию даже малых концентраций тетраэтилсвинца в воздухе рабочих помещений, особенно у лиц с хронической интоксикацией ТЭС и у профинвалидов, наблюдался отек сетчатки, который был наиболее выражен в перипапиллярной зоне и в центральной ее части.
Характерно было расширение физиологической скотомы и ангиоскотом. Патологический характер скотом отмечался у лиц различного возраста и определялся на обоих глазах.
Методом флюоресцентной ангиографии в сосудах глазного дна выявлено замедление кровотока, т. е. увеличение времени прохождения флюоресцеина (рука—глазное дно). Диффузная ишемия собственно сосудистой оболочки обусловливала мозаичный характер флюоресценции.
В артериальной фазе вслед за медленным заполнением сосудов флюоресцеином отмечалась длительная флюоресценция их, что также указывало на ухудшение кровотока. Подобные изменения гемостаза наблюдались и в венозной фазе при дилатации и расширении венул. В артериальной и ранней венозной фазах обнаруживалась гиперфлюоресценция в парамакулярной и парапапиллярной областях сетчатки за счет экстравазального выхода флюоресцеина из капилляров, в поздней венозной фазе — длительная тотальная гиперфлюоресценция сетчатки вследствие повышения проницаемости сосудов и периваскулярного отека.
Данные ангиографических исследований указывают на застойные явления, главным образом в вепулах капиллярного звена микроциркуляторпого русла сетчатки собственно сосудистой оболочки [Гогитта И. Ф.].
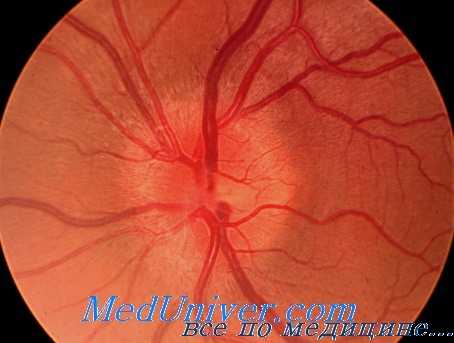
Поражение тетраэтилсвинцом зрительных нервов оценивается неоднозначно. М. Duvoir и F. Coste в начальном периоде поражения животных ТЭС наблюдали расширение сосудов сетчатки и гиперемию дисков зрительного нерва. Но мере развития интоксикации наступали сужение сосудов и побледнение дисков.
А. Е. Корелюк отрицал возможность поражения тетраэтилсвинцом зрительного нерва. Р. Н. Вольфовская сообщила о больном с поражением зрительного нерва после интоксикации ТЭС. Э. М. Бонгард и соавт. у лиц с хронической интоксикацией ТЭС наблюдали снижение темновой адаптации и повышение порога электрической чувствительности.
Н. Д. Мельникова отметила сужение хроматических, а у ряда лиц — и ахроматических границ поля зрения, сочетавшееся со снижением темновой адаптации. Е. Noda сообщил, что после употребления воды из колодца, вода в котором была отравлена ТЭС, больные жаловались на снижение зрения.
На возможность поражения тетраэтилсвинцом зрительного нерва указывают Ц. М. Иоффе и Ю. Д. Каплан. В начальном периоде действия ТЭС мы наблюдали у отдельных лиц гиперемию дисков зрительных нервов [Скрипниченко З. М.]. При наличия хронической интоксикации ТЭС нечасто, но все же имело место побледнение дисков зрительных нервов и нечеткость контуров их, что объяснялось сужением сосудов сетчатки и отеком ее, И. Ф. Гогина при тяжелой интоксикации ТЭС с перенесенным в прошлом острым отравлением диагностировала двустороннюю неропатию в 1,6% и атрофию зрительного нерва — в 2,4% случаев.
Стушеванность границ диска зрительного нерва за счет периианиллярного отека сетчатки в зоне капиллярного кровотока выявлена у 46,4%, макулярный отек сетчатки той же природы— у 12,7% обследованных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Согласно исследованиям И. Ф. Гогиной, для хронической тетраэтилсвинцовой интоксикации характерны нарушения микроциркуляции в сосудах бульварной конъюнктивы (98,5%). Изменения проявляются в основном спазмом артериол (86,6%) и дилатацией венул (68,7%). Вследствие спастико-атонического состояния сосудов нарушается артериовеиозное соотношение (68,7%), часто наблюдается извитость сосудов (65,7%).
Внутриваскулярные изменения характеризуются крупнозернистым кровотоком, что объясняется гиперагрегацией эритроцитов в артериолах (40,2%) и фрагмептированием в венулах (59,7%). Периваскулярные изменения проявляются локальным отеком (81,7%).
У 11—15,4% лиц, преимущественно с большим стажем и наличием хронической интоксикации тетраэтилсвинцом, наблюдались циркуляторные расстройства в сосудах сетчатки. Из-за часто встречающегося спазма артериол (57%), дилатации и полнокровия венул (69,6%) нарушалось нормальное соотношение калибра артериол и венул (1:3 против 2:3 в тторме).
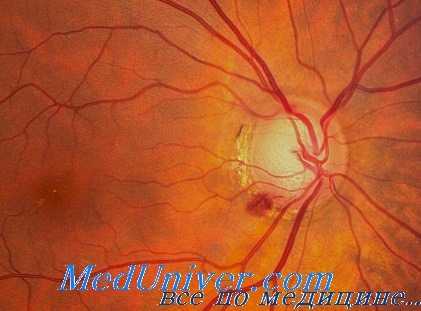
Резкий спазм обусловливал нарушение кровообращения в мелких сосудах, в которых отмечался прерывистый ток крови, либо наступал полный стаз. Калиброметрические исследования показали наличие достоверного сужения сосудов, диаметр которых составил 83,1±12,8 (в контрольной группе 89,8±12,3 мкм). Характерны были также чрезмерная извитость сосудов (44,7%) и ангиосклероз (27,8%) [Скрипниченко З. М., Рогина И. Ф.].
По сравнению с показателями здоровых людей у лиц, занимавшихся производством тетраэтилсвинца, артериальное давление в плечевой артерии было понижено.
Средний уровень диастолического давления центральной артерии сетчатки превышал показатели, полученные различными авторами при обследовании здоровых лиц [Котова Э. С, и др.]. Повышение давлении в центральной артерии сетчатки при пониженном давлении в плечевой артерии служило проявлением местной регионарной гипертензии. Повышение сетчато-плечевого коэффициента, свидетельствовавшее о регионарной гипертензии в сосудах сетчатки, подтверждало наличие вазомоторных расстройств и регионарной артериальной дистонии сосудов глазного дна.
По данным В. Е. Любомудрова, регионарная гипотония либо асимметрия показателей давления в височных артериях характерны для тетраэтилсвинцовой интоксикации и являются ранним признаком ее. Повышенное давление в центральной артерии сетчатки и обусловленная этим высокая разница по сравнению с офтальмотонусом создавали благоприятные условия для циркуляции крови и обмена в сосудах сетчатки. Высоким уровнем давления в цен тральной артерии сетчатки объясняется стабильное состояние зрительных функций в течение длительного времени у лиц повышением офтальмотонуса.
Влияние тетраэтилсвинца на внутриглазное давление
Наши представления о характере регуляции офтальмотонуса основаны на ежегодных профилактических обследованиях 563 рабочих на производстве ТЭС (в сравнении с показателями у 105 здоровых лиц) и дополнительном исследовании в стационаре 130 из 203 человек, прослеженных в динамике в течение 3—7 лет. Находившиеся под наблюдением были в возрасте 18—69 лет. По данным первичных профосмотров, офтальмотонус, уровень которого превышал норму и достигал 27—53 мм рт. ст., определялся у 10,7% лиц.
По сравнению с мужчинами у женщин нарушения регуляции офтальмотонуса наблюдалась чаще (соответственно в 23,2 и 9,7%).
Обследованные были разделены на возрастные группы от 21 года до 30 лет (241 человек), от 31 года до 40 лет (102) и от 41 года до 50 лет 150 (в последнюю группу вошло также 9 человек старше 50 лет). Частота повышения внутриглазного давления увеличивалась в соответствии с возрастом: офтальмотонус 27 мм рт. ст. и выше наблюдался соответственно в 8,о, 11,7 и 13,1% случаев. В соответствии с возрастом увеличивался срок пребывания рабочих в контакте с ТЭС, а также повышалась частота профессиональной интоксикации.
При анализе показателей уровня офтальмотонуса в зависимости от сроков пребывания в контакте с ТЭС установлено, что в соответствии с увеличением стажа возросло число лиц с повышенным внутриглазным давлением (с 0,9 до 14,1!%). Это указывает на прямую зависимость частоты нарушения регуляции офтальмотонуса от срока пребывания в контакте с ТЭС и от степени интоксикации.
Стационарным обследованиям было подвергнуто 130 человек с выявленным при профосмотрах нарушением регуляции внутриглазного давления. Это были преимущественно мужчины в возрасте моложе 40 лет со сроком пребывания в контакте с ТЭС 2— 24 года. Хроническая интоксикация и профиивалндность отмечены у 45%. Методами динамического исследования установлено, что у 108 из 130 человек регуляция офтальмотонуса была нарушена. Уровень его был высокий (27 — 54 мм рт. ст.), суточные колебания достигали 6—10 мм рт. ст.
У здоровых людей разница в уровне офтальмотонуса обоих глаз в основном не превышает 2 — 3 мм рт. ст. [Панина И. П. и др., Медковский М. М. и др.]. У рабочих с интоксикацией ТЭС эта разница достигала значительных величин. Повышение уровня офтальмотопуса наблюдалось в различное время суток и неодинаково проявлялось на парных глазах одного и того же человека. Суточные колебания внутриглазного давления были лишены закономерного ритма и отличались большой лабильностью.
Для определения стойкости этих нарушений и возможного влияния средств, понижающих офтальмотонус (пилокарпин, диакарб), были проанализированы результаты отдаленных наблюдений (от 3 до 7 лет) за 203 рабочими с различным производственным стажем. Ранее установленный факт зависимости частоты нарушения регуляции офтальмотопуса от срока и степени влияния ТЭС был подтвержден.
У 14 из 74 (18,9%) длительно наблюдавшихся преимущественно молодых людей со стажем до 5 лот установлены начальные признаки нарушения регуляции офтальмотонуса с повышением его.
Несмотря на молодой возраст и небольшой срок пребывания в контакте с ТЭС, при периодическом обследовании выявлены лица со значительно выраженным нарушением регуляции офтальмотонуса, уровень которого достигал 39,2—42,6 мм рт. ст.
Эти изменения проявлялись при общей интоксикации тетраэтилсвинцом, которая у отдельпых лиц диагностировалась в течение первых месяцев работы. У одного рабочего через 2 года обнаружена хроническая профессиональная интоксикация. Такой характер нарушения регуляции офтальмотонуса в начальном периоде работы указывает на повышенную чувствительность отдельных молодых людей к ТЭС. По данным динамических наблюдений, при большом стаже работы на производство ТЭС (6—10 и 11 —15 лет) выраженные нарушения в регуляции офтальмотонуса наблюдались соответственно у 31,4% и 30,6% обследованных.
Лиц с большим сроком пребывания в контакте с тетраэтилсвинцом, а также при наличии хронической интоксикации временно (на 2 мес в году) переводили на работы, исключающие влияние ТЭС и других токсических веществ. В профилактории им проводили антитоксическое н общеукрепляющее лечение, способствующее снятию интоксикации в начальном периоде ее проявления. В санатории и дома отдыха их направляли в первую очередь. Однако перерыв в работе с ТЭС и лечение не всегда способствовали восстановлению нормальной регуляции офтальмотонуса. Даже длительный (до 6 мес) перерыв в работе не был достаточным.
Значительно понизившееся после длительного отпуска впутриглазное давление вновь резко повышалось при возобновлении работы с ТЭС. Пилокарпин оказывал слабое, а чаще провоцирующее влияние на офтальмотонус.
Результаты динамических наблюдений позволили оценить влияние нарушений регуляции офтальмотонуса на состояние зрительных функций. У лиц, длительно находившихся в контакте с ТЭС, стойкое нарушение регуляции офтальмотонуса, сочетавшееся с выраженными сосудистыми и гемодинамическими расстройствами, обусловило некоторое снижение зрительных функций, что в сочетании с общими признаками поражения характеризует хроническую интоксикацию ТЭС.
Н. Д. Мельникова при профосмотрах рабочих на производстве тетраэтилсвинца повышение офтальмотонуса выявила у 12,5% лиц. Говоря о транзиторном характере повышения внутриглазного давления под влиянием ТЭС интоксикации, автор подчеркивает стойкость этих нарушений, которые были прослежены на протяжении 4 лет после прекращения контакта с ТЭС. При наблюдении в динамике у 25 человек (1—5 лет — 14 человек, 6—10 лет — 11), которые подверглись лечению по поводу периодически наступающих обострений хронической ТЭС интоксикации, диагностирована неустойчивость в регуляции офтальмотонуса с периодическими подъемами его.
У ряда больных нарушения в регуляции внутриглазного давления сохранялись длительное время даже после прекращения контакта с ТЭС: у 5 человек в течение 3—4, а у одного на протяжении 7 лет наблюдения офтальмотонус периодически повышался до 30—31 мм рт. ст.
У инвалидов по профессии II группы, несмотря на длительное (у 4 из 6 человек более 10—12 лет) отсутствие контакта с тетраэтилсвинцом, в период обострения интоксикации офтальмотонус повышался. Автор считает, что нарушение регуляции внутриглазного давления у лиц с хронической интоксикацией ТЭС и по профессии является стойким и наблюдается при обострении интоксикации в отдаленные сроки после прекращения контакта с ТЭС.
Учебное видео измерения внутриглазного давления - офтальмотонометрии
Кафедра глазных болезней ГБОУ ВПО "Кубанский государственный медицинский университет" Федерального агентства по здравоохранению и социальному развитию, Краснодар
Глазные симптомы при переднем и заднем шейном симпатическом синдроме
Журнал: Вестник офтальмологии. 2013;129(1): 67‑70
Лысенко О.И., Малышев А.В. Глазные симптомы при переднем и заднем шейном симпатическом синдроме. Вестник офтальмологии. 2013;129(1):67‑70.
Lysenko OI, Malyshev AV. Ocular signs in anterior and posterior cervical sympathetic syndrome. Vestnik Oftalmologii. 2013;129(1):67‑70. (In Russ.).
В обзоре представлены данные литературы об особенностях анатомического строения и морфологических изменениях шейного отдела позвоночника, приводящих к нарушению симпатической иннервации, снижению кровоснабжения и возникновению глазной симптоматики. Приведены результаты экспериментальных и клинических исследований о взаимосвязи раздражения симпатических шейных ганглиев и патологических процессов глазного яблока. Описываются клинические проявления изменения органа зрения, присутствующие в неврологической симптоматике при переднем и заднем шейном симпатическом синдроме.
Отличительной чертой жизни современного человека является гипокинезия. Уменьшение мышечных нагрузок, длительное вынужденное положение тела и головы приводят к детренированности мышц, ослаблению их рессорной функции, усилению нагрузки на межпозвоночные диски, суставы и связки. Заболевания центральной нервной системы вертеброгенного характера по распространенности среди населения в настоящее время уступают лишь острым респираторным заболеваниям. Болезни позвоночника встречаются у 60-90% населения старше 50 лет. Постоянно увеличивается число людей молодого возраста, страдающих данной патологией [9, 25, 30].
Нормально функционирующий позвоночник - естественная кинематическая цепь, состоящая из семи отдельных позвонков, сочленяющихся между собой с помощью межпозвоночных дисков, парных истинных суставов и связок. Возникновению глазной симптоматики способствуют анатомические особенности цервикального отдела. Это самая подвижная и наиболее уязвимая часть позвоночника, в норме описывает правильную дугу выпуклостью вперед - лордоз. Два верхних (вращательных) позвонка существенно отличаются от остальных (сгибательных).
I шейный позвонок - атлант - соединен с затылочной костью двумя суставами и удерживает на себе череп. II шейный позвонок имеет зубовидный отросток, направленный вверх, на него как бы «нанизан» атлант. Благодаря этому непарному суставу между атлантом и зубом II позвонка голова поворачивается в стороны. Остальные 5 шейных позвонков соединены между собой дисками и отростками. В обеспечении двигательной функции этой части позвоночника огромную роль играет также мышечный аппарат [10, 11, 20, 24, 44, 47, 48].
Все шейные позвонки (кроме VII) имеют в поперечных отростках отверстия, через которые проходят позвоночные артерии, сопровождающие их вены и нервы. А.а. vertebralis, являясь первой ветвью подключичных артерий, формируют основную артерию. Она составляет вертебрально-базилярную систему, питающую затылочные доли с центральным звеном зрительного анализатора, ствола головного мозга, ядрами и проводниками глазодвигательных, блоковидных, отводящих нервов и системой заднего продольного пучка, волокна которого обеспечивают совместную и одновременную работу глазодвигательных мышц [35, 37, 43].
Симпатический нервный ствол простирается от основания черепа до шейки I ребра, располагаясь позади сонных артерий на глубоких мышцах шеи. Это три симпатических ганглия: верхний шейный, средний шейный и нижний - шейно-грудной (звездчатый узел). От верхнего шейного ганглия отходит внутренний сонный нерв n. сaroticus internus, нижний шейный узел отдает позвоночный нерв n. vertebralis. Эти нервы сопровождают одноименные артерии, образуя вокруг них сплетения, поднимаются в полость черепа, где анастомозируют между собой и дают ветви к сосудам мозга. От ответвлений симпатического сплетения сонной артерии, верхнего шейного узла идут вазоконстрикторы к железам головы, в том числе и к слезной железе [8, 13, 24, 33, 36, 46].
В глазницу симпатические волокна попадают в виде периартериального сплетения глазной артерии, отдают корешок к ресничному узлу и в составе коротких ресничных нервов достигают глазного яблока. Шейные симпатические нервы связаны с гладкой мускулатурой орбиты, суживают просвет глазных артериол и расширяют зрачок. Периферический отдел парасимпатического пупилломоторного пути тянется от ядра n. ocolomotorius до сфинктера [1, 19, 41, 43].
Отверстия в поперечных отростках шейных позвонков достаточно узкие, сосудисто-нервный пучок тесно прилежит к костным стенкам. Поэтому при вращении головой, напряжении мышц шеи, органических изменениях в позвоночнике нервно-сосудистые образования могут подвергаться травматизации и деформации. Малейшее смещение шейного позвонка вызывает рефлекторный спазм позвоночной артерии, в дальнейшем и ее сдавливание. В процесс вовлекаются местные (шейные симпатические узлы и волокна) и общие (по типу рефлекторного вовлечения гипоталамических вегетативных центров) вегетативные образования. Патологическая афферентация, возникающая в области позвоночного нерва, по большому количеству анастомозов может распространяться и на периартериальные сплетения сонной и глазничной артерий, что приводит к появлению болей в орбите, глазных яблоках, снижению кровообращения в органе зрения [8, 10, 13, 22, 32].
Взаимосвязь между изменениями цервикального отдела и некоторой глазной патологией установлена при проведении экспериментальных и клинических исследований. В 1866 г. появилась печатная работа проф. Е.В. Адамюка «О влиянии симпатического нерва на внутриглазное давление», в которой глаукома рассматривалась как секреторный невроз, вызванный раздражением шейных симпатических узлов [1].
При изучении регуляторной роли центральной нервной системы и отдельных нервов, влияющих на глаз, советскими учеными было получено много ценных данных. В 20-х годах прошлого столетия В.П. Рощин подтвердил роль симпатической нервной системы в происхождении глаукомы [17]. Дальнейшие экспериментальные исследования, проведенные Л.С. Левиной (1941), А.Б. Десятниковым (1953), И.Ф. Синициным (1971), показали, что раздражение или экстирпация верхнего шейного симпатического ганглия приводит к колебаниям внутриглазного давления [2]. И.Б. Каплан и А.Т. Гуднева (1980) у 32% больных с внутриглазным давлением 27-33 мм рт.ст., путем лечения шейного отдела позвоночника добились его снижения до нормальных показателей [30]. А.М. Гринштейн (1957), Г.Н. Григорьев (1969), а также Д.И. Антонов (1970) указывали на встречающиеся иногда приступы одностороннего выпадения поля зрения или его части, сочетающиеся со спазмом артерии сетчатки при поражении шейных симпатических структур [2].
В середине прошлого столетия в зарубежной литературе также появились работы, посвященные клинике зрительных нарушений при окклюзиях интра- и экстракраниальных отделов позвоночных артерий Synonds, Mackenzie (1957), Hoyt (1959), Minoretal (1959), Kearns (1960). Зрительные расстройства связывались с ишемией коры затылочных долей, особенно их полюсов и областей, прилегающих к шпорной борозде [2, 40].
О зависимости зрительных нарушений от состояния позвоночника говорят изменения глазного дна, появляющиеся после воздействия на мышцы и связки шейного отдела. Во время растяжения по Бертши или при разгибании шеи у некоторых обследуемых отмечались изменения на глазном дне: расширение крупных вен, сужение артериальных стволиков или расширение артерий при неизмененном диаметре вен [30].
Г.П. Смолякова и соавт. (1988) установили, что при раздражении верхних шейных симпатических узлов появляются изменения, характерные для возрастной макулярной дегенерации. Э.С. Абдулаева (2002) зарегистрировала у пациентов при неэкссудативных формах макулодистрофии изменения кровотока в сифоне внутренней сонной и позвоночной артерий [14].
Швейцарский офтальмолог Иоганн Фридрих Горнер в 1869 г. описал передний шейный симпатический синдром как изменения лица на той стороне, где имеется недостаточность симпатической иннервации, вызванная патологическим процессом в области шеи или грудной клетки. Во Франции и Италии имя физиолога Клода Бернарда также связывают с данной патологией [1, 39].
Синдром Бернарда-Горнера бывает врожденным, приобретенным или ятрогенным. Причины развития такого симптомокомплекса многочисленны: оперативные манипуляции на симпатических узлах, опухолевые и воспалительные процессы шейного отдела позвоночника, спинного мозга, верхних сегментов грудной клетки, сирингомиелия, множественный склероз. Описаны случаи появления синдрома Горнера у лиц, ослабленных после острых инфекций, герпетических заболеваний, склеродермии; с улучшением общего состояния передний шейный симпатический синдром у этих пациентов полностью исчезал [1, 21, 27].
Триада Бернарда-Горнера - это совокупность симптоматики: птоз, миоз, энофтальм. Миоз образуется в связи с выключением m. dilatator pupillae, узкая глазная щель связана с симпатическим птозом, выключением мышцы Мюллера, а энофтальм - следствие выключения орбитальной мышцы Ландштрема. Из трех основных симптомов наиболее отчетливыми всегда являются миоз и птоз [1].
Синдром Горнера нередко осложняется рядом других болезненных состояний: гипотонией, обесцвечиванием радужки, катарактой, слезотечением, расширением конъюнктивальных и ретинальных сосудов. Иногда ко всему этому присоединяется потливость и гиперемия кожных покровов соответствующей половины лица [1, 22]. У детей отсутствие симпатической иннервации препятствует пигментации меланоцитов, находящихся в строме радужки, поэтому синдром Горнера может привести к гетерохромии [1, 38].
При переднем шейном симпатическом синдроме зрачковые реакции на свет и реакции на установку вблизи протекают так же, как и в норме, или могут быть даже несколько живее, но в меньшем объеме. Возвращение к исходному состоянию при этом происходит более замедленно [1, 18, 42].
Болевая зрачковая реакция в противоположность световой реакции и реакции на установку вблизи при синдроме Горнера уменьшается значительно, становится заметной только при сильном болевом раздражении [1, 8].
Опущение верхнего века может быть связано также с поражением n. оculomotorius. В таких случаях недостаточность иннервации сфинктера вызывает расширение зрачка. В реальной клинической работе такой птоз довольно легко отличить. Дополнительно к мидриазу при повреждении глазодвигательного нерва птоз более выраженный, может полностью закрывать весь глаз [1, 40, 42].
Задний шейный симпатический синдром описан французским невропатологом J. Barre в 1925 г., позднее более детально дополнен китайским врачом J. Lieo в 1928 г. Синонимами симптомокомплекса Баре-Льеу являются: синдром позвоночной артерии, шейная мигрень, синдром позвоночного нерва, неврит симпатического позвоночного нерва [5, 11, 15, 32].
Заболевание возникает, если происходит сдавление позвоночной артерии, ее симпатического сплетения при остеохондрозе, травме или опухоли в области шеи. Но первое место в патогенезе развития синдрома позвоночной артерии принадлежит разрастанию крючковидных отростков в направлении межпозвоночных отверстий и сужение последних. Другой причиной являются поражения и изменения самих позвоночных артерий: окклюзии, деформации, аномалии отхождения, расположения и вхождения. Задний шейный симпатический синдром приводит к различным проявлениям вертебробазилярной недостаточности. Выделяют функциональную и органическую стадии [2, 9, 15, 16, 45].
Функциональная стадия синдрома позвоночной артерии характеризуется тремя группами симптомов: головная боль, кохлеовестибулярные и зрительные расстройства [5, 19, 21, 23].
У большинства пациентов боль, начинаясь в шейно-затылочном отделе, распространяется кпереди до сосцевидно-височной, теменной и лобной областей с иррадиацией в глаз, сопровождается вестибулярными (головокружение, потеря равновесия), слуховыми (снижение слуха и шум в ушах), вегетативными (потливость, чувство жара, приливы, ознобы) нарушениями. Могут присоединяться гортанные и глоточные симптомы (дисфония, дисфагия, глоточные парестезии) [5, 7, 12, 25, 27].
Болевые ощущения появляются в результате раздражения рецепторов болевой чувствительности в фиброзной и мышечной тканях позвоночника, в капсуле межпозвоночных суставов, связках, сухожилиях мышц шеи. При пальпации нередко определяется болезненность в области паравертебральных точек, остистых отростков, по ходу сосудов цервикального отдела. При прощупывании мышц можно найти узелки Корнелиуса и Мюллера, болезненность и напряжение передней лестничной мышцы. Боль может распространяться на плечевой пояс и грудную клетку, иррадировать в область сердца [5, 8, 10, 12, 44].
Зрительные нарушения были включены J. Barre (1926) в описание заднего шейного симпатического синдрома как облигатный признак. При тщательном расспросе они выявляются почти у всех больных с вертебробазилярной недостаточностью любой этиологии. Офтальмологические симптомы при синдроме позвоночной артерии различными авторами описываются несколько по-разному. В этой работе мы попытались суммировать найденные в различных источниках литературы описания. Глазные симптомы могут быть преходящими и стойкими [5, 7, 25, 27].
К преходящим относятся фотопсии. Больные жалуются на появление перед глазами «черных мушек», «копоти», «искр», «молний», разноцветных и золотых точек, которые кажутся мелькающими и колеблющимися. Фотопсии в случаях расстройств мозгового кровообращения точечные, возникновение их не связано с источником света, они продолжаются даже при закрытых глазах [2, 12, 28, 29].
Могут появляться и более сложные фотопсии, например в форме «белых блестящих колец», часто блестящих зигзагообразных линий, в виде движущегося потока разноцветных (красных, желтых и зеленых) кубиков. Во всех случаях зрительные нарушения являются кратковременными и длятся всего несколько секунд [2, 11, 13, 21].
Неясность видения предметов, ощущение «пелены» или «тумана» перед глазами отмечается, по данным литературы, примерно у половины больных с синдромом позвоночной артерии. При заднем шейном симпатическом синдроме описаны нарушения зрения, появляющиеся вместе с болями в шейно-затылочной области: мерцающие скотомы, туман и потемнение перед глазами, светобоязнь, слезотечение, ощущение песка за веками, нистагм, изменения давления в артериях сетчатки или тонуса сосудов глазного дна. Иногда отмечается покраснение конъюнктивы и развитие нейродистрофического кератита [1, 5, 29, 31].
Такие больные обращаются к офтальмологу с жалобами на неприятные ощущения в глазах, особенно при длительной работе на близком расстоянии. Возможно появление чувства «распирания» в глазнице, «выкручивания» глазных яблок, усиливающегося при напряжении зрения, во время чтения, движения глаз. Больные с задним шейным симпатическим синдромом могут сообщить окулисту о беспокоящем их двоении предметов. При обследовании выявляются уменьшение остроты и сужение поля зрения [6, 13, 30, 31, 34].
У пациентов с заболеваниями шейного отдела позвоночника нередко «затуманивание» зрения и нечеткость изображения усиливаются от резкого изменения положения головы. При этом может ухудшиться и общее состояние: появиться или усилиться головная боль, головокружение, повыситься артериальное давление [4, 6, 7, 11, 35, 45, 48].
Иногда глазные симптомы и головокружение провоцируются запрокидыванием головы назад, а в ряде случаев появляются после чрезмерной физической или эмоциональной нагрузки. Они также нередко возникают на фоне утомления: при длительной ходьбе по пересеченной местности, физической работе, ситуациях, связанных с задержкой дыхания, или развиваются после обмороков. По окончании такого приступа зрение может полностью восстановиться [6, 13, 30, 31, 34].
При вертебробазилярной недостаточности возможны кратковременные нарушения высших корковых функций, такие как различные виды зрительных агнозий с нарушением оптико-пространственного восприятия. Они появляются в результате ишемии в дистальных корковых ветвях задней мозговой артерии [2, 4, 7].
Появление билатерально перемежающихся симптомов: потемнения в глазах, сужения полей зрения, дизартрии, дисфагии или головокружения - подтверждает наличие вертебробазилярной недостаточности. Человек может потерять зрение на несколько минут или сообщить о кратковременном выпадении периферического зрения на фоне головокружения. В такой ситуации возможно присоединение рвоты и неустойчивости при ходьбе [4, 6, 10, 12, 22].
Вертеброгенные патологические состояния - проблема, решением которой занимаются неврологи, ортопеды, нейрохирурги и др. Тесная связь патологии мозга и глаза обусловлена анатомо-функциональным единством их кровообращения. Поэтому возможны ситуации, когда глазная симптоматика становится одной из самых ранних церебральных проявлений заболевания шейного отдела позвоночника. Глазные изменения могут возникать задолго до развития других симптомов вертебробазилярной недостаточности [4, 7, 13].
В случаях, когда патологию органа зрения пациенты не связывают с неудобной позой во время сна или на рабочем месте, поворотами и наклонами головы, им кажется, что она возникает как бы «сама по себе», именно на нее офтальмолог и направляет свое основное внимание, в то время как первопричина заболевания может остаться незамеченной [4, 7, 11, 13, 26, 42].
В заключение авторы статьи выражают надежду, что представленный материал окажет помощь практикующим офтальмологам в правильной постановке диагноза, назначении адекватного обследования и лечения.
Читайте также:
- Дренирование плевральной полости - торакостомия. Постановка, уход за дренажной трубкой
- Быстропрогрессирующий (некротический экстракапиллярный) гломерулонефрит. Диагностика и лечение
- Отклонения сывороточных маркеров крови как показание к пренатальному кариотипированию.
- Нежелательные желудочно-кишечные явления при лечении по NCI
- Морфология рака ушной раковины. Карцинома ушной раковины
