Внутрипортальное введение лекарств при печеночной недостаточности.
Добавил пользователь Владимир З. Обновлено: 20.01.2026
А.Н. БЕЛЯЕВ, Е.И. МОКШИНА, С.А. БЕЛЯЕВ, Д.В. МЕЛЬНИКОВА, С.В. КОСТИН, С.И. ХВОСТУНОВ, М.Н. БУХАРКИН
Кафедра общей хирургии и анестезиологии им. Н.И. Атясова (зав. - проф. А.Н. Беляев) Мордовского государственного университета им. Н.П. Огарева, Саранск
Ключевые слова: механическая желтуха, внутрипортальные инфузии, мексидол.
Effectiveness of intraportal mexidol infusions in the treatment of obstructive jaundice
A.N. BELYAEV, E.I. MOKSHINA, S.A. BELYAEV, D.V. MELNIKOVA, S.V. KOSTIN, S.I. KHVOSTUNOV, M.N. BUKHARKIN
Key words: obstructive jaundice, intraportal infusions, mexidols:
Большая частота осложнений и значительная летальность при механической желтухе (МЖ), достигающая в послеоперационном периоде 20-40% [7], составляют важную проблему современной хирургии.
У больных с обтурационной желтухой наиболее опасным и частым осложнением в послеоперационном периоде является печеночная недостаточность. Исследования последних лет в гепатологии заметно улучшили понимание процессов, происходящих в печени при механической желтухе [8, 10, 12] и на их основе предложено новые методы медикаментозной коррекции ее морфо-функционального состояния. С этой целью применяют широкий арсенал медикаментозных препаратов, влияющие на белковосинтезирующую, детоксицирующую, гемостатическую и другие функции печени [5, 6, 11, 13].
В профилактике и комплексной терапии острой печеночной недостаточности находят применение антиоксиданты, в частности мексидол, обладающий широким спектром биологической активности. Он эффективен при разных видах гипоксии, повышая устойчивость организма к кислородзависимым патологическим состояниям [2], стабилизирует липидный бислой сарколеммы гепатоцитов в условиях активации ПОЛ и лимитирует трансмембранный перенос ионов кальция из внеклеточного пространства.
Однако при тяжелой интоксикации комплексная терапия, включающая антиоксиданты, не всегда оказывается эффективной, что в немалой степени связана с недостаточной концентрацией лекарственных препаратов, попадающих в поврежденный орган. Это касается и печени, когда при внутривенной инфузионной терапии лекарственные препараты, пройдя через легочный капиллярный фильтр, достигают точку приложения эффекта в недостаточной лечебной концентрации. Одним из эффективных и доступных методов регионарной медикаментозной коррекции нарушений морфофункционального состояния печени при МЖ является внутри -портальный метод инфузионной терапии, позволяющий доставлять в печень лекарственные препараты высокой концентрации [3, 4, 9].
Целью настоящей работы была оценка процессов перекисного окисления липидов и функциональной активности печени при системном (внутривенном) и регионарном (внутрипортальном) введении мексидола в лечении механической желтухи.
Материал и методы
Выполнены эксперименты на 40 беспородных собаках под тиопентал-натриевым наркозом (45 мг/кг). В зависимости от характера проведенного лечения и состава инфузионных сред экспериментальные животные были распределены на 5 серий (табл. 1).
В 1-й серии экспериментов проводили моделирование механической желтухи путём наложения лигатурной перетяжки на общий желчный проток. Удаление лигатуры (декомпрессия холедоха) проводилось на 3-и сутки после моделирования механической желтухи.
Таблица 1. Краткое содержание экспериментального материала
| Серия | Количество животных | Инфузионная среда и способ введения |
| 1-я | 8 | Моделирование механической желтухи (без лечения) |
| 2-я | 8 | Внутривенно 0,9% раствор хлорида натрия (ФР), 20 мл/кг |
| 3-я | 8 | Внутривенно ФР (10 мл/кг) и внутрипортально ФР (10 мл /кг) |
| 4-я | 8 | Внутривенно ФР (20 мл/кг) + мексидол (7 мг/кг) |
| 5-я | 8 | Внутривенно ФР (10 мл/кг) и внутрипортально ФР (10 мл/кг) + мексидол (7 мг/кг) |
Во 2-й серии сразу после выполнения декомпрессии желчевыводящих путей проводили внутривенное введение 0,9% раствора натрия хлорида (физиологического раствора - ФР) в объеме 20 мл/кг. В 3-й серии экспериментов, после декомпрессии холедоха, инфузионная терапия включала внутривенное (10 мл/кг) и внутрипортальное (10 мл/кг) введение ФР.
В 4-й и 5-й сериях проводилось изучение влияния внутривенного и внутрипортального введения мексидола (7 мг/кг). Препарат растворяли в 0,9% растворе натрия хлорида, при этом способы его введения и общий объем вводимых сред (20 мл/кг) был сопоставим с предыдущими сериями.
В асептических условиях при ревизии подпеченочного пространства в толще печеночно-двенадцатиперстной связке находили общий желчный проток и с помощью лигатурной иглы проводили под ним лигатуру. Концы лигатуры продевали через полихлорвиниловую трубку и затягивали на перпендикулярно расположенной второй трубке до такой степени, чтобы полностью перекрыть просвет холедоха, моделируя, таким образом, механическую желтуху.
На 3-и сутки эксперимента (на высоте биохимических изменений), после выполнения релапаратомии проводили удаление лигатурной перетяжки, восстанавливая тем самым пассаж желчи в двенадцатиперстную кишку. Затем катетеризировали портальную вену через ветвь брыжеечной вены (рацпредложение №101 от 01.04.03). Экспериментальных животных наблюдали в течение 10 дней. Для проведения биохимических исследований кровь забирали ежедневно. Выведение животных из эксперимента осуществлялось путём струйного введения тиопентала натрия.
Определение активности аспартатаминотранферазы (АсАТ) и аланинаминотрансферазы (АлАТ), щелочной фосфатазы (ЩФ), содержание общего билирубина и его фракций, мочевины, общего белка и его фракций, креатинина, общих липидов, три-ацилглицеридов (ТАГ), общего холестерина, α-холестерина и ß-липопротеидов (ß-ЛП) плазмы крови проводили стандартными унифицированными методами, принятыми в клинической и лабораторной практике (В.В. Меньшиков, 1987; А.И. Карпищенко, 1999). Активность каталазы плазмы определяли по М.А. Королюк (1988). Уровень малонового диальдегида (МДА) в плазме крови определяли по С.Г. Конюховой (1989). Про- и антиоксидантный статус организма изучали на основании анализа показателей интенсивности свечения индуцированной хемилюминесценции плазмы крови (S, Imax и I /Smax).
Свечение регистрировали на биохемилюминометре БХЛ-06 (НПФ аналитического приборостроения «Люмекс», Санкт-Петербург). При этом Imax отражает потенциальную способность биологического объекта к ПОЛ, а площадь под кривой (S) - буферную емкость антиоксидантной системы.
Полученные при исследовании данные обрабатывали методом вариационной статистики с использованием критерия Фишера-Стьюдента. Для изучавшихся параметров вычисляли среднее арифметическое выборочной совокупности (М), ошибку средней арифметической (m). Достоверность различий определяли в каждой серии по отношению к значению на 3-и сутки эксперимента (р). При этом различия средних величин признавались статистически достоверными при уровне значимости 95% (р<0,05).
Результаты и обсуждение
При исследовании прооксидантно-антиоксидантного статуса организма отмечена резкая интенсификация процессов свободнорадикального окисления, подтверждаемая данными биохемилюминометрического анализа плазмы. Показатель максимальной интенсивности индуцированной биохемилюминисценции (Imax) прогрессивно возрастал, составляя на 3-и сутки 286,05% (p<0,001) относительно исходного уровня. Содержание МДА на 3-и сутки увеличивалось в 4,3 раза (р<0,001).Реакцией на усиление липопероксидации явилось повышение на 3-и сутки показателя S - до 265,65% (p<0,001)
Выполнение 2-й и 3-й серий экспериментов было обусловлено необходимостью изучения влияния инфузии 0,9% раствора NaCl (растворителя мексидола, используемого для его парентерального введения) на функциональное состояние печени и процессы липопероксидации при механической желтухе (с целью сравнения эффективности применения мексидола).
Внутривенное введение мексидола при внепеченочном холестазе сопровождалось существенной положительной динамикой большинства исследуемых показателей. Исходя из результатов проводимого лечения в четыре серии экспериментов, отмечена выраженная способность мексидола снижать интенсивность холестатического (снижение уровня ЩФ в 2,8 раза, билирубина - в 30,2 раза (p<0,001), холестерина - в 1,6 раза, (p<0,05) и цитолитического синдромов (понижение активности АсАТ и АлАТ - в 6,4 раза; p<0,001)
Смена пути введения мексидола с внутривенного на внутрипортальный характеризовалась большей степенью нормализации большинства изучаемых показателей. Наиболее существенному изменению подверглось содержание общего билирубина, которое к концу эксперимента приближалось к исходному уровню (табл. 2). Ликвидация холестаза и проведение инфузионной терапии в 5-й серии сопровождались уменьшением в 4,6 раза активности ЩФ, концентрация которой соответствовала нормальным величинам.
На фоне проводимой внутрипортальной терапии мексидолом происходило значительное восстановление трансаминазной активности крови со снижением уровня АлАТ в 16,07 раза, АсАТ - в 10 раз (см. табл. 2).
Рисунок. Сравнительная динамика концентрации малонового диальдегида
при внепеченочном холестазе на фоне внутривенной и внутрипортальной
инфузии мексидола
Снижение свободнорадикальной активности и активация антиоксидантной системы сочетались с нормализацией показателей липидного обмена. При внутрипортальном введении мексидола содержание липидной фракции венозной крови уменьшалось в 1,7 раза (p<0,05) в основном за счет снижения концентрации общей фракции холестерина (в 2,1 раза) и ß-ЛП (в 1,5 раза). Содержание липидных фракций в крови после проведения внутрипортальной терапии мексидолом приближалось к исходным значениям
Таблица 2. Показатели функциональной активности печени при внепеченочном холестазе и после внутрипортальных инфузий мексидола, n=8 (М±m)
| Показатель | Этапы эксперимента, сутки | |||||
| Исходно | 3-и | 4-е | 5-е | 6-е | 7-е | |
| ЩФ, нмоль/с·л | 331,25±20,04 | 1575,00±82,07 | 1275,19±74,91 (р <0,05) | 812,17±93,92 (р <0,001) | 578,12±105,43 (р <0,001) | 341,12±99,20 (р <0,001) |
| АсАТ, мкмоль/мл·ч | 0,20±0,03 | 2,29±0,19 | 1,23±0,23 (р <0,01) | 0,86±0,09 (р <0,001) | 0,41±0,21 (р <0,001) | 0,23±0,15 (р <0,001) |
| АлАТ, мкмоль/мл·ч | 0,21±0,03 | 4,34±0,32 | 2,45±0,20 (р <0,001) | 1,21±0,14 (р <0,001) | 0,78±0,16 (р <0,001) | 0,27±0,11 (р <0,001) |
| Общий билирубин, мкмоль/л | 7,36±0,57 | 298,75±2,99 | 122,81±48,11 (р <0,01) | 29,76±15,73 (р <0,001) | 10,34±1,84 (р <0,001) | 8,01±0,96 (р <0,001) |
| Прямой билирубин, мкмоль/л | 6,09±0,06 | 257,50±0,78 | 106,26±7,58 (р <0,001) | 25,51±2,50 (р <0,001) | 8,89±0,16 (р <0,001) | 6,61±0,07 (р <0,001) |
Полученные результаты позволяют говорить о высокой способности мексидола корригировать нарушения гомеостаза, развивающиеся при синдроме механической желтухи. Наиболее существенным фармакологическим действием мексидола является блокада процессов перекисного окисления липидов и активация антиоксидантных ферментов с улучшением физико-химических свойств клеточной мембраны и возрастанием ее текучести. Эти изменения при механической желтухе способствуют значительному уменьшению цитолитических процессов и повышению функциональной активности гепатоцитов. В большей степени ингибирующее влияние на свободнорадикальные реакции в печени мексидол оказывает при внутрипортальном пути его введения, что проявляется более значительным гепатопротекторным эффектом и повышением ее функциональной активности.
Внутрипортальное введение лекарств при печеночной недостаточности.
Порто-кавальная печеночная недостаточность. Интенсивная терапия острой печеночной недостаточности.
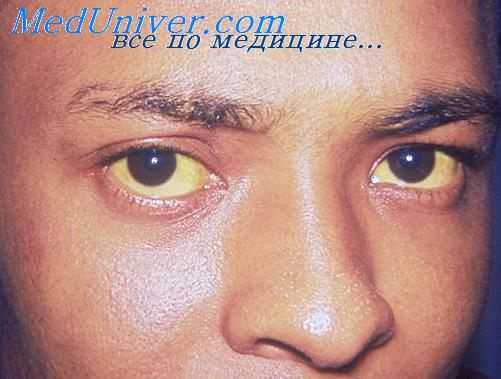
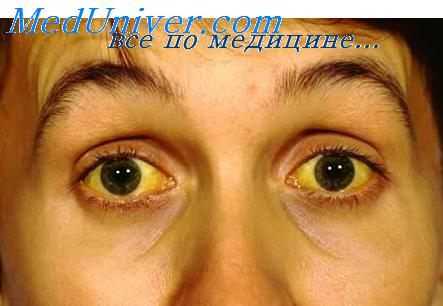
Порто-кавальная кома возникает вследствие тяжелого цирротического поражения печени. Стойкая длительная портальная гипертензия, приводящая к возникновению порто-кавальных анастомозов, по которым кровь "сбрасывается" в общий кровоток, минуя печень, обусловливает развитие эндогенной интоксикации. Особенностями этого варианта комы является возможность ее возникновения при небольшом нарушении желчевыведения, с чем связано отсутствие или незначительная выраженность желтухи. Возникновение печеночной комы может спровоцировать нарушение питания (пища, богатая белком).
При порто-кавальной печеночной недостаточности часто выявляются печеночные знаки - звездочки, печеночные ладони, белые ногти.
Звездочки состоят из центральной артериолы и расходящихся от нее многочисленных мелких сосудов. Размеры ее колеблются от булавочной головки до 0,5 см в диметре. Исчезновение звездочек в процессе терапии указывает на улучшение функции печени, появление новых -о прогрессировании заболевания.
Печеночные ладони представляют собой теплые кисти с ладонями ярко-красного щета (особенно в области тенора, гипотенора, подушечек пальцев). У больных иногда возникает ощущение пульсации ладоней и чувство зуда. Аналогичные поражения можно наблюдать и на ступнях.
В 80% у больных циррозом печени выявляются белые ногти, вследствие непрозрачности ногтевого ложа. Кончики ногтей приобретают розовую окраску. Поражение это обычно двухстороннее, особенно ярко выражено на больших и указательных пальцах.
Факторами, приводящими к развитию энцефалопатии у больных с порто-кавальной печеночной недостаточностью, относятся некорректное назначение диуретиков, удаление большого объема асцитической жидкости, электролитные нарушения при диарее и рвоте, желудочно-кишечные кровотечения, хирургические вмешательства, присоединение инфекций.
В случае развития наряду с порто-кавальной печеночно-клеточной недостаточности печени (обширного некроза) печеночная кома приобретает характер смешанной.
Острая печеночная недостаточность может являться одним из компонентов синдрома мультиорганной дисфункции, который возникает при сепсисе, политравме, геморрагическом шоке, синдроме длительного раздавливания, некоторых отравлениях и других состояниях. Развитие шока в большинстве случаев сопровождается печеночной недостаточностью, но ее симптомы выражены нерезко в связи с преобладанием сердечно-сосудистой и дыхательной недостаточности, причем часто печеночная недостаточность сопровождается почечной.
Интенсивная терапия острой печеночной недостаточности
Больные с острой печеночной недостаточностью изолируются или помещаются в специализированное отделение реанимации и интенсивной терапии.
Персонал, проводящий интенсивную терапию и уход за этой категорией больных, непременно должен быть вакцинирован против гепатита В(!), носить халат, шапочку, маску, пользоваться перчатками.
Для проведения инфузионной терапии катетеризируется центральная вена, в желудок устанавливается зонд. У больных в коматозном состоянии в мочевой пузырь вводится катетер Фолея для контроля темпа диуреза.
Обязательным является проведение тщательного мониторинга, включающего неинвазивное определение артериального давления, пульса, частоты сердечных сокращений, сатурации крови. Ежедневно перкуссионно определяют размеры печени, фиксируя ее проекцию в области передней стенки живота шариковой ручкой или фломастером.
Прием белка ограничивается до 0,5 г/кг в сутки, а в ряде случаев белок полностью исключается из рациона. Для перентерального питания целесообразно использовать специально созданные аминокислотные смеси типа аминостерил-гепа или гепаферил-А. Использование стандартных смесей аминокислот (альтезин и др.) только усиливает дисаминоацидемию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Руководство по лечению острой печеночной недостаточности у взрослых в отделении реанимации (SCCM, февраль 2020)
14 февраля 2020 г. Society of Critical Care Medicine опубликовало руководство по лечению острой печеночной недостаточности и острой на фоне хронической печеночной недостаточности у взрослых в отделении реанимации.
Рекомендации (далее острая печеночная недостаточность подразумевает обе, также и острую на фоне хронической печеночной недостаточности):
- Не рекомендуется применение гидроксиэтилкрахмала для изначальной инфузионной терапии (жидкостной реанимации) у пациентов с острой печеночной недостаточностью.
- Не рекомендуется применение растворов желатина для изначальной инфузионной терапии (жидкостной реанимации) у пациентов с острой печеночной недостаточностью.
- Рекомендуется применение альбумина для реанимации у пациентов с острой печеночной недостаточностью, нежели чем другие растворы, особенно если уровень сывороточного альбумина низкий (
- Рекомендуется целевое среднее АД 65 мм рт ст у пациентов с острой печеночной недостаточностью с одновременной оценкой перфузии.
- Рекомендуется введение артериального катетера для мониторинга АД у пациентов с острой печеночной недостаточностью.
- Рекомендуется применение инвазивного гемодинамического мониторинга для направления лечения у пациентов с острой печеночной недостаточностью и клинически нарушенной перфузией.
- Рекомендуется применение норадреналина как вазопрессора первой линии у пациентов с острой печеночной недостаточностью, у которых держится гипотензия несмотря на инфузионную терапию, либо у пациентов с глубокой гипотензией и гипоперфузией тканей, даже если инфузионная терапия непрерывная.
- Рекомендуется добавление вазопрессина в малой дозе к норадреналину у пациентов с острой печеночной недостаточностью, у которых держится гипотензия несмотря на инфузионную терапию, для повышения АД.
- Рекомендуется применение тромбоэластографии/ротационной тромбоэластометрии , нежели чем замер МНО , тромбоцитов и фибриногена , у критически больных пациентов с острой печеночной недостаточностью.
- Рекомендуется пороговый уровень гемоглобина для трансфузии 7 мг/дЛ, нежели другие пороговые уровни, у критически больных пациентов с острой печеночной недостаточностью.
- Рекомендуется применение низкомолекулярных гепаринов или антагонистов вит. К , нежели чем консервативное ведение , у пациентов с тромбозом воротной вены или с ТЭЛА .
- Рекомендуется применение низкомолекулярных гепаринов , нежели чем пневматических компрессионных чулков , для профилактики венозной тромбоэмболии, у госпитализированных пациентов с острой на фоне хронической печеночной недостаточности.
- Рекомендуется применение тромбоэластографии/ротационной тромбоэластометрии, нежели чем замер МНО, тромбоцитов и фибриногена, у критически больных пациентов с острой печеночной недостаточностью, проходящих вмешательства.
- Не рекомендуется применение элтромбопага у пациентов с острой на фоне хронической печеночной недостаточности с тромбоцитопенией перед операцией/инвазивными процедурами.
- Рекомендуется использование низкого экскурсирующего объема , нежели чем высокого экскурсирующего объема , у пациентов с острой печеночной недостаточностью и с острым респираторным дистресс-синдромом .
- Не рекомендуется применение высокого положительного давления в конце выдоха , по сравнению с низким положительным давлением в конце выдоха у пациентов с острой печеночной недостаточностью и с острым респираторным дистресс-синдромом.
- Для лечения порто-пульмональной гипертензии рекомендуется применение препаратов, одобренных для лечения легочной артериальной гипертензии у пациентов со средним легочным АД более 35 мм рт ст.
- Рекомендуется поддерживающее лечение кислородом при лечении гепатопульмонального синдрома , при ожидании возможной пересадки печени .
- Рекомендуется введение плевральной трубки с попыткой плевродеза при печеночном гидротораксе у пациентов, у которых не возможно трансяремное внутрипеченочное портосистемное шунтирование, либо с паллиативной целью.
- Рекомендуется применение высокопотоковой носовой канюли, нежели чем неинвазивной ИВЛ, у критически больных пациентов с острой печеночной недостаточностью с гипоксией.
- Нет достаточных данных для рекомендации по тому, продолжать либо отменить почечную заместительную терапию во время операции (во время пересадки печени) у пациентов, которые получали почечную заместительную терапию перед операцией .
- Рекомендуется ранняя почечная заместительная терапия у пациентов с острой печеночной недостаточностью и острым повреждением почек.
- Рекомендуется применение вазопрессоров, нежели чем их неприменение, у пациентов с острой на фоне хронической печеночной недостаточности, у которых развивается гепаторенальный синдром.
- Нет достаточных данных для рекомендации применения или не применения трансяремного внутрипеченочного портосистемного шунтирования у пациентов с циррозом печени и рефрактерным асцитом, для профилактики гепаторенального синдрома.
- Рекомендуется целевое значение сывороточной глюкозы 6,1-10 ммоль/Л (110-180 мг/дЛ) у пациентов с острой печеночной недостаточностью.
- Рекомендуется применение стресс-доз глюкокортикоидов при лечении септического шока у пациентов с острой печеночной недостаточностью.
- Не рекомендуется нацеливаться на низкие уровни протеина в диете у пациентов с острой печеночной недостаточностью, но рекомендуется нацеливаться на уровень протеина в диете сравнимый с критически больными без печеночной недостаточности (1,2-2 г протеина на кг сухого или идеального веса в день).
- Не рекомендуется применение аминокислот с разветвлённой цепью у критически больных пациентов , госпитализированных с острой печеночной недостаточностью, которые переносят энтеральные препараты.
- У критически больных пациентов, госпитализированных с острой печеночной недостаточностью, у которых нет противопоказаний к энтеральному питанию, рекомендуется энтеральное питание, нежели чем парентеральное питание.
- Рекомендуется проведение скрининга пациентов с острой печеночной недостаточностью на предмет лекарственно-индуцированных причин печеночной недостаточности. Препараты, которые доказаны, либо имеется высокое подозрение как причина острой печеночной недостаточности, должны быть отменены.
- У пациентов с острой печеночной недостаточностью рекомендуется корректировка доз препаратов, которые подвергаются печеночному метаболизму, на основании остаточной печеночной функции пациента и с применением наилучшей имеющейся литературы. При возможности необходимо проконсультироваться с клиническим фармакологом.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Важной мерой в интенсивной терапии острой печеночной недостаточности является внутрипортальное введение инфузионных средств, которое достигается реканализацией пупочной вены.
После разреза кожи, подкожной клетчатки и апоневроза по средней линии выше пупка в предбрюшинной клетчатке находят облитерированную пупочную вену в виде тяжа, направляющуюся к круглой связке печени. При надсечении ее передней стенки виден просвет сосуда, в который поочередно вводят полые бужи диаметром от 1 до 5 мм. Появление крови в просвете бужа служит основанием для его удаления и установки на его месте катетера с присоединенной системой для вливания лекарствершых средств. Катетер фиксируется лигатурой к апоневрозу и коже. Рану передней брюшной стенки наглухо ушивают.
В реканализированную пупочную вену вводят оксигенррроваршые растворы, включая кровь.
Внутрипортальное введение растворов глюкозы улучшает энергетические процессы в печени и, в частности, утилизацию кислорода. Утилизация кислорода печенью более эффективна при добавлении к растворам глрокозы пантотеновой кислоты, цитохрома С, кокарбоксршазы, гутимина.
Снижение уровня продуктов распада белка в ЖКТ достигается удалением белкового субстрата путем назначенррй промыванрря желудка, слабительных средств, энтеросорбции, сифонррых клизм.
При хорошей эвакуаторной функции кишечнррка назначается энтеросорбция билигнином по 5 г 3-4 раза в сутки. Суточная доза препарата обычно составляет 15-20 г. Билигнин сршжает интеисивность желтухи, уменьшает уровни билирубина, желчных кислот, холестерина, щелочной фосфатазы в крови.
Глутаминовую кислоту целесообразно использовать в сочетании с препаратами, понижающими потребление кислорода в ЦНС и вызывающими тормозные процессы в нервной ткани, в частности с оксибутиратом натрия. Глутамат превращается в ГАМК в обход цикла лимонной кислоты (ГАМК-шунт), минуя а-кетоглутаратдегидрогеназную реакцию. Витамин В6, являясь протектором оксибутирата натрия, ГАМК-шунт активирует.
Лактулоза относится к синтетическим гипоаммониемическим препаратам. Под влиянием лактулозы снижается рН содержимого кишечника и активируется его перистальтика. Под действием препарата уменьшается образование азотосодержащих токсических веществ в проксимальном отделе толстого кишечника и, соответственно, их абсорбция в системный кровоток. Кроме того, препарат увеличивает перемещение ионов аммония из крови в просвет кишечной трубки и, обладая послабляющим действием, ускоряет выведение токсинов. В ЖКТ лактулоза практически не адсорбируется.
Лактулоза назначается по 15-45 мл в сутки. В случае развития печеночной энцефалопатии суточная доза может составить 100-200 мл в 2-3 приема.
Лактинол, гептрал, ессенциале, ацетилцистеин при печеночной недостаточности.
Лактинол - препарат, по механизму действия близкий к лактулозе, не инактивируется и не адсорбируется в тонком кишечнике, но расщепляется бактериями толстой кишки. Лактинол используется в дозе до 30 г при печеночной энцефалопатии.
Для стимуляции липотропных механизмов печени используются гептрал, ессенциале, липостабил.
Гептрал (адеметионин). Препарат особенно эффективен при внутрипеченочном холестазе и при сочетании депрессивных расстройств ЦНС с патологией печешь Гептрал предотвращает экзогенные и эндогенные гепатотоксические эффекты, способствует поддержанию вязкости клеточных мембран, что необходимо для нормальной деятельности мембраносвязанных ферментов.
Гептрал в течение первых 5-7 дней вводится ежедневно по 1600 мг внутривенно, а затем проводится поддерживающая терапия: на протяжение 2 недель по 800-1600 мг в сутки, в два приема. Оптимальный курс лечения гептралом 3 недели. Клинически значимый эффект препарата развивается через 5-7 дней после начала внутривенных инъекций.
Ессенциале. Препарат содержит фосфолипиды (субстанция EPL) и витамины с антигипоксантными (тиамин, рибофлавин, пиридоксил, никотинамид) и антиоксидантными (токоферол, цианкоболамин) свойствами. Фосфолипиды, являющиеся основным компонентом клеточной стенки, встраиваясь в мембрану клетки, оказывают нормализующее действие на метаболизм липидов, белков и на дезинтоксикационную функцию печени, восстанавливают и сохраняют клеточную структуру печени и фосфолипидозависимые энзиматические системы. Ессенциале вводится по 10-20 мл (2-4 ампулы) в сутки внутривенно, разведенным в изотоническом растворе хлорида натрия или аутокровью.
Липостабил. Препарат содержит в своем составе эссенциальные фосфолипиды, обеспечивающие нормализацию содержания липопротеинов и снижение уровня липидов в крови. Липостабил обеспечивает мобилизацию холестерина из стенок артерий, препятствует прогрессированию атеросклеротических повреждений сосудов и улучшает реологические свойства крови.
Препарат вводится внутривенно по 10-20 мл ежедневно в течение 2-4 недель (запрещается смешивание препарата с растворами электролитов!).
Орницел, способствующий восстановлению энергетического потенциала клеток, ускоряет снижение билирубина, способствует улучшению общего состояния больного. Препарат вводится внутривенно медленно по 2-10 г в сутки.
N-ацетилцистеин. Препарат улучшает кровоток, доставку кислорода и его усвоение тканями. При острой печеночной недостаточности, вызванной отравлением парацетамолом, - 100 мг/кг массы тела больного вводятся внутривенно в течение первых 16 часов. Считается, что N-ацеталцистеин повышает выживаемость больных, снижает риск развития отека головного мозга, артериальной гипотензии и почечной недостаточности.
При лечении больных с острой печеночной недостаточностью следует избагать седативных препаратов. Наличие абсолютных показании (aгрессивнoe поведение больного) служит основанием для использования бензодиазепинов короткого действия (мидазолам). При развитии печеночной комы введение флюмазенила, антагониста бензодиазепиновых рецепторов, может вызвать временное восстановление сознания.
Глюкокортикостероиды при острой печеночной недостаточности зачастую способствуют стимуляции катаболизма белков с нарастанием азотемии, развитию инфекционных-септических осложнений и эрозий слизистой оболочки желудка. На этом основании использование глюкокортикостероидов большинством авторов признано нецелесообразным.
Получены обнадеживающие результаты от применения метода гипербарической оксигенации в режиме 2-3 атм длительностью 1-3 часа.
Нормоволемическая гемотрансфузия.
Нормоволемическая гемотрансфузия позволяет уменьшить степень печеночной энцефалопатии, оказывает положительное влияние на выраженность гипертрансаминаземии, гипербилирубинемии, нормализует протромбиновый индекс, показатели кислотно-основного и электролитного баланса.
Забор крови от донора производится в 20-миллитровые, предварительно промытые гепарином шприцы и затем внутривенно медленно вводится больному. Общий объем гемотрансфузии составляет от 0,5 до 1,5 л, для чего используются 1-3 донора. Предварительно или параллельно с процедурой выполняется эксфузия крови больного в объеме предполагаемой гемотрансфузии. Нормоволемическая гемотрансфузия выполняется от 2 до 5 раз ежедневно или через день.
Перекрестное кровообращение.
Перекрестное кровообращение между больным с острой печеночной недостаточностью и донором предполагает очищение крови реципиента от токсичных продуктов здоровой печени донора. В качестве донора используются члены семьи больного, больные с неоперабельными злокачественными новообразованиями, со смертью мозга в результате ЧМТ.
Методика перекрестного кровообращения заключается в соединении лучевой артерии донора и лучевой вены больного, а лучевой вены донора - с лучевой артерией больного. Для поддержания эффективного кровотока (125-200 мл/мин) в эту систему иногда вставляют роликовый насос. Длительность сеанса составляет 2-7 часов. Процедуру повторяют ежедневно или через день.
При наличии показаний (случайная перевязка печеночной артерии во время операции, цирроза печени с варикозно расширенными венами пищевода) выполняют наложение артериовенозных шунтов (селезеночная артерия - воротная вена, лучевая артерия - воротная вена).
Достаточно сложным и редко используемым на территории России методом лечения острой печеночной недостаточности является пересадка печени, основанием для которой служат рН крови менее 7,3, тромбиновое время более 100 с, уровень билирубина более 300 мкмоль/л, длительность желтухи более 7 суток до развития энцефалопатии.
Читайте также:
