Сиролимус. Лечение острых коронарных синдромов
Добавил пользователь Валентин П. Обновлено: 10.01.2026
По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания занимают первое место в мире в структуре причин смертности. В настоящее время стандартом интервенционного лечения пациентов с атеросклеротическим поражением коронарных артерий является чрескожное коронарное вмешательство (ЧКВ). Внедрение в клиническую практику стентов второго поколения с лекарственным покрытием (СЛП) позволило увеличить эффективность и безопасность ЧКВ за счет уменьшения выраженности воспалительных изменений, а также увеличения скорости заживления и эндотелизации артерии в месте имплантации стента. Однако техника и технология вмешательства сами по себе препятствуют полному восстановлению структуры и функции сосудов и сопряжены с риском отсроченного нарушения функции стента. У пациентов, перенесших ЧКВ с имплантацией СЛП, сохраняется риск поздних осложнений стентирования (тромбоза стента, рестеноза, неоатеросклероза и кровотечения), информация о которых представлена в настоящем обзоре. Важную роль в патогенезе острого коронарного синдрома после стентирования, а также в рецидивировании клинических симптомов после ЧКВ играет неоатеросклероз. Расширенная коронарная визуализация и длительная двойная антитромбоцитарная терапия, возможно, будут иметь фундаментальное значение для дальнейшего понимания и лечения этого процесса.
Ключевые слова: ишемическая болезнь сердца, чрескожное коронарное вмешательство, стент с лекарственным покрытием, рестеноз коронарных артерий, тромбоз стента, кровотечение.
Для цитирования: Шумаков Д.В., Шехян Г.Г., Зыбин Д.И. и др. Поздние осложнения чрескожных коронарных вмешательств. РМЖ. 2020;10:25-28.
Late complications of percutaneous coronary interventions
D.V. Shumakov, G.G. Shekhyan, D.I. Zybin, A.A. Yalymov, E.V. Stepina, M.A. Popov
Moscow Regional Clinical Research Institute named after M.F. Vladimirsky, Moscow
According to the World Health Organization, cardiovascular diseases occupy first place in the world as the causes of fatal outcomes. At present, percutaneous coronary intervention (PCI) is the standard treatment regimen of patients with atherosclerotic lesions of the coronary arteries. The introduction of second-drug-eluting stents (SDES) into clinical practice has increased the efficacy and safety of PCI by reducing the severity of inflammatory changes, as well as increasing the rate of regeneration and endothelization of the artery at the stent implantation site. However, the technique and technology of intervention itself prevent the complete regeneration of vascular structure and function and are associated with the risk of late stent dysfunction. Patients who have undergone PCI with SDES implantation remain at risk of late stenting complications (stent thrombosis, restenosis, neoa therosclerosis and bleeding), which are described in this review. Neoatherosclerosis plays an important role in the pathogenesis of acute coronary syndrome after stenting, as well as the recurrence of clinical symptoms after PCI. Advanced cardiac imaging and long-term dual antiplatelet therapy may be of fundamental importance for further understanding and treatment of this pathological process.
Keywords: coronary heart disease, percutaneous coronary intervention, drug-eluting stents, restenosis, stent thrombosis, bleeding.
For citation: Shumakov D.V., Shekhyan G.G., Zybin D.I. et al. Late complications of percutaneous coronary interventions. RMJ. 2020;10:25–28.
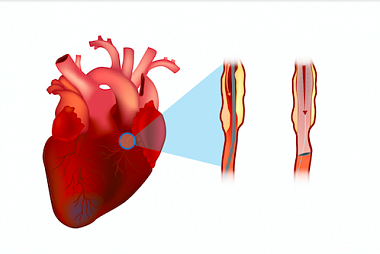
Введение
По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания занимают первое место в мире в структуре причин смертности [1]. В Российской Федерации ишемическая болезнь сердца (ИБС) встречается у 13,5% населения [2], при этом 44,9% случаев смерти от всех причин у женщин и 55,4% у мужчин приходится именно на пациентов с ИБС (14% у лиц трудоспособного возраста) [3]. В настоящее время в лечении ИБС одно из ведущих мест занимает чрескожное коронарное вмешательство (ЧКВ) с имплантацией стента, которое ежегодно выполняется не менее чем у 5 млн пациентов во всем мире [4]. Внедрение в повседневную клиническую практику стентов с лекарственным покрытием (СЛП) второго поколения, которые в значительной степени заменили голометаллические стенты (ГМС), способствовало уменьшению выраженности воспалительных изменений, а также увеличению скорости заживления и эндотелизации артерии в месте имплантации стента [5]. Как следствие, при использовании СЛП наблюдалось снижение частоты осложнений, связанных со стентированием, что способствовало расширению показаний к ЧКВ. Однако проблема безопасности вмешательства остается актуальной. Настоящий обзор посвящен наиболее часто встречающимся поздним осложнениям стентирования: тромбоз стента (ТС), рестеноз, неоатеросклероз и кровотечение.
Тромбоз стента
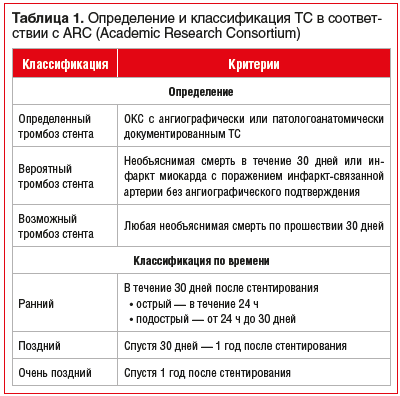
Под ТС подразумевается его тромботическая окклюзия [6]. ТС относится к большим осложнениям ЧКВ и ассоциирован с высоким риском заболеваемости и смертности. В отличие от рестеноза, на фоне которого могут возникать симптомы, характерные для стабильной стенокардии, ТС является острым процессом, который обычно манифестирует в виде острого коронарного синдрома (ОКС). Определение и классификация ТС представлены в таблице 1 [7].
По данным ранних публикаций [8, 9], ТС после ЧКВ отмечался в 16% случаев, при этом показатель 30-дневной смертности составлял 15–30%. По крайней мере отчасти, подобные результаты были обусловлены низкоэффективными схемами профилактики ТС (препараты ацетилсалициловой кислоты, дипиридамол, декстран). С совершенствованием методов стентирования и внедрением двойной антитромбоцитарной терапии (ДАТ) в клиническую практику наблюдалось выраженное снижение частоты ТС до 0,7% в течение 1 года и 0,2–0,6% в течение последующего наблюдения [10–12]. Распространенность ТС при плановом ЧКВ составляет 0,3–0,5% и увеличивается до 3,4% при ОКС. Не получено статистически значимых различий в отношении частоты ТС при использовании ГМС и СЛП. Однако для ГМС по сравнению с СЛП характерно более раннее развитие тромбоза (первые 30 дней с момента вмешательства по сравнению с 3 мес. и более) [13].
В крупных рандомизированных исследованиях и регистрах были идентифицированы факторы, ассоциированные с ТС. Так, в исследовании CHAMPION-PHOENIX инфаркт миокарда с подъемом и без подъема сегмента ST на момент поступления, ангиографические характеристики тромботических поражений и длина стента являлись независимыми предикторами острого ТС [14]. В исследовании ACUITY была установлена ассоциация между сахарным диабетом (СД), почечной недостаточностью, количеством баллов по шкале Duke Jeopardy score, минимальным диаметром просвета стента, назначением тиенопиридинов в предоперационном периоде, исходным уровнем гемоглобина, протяженностью поражений коронарных артерий и ранним ТС [15]. В субанализе HORIZONS-AMI при использовании внутрисосудистого ультразвукового исследования (ВСУЗИ) были идентифицированы следующие предикторы ТС: площадь поперечного сечения менее 5 мм, некорректное позиционирование стента, пролапс или протрузия атеросклеротической бляшки, краевая диссекция, резидуальный стеноз и бифуркационное стентирование [16]. В исследовании Triton-TIMI 38 инфаркт миокарда с подъемом сегмента ST был ассоциирован с более высоким риском ТС, который снижался на 50% при использовании некоторых антитромбоцитарных препаратов [17].
В настоящее время особое внимание уделяется позднему и очень позднему ТС. Если при развитии острого и подострого ТС основную роль, по-видимому, играют анатомические особенности коронарного русла, а также техники и технологии стентирования, то механизм отсроченных тромботических явлений представляется более сложным [18, 19]. В исследованиях идентифицированы следующие факторы риска позднего и очень позднего ТС: СД, ОКС во время исходной процедуры, почечная недостаточность, пожилой возраст, снижение фракции выброса левого желудочка, сердечно-сосудистые осложнения в течение 30 дней после исходной процедуры. Особенности ангиопластики (малый размер сосуда, бифуркационное стентирование, многососудистое поражение, наличие кальцификаций и окклюзий, использование длинных стентов), скорее всего, ассоциированы с поздним ТС как для ГМС, так и для СЛП. Риск ТС увеличивается при нарушениях, связанных с ДАТ: несоблюдение режима приема препаратов, субоптимальная дозировка, лекарственные взаимодействия, коморбидный фон, генетический полиморфизм. К позднему ТС также могут приводить неоатеросклероз (НА) в стенте и поздние реакции гиперчувствительности.
Рестеноз
Применение коронарных стентов позволило улучшить прогноз при ЧКВ по сравнению с изолированной баллонной ангиопластикой, которая сопровождалась как механическими осложнениями (окклюзия, диссекция и т. д.), так и высокой частотой рестенозов (до 40–50%). К концу 1990-х гг. до 70% ЧКВ выполнялись с имплантацией ГМС [20]. Несмотря на совершенствование технологий вмешательства и медикаментозной терапии, риск рестеноза после имплантации ГМС оставался достаточно высоким и составлял около 20%, и внедрение в клиническую практику СЛП позволило дополнительно снизить частоту рестенозов [21, 22].
Одним из наиболее важных предикторов рестенозов является СД (табл. 2). Так, у пациентов с СД, перенесших имплантацию ГМС, риск развития рестеноза увеличивается на 30–50% [23]. При этом применение СЛП у больных с СД также не позволяет полностью предотвратить данное осложнение. Механизм формирования рестеноза при СД, вероятно, является комплексным и включает в себя как системные (например, вариабельность воспалительного ответа), так и анатомические (например, стентирование сосудов малого диаметра; протяженность и диффузный характер поражений) факторы [24]. Также на распространенность рестенозов независимо влияют диаметр сосуда и протяженность поражения [22]. Кроме того, при длине стента свыше 35 мм (по сравнению с длиной менее 20 мм) наблюдалось практически двукратное увеличение частоты рестеноза. Немаловажную роль играет минимальный диаметр просвета стента [25].
Неоатеросклероз
НА называют процесс трансформации нормального слоя интимы в атерогенную неоинтиму внутри стента. Процесс опосредован накоплением липидных макрофагов и в некоторых случаях сопровождается кальцификацией в области стентирования [26]. В отличие от атеросклероза в нативных коронарных артериях, прогрессирующего в течение десятилетий, формирование неоинтимы после ЧКВ происходит в течение нескольких месяцев — нескольких лет [27].
НА в стенте проявляется инфильтрацией и апоптозом макрофагов и последующим образованием некротического ядра [28]. Точная причина высокой скорости процесса в настоящее время не установлена, однако предложено несколько механизмов, в т. ч. неполное эндотелиальное покрытие, приводящее к эндотелиальной дисфункции. На фоне данного процесса, преимущественно после имплантации СЛП, нарушается формирование клеточных соединений, снижаются экспрессия антитромботических молекул и продукция оксида азота. Кроме того, при НА имеет место проникновение липопротеинов высокой плотности и протеогликанов в субэндотелиальное пространство [29].
Для выявления механизмов недостаточности стента можно использовать ВСУЗИ или OКT [32]. Однако разрешение ОКТ (10–20 мкм) по сравнению с разрешением ВСУЗИ (80–120 мкм) делает его предпочтительным методом интракоронарной визуализации для оценки неоинтимальной ткани в стентированном сегменте.
Многоцентровой анализ показал, что среди пациентов, которым были установлены СЛП первого и второго поколения, распространенность НА, определяемого с помощью OКT, составила 27,4% (58/212) [33]. Первое поколение СЛП по сравнению со стентами второго поколения показало более высокую скорость развития НА (45,5% против 10,8%; p<0,001). Разницы между типами стентов установлено не было. Кроме того, пациенты с НА имели более высокий риск развития ОКС (19% против 3,9%; р=0,001). Многофакторный анализ показал, что хроническая болезнь почек, уровень липопротеинов низкой плотности выше 70 мг/дл и длительность наблюдения с момента установки стента были независимыми предикторами развития НА.
Таким образом, не вызывает сомнений, что НА является распространенным осложнением ЧКВ с имплантацией СЛП. Широкое внедрение внутрикоронарной визуализации, особенно ОКТ, неизбежно будет способствовать повышению осведомленности и более глубокому пониманию данного процесса. Следует подчеркнуть, что НА не является доброкачественным процессом и может приводить к очень позднему ТС.
Кровотечение
Кровотечения после ЧКВ являются значимой причиной общей и сердечно-сосудистой смертности [36]. После острой кровопотери повышается риск развития ТС, вероятно, за счет образования незрелых крупных тромбоцитов с большей реактивностью [37]. По данным регистра [38], частота больших кровотечений после ЧКВ составляет 1,7%, при этом до 50% случаев связаны с сосудистым доступом. В остальных случаях наиболее распространенной локализацией являются органы желудочно-кишечного тракта. Внедрение радиального доступа в клиническую практику способствовало значительному снижению распространенности больших кровотечений в послеоперационном периоде [39].
В настоящее время предложено несколько инструментов оценки риска кровотечений, полученных в регистрах и клинических исследованиях ОКС и ЧКВ. Шкала CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse out comes with Early implementation of the ACC/AHA guidelines) была разработана на когорте из 71 277 пациентов с ОКС без подъема сегмента ST и прошла валидацию на 17 857 больных [40]. При оценке риска больших кровотечений во время пребывания в стационаре используются исходные характеристики (женский пол, анамнез СД, облитерирующего атеросклероза артерий нижних конечностей, инсульта), клинические (частота сердечных сокращений, систолическое артериальное давление, признаки правожелудочковой сердечной недостаточности) и лабораторные (гематокрит, расчетное значение клиренса креатинина) параметры на момент поступления. Однако для данной модели характерна умеренная точность (с-статистика 0,68 и 0,73 для консервативного лечения и инвазивного лечения соответственно).
Шкала ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) была разработана на когорте из 17 421 пациента с ОКС с подъемом и без подъема сегмента ST, включенных в исследования ACUITY и HORIZONS-AMI [41]. По результатам анализа были выявлены независимые предикторы кровотечений (женский пол, пожилой возраст, увеличение сывороточной концентрации креатинина, концентрация лейкоцитов, анемия и инфаркт миокарда с подъемом или без подъема сегмента ST, применение низкомолекулярных гепаринов и ингибиторов гликопротеина IIb/IIIa). Модель позволила прогнозировать риск больших кровотечений, не связанных с аортокоронарным шунтированием, в течение 30 дней и смертности в течение 1 года наблюдения. Следует отметить, что представленная шкала не была валидирована на независимой когорте больных. Кроме того, для нее характерна умеренная точность (с-статистика 0,74). Изменение практики инвазивных вмешательств (например, внедрение радиального доступа), снижение дозировки низкомолекулярных гепаринов, снижение частоты использования ингибиторов GPIIb/IIIa и применение более эффективных ингибиторов рецепторов аденозиндифосфата тромбоцитов P2Y12 (ингибиторы P2Y12) потенциально могут модифицировать расчетную величину риска. Таким образом, вероятность ишемических событий и геморрагических осложнений следует оценивать индивидуально в каждом конкретном случае. Однако важно подчеркнуть, что одни и те же факторы могут быть ассоциированы с риском и тромбоза, и кровотечений.
Достижение баланса между тромботическими событиями и геморрагическими осложнениями у пациентов, получающих длительную ДАТ, вызывает определенные затруднения. Имплантация СЛП второго поколения и назначение ДАТ в течение 6 мес. представляется достаточным для предотвращения большинства случаев ТС. Внедрение шкал PRECISE-DAPT и DAPT может индивидуализировать решения относительно длительности ДАТ.
Заключение
За последние 40 лет произошли значительные изменения в области интервенционной ангиологии у пациентов с ОКС, которые позволили повысить эффективность и безопасность ЧКВ. Внедрение в клиническую практику СЛП первого поколения значительно снизило частоту рестеноза при увеличении риска позднего ТС. Использование СЛП второго поколения сопровождалось уменьшением частоты данного осложнения, однако техника и технология стентирования сами по себе препятствуют полному восстановлению структуры и функции сосудов с соответствующим риском отсроченного нарушения функции стента. В данной ситуации следует отметить роль НА как фактора риска ОКС и позднего рецидивирования симптомов у пациентов, перенесших ЧКВ. Расширенная коронарная визуализация и длительная ДАТ, возможно, будут иметь фундаментальное значение для дальнейшего понимания и лечения этого процесса.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Сиролимус. Лечение острых коронарных синдромов
Сиролимус (ранее известный как рапамицин) и такролимус ингибируют активацию Т-лимфоцитов, как полагают, разными способами, хотя точный механизм их действия неизвестен.
Экспериментально установлено, что такролимус связывается с внутриклеточным белком FKBP-12. Затем образуется комплекс такролимус-БКВР-12 с Са2+, кальмодулином и кальцинейрином, и фосфатазная активность кальцинейрина подавляется. Этот эффект предотвращает дефосфорилирование и транслокацию NFAT — ядерного компонента, предположительно инициирующего транскрипцию генов, ответственных за образование лимфокинов (таких как IL-2, у-интерферон). В итоге подавляется активация Т-лимфоцитов, т.е. происходит иммуносупрессия. Хотя сиролимус напоминает такролимус, связываясь с FKBP-12, такролимус блокирует транскрипцию генов цитокинов (например, IL-2).
Сиролимус действует позднее, блокируя IL-2-зависимую пролиферацию Т-клеток и стимуляцию, обусловленную перекрестным связыванием CD28, возможно подавляя активацию киназы, которая у млекопитающих служит мишенью для рапамицина или mTOR. Это серин-треонинкиназа, играющая важную роль в клеточном цикле. Таким образом, считают, что сиролимус действует синергично с такролимусом, супрессируя иммунную систему. Такролимус используют также при атопическом дерматите, а сиролимус — для профилактики отторжения аллотрансплантата почки.
Цилостазол применяют для предотвращения рестеноза у пациентов, перенесших коронарную ангиопластику и имплантацию стента, а также у пациентов, имеющих в анамнезе инсульт, для профилактики повторного инфаркта мозга.

Лечение синдромов, имеющих отношение к острому инфаркту миокарда (острые коронарные синдромы). Хотя существуют разнообразные методы лечения ОИМ, общий результат (т.е. выживаемость) остается плохим. Снижение одногодичной смертности при оптимальном использовании всех доступных вмешательств составляет 20-30%. К несчастью, у многих пациентов первым симптомом ОИМ является фибрилляция желудочков, и 35-50% пациентов погибает при первом ОИМ вне больницы, еще до получения медицинской помощи.
Таким образом, пациенты с наивысшим риском летального исхода в большинстве случаев не попадают в статистку, учитывающую эффективность вмешательств. В отдаленный период предотвращение коронарной болезни сердца посредством соответствующей диеты, а также исключением факторов риска, например курения, в сочетании с применением АИД для пациентов группы высокого риска острой коронарной обструкции, вероятно, будет более эффективным, чем фармакологическое вмешательство после острого процесса.
Застойная сердечная недостаточность является наиболее частой причиной госпитализации лиц старше 65 лет в США с ежегодной регистрацией более 400 000 новых случаев. Диагноз ставят на основании нарушения сердечной функции и ухудшения переносимости физической нагрузки. Основные причины ЗСН — ишемическая болезнь сердца, гипертензия, заболевание сердечных клапанов и кардиомиопатия. Установление причины влияет на выбор лекарственной терапии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Антиаритмические средства при инфаркте миокарда. Рестеноз и стенты, элюирующие лекарственные средства после инфаркта миокарда
Антиаритмические средства используют для устранения аритмии в острой фазе ОИМ. Желудочковую аритмию, не угрожающую жизни пациента, можно устранить в/в введением лидокаи-на. Если при поступлении в больницу у пациента присутствует желудочковая тахикардия, используют прокаинамид (в/в). При фибрилляции желудочков необходима электрическая кардиоверсия. Для лечения и профилактики часто возникающих рецидивов фибрилляции желудочков и гемодинамически нестабильной желудочковой тахикардии применяют в/в введение амиодарона пациентам, рефрактерным к другим способам терапии.
Использование этих лекарственных средств значительно варьирует в разных странах и лечебных учреждениях. Ускоренный идиовентрикулярный ритм, возникающий в результате аномального автоматизма в пораженных инфарктом волокнах Пуркинье (через 2 час или более после острой фазы), можно подавить введением атропина, который, блокируя мускариновые М2-рецепторы в СА-узле и повышая его активность, восстанавливает синусовый ритм.
Применение антиаритмических средств для повышения выживаемости после ОИМ после стабилизации состояния пациента нельзя оценить однозначно.
С помощью метаанализа было показано, что в/в введение лидокаина не влияет на одногодичную выживаемость пациентов, однако в некоторых странах его продолжают вводить непосредственно после ОИМ (даже если желудочковая аритмия отсутствует или минимальна). Хотя лидокаин способен сразу же подавить не угрожающие жизни аритмии, он не увеличивает длительность выживания, и его применение может оказаться нежелательным из-за побочного действия на ЦНС (в частности, парестезии) и сердечно-сосудистую систему (асистолия).
Длительное применение антиаритмических средств класса I (прокаинамид, хинидин) или класса III (соталол, амиодарон) после острой фазы ОИМ спорно, поскольку препараты не купируют фибрилляцию желудочков и имеют побочные эффекты (включая проаритмии). Другие антиаритмические средства классов I и III можно применять длительно, однако их влияние на выживаемость не изучено (исследования CAST и SWORD). Препараты класса II — единственные антиаритмические средства, способность которых снижать смертность от ОИМ в течение года после выписки пациента из больницы доказана, хотя механизм действия этих лекарственных средств неясен (и даже может быть не связанным с подавлением аритмии).
Рестеноз и стенты, элюирующие лекарственные средства, после ОИМ и при нестабильной стенокардии. Хирургическая операция на коронарных артериях возможна непосредственно после ОИМ, а также при нестабильной стенокардии. Стенты представляют собой искусственные кровеносные сосуды, используемые для замены пораженных атеросклерозом артерий, особенно коронарных, которые невозможно восстановить другими способами. Стенты, элюирующие лекарственные средства, высвобождают препараты из своего матрикса. Стент обеспечивает высокую концентрацию местно высвобождаемого препарата.
Такой способ доставки лекарственного средства можно использовать для эффективных средств, но способных вызывать серьезные побочные эффекты при их распределении по организму после системного введения. В настоящее время существуют многочисленные разнообразные стенты, элюирующие лекарственные средства, которые оказывают антитромботическое, антипролиферативное и противовоспалительное действие: сиролимус, такролимус, эверолимус, АВТ-578, биолимус, паклитаксел, QP2, дексаметазон, 17/3-эстрадиол, батимастат, актиномицин D, метотрексат, ангиопептин, ингибиторы тирозинкиназ, винкристин, митомицин, циклоспорин и антисмысловые препараты С-тус (Resten-NG, AVI-4126). Только для трех из этих лекарственных средств их эффективность доказана в рандомизированных исследованиях — паклитаксела, сиролимуса и эверолимуса. Существенный эффект при конечной ангиографической оценке не обязательно равноценен существенному клиническому эффекту.
Безопасность и эффективность ЧKB в незащищенных левых главных коронарных артериях все еще являются спорными. В США применение стентов, элюирующих лекарственные средства, остается предметом исследований.
Общие лечебные мероприятия, которые можно провести в домашних условиях:
- дать больному аспирин - 325-500 мг - разжевать и проглотить,
- нитроглицерин (повторно) под язык при АД не менее 90 мм рт.ст.,
- дать (при наличии) b-блокатор,
- вызвать бригаду «скорой помощи».
Врач «скорой помощи» (общей практики, участковый терапевт).
На догоспитальном этапе тактика: одновременно (параллельно) проводятся диагностические и лечебные мероприятия, которые включают
- Сбор анамнеза. Выяснить характер болевого синдрома, время его возникновения и т.п. Варианты болевого синдрома:
1. Чувство боли в грудной клетке имеет очень интенсивный характер, возникает остро, почти не меняет своей интенсивности на протяжении всего приступа. Продолжительность болевого приступа от 30 мин. до нескольких часов, иногда сутки и более. Боль может прекратиться после однократного введения морфина, в других случаях она стихает на какой-то период времени и возобновляется с прежней силой. Такой болевой синдром чаще наблюдается у больных ОКС с подъемом сегмента ST.
2. Более или менее частое возникновение нескольких приступов ангинозной боли, причем во время каждого из них ощущение сжатия или жжения то усиливается, то ослабевает. Такое течение болевого синдрома более характерно при депрессии сегмента ST на ЭКГ.
3. У больных с имеющейся клиникой стенокардии (приступы -«близнецы» - стереотипность приступов) нарушается привычный стереотип возникновения болей - нестабильная стенокардия.
- физикальное обследование постоянно наблюдать за жизненными функциями - коллапс, шок, нарушения ритма, сердечная недостаточность, тампонада и др.
- регистрация ЭКГ в 12 отведениях
- решать вопрос о транспортировке больного в стационар, желательно в специализированный;
- просить данные (ЭКГ, амбулаторная карта) о предшествующих заболеваниях;
- доступ в вену;
- адекватное обезболивание (наркотические анальгетики внутривенно);
- вдыхание кислорода через носовые катетеры (скорость подачи 4-6 л в мин.).
Цели госпитализации при остром коронарном синдроме
Известно, что повлиять на размеры ИМ и смертность можно только в первые часы его развития (3-4 часа), тогда как большинство больных поступает в стационар значительно позднее. 30-40% от общего числа умирающих погибают в первые 15 мин. от начала заболевания и примерно столько же - в последующие 2 часа. Это означает, что даже при хорошо организованной экстренной помощи 2/3 смертей происходит до поступления в стационар.
- У части больных может быть предотвращено развитие ИМ.
- Антиангинальная терапия с применением антикоагулянтов и дезагрегантов может способствовать уменьшению размеров ИМ.
- Если же инфаркт миокарда возникнет - терапия будет своевременной, появится возможность реанимации больных.
В современных условиях возникает возможность проведения системного тромболизиса и на догоспитальном этапе - теплелаза.
При нормальной ЭКГ («дурная примета») необходимо повторно регистрировать ЭКГ.
В стационаре тактика определяется временем, прошедшим после появления непрекращающейся боли и динамикой ЭКГ, при этом возможны несколько вариантов ведения больных.
В стационаре при нормальной или «не диагностической» ЭКГ необходимо:
• повторно регистрировать ЭКГ;
• оценить динамику содержания маркеров некроза миокарда в крови;
• обсудить целесообразность выполнения эхокардиоскопии, велоэргометрии, коронарографии.
В зависимости от полученных результатов определить дальнейшую тактику ведения.
1. Если после появления болей
- прошло меньше 12 часов
- и наблюдаются электрокардиографические изменения -подъемы сегмента ST более ОД мВ в 2 и более отведениях, отражающие одну зону кровоснабжения миокарда, а также полная блокада ножки пучка Гиса (особенно вновь возникшая или предположительно вновь возникшая блокада левой ножки пучка Гиса), то они становятся показаниями для реперфузии коронарной артерии.
2. Если после появления болей прошло более 12 часов и симптомы сохраняются, то тактика такая же как и предыдущем варианте (хотя эффект тромболитической терапии становится сомнительным).
3. Если после появления болей прошло более 12 часов, но симптомы не сохраняются, то стоит вопрос только о лечении.
СИРОЛИМУС (SIROLIMUS) ОПИСАНИЕ
Иммунодепрессант. Действие обусловлено подавлением активации T-клеток за счет блокирования Ca 2+ -опосредованной и Ca 2+ -независимой внутриклеточной передачи сигнала; связыванием со специфическим цитозольным белком – иммунофилином. Снижает активность T- и B-лимфоцитов и подавляет отторжение аллогенного трансплантата.
Фармакокинетика
После приема внутрь быстро всасывается. Время достижения C max в крови после однократного приема здоровыми людьми составляет 1 ч, после повторного приема внутрь пациентами, находящимися в стабильном состоянии после аллогенной трансплантации почки, - 2 ч. Системная биодоступность при одновременном приеме с циклоспорином - около 14%. При повторном приеме средняя концентрация сиролимуса в крови возрастает примерно в 3 раза. Богатая жирами пища снижает C max на 34%, увеличивает время достижения C max в 3.5 раза и AUC на 35%. При разведении сиролимуса водой либо апельсиновым соком C max и AUC существенно не меняются (грейпфрутовый сок влияет на CYP3A4-опосредованный метаболизм, и поэтому его нельзя использовать для разведения препарата).
При повторном приеме внутрь у пациентов после пересадки почки T 1/2 - 46-78 ч, а C ss создаются спустя 5-7 сут. Коэффициент, отражающий соотношение концентрации в крови к концентрации в плазме, - 36 (т.е. активное вещество в значительной степени накапливается в форменных элементах крови). Средняя концентрация сиролимуса в крови - 9 нг/мл (5-14 нг/мл) после приема в дозе 2 мг/сут и 17 нг/мл (10-28 нг/мл) после приема в дозе 5 мг/сут. Сиролимус является субстратом для цитохрома CYP3A4 и для P-гликопротеина. Метаболизируется посредством О-деметилирования и/или гидроксилирования. В крови определяются 7 малоактивных (сиролимус более чем на 90% определяет иммунодепрессивное действие) основных метаболитов, включая гидроксил, деметил и гидроксидеметил. Выводится на 91% с желчью и лишь незначительная часть (2.2%) - почками.
У больных с печеночной недостаточностью (от легкой до умеренной степени тяжести - класс А или B по шкале Чайлд-Пью) средние значения AUC и T 1/2 больше (на 61 и 43% соответственно), а среднее значение клиренса на 33% меньше.
Показания активного вещества СИРОЛИМУС
Профилактика отторжения трансплантата (у взрослых пациентов с низким и умеренным иммунологическим риском после трансплантации почки, в комбинации с ГКС и циклоспорином).
Режим дозирования
Принимают внутрь. Рекомендуется применение в комбинации с ГКС и циклоспорином в течение 2-3 мес. Поддерживающая терапия при необходимости может быть продолжена в комбинации с ГКС без циклоспорина.
Начальная терапия (в течение 2-3 мес после трансплантации): насыщающая доза – 6 мг однократно в течение 48 ч после трансплантации, затем поддерживающая доза 2 мг/сут. В дальнейшем дозу следует подобрать так, чтобы C min в крови находилась в пределах 4-12 нг/мл (хроматографический метод). C min циклоспорина в крови в течение первых 2-3 мес после трансплантации должна поддерживаться на уровне 150-400 нг/мл (моноклональный метод определения концентрации).
Поддерживающая терапия: циклоспорин должен быть отменен за 4-8 нед. и дозу сиролимуса следует подбирать в зависимости от его концентрации в крови. Рекомендуется поддерживать C min в крови 12-20 нг/мл (хроматографический метод).
Побочное действие
Со стороны лимфатической системы: очень часто (10%) - лимфоцеле.
Со стороны организма в целом: часто (1-10%) - нарушение заживления ран, отеки, развитие или обострение грибковых, вирусных и бактериальных инфекций (в т.ч. вызванных микобактериями и вирусом Эпштейна-Барр).
Со стороны печени: возможно - гепатотоксичность, включая некроз печени с летальным исходом.
Данные побочные эффекты наблюдались при комбинированной терапии сиролимусом и циклоспорином.
Противопоказания к применению
Беременность, период лактации, детский и подростковый возраст, повышенная чувствительность к сиролимусу.
Применение при беременности и кормлении грудью
Применение при беременности и в период лактации противопоказано.
В экспериментальных исследованиях показаны эмбрио- и фетотоксичность сиролимуса.
Во время терапии и в течение 12 нед. после ее прекращения следует применять надежные методы контрацепции.
Неизвестно, выделяется ли сиролимус с грудным молоком у человека
Применение у детей
Особые указания
Терапию должен проводить врач, имеющий соответствующий опыт в трансплантологии.
При выборе режима дозирования сиролимуса следует учитывать его концентрацию в крови, а также клинические симптомы, результаты гистологического исследования и лабораторные данные.
Не рекомендуется применять одновременно с сильными индукторами (в т.ч. с рифампицином, рифабутин) или ингибиторами (например, кетоконазол) системы цитохрома CYP3A4, за исключением случаев, когда польза от проводимой терапии превышает риск, связанный с возможным взаимодействием.
Для оптимизации терапии у всех пациентов требуется контроль концентрации сиролимуса в крови у всех больных.
Концентрации сиролимуса в цельной крови особенно тщательно следует определять у пациентов с печеночной недостаточностью, при одновременном назначении сильных индукторов или ингибиторов микросомального окисления, а также после окончания их приема, при изменении режима дозирования сиролимуса, при снижении дозы или отмене циклоспорина.
Чтобы свести к минимуму колебания концентрации, сиролимус необходимо принимать в одно и то же время (через 4 ч после приема циклоспорина) либо с пищей, либо между ее приемами.
После проведения комбинированной терапии при отмене циклоспорина требуется коррекция режима дозирования сиролимуса.
Иммунодепрессия повышает восприимчивость к инфекциям (включая оппортунистические инфекции и сепсис, приводящие к летальному исходу), может обусловливать развитие злокачественных заболеваний (в т.ч. лимфомы), особенно кожи (воздействие солнечного света и УФ-излучения должно быть ограничено за счет применения защитной одежды и использования средств для загара с высокой степенью защиты).
У пациентов, не получавших противомикробную профилактику, были описаны случаи возникновения пневмонии, вызываемой Pneumocystis carinii (профилактику следует проводить в течение первых 12 мес после трансплантации).
Профилактику ЦМВ-инфекции рекомендуется проводить в течение 3 мес после трансплантации (особенно у пациентов с повышенным риском ее развития).
В период лечения необходим контроль концентрации липидов в крови (назначение сиролимуса сопровождается повышением холестерина и ТГ в сыворотке крови, что может потребовать лекарственной коррекции). Следует оценить соотношение пользы и риска перед началом лечения сиролимусом у пациентов с установленной гиперлипидемией. Необходимо оценивать целесообразность продолжения терапии сиролимусом у пациентов с тяжелой рефрактерной гиперлипидемией.
При комбинированной терапии с циклоспорином необходимо контролировать функции почек (у пациентов с гиперкреатининемией требуется соответствующая коррекция терапии).
При одновременном назначении с другими лекарственными средствами, обладающими нефротоксичностью, требуется осторожность.
У пациентов, получавших циклоспорин и сиролимус более 3 мес, отмечалась более высокая концентрация сывороточного креатинина и низкий КК, чем у больных, получавших циклоспорин в сочетании с азатиоприном (после успешной отмены циклоспорина отмечалась более низкая концентрация креатинина и высокий КК в сравнении с больными, продолжавшими получать циклоспорин). Не рекомендуется проводить комбинированную терапию сиролимусом и циклоспорином более 3 месяцев
Лекарственное взаимодействие
Сиролимус подвергается интенсивному метаболизму под влиянием изофермента CYP3A4 в стенке кишечника и печени, а также является субстратом для системы выведения многих лекарственных средств - P-гликопротеина тонкого кишечника
Циклоспорин (субстрат CYP3A4): применение микроэмульсионной формы циклоспорина А за 4 ч до приема сиролимуса увеличивает C max , время ее достижения и AUC последнего в 1.8, 1.4 и 1.6 раза соответственно. Прием сиролимуса одновременно или спустя 4 ч после приема циклоспорина не влияет на кинетику циклоспорина у здоровых лиц (сиролимус следует назначать с интервалом в 4 ч после приема циклоспорина).
Рифампицин (индуктор CYP3A4) снижает концентрацию сиролимуса в крови после однократного приема внутрь в дозе 10 мг, увеличивает клиренс примерно в 5.5 раза, снижает AUC и C max приблизительно на 82 и 71% (требуется коррекция режима дозирования сиролимуса и рифампицина).
Повторный прием кетоконазола (ингибитор CYP3A4) увеличивает C max , время ее достижения и AUC сиролимуса в 4.3, 1.4 и 10.9 раза соответственно (требуется коррекция режима дозирования сиролимуса и кетоконазола).
При одновременном приеме внутрь сиролимуса в дозе 10 мг и дилтиазема в дозе 120 мг C max , время ее достижения и AUC возрастают соответственно в 1.4, 1.3 и 1.6 раза. Сиролимус не влияет на фармакокинетику дилтиазема и его метаболитов - дезацетилдилтиазема и дезметилдилтиазема. При назначении дилтиазема необходимо измерять концентрации сиролимуса в крови и в случае необходимости корректировать дозу последнего.
Нельзя исключить вероятность того, что при длительной терапии сиролимусом возможно изменение эффективности пероральных контрацептивов).
Концентрация сиролимуса в крови повышается вследствие замедления его метаболизма под влиянием ингибиторов CYP3A4 (никардипин, верапамил, клотримазол, флуконазол, итраконазол, кларитромицин, эритромицин, цизаприд, метоклопрамид, бромокриптин, циметидин, даназол, ритонавир, индинавир).
Концентрация сиролимуса в крови уменьшается вследствие ускорения его метаболизма под влиянием индукторов CYP3A4 (карбамазепин, фенобарбитал, фенитоин; рифабутин, рифампицин; препараты зверобоя продырявленного).
Ингибиторы P-гликопротеина уменьшают выведение сиролимуса из клеток кишечника и повышают его концентрацию. Грейпфрутовый сок влияет на CYP3A4-опосредованный метаболизм, и поэтому его употребление не рекомендуется.
При одновременном применении с ингибиторами ГМГ-КоА-редуктазы, фибратами следует тщательно контролировать состояние пациента для выявления симптомов развития рабдомиолиза.
Читайте также:
