Внутривенные анестетики. Тиопентал и пропофол
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Тотальная внутривенная анестезия (англ. Total intravenous anesthesia, TIVA) — это метод проведения анестезии, использующий сочетание препаратов вводимых только внутривенным путем, без использования ингаляционных агентов (ингаляционная анестезия).
Невозможность проведения ингаляционной анестезии или ситуации, когда традиционные системы доставки анестетиков пациенту недоступны, непрактичны — разумные показания для проведения TIVA. Во всех других случаях TIVA может улучшить процедуру, сделав ее эффективнее и благоприятнее для пациента.
Тотальная внутривенная анестезия по сравнению с традиционной ингаляционной анестезией предлагает несколько потенциальных преимуществ.
- Снижение послеоперационной тошноты и рвоты.
- Снижение загрязнения окружающей среды.
- Предсказуемое и быстрое восстановление пациента.
- Гемодинамическая стабильность.
- Сохранение гипоксической легочной вазоконстрикции.
- Снижение внутрисосудистого давления.
- Снижение риска токсичности для органов пациента.
В последнее время TIVA становится более популярной, практичной и применяемой вследствие двух основных причин, приведенных далее.
- Улучшенные фармакокинетические и фармакодинамические свойства препаратов, таких как Пропофол, и новые опиоидные анальгетики короткого действия, которые делают их пригодными для внутривенного введения.
- Новые концепции фармакокинетического моделирования в сочетании с достижениями в области автоматизированной инфузии, которые позволяют использовать алгоритмы инфузии по целевой концентрации (TCI).
Простота и удобство использования для персонала, осуществляющего уход за больным, а также быстрое и комфортное востановление пациента являются неотъемлемыми преимуществами TIVA, проводимой при помощи инфузии по целевой концентрации (TCI) перед традиционной ингаляционной анестезией.
Комбинированные стратегии обезболивания могут быть применены, когда необходимо послеоперационное проведение анестезии. В таком случае проводниковая анестезия может использоваться до, а TIVA в послеоперационный период, чтобы ускорить восстановление пациента.
Назначение
Назначение
TIVA может проводиться как с одним, так и с комбинацией препаратов. Фармакологический профиль (фармакокинетика) препарата может прояснить его клинические аспекты и тем самым помочь в выборе лекарственного средства. Наиболее часто используемые группы препаратов — гипнотики и опиодные анальгетики короткого действия. Открытие Пропофола в 70-е годы произвело революцию в использовании TIVA. На сегодняшний день это единственный вводимый внутривенно активный гипнотический агент, предназначенный для проведения и поддержания анестезии. Преимуществами методик TIVA, основанных на пропофоле, являются: быстрое восстановление сознания и физикомоторных функций, ускоренная реабилитация пациента и низкая вероятность тошноты и рвоты в послеоперационный период. Пропофол может использоваться в сочетании с опиоидами, мышечными релаксантами и нестероидными противовоспалительными средствами в зависимости от статуса пациента или процедуры, которую необходимо выполнить. Опиоидные анальгетики короткого действия, такие, как Ремифентанил, предпочтительны при использовании методики проведения инфузии по целевой концентрации (TCI). Было замечено, что использование в плановой хирургии Ремифентанила и Пропофола при проведении TIVA с помощью TCI позволяет более эффективно контролировать оперативное вмешательство, и в тоже время ускорять процесс пробуждения пациента после анестезии. Также это подтвердилось и в амбулаторной хирургии.
Обеспечение доступа
Обеспечение доступа
Обеспечение доступа
Так как TIVA может проводиться только внутривенно, выбирать приходится между периферическим и центральным венозным доступом. Этот выбор чаще всего обусловлен состоянием пациента или количеством и типом препаратов, которые будут вводиться.
Для краткосрочных процедур, где нет необходимости в артериальном доступе, могут использоваться периферические венозные катетеры. Для пациентов, которые нуждаются в послеоперационной инфузии (тяжелобольные пациенты) или пациентов, получающих несовместимые друг с другом препараты, рекомендуется использовать многоканальные катетеры. В неонатологии или педиатрии может использоваться игла-бабочка.
Интрокан Сэйфти 3
Внутривенный катетер закрытого типа со встроенной мембраной, препятствующий вытеканию крови.
Вазофикс Браунюля/Вазофикс Церто
Внутривенный катетер с инъекционным портом

Вазофикс Сэйфти
Внутривенный катетер с инъекционным портом и системой защиты от укола иглой.
Цертофикс® Трио
Набор с трехканальным катетером для катетеризации полой вены по методу Сельдингера с возможностью ЭКГ-контроля положения катетера
Подготовка
Подготовка
Метод проведения TIVA при помощи TCI в высокой степени зависит от выбранного лекарства или режима введения, что, в свою очередь, влияет на процесс приготовления лекарственного средства. Готовые к использованию препараты могут набираться сразу в шприц или через фильтр. Для лекарств, требующих предварительного приготовления (смешивания), могут использоваться безыгольные устройства и пакеты для смешивания. В зависимости от выбора метода проведения инфузии или комбинации лекарственных препаратов могут быть доступны специальные процедурные наборы, включающие все необходимые устройства, пеленки и салфетки. Такие наборы могут сделать процедуры более безопасными и эффективными.

Омнификс Соло
Трехкомпонентный одноразовый шприц

Стерификс инъекционный фильтр
Инъекционный фильтр для аспирации раствора из стеклянных ампул
Введение
Введение
Выбор устройства для введения препарата, также как приготовление лекарства и доступ к пациенту, зависят от метода и лекарства, которое будет использоваться в проведении TIVA. Для индукции или инъекции анальгезирующего средства до вводного наркоза может использоваться шприц. Анестезия при помощи TCI проводится с применением инфузионных насосов. В последнее время инфузионные шприцевые насосы быстро развивались. На сегодняшний день автоматизированные инфузионные насосы имеют встроенные алгоритмы проведения TCI с широко используемыми в TIVA препаратами. Насосы совместимы со шприцами и удлинительными линиями, которые позволяют одновременно вводить более одного лекарственного средства. Также для совмещения или разделения потоков применяются трехходовые краны.

Дискофикс С

Омнификс Соло
Трехкомпонентный одноразовый шприц

Перфузор® Спэйс
Удобная и безопасная смена шприца

Станция Б. Браун Спэйс
Индивидуальное решение одним щелчком
Оригинальный шприц Перфузор® 50 мл
3-компонентный шприц для инфузионных насосов

Инфузомат® Спэйс
Автоматическая защита от свободного тока при извлечении системы
Реабилитация
Реабилитация
Реабилитация
Сама по себе TIVA не поддерживает послеоперационный контроль боли, однако продолжительная анальгезия может быть достигнута при комбинировании TIVA и регионарной анестезии. Если регионарная анестезия не проводилась или послеоперационная боль может быть устранена при помощи внутривенных вливаний анальгезирующего препарата, то инфузионный насос может быть незамедлительно переведен в нужный режим, тем самым улучшая общее удовлетворение пациента.

Перфузор® Спэйс
Удобная и безопасная смена шприца

Оригинальный шприц Перфузор® 50 мл
3-компонентный шприц для инфузионных насосов
Литература
Все внутривенные анестетики по продолжительности действия можно разделить на:
II. Средней продолжительности (до 20 минут): барбитураты, кетамин.
III. Длительного действия (до 60 минут): натрия оксибутират.
23.Фармакологическая характеристика неингаляционных анестетиков (пропофол, кетамин, гексенал, тиопентал, оксибутират натрия).
Пропофол — внутривенный анестетик последнего поколения. Пропофол — мощный гипнотический агент, обеспечивающий анестетическое и седативное действие, обладающий превосходной управляемостью эффекта.
Применяется в виде 1% (10 мг/мл) изотонической жировой эмульсии (ампулы 20 мл, шприцы для длительной инфузии 50 мл) в 10% соевом масле, 2,25% глицерине и 1,2% очищенных яичных фосфолипидах, что требует строгого соблюдения правил асептики при заборе из ампулы из-за риска быстрой контаминации. Начало действия препарата соответствует одному кругу циркуляции «предплечье-мозг». После введения индукционной дозы пиковый эффект наступает через 90 с, анестезия длится 5-10 мин. Быстрое распределение в тканях и интенсивный метаболизм пропофола обусловливают раннее окончание снотворного эффекта
КЕТАМИН (КАЛИПСОЛ)
Кетамин вызываемая им общая анестезия сопровождалась выраженными центральными побочными эффектами, что затрудняло работу с препаратом.
Кетамин выпускается в виде 5% раствора для введения внутривенно или внутримышечно; в РБ представлен в виде рацемической смеси S(+) и R(-) энантиомеров.
По сравнению с другими неингаляционными анестетиками кетамин действует медленнее — приблизительно через 90 с после внутри-венного введения. После внутримышечной инъекции для развития эффекта иногда требуется до 8 мин. Бывает трудно с точностью определить начало действия: пациент в течение нескольких минут может смотреть перед собой в пространство, не закрывая глаз. В отличие от большинства других анестетиков, кетамин дозозависимо увеличивает ЧСС, сердечный выброс и концентрацию норадреналина в плазме крови. На 20-40% повышаются диастолическое и систолическое АД, а так-же легочное сосудистое сопротивление.
Благоприятный фон для кетаминовой анестезии — состояние бензодиазепиновой транквилизации (диазепам 0,2-0,3 мг/кг), позволяющее избежать развития нежелательных побочных эффектов. При этом введенный в общеанестетической дозе 2 мг/кг в течение 1 мин кетамин обеспечивает спокойное наступление анестезии с выключением сознания, отсутствием реакции на внешние раздражители, без судорожных, психотических и вегетативных проявлений.
Основная область применения кетамина — диагностические и лечебные вмешательства, требующие аналгезии и выключения сознания с минимальным воздействием на жизненно важные функции.
Тиопентал натрия внутривенно болюсно вводят в 1-5% растворе, медленно — сначала 1-2 мл раствора, а затем через 30-40 с — остальное количество, необходимое для достижения наркоза. Для длительной ане-стезии капельно вводят 0,2-0,5% раствор. После однократного введения действие тиопентала натрия начинается через 10-15 с и продолжается 15-20 мин.
Начальная стадия анестезии барбитуратами кратковременна и ха-рактеризуется появлением у пациента небольшого головокружения, ощущения легкого опьянения, эйфории, исчезновения чувства тревоги, увеличения ЧСС, активацией биоэлектрической активности головного мозга на ЭЭГ. Затем контакт с пациентам утрачивается, у него снижает-ся реакция на болевые раздражения, наблюдаются быстрые движения глазных яблок, зрачки несколько расширяются, на свет реагируют, ро-говичный рефлекс сохранен. Сон наступает очень быстро, незаметно для пациента, в течение 1-2 мин. Нистагм исчезает, зрачки суживаются, глазные яблоки смещаются кверху (симптом Пирогова). На начальных (I—II) стадиях общей анестезии глоточные и гортанные рефлексы со-хранены, и введение воздуховода может вызывать кашель и даже ла-рингоспазм. В III стадии наркотического сна, не сопровождающейся хи-рургической анестезией, зрачки сужены, глазные рефлексы снижены, скелетная мускулатура, в той числе мускулатура глотки и нижней челю-сти, расслаблена, что требует использования анестезиологом приемов, препятствующих западению языка (для обеспечения проходимости ды-хательных путей)
Оксибутират натрия Обладает гипнотическим и крайне незначительным анальгетическим эффектом, элементами ноотропной активности, повышает устойчивость к гипоксии; хорошо потенцирует действие седативных и наркотическим препаратов. Считается нейротрансмиттером, хотя не вполне удовлетворяет всем требованиям, предъявляемым этому классу веществ. Является предшественником гамма-аминомасляной кислоты (ГАМК), но непосредственно на ее рецепторы не воздействует.
Фармакокинетика. Эффективен при внутривенном, внутримышечном, ректальном и пероральном применении, легко проникает через гематоэнцефалический барьер, подобно ГАМК подавляет высвобождение возбуждающих медиаторов из пресинаптических окончаний и вызывает постсинаптическое торможение. Легко метаболизируется до углекислого газа и воды, не оставляя после себя токсичных метаболитов. Метаболизм настолько эффективен, что через 4-5 часов после инъекции препарат уже не обнаруживается в крови. Незначительное количество выделяется с мочой. Длительность действия - 1 - 3 часа
Внутривенные анестетики в анестезиогии
Внутривенные анестетики (неингаляционные анестетики) используются для вводного наркоза и поддержания анестезии, а также для проведения седации. Современные препараты для внутривенной анестезии — пропофол, тиопентал и кетамин.
Сравнивая внутривенные анестетики с ингаляционными, приходится констатировать, что внутривенные анестетики менее управляемые с позиции анестезиолога. Вопрос управляемости — это возможность контролировать концентрацию анестетика на всех этапах анестезии (индукция, поддержание и пробуждение). При этом концентрацию внутривенного анестетика можно измерить только в шприце (ампуле). У ингаляционных анестетиков концентрацию можно измерить в испарителе, на вдохе и выдохе пациента.
Внутривенные анестетики имеют и свои преимущества— они не требуют наличие дополнительной аппаратуры (например, газоанализатор). Кроме этого, пропофол не заменим при выполнении коротких хирургических манипуляций (перевязки, удаление дренажей и т.д.)
Подробнее о других препаратах в анестезиологии и реаниматологии читайте здесь…
Пропофол — внутривенный анестетик

Внутривенный анестетик Пропофол (диприван, diprivan, propofol) является наиболее часто используемым в настоящее время внутривенным анестетиком. Результатом работ начала 70-х гг. прошлого столетия стала разработка 2,6-диизопропофола. Первое клиническое исследование, проведенное Kay и Rolly и опубликованное в 1977 г., подтвердило эффект пропофола как препарата для индукции в анестезию.
По причине анафилактоидных реакций, ассоциированных с кремофором в ранней химической формуле пропофола, препарат был преобразован в эмульсию. Пропофол быстро начинает действовать и имеет дозозависимое окончание действия в течение 10 мин, если вводился в течение 3 ч, и менее чем за 40 мин, когда вводился в течение 8 ч. Механизмом его действия, как полагают, является потенцирование действия γ-аминомасляной кислоты (ГАМК), что вызывает перемещение ионов хлора.
В терапевтических дозах пропофол умеренно угнетает дыхание. Он также вызывает дозозависимое снижение артериального давления, главным образом, за счет уменьшения сердечного выброса и системного сосудистого сопротивления. Уникальным свойством пропофола является его противорвотное действие, которое проявляется в концентрациях, значительно меньше седативных. Индукционная доза, сопровождающаяся потерей сознания, составляет 1–2 мг/кг с поддерживающей скоростью инфузии 100–200 мкг/кг/мин. Для продленной седации дозы от 25 до 75 мкг/кг/мин, как правило, достаточны. При скорости инфузии пропофола более 30 мкг/кг/мин, у пациентов развивается амнезия. По сравнению с мидазоламом, когда он используется в качестве основного препарата для седации, пропофол так же или лучше контролируем и обеспечивает более быстрое пробуждение.
Синдром инфузии пропофола является редким, но летальным осложнением, связанным с инфузией пропофола в дозе, равной или превышающей 4 мг/кг/ч в течение более 48 ч. Впервые он был описан у детей, но впоследствии наблюдался у тяжелобольных взрослых. Клиническими признаками синдрома инфузии пропофола являются острая рефрактерная брадикардия, приводящая к асистолии, в присутствии одного или более из следующих признаков: метаболический ацидоз (дефицит оснований более 10 ммоль/л), острый рабдомиолиз, гиперлипидемия, увеличение печени или жировой гепатоз [Kam PC, Cardone D: Propofol infusion syndrome. Anaesthesia 62:690-701, 2007]. Другие признаки включают: кардиомиопатию с острой сердечной недостаточностью, скелетную миопатию, гиперкалиемию, увеличение печени и липемию [Kang TM: Propofol infusion syndrome in critically ill patients. Ann Pharmacother 36: 1453-1456, 2002]. Теории о причинах его развития включают митохондриальную токсичность, дефекты митохондрий, нарушение оксигенации тканей и дефицит углеводов. Основными факторами риска для развития синдрома инфузии пропофола, вероятно, являются сниженная доставка кислорода к тканям, сепсис, тяжелое повреждение головного мозга и высокие дозы пропофола. В некоторых исследованиях было отмечено нарастание липемии, вероятно, связанное с нарушением печеночной регуляции вследствие сниженной оксигенации, низкого уровня глюкозы или сочетания этих факторов. В некоторых случаях рост липемии был первым признаком развития синдрома инфузии пропофола, в связи с чем она не должна рассматриваться как неопасный признак [Ahlen K, Buckley CJ, Goodale DB, Pulsford AH: The «propofol infusion syndrome»: The facts, their interpretation and implications for patient care. Eur J Anaesthesiol 23:990-998, 2006].
С целью седации пропофол рекомендован в интенсивной терапии. Однако существуют и альтернативы, например ингаляционная седация севофлураном или изофлураном с помощью устройства AnaConDa, подробнее читать здесь…
Тиопентал — внутривенный анестетик
Внутривенный анестетик тиопентал был введен клиническую практику Waters и Lundy в 1934 г. и стал популярным из-за быстрого начала и короткой продолжительности действия, без возбуждающих эффектов. Несмотря на критику препарата, как «идеальную форму эвтаназии в военно-полевой хирургии», барбитураты по-прежнему широко используются в клинической практике. Тиопентал обеспечивает быстрое начало анестезии при болюсном использовании, но он быстро накапливается при длительном применении и ведет к замедленному восстановлению.
Барбитураты используют в виде натриевой соли на водной основе при щелочном рН. Так же как и пропофол, они оказывают гипнотический эффект в значительной степени путем воздействия на ГАМК-рецепторы. Барбитураты используются для вводного наркоза. Для поддержания длительной анестезии применять тиопетал (как основного препарата) не рекомендуется.
Тиопентал вызывает умеренное дозозависимое снижение артериального давления (главным образом, в результате периферической вазодилатации) и респираторного драйва. Барбитураты противопоказаны пациентам с порфирией.
Индукционная доза тиопентала составляет 4 мг/кг и вводится в течение 5–15 с. Существует меньшая вариабельность среди пациентов в ответ на дозу барбитуратов по сравнению с бензодиазепинами, для введения в наркоз, но значительная вариабельность дозировки тиопентала, требуемой для индукции в анестезию, все еще существует.
Кетамин — внутривенный анестетик

Внутривенный анестетик Кетамин (кеталар, калипсол) был синтезирован в 1962 г. Stevens и впервые был использован на людях в 1965 г. Corssen и Domino. Кетамин был выпущен для клинического использования в 1970 г. и до сих пор используется в различных клинических ситуациях. Кетамин — производное фенциклидина, принципиально отличается от вышеперечисленных гипнотиков. Он вызывает диссоциативные состояния гипноза и аналгезии. Кетамин отличается от большинства других препаратов, используемых для анестезии, наличием выраженного обезболивающего эффекта.
Кетамин не угнетает сердечно-сосудистую и дыхательную системы, но обладает неблагоприятными психологическими эффектами которые происходят во время восстановления сознания после анестезии кетамином и определяются как реакции пробуждения. Общие признаки этих реакций, которые различаются по степени тяжести и проявлениям, включают яркие сновидения, ощущение выхода из телесной оболочки (чувство плавающего тела) и иллюзии (неправильная интерпретация реального, внешнего чувственного опыта). Эти сновидения и иллюзии часто бывают связаны с волнением, спутанностью сознания, эйфорией и страхом.
Интерес к внутривенному анестетику кетамину увеличился в последнее время из-за его влияния на состояние гипералгезии и толерантности к опиатам, использования при хронических болевых синдромах, потенциального нейропротекторного действия.
Кетамин используется для индукции и поддержания анестезии. Кетамин действует главным образом, через N-метил-D-аспартатные (NMDA-) рецепторы. Действие кетамина в высоких дозах связано с выраженными неблагоприятными психологическими последствиями и рядом других побочных эффектов. На современном этапе он используется в первую очередь в качестве аналгетического компонента. Он имеет быстрое начало действия и относительно быстрое восстановление, даже после инфузии в течение нескольких часов. Он обладает симпатомиметическим эффектом, поддерживающим функцию сердца. Кетамин оказывает минимальное влияние на дыхание и состояние вегетативной нервной системы. Индукционная доза кетамина составляет 2–4 мг/кг внутривенно. Инфузия кетамина обеспечивает аналгезию, и он может быть использован в сочетании с пропофолом для проведения тотальной внутривенной анестезии. Предоперационное введение кетамина в дозе 10–20 мг используется в качестве упреждающей аналгезии (0,15-0,25 мкг/кг в/в).
Внутривенные анестетики. Тиопентал и пропофол
Внутривенные анестетики. Тиопентал и пропофол
В течение 50 лет препаратом выбора был тиопентал, но в 1990-е гг. начали применять пропофол. Для индукции и поддержания анестезии в кардиохирургии или для хирургических больных с низким сердечным выбросом в течение 25 лет использовали большие дозы фентанила и суфентанила, но при этом необходима была послеоперационная искусственная вентиляция легких (ИВЛ).
Кетаминовую анестезию сопровождает симпатическая стимуляция, которая желательна для анестезии у больных с циркуляторным шоком или острым бронхоспазмом. К сожалению, при пробуждении от кетамино-вого наркоза больного могут беспокоить галлюцинации.
Фармакокинетические и фармакодинамические характеристики тиопентала и пропофола. Тиопентал хорошо растворяется в липидах. Для придания ему водорастворимых свойств его смешивают с гидрокарбонатом натрия. Пропофол совсем не растворяется в воде, поэтому для в/в введения готовят эмульсию из масла соевых бобов, лецитина и гликоля. Высокая растворимость тиопентала и пропофола в липидах позволяет им легко проходить через гематоэнцефалический барьер.
После инъекции оба препарата быстро попадают в мозг, и бессознательное состояние наступает в течение 30 сек. Затем концентрация в мозге снижается, и препарат перераспределяется в другие хорошо кровоснабжаемые ткани с низким содержанием липидов. Перераспределение и отсутствие метаболизма являются причиной ультракороткой продолжительности действия и пробуждения через 10 мин после разовой дозы тиопентала или пропофола.
Метаболизм тиопентала в печени протекает медленно. Вследствие аккумуляции препарата после введения повторных доз тиопентала пробуждение происходит медленно. Пропофол, наоборот, быстро метаболизируется и перераспределяется в тканях, поэтому его можно вводить в/в для поддержания анестезии.
Медленный метаболизм бензодиазепинов и большинства наркотических анальгетиков не позволяет использовать их по отдельности в качестве вводного наркоза. К тому же обе группы лекарственных средств могут не вызвать полного бессознательного состояния. Выраженное послеоперационное состояние дремоты, являющееся следствием низкой скорости метаболизма, клинически неприемлемо. Исключение составляет опиоид ремифентанил, вводимый в/в. Он очень быстро метаболизируется тканевой эстеразой.
Клиническое применение и токсичность тиопентала и пропофола. Тиопентал также используют в реанимации для прекращения судорог и лечения повышения внутричерепного давления. Тиопентал не используют как седативное средство, поскольку в малых дозах он снижает болевой порог и вызывает парадоксальное эмоциональное возбуждение. При использовании ларингеальной маски с последующим введением тиопентала необходимо применять миорелаксанты для свободного наложения маски и предотвращения ларингоспазма.
Если вводят пропофол, миорелаксанты не нужны. Введение пропофола не вызывает в раннем послеоперационном периоде дремоту и в меньшей степени сопровождается тошнотой и рвотой, поэтому он подходит для ежедневного применения в хирургической практике, хотя стоит дороже тиопентала. Как и ингаляционные анестетики, тиопентал и пропофол угнетают дыхательный центр и оказывают дозозависимый угнетающий эффект на сердечный выброс и артериальное давление. Пропофол противопоказан пациентам с аллергией на яйца и соевые бобы, а тиопентал — больным с острой перемежающейся порфирией.
- Вернуться в оглавление раздела "фармакология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Журнал «Медицина неотложных состояний» 3 (42) 2012
Сравнение влияний разных гипнотиков на состояние пациента во время анестезии и в раннем послеоперационном периоде
Авторы: Дагеш Атеф, ГУ «Днепропетровская медицинская академия МЗ Украины»
Версия для печати
В статье рассматриваются возможности препаратов тиопентал натрия и пропофол на основании показателей BIS-мониторинга, их влияние на состояние сознания пациента во время анестезии и высших психических функций в раннем послеоперационном периоде.
Summary. This article discusses the effects of sodium thiopental and propofol on the basis of BIS monitoring indicators and their impact on the patient’s consciousness during anesthesia and higher mental functions in the early postoperative period.
Резюме. У статті розглядаються можливості препаратів тіопентал натрію і пропофол на підставі показників BIS-моніторингу, їх вплив на стан свідомості пацієнта під час анестезії та вищі психічні функції в ранньому післяопераційному періоді.
Тиопентал натрия, пропофол, BIS-мониторинг, высшие психические функции.
Key words: sodium thiopental, propofol, BIS monitoring; higher mental functions.
Ключові слова: тіопентал натрію, пропофол, BIS-моніторинг, вищі психічні функції.
Каждый гипнотический препарат имеет свои преимущества и недостатки, и выбор анестетика осуществляется индивидуально, в зависимости от состояния пациента и характера хирургического вмешательства. Как в зарубежной, так в отечественной литературе ведущее место в последние годы для проведения внутривенной анестезии занимает пропофол [1, 2]. Но это не отменяет места тиопентала натрия в анестезиологии, который является хорошей альтернативой во многих ситуациях.
На сегодняшний день использование BISмониторинга дает возможность изучить влияние анестетика на уровень сознания пациента и оценить эффективность проводимой анестезии [3–5].
Цель работы: оценить адекватность анестезии препаратами тиопентал натрия и пропофол и влияние этих препаратов на высшие психические функции в раннем послеоперационном периоде.
Материалы и методы
Исследование проводилось на базе отделения анестезиологии и интенсивной терапии № 1 КУ «Областная клиническая больница им. И.И. Мечникова» (г. Днепропетровск). После получения разрешения локального этического комитета и письменного согласия пациентов в исследование были включены 35 человек, которые подлежали оперативным вмешательствам на органах желудочнокишечного тракта: фенестрация кисты печени — 2, холецистэктомия — 8, пластика вентральной грыжи — 7, холецистэктомия и холедохолитотомия — 4, гемиколэктомия — 2, билиодигестивный анастомоз — 3, панкреатодуоденальная резекция — 2, пластика пищеводного отверстия — 1, дренирование желчных путей — 2, закрытие стомы — 1, резекция желудка — 1.
Пациенты были разделены на две группы: в первой анестезия проводилась пропофолом (20 пациентов), а во второй — тиопенталом натрия (15 пациентов). Все анестезии проходили под контролем BISмониторинга (BIS VISTA).
Предоперационный осмотр был проведен за день до оперативного вмешательства. Обследование включало регистрацию демографических данных, сбор жалоб и анамнеза, физикальное обследование, а также лабораторное и инструментальное исследования. Для премедикации были назначены феназепам на ночь 0,003–0,005 г (3–5 мг); сибазон 0,5% 2 мл, атропин 0,1% 0,01 мл/кг, морфин 1% 1 мл или промедол 2% 1 мл за 40 минут до начала операции. Для вводного наркоза в первой группе использовались: сибазон 0,5% 2 мл, фентанил 3 мкг/кг, пипекуроний 0,06 мг/кг, пропофол, а во второй вместо пропофола — ГОМК 10 мл, тиопентал натрия 1%. Для поддержания анестезии вводился тиопентал натрия или пропофол инфузионно и скорость инфузии регулировали в зависимости от значений BIS, фентанил вводился по схеме 10 мкг/кг за первый час операции, 5 мкг/кг — за второй час операции и 3 мкг/кг в последующем.
Восстановление сознания больного после операции определялось спонтанным открыванием глаз, полным восстановлением рефлексов и выполнением таких команд, как «покажите язык», «сожмите мне руку», «поднимите голову».
Для оценки состояния высших психических функций (память, внимание и мышление) пациенты проходили тестирование за день до оперативного вмешательства, через сутки и на седьмой день после операции.
Данные в тексте представлены в виде среднего арифметического для параметрических данных и в виде медианы [нижний и верхний квартили] для непараметрических данных. Статистический анализ проводился при помощи программы Statistica 6.
Результаты и их обсуждение
Характеристика больных приведена в табл. 1.

Использование BISмониторинга дало нам возможность регистрировать состояние сознания у исследуемых больных и в дальнейшем посчитать временной индекс (отношение длительности повышения/снижения показателей к общей длительности операции) поверхностной анестезии (значение BIS выше 60) и переуглубления уровня сознания (значение BIS ниже 40).
В среднем в первой группе временной индекс поверхностной анестезии составил 3,6 [0,00–7,27] %, а во второй группе — 4,2 [1,1–7,1] %, тогда как временной индекс чрезмерно глубокой анестезии в первой группе составил 14,7 [7,2–26,6] %, а во второй группе — 15,8 [7,2–27,5] %. Как видно, показатели в двух группах не сильно отличаются. Это свидетельствует о том, что управляемость анестезии у тиопентала натрия и пропофола одинаковая, несмотря на различия в длительности действия этих препаратов.
С другой стороны, скорость восстановления сознания после окончания операции в первой группе составляла в среднем 6,2 мин, а во второй группе — 22,06 мин, что достоверно выше (p < 0,0001). Такое явление связано с особенностями фармакокинетики тиопентала натрия.
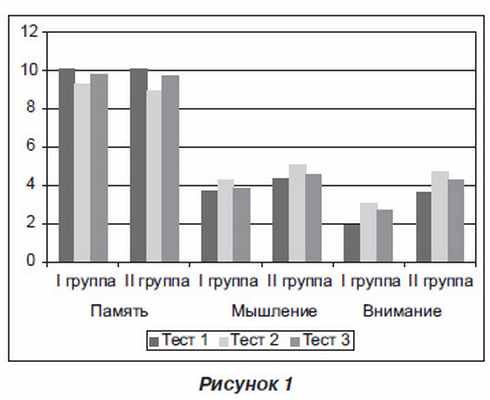
В обеих группах наблюдалось нарушение состояния высших психических функций на втором и на третьем этапе исследования по сравнению с исходным уровнем до операции. В первой группе по сравнению с первым тестированием состояние памяти, мышления и внимания при втором тестировании ухудшалось соответственно на 6,81 % (р = 0,0051), 22,37 % (р = 0,0498) и 65,35 % (р = 0,0006), а на третьем этапе — на 2,35 % (р = 0,0431), 8,16 % (р > 0,05) и 54,82 % (р = 0,0033). Во второй группе ухудшение составило на втором этапе соответственно 11,25 % (p = 0,0025), 16,93 % (p = 0,0268) и 29,11 % (p = 0,0265), а на третьем этапе — 2,75 % (p > 0,05), 2,81 % (p = 0,0455) и 16,36 % (p > 0,05). Как видно, нарушения состояния высших психических функций в обеих группах больше наблюдались на первые сутки после операции, имелась тенденция к их восстановлению к седьмым суткам.
При сравнении двух групп достоверные отличия были только на третьем этапе исследования мышления (седьмой день) (p = 0,0301) и на втором этапе исследования внимания (первые сутки) (p = 0,0274).
Таким образом, нами выявлено, что действие тиопентала натрия и пропофола на состояние высших психических функции при адекватном имеющемся уровне сознания во время проведения анестезии сильно не отличается.
Выводы
1. C использованием BISмониторинга не выявлено различий между тиопенталом натрия и пропофолом во влиянии на уровень сознания, управляемость анестезии, состояние высших психических функций в раннем послеоперационном периоде.
2. Тиопентал натрия удлиняет время восстановления сознания после окончания операции.
1. Гельфанд Б.Р., Гологорский В.А., Мамонтова О.А. и др. // Вестник инт. терап. — 1999. — 1. — 4245.
2. Лекманов Л.У., Розанов Е.М. // Вестник инт. терап. — 1999. — 1. — 2731.
3. Галушка С.В., Лазарев К.В. Практические рекомендации по использованию BISмонитора во время анестезии.
4. Sandin R., Enlund G. Awareness During Anesthesia: A Prospective Case Study // The Lancet. — 2000. — Vol. 355.
5. Myles P.S., Leslie K. et al. Bispectral index monitoring to prevent awareness during anaesthesia: the BAware randomised controlled trial // Lancet. — 2004. — 363. — 175763.
Читайте также:
