Волокнистые структуры пульпы. Биохимия пульпы
Добавил пользователь Валентин П. Обновлено: 29.01.2026
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«ИВАНОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАФЕДРА БИОХИМИИ
ОСОБЕННОСТИ
СТРУКТУРЫ
И МЕТАБОЛИЗМА
ТКАНЕЙ
ЗУБА
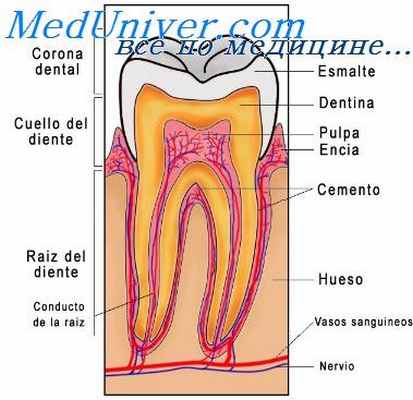
ХИМИЧЕСКИЙ СОСТАВ ТКАНЕЙ
ЗУБА
ВЕЩЕСТВА, %
неорганические
органические
вода
ЭМАЛЬ
95
1,2
3,8
ДЕНТИН
70
17-20
10-13
ЦЕМЕНТ
65-70
20-25
10
КОСТЬ
45
30
25
Основной минеральный компонент - АПАТИТЫ
Эмаль - самая твердая,
резистентная к изнашиванию,
минерализованная ткань
организма человека,
покрывающая коронку зуба.
Толщина эмали
на разных поверхностях зуба
неодинакова.
СТРУКТУРА ЭМАЛИ
Основной структурный компонент –
ЭМАЛЕВЫЕ ПРИЗМЫ
Длина призмы превышает толщину эмали.
Призмы концентрируются в пучки, образуя Sподобные изгибы.
Диаметр – 4-6 мкм.
Общее число на зуб – 5 – 12 млн.
ВИДЫ ЭМАЛИ
призменная эмаль
межпризменная эмаль
локализована между
эмалевыми призмами
кристаллы гидроксиапатита
расположены под прямым
углом к кристаллам,
формирующим
призмы
меньшая степень
минерализации
беспризменная эмаль
внутренний слой эмали
вдоль дентино-эмалевой
границы
Развитие кариозного процесса:
Поражение периферической
части призм
Поражение
межпризматического
пространства
Поражение центральной части
призм
СОСТАВ ЭМАЛИ
Органические вещества
Белки
Липиды
Гликозаминогликаны
Э
М
А
Л
Ь
Апатитные
формы
Ca10(PO4)6(OH)2
Ca10(PO4)6F2
Ca10(PO4)6CO3
Минеральные вещества
Вода
(связанная и свободная)
Неапатитные
формы
Ca3(PO4)2
CaСO3
CaF2
Mg3(PO4)2
НЕОРГАНИЧЕСКИЙ КОМПОНЕНТ
ЭМАЛИ
АПАТИТ
СТРОЕНИЕ
Гидроксиапатит
Ca10(PO4)6(OH)2
Карбонатный апатит
Ca10(PO4)6CO3
Хлорный апатит
Ca10(PO4)6Cl2
Фторапатит
Ca10(PO4)6F2
Стронциевый апатит
Ca9Sr(PO4)6(OH)2
Каждый кристалл покрыт
гидратной оболочкой.
Между кристаллами –
микропространства, заполненные
эмалевой жидкостью.
НЕОРГАНИЧЕСКИЙ КОМПОНЕНТ
ЭМАЛИ
Свойства эмали зависят от соотношения Ca/P.
Оптимальное соотношение Ca/P = 1,67.
Чем оно больше, тем выше её резистентность
к кислотному разрушению.
ФТОРАПАТИТ –
наиболее кариесрезистентный апатит эмали.
При низких концентрациях фтора
Ca10(PO4)6(OH)2 + 2F- → Ca10(PO4)6F2 + 2(OH)При высоких концентрациях фтора
Ca10(PO4)6(OH)2 + 20F- → 10CaF2 + 6PO43- + 2(OH)растворение эмали
ОРГАНИЧЕСКИЙ МАТРИКС ЭМАЛИ
составляет 1,2% вещества эмали
тесно связан с кристаллами солей
обеспечивает рост и ориентацию кристаллов
по мере созревания сохраняется в виде тончайшей белковой
сетки
БЕЛКИ ЭМАЛИ:
тафтелин
энамелин
амелогенин
БЕЛКИ ЭМАЛИ
ТАФТЕЛИН
338 аминокислот
β-структура
роль сигнального
белка
белок
дифференциации
проамелобластов
ЭНАМЕЛИН
3 этапа жизни:
высокомолекулярный (внешний слой эмали),
большой энамелин,
низкомолекулярный энамелин (глубокие слои эмали)
содержит много СЕР и ГЛУ
нуклеатор минерализации
формирует центр кристалла
определяет позицию и ориентацию кристалла
АМЕЛОГЕНИН
216 аминокислот
общий фрагмент с энамелином
наличие постоянного мотива
ГЛН-ГЛН-ПРО-МЕТ-МЕТ-ПРО
несколько этапов созревания
нуклеатор кристаллизации
регулирует рост и размер кристалла
ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ
В ЭМАЛИ
Амелогенез включает 3 стадии:
Стадия секреции и первичной минерализации – энамелобласты
выделяют органическую основу, которая сразу подвергается
минерализации.
II. Стадия созревания (вторичной минерализации) – дальшейшее
обызвествление путём удаления большей части органического
матрикса.
III. Стадия конечного созревания (третичной минерализации) –
завершение минерализации после прорезывания зубов.
I.
ПЕРВИЧНАЯ МИНЕРАЛИЗАЦИЯ ЭМАЛИ
Присоединение кальция и фосфата
к гамма-карбоксильным и спиртовым группам
радикалов аминокислот энамелина (амелогенина)
Формирование длинных и тонких кристаллов гидроксиапатитов
Встраивание кристаллов в органический матрикс параллельно друг
другу
Утолщение кристаллов и формирование плоских шестиугольных
призм
Формирование первичной незрелой эмали
ПРОНИЦАЕМОСТЬ ЭМАЛИ
Основной путь поступления веществ –
простая и облегченная диффузия.
Проницаемость эмали зависит от:
1) размеров микропространств, заполненных водой, в структуре эмали
2) размера иона или размера молекулы вещества
3) градиента концентрации ионов
4) способности этих ионов или молекул связываться с компонентами эмали
5) рН среды
ИЗОИОННЫЕ ЗАМЕЩЕНИЯ
Роль слюны в поддержании постоянства эмали
Кристалл гидроксиапатита
Са10(РО4)6(OH)2
Мицелла слюны
Ca2+
Ca2+
HPO42-
X
Ca2+
Ca3(PO4)2
ДЕМИНЕРАЛИЗАЦИЯ ЭМАЛИ
Са10(РО4)6 (OН)2 + 8H+ →10Ca2 + + 6HPO42- + 2H2O
нерастворимое
соединение
Кислоты
пищи
Кислые продукты
жизнедеятельности
микроорганизмов
H+
Са10(РО4)6 (OН)2
HPO42Ca2+
Изменение формы кристаллов
Изменение размера кристаллов
РЕМИНЕРАЛИЗАЦИЯ ЭМАЛИ
Реминерализация –
переотложение минералов,
потерянных эмалью,
способствующее частичному
восстановлению плотности
повреждённой эмали.
ДЕНТИН
обызвествлённая ткань зуба, оставляющая его основную массу и
определяющая его форму
в области коронки покрыт эмалью, в области корня – цементом
крепче кости и цемента, но 4-5 раз мягче эмали
состоит из межклеточного вещества, пронизанного дентиновыми
канальцами
по сравнению с эмалью содержит больше воды и органического
матрикса .
ХИМИЧЕСКИЙ СОСТАВ ДЕНТИНА
ЗРЕЛЫЙ
ДЕНТИН
70%
неорганические
вещества
17%
органические
вещества
13%
вода
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
ДЕНТИНА
95%
5%
коллаген
I типа
неколлагеновые
белки
костный сиалопротеин
матриксный белок дентина-1
остеопонтин
дентинфосфопротеин
дентинсиалопротеин
Много
ПРОТЕОГЛИКАНОВ
(хондроитин-4-сульфат, хондроитин-6-сульфат),
ГИАЛУРОНОВОЙ КИСЛОТЫ,
ЛИПИДОВ.
ДЕНТИННЫЕ ТРУБОЧКИ
Выделяют 2 главные структурные единицы:
основное вещество
дентинные трубочки, которые
начинаются от пульпо-дентинной границы и заканчиваются вблизи эмалеводентинного соединения.
Диаметр дентинных трубочек достигает 2-5 мкм, сужаясь по направлению от
центра зуба к эмалево-дентинному соединению.
Дентинные трубочки на поперечном шлифе имеют округлую или овальную
форму. Края их неровные, как следствие процессов де- и реминерализации,
в которых участвует околотрубочковый дентин.
В дентинных канальцах содержатся отростки специфических клетокодонтобластов, тела которых расположены по периферии пульпы
ДЕНТИННАЯ ЖИДКОСТЬ
транссудат периферических капилляров пульпы
по белковому составу сходна с плазмой крови
содержит гликопротеины и фибронектин
служит важным путём поступления различных веществ
из пульпы к дентино-эмалевой границе
при развитии кариеса служат путём распространения
микроорганизмов
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
ДЕНТИНА
Минеральная основа - кристаллы
Кристаллы откладываются в виде зёрен и комочков,
которые сливаются в шаровидные образования - калькосфериты
АПАТИТ
СТРОЕНИЕ
Гидроксиапатит
Ca10(PO4)6(OH)2
Карбонатный апатит
Ca10(PO4)6CO3
Хлорный апатит
Ca10(PO4)6Cl2
Фторапатит
Ca10(PO4)6F2
Много МАГНИЯ, КАРБОНАТОВ и ФТОРА!
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
ДЕНТИНА
АПАТИТ
СТРОЕНИЕ
Гидроксиапатит
Ca10(PO4)6(OH)2
Карбонатный апатит
Ca10(PO4)6CO3
Хлорный апатит
Ca10(PO4)6Cl2
Фторапатит
Ca10(PO4)6F2
Общая формула апатитов:
А10(ВО4)6С2
где
А – Са, Sr, Ba, Cd, Pb…
B – P, As, V, Cr, Si…
C – F, OH, Cl, CO3…
В составе дентина – минимум 41 элемент таблицы Д.И.Менделеева.
Количество элементов зависит от характера питания и содержания
во внешней среде.
ВИДЫ ДЕНТИНА
Виды дентина
Характерные особенности
ПЕРВИЧНЫЙ
Образуется в период формирования и
прорезывания зуба
ВТОРИЧНЫЙ
(регулярный
вторичный дентин,
физиологический
вторичный дентин)
Образуется в сформированном зубе после
прорезывания и является продолжением
первичного дентина.
Меньшая скорость образования.
Менее упорядочен.
Меньшая минерализация.
Трубочки малочисленны и более узкие.
ТРЕТИЧНЫЙ
(иррегулярный
вторичный дентин,
репаративный
дентин)
Образуется в ответ на действие патогенных
факторов.
Формируется более или менее локально.
Неравномерно и слабо минерализован.
Характеризуется неправильным ходом или
отсутствием трубочек.
ДЕНТИНОГЕНЕЗ
Образование дентина и поддержание его состава неразрывно связано с
пульпой зуба. Вместе эти ткани формируют дентино-пульпарный
комплекс.
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
ЦЕМЕНТА
90%
коллаген
I типа
5%
5%
коллаген
III типа
неколлагеновые белки
костный сиалопротеин – участвует в процессах минерализации и
превращении прецементобластов в цементобласты
остеопонтин – регулирует миграцию клеток в период
цементообразующей активности
специфический цементосвязывающий белок – способствует адгезии и
перемещению мезенхимальных клеток
фибронектин - связывании периодонтальных волокон с цементом зуба.
ундулин - обеспечивают связывание компонентов межклеточного
матрикса, участвует в развитии и дифференцировке клеток
ламенин
ПУЛЬПА
рыхлая волокнистая соединительная ткань зуба
богата сосудами
богата иннервацией
ФУНКЦИИ ПУЛЬПЫ:
1. ПЛАСТИЧЕСКАЯ – синтез дентина, коллагена,
протеогликанов, фибронектина, образование вторичного
дентина.
2. ТРОФИЧЕСКАЯ – обеспечивает транспорт метаболитов
к одонтобластам.
3. СЕНСОРНАЯ
4. ЗАЩИТНАЯ
ХИМИЧЕСКИЙ СОСТАВ ПУЛЬПЫ
5%
ПУЛЬПА
неорганические
вещества
40%
органические
вещества
Коллаген I, III,
V и VI типа
Глицерофосфолипиды
Холестерин
Жирные
кислоты
55%
вода
КЛЕТОЧНЫЙ СОСТАВ ПУЛЬПЫ
Одонтобласты
соединены различными видами межклеточных контактов
выполняют барьерную функцию
обеспечивают избирательное прохождение ионов и низкомолекулярных
веществ.
осуществляют синтез коллагена
инициируют минерализацию дентина
осуществляется доставка питательных компонентов к твёрдым тканям
зуба
содержат в мембране особые белки: виментин и нестин - адгезивные
белки, клатрин - обеспечивает транспорт деградируемых или
фрагментированных молекул внутриклеточного матрикса
Фибробласты
синтез компонентов самой пульпы - коллагена и кислых ГАГ
синтез коллагеназ
ПЕРИОДОНТ
Периодонт –
совокупность структур, которые окружают зуб и обеспечивают его
соединение с челюстными костями:
периодонтальная связка
цемент
костная ткань альвеолы
десна.
Воспалительное заболевание, поражающее эти структуры –
периодонтит.
Патохимические изменения при периодонтите:
1. Уменьшение содержания в десне коллагеновых и неколлагеновых
белков.
2. Резкое возрастание в десне содержания кислых мукополисахаридов
(ГАГ).
3. Повреждение клеточных мембран.
1.4. Пульпа
Пульпа зуба – это соединительнотканное образование, состоящее из клеток и основного вещества.
Одонтобласты – это высокодифференцированные клетки пульпы, основная функция которых – образование дентина. В субодонтобластическом слое располагаются малодифференцированные клетки – пульпоциты, которые могут превращаться в одонтобласты. Обязательным компонентом пульпы являются фибробласты, которые создают рыхлую волокнистую соединительную ткань, которая замещает мезенхиму зубного сосочка. Защитную функцию в мякоти зуба выполняют макрофаги и плазматические клетки, при воспалительных процессах протективные свойства также может проявить и эндотелий кровеносных сосудов. Макрофаги секретируют факторы, индуцирующие продукцию коллагена фибробластами, а также лизоцим, интерферон, простагландины, циклические нуклеотиды, лизосомальные (кислые гидролазы, ДНК-азы и другие) и нелизосомальные (коллагеназа, эластаза и другие) ферменты.
В молодой пульпе меньше волокон коллагена и больше клеточных элементов. По мере ее старения количество клеток начинает уменьшаться.
Основное вещество (межклеточной матрикс) соединительной ткани состоит из представителей четырех классов: коллагена, протеогликанов, неколлагеновых структурных гликопротеидов и эластина. В матрикс наряду с нерастворимыми фибриллярными структурами погружены и клеточные образования (фибро-, дентинобласты, пульпоциты и др.).
На строении коллагена мы подробно останавливались в предыдущем разделе. Эластин, как и коллаген, содержит много глицина и пролина, количество гидроксипролина невелико, совсем отсутствует гидроксилизин, однако много в его составе валина. По механическим свойствам эластин отличается от коллагена высокими растяжимостью и эластичностью. Процент «сшивок» в молекуле данного белка исключительно высок, встречаются и многокомпонентные «сшивки» в виде узлов, как, например, в случае образования производных десмозина (рис. 5). Эластин преобладает в тканях, подвергающихся периодическому «растяжению – сокращению»: крупные кровеносные сосуды, связки, легкие. В связи с этим среди волокнистых структур пульпы этот протеин практически отсутствует, однако он имеется в тканях пародонта.
Рис. 5. Внутримолекулярная окислительная конденсация в эластине, приводящая к образованию десмозина.
Протеогликаны состоят из углеводного и белкового компонентов. Первый представлен гликозамингликанами – линейными полисахаридами, построенными из повторяющихся дисахаридов. Важнейшими из них являются:
а) Гиалуроновая кислота, состоящая из дисахаридных фрагментов, соединенных -1,4-гликозидными связями. В свою очередь в состав фрагмента входят D-глюкуроновая кислота и N-ацетил-D-глюкозамин, связанные -1,3-гликозидными связями. Молекулярная масса гиалуроновой кислоты равняется 10 5 -10 7 Да. Растворы ее обладают высокой вязкостью за счет ее большой способности связывать воду (1 г может связать 0,5 л воды), поэтому они участвуют в регуляции проницаемости соединительной ткани, обеспечивая ее защиту от действия болезнетворных бактерий.
б) Хондроитин-сульфаты, отличающиеся от гиалуроновой кислоты тем, что в них N-ацетил-D-глюкозамин заменен на сульфатированный (в 4 или 6 положении) N-ацетил-D-галактозамин. Мr=10-60 кДа.
Поскольку гликозамингликаны в организме человека в чистом виде не встречаются, а всегда связаны с белком, то пептидный компонент протеогликанов синтезируется на полирибосомах, связанных с эндоплазматическим ретикулумом: пептидная цепь пронизывает мембрану и наращивается в сторону полости эндоплазматической сети, где начинается синтез углеводной части протеогликанов. Гликозамингликаны связываются с белком через гидроксильные группы серина. Здесь же в полости ретикулума происходит и сульфатирование углеводного компонента. В процессе синтеза вновь образованные молекулы перемещаются к аппарату Гольджи, где они включаются в секреторные гранулы и происходит экзоцитоз в составе этих гранул.
К одной полипетидной цепи последовательно прикрепляются цепи хондроитинсульфатов, образуя фигуру, напоминающую щеточку («ершик») (рис. 6).
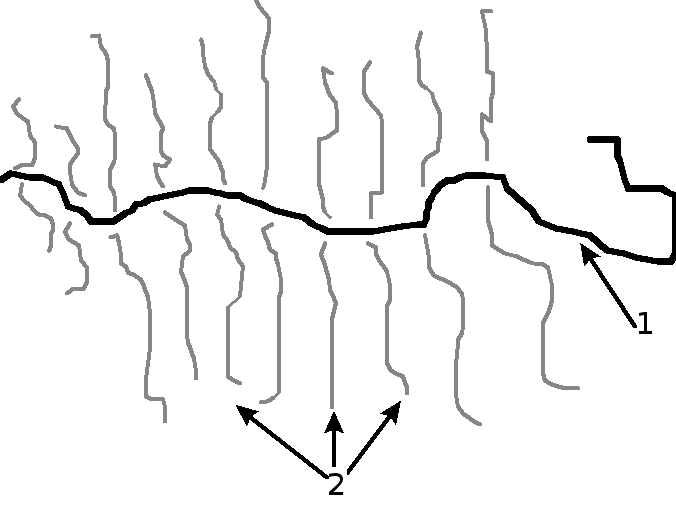
Рис. 6. Строение протеогликана: 1 – полипептидная цепь; 2 – молекулы хондроитинсульфатов.
В межклеточном веществе протеогликаны образуют комплексы, в составе которых к молекуле гиалуроновой кислоты прикреплены полюсами хондроитинсульфатные протеогликановые единицы, образуя ствол с разветвленными ветвями или щетку, состоящую из малых щеточек (рис. 7).
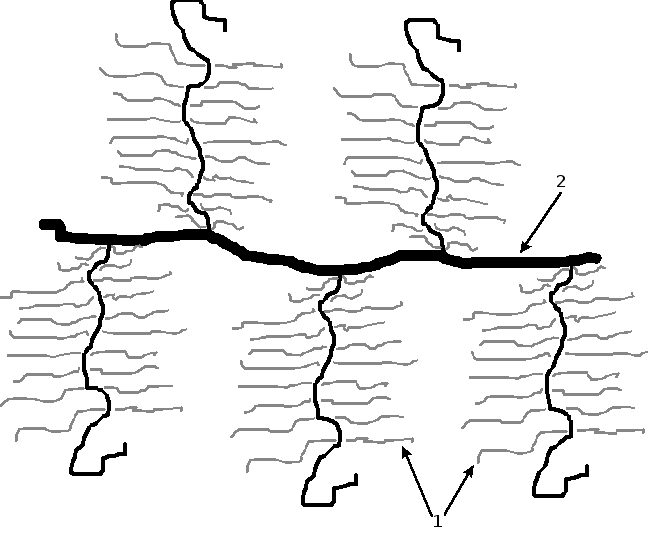
Рис. 7. Фрагмент комплекса гиалуроновой кислоты с протеогликанами: 1– хондроитинсульфатные протеогликаны; 2 – молекула гиалуроновй кислоты.
Одноименные заряды сульфатированных цепей протеогликанов и гидратация обусловливают их взаимооталкивание. Поэтому комплексы занимают максимально возможное пространство. По тем же причинам комплексы отталкиваются друг от друга и их общий объем оказывается значительно большим, чем объем собственно молекул, если бы они были плотно уложены в пространстве.
При увеличении внешнего давления молекулы сближаются, выжимая воду из межмолекулярных промежутков, по прекращении давления восстанавливаются исходные расстояния. Это обеспечивает всей совокупности описываемых комплексов в матриксе роль амортизаторов.
Связанная гликозаминогликанами вода представляет собой гель, который ограничивает диффузию и проницаемость межклеточного вещества. Проницаемость и соответственно диффузия повышаются при разрушении гиалуроновой кислоты гиалуронидазой. Этот фермент выделяют некоторые микроорганизмы, и он рассматривается как фактор агрессии, дающий способность патогенным микроорганизмам распространяться в тканях (возбудители газовой гангрены, гнойных инфекций).
Способность гликозаминогликанов как поливалентных анионов связывать большие количества ионов натрия определяет их участие в водно-солевом обмене.
Важную роль в структурной организации межклеточного матрикса играют неколлагеновые структурные гликопротеины, из которых детальнее изучен фибронектин, упомянутый нами в разделе 1.3. Кроме того, этот белок участвует в объединении между собой неклеточных структур основного вещества и клеток, погруженных в него. Фибронектин синтезируется и выделяется в межклеточное пространство многими клетками. Он находится на поверхности плазматических мембран, в базальных мембранах, глубине межклеточного вещества соединительной ткани и плазме крови. Его роль как фактора, объединяющего (наряду с другими менее изученными белками) компоненты межклеточного матрикса в единую систему (ткань), обеспечивается своеобразной структурой. Молекула фибронектина включает в себя две почти одинаковые пептидные цепи, соединяющиеся вблизи С-конца дисульфидными связями. Каждая цепь содержит 7-8 доменов, между которыми находятся неструктурированные гибкие участки. Молекула фибронектина располагает специфическими центрами связывания для некоторых компонентов плазматической мембраны (ганглиозидов и сиалопротеидов), для коллагена, гиалуроновой кислоты и сульфированных гликозаминогликанов. Это дает возможность фибронектину связывать в одну систему клетки и неклеточные компоненты матрикса. Нековалентные связи закрепляются благодаря наличию у молекулы фибронектина центра связывания для трансглутаминазы. Этот энзим катализирует реакцию между остатками глутамина и лизина в разных белках, соединяя их между собой. Так происходит сшивка молекул фибронектина друг с другом, коллагеном и другими неклеточными элементами матрикса или плазматических мембран.
Таким образом, межклеточный матрикс пульпы выполняет разнообразные функции: влияет на распространение инфекционного процесса в ткани, обменные реакции в клетках, устойчивость кристаллоидов, на рецепцию гормонов, витаминов и других веществ, участвующих в обмене. Метаболизм в клетках и волокнах пульпы проходит через основное вещество. Для того чтобы проникнуть из кровеносных сосудов в клетки, питательные вещества проходят через основное вещество, предварительно растворяясь в нем. Точно также соединения, выделенные клеткой, должны пройти через основное вещество, чтобы попасть в концевые сосуды. Таким образом обменная роль основного вещества влияет на жизнеспособность пульпы.
Волокнистые структуры пульпы. Биохимия пульпы
Волокнистые структуры пульпы. Биохимия пульпы
Волокнистые структуры пульпы представлены преколлагеновыми и коллагеновыми волокнами, располагающимися по различным направлениям, причем пульпа корневых каналов характеризуется большим содержанием пучков коллагеновых волокон по сравнению с коронковой. Эластичных волокон в межклеточном веществе пульпы не обнаружено, что существенно отличает ее от других видов соединительной ткани организма.
Пульпа зуба имеет сложный биохимический состав. Большинство работ, посвященных биохимии пульпы и различным ее изменениям, выполнены в основном за последние два десятилетия. При этом главное внимание уделено изучению ферментов, нуклеиновых кислот, сульфатированных полисахаридов, липидов, синтеза белка [Григорьян А. С, 1965; Зихерман С. З., 1967; Добрынина В. И., Разин А. С., 1969; Барабаш Р. Д. и др., 1977; Ten Cate A. R., 1963; Baranska-Gachowska M., 1968; Coffey С. J. et al., 1970].
Исследования позволили установить в пульпе наличие ферментов, принимающих участие в окислительно-восстановительных процессах (сукциндегидрогеназа, лактатдегидрогеназа, другие дегидрогеназы, каталаза, цитохромоксидаза), а также гидролитических ферментов (холинэстераза, фосфатаза) и др. Большое внимание, которое уделяют ферментам, объясняется их активным участием в процессах метаболизма пульпы при различных патологических изменениях и функциональных перестройках, связанных как с заболеваниями пульпы, так и с внешними физическими, механическими и химическими воздействиями при терапевтических вмешательствах.
Сульфатированные полисахариды (мукополисахариды) представляют интерес с точки зрения их участия в возникновении и течении воспалительных процессов в пульпе, механизмах проникновения вещества, дифференциации соединительной ткани и др. В этом же аспекте в последние годы изучают и простагландины [Baer P. N., Morris M. L., 1977].
Изучение нуклеиновых кислот (ДНК и РНК) связано с их участием в процессах формирования тканей зубов, а также той ролью, которую они играют в ответных реакциях пульпы на раздражение и в синтезе белка в одонто- и фибробластах.
Исследование содержания и распределения гликогена, РНК и других соединений, проведенное А. Г. Рахленко (1977), показало, что сразу после препарирования в пульпе сошлифованных зубов обнаруживается яркая пиронинофилия ядрышек и зерен РНК, расположенных в цитоплазме одонтобластов. Увеличение содержания РНК наиболее выражено через 1—3 сут после препарирования. В то же время уровень гиалуроновой кислоты в пульпе через 1—3 сут несколько повышен. Через 21— 28 сут содержание и распределение в пульпе гликогена, РНК, гиалуроновой кислоты приближается к норме.
М. Бушан и соавт. (1979) отмечают, что в периоде острого кариеса происходит ослабление связей между минеральными и органическими компонентами тканей зубов, что является первой причиной изменения их химического состава. В этом же периоде наблюдается изменение и дезорганизация коллагеновых структур, перераспределение белковых компонентов. В дентине основное вещество и содержимое дентинных канальцев характеризуется резко ослабленной базофилией и усиленной пикринофилией, что связано с разрушением преколлагена — растворимой фазы дентина.
Указанные процессы протекают в участках дентина, непосредственно примыкающих к пораженной кариесом эмали.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
международный конгресс по базальной имплантации в российской столице спорта и отдыха – в гороед Сочи.
Керамические виниры: эстетика высшего класса!
3КОММЕНТАРИЙ
К СТАТЬЕ
Когда-то наши предки делали из керамики посуду, а сегодня из нее можно изготовить тончайшие пластинки, способные превратить нашу улыбку в настоящее произведение искусства. Речь идет о керамических винирах, с помощью которых можно придать зубам идеальную форму, эстетичный светлый оттенок и естественную прозрачную структуру.
На протяжении 20 лет компания «Колгейт-Палмолив» во всем мире проводит детскую образовательную стоматологическую программу «Ослепительная улыбка на всю жизнь». С 1991 года в ней приняли участие более 650 миллионов детей, говорящих на 30 различных языках и живущих в 80 странах мира.
Применение фторидов является на сегодняшний день одним из немногих научно обоснованных и доказанных методов эффективной кариеспрофилактики. Расширение наших знаний и понимания механизмов защитного действия фторидов во многом изменило отношение к различным методам фторпрофилактики.
Имплантация: мифы и реальность.МИФ ПЕРВЫЙ.
Говорят, имплантация - это мучительно больно.
Поставить имплантат не больнее, чем лечить кариес. Современные анестетики дают отличное обезболивание, а при отсутствии противопоказаний и при желании пациента имплантация может быть выполнена в присутствии анестезиологов.
физиология и патфизиология пульпы зуба
Физиология и патофизиология пульпы зуба
Пульпа зуба обладает специфической, т.е.
характерной лишь для нее, функцией, связанной
с особенностями ее места в системе соединительной
ткани организма, а также зубочелюстного аппарата.
Физиологические особенности пульпы зуба соответствуют общим представлениям о соединительной ткани, ее биологических свойствах и пластических возможностях, изученных в фундаментальных классических трудах таких ученых, как А.А. Богомолец (1942), и продолженных А.А. Заварзиным (1953), В.Г. Елисеевым (1961), И.В. Давыдовским (1965) и др. Расширено представление о соединительной ткани как опорной субстанции, ткани внутренней среды организма, в которой происходят обменные процессы, ответные реакции на разнообразные воздействия. Физиологическими и патофизиологическими особенностями пульпы зуба человека занимались Л.И. Фалин (1953), А.С. Григорьян (1975), В.Р. Окушко (1981) и др.
Биологии пульпы зуба посвящены монографии Е.И. Гаврилова (1969) и др. Строение пульпы и жизненные процессы, происходящие в ней, разнообразны. Стоматолог должен оценить пульпу зуба, принимая во внимание ряд факторов, определяющих ее состояние: возраст, конституцию, общие заболевания организма. С возрастом развиваются регрессивные изменения, а заболевания органов и систем организма проявляются реактивными, дистрофическими и другими изменениями в пульпе.
Пульпа закономерно связана с состоянием здоровья человека. В любом зубе различают коронковую и корневую пульпу. Коронковая пульпа без какой-либо границы переходит в корневую, хотя в молярах есть сужение. Нормальная пульпа является рыхлой соединительной тканью. В периферической зоне находится слой одонтобластов, которые играют решающую роль в развитии и сохранении нормального дентина. В строме пульпы множество клеток: фибробластов, гистиоцитов, звездчатых, веретенообразных, адвенциальных. Пульпа содержит много фибрилл, составляющих каркас, и со временем волокнистые образования начинают преобладать над клеточными. Обычно волокна располагаются у стенок кровеносных сосудов, где группируются в пучки. Волокна способны также воспринимать известковые элементы. Клетки и волокна пульпы погружены в основное вещество, состоящее главным образом из кислых мукополисахаридов (гликозаминогликаны). Васкуляриация пульпы. Зуб является почти уникальным примером органа, кровоснабжение которого осуществляется в условиях замкнутой полости, жестко лимитирующих каналов поступления и оттока крови. Неблагоприятные условия диктуют необходимость оптимальной конструкции системы обеспечения трофики пульпы и твердых тканей зуба.
Очевидно, что она должна быть адаптирована к вариациям гистоархитектоники корневой и коронковой пульпы, а также отвечать особой «послойной» диспозиции ее клеточных элементов, не типичной для рыхлой соединительной ткани. Соответственно от топографо-морфологических особенностей пульпы зависят органоспецифические черты пространственной организации, строения и функционирования сосудистого русла зуба. Общепризнанно, что зубная пульпа имеет основные и дополнительные источники кровоснабжения. Первые (собственно зубные артерии) в виде одного, реже двух стволиков входят в полость зуба через апикальное отверстие корневого канала, вторые попадают сюда через добавочные аппертуры в его дельтовидных разветвлениях [Лукомский И.Г., 1934; Воробьев В.П., Ясвоин Г.В., 1936; Логинова Н.К., 1970; Иванов В.С. и др., 1984;] Достоверно установлено, что в корневой пульпе основные и добавочные артериальные стволы, разветвляясь, образуют многочисленные анастомозы [Гаврилов Е.И.1957; Варшавский А.И., Левин В.И., 1972].
Присутствие коллатералей в определенной мере увеличивает надежность артериального кровоснабжения пульпы, препятствует ее полной ишемизации при обтурации основной зубной артерии. Таким образом, мнение о том, что артерии пульпы относятся к сосудам концевого типа, имеет лишь исторический интерес, особенно если учесть значительную роль в кровоснабжении ответвлений, сообщающихся с периодонтом. В связи с исследованиями, проведенными в последние годы, возникает вопрос: как квалифицировать приносящие артериальные ветви?
Этот вопрос не ограничивается рамками терминалиями. Зубные артерии — тонкостенные сосуды лишены выраженных эластичных мембран и содержат в средней оболочке, как правило, один слой циркулярно-ориентированных гладких миоцитов, что по всем параметрамсоответствует морфологической характеристике артериол [Ковалев Е.В., 1983]. Электронно-микроскопические исследования подтверждают вывод об отсутствии в пульпе типичных артерий. Следствием этого заключения может явиться представление о кровеносном русле пульпы как фрагменте микроциркуляторной системы зубодесневого комплекса. На такой основе еще ярче вырисовывается степень зависимости кровоснабжения зуба от состояния кровоснабжения всего региона. Приносящие артериальные сосуды в корневой пульпе характеризуются магистральным типом ветвления. Этот принцип особенно демонстративен в однокорневых зубах; в молярах он нивелируется сетью артериоло-артериолярных анастомозов, образующих дугообразные конструкции, связывающие артериальные коллекторы корней. Уже в корневом канале от артериол начинают отходить артериальные микрососуды диаметром до 30-35 мкм, которые, анастомозируя, дают начало прекапиллярным артериолам, формирующим в свою очередь редкопетлистую капиллярную сеть. Отличительной чертой микроциркуляторного русла корневой пульпы является слабое развитие обменного звена (рис. 3, а). Вероятно, это связано с регионарными особенностями строения пульпы, представленной здесь в основном «инертным» своим компонентом — коллагеновыми волокнами, что исключает необходимость активного обмена. Определенное исключение в этом плане составляет корневая пульпа клыков, объем и клеточный состав которой в корневой и коронковой частях зуба сравнительно близки. Вследствие этого в корневой пульпе клыков капиллярная сеть более обширна. Возможно, что особый режим трофики обусловливает относительно меньшую подверженность клыков патологическим процессам.
Достаточно простая конструкция русла в корневом канале отражает общую топографию микрососудов, характерную для всех отделов зуба. Положение Е.И. Гаврилова (1961) о слоистом строении пульпы находит отражение и в функционально обоснованной ориентации транспортных коммуникаций. Центральный слой пульпы, имеющей в основном волокнистую Структуру, занят магистральными резистивными и емкостными сосудами. Пододонтобластический слой — зона преимущественной локализации прекапиллярных артериол, посткапиллярных венул. Периферический слой, или слой одонтобластов, граничит с терминальными отделами капиллярных петель. Принцип продольного хода магистральных сосудов и радиального расположения пре- и посткапиллярных звеньев постоянен и нарушается лишь в краниальных отделах коронковой пульпы, где ветвление артериол приобретает «рассыпной» характер.
Активация развития микроциркуляторного русла отчетливо отмечается уже в средней трети корневого канала. Проникающие сюда артериолы отдают многочисленные артериолярные стволики, диаметр которых не превышает 35 мкм. Эти микрососуды могут быть определены как артериолы второго порядка. Их стенка еще сохраняет сплошной слой гладких миоцитов, и именно они являются источником прекапиллярных артериол. По данным Е.В. Ковалева (1977), указанные «дочерние» артериолы, анастомозируя, образуют аркадные конструкции, располагающиеся ярусами на всем протяжении пульпы. По мнению автора, существование артериолярных аркад (и сопутствующих им венул) обусловливает пространственную организацию кровеносной системы пульпы как повторение (ярусы) комплексов микрососудов, представленных всеми звеньями микроциркуляторного русла. Подтверждение этой закономерности было бы интересно в теоретическом плане как дополнительный аргумент в пользу вероятной универсальности «блочного» типа объединения микрососудов [В.В. Куприянов и др., 1976].
В конкретном случае заслуживает внимания факт анастомозирования микрососудистых комплексов пульпы, что создает благоприятные условия для поддержания гемодинамического баланса в пределах данной системы кровообращения. Отходящие от аркад прекапиллярные артериолы отличаются небольшим диаметром (до 20 мкм) и редукцией гладкомышечных элементов в средней оболочке. Вектор ветвления этих микрососудов на капилляры направлен, на периферию пульпы, в сторону наиболее активных «рабочих» структур — одонтобластов. В коронковой части капиллярная сеть представлена чрезвычайно обильно, отражая тем самым прямую зависимость между степенью развития одонтобластического слоя и уровнем васкуляризации пульпы.
Электронно-микроскопически регистрируется двухслойная структура стенки гемокапилляров: эндотелиальный пласт лежит на непрерывной базальной мембране, в дубликатуре которой заключены немногочисленные перициты. Адвентициальная оболочка как самостоятельное образование не прослеживается. Примечательно присутствие в пульпе капилляров двух типов: висцеральных с фенестрированным эндотелием и соматических с непрерывной эндотелиальной выстилкой [Иванчикова Л.А. и др., 1973]. Крайне интересна закономерность топографии гемокапилляров различных типов. Капилляры с фенестрированным эндотелием выявляются главным образом по периферии пульпы, а соматические — в зоне локализации прекапиллярных артериол и посткапиллярных венул. Логично оценить этот феномен как морфологическое выражение градиента функциональной (обменной) активности по длиннику капилляра. Фенестры являются каналами «облегченного» трансэндотелиального переноса микромолекул, в частности белков [Casley-Smith U., 1976]. Следовательно, такая специализация эндотелия капилляров субодонтобластического слоя может свидетельствовать об активности транспортных процессов в этой области. Правомерно допустить, что выявление на срезах капилляров двух типов связано с вариациями строения артериолярного и венулярного сегментов терминальных капиллярных петель. Это предположение косвенно подтверждает фенестрация эндотелия расположенных на периферии пульпы посткапиллярных венул [Ковалев Е.В., 1978].
Структура посткапилляров, локализующихся в субодонтобластическом слое, близка к структуре истинных капилляров. Различия касаются диаметров микрососудов и некоторых деталей организации их стенок. Так, для посткапилляров типичны более округлая форма перикариона и меньшая протяженность маргинальных зон эндотелиоцитов, обилие перицитов и большое количество адвентициальных клеток в субэндотелиальном окружении. Основываясь на сходстве ультрамикроскопических характеристик стенки капиллярных и посткапиллярных микрососудов, можно сделать вывод о включении посткапилляров в обменное звено микроциркуляторного русла и вследствие этого значительном расширении активной площади гематотканевого обмена. Участие посткапиллярных венул в процессах трансэндотелиального транспорта веществ активно обсуждается в литературе и продемонстрировано на примере ряда органов [Куприянов В.В. и др., 1977; Банин В.В., 1986].
Что касается особенностей ультраструктуры эндотелия обменных микрососудов пульпы, то следует указать на сравнительное постоянство присутствия в цитоплазме эндотелиальных клеток микрофиламентов, микротрубочек, микротелец типа «стержневидных гранул» [Wiebel Е.W, Ра1ас1е С.Е., 1964] и крупных кристаллоподобных структур, часто комплектирующихся с лизосомами и липидными включениями. Отвергая возможность «продукции» кристаллоподобных структур самой эндотелиальной клеткой, В.А. Шахламов (1971) ассоциирует их с проявлением фагоцитарной активности эндотелия. В конкретном случае эта точка зрения приобретает особый интерес, открывая возможность обсуждения роли сосудистого эндотелия в реализации защитной функции пульпы. Активность развития микрофибриллярных и микротубулярных структур в эндотелиоцитах в определенной мере относится к органоспецифическим признакам гемокапилляров. Их обилие в эндотелии пульпарных микрососудов должно интерпретироваться в рамках нерешенного вопроса о контрактильных свойствах сосудистого эндотелия.
Предполагается, что элементы цитоскелета, содержащие сократительные белки, способны регулировать «рабочий» просвет капилляров путем изменения формы эндотелиоцитов. Заметная роль в регуляции этого параметра отводится также перицитам. Так или иначе, но разнообразие диаметров капилляров пульпы даже в пределах одного микрорайона вплоть до «зияющих» капилляров, описанных Н.А. Кодола и соавт. (1980), оправдывает поиск механизмов, дифференцированно корригирующих этот показатель в отдельных микрососудах. В регуляции объемного кровотока и, следовательно, площади сечения сосудистых трубок ведущее место отводится гемодинамическим факторам, а также изменениям концентрации нейромедиаторов и вазоактивных веществ в паравазальных пространствах.
Лаброциты в пульпе не обнаружены [Кодола Н.А. и др., 1980], в то время как околососудистые нервные терминали представлены достаточно широко. Учитывая топографическую связь микрососудов и нервных термина-леи (рис. 6), можно допустить вероятность существования в пульпе функциональных аксовазальных синапсов по аналогии с функциональными (лишенными синаптической структуры) нейротканевыми синапсами в паренхиматозных органах [Zellander T. et al., 1962]. Этот механизм может являться составным компонентом адаптационно-компенсаторных реакций пульпарной микроциркуляции. С данных позиций возможна более глубокая оценка значения нейродистрофических расстройств в патогенезе заболеваний зубодесневого комплекса.
Очевидно, что повреждение иннервационных приборов может снижать приспособительные возможности микроциркуляторной системы пульпы, усугублять нарушения гемодинамики и транскапиллярного обмена, вызванные воспалением или иным патологическим процессом. Для понимания механизмов нарушения трофики зуба при развитии патологических процессов необходимо также представление о природе транспортных взаимодействий в пульпе, в том числе о кинетике внесосудистого интерстициального переноса веществ.
Пространственная организация русла, обусловливающая максимальную концентрацию обменных микрососудов на периферии пульпы, регионарные особенности строения их стенок (фенестрация эндотелия) позволяют квалифицировать зону раздела твердых и мягких тканей зуба как область активного гематотканевого обмена. Присутствие здесь фенестрированных гемокапилляров и посткапиллярных венул служит основой для предпочтительного транспорта макромолекул, в частности белков, к основанию одонтобластического слоя. Связанное с этим локальное повышение онкотического давления обусловливает направленное перемещение потоков жидкости, фильтрующейся через стенки всех гемокапилляров, в краевую зону пульпы. Это является основой для обеспечения оптимальной трофики дентина и предентина. В реализации данного процесса важная роль отводится одонтобластам (точнее их цитоплазматическим отросткам) как посредникам в переносе различных субстратов к дентиновому слою.
Однако существуют данные, опровергающие мнение об исключительности этого пути транспорта. С помощью электронно-плотных маркеров (пероксидаза хрена, ферритин) установлено, что белки с низкой молекулярной массой (до 50 тыс.) могут транспортироваться по межклеточным щелям в слое одонтобластов [Semba Т., Ishida М., 1975]. - На границе раздела твердых и мягких тканей зубов человека выявлена сложная система коммуникаций, представленная интрацеллюлярными «каналами», осуществляющими прямую связь интерстициального пространства пульпы с предентином (Ковалев Е.В., 1978]. В свете противоречивости мнений о существовании в пульпе лимфатических капилляров эта транспортная система может рассматриваться также как начальные пути экстравазального лимфооттока. Изменение ее конструкции при патологических процессах в пульпе может иметь существенное значение для потенцирования дистрофических нарушений и сдвигов жидкостного баланса в тканях зуба.
Отток крови из капиллярной сети осуществляется по посткапиллярам, формирующим собирательные венулы. Диаметр этих микрососудов достигает 40 мкм; в их стенке отсутствуют гладкомышечные элементы, но сравнительно развита адвентициальная оболочка.
Обилие венулярных микрососудов, связанных многочисленными анастомозами, обеспечивает высокую емкость венулярного звена микроциркуляторного русла пульпы. В области локализации собирательных венул обнаружены артериоло-венулярные анастомозы, открывающие возможность прямого шунтирования крови.
Сбросом крови через артериоло-венулярные анастомозы и вследствие этого резким изменением давления в пульпарной камере объясняется периодичность болей при пульпите [Рыбаков А.И., Иванов В.С. 1980]. Собирательные венулы сливаются в магистральные коллекторы, диаметр которых достигает 120-130 мкм, но структура стенки практически не отличается от таковой в собирательных венулах. Тонкостенность магистральных венул в коронковой пульпе и отсутствие гладкомышечных элементов в их стенке (рис. 8) служат причинами выраженных гемодинамических расстройств, возникающих при отеке пульпарной ткани. Магистральные венулы сопровождают магистральные артериолы, формируя вместе с ними и нервными проводниками сосудисто-нервный пучок корневого канала.
ИЗУЧЕНИЕ ЭФФЕКТОВ ОТ ПРИМЕНЕНИЯ ДОНОРОВ МОЛЕКУЛ ОКСИДА АЗОТА И БЛОКАТОРОВ ФЕРМЕНТА NO-СИНТАЗЫ ПРИ ЭМОЦИОНАЛЬНО-БОЛЕВОМ СТРЕССЕ НА МОРФОЛОГИЧЕСКУЮ КАРТИНУ ТКАНЕЙ ПУЛЬПЫ ЗУБОВ И ПАРОДОНТА
В статье приводятся результаты исследования влияния доноров и блокаторов фермента NO-синтазы на морфологическую картину пульпы зубов и тканей пародонта лабораторных животных при стрессорном воздействии. Показано, что донор молекул оксида азота L-аргинин способен ограничивать развитие стресс-реакции и снизить выраженность морфофункциональных нарушений в тканях пародонта и пульпе зубов. Блокатор фермента NO-синтазы L-NNA способствует усилению альтерирующих эффектов стресс-реакции на ткани пародонта и пульпы зубов.
Ключевые слова
Полный текст
Актуальность исследования. Важную роль в повреждении тканей пародонта играют стрессорные воздействия, так как в результате активации адренергической и гипоталамо-гипофизарно-адреналовой систем происходят нарушения углеводного обмена, чрезмерная активация процессов перекисного окисления липидов, расстройства регионарной гемодинамики, что приводит к деструкции клеточных мембран пародонтальных тканей [1]. Ф.З. Меерсоном была разработана концепция стресс-лимитирующих систем организма, которая дала реальную основу для разработки принципов предупреждения чрезмерной активности стресс-реакции и реализации ее патогенных воздействий на различные органы и системы организма [2]. В соответствии с концепцией Меерсона, формирование защитных эффектов адаптации обеспечивается активацией генетического аппарата и изменением метаболизма клеток, а также изменением функционирования практически всех основных систем организма: нервной, эндокринной, сердечно-сосудистой, дыхательной, мышечной и т. д. Поэтому очевидно, что в механизме адаптации наиболее важную роль играют универсальные факторы регуляции физиологических систем и экспрессии генов [2, 3]. Согласно современным представлениям, таким универсальным регулятором является оксид азота (NO) [4]. С начала 1990-х годов стали появляться очень важные доказательства того, что NO вовлечен в регуляцию активности генетического аппарата как на уровне 14 ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ факторов транскрипции, так и на уровне самих механизмов транскрипции и трансляции мРНК [5, 6]. Наконец, после того как были получены данные о значительных изменениях в продукции NO при стрессе и в процессе адаптации к разным факторам, сразу возникло предположение о том, что NO играет важную роль в стрессорных и адаптивных ответах организма [7, 8]. Была выдвинута гипотеза о том, что NO участвует в регуляции стресс-реакции, ограничивая ее чрезмерную активацию и ее повреждающие эффекты как на центральном, так и на периферическом уровне [9]. Если эта гипотеза верна, то увеличение содержания NO, обусловленное, например, введением доноров NO, должно ограничить чрезмерную активацию стресс-системы, и наоборот, снижение мощности систем генерации NO, например, с помощью блокаторов NO-синтазы, должно приводить к увеличению повреждающих эффектов факторов среды. Цель исследования. Раскрыть закономерности и механизмы стрессорных изменений пульпы зубов и тканей пародонта, возникающих под влиянием эмоционально-болевого стресса, и разработать принципы их предупреждения в эксперименте путем использования активаторов и ингибиторов фермента NO-синтазы. Материалы и методы Опыты проведены на 168 белых крысах-самцах линии Vistar массой 180—220 г в осенне-зимний период. Все животные были разделены на 4 группы, соответствующие следующим сериям экспериментов: 1-ю группу (контрольную) составили животные для изучения исходного уровня кортикостерона, эозинофилов, строения пульпы зуба и тканей пародонта в норме (n = 6). 2-я группа — животные для изучения уровня кортикосте-рона, эозинофилов, состояния пульпы зуба и тканей пародон-та при эмоционально-болевом стрессе (n = 54). 3-я группа — животные для изучения уровня кортикосте-рона, эозинофилов, состояния пульпы зуба и тканей пародон-та при эмоционально-болевом стрессе в условиях использования донора молекул оксида азота (NO) L-аргинина (n = 54). 4-я группа — животные для исследования уровня корти-костерона, эозинофилов, морфологической картины пульпы зубов и тканей пародонта после стрессорного воздействия в условиях применения блокатора фермента NO-синтазы L-NNA (n = 54). Для морфологического анализа материал после фиксации в забуференном 10% нейтральном формалине проводился и заливался в парафин по общепринятой методике. Срезы стандартной толщины (5 мкм) окрашивались гематоксилином и эозином, а также пикрофуксином по Ван-Гизону. Морфометрическое исследование проводилось с использованием измерительной сетки со 100 равноудаленными точками Г.Г. Автандилова для цитогистостереометрических исследований, накладываемой на фотоснимок на экране монитора произвольно выбранного поля зрения [10]. Методом точечного счета определялись: относительный объем, занимаемый фибробластами, пульпоцитами, аморфным веществом, сосудами, коллагеновыми волокнами, сегментоядерными лейкоцитами. Подсчет производился в каждом случае в 20 различных полях зрения при увеличении микроскопа *100. Отдельно путем определений линейных размеров вычислялись среднее значение толщины слоя одон-тобластов (мкм), высоты одонтобластов, размеры пульпоци-тов. Средний диаметр сосудов вычислялся по совокупности перпендикулярных измерений большого и малого диаметров (мкм). Определялась также численная плотность одонтобластов на единицу площади (1000 мкм2). Поле зрения при увеличении микроскопа *100 составило 202 459,22 мкм2, при увеличении *400 — 11 685,37 мкм2. Полученные данные обрабатывались методом вариационной статистики с помощью программы Statistica 6.0 StatSoft. Достоверность различий между группами с независимыми количественными показателями определялась по ü-критерию Манна—Уитни для непараметрических величин. Уровень различий при р < 0,05 рассматривался как статистически значимый. Результаты исследования. Как показали результаты исследования уровня кортикостерона и эозино-филов в крови подопытных животных, реакция ги-поталамо-гипофизарно-адреналовой системы носит фазный характер (рис. 1). Первый период характеризуется увеличением концентрации кортикостерона и развитием эозинопении (от начала стрессорного воздействия до 39 ч). Второй (от 39 до 45 ч) — снижением концентрации корти-костерона и развитием выраженной эозинофилии. В третьем периоде после повторной кратковременной эозинопении колебания уровня эозинофилов в крови постепенно приближаются к исходному уровню, а концентрация кортикостерона вновь повышается (45—72 ч). Проведенные исследования позволили установить, что в динамике морфологических изменений пульпы зубов лабораторных животных достаточно четко определяются три стадии процесса повреждения и восстановления структуры пульпы зуба. Максимальной выраженности по степени и распространенности изменения структуры пульпы зубов и пародонта достигли к 45 часам после окончания стрессорного воздействия, что соответствует переходу стадии тревоги в стадию резистентности стресс-реакции. В пульпе зубов они характеризовались разрыхлением слоя одонтобластов, полнокровием, появлением мелких вакуолей. Одонтобласты в области разрыхления деформированы. Данные изменения соответствуют гидропической (вакуольной, водяночной) дистрофии. Размеры, количество и расположение вакуолей какой-либо системы не имели. В ряде полей зрения встречались группы гиперхромных одонтобластов, которые обнаруживались только в области шейки на язычной поверхности зуба. Основное вещество пульпы отличается очаговой базофилией и менее компактным расположением волокнистых структур, разделенных оптически пустыми более или менее широкими пространствами. Развившиеся преобразования свидетельствуют в пользу обратимой дезорганизации соединительной ткани — мукоидного набухания. Она имеет неравномерный характер, занимая не более трети площади пульпы в каждом зубе. Реакция кровеносных сосудов пульпы на стресс более демонстративна и отчетлива. В сравнении с группой контроля в пульпе резцов отмечено реактивное расширение сосудов и переполнение их кровью, особенно в субодонтобластическом слое. В связи с этим артерии, капилляры и вены коронковой части пульпы резко выделялись на фоне всей ткани (рис. 2 на вклейке). При морфологическом анализе тканей пародонта через 45 ч после окончания стрессорного воздействия установлено, что количество клеточных элементов 15 РОССИЙСКИЙ СТОМАТОЛОГИЧЕСКИЙ ЖУРНАЛ, №4, 2013 Jt>0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 51 54 57 60 63 66 69 72 У//Л Кортикостерон -Эозинофилы Рис. 1. Содержание кортикостерона и эозинофилов у крыс в динамике при эмоциональноболевом стрессе. периодонта возрастает по направлению к верхушке корня зуба и от центра периодонтальной щели к поверхности цемента. Основную массу клеток периодонтальной щели составляют фибробласты. В ряде полей зрения в тканях пародонта в небольшом количестве появляются эозинофилы. Фибробласты имеют нечеткие контуры, мелкозернистые ядра. В отличие от группы сравнения вблизи мелких артерий выявлены единичные макрофаги, которые не содержат фагоцитированных частиц. Наряду с этим наблюдается миграция небольшого количества нейтрофильных лейкоцитов за пределы сосудов. В окружающей ткани определяется отек с увеличением пространств между коллагеновыми волокнами с некоторым набуханием последних. Возле сосудов видны единичные макрофаги, их цитоплазма содержит вакуоли и фагоцитируемые частицы (рис. 3 на вклейке). Подводя итог результатам морфологического исследования пульпы и пародонта крыс через 45 ч после окончания эмоционально-болевого воздействия, можно сделать вывод о развитии существенных ге-модинамических расстройств, вызванных стрессом. Они сводятся к неравномерному артериальному и венозному полнокровию, гемостазам, диапедезным кровоизлияниям, умеренным лейкодиапедезу и ма-крофагальной реакции. Выявленные структурные изменения являются обратимыми, без дальнейшей отрицательной динамики. Решая следующие задачи работы, нами были изучены возможности ограничения выраженности стрессорных повреждений тканей пульпы зубов и пародонта у животных с помощью оксида азота (NO) путем введения доноров и блокаторов фермента NO-синтазы. Было установлено, что слой одонтобластов в пульпе зубов крыс третьей группы состоит из нескольких слоев. Форма одонтобластов преимущественно грушевидная, цитоплазма базофильная, мелкозернистая, ядра вытянутые и округлые. В части полей зрения в пульпе резцов в области шейки с язычной поверхности зуба определяются немногочисленные одонтобласты с заметно гиперхромными ядрами. Дистрофические изменения одонтобластов в виде гипергидратации содержимого клетки морфологиче ски проявляются в наличии в их цитоплазме немногочисленных мелких вакуолей. Эти изменения носят локальный и менее распространенный характер в сравнении со второй группой. Соответственно этим участкам слой одонтобластов разрыхлен, не имеет четкой границы, полнокровен. Состав, распределение и количество клеточных элементов центральных отделов пульпы мало отличается от группы сравнения. В артериях полнокровие имеет умеренную степень выраженности, сопровождаясь утолщением эндотелия (рис. 4 на вклейке). Во всех случаях имеет место умеренная транссудация жидкой части крови в основное вещество пульпы, что приводит к отеку. Вне участков отека волокнистые структуры по расположению и тинкториаль-ным свойствам не имели морфологических отличий от таковых в пульпе контрольных животных. В тканях пародонта после стресса на фоне введения молекул оксида азота — L-аргинина наблюдается формирование сосудистого и клеточного ответа. Сосуды пародонта были расположены типично для нормального состояния периодонта, т. е. ближе к стенке альвеолы. Эндотелий сосудов — без признаков дезорганизации, ядра эндотелиальных клеток по структуре не отличаются от контроля. Отмечаются присущие всем наблюдениям исследуемых групп полнокровие, диапедезные кровоизлияния и гемостазы. Однако после стрессорного воздействия кровенаполнение сосудов имеет неравномерный, преимущественно умеренный характер. Целостность эндотелиальной выстилки сосудов не нарушена. В сосудах костных каналов эндотелий не изменен, сосуды содержат обычные форменные элементы крови. Изменения клеточного состава характеризовались увеличением размера небольшого числа фибробластов, ядра которых были четко очерчены, цитоплазма — легкобазофильна. Вблизи цемента больше молодых фибробластов с нечетко контурирующейся цитоплазмой и овальной формы ядрами. Вокруг кровеносных сосудов расположены единичные лимфоциты, плазмо-циты, нейтрофилы, эозинофилы (рис. 5 на вклейке). Граница между остеонным и безостеонным слоями альвеолы четкая. Коллагеновые волокна в участках па-родонта, расположенных ближе к маргинальному отделу, отличаются набуханием, появлением между ними пространств вследствие отека. Отек значительно меньше, чем в контрольной группе. При этом тинкториаль-ные свойства коллагеновых волокон сохраняются. В процессе проведенного анализа в четвертой группе животных (на фоне введения блокатора NO-синтазы L-NNA) морфологические изменения выявлены во всех структурных компонентах пульпы и пародонта. Слой одонтобластов на большем протяжении имеет неравномерную толщину, разрыхлен, не обладая 16 ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ Таблица 1 Морфометрические показатели пульпы зуба крысы при эмоционально-болевом стрессе (M ± m) Структурные компоненты Контроль* Через 45 ч после эмоциональноболевого воздействия, % Через 45 ч после эмоционально-болевого воздействия на фоне введения донора молекул оксида азота — L-аргинина, % Через 45 ч после эмоционально-болевого воздействия на фоне введения блокатора фермента NO-синтазы — L-NNA, % Пульпоциты 14,7 ± 0,49 10,9 ± 1,71 12,2 ± 1,22 7,65 ± 0,98 Аморфное вещество 31,4 ± 0,54 40,1 ± 0,83 34,6 ± 0,73 38,45 ± 0,91 Сосуды 13,1 ± 0,77 19,5 ± 0,65 16,3 ± 0,67 29,7 ± 0,74 Коллагеновые волокна и фибробласты 40,8 ± 0,74 29,2 ± 0,62 36,7 ± 0,58 23,6 ± 0,55 Сегменто-ядерные лейкоциты 0 0,3 ± 1,31 0,2 ± 1,23 0,6 ± 1,54 Количество одонтобластов 8,5 ± 1,87 8,1 ± 1,24 8,2 ± 1,24 6,2 ± 0,53 Толщина слоя одонтобластов, мк 22,3 ± 1,5 23,8 ± 2,35 20,7 ± 1,24 28,9 ± 1,37 Высота одонтобластов, мк 11,4 ± 1,11 13,9 ± 2,08 9 ± 2,24 13,5 ± 1,03 Диаметр сосуда 24,8 ± 2,05 32,3 ± 1,04 29,6 ± 1,24 35,4 ± 1,06 Примечание. относительный удельный объем. * четкими границами, сливается с субодонтобластиче-ским слоем. Одонтобласты в участках разрыхления деформированы, приобретают чрезмерно вытянутую и неправильную форму. Во многом это связано с многочисленными вакуолями, располагающимися преимущественно в базальной части клеток. Вакуоли округлой формы, имеют различную величину, местами сливаясь, формируют относительно крупные полости, выступающие за пределы слоя одонтобластов (баллонная дистрофия) (рис. 6 на вклейке). В центральной части пульпы клыков и резцов отмечается ярко выраженная сосудистая реакция в виде расширения сосудов и их полнокровия, как в основных магистральных стволах, так и в мелких ветвях прекапиллярного и капиллярного типа. В просветах капилляров и венул располагаются формирующие "монетные столбики" эритроциты. Кровоизлияния занимают 9,3% площади среза. В результате этого часть пучков коллагеновых волокон, расположенных в центральных отделах пульпы, разволокнена, а строма в целом имеет неравномерную плотность. В этих полях зрения волокнистые структуры изменяют тинкто-риальные свойства в сторону базофилии, что служит проявлением мукоидного набухания. Пучки волокон располагаются вдоль оси зуба или под небольшим углом к ней. Повышение сосудистой проницаемости не ограничивается транссудацией жидких составных элементов крови. Эмиграция лейкоцитов подтверждается наличием их небольшого количества вблизи сосудов центральной части пульпы. Здесь определяются макрофаги, в цитоплазме которых имелись мелкие вакуоли. Макрофагальная реакция, выявленная у 57,5% животных, характеризуется увеличением числа макрофагов в сравнении с другими группами. При морфологическом исследовании пародон-та крыс, подвергшихся стрессорному воздействию на фоне введения блокатора фермента NO-синтазы, установлено, что, так же как в контрольной группе, пучки коллагеновых волокон периодонта располагаются разнонаправленно. Кровеносные сосуды располагаются как параллельно длинной оси зуба, так и в виде спирали вокруг корня (рис. 7 на вклейке). Основные клетки периодонтальной щели — фибробласты — имеют преимущественно веретенообразную и отростчатую форму, обладают нечеткими границами, мелкозернистой цитоплазмой. Наблюдается отек, местами выраженный, периодонтальной связки. В половине наблюдений отмечается умеренно выраженная макрофагальная реакция с образованием небольших групп макрофагов, которые содержат вакуоли и фагоцитируемые частицы. Изменения в костной ткани альвеол проявляются нечетким набуханием безостеонного слоя. Кровеносные сосуды гаверсовых каналов резко полнокровны (рис. 8 на вклейке). С целью объективизации полученных результатов в тканях пульпы и пародонта крыс при изучаемых вариантах стрессового воздействия был осуществлен морфометрический анализ (табл. 1, 2). Цифровые по- Таблица 2 Морфометрические показатели пародонта крысы при эмоционально-болевом стрессе (M ± т) Структурные компоненты, % Через 45 ч после стрес-сорного воздействия, % Через 45 ч после стрессорно-го воздействия на фоне введения донора молекул оксида азота — L-аргинина, % Через 45 ч после стрессор-ного воздействия на фоне введения блокатора фермента NO-синтазы — L-NNA, % Аморфное вещество 25,9 ± 0,45 31,4 ± 0,35 Сосуды 7,8 ± 0,81 14,9 ± 0,43 Коллагеновые волокна и фибробласты 66,3 ± 0,47 53,6 ± 0,48 Сегменто-ядерные лейкоциты 0 0,1 ± 1,13 28.5 ± 0,54 10,8 ± 0,69 60.5 ± 0,32 0,2 ± 1,14 37,6 ± 0,39 21,4 ± 0,69 40,8 ± 0,69 0,2 ± 1,69 Примечание. относительный удельный объем. * 17 РОССИЙСКИЙ СТОМАТОЛОГИЧЕСКИЙ ЖУРНАЛ, №4, 2013 казатели не противоречат выявленным качественным изменениям. Таким образом, сравнительный анализ выявленных структурных изменений тканей пульпы и паро-донта в условиях активации стресс-лимитирующих систем и группы контроля позволил сделать следующие выводы: 1. В пульпе и пародонте крысы через 45 ч после стрессорного воздействия на фоне введения аминокислоты L-аргинина развиваются очаговая дистрофия одонтобластов, а также сосудистые реакции в виде неравномерного полнокровия, немногочисленных гемостазов, слабо выраженного лейкодиапедеза, участков отека. Индуцированная активация фермента NO-синтазы позволила свести к минимуму гемодина-мические расстройства и вызванные этим повреждения структурных компонентов исследуемых тканей. 2. В пульпе и пародонте крыс, подвергшихся стрессорному воздействию на фоне введения бло-катора фермента NO-синтазы, развиваются очаги повреждения в слое одонтобластов и эндотелии сосудов с гибелью части их клеток. Гемодинамические расстройства сопровождаются распространенными гемостазами, различных размеров кровоизлияниями, отеком, лейкодиапедезом и макрофагальной реакцией. Данные изменения имеют более выраженный, чем в других исследуемых группах, характер, являясь частью необратимыми. В целом представленные выше данные показали принципиальную возможность влияния с помощью доноров NO и блокаторов синтеза NO на стрессорные ответы организма.
Читайте также:
