Гепатоцеллюлярный рак. Частота, диагностика
Добавил пользователь Cypher Обновлено: 28.01.2026
Как правило, новообразование печени впервые обнаруживают при УЗИ, однако чувствительность метода не позволяет выявить все малые опухоли и все имеющиеся узлы. К примеру, для выявления мелких метастазов, которые могут быть наряду с первичной опухолью, разрешающих возможностей ультразвукового исследования недостаточно. В то же время УЗИ навигация помогает контролировать выполнение чрескожной биопсии, что неотъемлемо при интервенционных вмешательствах и полезно в наблюдении за течением процесса.
Для первичной диагностики рака печени УЗИ не пригодно.
Как ставят диагноз рака печени?
В стандарты диагностики рака печени включены компьютерная (КТ) и магнитно-резонансная томографии (МРТ) обязательно с контрастными веществами, выявляющие типичную для гепатоцеллюлярного рака (ГЦР) васкуляризацию (сосудистую структуру) опухоли. Кровоснабжение опухоли идёт из других сосудов, нежели остальная ткань печени. В большинстве случаев злокачественные опухоли печени возникают на фоне хронической патологии, что тоже вносит изменение в картину КТ и МРТ, но есть типичные для каждого состояния моменты выведения контрастного вещества, которые хорошо знают специалисты.
Международные рекомендации считают доказанным гепатоцеллюлярный рак при независимой фиксации изменённого кровоснабжения печени во время динамической КТ и МРТ.
В России выполнение сразу двух исследований обычно не проводят, бывает достаточно и одного, но с совершенно типичной для рака картиной васкуляризации, не оставляющей каких-либо сомнений. Это может быть на выбор КТ с контрастным усилением или МРТ, то есть любой доступный метод объективной лучевой визуализации. Исследования позволяют оценить распространение злокачественного процесса, установить его стадию, оценить состояние всей печени.
Позитронно-эмиссионная томография для первичной диагностики рака печени пока не рекомендуется.

Биопсия печени
Биопсия позволяет получить морфологическое подтверждение рака. Но и при отрицательном результате нельзя отказаться от диагноза – в подобных случаях требуется динамическое наблюдение с регулярными контрольными обследованиями. Биопсию печени не стоит относить к методам «научно-обоснованного тыка» – манипуляции в глубине организма сложны, а современное оборудование даёт возможность контролировать нахождение иглы и с математической точностью подводить её к нужному месту.
Полученный при биопсии материал может быть малоинформативным совсем не по вине хирурга, а из-за особенностей строения и патологических изменений печени пациента, тем более при наличии цирроза или хронического гепатита.
Биопсия проводится тонкой иглой, так и называется «аспирационная тонкоигольная биопсия печени», когда насасывается материал.
Биопсия столбика ткани предпочтительнее, она именуется «кор-биопсия», но чаще русско-английской смесью «core-биопсия».
Манипуляция малоприятна, но больше психологически, чем физически. В хороших хирургических руках осложнения довольно редки. Вероятность кровотечения из-за повреждения сосуда составляет едва ли 1-2%. Опасения распространения опухолевых клеток по пункционному каналу оправданы, но при среднем полуторагодичном наблюдении такое возможно максимально в 11% случаев.
Биопсию печени не проводят, если изменённой в результате цирроза печени во время мультифазной компьютерной томографии выявлена васкуляризация, характерная для гепатоцеллюлярного рака, и диагноз подтверждается на контрастной МРТ.
Биопсия опухоли обязательна, если:
- новообразование печени без признаков цирроза;
- опухоль больше 2 см и на КТ и МРТ нетипичная васкуляризация;
- опухоль менее 2 см с типичным для ГЦР кровотоком, выявленном любым методом объективной визуализации;
- неоднозначная трактовка исследований при отсутствии изменений альфа-фетопротеина (АФП).
Биопсия не показана:
- не предполагается лечение из-за тяжёлой сопутствующей патологии;
- не планируется лечение из-за декомпенсированного цирроза печени;
- планируется резекция печени.

Лабораторные тесты
Анализы показывают функциональные возможности печени, но не способны что-либо сообщить о наличии или отсутствии злокачественной опухоли. То есть расскажут о циррозе и гепатите, но рак на показателях не отражается.
Роль альфа-фетопротеина (АФП) в диагностике рака печени несколько преувеличена. Этот маркёр повышается при любой патологии печени (и не только печени). При выявлении небольшого гепатоцеллюлярного рака АФП повышается у пятой части больных. Но при высоких показателях в несколько сот единиц и нарушениях васкуляризации при КТ или МРТ опухоли более 2 см, конечно, сомнений в злокачественности быть не может.
Наряду с методами визуализации маркёр АФП используется для контроля эффективности лечения рака печени, поскольку увеличивается при формировании сосудов в растущей опухоли.
Гепатоцеллюлярный рак. Частота, диагностика
Гепатоцеллюлярный рак (гепато-целлюлярная карцинома, или hepatocellular carcinoma, или НСС) — одна из часто встречающихся в мире злокачественных опухолей, которая приводит к летальному исходу более 1 000 000 больных в год. Частота вновь диагностируемых случаев колеблется от 30 на 100 000 населения в Юго-Восточной Азии и Африке и до 2 на 100 000 населения в Северной Европе и Северной Америке. В настоящее время доказана связь между НСС и циррозом печени. Так, в странах Запада более 70% больных с развившейся НСС имеют цирроз, обусловленный алкоголем.
Резекция печени — единственный реальный шанс на излечение этой категории больных, но, к сожалению, большинство из них (80—90%) на момент диагностики уже не операбельны, что обусловлено наличием запущенного, далеко зашедшего распространенного процесса или выраженного цирроза печени, которые делают саму операцию крайне рискованной и опасной.
Фиброламеллярная НСС (fibrolamellar HCC-FLHCC) встречается приблизительно в 5% случаев в европейских странах.
Ее особенности: встречаемость у пациентов молодого возраста (20—30 лет), нормальные уровни а-фетопротеина (АФП), отсутствие строгой привязанности к циррозу.
При операциях на ранних стадиях вероятность удачной резекции и последующего лечения этих больных составляет 50—75%.
Главная проблема в том, что данная опухоль диагностируется достаточно поздно (когда она уже большого размера). Продолжительность жизни нелеченных пациентов крайне мала.
Особенность гепатоцеллюлярного рака — быстрое прогрессирование от хорошо дифференцированной, медленно растущей опухоли в быстро растущую, плохо дифференцированную.
Больные с небольшими, асимптомными, нелечеными НСС в 13% случаев имеют 3-летнюю выживаемость, выживаемость больных с клинически манифестировавшимися НСС составляет лишь несколько месяцев.
Средняя продолжительность жизни больных с НСС с момента постановки диагноза до летального исхода составляет 2—4 месяца. Однако индивидуальные вариации достаточно широки, и продолжительность жизни зависит как от стадии опухолевого процесса, так и от стадии основного заболевания печени (цирроза).
Сравнительно недавно разработана прогностическая модель на основе мультивариантного анализа у нелеченых или неадекватно пролеченных больных. Хотя, как правило, такие модели очень сложно внедрять в клиническую практику, их использование позволяет достаточно точно оценить выживаемость у больных в пределах 1—12 месяцев с момента постановки диагноза.
Продолжительность жизни больных, имеющих т.н. резектабельные опухоли, — 20—30 месяцев, имеющих нерезектабельные объемные образования в виде НСС — 3—10 месяцев.
Диагностика гепатоцеллюлярного рака
Предварительный диагноз гепатоцеллюлярного рака можно ставить больному при наличии:
1) клинических проявлений,
2) УЗИ признаков заболевания,
3) повышенного уровня АФП.
Цель последующих исследований:
- подтверждение диагноза;
- установка стадии опухолевого процесса;
- оценка выраженности основного процесса в печени (фиброз/ цирроз);
- определение дальнейшего прогноза у больного.
Для диагностики и подтверждения диагноза гепатоцеллюлярного рака часто используется ангиография печени, поскольку имеются весьма характерные и достоверные сосудистые проявления.
КТ ангиография/портография и КТ сканирование «с отсроченным снятием сканов» после внутриартериального введения Липидола — очень чувствительный и специфический метод диагностики, позволяющий определить даже небольшие очаги поражения. Можно считать, что в настоящее время это метод выбора для диагностики НСС.
Биопсия печени при гепатоцеллюлярном раке
Чрезкожная биопсия печени может привести к:
1) кровотечению,
2) «разрыву» опухоли (ткань НСС очень хрупкая и ломкая, ее можно сравнивать по свойствам со стеклом),
3) возможной диссеминации опухолевых клеток по ходу биопсийного канала (благоприятная в плане операции опухоль после данной манипуляции становится неоперабельной). Биопсия оправдана только тогда, когда резекция или OLT исключены из арсенала лечения конкретного больного.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гепатоцеллюлярная карцинома ( Печеночно-клеточный рак )
Гепатоцеллюлярная карцинома – это первичное злокачественное поражение печени (печеночно-клеточный рак), характеризующееся быстрым прогрессированием и неблагоприятным прогнозом. Признаками данной патологии являются гепатомегалия, симптомы сдавления портальной вены и общего печеночного протока, диспепсические явления и интоксикационный синдром. Диагностика основана на данных УЗИ, КТ и МРТ печени, гистологическом подтверждении злокачественного новообразования и определении повышенного (более 400 нг/мл) уровня альфа-фетопротеина в крови. Лечение комплексное: радикальное удаление опухоли и химиотерапия.
Общие сведения
Гепатоцеллюлярная карцинома – это первичный рак печени, одно из наиболее распространенных онкологических заболеваний, частота которого продолжает неуклонно расти. Среди всех опухолей печени данная форма диагностируется в более чем 80% случаев. Заболеваемость первичным раком печени составляет 5-6 случаев на 100 тысяч населения. Сложность патологии заключается в ее стремительном прогрессировании: при некоторых формах гепатоцеллюлярной карциномы от момента появления яркой клинической картины до летального исхода проходит всего несколько месяцев. Часто регистрируются скрытые формы, когда симптомы проявляются уже при достижении образованием значительных размеров и наличии отдаленных метастазов.
Причины
Доказана непосредственная связь развития гепатоцеллюлярной карциномы с хроническими заболеваниями печени, вызванными вирусами гепатитов С, В, а также алкогольной болезнью и циррозом. В этиологии опухоли важная роль отводится несбалансированному питанию с недостаточным поступлением протеинов, повторным травмам печени, аутоиммунным заболеваниям и портальной гипертензии. Наличие у пациента диспластических узлов или аденоматозной гиперплазии печени рассматривается как предраковое состояние.
К факторам риска относят мужской пол, гемохроматоз, неалкогольную жировую болезнь печени (при ожирении), паразитарные заболевания (шистосомоз, описторхоз и другие). Существенно повышает вероятность заболеваемости раком печени влияние канцерогенных веществ (полихлорированные дифенилы, углеводородные растворители, органические пестициды, афлатоксины пищевых продуктов), табакокурение (риск значительно увеличивается при одновременном употреблении алкоголя), применение анаболических стероидов (в частности их неконтролируемое использование в спорте) и противозачаточных препаратов, действие мышьяка (употребление загрязненной этим веществом воды).
Классификация
В современной онкологии существует несколько классификаций данного заболевания. В зависимости от морфологических изменений различают узловую, массивную и диффузную гепатоцеллюлярную карциному. Согласно общепринятой классификации злокачественных новообразований (TNM) определяют характеристики первичной опухоли, наличие или отсутствие поражения регионарных лимфатических узлов и отдаленных метастазов. На основании выявленных патоморфологических изменений при гистологическом исследовании биоптата выделяют четыре степени дифференциации: высокую, среднюю, низкую степень, а также недифференцированную неоплазию.
Симптомы гепатоцеллюлярной карциномы
Клиническая картина характеризуется быстрым ухудшением общего состояния пациента, значительным похудением, прогрессирующей слабостью. В начале заболевания появляется ощущение тяжести и давления в эпигастральной области, постоянная боль в правом подреберье. При прогрессировании патологии болевой синдром усиливается вследствие растяжения капсулы печени, прорастания опухолью серозной оболочки, окружающих тканей и органов.
Характерно быстрое увеличение размеров печени, ее нижний край может находиться на уровне пупка. Гепатомегалия и пальпируемое на поверхности печени неотделяемое и подвижное вместе с ней образование относятся к постоянным признакам гепатоцеллюлярной карциномы. Поздними симптомами являются желтуха, асцит и расширение поверхностных вен живота. Причина желтухи – прорастание опухолью ворот печени и сдавление общего желчного протока. Асцит формируется вследствие нарушения кровотока в системе воротной вены или ее тромбоза. Возможны также диспепсические явления (потеря аппетита, тошнота, рвота) и повышение температуры тела.
Гепатоцеллюлярная карцинома в большинстве случаев развивается на фоне имеющегося заболевания печени. У пациентов с циррозом или вирусным гепатитом заподозрить наличие злокачественного новообразования позволяет значительное ухудшение состояния в течение короткого промежутка времени, появление болевого синдрома, прогрессирующее увеличение размеров печени, а также появление резистентных к проводимому лечению асцита и желтухи.
В зависимости от преобладающих симптомов выделяют шесть вариантов клинического течения гепатоцеллюлярной карциномы. Наиболее часто встречается гепатомегалический вариант, при котором ведущим признаком является увеличение размеров печени, значительное ее уплотнение, появление бугристости на доступных пальпации участках. Больных беспокоит боль в правом подреберье с иррадиацией в поясничную область, незначительная желтушность кожи и слизистых оболочек, повышение температуры тела.
Циррозоподобное течение отличается медленным прогрессированием без значительного увеличения размеров печени. Болевой синдром менее выражен, в большинстве случаев развивается резистентный к терапии асцит. При такой форме опухоль обычно небольших размеров, около трех сантиметров в диаметре, но, несмотря на это, образование сдавливает ветви воротной вены и значительно нарушает портальный кровоток.
Кистозный вариант по клиническим проявлениям напоминает гепатомегалический, но развивается медленнее; при проведении МРТ печени определяются округлые полостные образования. Гепатонекротический (абсцессоподобный) тип новообразования развивается при некротизировании опухолевых узлов и сопровождается значительным повышением температуры тела, признаками интоксикации, выраженной гепатомегалией и болевым синдромом.
Обтурационная форма возникает при сдавлении общего желчного протока и характеризуется ранним развитием желтухи при плавном увеличении образования. В 10% случаев гепатоцеллюлярная карцинома протекает в замаскированном варианте, когда первые проявления заболевания вызваны отдаленными метастазами, а увеличение печени, желтуха и асцит возникают в терминальной стадии.
Диагностика
При обследовании пациентов с печеночно-клеточным раком в лабораторных анализах определяется гипохромная анемия, лейкоцитоз с нейтрофильным сдвигом, резко увеличенная СОЭ. При оценке печеночных проб выявляется повышение активности щелочной фосфатазы, ГГТ. Важным диагностическим критерием является увеличение уровня альфа-фетопротеина в крови пациентов с патологией печени выше 400 нг/мл (уровень данного вещества коррелирует с размерами опухолевого образования). Анализ на альфа-фетопротеин в сочетании с УЗИ печени проводится каждые полгода для оценки течения патологии, эффективности лечения и прогноза.
УЗИ органов брюшной полости служит высокоинформативным методом, позволяет обнаружить узловые образования, предположить их злокачественный характер, оценить изменения паренхимы органа. КТ и МРТ печени назначаются врачом-онкологом для детальной визуализации образования с определением размеров, степени распространенности процесса, прорастания опухоли в систему воротной вены, печеночные протоки или соседние органы. Обязательный метод диагностики - пункционная биопсия печени с проведением гистологического исследования тканей и определением типа опухоли и степени дифференциации.
Критериями верификации диагноза гепатоцеллюлярной карциномы являются характерные гистологические признаки, совпадение результатов двух неинвазивных методов исследования (УЗИ и КТ или МРТ печени) и повышение альфа-фетопротеина более 400 нг/мл. Дифференциальная диагностика проводится с метастатическим поражением печени.
Лечение гепатоцеллюлярной карциномы
При выявлении печеночно-клеточного рака проводится комбинированное лечение, включающее радикальное хирургическое удаление опухоли и химиотерапию. Операция заключается в удалении сегмента (сегментарная резекция) или доли (лобэктомия) печени, при значительном распространении образования показана трансплантация печени. Пациентам с наличием не более чем трех очагов поражения диаметром до 3-х сантиметров проводятся чрезкожные инъекции этанола в опухолевые образования. При отсутствии внепеченочных проявлений эффективность данного метода составляет около 80%.
Удаление опухоли также может осуществляться методами термического воздействия: радиочастотной, лазериндуцированной термоабляцией, а также индуцированной высокочастотными волнами термотерапией. Кроме этого, при гепатоцеллюлярной карциноме применяется метод введения в сосуды желатиновой пены (эмболизация), при этом прекращается доступ крови к опухоли и происходит ее некротизирование.
Возможно введение через печеночную артерию непосредственно в опухоль масляного контрастного вещества, смешанного с химиотерапевтическими препаратами и обладающего способностью накапливаться клетками образования. Локальная химиотерапия обладает намного более высокой эффективностью при данной патологии, чем системная. Применяются также методы генетической иммунотерапии и угнетения онкогенов.
Прогноз и профилактика
Первичный рак печени относится к прогностически неблагоприятным заболеваниям. Прогноз определяется степенью дифференциации опухолевых клеток, вариантом течения, своевременностью выявления заболевания. Профилактика заключается в исключении действия канцерогенных веществ (в частности алкоголя, особенно у пациентов с вирусным поражением печени), проведении вакцинации против гепатита В, предупреждении инфицирования вирусом гепатита С, своевременной диагностике заболеваний печени и раннем эффективном лечении всех хронических гепатологических болезней.
Гепатоцеллюлярный рак печени (гепатома) - частота, причины, механизмы развития
Первичный рак печени — одна из наиболее глобальных проблем здоровья человека. Это тяжелое заболевание, занимающее 5-е место в мире по частоте встречаемости и 3-е по степени смертности среди раков. Существует четыре типа первичной карциномы печени. Среди них преобладает гепатоцеллюлярная карцинома, которая в Великобритании встречается в 10 раз чаще, чем холангиокарцинома внутрипеченочных желчных протоков, и в 20 раз чаще по сравнению с ангиосаркомой. Гепатобластома — редкая для детского возраста болезнь. На сегодняшний день существует значительное число данных об этиологии и патогенезе данного заболевания.
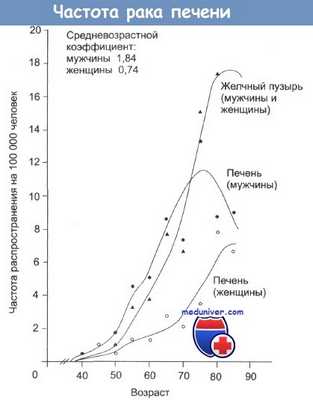
Ежегодно в мире регистрируется свыше 500 000 новых случаев гепатоцеллюлярной карциномы. В Великобритании и США частота заболеваемости составляет 1,8 на 100 000 мужчин и 0,7 на 100 000 женщин. Опухоль возникает у людей всех возрастных групп — от детей до пожилых. Частота распространения в мире (на 100 000 человек) варьирует от 104 в Мозамбике до 29 в Южно-Африканской Республике и 12 в Нигерии.
На Западе доминирующая роль (около 90%) в формировании гепатоцеллюлярной карциномы принадлежит циррозу печени. Этот процесс обычно зависит от возраста: у молодых людей карцинома чаще возникает на фоне нецирротических изменений. Наиболее высокими факторами риска развития гепатомы являются хронический гепатит (как следствие острого вирусного гепатита В), гепатит С и гемохроматоз (гемохрома-тоз — цирроз накопления (пигментный цирроз) — связан с дефицитом фермента, осуществляющего связь железа с белком и, тем самым, регулирующего его всасывание).
Кроме того, гепатома часто образуется у больных алкогольным циррозом печени, развивающимся после хронического гепатита В. У неинфицированных пациентов данное заболевание возникает редко. Пациенты с первичным билиарным циррозом и HBsAg-отрицательные пациенты имеют значительно меньший риск заболеть раком печени (по сравнению с другими типами циррозов). Гепатоклеточная карцинома чаще выявляется у мужчин (соотношение заболевших мужчин и женщин составляет 11:1) и пациентов с хроническим циррозом в возрасте старше 50 лет.
Развитие гепатомы при циррозе печени выявляется как в областях с высоким уровнем заболеваемости, так и в относительно благополучных районах. При этом длительность цирроза представляет собой более важный показатель, чем его этиология. Так, риск развития гепатоцеллюлярной карциномы у больных хроническим циррозом через 20 лет от момента начала заболевания составляет около 5% у женщин и 20% у мужчин. Коэффициент заболеваемости с хорошо сформированным циррозом ежегодно составляет около 3-5%. Повышение уровня альфа-фетопротеина (АФП) в крови может быть также связано с развитием опухоли.
География распространения гепатоцеллюлярной карциномы может быть связана с различными факторами. Цирроз печени, независимо от этиологии, является основным фактором риска развития гепатомы. Европа и Северная Америка являются относительно благополучными районами по степени риска развития рака печени; наиболее распространен алкогольный цирроз. В странах с высокой частотой распространения гепатоцеллюлярной карциномы чаще диагностируется макронодулярный цирроз, развивающийся на фоне инфекции вирусом гепатита В (HBV). Подобный высокий риск рака печени связан с потреблением продуктов, которые в результате неправильного хранения становятся пораженными афлотоксином (токсином плесневого гриба Aspergilis flavus). Токсин является одним из факторов, стимулирующих формирование опухоли.
Значительную роль в развитии рака печени играет вирусная инфекция гепатита В. Среди жителей районов, эндемичных по гепатоцеллюлярной карциноме, у 80% больных в крови выявляется вирус гепатита В. Исследования показывают, что у HBsAg-положительных пациентов вероятность заболеть составляет 230:1. На Западе только в 15-20% случаев больные обнаруживают положительную реакцию на вирус гепатита В. В геноме гепатоцитов у HBsAg-положительных больных выявляют последовательности ДНК вируса.
Немаловажное значение в развитии гепатоклеточной карциномы имеет вирус гепатита С (HCV). Это РНК-содержащий вирус, который не внедряется в ДНК хозяина. Однако белки, формируемые данным вирусом, активируют гены клетки. Исследования, проведенные в последние годы, показали, что лечение хронического гепатита С при помощи интерферона X уменьшает риск развития гепатоцеллюлярной карциномы [5]. Носителями вируса гепатита С являются 0,2% жителей Северной Европы и 5% населения Дальнего Востока. Вирус гепатита С передается парентеральным путем. Гепатит С чаще отмечается в США, Европе и Японии.
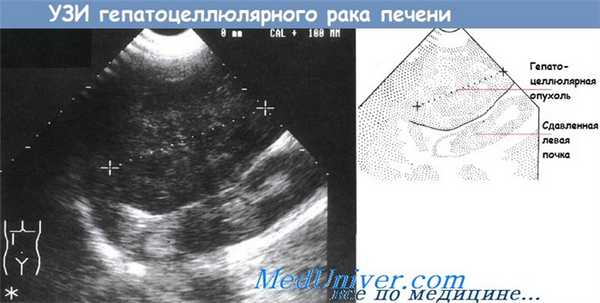
Ультрасонограмма большого гепатоцеллюлярного злокачественного образования (обозначена линией, соединяющей кресты), сдавливающей левую почку.
Патогенез рака печени
Наиболее распространенным анатомическим типом гепатоцеллюлярной карциномы является множественная узловая форма (60%). Массивная анатомическая форма (30%) часто характеризуется наличием повреждений и в окружающей ткани. Остальные 10% гепатоклеточных карцином приходятся на диффузную форму. Окружающая ткань в 80% случаев выявляет цирротические изменения. В группе больных, у которых подобные преобразования структуры ткани отсутствуют, численное соотношение полов одинаково, а средний возраст более низкий. У некоторых пациентов в отсутствие цирроза опухоль формирует тяжи коллагеновых нитей (фиброламеллярная карцинома).
Опухолевые клетки холангиокарциномы внутрипеченочных протоков образуют трубчатые структуры, обычно с протяженным фиброзом.
Гепатоцеллюлярный рак - современное состояние проблемы в России
И.С.Базин, РОНЦ РАМН им. Блохина,
В.В.Омельяновский, д.м.н., проф., директор НИИ клинико-экономической экспертизы и фармакоэкономики ГОУ ВПО РГМУ,
Н.Д.Свешникова, НИИ клинико-экономической экспертизы и фармакоэкономики ГОУ ВПО РГМУ,
О.И.Ивахненко, ст. научный сотрудник НИЛ моделирования и автоматизации лекарственного обеспечения
НИИ клинико-экономической экспертизы и фармакоэкономики ГОУ ВПО РГМУ
Целью данной публикации является анализ современной стратегии лечения ГЦР, основанной на существующей классификации и оценка реальной практики лекарственного обеспечения пациентов, страдающих данным заболеванием.
Среди онкологических заболеваний печени различают первичный и метастатический рак печени. Первичный рак печени в структуре онкологической заболеваемости занимает 6 место среди всех регистрируемых случаев рака - 5,7%, 90% первичного рака печени составляет гепатоцеллюлярный рак (ГЦР). ГЦР занимает ведущее место среди злокачественных опухолей печени у взрослых. Для определения тактики лечения и прогнозирования течения заболевания крайне важное значение имеет четкое стадирование. Например, прогностическая классификация ГЦР, разработанная в Испании (Барселонская классификация), предполагает следующие стадии: Ранний рак (стадия А) - в печени от одного до трех узлов, менее 3-х сантиметров в диаметре. Только эти больные (около 30%) могут иметь достоверные шансы на выздоровление. Стадия В (промежуточная) - узлы множественные. Эти больные имеют небольшие шансы на выздоровление после трансплантации донорской печени.
Стадия С - узлы множественные, опухоль распространяется за пределы печени. Этим больным показана системная терапия. Их 3-летняя выживаемость составляет 20-40%. Стадия D - терминальная, возможна лишь симптоматическая терапия. Согласно классификации определяется и лечебная тактика. Больные с нелеченным ГЦР имеют плохой прогноз для жизни. Выживаемость 1, 3, 5 лет - от 10 до 94%, 0 до 65% и от 0 до 20% соответственно, зависит от стадии опухолевого процесса: при I стадии 55%, при II стадии 35%, при III стадии 15%.
СТРАТЕГИЯ ЛЕЧЕНИЯ ГЦР
Лечение раннего ГЦР заключается в выполнении радикальной операции (резекция печени, трансплантация донорской печени) путем радиочастотной термоабляции, введения этанола или уксусной кислоты в опухоль. Показатели выживаемости колеблются в довольно широких пределах - средний показатель 5-летней выживаемости близок к 40%.
Внутриартериальные введения препаратов больным ГЦР были начаты еще в 70-х годах. Эффект был более выраженным, чем при внутривенном введении, за счет возможности подвести большую дозу с меньшей токсичностью.
Накоплен опыт комбинированного введения препаратов. Заслуживает упоминания комбинация, включающая в себя метотрексат, фторурацил, цисплатин и интерферон. Почти у половины больных фиксировалось клиническое улучшение, а сроки жизни существенно не улучшились (Fong, et al., 2001).
Первичный рак печени малочувствителен к химиотерапии. Объясняют это гиперэкспрессией гена множественной лекарственной устойчивости в гепатоцитах. В режиме системной монотерапии непосредственный эффект не превышал 20% для доксорубицина, эпирубицина, митоксантрона, цисплатина, вепезида, фторурацила с медианой выживаемости в 3-4 месяца.
Стандартом в большинстве стран считается монотерапия доксорубицином. Наибольшие надежды на успешное лечение распространенного ГЦР связаны с препаратами целевой терапии. Новые разработки в области онкологических заболеваний, которые позволяют не только заметно улучшить, но и продлить жизнь больных, в первую очередь связаны с успехами молекулярной генетики. Поэтому в последнее время большое внимание уделяется таргетной (от англ. target - цель, мишень) терапии. В современные стандарты лечения из таргетных препаратов вошел сорафениб. Сорафениб (Нексавар) - новый мультитаргетный препарат, целями которого служат как пролиферация, так и ангиогенез. Нексавар - мультикиназный ингибитор, прицельно действующий как на клетки опухоли, так и на ее сосудистую сеть.
Он не только непосредственно блокирует клеточную пролиферацию, но и нарушает процессы ангиогенеза, что препятствует росту новообразования и его метастазов, приводит к регрессированию очага заболевания.
В 2006 г. опубликованы результаты II фазы исследования сорафениба при лечении диссеминированного гепато-целлюлярного рака. Время до прогрессирования 5,5 месяцев, медиана выживаемости 9,2 месяцев. Опубликованные в 2007 г. результаты рандомизированного исследования SHARP подтвердили полученные ранее данные. Было показано, что сорафениб увеличивает выживаемость в сравнении с плацебо при ГЦР. Медиана общей выживаемости 10,7 против 7,9 месяцев, 44%-ное увеличение общей выживаемости (Hazard ratio: 0.69, P=0.00058), продлевает время до прогрессирования, медиана времени до прогрессирования 5,5 против 2,8 месяцев, 73%-ное пролонгирование TTP (Hazard ratio: 0.58, P=0.000007). В 2008 г. опубликованы предварительные данные по эффективности комбинации сорафениба с доксорубицином в сравнении с доксорубицином. Время до прогрессирования для комбинации 8,6 месяцев при монотерапии 4,8 месяцев.
ОЦЕНКА РЕАЛЬНОЙ ПРАКТИКИ ПАЦИЕНТОВ С ГЕПАТО-ЦЕЛЛЮЛЯРНЫМ РАКОМ
Для оценки реальной практики лечения в Российской Федерации пациентов с гепатоцеллюлярным раком проведен анализ отпущенных по программе Дополнительного лекарственного обеспечения (ДЛО) препаратов для лечения этого заболевания по данным за 2006 г. За 2006 г. по программе ДЛО пролечено 2110 пациентов с первичным раком печени. В соответствии с представленной информацией этим пациентам были назначены 193 лекарственных препарата по торговым наименованиям и 92 препарата по МНН на общую сумму 7232207 руб. (данные ФФОМС, 2009 г.).
Для проведения анализа рациональности использования бюджетных средств все препараты были разделены на три группы: оправданные (обязательные) препараты (тамоксифен, митомицин, эпирубицин, интерферон альфа-2a, циклофосфамид, доксорубицин и фторурацил), препараты сопроводительной терапии (важные) и неоправданные (не важные) препараты или препараты с дискутабельной эффективностью.
В результате анализа получены следующие данные (табл.).
Таблица. Распределение препаратов по целесообразности их назначения
| Группы препаратов | Затраты по системе ДЛО | Доля, в% |
| Препараты, оправданные (обязательные) для назначения | 147564 руб. | 2,04 |
| Препараты сопроводительной терапии (важные) | 2424307 руб. | 33,52 |
| Препараты с дискутабельной эффективностью (не важные) | 4660336 руб. | 64,44 |
| Всего | 7 232 207 руб. |
Следует отметить, что для терапии первичного рака печени, по данным проведенного анализа, назначались химиотерапевтические препараты, не имеющие доказанных данных клинической эффективности при изучаемом заболевании. К таким препаратам относятся цисплатин, оксалиплатин, бевацизумаб, хлорамбуцил, гемцитабин, карбоплатин и бортезомиб. Таким образом, количество пациентов с первичным раком печени, получающих лекарственные препараты по программе ОНЛС, и сумма выделяемых на них средств в РФ крайне незначительна.
В исследовании также были изучены закупаемые лекарства для пациентов с первичным раком печени в одном из субъектов Федерации.
Полученные данные свидетельствуют о том, что 59,9 % от общей суммы закупленных препаратов имеют показания для подготовки и ведения пациентов после трансплантации, проводимой по поводу первичного рака печени. Назначение данных препаратов у пациентов после трансплантации вполне оправдано, однако эта терапия не имеет показаний для лечения первичного рака печени. Около 33,4% средств от общих затрат было истрачено на закупку препарата Мабтера, в настоящий момент не имеющего показаний для применения при ГЦР.
На лечение этих двух пациентов было истрачено 86 590 руб. Из закупленных препаратов только один препарат Кселода относился к химиотерапевтической группе. Однако данный препарат не имеет показаний для лечения печеночно-клеточного рака. Эти больные в основном обеспечивались обезболивающими средствами и другими препаратами симптоматической терапии.
ЗАКЛЮЧЕНИЕ
Результаты исследования свидетельствуют о том, что в настоящее время крайне мало пациентов с первичным раком печени получают таргетную фармакотерапию по программе ОНЛС и в соответствии с Постановлением Правительства №890, т.е. за счет средств регионального бюджета. Анализ реальной практики ведения пациентов с первичным раком печени свидетельствует о преобладании препаратов, не имеющих показаний для применения с точки зрения существующих стандартов и рекомендаций. Улучшить сложившуюся ситуацию с нерациональным использованием средств, направляемых на лечение больных ГЦР, можно путем повышения образовательного и профессионального уровня онкологов и гепатологов.
Читайте также:
