Возможные осложнения нейролептанальгезии (НЛА) при инфаркте миокарда ( оим, ОИМ ).
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Инфаркт – острейшая форма ишемической болезни сердца: когда венечный кровоток недостаточно обеспечивает миокард кислородом, часть клеток погибает.
Наиболее частой причиной развития острого инфаркта является поражение атеросклерозом венечных сосудов, питающих миокард. Дестабилизация жировой бляшки приводит к пристеночному образованию тромба и закупорке участка коронарного сосуда.
Основные осложнения после перенесенного инфаркта миокарда
Тяжесть осложнений острого инфаркта миокарда (ОИМ) связана со степенью нарушения венечного кровотока, сократительной способности сердечной мышцы и локализацией ишемии. Важную роль играет оперативность оказания медицинской помощи, адекватность терапии, наличие сопутствующей патологии, возраст пациента. Кратковременное нарушение кровоснабжения вызывает отмирание клеток субэндокардиальной зоны. Если длительность ишемии превышает 6 часов, развивается некроз 80% пораженного миокарда.
Стадии развития:
- Острейшая (первые 6 часов).
- Острая (до 14 дней).
- Подострая (до 2 месяцев).
- Рубцевания.
Осложнения инфаркта могут возникать на любом этапе. В этом его опасность. Особенно рискуют больные, которых госпитализировали через 6-12 часов после начала приступа и тромболитическая терапия или другие методы восстановления кровотока не проводились. При развитии осложненного инфаркта летальный исход может наступить в течение года.
Все осложнения ОИМ можно разделить на четыре блока:
- Электрические (нарушение ритма и проводимости импульса).
- Механические (связаны со структурными нарушениями в миокарде).
- Гемодинамические (вызваны функциональной неспособностью пораженного миокарда обеспечивать прежний кровоток).
- Реактивные (связаны с резорбтивными и аутоиммунными процессами, активацией симпатической нервной системы, а также вторичными дисфункциями внутренних органов).
Ранние
Осложнения острого периода инфаркта миокарда развиваются в первые 10 суток после болевого приступа и существенно не ухудшают прогноз заболевания при своевременном лечении.
Нарушения ритма и проводимости – самые частые осложнения острого периода инфаркта (до 80%). Аритмии в основном развиваются из-за изменения электрофизиологических свойств и метаболизма в пораженной зоне, снижения порога фибрилляции, выброса в кровоток большого количества активных веществ — катехоламинов и развития феномена re-entry (круговой циркуляции волны возбуждения в миокарде).
Клинико-прогностическая классификация аритмий:
Неопасные для жизни:
- синусовая аритмия, брадикардия (пульс медленный, но >50), тахикардия (
- миграция водителя ритма по предсердиям;
- редкие (
- переходящая AV-блокада I степени.
- синусовая тахикардия с пульсом >110 уд/мин, брадикардия
- частые предсердные, а также групповые, политопные ранние желудочковые экстрасистолы (предикторы фибрилляции и мерцательной аритмии);
- синоаурикулярная блокада;
- AV-блокада II-III степеней;
- идиовентрикулярный ритм;
- ритм из АV-соединения;
- суправентрикулярная пароксизмальная тахикардия;
- мерцание и трепетание предсердий;
- синдром слабости синусового узла.
Опасные для жизни:
- пароксизмальная желудочковая тахикардия;
- фибрилляция, трепетание желудочков;
- субнодальная полная AV-блокада;
- асистолия желудочков.
Клинически нарушения ритма проявляются:
- сердцебиением;
- ощущением перебоев в работе сердца;
- падением артериального давления;
- головокружением, потерей сознания.
Благодаря широкому внедрению тромболизиса на догоспитальном этапе и экстренной реваскуляризации миокарда частота внутрижелудочковых и полных AV-блокад не превышает 5%. Ранее эти осложнения становились причиной смерти более 50% пациентов как следствие прогрессирования сердечной недостаточности и развития кардиогенного шока.
В случае повторения жизнеугрожающих нарушений ритма устанавливают трансвенозный электрод для временной стимуляции миокарда в режиме of demand (по требованию). После возобновления адекватного сердцебиения устройство оставляют до полной стабилизации гемодинамических показателей (на 7-10 дней).
Острая сердечная недостаточность развивается из-за нарушения функции левого желудочка. К ней приводят обширные и трансмуральные инфаркты, осложненные тахиаритмией или AV-блокадой. Некротизированная зона миокарда «выключается» из сократительной массы При отмирании более 40% мышечной ткани желудочка развивается кардиогенный шок.
Резкое снижение функции выброса левого желудочка приводит к:
- увеличению конечного диастолического объема крови в нем;
- повышению давления сначала в левом предсердии, затем в легочных венах;
- развитию кардиогенного отека легких;
- недостаточному кровоснабжению жизненно важных органов (головного мозга, печени, почек, кишечника.
Клинически острая сердечная недостаточность проявляется:
- прогрессирующей одышкой;
- тахикардией, снижением давления;
- влажными хрипами в легких, крепитацией;
- цианозом (посинением кожи);
- снижением диуреза;
- нарушением сознания.
Кардиогенный шок – крайняя степень недостаточности левого желудочка, летальность при котором превышает 85%.
Лечение острой сердечной недостаточности, кардиогенного шока и альвеолярного отека легких должно проводиться в условиях реанимационного блока.
Механические осложнения в раннем периоде (разрывы сердца). Этот тяжелейший, чаще всего летальный исход инфаркта развивается на 5-7 сутки после приступа.
Разрывы сердца делят на:
- Наружные. Разрыв стенки желудочка в области ишемического поражения с истечением крови в перикард.
Выделяют предразрывный период, который интенсивной болью, проявлениями шока, и собственно разрыв стенки. В этот момент быстро происходит остановка кровообращения с признаками клинической смерти. Иногда этот процесс может затянуться на несколько суток.
К сожалению, лишь малому проценту больных удается выполнить экстренную пункцию перикарда и срочную операцию по восстановлению целостности левого желудочка с дополнительным аортокоронарным шунтированием.
- Разрыв межжелудочковой перегородки. Возникает при передней локализации некроза. Диаметр дефекта колеблется от 1 до 6 см. Клинически это проявляется нарастанием некупируемой боли, развитием кардиогенного шока, появлением за несколько часов тотальной сердечной недостаточности. Лечение исключительно хирургическое.
- Разрыв сосочковой мышцы. Папиллярные мускулы удерживают митральный и трикуспидальный клапаны закрытыми во время систолы, не давая крови забрасываться обратно в предсердия. Полностью несовместим с жизнью, так как молниеносно развивается митральная недостаточность и альвеолярный отек легких.
Аневризма левого желудочка. Локальное выбухание стенки левого желудочка во время диастолы. Дефект состоит из отмершей или рубцовой ткани и не участвует в сокращении, а его полость зачастую заполнена пристеночным тромбом. Состояние опасно развитием эмболических осложнений или разрывом сердца.
Психические нарушения. Обычно развиваются на первой неделе заболевания и вызваны недостаточным поступлением крови в мозг, низким содержанием в ней кислорода и влиянием продуктов распада сердечной мышцы.
Нарушения поведения могут протекать в форме психотических (сопор, делирий, сумрачное состояние) и непсихотических реакций (астения, депрессия, эйфория, невроз).
Особое внимание следует уделить депрессивному синдрому (он может послужить причиной суицида).
Поздние
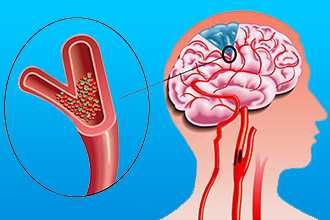
По истечении 10 суток после сердечного приступа могут развиться:
- Ранняя постинфарктная стенокардия. Чаще возникает при поражении нескольких венечных сосудов или недостаточном тромболизисе, а также из-за нарушения диастолической функции левого желудочка. Является предиктором рецидива инфаркта миокарда и внезапной сердечной смерти.
- Тромбоэмболические осложнения:
- ТЭЛА (тромбоэмболия легочной артерии);
- бифуркации брюшного отдела аорты, артерий нижних конечностей (с развитием гангрены);
- тромбоз мезентериальных сосудов (клиническая картина острого живота), почечной артерии (инфаркт почки), церебральных артерий (инсульт).
3. Тромбоэндокардит. Асептическое воспаление эндокарда с пристеночным тромбообразованием в зоне некроза. Служит источником материала для эмболии сосудов большого круга кровообращения.
4. Стрессовые эрозии и язвы желудочно-кишечного тракта, кровотечение. Может развиваться и в остром периоде инфаркта миокарда. Причиной развития патологии служит нарушение кровоснабжения кишечной стенки, гиперактивация симпатической нервной системы, терапия антиагрегантами и антикоагулянтами.
5. Парез кишечника. Нарушение мочеиспускания (атония мочевого пузыря). Особенно часто встречается у пожилых пациентов на фоне действия нейролептаналгезии, строгого постельного режима, применения атропина.
Также в позднем периоде возможно развитие нарушений ритма и проводимости и хронической аневризмы сердца.
Отдаленные
В отдаленном периоде возможно развитие:
- Хронической сердечной недостаточности, которая требует пожизненной медикаментозной терапии.
- Постинфарктного кардиосклероза. Снижение и нарушения функции миокарда, вызванное рубцовыми и склеротическими процессами, что повышает риск повторного ОИМ.
- Постинфарктного синдрома (Дресслера). Это аутоиммунный процесс, вызванный неадекватным ответом организма больного на продукты распада отмерших клеток сердца: образуются антитела к собственным серозным оболочкам. Развивается на 2-8 неделе заболевания и характеризуется классической триадой: сухой перикардит, плеврит, пневмонит. Реже наблюдается поражение грудинно-реберных и плечевых суставов с развитием синовита.
Как не допустить ухудшения
Большинство осложнений ОИМ развиваются по причинам, не зависящим от пациента. Но существует ряд превентивных мер, способных снизить вероятность возникновения и тяжесть последствий:
- Обучение азам первой медицинской помощи при ОИМ и алгоритму реанимационных мероприятий.
- Своевременное обращение за медицинской помощью. Реваскуляризация (тромболизис, стентирование, аортокоронарное шутнирование) возобновляет кровоток в пораженном сосуде и ограничивает зону некроза миокарда.
- Строгий постельный режим в первые сутки заболевания, максимальный эмоциональный покой.
- Следование курсу лечения и своевременный прием медикаментов.
- Дозированные физические нагрузки, физиотерапия согласно стадии инфаркта.
Что делать при осложнениях: как лечить и к кому обращаться
Ранние осложнения лечатся в условиях палаты интенсивной терапии кардиологической клиники с постоянным мониторингом жизненных показателей. Ритм восстанавливают путем введения антиаритмических препаратов (класс медикамента зависит от вида аритмии), электроимпульсной терапией или имплантацией кардиостимулятора. Механические осложнения требуют хирургического вмешательства на открытом сердце с использованием искусственного кровообращения.
Поздние осложнения развиваются на стационарном или санаторно-курортном этапе. Лечение тромбоэмболических эпизодов зависит от состояния пораженного сосуда и длительности ишемии. Допускается консервативное введение антикоагулянтов, тромболизис, эндоваскулярное удаление эмбола, открытая тромбэктомия. В случае необратимых повреждений выполняют резекцию.
С осложнениями отдаленного периода пациент должен обратиться к лечащему кардиологу, который проведет диагностику и назначит лечение.
Выводы
Вероятность ранних и поздних осложнений инфаркта миокарда возрастает при несвоевременном обращении за медицинской помощью, а также у пациентов с нелеченной гипертонией, сахарным диабетом и атеросклерозом.
Для профилактики инфаркта и его осложнений стоит придерживаться здорового образа жизни, полноценно питаться, избегать стрессов и влияния неблагоприятных факторов окружающей среды, отказаться от курения, ограничить употребление алкоголя, регулярно делать зарядку.
Пациентам с сердечно-сосудистыми заболеваниями стоит систематически проходить профилактические осмотры 2 раза в год и следовать рекомендациям врача.
Для подготовки материала использовались следующие источники информации.
Обезболивание при инфаркте миокарда
Проблема обезболивания - одна из важнейших при лечении инфаркта миокарда (ИМ). Конечный результат интенсивной терапии во многом зависит от эффективности аналгезии [3, 4, 29, 47]. Чем выраженное и продолжительнее болевой синдром, тем больше опасность развития тяжелых осложнений [1, 2, 21, 42, 44]. Главной задачей обезболивания является смягчение стрессорной реакции при минимальном угнетающем действии медикаментов на системы кровообращения и дыхания [19, 20, 49]. Снижение или полное купирование болевого стресса способствуют уменьшению числа осложнений и более благоприятному течению заболевания [22, 54]. В настоящее время для купирования болевого синдрома у больных ИМ используется большое количество лекарственных средств с различными механизмами действия [48].
Наркотические аналгетики (НА)
Аналгетики - это лекарственные средства, обладающие специфической особенностью ослаблять или устранять чувство боли [56]. Среди них наиболее мощными по действию являются НА.
Морфин гидрохлорид является основным представителем группы НА. Используется внутривенно в дозе 3-5 мг, внутримышечно или подкожно - 10-20 мг. Наибольший обезболивающий эффект развивается в зависимости от способа введения через 30-60 минут. Полного обезболивания обычно удается достичь в 15-30% случаев, неполного - в 40-60%. В настоящее время морфин реже используется для обезболивания больных ИМ ввиду возможности развития негативных эффектов (угнетение дыхательного центра, тошнота, рвота, парез желудочно-кишечного тракта, задержка мочеиспускания и т.п.) [45].
Другим НА, часто используемым для обезболивания ИМ, является промедол [20]. Препарат по своим свойствам близок к морфину, но меньше угнетает дыхательный центр, меньше возбуждает рвотный центр и центр блуждающего нерва. Разовая доза при внутривенном и внутримышечном введении у больных ИМ составляет 10-20 мг.
Наиболее популярным НА является фентанил [50]. Это синтетический НА, с выраженным аналгетическим действием (в 100 раз превосходит морфин). При внутривенном введении препарата в дозе 0,05-0,1 мг (1-2 мл 0,005% раствора) эффект наступает через 1-3 минуты и продолжается в течение 15-30 минут [45]. Характеризуется коротким периодом действия (около 30 минут). При внутривенном введении в дозе 0,1-0,5 мг может вызвать резкое угнетение дыхания, ригидность грудной клетки, брадикардию.
В последние годы для обезболивания ИМ все чаще используются пентазоцин, нубаин, трамал [21, 31]. Пентазоцин (фортрал) является слабым антагонистом опиатов. Способен снимать угнетающее действие на дыхание фентанила, сохраняя аналгезию. Длительность аналгезии при введении препарата в дозе 30 мг в среднем составляет 3-4 часа. Нубаин является аналгетиком синтетическою ряда. Обезболивающий эффект после внутривенного введения 10-20 мг наступает через 3-5 минут, после внутримышечного - через 5-10 минут. Длительность эффекта - 4-6 часов. Препарат вводится, в среднем, 3-4 раза в сутки [32]. Хорошие результаты обезболивания ИМ отмечаются при использовании трамадола в средней дозе 1,4 мг/кг (достигнуто достаточное обезболивание в 58,8% случаев) [31]. Препарат более безопасен по сравнению с морфином и промедолом, поэтому его более целесообразно использовать у больных пожилого возраста с умеренным болевым синдромом или с сердечной недостаточностью.
Внутривенные и внутримышечные инъекции НА и их аналогов, как правило, малоэффективны при разрывах сердечной мышцы и затяжном течении инфаркта миокарда [5, 47]. Морфин, промедол в небольших дозах вызывают угнетение спастических рефлекторных реакций коронарных сосудов, тогда как при применении больших доз этих препаратов проявляется противоположный эффект - повышение тонуса и спастические реакции венечных сосудов [37]. Кроме того, наркотические аналгетики в больших дозировках оказывают выраженный отрицательный инотропный эффект, вызывают снижение артериального давления и брадикардию [56].
При возникновении депрессии дыхания вследствие использования НА, необходимо 1 мл налоксона (0,04 мг) развести в 9 мл изотонического раствора и ввести внутривенно. При отсутствии эффекта следует повторно вводить препарат в той же дозировке каждые 1-2 минуты до восстановления и нормализации дыхания [31]. Следует помнить, что использование с целью снижения дыхательной депрессии аналептиков, увеличивает потребность нервных клеток в кислороде и ведет к гипоксии. Применение специфических антидотов типа налорфина снимает не только депрессию дыхания, но и аналгезию [20, 56].
Нейролептаналгезия (НЛА)
При купировании болевого синдрома у больных ИМ необходимо блокировать не только центральные, но и клеточные, эндокринные и вегетативные реакции организма на повреждающие воздействия [29, 33]. Эта задача может быть решена с помощью НЛА - сочетанного применения аналгетика и нейролептика. НЛА оказывает селективное воздействие на клетки зрительного бугра, подбугорной области, ретикулярную формацию, вызывая потерю болевой чувствительности, состояние психического и двигательного покоя без наступления сна. В качестве нейролептика обычно используется дроперидол [45]. Препарат вызывает выраженное нейровегетативное торможение, оказывает противошоковый эффект, обладает противорвотным действием [34], Аналгетическим компонентом чаще всего служит фентанил, но может использоваться другой препарат (трамал, ненаркотические аналгетики). Существует готовая смесь - таламонал, которая содержит 0,05 мг фентанила и 2,5 мг дроперидола в 1 мл. Обезболивающий эффект НЛА можно усилить предварительным введением 10-15 тыс. ЕД гепарина [22].
НЛА обеспечивает хорошее обезболивание у большинства больных. У больных пожилого и старческого возраста с выраженной сопутствующей соматической патологией при использовании классической НЛА выявляются нарушения функции внешнего дыхания [23, 26]. Чтобы при проведении НЛА избежать угнетения дыхания, целесообразно усиливать ненаркотический компонент (анальгин, баралгин, трамал и т.п.) [22, 43, 50].
Атаролгезия
Атаралгезией называют метод комбинированного использования транквилизаторов и НА (например, 2 мл 0,005% раствора фентанила и 2 мл 0,5% раствора седуксена) [44]. Клиника атаралгезии сходна с клиникой нейролептаналгезии, но характеризуется меньшими нарушениями дыхания и гемодинамики, что позволяет широко использовать данную методику у больных пожилого и старческого возраста с выраженной сопутствующей патологией [43]. Наибольшее применение для атаралгезии из транквилизаторов получил седуксен (диазепам, реланиум) [31, 37, 41]. Препарат не оказывает прямого влияния на миокард, но кратковременно уменьшает общее периферическое сопротивление, благодаря чему может несколько снижаться артериальное давление и сердечный выброс. Препарат параллельно с торможением поведенческих проявлений ноцицептивных реакций значительно уменьшает прессорные реакции артериального давления и тахикардию, усиливает кардиохронотропный эффект барорефлекса и модулирующую функцию "аналгетических" систем среднего мозга. В качестве аналгетика чаще всего используются фентанил, промедол, пентазоцин в обычных или несколько уменьшенных дозировках (возможно использование других препаратов) [28, 31].
Клофелин
Клофелин (клонидин) - водорастворимый препарат, легко проникающий через гематоэнцефалический барьер. Обладает селективными альфа-2-адреностимулирующими свойствами. Имеющиеся данные позволяют рекомендовать препарат для включения в комплекс аналгетических средств, используемых при болевом синдроме у больных с инфарктом миокарда [28]. Помимо обезболивающего эффекта клофелин способен обеспечивать уменьшение работы поврежденного миокарда путем уменьшения адренергических воздействий на сердце. Использование препарата показано у больных с артериальной гипер- и нормотензией. Его применение ограничено при наличии артериальной гипотензии. По мнению В.А. Михайловича и соавт. [28], клофелин, обладающий одновременно аналгетическим и гемодинамическим свойствами, может занять промежуточную позицию между собственно аналгетическими препаратами и специфическими способами лечения ИМ, в основе действия которых лежит уменьшение нагрузки на миокард.
Средства для ингаляционного наркоза
Наиболее широко для обезболивания у больных ИМ используется закись азота [45]. Аналгезирующее действие закиси наступает при концентрации 35-45 об.%. Утрата сознания наблюдается при концентрации, равной 60-80%, но не у всех пациентов. Закись азота обладает достаточным аналгетическим эффектом при купировании болевого синдрома у большинства пациентов с ИМ. В концентрациях до 80% она практически безвредна для организма. Использование более высоких концентраций ведет к развитию гипоксии. Хотя закись азота принято считать одним из традиционных способов обезболивания при ИМ, в настоящее время имеется ряд публикаций, заставляющих более осторожно подходить к ее использованию. Выявлено, что закись азота способна вызывать сужение эпикардиальных коронарных артерий и усугублять повреждение сердечной мышцы с последующим уменьшением насосной функции сердца [15, 60].
Другие средства для ингаляционного наркоза (пентран, трилен и др.) в настоящее время используются редко для проведения обезболивания у больных ИМ или применяются по определенным показаниям (необходимость выключения сознания при кардиоверсии, выполнение болезненных манипуляций, проведение искусственной вентиляции легких и т.п.) [37]. Это обусловлено необходимостью использования специальной наркозной аппаратуры и специфическими особенностями препаратов (способность сенсибилизации миокарда и т.п.) [28].
Электрообезболивание
Транскраниальная электроаналгезия представляет собой воздействие электрическим током на структуры головного мозга, которое способно вызывать состояние обезболивания или снижать интенсивность болевых ощущений [30]. Механизм возникновения аналгезии при электростимуляционных способах обезболивания связан с активацией эндогенных опиатных структур. Это приводит к высвобождению опиоидных пептидов, в частности, бета-эндорфина, концентрация которого в плазме и спинномозговой жидкости возрастает в несколько раз. Кроме того, стимуляция толстых периферических афферентных волокон угнетает интернейроны головного мозга и не позволяет болевым импульсам, проводящимся по тонким А-cигма и С-волокнам, достигать центральной нервной системы. Рекомендуемые параметры: частота 1000-2000 Гц, длительность импульсов - 0,15-0,20 мсек, величина среднего тока - от 0,1 до 3,0 мА. Длительность процедуры электрообезболивания составляет 40-60 минут 1 раз в день в первые трое суток заболевания. Аналгетическое действие развивается не сразу, а через 10-15 минут [37]. Эффект одной процедуры сопровождается длительным аналгетическим последействием (2-24 часа).
Транскраниальная электроаналгезия позволяет получить достаточный уровень обезболивания у большинства больных ИМ (купирующий эффект 84,3%) [41]. При этом отмечается нормализация артериального давления, частоты сердечных сокращений и дыхания. Методика достаточна эффективна и безопасна, практически нe имеет противопоказаний.
Большим достижением в обезболивании некупирующегося ангинозного статуса стала эпидуральная блокада (ЭБ) [14, 28]. При ЭБ местными анестетиками (МА) развивается блокада передних и задних корешков спинного мозга. Взаимодействуя с мембраной нервной клетки, МА препятствуют возникновению нервного импульса и обратимо блокируют его проведение по нервному волокну. Но следует сказать, что применение ЭБ имеет определенные ограничения, связанные с развитием специфических осложнений и наличием технических трудностей при ее выполнении [26, 36, 40].
Симпатическая блокада сопровождается развитием дилатации артерий и артериол, снижением венозного тонуса, уменьшением венозного возврата к сердцу и снижением артериального давления [7]. При этом происходит значительное снижение общего периферического сопротивления (на 5-20%), ударного объема сердца (на 10-30%), артериального давления (на 15-33%) [47]. В связи с повышением тонуса парасимпатической системы и развитием рефлекса Бейнбриджа у больных развивается урежение частоты сердечных сокращений.
Фармакологическая денервация сердца и его десимпатизация в физиологических пределах оказывает благотворное влияние на систему кровобращения [6, 23]. Уменьшение коронарного кровотока, которое наблюдается после снижения среднего аортального давления, компенсируется снижением работы миокарда за счет уменьшения пред- и постнагрузки и уменьшения частоты сердечных сокращений. ЭБ МА на уровне Th1-6 способна в определенной степени увеличивать диаметр стенозированных коронарных артерий [55], не влияя при этом на их нестенозированные сегменты и не вызывая вазодилатации мелких коронарных сосудов [40]. Высокая ганглионарная блокада симпатических волокон стимулирует коллатеральное кровообращение миокарда, что может в определенных условиях способствовать улучшению питания в зоне ишемии и повреждения, снижает давление в правых полостях сердца и легочных сосудах [19].
ЭБ МА не оказывает прямого влияния на внутрисердечную проводимость даже у больных с исходными ее нарушениями. В ряде исследований отмечено, что под влиянием ЭБ происходит снижение потребления кислорода миокардом и улучшение функций левого желудочка, улучшение оксигенации артериальной крови в связи со снижением внутрилегочного венозного шунта, нормализация регионарной гемодинамики, благотворные изменения вязкостных параметров крови посредством регуляции транскапиллярного обмена [35, 46, 59].
Обычно в эпидуральное пространство (ЭП) на уровне Тh1-6 вводится 4 мл 2% лидокаина или 3-5 мл 2-2,5% раствора тримекаина [58]. Для пролонгирования эффекта введение повторяют каждые 2 часа (2-5 раз в сутки). Суточная доза может достигать 2 г [43]. ЭБ МА полностью купирует болевой синдром уже через 5-10 минут после введения препарата. Частота сердечных сокращений при этом уменьшается, в среднем, на 6-8 в минуту, систолическое артериальное давление - на 10-15 мм рт. ст. Более того, у ряда больных наблюдается быстрое обратное развитие признаков инфаркта миокарда. Недостатками ЭБ МА является относительно короткий период действия, риск повреждения спинного мозга и развитие тахифилаксии.
Открытие в центральной нервной системе опиатных рецепторов и их эндогенных лигандов позволили более эффективно использовать ЭБ для лечения болевого синдрома у больных ИМ. Введение в эпидуральное пространство (ЭП) минимальных доз НА вызывает длительную и избирательную блокаду болевой импульсации и практически не влияет на другие виды чувствительности [25, 28, 53].
При эпидуральном введении НА у больных ИМ происходит нормализация показателей гемодинамики и внешнего дыхания, снижение количества катехоламинов, увеличение почасового диуреза и улучшение показателей электрокардиограммы в динамике [39]. Через 1 час после введения отмечается восстановление физиологического равновесия между симпатическим и парасимпатическим отделами вегетативной нервной системы [11]. Эпидуральная аналгезия морфином в дозе 2-5 мг оказывает положительное влияние на биомеханику дыхания и газообмен [8, 10]. ЭБ НА в грудном отделе позволяет значительно улучшить качество обезболивания и увеличить его продолжительность при купировании болевого синдрома [10]. Но широкому внедрению в практику препятствует ряд факторов: 1) высокий риск повреждения спинного мозга; 2) возможность развития отсроченной депрессии дыхания; 3) необходимость привлечения высококвалифицированных анестезиологических кадров. Для снижения риска проведения аналгезии была разработана методика проведения ЭБ НА у больных ИМ в люмбальном отделе [5, 13].
При погрешностях в технике проведения ЭБ возможна перфорация твердой мозговой оболочки и случайное интратекальное введение препарата, ранение венозного сплетения или спинномозгового корешка [40]. При нарушении принципов асептики могут развиться гнойные осложнения. Помимо этого, ЭБ НА имеет специфичные побочные эффекты. Это депрессия дыхания, транзиторная задержка мочеиспускания, кожный зуд, тошнота, рвота [38].
Основной опасностью при эпидуральной блокаде является незамеченная пункция твердой мозговой оболочки с последующем введением значительного количества МА или НА в субарахноидальное пространство [37]. Истечение ликвора является очевидным признаком субарахноидальной пункции. При этом истечение идет с постоянной частотой капель, и ее температура равна температуре тела. При подозрении на перфорацию твердой мозговой оболочки следует иглу извлечь и снова ввести на сегмент выше или ниже. Для определения характера вытекающей по катетеру жидкости можно использовать пробу с 25% сульфосалициловой кислотой или с лакмусовой бумажкой [40]. При развитии тотального спинального блока основные усилия должны быть направлены на немедленное проведение искусственной вентиляции легких и быстрое достижение вазопрессорного эффекта [38]. ЭБ необходимо проводить в случаях если имеется [11]:
1. Болевой синдром, оцениваемый не менее чем в 4 балла, при том, что внутримышечные и/или внутривенные введения НА не дали полного обезболивающего эффекта (интенсивность боли оценивается по 5-балльной шкале).
2. Затяжное течение инфаркта миокарда.
3. Рецидивирующий инфаркт миокарда.
4. Наличие в М-комплексе на ЭКГ зубца S+ на фоне высокой интенсивности болевого синдрома, что специфично для угрожающего разрыва миокарда.
5. Эпистенокардитический перикардит или формирующаяся острая аневризма сердца с выраженным болевым синдромом.
Противопоказания к проведению эпидуральной анестезии делятся на абсолютные и относительные. Абсолютными противопоказаниями принято считать:
1) воспалительные изменения в области предполагаемой пункции;
2) наличие генерализованной инфекции (сепсис);
3) тяжелый шок (обосновано использование ЭБ НА на фоне параллельно проводимой интенсивной терапии);
4) повышенную чувствительность к препаратам для проведения эпидуральной блокады.
К относительным противопоказаниям относят:
1) деформации или другие изменения позвоночника, создающие препятствия для выполнения пункции-катетеризации эпидурального пространства;
2) заболевания центральной или периферической нервной системы;
3) глубокую артериальную гипотонию (тяжелая сердечно-сосудистая недостаточность);
4) гипокоагуляцию.
В связи с усовершенствованием методики проведения эпидуральной блокады и получением новых клинических данных, круг противопоказаний может сужаться. Так, долгое время антикоагуляционная терапия считалась противопоказанием к проведению эпидуральной анестезии из-за риска развития эпидуральной гематомы. Ряд исследований и наш собственный опыт проведения ЭБ на фоне антикоагулянтной терапии у больных ИМ свидетельствует о незначительном риске развития этого осложнения у исследуемой категории пациентов [13].
ЛИТЕРАТУРА
Возможные осложнения нейролептанальгезии (НЛА) при инфаркте миокарда ( оим, ОИМ ).
После определения исходной свертываемости крови (на этапе скорой помощи можно не делать), больному в/в вводится 10-15 тысяч ЕД гепарина. В последующем, в течение 7—10 суток, его назначают 4—6 раз в сутки. Доза гепарина перед каждым введением подбирается так, чтобы добиться увеличения времени свертывания крови в 2—3 раза по сравнению с нормой.
Примечание. I. При терапии антикоагулянтами прямого действия, помимо определения свертываемости крови, один раз в сутки следует проводить исследование мочи на форменные элементы крови (эритроциты). Допускается умеренная микрогематурия (6—8 эритроцитов в поле зрения), а при значительной (20—30 эритроцитов в поле зрения), следует снизить суточную дозу гепарина.
2.Определение кровоточивости при использовании гепарина является неинформативным исследованием.
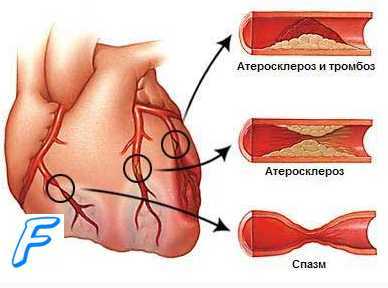
Тромболитическая терапия
Перед проведением данного лечения необходимо уточнить сроки начала ОИМ. Если с момента его развития прошло более 3 часов, тромболитнческая терапия не проводится из-за опасности возникновения синдрома реканализации и развития его осложнений: коллапса, сложных нарушений ритма.
Тромболитическая терапия осуществляется при помощи препаратов, активирующих фибринолиз: стрептокиназой, стрептодеказой, урокиназой и другими препаратами.
При лечении стрептокиназой в течение первых 30 мин. в/в вводят 250—300 тыс. ЕД, растворенных в изотоническом растворе хлорида натрия или глюкозы. В последующие 72 часа продолжается инфузия данного препарата со скоростью 100—150 тыс. ЕД в час. Для купирования возможных аллергических реакций с первой дозой стрептокиназы рекомендуется ввести в/в 60—90 мг преднизолона.
Стрептодеказа представляет собой иммобилизованный тромболитический фермент стрептокиназы на биосовместимом и биодеградуируемом водорастворимом декстране. После проведения биологической пробы (300 000 фибринолитических единиц (ФЕ), препарат вводится в/в струйно, в дозе 2,7 млн. ФЕ. Он действует мягче, чем стрептокиназа, его использование реже сопровождается осложнениями. Лечение стрептодеказой сочетают с гепаринотерапией.
Урокиназа — наиболее физиологичный активатор фибринолиза. После проведения биологической пробы (4400 ЕД/кг/10 мин.) вводится в/в капельно, в течение 12—72 часов с момента возникновения ОИМ, в дозе 4400 ЕД/кг/час. Применяется в сочетании с гепарином и без него. При правильно проводимом лечении про-тромбиновый индекс должен уменьшиться в 2—4 раза.
Тромболитическая терапия должна осуществляться под постоянным контролем времени свертывания крови, фибриногена, коа-гулограммы, содержания эритроцитов в моче.
При использовании активаторов фибринолиза возможно появление геморрагических осложнений; в этом случае показана их отмена и назначение эпсилон-аминокапроновой кислоты (5% раствор эпсилон-аминокапроновой кислоты 100—200 мл в/в кап.), тра-силола, протаминсульфата.
Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ
Терещенко Сергей Николаевич, Проф., д. м. н., заведующий кафедрой скорой помощи, председатель секции ВНОК "Неотложная кардиология"
Рабочая группа по подготовке текста рекомендаций:
проф. Руда М. Я. (председатель), проф. Голицын С. П., проф. Грацианский Н. А., к. м. н. Комаров А. Л., проф. Панченко Е. П., д. м. н. Староверов И. И., проф. Терещенко С. Н., д. м. н. Явелов И. С.
В настоящее время применение ингибиторов ангиотензинпревращающего фермента (АПФ) у больных острым инфарктом миокарда (ОИМ) не вызывает сомнений. Общеизвестен тот факт, что у данной категории пациентов риск летального исхода, развития повторного ИМ и сердечной недостаточности довольно высок. Прогноз ОИМ, прежде всего, определяется размерами некроза и осложнениями. Особое место в терапии ОИМ в отношении влияния на ближайший и отдаленный прогноз занимают ингибиторы АПФ.
Ингибиторы АПФ тормозят процессы ремоделирования миокарда, запущенные в результате инфарктного повреждения сердечной мышцы. Ремоделирование левого желудочка подразумевает истончение стенки в зоне некроза, гипертрофию непораженного миокарда, дилатацию камер сердца. В развитии этого процесса важную роль играет местная тканевая ренин-ангиотензин-альдостероновая система (РААС) сердца, активизирующаяся в первые дни инфаркта миокарда. Следует отметить, что активация РААС и симпатической системы имеет большое значение в приспособлении миокарда к новым условиям функционирования, стимулируя раннюю гипертрофию кардиомиоцитов и замещение зоны инфаркта рубцовой тканью. Изменение структуры и формы левого желудочка, нейрогормональная активность способствуют нормализации сердечного выброса в первые недели. Однако конечным результатом постинфарктного ремоделирования является прогрессирующая дилатация левого желудочка. Активация РААС обусловливает не только гипертрофию кардиомиоцитов, но и вазоконстрикцию и задержку жидкости, что играет важную роль в развитии хронической сердечной недостаточности (ХСН).
Применение ингибиторов АПФ приводит к снижению общего периферического сосудистого сопротивления за счет снижения активности ангиотензина II на рецепторы сосудов и увеличения содержания брадикинина, оказывающего сосудорасширяющее действие. Ингибиторы АПФ, воздействуя на локальные РААС, препятствуют прогрессированию дилатации левого желудочка и вызывают регресс его гипертрофии. Результатом этого является уменьшение ремоделирования миокарда. Влияя на тканевые РААС в миокарде, ингибиторы АПФ оказывают также и антиаритмическое действие.
Ингибиторы АПФ наряду со способностью улучшать эндотелиальную функцию, тормозить рост и пролиферацию гладкомышечных клеток, обладают свойством тормозить миграцию и функцию макрофагов, снижать тромботическую активность посредством предотвращения агрегации тромбоцитов и усиления эндогенного фибринолиза.
Снижая синтез ангиотензина II и регулируя артериальное давление, которое является важным компонентом, влияющим на потребление миокардом кислорода, а также, обладая антиадренергическим действием и стимулируя синтез брадикинина - одного из мощных вазодилататоров, ингибиторы АПФ оказывают антиишемический эффект на миокард. Стимуляция брадикинина также приводит к уменьшению зоны некроза.
Таким образом, эффект ингибиторов АПФ у больных ОИМ проявляется:
- Влиянием на процессы ремоделирования миокарда.
- Влиянием на ремоделирование сосудов (антиангинальный, антиишемический эффект).
- Снижением тромбообразования.
- Профилактикой развития сердечной недостаточности.
- Антиаритмическим действием.
По данным ACC/AHA Guidelines for the Management of Patients With STEMI - Executive Summary, эффективность терапии ингибиторами АПФ высока в группах пациентов с высоким риском, т. е. у больных с повторным инфарктом миокарда, признаками сердечной недостаточности, левожелудочковой дисфункцией и тахикардией.
Целесообразность применения ингибиторов АПФ у больных, перенесших инфаркт миокарда, показана в целом ряде рандомизированных многоцентровых клинических исследований (см. таблицу 1).
Таблица 1. Применение ингибиторов АПФ у больных инфарктом миокарда: результаты рандомизированных исследований
Первым проектом, в котором убедительно показано благотворное влияние ранней терапии ИАПФ на исходы у пациентов с ОИМ, явилось исследование SMILE.
Исследование SMILE было разработано для тестирования гипотезы о применении зофеноприла в течение 24 часов от момента появления симптомов, способного улучшить клинический исход 1556 пациентов группы высокого риска с острым инфарктом миокарда передней стенки, не получающих тромболитической терапии.
В исследование SMILE через 6 недель сумма случаев смерти и тяжелой сердечной недостаточности была достоверно ниже у получавших зофеноприл (7,1% против 10,6% в группе плацебо, что соответствует достоверному снижению риска на 34%, р=0,018). При этом риск возникновения тяжелой сердечной недостаточности уменьшился почти наполовину (на 46%, р=0,018). К концу 1 года наблюдения смертность в группе зофеноприла составила 10,0%, в группе плацебо 14,1%, что соответствует достоверному снижению риска на 29% (р=0,011).
Очень важно при назначении ингибитора АПФ в первые часы инфаркта миокарда контролировать уровень АД, чтобы избежать развития эффекта первой дозы. В связи с этим большой практический интерес представляют результаты исследования SMILE-2.
В 6-недельном двойном слепом плацебо-контролируемом исследовании SMILE-2, включавшем 1024 больных, эти иАПФ назначали в интервале от 90 минут до 12 часов после окончания тромболитической терапии при отсутствии тяжелой артериальной гипотензии (систолическое АД>100 мм рт. ст.). Режим титрования доз был более медленным, чем в проведенных ранее исследованиях (зофеноприл 7,5 мг 2 раза/сут. первые двое суток, затем 15 мг 2 раза/сут. на 3-и и 4-е сутки, далее 30 мг 2 раза/сут.; лизиноприл 2,5 мг 1 раз/сут. первые двое суток, затем 5 мг 1 раз/сут. на 3-и и 4-е сутки, далее 10 мг 1 раз/сут.). При этом через 12 часов после приема первой дозы препаратов систолическое и диастолическое АД оказалось достоверно ниже в группе лизиноприла. Частота возникновения тяжелой артериальной гипотензии, связанной с применением иАПФ (отмечалась в среднем на 6-е сутки после начала лечения), была ниже у получавших зофеноприл (6,7% против 9,8%в группе лизиноприла, р=0,048). Данная закономерность была отмечена при учете событий в первые 48 часов и после 5-ти суток от начала лечения (3,2% в группе зофеноприла против 5,8% в группе лизиноприла, р=0,031; 4,4% в группе зофеноприла против 7,7% в группе лизиноприла, р=0,017).
Результаты применения зофеноприла у больных с ОИМ открывают новые перспективы раннего назначения ингибиторов АПФ при данной патологии. зофеноприл следует считать препаратом первого выбора при назначении иАПФ в первые часы развития ОИМ.
Подводя итог, можно говорить о том, что:
Терещенко Сергей Николаевич, проф., д. м. н., заведующий кафедрой скорой помощи.
Выдержки из рекомендаций
"Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ"
Глава 8.9. Ингибиторы ренин-ангиотензин-альдостероновой системы
Ингибиторы иАПФ широко применяются как в остром периоде ИМпST, так и после выписки из стационара. Кроме профилактики ремоделирования ЛЖ, они обладают широким спектром действия и существенно уменьшают летальность. иАПФ особенно эффективны у наиболее тяжелых больных с обширным некрозом миокарда, сниженной функциональной способностью ЛЖ (фракция выброса - ФВ - менее 40%), симптомами сердечной недостаточности, сахарным диабетом. Вместе с тем они улучшают прогноз и у больных без клинически значимого уменьшения ФВ. Положительное влияние на смертность отмечается с самого начала ИМ и увеличивается при продолжении использования иАПФ.
иАПФ следует применять с первых суток заболевания. Учитывая, что у многих больных ИМпST в первые часы гемодинамика относительно нестабильна, рекомендуется начинать лечение с минимальных доз. иАПФ оказывают положительный эффект на фоне любой сопутствующей терапии, в том числе АСК. Общий принцип лечения - постепенно увеличивать (титровать) дозу до рекомендуемой (целевой), которая, по данным клинических исследований, обеспечивает положительное влияние на прогноз, а если это невозможно, до максимально переносимой. Наиболее частое осложнение при использовании иАПФ - артериальная гипотензия. В случаях выраженного снижения АД на фоне лечения следует исключить наличие гиповолемии, уменьшить дозу сопутствующих препаратов, но если это не помогает или нежелательно - снизить дозу иАПФ. При систолическом АД ниже 100 мм рт. ст. иАПФ следует временно отменить, а после восстановления АД возобновить прием, уменьшив дозу препарата. В процессе лечения иАПФ необходимо контролировать содержание креатинина и калия в крови, особенно у больных со сниженной функцией почек.
Лечение иАПФ, начатое в остром периоде заболевания, следует проводить неопределенно долго. Это обеспечивает улучшение прогноза у больного не только за счет профилактики хронической сердечной недостаточности, но и вследствие снижения вероятности повторного ИМ. Дозы иАПФ приведены в Приложении 10.
Приложение 10. Медикаментозное лечение ИМпST
Таблица 2. иАПФ при ИМпБХ
| Препарат | |
| Лечение с первых суток заболевания | |
| каптоприл | Начальная доза внутрь 6,25 мг, через 2 часа 12,5 мг, через 10-12 часов 25 мг; целевая доза 50 мг 2-3 раза в сутки |
| лизиноприл | Начальная доза внутрь 5 мг, через 24 часа 5 мг; целевая доза 10 мг 1 раз в сутки |
| зофеноприл | Начальная доза внутрь 7,5 мг, через 12 часов 7,5 мг, затем удвоение дозы каждые 12 часов; целевая доза 30 мг 2 раза в сутки |
| Лечение в более отдаленные сроки заболевания | |
| каптоприл** | Целевая доза 50 мг 3 раза в сутки |
| рамиприл**& | Начальная доза внутрь 1,25-2,5 мг; целевая доза 5 мг 2 раза в сутки |
| трандолаприл** | Начальная доза внутрь 0,5 мг; целевая доза 4 мг 1 раз в сутки |
| эналаприл** | Начальная доза внутрь 2,5 мг; целевая доза 10 мг 2 раза в сутки |
| периндоприл& | Целевая доза 8 мг 1 раз в сутки |
Примечания.
Лечение иАПФ следует начать как можно раньше (с первых часов заболевания), как только стабилизируется гемодинамика (в частности, систолическое АД станет не менее 100 мм рт. ст.) и при отсутствии противопоказаний проводить неопределенно долго.
* Особенности подбора дозы у конкретного больного зависят от реакции АД, уровня креатинина и калия в крови; если достичь целевой дозы препарата не удается, следует использовать максимально переносимую дозу.
** Доказательства пользы получены у больных с существенной сократительной дисфункцией ЛЖ (сердечная недостаточность и/или ФВ менее 40%).
& Доказательства пользы получены у больных без выраженного снижения сократительной способности ЛЖ.
Противопоказания для использования иАПФ: систолическое АД ниже 100 мм рт. ст., выраженная почечная недостаточность, гиперкалиемия, двусторонний стеноз почечных артерий, беременность, индивидуальная непереносимость.
Глава 11.5. Ингибиторы АПФ
Прием иАПФ, начатый в остром периоде ИМпST, следует продолжить и после перевода в обычную палату отделения. Если по каким-то причинам больной не получал иАПФ в остром периоде заболевания, при отсутствии противопоказаний они должны быть назначены. Позитивное влияние иАПФ при ИМпST - класс-эффект этой группы препаратов. В рандомизированных контролируемых исследованиях в ранние сроки ИМ более детально изучены каптоприл, лизиноприл и зофеноприл, при достаточно длительном применении - каптоприл, рамиприл, трандолаприл и отчасти эналаприл.
Как и во многих других случаях, эффективность иАПФ относительно выше при осложненном течении заболевания, особенно при снижении сократительной функции ЛЖ (ФВ менее 40%) или клинически выраженных признаках сердечной недостаточности. Однако и при неосложненном течении ИМ их польза очевидна. Не следует медлить с назначением иАПФ, так как существенная доля снижения летальных исходов наблюдается в первую неделю и особенно в первые двое суток заболевания.
Результаты клинических испытаний показывают, что при отсутствии противопоказаний лечение иАПФ целесообразно продолжать неопределенно долго, в том числе и у больных без значительного (ФВ менее 40%) поражения функции ЛЖ. В пользу этого же говорят наблюдения, подтверждающие пользу длительного применения иАПФ при хронической ИБС и особенно при некоторых сопутствующих заболеваниях, в частности сахарном диабете.
Лечение нарушений ритма при остром инфаркте миокарда
Аритмии - самое частое осложнение инфаркта миокарда (ИМ) и самая частая причина смерти на догоспитальном этапе. Половина летальных исходов при ИМ происходит в первые два часа, в большинстве случаев вследствие фибрилляции желудочков. На госпитальном этапе аритмии являются второй по частоте (после острой сердечной недостаточности) причиной летальных исходов больных с ИМ. Нарушения ритма являются отражением обширного поражения миокарда и часто вызывают появление или усиление нарушений гемодинамики и клинических проявлений недостаточности кровообращения. В последние годы произошли заметные изменения многих представлений о лечении аритмий у больных с острым ИМ.
Чаще всего при ИМ отмечается желудочковая экстрасистолия. До недавнего времени желудочковой экстрасистолии при ИМ придавали очень большое значение. Популярной была концепция так называемых "предупреждающих аритмий", согласно которой желудочковые экстрасистолы высоких градаций (частые, полиморфные, групповые и ранние - типа "R на Т") являются предвестниками фибрилляции желудочков, а лечение желудочковых экстрасистол должно способствовать снижению частоты возникновения фибрилляции. Концепция "предупреждающих аритмий" не подтвердилась. В настоящее время установлено, что экстрасистолы, возникающие в первые 1-1,5 суток ИМ, сами по себе безопасны (их даже называют "косметическими аритмиями") и не являются предвестниками фибрилляции желудочков. А самое главное - лечение экстрасистолии не влияет на частоту возникновения фибрилляции желудочков. В рекомендациях Американской Кардиологической Ассоциации по лечению острого ИМ (1996 г.) специально подчеркивается, что регистрация желудочковых экстрасистол и даже неустойчивой желудочковой тахикардии (включая полиморфную желудочковую тахикардию продолжительностью до 5 комплексов) не является показанием для назначения антиаритмических препаратов (!). Отрицательное прогностическое значение имеет выявление частых желудочковых экстрасистол через 1-1,5 суток от начала ИМ, т.к. в этих случаях желудочковые экстрасистолы являются "вторичными" и, как правило, возникают вследствие выраженной дисфункции левого желудочка ("маркеры дисфункции левого желудочка").
Эпизоды неустойчивой желудочковой тахикардии, продолжительностью менее 30 сек., не сопровождающиеся нарушениями гемодинамики, многие авторы так же, как и желудочковую экстрасистолию, относят к "косметическим аритмиям" (их называют "энтузиастическими" выскальзывающими ритмами). Антиаритмические препараты назначают только при очень частых, обычно групповых экстрасистолах (вплоть до так называемых "пробежек" неустойчивой желудочковой тахикардии), если они вызывают нарушения гемодинамики с возникновением клинических симптомов или субъективно очень плохо переносятся больными. Клиническая ситуация при ИМ очень динамична, аритмии часто носят преходящий характер, и очень трудно провести оценку эффективности лечебных мероприятий. Тем не менее в настоящее время рекомендуется избегать применения антиаритмических препаратов класса I (за исключением лидокаина), а при наличии показаний для антиаритмической терапии предпочтение отдается бета-блокаторам, амиодарону и соталолу. Следует также подчеркнуть, что показаний для назначения так называемых метаболических препаратов и манипуляций типа лазерного облучения при аритмиях у больных ИМ не существует. Препаратом выбора для лечения желудочковых аритмий при ИМ по-прежнему остается лидокаин. Лидокаин вводят внутривенно - 200 мг в течение 20 мин. (обычно повторными болюсами по 50 мг). При необходимости проводят инфузию со скоростью 1-4 мг/мин. При отсутствии эффекта от лидокаина раньше, как правило, назначали новокаинамид внутривенно 1 г в течение 30-50 мин., скорость введения новокаинамида при длительной инфузии составляет 1-4 мг/мин. Однако в последние годы при отсутствии эффекта от лидокаина чаще применяют бета-блокаторы или амиодарон. Удобнее использовать внутривенное введение короткодействующих бета-блокаторов, например, эсмолола. Однако в нашей стране в настоящее время наиболее доступным препаратом этой группы для внутривенного введения янляется пропранолол (обзидан). Обзидан при ИМ вводят со скоростью 1 мг в течение 5 минут. Доза обзидана при внутривенном введении составляет от 1 до 5 мг. При наличии эффекта переходят на прием бета-блокаторов внутрь. Амиодарон (кордарон) вводят внутривенно медленно в дозе 150-450 мг. Скорость введения амиодарона при длительной инфузии составляет 0,5-1,0 мг/мин. Следует отметить, что профилактическое назначение лидокаина больным с острым инфарктом миокарда не показано. Для предупреждения возникновения фибрилляции желудочков наиболее эффективным является возможно более раннее назначение бета-блокаторов. В настоящее время проводятся исследования целесообразности профилактического применения амиодарона.
ЖЕЛУДОЧКОВАЯ ТАХИКАРДИЯ
Для лечения полиморфной желудочковой тахикардии (включая тахикардию типа "пируэт") препаратом выбора является сульфат магния - внутривенное введение 1-2 г в течение 5 минут и последующая инфузия со скоростью 10-50 мг/мин. При отсутствии эффекта от сульфата магния у больных без удлинения интервала QT оценивают действие бета-блокаторов и амиодарона. При наличии удлинения интервала QT используют электрокардиостимуляцию с частотой около 100 в минуту. Следует отметить, что у больных с острым ИМ даже при удлинении интервала QT в лечении тахикардии типа "пируэт" может быть эффективным применение бета-блокаторов и амиодарона.
ФИБРИЛЛЯЦИЯ ЖЕЛУДОЧКОВ
Примерно 60% всех случаев фибрилляции желудочков происходят в первые 4 часа. "80% - в первые 12 часов ИМ. Частота возникновения фибрилляции желудочков после поступления больного в блок интенсивной терапии составляет 4,5-7%. В основном это так называемая первичная фибрилляция желудочков (не связанная с рецидивированием ИМ, ишемией и недостаточностью кровообращения).
Единственным эффективным методом лечения фибрилляции желудочков является немедленное проведение электрической дефибрилляции. При отсутствии дефибриллятора реанимационные мероприятия при фибрилляции желудочков практически всегда безуспешны, более того, с каждой минутой снижается вероятность успешной электрической дефибрилляции. Эффективность немедленной электрической дефибрилляции при ИМ составляет около 90%. Сначала используют разряд в 200 Дж (5 кВ), при отсутствии эффекта максимально быстро проводят повторные попытки, увеличивая мощность разрядов до 300-400 Дж (6-7 кВ). Если после нескольких попыток дефибрилляции ритм не восстанавливается, на фоне продолжения общих реанимационных мероприятий и повторных попыток дефибрилляции через каждые 5 минут вводят адреналин (внутривенно по 1 мг). При рефрактерной фибрилляции кроме адреналина повторно вводят лидокаин (по 100 мг), а при отсутствии эффекта - бретилий, амиодарон или сульфат магния. После восстановления синусового ритма назначают инфузию эффективного антифибрилляторного препарата (лидокаина, бретилия, амиодарона или сульфата магния). При наличии признаков активации симпатической нервной системы, например, при синусовой тахикардии, не связанной с сердечной недостаточностью, дополнительно применяют бета-блокаторы.
Прогноз у больных, перенесших первичную фибрилляцию желудочков, как правило, вполне благоприятный и по некоторым данным практически не отличается от прогноза у больных с неосложненным ИМ. Фибрилляция желудочков, возникающая в более поздние сроки (после первых суток), в большинстве случаев является вторичной и обычно возникает у больных с выраженным поражением миокарда, рецидивирующими ИМ, ишемией миокарда или признаками сердечной недостаточности. Следует отметить, что вторичная фибрилляция желудочков может наблюдаться и в течение первых суток ИМ. Неблагоприятный прогноз при этом определяется тяжестью поражения миокарда. Частота возникновения вторичной фибрилляции желудочков составляет 2,2-7%, в том числе у 60% в первые 12 часов. У 25% больных вторичная фибрилляция желудочков отмечается на фоне мерцания предсердий. Эффективность дефибрилляции при вторичной фибрилляции составляет от 20 до 50%, повторные эпизоды возникают у 50% больных, летальность больных в стационаре составляет 40-50%.
Проведение тромболитической терапии позволяет резко (в десятки раз) снизить частоту возникновения устойчивой желудочковой тахикардии и вторичной фибрилляции желудочков. Реперфузионные аритмии не представляют проблемы, в основном это частые желудочковые экстрасистолы и ускоренный идиовентрикулярный ритм ("косметические аритмии") - показатель успешного тромболизиса. Редко возникающие более серьезные аритмии, как правило, хорошо поддаются стандартной терапии.
АСИСТОЛИЯ ЖЕЛУДОЧКОВ И ЭЛЕКТРОМЕХАНИЧЕСКАЯ ДИССОЦИАЦИЯ
Эти причины остановки сердца, как правило, являются следствием тяжелого, часто необратимого повреждения миокарда с длительным периодом выраженной ишемии.
Очень важно исключить наличие вторичной электромеханической диссоциации, основными причинами которой являются гиповолемия, гиперкалиемия, тампонада сердца, массивная тромбоэмболия легочной артерии, напряженный пневмоторакс. Всегда показано введение плазмозамещающих растворов, т.к. гиповолемия является одной из самых частых причин электромеханической диссоциации.
НАДЖЕЛУДОЧКОВЫЕ ТАХИАРИТМИИ
Из наджелудочковых тахиаритмий (если не учитывать синусовую тахикардию) в остром периоде ИМ чаще всего наблюдается мерцание предсердий - у 15-20% больных. Все остальные варианты наджелудочковых тахикардий при ИМ встречаются очень редко и обычно прекращаются самостоятельно. При необходимости проводятся стандартные лечебные мероприятия. Ранняя мерцательная аритмия (в первые сутки ИМ), как правило, носит преходящий характер, ее возникновение связывают с ишемией предсердий и эпистенокардическим перикардитом. Возникновение мерцательной аритмии в более поздние сроки в большинстве случаев является следствием растяжения левого предсердия у больных с дисфункцией левого желудочка. При отсутствии заметных нарушений гемодинамики мерцание предсердий не требует проведения лечебных мероприятий. При наличии выраженных нарушений гемодинамики методом выбора является проведение неотложной электрической кардиоверсии.
При более стабильном состоянии возможны 2 варианта ведения больных: 1) урежение ЧСС при тахисистолической форме в среднем до 70 в минуту с помощью внутривенного введения дигоксина, бета-блокаторов, верапамила или дилтиазема; 2) восстановление синусового ритма с помощью внутривенного введения амиодарона или соталола. Преимуществом второго варианта является возможность достижения восстановления синусового ритма и одновременно быстрое урежение ЧСС в случае сохранения мерцания предсердий. У больных с явной сердечной недостаточностью выбор проводится между двумя препаратами: дигоксин (внутривенное введение около 1 мг дробными дозами) или амиодарон (внутривенно 150-450 мг). Всем больным с мерцанием предсердий показано внутривенное введение гепарина.
БРАДИАРИТМИИ
Нарушение функции синусового узла и атриовентрикулярные (АВ) блокады чаще наблюдаются при ИМ нижней локализации, особенно в первые часы. Синусовая брадикардия редко представляет какие-либо проблемы. При сочетании синусовой брадикардии с выраженной гипотонией (синдром "брадикардии-гипотонии") используют внутривенное введение атропина
Атриовентрикулярные блокады также чаще регистрируются у больных с нижним ИМ. Частота возникновения АВ-блокады II-III степени при нижнем ИМ достигает 20%, а если имеется сопутствующий ИМ правого желудочка - АВ-блокада отмечается у 45-75% больных. АВ-блокада при ИМ нижней локализации, как правило, развивается постепенно: сначала удлинение интервала PR, затем АВ-блокада II степени типа I (Мобитц-I, периодика Самойлова-Венкебаха) и только после этого - полная АВ-блокада. Даже полная АВ-блокада при нижнем ИМ почти всегда носит преходящий характер и продолжается от нескольких часов до 3-7 суток (у 60% больных - менее суток).
Однако возникновение АВ-блокады является признаком более выраженного поражения: госпитальная летальность при неосложненном нижнем ИМ составляет 2-10%, а при возникновении АВ-блокады достигает 20% и более. Причиной смерти при этом является не сама АВ-блокада, а сердечная недостаточность, вследствие более обширного поражения миокарда.
При ИМ передней локализации АВ-блокада II-III степени развивается только у больных с очень массивным поражением миокарда. При этом АВ-блокада происходит на уровне системы Гиса-Пуркинье. Прогноз у таких больных очень плохой - смертность достигает 80-90% (как при кардиогенном шоке). Причиной смерти является сердечная недостаточность, вплоть до развития кардиогенного шока, или вторичная фибрилляция желудочков.
В заключение необходимо подчеркнуть, что при аритмиях, сопровождающихся гипотонией, прежде всего необходимо восстановить синусовый ритм или нормальную ЧСС. В этих случаях даже внутривенное введение препаратов типа верапамила (например, при тахисистолической форме мерцания предсердий) или новокаинамида (при желудочковой тахикардии) может улучшить гемодинамику, в частности, повысить АД. Полезно помнить о предложенной рабочей группой Американской Кардиологической Ассоциации "кардиоваскулярной триаде": ЧСС, объем крови и насосная функция сердца. Если у больного с отеком легких, выраженной гипотонией или шоком имеется тахикардия или брадикардия, коррекция ЧСС является первой целью лечебных мероприятий. При отсутствии отека легких, а тем более при наличии признаков гиповолемии, у больных с коллапсом или шоком проводят пробу с жидкостью: болюсное введение 250-500 мл физиологического раствора. При хорошей реакции на введение жидкости продолжают инфузию плазмозамещающих растворов со скоростью, достаточной для поддержания АД на уровне около 90-100 мм. Если реакция на введение жидкости отсутствует или появляются признаки застоя в легких, начинают внутривенную инфузию мощных инотропных и вазопрессорных препаратов: норадреналина, допамина, добутамина, амринона.
Читайте также:
