Врожденные заболевания артерии. Диагностика и лечение врожденных заболеваний артерий
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Врожденные заболевания артерии. Диагностика и лечение врожденных заболеваний артерий
Приведенная концепция образования и развития врожденных нарушений сосудистой системы позволяет объяснить и множественный характер этих поражений. Сосудистые изменения при врожденных аневризмах могут быть ограниченными и диффузными, распространенными по всей конечности, органу и даже половине тела.
Клинические проявления врожденных артериовенозиых фистул периферических сосудов подразделяются на местные, регионарные и общие, к местным симптомам относятся: расширение приводящей артерии и поверхностных вен, сосудистый шум и дрожание, к регионарным — удлинение и гипертрофия конечности, повышение кожной температуры, трофические нарушения кожи, к общим — изменения со стороны сердца. Клиническая картина заболевания зависит не только от локализации сосудистого поражения и калибра пораженных сосудов, но и от величины фистул, их количества (единичные или множественные), распространенности процесса (локализованный или диффузный). В связи с тем, что наличие у одного больного одновременно всех клинических проявлений данного заболевания встречается редко, целесообразно выделить те из них, которые дают основание заподозрить врожденную аневризму: 1) образование варикозного расширения вен в молодом возрасте, особенно у детей, и на необычных местах (например, на верхней конечности), пульсация расширенных вен; 2) однократное или повторные кровотечение артериального характера из «варикозных» язв, располагающихся в типичных местах; 3) расширенные и извитые артерии; 4) значительная разница (на несколько градусов) кожной температуры конечностей; 5) гипертрихоз и гипергидроз одной из конечностей, сочетающиеся с телеангиэктатическим невусом (nevl); 6) усиленный рост одной из конечностей при наличии удлинения ее костей, установленного рентгенологически; 7) значительное увеличение реографического индекса по сравнению со здоровой конечностью; 8) симптом замедления пульса (симптом Добровольской).
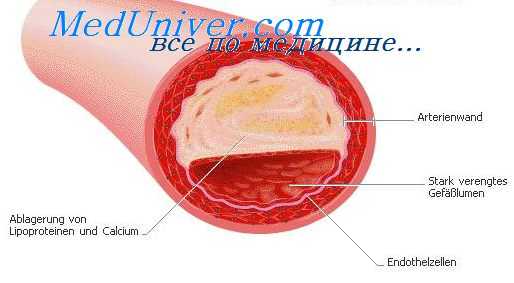
Особенно важно подчеркнуть признаки, безусловно позволяющие диагностировать врожденную аневризму: систолодиастолический шум и симптом дрожания (кошачье мурлыканье), повышение оксигенации венозной крови (разница на симметричных участках конечностей не менее 2%) и данные рентгеноконтрастного исследования сосудов. Прямые признаки: а) контрастирование сосудистой полости, сообщающейся с артерией и венами; б) контрастирование артерновенозной фистулы. Косвенные признаки: а) четкое контрастирование расширенной и извитой приводящей артерии; б) нечеткое контрастирование дистальных отделов артерии; в) заполнение контрастирующим раствором множественных сосудистых полостей/имеющих вид снежных пятен, или не существующей в норме петлистой сети сосудов; г) одновременное контрастирование артерий и вен.
Излечение больных врожденными аневризмами возможно только путем хирургического вмешательства, направленного на устранение патологических артериовенозных коммуникаций. Оперативное лечение является наиболее радикальным и надежным методом, но нередко представляет собой крайне трудную задачу. Оно может быть успешным только при единичных фистулах, причем если операция предпринята до заметного увеличения конечности. Однако и в далеко зашедших случаях, когда после полной ликвидации врожденной аневризмы не происходит обратного развития всех симптомов заболевания (удлинение конечности, гигантизм и пр.), операция предупреждает развитие тяжелых осложнений (некрозы, гангрена, кровотечение, сердечная недостаточность), которые могут привести к летальному исходу.
При хирургическом лечении используют различные оперативные методы. Выбор их зависит главным образом от характера поражения сосудов, локализации и протяженности патологических изменений. В большинстве случаев приходится делать лигатурные операции, устраняющие просвет сосудов. При единичных артериовенозных фистулах, имеющих диаметр сосуда среднего калибра, наиболее эффективной и сравнительно простой операцией является двойная перевязка свища или пересечение его между двумя лигатурами. Лртсрновенозиыс фистулы чаще бывают множественными. Такие фистулы сопровождаются более значительными гемодинамическими нарушениями, а вследствие этого и более тяжелыми изменениями сосудов, участвующих в их образовании. В силу этого, помимо перевязки артериовенозных фистул, нередко приходится дополнительно иссекать на большом протяжении венизированную артерию (ввиду опасности се разрыва), ушивать или иссекать образовавшиеся венозные полости.
При ограниченных аневризмоподобных сосудистых образованиях, локализующихся на парных или более мелких магистральных артериях, а также на их ветвях может быть произведено иссечение пораженных сосудов по типу операции филагриуса. Исключение составляют аневризмы, расположенные в дистальных отделах конечностей, особенно на кисти, где они нередко образуются за счет двух основных магистралей — лучевой и локтевой артерий. Подобная операция в этих случаях может легко привести к нарушению кровоснабжения и гангрене одного и даже нескольких пальцев. При подобных поражениях более целесообразно перевязать приводящую артерию вблизи аневризмы и ушить последнюю.
В тех случаях, когда имеется распространенное сосудистое поражение, которое невозможно полностью ликвидировать из-за неизбежного при этом развития гангрены, либо вторичные изменения конечности (гемигипертрофия, значительное удлинение, тяжелые трофические нарушения) настолько велики, что даже после ликвидации патологического шунта функция конечности фактически останется утраченной н по сути будет только помехой, производят ампутацию. При повторяющихся кровотечениях, развитии тяжелой сердечной недостаточности либо в связи с рецидивом, возникшим после одной или нескольких операций, направленных на устранение сосудистой патологии, ампутация бывает вынужденной.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Врожденные пороки сердца - весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий – глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца – болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой - электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Артериовенозные мальформации головного мозга ( Церебральные АВМ )
Артериовенозные мальформации головного мозга — врожденные аномалии церебральных сосудов, характеризующиеся образованием локального сосудистого конгломерата, в котором отсутствуют капиллярные сосуды, а артерии напрямую переходят в вены. Артериовенозные мальформации головного мозга проявляются упорными головными болями, эпилептическим синдромом, интракраниальным кровотечением при разрыве сосудов мальформации. Диагностика осуществляется при помощи КТ и МРТ сосудов головного мозга. Лечение хирургическое: транскраниальное иссечение, радиохирургическое вмешательство, эндоваскулярная эмболизация или комбинация этих методик.
МКБ-10
Артериовенозные мальформации головного мозга (церебральные АВМ) — измененные участки церебральной сосудистой сети, на которых вместо капилляров имеются многочисленные разветвления извитых артерий и вен, формирующих единый сосудистый конгломерат, или клубок. АВМ относятся к сосудистым аномалиям развития головного мозга. Встречаются у 2 человек из 100 тыс. населения. В большинстве случаев клинически дебютируют в период от 20 до 40 лет, в отдельных случаях — у лиц старше 50 лет. Артерии, формирующие АВМ, имеют истонченные стенки с недоразвитым мышечным слоем. Это обуславливает главную опасность сосудистых мальформаций — возможность их разрыва.
При наличии АВМ головного мозга риск ее разрыва оценивается примерно 2-4% в год. Если кровоизлияние уже имело место, то вероятность его повтора составляет 6-18%. Смертность при внутричерепном кровоизлиянии из АВМ наблюдается в 10% случаев, а стойкая инвалидизация отмечается у половины пациентов. Из-за истончения артериальной стенки на участке АВМ может сформироваться выпячивание сосуда — аневризма. Летальность при разрыве аневризмы сосудов головного мозга намного выше, чем при АВМ, и составляет около 50%. Поскольку АВМ опасны внутричерепным кровоизлиянием в молодом возрасте с последующей летальностью или инвалидизацией, их своевременная диагностика и лечение являются актуальными проблемами современной нейрохирургии и неврологии.
Причины АВМ головного мозга
Артериовенозные мальформации головного мозга возникают в результате внутриутробных локальных нарушений формирования церебральной сосудистой сети. Причинами таких нарушений являются различные вредоносные факторы, влияющие на плод в течение антенатального периода: повышенный радиоактивный фон, внутриутробные инфекции, заболевания беременной (сахарный диабет, хронический гломерулонефрит, бронхиальная астма и др.), интоксикации, вредные привычки беременной (наркомания, курение, алкоголизм), прием во время беременности фармпрепаратов, имеющих тератогенный эффект.
Церебральные артериовенозные мальформации могут располагаться в любом месте головного мозга: как на его поверхности, так и в глубине. В месте локализации АВМ отсутствует капиллярная сеть, циркулирование крови происходит из артерий в вены напрямую, что обуславливает повышенное давление и расширение вен. При этом сброс крови в обход капиллярной сети может повлечь за собой ухудшение кровоснабжения церебральных тканей в месте расположения АВМ, приводя к хронической локальной ишемии мозга.
Классификация АВМ головного мозга
По своему типу мальформации церебральных сосудов классифицируются на артериовенозные, артериальные и венозные. Артериовенозные мальформации состоят из приводящей артерии, дренирующей вены и расположенного между ними конгломерата измененных сосудов. Выделяют фистулезную АВМ, рацинозную АВМ и микромальформацию. Около 75% случаев занимают рацинозные АВМ. Изолированные артериальные или венозные мальформации, при которых наблюдается извитость соответственно только артерии или только вены, встречаются достаточно редко.
По размеру церебральные АВМ подразделяются на малые (диаметром менее 3 см), средние (от 3 до 6 см) и большие (свыше 6 см). По характеру дренирования АВМ классифицируют на имеющие и не имеющие глубокие дренирующие вены, т. е. вены, впадающие в прямой синус или систему большой церебральной вены. Различают также АВМ, локализующиеся в или за пределами функционально значимых областей. К последним относят сенсомоторную кору, мозговой ствол, таламус, глубинные зоны височной доли, сенсорную речевую область (зону Ве́рнике), центр Брока, затылочные доли.
В нейрохирургической практике для определения риска оперативного вмешательства по поводу церебральных сосудистых мальформаций используется градация АВМ в зависимости от совокупности баллов. Каждому из признаков (размер, тип дренирования и локализация по отношению к функциональным зонам) присуждается определенное количество баллов от 0 до 3. В зависимости от набранных балов АВМ классифицируется от имеющей незначительный операционный риск (1 балл) до связанной с высоким операционным риском из-за технической сложности ее ликвидации, большого риска смертельного исхода и инвалидности (5 баллов).
Симптомы АВМ головного мозга
В клинике церебральных АВМ выделяют геморрагический и торпидный варианты течения. По различным сведениям, геморрагический вариант составляет от 50% до 70% случаев АВМ. Он типичен для АВМ небольшого размера, имеющих дренирующие вены, а также для АВМ, располагающихся в задней черепной ямки. Как правило, в таких случаях у пациентов наблюдается артериальная гипертензия. В зависимости от локализации АВМ возможно субарахноидальное кровоизлияние, которое занимает около 52% от всех случаев разрыва АВМ. Остальные 48% приходится на осложненные кровоизлияния: паренхиматозные с формированием внутримозговой гематомы, оболочечные с образованием субдуральной гематомы и смешанные. В ряде случаев осложненные кровоизлияния сопровождаются кровоизлиянием в желудочки головного мозга.
Клиника разрыва АВМ зависит от ее локализации и скорости истечения крови. В большинстве случаев наблюдается резкое ухудшение состояния, нарастающая головная боль, расстройство сознания (от спутанности до комы). Паренхиматозные и смешанные кровоизлияния наряду с этим проявляются очаговой неврологической симптоматикой: нарушениями слуха, зрительными расстройствами, парезами и параличами, выпадением чувствительности, моторной афазией или дизартрией.
Торпидный вариант течения более типичен для церебральных АВМ среднего и большого размера, располагающихся в мозговой коре. Для него характерны кластерные цефалгии — следующие друг за другом пароксизмы головной боли, длящиеся не дольше 3 часов. Цефалгия не носит такого интенсивного характера как при разрыве АВМ, но является регулярной. На фоне цефалгий у ряда пациентов возникают судорожные приступы, которые зачастую имеют генерализованный характер. В других случаях торпидная церебральная АВМ может имитировать симптомы внутримозговой опухоли или другого объемного образования. В таком случае наблюдается появление и постепенное нарастание очагового неврологического дефицита.
В детском возрасте встречается отдельный вид церебральной сосудистой мальформации — АВМ вены Галена. Патология является врожденной и заключается в наличии АВМ в области большой вены мозга. АВМ вены Галена занимают около трети всех случаев сосудистых церебральных мальформаций, встречающихся в педиатрии. Характеризуются высокой летальностью (до 90%). Наиболее эффективным считается хирургическое лечение, проведенное на первом году жизни.
Диагностика АВМ головного мозга
Поводом для обращения к неврологу до разрыва АВМ могут быть упорные головные боли, впервые возникший эпиприступ, появление очаговой симптоматики. Пациенту проводится плановое обследование, включающее ЭЭГ, Эхо-ЭГ и РЭГ. При разрыве АВМ диагностика осуществляется в экстренном порядке. Наиболее информативны в диагностике сосудистых мальформаций томографические методы. Компьютерная томография и магнитно-резонансная томография могут быть использованы как для визуализации тканей мозга, так и для исследования сосудов. В случае разрыва АВМ МРТ головного мозга более информативно, чем КТ. Она дает возможность выявить локализацию и размер кровоизлияния, отдифференцировать его от других объемных интракраниальных образований (хронической гематомы, опухоли, абсцесса головного мозга, церебральной кисты).

При торпидном течении АВМ МРТ и КТ головного мозга могут оставаться в норме. Обнаружить сосудистую мальформацию в таких случаях позволяет лишь церебральная ангиография и ее современные аналоги — КТ сосудов и МР-ангиография. Исследования церебральных сосудов проводятся с использованием контрастных веществ. Диагностика осуществляется нейрохирургом, который также оценивает операционный риск и целесообразность хирургического лечения АВМ. При этом следует учитывать, что при разрыве, в связи с компрессией сосудов в условиях гематомы и отека мозга, томографический размер АВМ может быть существенно меньше реального.
Лечение АВМ головного мозга
Артериовенозные мальформации головного мозга при их разрыве или при опасности такого осложнения подлежат удалению. Предпочтительно плановое оперативное лечение АВМ. В случае разрыва оно проводится после ликвидации острого периода кровоизлияния и рассасывания гематомы. В остром периоде по показаниям возможно хирургическое удаление образовавшейся гематомы. Одновременная ликвидация и гематомы, и АВМ проводится лишь при лобарной локализации сосудистой мальформации и ее небольшом диаметре. При кровоизлиянии в желудочки в первую очередь показано наружное вентрикулярное дренирование.
Классическое хирургическое удаление АВМ осуществляется путем трепанации черепа. Производится коагуляция приводящих сосудов, выделение АВМ, перевязка отходящих от мальформации сосудов и иссечение АВМ. Такое радикальное транскраниальное удаление АВМ осуществимо при ее объеме не более 100 мл и расположении вне функционально значимых зон. При большом размере АВМ зачастую прибегают к комбинированному лечению.
Когда транскраниальное удаление АВМ затруднительно из-за ее расположения в функционально значимых областях мозга и глубинных структурах, проводится радиохирургическое удаление АВМ. Однако этот метод эффективен лишь для мальформаций размером не более 3 см. Если размер АВМ не превышает 1 см, то ее полная облитерация происходит в 90% случаев, а при размерах свыше 3 см — в 30%. К недостатком метода относится длительный период (от 1 до 3 лет), необходимый для полной облитерации АВМ. В ряде случаев требуется поэтапное облучение мальформации в течение ряда лет.
К способам ликвидации церебральных АВМ относится также рентгеноэндоваскулярная эмболизация приводящих к АВМ артерий. Ее проведение возможно, когда имеются доступные для катетеризации приводящие сосуды. Эмболизация проводится поэтапно, и ее объем зависит от сосудистого строения АВМ. Полной эмболизации удается достигнуть только у 30% пациентов. Субтотальная эмболизация получается еще у 30%. В остальных случаях эмболизация удается лишь частично.
Комбинированное этапное лечение АВМ заключается в стадийном использовании нескольких перечисленных выше методов. Например, при неполной эмболизации АВМ следующим этапом проводится транскраниальное иссечение ее оставшейся части. В случаях, когда не удается полное удаление АВМ, дополнительно применяется радиохирургическое лечение. Такой мультимодальный подход к лечению церебральных сосудистых мальформаций показал себя как наиболее эффективный и оправданный в отношении АВМ большого размера.
Тетрада Фалло
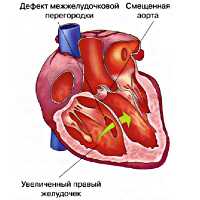
Тетрада Фалло – сочетанная врожденная аномалия сердца, характеризующаяся стенозом выводного тракта правого желудочка, дефектом межжелудочковой перегородки, декстропозицией аорты и гипертрофией миокарда правого желудочка. Клинически тетрада Фалло проявляется ранним цианозом, задержкой развития, одышкой и одышечно-цианотическими приступами, головокружением и обмороками. Инструментальная диагностика тетрады Фалло включает проведение ФКГ, электрокардиографии, УЗИ сердца, рентгенографии грудной клетки, катетеризации полостей сердца, вентрикулографии. Оперативное лечение тетрады Фалло может быть паллиативным (наложение межсистемных анастомозов) и радикальным (полная хирургическая коррекция порока).
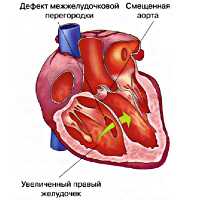
Тетрада Фалло – сложный врожденный порок сердца «синего» типа, морфологическую основу которого составляют четыре признака: обструкция выходного отдела правого желудочка, обширный ДМЖП, гипертрофия правого желудочка и смещение аорты. В кардиологии тетрада Фалло встречается в 7-10 % случаев среди всех врожденных пороков сердца и составляет половину всех пороков цианотического типа. Подробная анатомическая характеристика порока, как самостоятельной нозологической формы, впервые была дана французским врачом-патологоанатомом Е.L.A. Fallot в 1888 г., по имени которого впоследствии он и был назван.
По структуре дефекта к тетраде Фалло наиболее близки триада Фалло (стеноз отверстия легочной артерии, дефект межпредсердной перегородки и гипертрофия правого желудочка) и пентада Фалло (тетрада Фалло и ДМПП). Тетрада Фалло может сочетаться с другими аномалиями сердца и сосудов: праворасположенной дугой аорты, аномалиями венечных артерий, стенозом ветвей легочной артерии, открытым артериальным протоком, полной формой открытого атриовентрикулярного канала, добавочной левосторонней верхней полой веной, частичным аномальным дренажом легочных вен.
Причины тетрады Фалло
Тетрада Фалло формируется вследствие нарушения процесса кардиогенеза на 2–8 нед. эмбрионального развития. К развитию порока могут приводить перенесенные беременной на ранних сроках гестации инфекционные заболевания (корь, скарлатина, краснуха); прием лекарственных средств (снотворных, седативных, гормональных и др.), наркотиков или алкоголя; воздействие вредных производственных факторов. В формировании ВПС прослеживается влияние наследственности.
Тетрада Фалло нередко встречается у детей с синдромом Корнелии де Ланге (амстердамской карликовостью), включающим олигофрению и множественные аномалии развития («лицо клоуна», атрезию хоан, деформацию ушных раковин, готическое небо, косоглазие, миопию, астигматизм, атрофию зрительных нервов, гипертрихоз, деформацию грудины и позвоночника, синдактилию стоп, уменьшение количества пальцев, пороки развития внутренних органов и т. д.).
Пусковым механизмом тетрады Фалло служит неправильная ротация (против часовой стрелки) артериального конуса, вследствие чего происходит смещение клапана аорты правее относительного легочного. При этом аорта располагается над межжелудочковой перегородкой («аорта-всадник»). Неправильное положение аорты обусловливает смещение легочного ствола, который несколько удлиняется и сужается. Ротация артериального конуса препятствует соединению его собственной перегородки с межжелудочковой перегородкой, что обусловливает образование ДМЖП и последующее расширение правого желудочка.
Классификация тетрады Фалло
С учетом характера обструкции выводного тракта правого желудочка анатомические варианты тетрады Фалло представлены четырьмя типами: эмбриологическим, гипертрофическим, тубулярным и многокомпонентным.
I тип тетрады Фалло – эмбриологический. Обструкция обусловлена смещением конусной перегородки кпереди и влево или (и) ее низким расположением. Зона максимального стеноза соответствует уровню разграничительного мышечного кольца. Фиброзное кольцо легочного клапана практически не изменено или умеренно гипоплазировано.
II тип тетрады Фалло – гипертрофический. В основе обструкции лежит смещение конусной перегородки кпереди и влево или (и) ее низкое расположение, а также выраженные гипертрофические изменения ее проксимального сегмента. Зона максимального стеноза соответствует уровню отверстия выходного отдела правого желудочка и разграничительного мышечного кольца.
III тип тетрады Фалло - тубулярный. Обструкция вызвана неравномерным разделением общего артериального ствола, в результате чего легочный конус оказывается резко гипоплазированным, суженным и укороченным. При данном типе тетрады Фалло может иметь место гипоплазия фиброзного кольца или клапанный стеноз легочного ствола.
IV тип тетрады Фалло - многокомпонентный. Причина обструкции - значительное удлинение конусной перегородки или высокое отхождение перегородочно-краевой трабекулы модераторного тяжа.
В связи с особенностями гемодинамики различают три клинико-анатомических формы тетрады Фалло: 1) с атрезией устья легочной артерии; 2) цианотичная форма со стенозом устья различной степени; 3) ацианотичная форма.
Особенности гемодинамики при тетраде Фалло
Степень гемодинамических нарушений при тетраде Фалло определяется выраженностью обструкции выводного отдела правого желудочка и наличием дефекта в межжелудочковой перегородке.
Наличие значительного стеноза легочной артерии и септального дефекта больших размеров обусловливает преимущественное поступление крови из обоих желудочков в аорту и меньшее - в легочную артерию, что сопровождается артериальной гипоксемией. Ввиду большого дефекта перегородки давление в обоих желудочках становится равным. При крайней форме тетрады Фалло, связанной с атрезией устья легочной артерии, в малый круг кровообращения кровь попадает из аорты через открытый артериальный проток или через коллатерали.
При умеренной обструкции общее периферическое сопротивление выше, чем сопротивление стенозированного выводного тракта, поэтому развивается лево-правый сброс крови, приводящий к развитию ацианотичной (бледной) формы тетрады Фалло. Однако по мере прогрессирования стеноза возникает сначала перекрестный, а в дальнейшем - веноартериальный (право-левый) сброс крови, что означает трансформацию порока из «белой» формы в «синюю».
Симптомы тетрады Фалло
В зависимости от времени появления цианоза выделяют пять клинических форм и соответственно столько же периодов манифестации тетрады Фалло: раннюю цианотичную форму (появление цианоза с первых месяцев или первого года жизни), классическую (появление цианоза на втором-третьем году жизни), тяжелую (протекает с одышечно-цианотическими приступами), позднюю цианотичную (появление цианоза к 6–10 годам) и ацианотичную (бледную) форму.
При тяжелой форме тетрады Фалло цианоз губ и кожных покровов появляется с 3-4 месяцев и становится стабильно выраженным к 1 году. Синюшность усиливается при кормлении, плаче, натуживании, эмоциональном напряжении, физической нагрузке. Любая физическая активность (ходьба, бег, подвижная игра) сопровождается нарастанием одышки, появлением слабости, развитием тахикардии, головокружением. Характерное положение пациентов с тетрадой Фалло после нагрузки – сидя на корточках.
Крайне тяжелым проявлением клинической картины тетрады Фалло служат одышечно-цианотические приступы, которые обычно появляются в возрасте 2-5 лет. Приступ развивается внезапно, сопровождается беспокойством ребенка, усилением цианоза и одышки, тахикардией, слабостью, потерей сознания. Возможно развитие апноэ, гипоксической комы, судорог с последующими явлениями гемипареза. Одышечно-цианотические приступы развиваются вследствие резкого спазма инфундибулярного отдела правого желудочка, что приводит к поступлению всего объема венозной крови через дефект в межжелудочковой перегородке в аорту и усилению гипоксии ЦНС.
Дети с терадой Фалло могут отставать в физическом (гипотрофия II-III ст.) и моторном развитии; они часто болеют повторными ОРВИ, хроническим тонзиллитом, гайморитом, рецидивирующими пневмониями. У взрослых пациентов с тетрадой Фалло возможно присоединение туберкулеза легких.
Диагностика тетрады Фалло
При объективном обследовании пациентов с тетрадой Фалло обращает внимание бледность или синюшность кожных покровов, утолщение пальцевых фаланг («барабанные палочки» и «часовые стекла), вынужденная поза, адинамия; реже - деформация грудной клетки (сердечный горб). Перкуторно обнаруживается незначительное расширение границ сердца в обе стороны. Типичными аускультативными признаками тетрады Фалло служат грубый систолический шум во II-III межреберье слева от грудины, ослабление II тона над легочной артерией и др. Полная аускультативная картина порока фиксируется с помощью фонокардиографии.
Рентгенография органов грудной клетки выявляет умеренную кардиомегалию, типичную форму сердца в виде башмачка, обеднение легочного рисунка. ЭКГ-картина характеризуется значительным отклонением ЭОС вправо, гипертрофическими изменениями миокарда правого желудочка, неполной блокадой правой ножки пучка Гиса.
С помощью УЗИ сердца непосредственно определяются все анатомические компоненты тетрады Фалло: степень легочного стеноза, величина смещения аорты, размер ДМЖП и выраженность гипертрофии правого желудочка.
Зондирование полостей сердца позволяет выявить высокое давление в правом желудочке, снижение насыщения артериальной крови кислородом, прохождение катетера из правого желудочка в аорту. При проведении аортографии и легочной артериографии обнаруживается наличие коллатерального кровотока, ОАП, патологии легочной артерии. При необходимости выполняется левая вентрикулография, селективная коронарография, МСКТ и МРТ сердца.
Дифференциальный диагноз тетрады Фалло проводится с транспозицией магистральных сосудов, двойным отхождением аорты и легочной артерии от правого желудочка, одножелудочковым сердцем, двухкамерным сердцем.
Лечение тетрады Фалло
Все пациенты с тетрадой Фалло подлежат хирургическому лечению. Медикаментозная терапия показана при развитии одышечно-цианотических приступов: ингаляции увлажненного кислорода, внутривенное введение реополиглюкина, натрия гидрокарбоната, глюкозы, эуфиллина. В случае неэффективности лекарственной терапии необходимо незамедлительное наложение аортолегочного анастомоза.
Способ оперативной коррекции тетрады Фалло зависит от тяжести течения порока, его анатомо-гемодинамического варианта, возраста пациента. Новорожденным и детям раннего возраста с тяжелой формой тетрады Фалло на первом этапе требуется проведение паллиативных операций, которые позволили бы снизить степень риска осложнений при последующей радикальной коррекции порока.
К паллиативным (шунтирующим) типам операций при тетраде Фалло относятся: наложение подключично-легочного анастомоза Блелока-Тауссиг, внутриперикардиальное анастомозирование восходящей аорты и правой легочной артерии, наложение центрального аорто-легочного анастомоза с помощью синтетического или биологического протеза, наложение анастомоза между нисходящей аортой и левой легочной артерией и др. Для уменьшения гипоксемии применяются операции открытой инфундибулопластики и баллонной вальвулопластики.
Радикальная коррекция тетрады Фалло предусматривает проведение пластики ДМЖП и устранения обструкции выходного отдела правого желудочка. Обычно она проводится в возрасте от полугода до 3-х лет. Специфическими осложнениями операций, выполняемых при тетраде Фалло, могут являться тромбоз анастомоза, острая сердечная недостаточность, легочная гипертензия, аневризма правого желудочка, АВ–блокада, аритмии, инфекционный эндокардит.
Прогноз тетрады Фалло
Естественное течение порока в значительной мере зависит от степени легочного стеноза. Четверть детей с тяжелой формой тетрады Фалло погибает в первый год жизни, из них половина - в период новорожденности. Без операции средняя продолжительность жизни – 12 лет, менее 5% больных доживают до 40-летия. Причиной гибели больных с тетрадой Фалло чаще всего становится тромбоз сосудов головного мозга (ишемический инсульт) или абсцесс мозга.
Отдаленные результаты радикальной коррекции тетрады Фалло хорошие: пациенты трудоспособны и социально активны, удовлетворительно переносят физические нагрузки. Однако чем в более позднем возрасте выполнена радикальная операция, тем хуже ее отдаленные результаты. Все пациенты с тетрадой Фалло нуждаются в наблюдении кардиолога и кардиохирурга, антибиотикопрофилактике эндокардита перед проведением стоматологических или хирургических процедур, потенциально опасных в отношении развития бактериемии.
1. Гипертрофия правого желудочка при тетраде и пентаде Фалло. Гипертрофия при пороках сердца Фалло
2. Увеличение сердца при пентаде Фалло. Вес сердца при пороках Фалло
3. Гемодинамика при тетраде Фалло. Кровоток при пентаде Фалло
4. Триада Фалло. Кровоток и изменение сердца при триаде Фалло
5. Инфундибулярное сужение конуса правого желудочка. Трехкамерное сердце с двумя желудочками
6. Анатомия трикуспидальной атрезии. Виды трикуспидальной атрезии
7. Гипертрофия миокарда, гемодинамика при трикуспидальной атрезии. Атрезия правого желудочка
8. Транспозиция магистральных сосудов. Гипоплазия легочной артерии
9. Атрезия устья легочной артерии. Врожденные пороки сердца с уменьшением кровотока через легкие
10. Пороки сердца с увеличением кровотока через легкие и цианозом. Цианз при транспозиции магистральных сосудов
1. Дефекты перегородок сердца. Открытый боталлов проток и облитерация артериального конуса
2. Инфундибулярное сужение артериального конуса. Сужение артериального конуса правого желудочка
3. Вес сердца при различных пороках. Влияние возраста на вес сердца при пороке
4. Влияние порока на вес сердца. Закономерности изменений сердца при врожденных пороках
5. Морфология дефекта межпредсердной перегородки. Гистология дефекта межпредсердной перегородки
6. Морфология дефекта межжелудочковой перегородки. Строение дефекта межжелудочковой перегородки
7. Коллагеновое кольцо при дефекте межжелудочковой перегородки. Строение суженного артериального конуса
8. Дополнительные выходные тракты правого желудочка. Морфология дополнительных выходных трактов правого желудочка
9. Морфология бородавчатого эндокардита. Эндокардит при врожденных пороках сердца
10. Клапанное сужение артериального конуса. Эластичность артериального конуса сердца
11. Генетические причины пороков сердца. Врожденные заболевания сердца
12. Дефекты межпредсердной и межжелудочковой перегородок. Генетические причины дефектов перегородок сердца
13. Причины нарушения ритма при дефектах перегородок сердца. Двухстворчатый аортальный клапан
1. Систолическая перегрузка желудочков. Классификация сердечной недостаточности
2. Острая сердечная недостаточность при пороке сердца. Классификация СН при пороках сердца
3. Сердечная недостаточность в раннем детском возрасте. Одышка и хрипы в легких при пороках сердца
4. Сердечная недостаточность у грудных детей. Сердечная недостаточность у детей старшего возраста и взрослых
5. Сердечные гликозиды при СН. Дигоксин и дигитализация при сердечной недостаточности
6. Интоксикация сердечными гликозидами. Оперативное лечение порока сердца при сердечной недостаточности
7. Миокардиодистрофия. Дистрофия миокарда при пороках сердца
8. Перикардит при пороках сердца. Диагностика и лечение эксудативного и слипчивого перикардита
9. Нарушение ритма сердца и проводимости при пороках сердца. Внутрижелудочковая блокада при пороке сердца
10. Миграция водителя ритма при пороке сердца. Атрио-вентрикулярный ритм при пороке сердца
2. Формирование общего артериального ствола. Формирование клапанов сердца
3. Фазы развития сердца. Теория филогенетического происхождения пороков сердца
4. Вирусная теория врожденных пороков сердца. Внешние факторы как причина врожденных пороков сердца
5. Эпидемиология врожденных пороков сердца. Частота врожденных пороков сердца
6. Классификация врожденных пороков сердца. Тетрада Фалло
7. Сужение аортального конуса при пороках сердца. Коронарные сосуды при врожденных пороках сердца
8. Сосуды Вьессана — Тебезия при тетраде Фалло. Клапанный стеноз легочной артерии
9. Врожденные дефекты перегородок сердца. Виды дефектов межпредсердной перегородки
10. Трехкамерное сердце. Дефект межжелудочковой перегородки
2. Врожденная атрио-вентрикулярная блокада у детей. Приступ Морганьи—Эдемс—Стокса
3. Синдром Вольф — Паркинсон — Уайта (WPW) у детей. Аневризма легочной артерии и аорты при пороке сердца
4. Болезни легких у детей с пороком сердца. Частота повторных пневмоний при ВПС
5. Причины повторных пневмоний при пороке сердца. Патогенез повторных пневмоний у детей с ВПС
6. Хронические пневмонии у детей с пороком сердца. Легочная гипертензия и повторные пневмонии
7. Клиника повтороных пневмоний у детей. Течение повторных пневмоний при пороке сердца
8. Пример повторных пневмоний у ребенка. Хроническая пневмония при открытом артериальном протоке
9. Сочетание порока сердца и бронхоэктатической болезни. Зависимость частоты пневмоний от гипертензии в малом круге
10. Внешнее дыхание у детей при пороке сердца. Степень легочной гипертензии и хронические пневмонии
2. Операция при сужении артериального конуса. Смертность при инфундибулотомии
3. Сердце при сужении артериального конуса. Морфология закрытой вальвулотомии по Броку
4. Результаты закрытых операций на сердце. Механизм инфудибулэктомии
5. Эффективность вальвулотомии. Опасность инфудибуляной резекции по методу Брока
6. Смертность при операции по поводу тетрады Фалло. Идеальная операция при тетраде Фалло
7. Суженный артериальный конус левого желудочка. Клапанное сужение артериального конуса левого желудочка
8. Операции на артериальном конусе левого желудочка. Некроз стенки аорты после ушивания
9. Преимущества открытой операции на артериальном конусе левого желудочка. Гипертрофия сердца при врожденных пороках
10. Локализация гипертрофии миокарда при пороках сердца. Особенности гипертрофии при врожденных и приобретенных пороках
1. Соединительная ткань сердца при пороках. Коллагенизация сердца при врожденных пороках
2. Миофиброз при врожденных пороках. Компенсаторная гипертрофия миокарда
3. Механизмы фиброза миокарда при пороках. Сосуды сердца при врожденных пороках
4. Сосуды сердца при тетраде Фалло. Коронарные сосуды при сужении артериального конуса
5. Левый тип ветвления венечных артерий. Анастомозы коронарных сосудов при тетраде Фалло
6. Кровоснабжение гипертрофированных отделов сердца. Кровоснабжение сердца при врожденном пороке
7. Анастомозы между ветвями коронарных артерий. Застойное полнокровие при врожденных пороках сердца
8. Замыкающие артерии в сердце. Гистология замыкающих артерий при пороках сердца
9. Суданофилия мышечных волокон сердца. Дегенерация мышц желудочков при пороках сердца
10. Окислительный обмен в сердце. Микромиомаляции при врожденных пороках сердца
1. Инфаркт миокарда у детей. Инфракт при врожденном пороке сердца
2. Пример инфаркта миокарда у ребенка. Инфаркт миокарда при тетраде Фалло
3. Пример инфаркта миокарда при триаде Фалло. Операция на сердце при инфаркте миокарда
4. Дополнительные сосуды сердца при пороке. Инфаркт миокарда после операции на врожденном пороке сердца
5. Причины инфаркта миокарда при врожденном пороке сердца. Кардиосклероз при врожденном пороке сердца
6. Диффузный кардиосклероза при пороках Фалло. Диффузный кардиосклероз при гипертрофии миокарда
7. Вес сердца при диффузном кардиосклерозе. Папиллярные мышцы при диффузном кардиосклерозе
8. Кардиосклероз у детей при пороках сердца. Механизмы склероза сердца у детей
9. Прогноз при диффузном кардиосклерозе у детей. Операция на сердце при кардиосклерозе
10. Сроки операции на сердце при врожденном пороке. Когда делать операцию при врожденном пороке сердца?
1. Клиника инфаркта миокарда при пороке сердца. Течение инфаркта миокарда при пороке сердца
2. Инфаркты миокарда у детей. Пример инфаркта миокарда при пороке сердца
3. Микроинфаркты при пороке сердца. Боли в сердце при микроинфарктах
4. Частота болей в сердце при врожденных пороках. Ревмокардит при врожденных пороках сердца
5. Ревматизм при открытом артериальном протоке. Диагностика и течение ревматизма при врожденном пороке сердца
6. Легочная гипертензия при врожденном пороке сердца. Механизмы развития легочной гипертензии
7. Морфология легочной гипертензии. Частота легочной гипертензии при ВПС
8. Классификация легочной гипертензии. Клиника легочной гипертензии
9. Лечение пороков сердца с легочной гипертензией. Сердечная недостаточность при пороке сердца
10. Причины сердечной недостаточности при пороке сердца. Диастолическая перегрузка при пороке сердца
2. Пример гипотиреоза при пороке сердца. Синдром Шершевского-Тернера при пороке сердца
3. Пример порока сердца при синдроме Шершевского-Тернера. Опухоли наподчечников при врожденном пороке сердца
4. Подагра при пороке сердца. Врожденные пороки сердца с клиникой подагры
5. Болезни органов кроветворения при пороке сердца. Метгемоглобиноз - метгемоглобинемия
6. Анемия при пороке сердца. Гипохромная анемия при цианотических пороках сердца
7. Синюшно-одышечные приступы при тетраде Фалло. Тромбоцитопении при пороке сердца
8. Лейкоз при врожденных пороках сердца. Парадоксальные эмболии и тромбозы сосудов мозга при пороке сердца
9. Кровоизлияния в мозг при коарктации аорты. Абсцессы мозга при врожденных пороках сердца
10. Механизмы развития абсцессов мозга при пороке сердца. Клиника и течение абсцессов мозга
2. Комплекс Эйзенменгера. Трехкамерное сердце с двумя желудочками - отсутствие межпредсердной перегородки
3. Общий артериальный ствол. Гемодинамика при общем артериальном стволе
4. Пороки сердца с увеличенным кровотоком через легкие. Незаращение боталлова протока
5. Изолированный дефект межпредсердной перегородки. Гемодинамика при дефекте межпредсердной перегородки
6. Диффузное расширение общего ствола легочной артерии и незаращение овального окна. Болезнь Лютембахера
7. Дефект межжелудочковой перегородки с дефектом межпредсердной перегородки. Изолированный дефект межжелудочковой перегородки
8. Врожденное сужение артериального конуса левого желудочка. Сочетанные пороки сужения артериального конуса
9. Увеличение сердца при сужении артериального конуса. Гемодинамика при сужении артериального конуса
10. Болезнь Эбштейна. Анатомия и формы болезни Эбштейна
1. Беременность при дефекте межпредсердной перегородки. Гемодинамика у беременных при ДМПП
2. Объем сброса крови при ДМПП. Прогноз беременности при дефекте межпредсердной перегородки
3. Дефект межжелудочковой перегородки. Морфология и гемодинамика при дефекте межжелудочковой перегородки
4. Стабилизация при дефекте межжелудочковой перегородки. Клиника и диагностика ДМЖП
5. Оценка гемодинамики при дефекте межжелудочковой перегородки. Оценка сброса крови при ДМЖП
6. Беременность при дефекте межжелудочковой перегородки. Течение беременности при ДМЖП
7. Атриовентрикулярный септальный дефект. Морфология и гемодинамика при атриовентрикулярном дефекте
8. УЗИ сердца при атриовентрикулярном дефекте. Стеноз выходного тракта правого желудочка и легочной артерии
9. Допплерография стеноза выходного тракта правого желудочка. Беременность при стенозе легочной артерии
10. Тетрада Фалло. Клиника и диагностика тетрады Фалло
2. Цели диагностики при аномалии расположения сердца. Тип формирования сердца
3. Определение локализации желудочков сердца. Обследование при аномалиях сердца
4. Рентгенологическое исследование расположения сердца. Катетеризация сердца при аномалиях сердца
5. Ангиокардиография при аномалиях сердца. Анатомическое расположение сердца
6. Терминология расположения сердца. Термины транспозиции сосудов
7. Правосформированное праворасположенное сердце. Частота правосформированного праворасположенного сердца
8. Анатомия правосформированного праворасположенного сердца. Клиника правосформированного праворасположенного сердца
9. ЭКГ при правосформированном праворасположенном сердце. Электрокардиографические признаки правосформированного праворасположенного сердца
10. Рентгенолография при правосформированном праворасположенном сердце. Рентгенологические признаки правосформированного праворасположенного сердца
2. Клиника и признаки транспозиции магистральных сосудов.
3. Лечение транспозиции магистральных сосудов. Операции при транспозици магистральных сосудов.
4. Критический стеноз легочной артерии. Патогенез критического стеноза легочной артерии.
5. Атрезия легочной артерии. Патогенез и кровообращение при атрезии легочной артерии.
6. Естественное течение атрезии легочной артерии. Признаки и клиника атрезии легочной артерии.
7. Атрезия легочной артерии с интактной межжелудочковой перегородкой.
8. Клиника и диагностика атрезии легочной артерии с интактной межжелудочковой перегородкой.
9. Тетрада Фалло. Виды и классификация тетрады фалло.
10. Течение тетрады фалло. Клиника и признаки тетрады фалло.
2. Единственный желудочек и атрезия трикуспидального клапана у ребенка.
3. Гемодинамика при единственном желудочке у ребенка.
4. Диагностика единственного желудочка у ребенка. Лечение при единственном желудочке.
5. Аномалия Эбштейна. Анатомия аномалии эбштейна у ребенка.
6. Развитие аномалии эбштейна у ребенка. Диагностика аномалии Эбштейна.
7. Лечение аномалии эбштейна у ребенка. Операция при аномалии Эбштейна.
8. Сосудистое кольцо и слинг легочной артерии у ребенка.
9. Диагностика и лечение сосудистого кольца у ребенка.
10. Сердечная недостаточность у новорожденных. Причины и классификация сердечной недостаточности.
Читайте также:
- Диагностика фебрильной трансфузионной реакции. Фильтрация лейкоцитов
- Масса миокарда левого желудочка. Объем левого желудочка
- Рефлекторно-токсические осложнения ангиографии. Токсическое действие контраста
- МРТ тазобедренного сустава в продольной проекции в норме
- Лучевая диагностика аплазии и гипоплазии поднижнечелюстной железы
