Жировые клетки, коллагеновые волокна при лучевой болезни. Лучевое поражение скелетных мышц
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Репаративная регенерация крови отличается от физиологической прежде всего своей большей интенсивностью. При этом активный красный костный мозг появляется в длинных трубчатых костях на месте жирового костного мозга (миелоидное превращение жирового костного мозга). Жировые клетки вытесняются растущими островками кроветворной ткани, которая заполняет костномозговой канал и выглядит сочной, темно-красной. Кроме того, кроветворение начинает происходить вне костного мозга - внекостномозговое, или экстрамедуллярное, кроветворение. Очаги экстрамедуллярного (гетеротопического) кроветворения в результате выселения из костного мозга стволовых клеток появляются во многих органах и тканях - селезенке, печени, лимфатических узлах, слизистых оболочках, жировой клетчатке и т. д.
Регенерация крови может быть резко угнетена (например, при лучевой болезни, апластической анемии, алейкии, агранулоцитозе) или извращена (например, при злокачественной анемии, полицитемии, лейкозе). В кровь при этом поступают незрелые, функционально неполноценные и быстро разрушающиеся форменные элементы. В таких случаях говорят о патологической регенерации крови.
Репаративные возможности органов кроветворной и иммунокомпетентной системы неоднозначны. Костный мозг обладает очень высокими пластическими свойствами и может восстанавливаться даже при значительных повреждениях. Лимфатическиеузлы хорошо регенерируют только в тех случаях, когда сохраняются связи приносящих и выносящих лимфатических сосудов с окружающей их соединительной тканью. Регенерация ткани селезенки при повреждении бывает, как правило, неполной, погибшая ткань замещается рубцом.
Регенерация кровеносных и лимфатических сосудов протекает неоднозначно в зависимости от их калибра.
Микрососуды обладают большей способностью регенерировать, чем крупные сосуды. Новообразование микрососудов может происходить путем почкования или аутогенно. При регенерации сосудов путем почкования в их стенке появляются боковые выпячивания за счет усиленно делящихся эндотелиальных клеток (ангиобласты). Образуются тяжи из эндотелия, в которых возникают просветы и в них поступает кровь или лимфа из «материнского» сосуда. Другие элементы сосудистой стенки образуются за счет дифференцировки эндотелия и окружающих сосуд соединительнотканных клеток, В сосудистую стенку врастают нервные волокна из пред существующих нервов. Аутогенное новообразование сосудов состоит в том, что в соединительной ткани появляются очаги недифференцированных клеток. В этих очагах возникают щели, в которые открываются предсуществующие капилляры и изливается кровь. Молодые клетки соединительной ткани, дифференцируясь, образуют эндотелиальную выстилку и другие элементы стенки сосуда.
Крупные сосуды не обладают достаточными пластическими свойствами. Поэтому при повреждении их стенки восстанавливаются лишь структуры внутренней оболочки, ее эндотелиальная выстилка; элементы средней и наружной оболочек обычно замещаются соединительной тканью, что ведет нередко к сужению или облитерации просвета сосуда.
Регенерация соединительной ткани начинается с пролиферации молодых мезенхимальных элементов и новообразования микрососудов. Образуется молодая, богатая клетками и тонкостенными сосудами соединительная ткань, которая имеет характерный вид. Это - сочная темно-красная ткань с зернистой, как бы усыпанной крупными гранулами поверхностью, что явилось основанием назвать ее грануляционной тканью. Гранулы представляют собой выступающие над поверхностью петли новообразованных тонкостенных сосудов, которые составляют основу грануляционной ткани. Между сосудами много недифференцированных лимфоцитоподобных клеток соединительной ткани, лейкоцитов, плазматических клеток и лаброцнтов. В дальнейшем происходит созревание грануляционной ткани, в основе которой лежит дифференци-ровка клеточных элементов, волокнистых структур, а также сосудов. Число гематогенных элементов уменьшается, а фибробластов - увеличивается. В связи с синтезом фибробластами коллагена в межклеточных пространствах образуются аргирофильные, а затем и коллагеновые волокна. Синтез фибробластами гликозаминогликанов служит образованию основного вещества соединительной ткани. По мере созревания фибробластов количество коллагеновых волокон увеличивается, они группируются в пучки; одновременно уменьшается количество сосудов, они дифференцируются в артерии и вены. Созревание грануляционной ткани завершается образованием грубо-волокнистой рубцовой ткани.
Новообразование соединительной ткани происходит не только при ее повреждении, но и при неполной регенерации других тканей, а также при организации (инкапсуляции), заживлении ран, продуктивном воспалении.
Созревание грануляционной ткани может иметь те или иные отклонения. Воспаление, развивающееся в грануляционной ткани, приводит к задержке ее созревания, а чрезмерная синтетическая активность фибробластов - к избыточному образованию коллагеновых волокон с последующим резко выраженным их гиалинозом. В таких случаях возникает рубцовая ткань в виде опухолевидного образования синюшно-красного цвета, которая возвышается над поверхностью кожи в виде келоида. Келоидные рубцы образуются после различных травматических поражений кожи, особенно после ожогов.
Регенерация жировой ткани происходит за счет новообразования соединительнотканных клеток, которые превращаются в жировые (адипозоциты) путем накопления в цитоплазме липидов. Жировые клетки складываются в дольки, между которыми располагаются соединительнотканные прослойки с сосудами и нервами. Регенерация жировой ткани может происходить также из ядросодержащих остатков цитоплазмы жировых клеток.
Регенерация костной ткани при переломе костей в значительной мере зависит от степени разрушения кости, правильной репозиции костных отломков, местных условий (состояние кровообращения, воспаление и т. д.). При неосложненном костном переломе, когда костные отломки неподвижны, может происходить первичное костное сращение. Оно начинается с врастания в область дефекта и гематомы между отломками кости молодых мезенхимальных элементов и сосудов. Возникает так называемая предварительная соединительнотканная мозоль, в которой сразу же начинается образование кости. Оно связано с активацией и пролиферацией остеобластов в зоне повреждения, но прежде всего в периостате и эндостате. В остеогенной фиброретикулярной ткани появляются малообызвествленные костные балочки, число которых нарастает. Образуется предварительная костная мозоль. В дальнейшем она созревает и превращается в зрелую пластинчатую кость - так образуется окончательная костная мозоль, которая по своему строению отличается от костной ткани лишь беспорядочным расположением костных перекладин. После того как кость начинает выполнять свою функцию и появляется статическая нагрузка, вновь образованная ткань с помощью остеокластов и остеобластов подвергается перестройке, появляется костный мозг, восстанавливаются васкуляризация и иннервация. При нарушении местных условий регенерации кости (расстройство кровообращения), подвижности отломков, обширных диафизарных переломах происходит вторичное костное сращение. Для этого вида костного сращения характерно образование между костными отломками сначала хрящевой ткани, на основе которой строится костная ткань. Поэтому при вторичном костном сращении говорят о предварительной костно-хрящевой мозоли, которая со временем превращается в зрелую кость. Вторичное костное сращение по сравнению с первичным встречается значительно чаще и занимает больше времени.
При неблагоприятных условиях регенерация костной ткани может быть нарушена. Так, при инфицировании раны регенерация кости задерживается. Костные осколки, которые при нормальном течении регенераторного процесса выполняют функцию каркаса для новообразованной костной ткани, в условиях нагноения раны поддерживают воспаление, что тормозит регенерацию. Иногда первичная костно-хрящевая мозоль не дифференцируется в костную. В этих случаях концы сломанной кости остаются подвижными, образуется ложный сустав. Избыточная продукция костной ткани в ходе регенерации приводит к появлению костных выростов - экзостозов.
Регенерация хрящевой ткани в отличие от костной происходит обычно неполно. Лишь небольшие дефекты ее могут замещаться новообразованной тканью за счет камбиальных элементов надхрящницы - хондробластов. Эти клетки создают основное вещество хряща, затем превращаются в зрелые хрящевые клетки. Крупные дефекты хряща замещаются рубцовой тканью.
Регенерация мышечной ткани , ее возможности и формы различны в зависимости от вида этой ткани. Гладкие мышцы, клетки которых обладают способностью к митозу и амитозу, при незначительных дефектах могут регенерировать достаточно полно. Значительные участки повреждения гладких мышц замещаются рубцом, при этом сохранившиеся мышечные волокна подвергаются гипертрофии. Новообразование гладких мышечных волокон может происходить путем превращения (метаплазии) элементов соединительной ткани. Так образуются пучки гладких мышечных волокон в плевральных спайках, в подвергающихся организации тромбах, в сосудах при их дифференцировке.
Поперечнополосатые мышцы регенерируют лишь при сохранении сарколеммы. Внутри трубок из сарколеммы осуществляется регенерация ее органелл, в результате чего появляются клетки, называемые миобластами. Они вытягиваются, число ядер в них увеличивается, в саркоплазме дифференцируются миофибриллы, и трубки сарколеммы превращаются в поперечнополосатые мышечные волокна. Регенерация скелетных мышц может быть связана и с клетками-сателлитами, которые располагаются под сарколеммой, т. е. внутри мышечного волокна, и являются камбиальными. В случае травмы клетки-сателлиты начинают усиленно делиться, затем подвергаются дифференцировке и обеспечивают восстановление мышечных волокон. Если при повреждении мышцы целость волокон нарушается, то на концах их разрывов возникают колбо-образные выбухания, которые содержат большое число ядер и называются мышечными почками. При этом восстановления непрерывности волокон не происходит. Место разрыва заполняется грануляционной тканью, превращающейся в рубец (мышечная мозоль). Регенерация мышцы сердца при ее повреждении, как и при повреждении поперечнополосатой мускулатуры, закан чивается рубцеванием дефекта. Однако в сохранившихся мышечных волокнах происходит интенсивная гиперплазия уль траструктур, что ведет к гипертрофии волокон и восстановлению функции органа
Регенерация эпителия осуществляется в большинстве случаев достаточно полно, так как он обладает высокой регенераторной способностью. Особенно хорошо регенерирует покровный э п и- телий. Восстановление многослойного плоского ороговевающего эпителия возможно даже при довольнокрупных дефектах кожи. При регенерации эпидермиса в краях дефекта происходит усиленное размножение клеток зародышевого (камбиального), росткового (мальпигиева) слоя. Образующиеся эпителиальные клетки сначала покрывают дефект одним слоем. В дальнейшем пласт эпителия становится многослойным, клетки его дифференцируются, и он приобретает все признаки эпидермиса, включающего в себя ростковый, зернистый блестящий (на подошвах и ладонной поверхности кистей) и роговой слои. При нарушении регенерации эпителия кожи образуются незаживающие язвы, нередко с разрастанием в их краях атипичного эпителия, что может послужить основой для развития рака кожи.
Жировые клетки, коллагеновые волокна при лучевой болезни. Лучевое поражение скелетных мышц
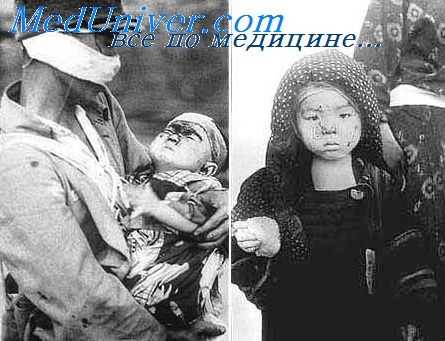
Скелетные мышцы при лучевой болезни. Изменения мышечной ткани после радиационного поражения
У людей, погибших от острой лучевой болезни в результате взрывов атомных бомб (1945) или во время производственных аварий, тоже были отмечены грубые структурные изменения скелетных мышц, особенно на участках тела, подвергшихся облучению в массивных дозах. Обнаруженные изменения скелетных мышц были сходны с наблюдаемыми у животных после локального или общего облучения организма.
Вместе с тем, судя по литературным данным, при действии ионизирующих излучений высоких энергий, особенно быстрых нейтронов, поражение мышечной ткани может быть, наиболее тяжелым и значимым для течения и исхода острой лучевой болезни в целом. Как известно, 97% массы скелетных мышц составляют водород, азот, углерод и кислород, т. е. именно те химические вещества, за счет которых в основном осуществляется эффект вторичной ионизации при воздействии нейтронов. Учитывая, что скелетные мышцы составляют 40—47% всего тела человека, нетрудно представить значения возникающих в них структурных нарушений для развития токсемии, которой придается большое значение в патогенезе «токсемической» формы острой лучевой болезни [Гуськова А. К-, Байсоголов Г. Д., 1971].
При патологоанатомическом исследовании в случае гибели организма в разгар острой лучевой болезни, вызванной облучением быстрыми нейтронами или гамма-лучами высоких энергий, обращает на себя внимание полнокровие и отек скелетных мышц, а также кровоизлияние, особенно в местах инъекций или механической травмы. При микроскопическом исследовании на первый план тоже выступают полнокровие капилляров и кровеносных сосудов, отек и высокое содержание кислых мукополисахаридов в основном веществе межуточной ткани и стенок кровеносных сосудов.

На этом фоне в мышечных волокнах обнаруживаются волны сокращения, признаки дискоидного и фибриллярного распада, миолиза. В большинстве мышечных волокон отсутствует поперечная исчерченность, выявляется фуксинофнлия и неспецифическая пиронинофилия, свидетельствующая о белковой дегенерации миолазмы, низкая активность цитохромоксидазы и сукцинатдегидрогеназы, небольшое содержание ДНК, РНК и гликогена, повышенная активность щелочной фосфатазы, увеличение свободных липидов и значительное уменьшение фосфолипидов. Определяются и более грубые изменения в виде вакуолизации, глыбчатого распада, наличия крупных капель жира в миоплазме, растворения и распада ядер. Встречается большое количество волокон с неразделившимися ядрами, а также с цепочками гиперхромных мелких ядер, преимущественно в пиронинофильных волокнах.
Общее однократное воздействие излучений высоких энергий вызывает значительные морфологические нарушения иннервациоиного аппарата скелетной мускулатуры в виде явлений раздражения, дистрофических изменений и распада [Зайратьянц В. Б., 1957], Наиболее грубые нарушения выявляются в претерминальных отделах мякотных нервных волокон и в концевых нервных приборах чувствительных и двигательных окончаний [Сутулов Ю, Л., Загребин А. М., 1977].
В поздние сроки, через 30—40 дней и более после облучения, наряду с дистрофическими изменениями мышечных волокон различаются признаки склероза межуточной ткани в виде накопления нейтральных мукополисахаридов в основном веществе, огрубения и увеличения коллагеновых волокон, гиалиноза стенок кровеносных сосудов без выраженной фибробластической реакции.
Таким образом, имеется достаточно оснований считать, что в скелетных мышцах возникают значительные морфологические изменения при воздействии на организм ионизирующего излучения высокой энергии. Это хорошо подтверждается наблюдениями И. В. Торопцева и соавт. (1972), которые обнаружили описанные выше структурные изменения в скелетных мышцах уже в первые часы после облучения в дозе 25 000—30 000 рад на бетатроне в 25 мэВ.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
При острой лучевой болезни, заканчивающейся смертью через 1—2 нед после облучения, заметных изменений в жировых клетках не наблюдается. В случае затянувшегося течения лучевой болезни уменьшается содержание в них липидов. Одновременно с изменением клеточных элементов рыхлой соединительной ткани при лучевой болезни происходит нарушение волокнистых элементов и основного межуточного вещества.
Коллагеновые волокна после облучения несколько уплотняются и дают интенсивную метахромазию при окраске то-лундиновым синим или пикрофуксином. В разгар лучевой болезни, особенно у погибших животных, интенсивность мета-хромазии несколько снижается, коллагеновые волокна слабее окрашиваются фуксином [Шиходыров В. В., 1957].
Аргирофильные волокна тоже претерпевают довольно ранние и глубокие изменения. В первые сутки после облучения общее количество аргирофильных волокон уменьшается. Вместо четкой, хорошо различимой сети тонких волоконец обнаруживаются поля, состоящие из аргирофильной зернистости, а более толстые аргирофильные волокна подвергаются фрагментации и распаду.
Такие же изменения аргирофильного каркаса наблюдаются при лучевой болезни в соединительной ткани внутренних органов. Эластические волокна морфологически изменяются сравнительно мало.
С первых же дней после облучения возникает своеобразный мукоидный отек соединительной ткани за счет накопления и деполимеризации мукополнсахаридов [Upton A., Gude W., 1954].

У животных, переживших острую лучевую болезнь, в пепериод выздоровления клеточно-волокнистый состав рыхлой соединительной ткани восстанавливается. Регенерация клеточных элементов начинается с увеличения числа камбиальных клеток и дифференцировки их в фибробласты и макрофаги. Увеличивается количество лаброцитов. Расплавленные массы коллагена рассасываются. Одновременно наблюдается уменьшение массы межуточного вещества, новообразование аргнрофильных волокон, нормализация коллагеновых волокон. Однако уже с конца 1-х и начала 2-х суток происходит интенсивное набухание и гомогенизация коллагеновых волокон, которые превращаются в массы аморфного коллагена [Шиходыров В. В., 1960].
Даже через 1—2 года после облучения в рыхлой соединительной ткани клеточный состав полностью не восстанавливается. Общее количество клеток остается уменьшенным главным образом за счет фибробластических элементов и вместе с тем отмечается значительное образование коллагеновых волокон.
В литературе давно уже существует мнение о радиорезистентности скелетных мышц. Однако большая часть соответствующих морфологических данных получена при местном облучении рентгеновскими лучами. Отмечено, что выраженные структурные изменения в облученных мышцах возникают только после воздействия в дозах более 2000 Р. По мнению некоторых исследователей [Клишов А. А., 1965; Тужилкова Т. Н., 1969], вначале это проявляется в виде воспалительной клеточной инфильтрации эндомизия, активации амитотического деления мышечных, ядер и уменьшения в них хроматина, а впоследствии в дискоидном распаде, атрофии отдельных мышечных волокон и тоже воспалительной реакции.
Через несколько месяцев обнаруживаются атрофическне изменения и гибель мышечных, волокон, огранизацня клеточного детрита и склеротическое разрастание межуточной ткани. Однако следует заметить, что ранняя инфильтрация эндомизия полиморфно-ядерными лейкоцитами скорее всего не воспалительного происхождения, а связана с перераспределительным лейкоцитозом, который, как известно, возникает в ранние сроки после облучения в больших дозах. Воспалительная реакция в поздние сроки после облучения может возникать как вторичная реакция на гибель мышечных волокон. Что касается изменения скелетных мышц после общего внешнего облучения, то такие экспериментальные наблюдения немногочислены и далеко неоднозначны.
Например, В. Б. Заратьяиц (1957) отмечала у различных животных после общего облучения рентгеновскими лучами в дозах от 600 до 2000 Р отек межуточной ткани и исчезновение поперечной исчерченности мышечных волокон с последующим нарастанием дистрофически-атрофических изменений. Вместе с тем J. Allen и соавт. (1963) не обнаружили выраженных структурных изменений в мышцах, обезьян, облученных в дозе 800 Р. По данным Н. В. Козловой (1961), у мышей после облучения гамма-лучами в дозе 1500 Р определялись лишь реактивные изменения в виде полнокровия капилляров эндомизия, перегруппировки ядер в мышечных волокнах.
Рыхлая соединительная ткань при лучевой болезни. Дистрофия соединительной ткани под воздействием радиации
Как указывалось выше, тяжесть структурных изменений и заживлений некротическиязвенных дефектов облученной кожи во многом зависят от сохранности пластических свойств подкожной клетчатки и прежде всего рыхлой соединительной ткани. Изменения, возникающие в последней при типичной форме острой лучевой болезни, вызванной рентгеновским облучением в минимальной смертельной дозе, носят фазный характер. Вначале происходит выраженная активация жизнедеятельности рыхлой соединительной ткани.
Камбиальные клетки усиленно делятся и подвергаются интенсивной дифференцировке на фибробласты и макрофаги. В результате этого в 1,5—2 раза увеличивается количество молодых фибробластов и особенно макрофагов. Изменяется и структура клеток. В экзоплазме зрелых фнбробластов появляется большое количество вакуолей. Цитоплазма макрофагов вспенивается, в них появляются вакуоли и псевдоподии. В лаброцитах изменяется четкая структура цитоплазмы: гранулы секрета склеиваются между собой в конгломераты или вследствие разрыва оболочки клеток выходят в окружающую среду.
При флюоресцентном исследовании рыхлой соединительной ткани [Поздняков А. Л., 1975] можно видеть, что уже через 1 ч после облучения изменяется свечение гранул лаброцитов: в норме оранжевые, они становятся кирпично-красными при нарушений мукопротеидного обмена клетки. Вместе с тем волокнистые элементы рыхлой соединительной ткани изменяются незначительно.
Продолжительность описанных изменений зависит от дозы и характера радиационного воздействия. Так, например, при облучении собак в дозах 400—600 Р эта фаза заболевания продолжается до 12 ч, а при облучении в дозах 20000— 3000 Р активация начинается в ходе облучения, но имеет слабую выраженность и продолжается не более 30 мин [Шиходыров В. В., 1958].

Вторая фаза изменения рыхлой соединительной ткани после облучения характеризуется появлением дистрофических изменений во всех ее компонентах. Начинается данная фаза в конце первых суток и продолжается либо до момента гибели животного, либо до его выздоровления. В это время наблюдается уменьшение общего количества клеточных элементов за счет фибробластов, макрофагов и камбиальных элементов.
Значительные изменения претерпевают фибробласты: количество молодых клеток уменьшается, а количество старых и распадающихся фибробластов значительно увеличивается. Старые фибробласты имеют большие гомогенные ядра и широкий, бледно окрашивающийся экзоплазматический ободок цитоплазмы с низким содержанием РНК.
В то же время в цитоплазме макрофагов происходят глубокие изменения, которые впоследствии приводят к их распаду. В результате этого уменьшается общее количество клеточных элементов. Так, например, на высоте лучевой болезни (облучение собак в дозах 400—500 Р) остается лишь 2—3% макрофагов, часть из которых находится в состоянии распада. В то же время у здоровых собак макрофаги составляют около 15% клеточных элементов рыхлой соединительной ткани [Шиходыров В. В., 1958]. Существенно, что уменьшение количества макрофагов в рыхлой соединительной ткани происходит одновременно с убылью этих клеток я понижением их фагоцитарной функции в других органах [Фриденштейи А, Я., 1958; Иванов А. Е., Куршакова Н. Н., 1959].
В соединительной ткани наступает усиленный распад лаброцидов. Вокруг кровеносных сосудов остаются лишь единичные клеточные элементы. Однако на границе лучевых ожогов и язвенных дефектов кожи у людей, погибших от острой лучевой болезни, количество лаброцитов может быть значительным [Liebow A. et al., 1949].
Костный мозг при острой лучевой болезни. Морфология лучевого поражения костного мозга
В самом начале острой лучевой болезни макроскопически костный мозг выглядит неизмененным. При микроскопическом исследовании пунктатов или срезов уже в первые часы развития заболевания (200Р и более) в костном мозге обычно обнаруживаются явления резкого полнокровия, очаговые диапедезные кровоизлияния, плазматическое пропитывание стромы и достаточное количество клеточных элементов.
Однако при цитологическом исследовании обращает на себя внимание уменьшение числа сегменто-ядерных лейкоцитов при относительном преобладании миелоцитов, юных и палочкоядреных форм, а также относительное увеличение числа клеток красной крови.
Это свидетельствует об ускорении созревания и интенсивном переходе лейкоцитов из кроветворной ткани в периферическую кровь [Краевский Н. А., 1957, 1962; Fliedner Т. М. et al., 1961] вследствие нарушения проницаемости костномозговых синусоидов. Значительная часть белого и красного ростков крови в это время находится в состоянии некробиоза, вплоть до полного разрушения ядер.
Как показывают электронно-микроскопические исследования, некробиотические изменения в клетках всех 3 ростков костного мозга выявляются уже через 1 ч после облучения в виде вакуолей в ядрах, смещения ядрышек, нарушения цитоплазматической сети, образования выступов цитоплазмы типа псевдоподии и большого количества вакуолей в цитоплазме, нарушения мембран митохондрий. Причем ультраструктурные изменения в плазматических клетках наступают значительно позже, что подтверждает существующее в литературе представление об их устойчивости к действию излучения [Шурьян И. М., Андрюшенко В. В., 1964; Bari A., Sorenson G., 1965; Токин И. Б., 1974; Марков В. И. и др., 1978].
Установлено, что миелоидные клетки разрушаются вследствие гибели их ультраструктуры, а эритроидные элементы — путем пикноза [Пискарёв В. И. и др., 1978]. В тромбоцитах выявляется увеличенное, число а-гранул, концентрация их в центре клетки, снижение общего количества лизосом, содержащих серотонин, увеличение числа «старых» тромбоцитов [Нестайко Г. В. и др., 1971]. Говоря о ранних изменениях клеток крови, следует напомнить о появлении микроочагов некроза, обнаруживаемых с помощью люминесцентной микроскопии в гистологических препаратах, обработанных акридином оранжевым [Мейсель М. Н., Сондак В. А., 1956; Поздняков А. Л., 1959]. Количество таких микронекрозов нарастает в течение первых 3 ч после облучения, а затем постепенно уменьшается.
Кроме того, отмечается изменение люминесценции значительной части, клеток костного мозга, выявляемое уже через 10—15 мин после облучения в смертельных дозах. В основе данного явления лежит нарушение клеточных мембран [Черникова В. Е., Тарханова М. В., 1965], главным образом ядерной оболочки и митохондрий, а также нуклеопротеидных структур [Зотиков Л. А. и др., 1978], хотя в лимфоцитах человека, облученных in vitro в летальной дозе, наиболее грубые ультраструктурные изменения обнаруживаются в цитоплазматических мембранах клеток [Stefani S. et a]., 1977].
Сравнительно рано обнаруживается изменение содержания нуклеиновых кислот в цитоплазме и ядрах клеток костного мозга. Уменьшается содержание РНК [Носелевич О. М., Колесникова Г. С, 1961], что связано не только с изменением клеточного состава костного мозга, но и с нарушением функции клеток. Изменение ДНК возникает несколько позже, когда убывает количество незрелых клеточных форм. В первые часы после облучения в лейкоцитах снижается активность щелочной фосфатазы и значительно увеличивается содержание гликогена в результате накопления его в клетках во время прохождения их через печень и вследствие активности гидролитических ферментов [Губин В. А., 1959; Bartnikowa W., 1973].
Вместе с тем изменение SH-групп и уменьшение пероксидазной зернистости отмечается только в отдельных клетках миелоидного ряда. Интенсивность соответствующих гистохимических реакций снижается только по мере нарастания признаков массовой гибели клеток.
Читайте также:
