Актин в составе цитоскелета клетки
Добавил пользователь Morpheus Обновлено: 01.02.2026
Цитоскелет прокариот — это система нитеподобных структур, которые преимущественно являются упорядоченными полимерами белков одного класса, наличествует в клетках бактерий и архей. Все исследованные (на 2006 год) белки цитоскелета бактерий способны к самоорганизации в длинные филаменты in vitro. [1]
Цитоскелет прокариот был впервые открыт в начале 1990 годов, когда было установлено, что почти все бактерии и большинство архей содержат белок FtsZ, которые является гомологом тубулина, и может полимеризовываться в филаменты, которые образуют кольцо (Z-кольцо) во время клеточного деления. [2] Позднее были выявлены и прокариотические гомологи актина. Эти открытия изменили представления о том, что именно отсутствие цитоскелета является наиважнейшей причиной меньших размеров и более простой организации прокариот в сравнении с эукариотами. Вместо этого сейчас допускается, что относительная простота бактерий и архей связана с отсутствием белков-двигателей (по крайней мере, до сих пор они выявлены не были), которые «ходят» вдоль филаментов цитоскелета и обеспечивают транспорт разных структур, а также и локомоцию всей клетки. [3]
Наличие у прокариот гомологов актина и тубулина позволяет допустить, что эти два класса нуклеотид-связывающих белков, которые могут образовывать длинные филаменты, возникли в процессе эволюции достаточно давно, ещё до появления эукариот. Однако, ядерные и безъядерные организмы по-разному их используют, например, в цитокинезе бактерий задействован гомолог тубулина FtsZ, тогда как у эукариот эту функцию осуществляют актиновые филаменты, в расхождении молекул ДНК во время деления у бактерий, наоборот, принимают участие гомологи актина, а у эукариот — микротрубочки из тубулина, которые образуют веретено деления. Также у прокариот был выявлен, по крайней мере, один класс белков, которые могут считаться гомологами белков промежуточных филаментов и один класс белков цитоскелета (MinD/PraA), которые не имеют соответствующих у эукариот. [1]
Содержание
Гомологи актина
В 2001 году Джонс (англ. Jones ) и сотрудники обнаружили, что у бактерии Bacillus subtilis имеются белки гомологи актина, которые формируют длинные спиральные структуры. Это открытие дало начало интенсивному развитию исследований в области цитоскелета прокариот, вследствие чего было обнаружено много других гомологов актина. Для всех этих белков характерно наличие актинового АТФазного домена. Большинство из них, как и актин у эукариот, является частью цитоскелета, однако некоторые имеют другие функции, например, FtsA, которые принимает участие в клеточном делении, шаперон DnaK и гексокиназе. [1] Гомологи актина бактерий имеют схожее пространственное строение, но преимущественно достаточно сильно отличаются по аминокислотной последовательности (5-10 % идентичности). Также эти белки имеют отличительные характеристики динамики полимеризации и свойств филаментов, которые они образуют. Очевидно, что, в отличие от эукариот, которые используют один и тот же актин для очень разных потребностей клетки, бактерии имеют много вариантов схожих белков, каждый из которых специализирован на использовании отдельной функции. [3]
Пространственное строение эукариотического актина и его прокариотических гомологов MreB и ParM, все белки находятся в АДФ-связанной форме
Прокариотический белок цитоскелета MreB
Белок, который принимает участие в расхождении плазмид у бактерий ParM
MreB и его гомологи
MreB (англ. murein cluster B ) и его гомологи — белки распространены среди бактерий, имеющих палочкоподобную или спиральную формы, и отсутствует у кокков. Некоторые бактерии, например, Escherichia coli и Caulobacter crescentus, содержат только ген белка MreB, тогда как другие, в частности, Bacillus subtilis, кроме него, имеют также гены его гомологов Mbl (англ. MreB-like ) и MreBH (англ. MreB homolog ). [4] Эти белки обеспечивают поддержание палочкоподобной формы клетки, её полярности, а также расхождение копий бактериальной ДНК во время деления.
Структура и динамика филаментов MreB и его гомологов
In vivo белок MreB и его гомологи образуют длинные спиральные филаменты, расположенные вдоль бактериальной клетки, они могут объединяться в прочные и достаточно гибкие пучки. Такие филаменты являются динамическими структурами, продолжительность их полужизни обычно не превышает нескольких минут. Кроме того, у некоторых видов, в частности, C.crescentus и Rhodobacter sphaeroides филаменты MreB изменяют своё расположение в течение клеточного цикла: во время деления они концентрируются в центральной части клетки и образуют кольцо. Однако, поскольку мутанты с делецией гена mreB не утрачивают способность к цитокинезу, очевидно, белок MreB не является необходимым для этого процесса. [1]
Как было показано в экспериментах на белках бактерии Thermotoga maritima мономерные единицы MreB способны к самоорганизации in vitro в длинные линейные филаменты, которые состоят из двух протофиламентов, расположенных параллельно. По строению филаменты MreB отличаются F-актина, образованного двумя цепями, спирально закрученными один вокруг другого. Для полимеризации MreB необходимо наличие в среде АТФ, однако она происходит одинаково успешно и в присутствии ГТФ (в отличие от актина, который полимеризуется лишь при наличии АТФ). Это связано с тем, что новые субъединицы включаются в состав полимера только в форме, связанной с нуклеотидтрифосфатом, позднее происходит гидролиз связанного АТФ или ГТФ до АДФ или ГДФ соответственно. [1]
Функции MreB и его гомологов
Одной из основных функций филаментов MreB и гомологических белков является поддержание палочкоподобной или спиральной формы бактериальной клетки. Мутации, которые нарушают экспрессию этих белков, приводят к выраженному изменению формы бактерий (обычно они преобразуются в округлые клетки, или в случае Mbl — в клетки неправильной формы). Однако филаменты MreB не служат непосредственно каркасом для поддержания формы клетки, вместо этого, располагаясь по спирали вдоль неё, они являются сайтами для прикрепления ферментов, синтезирующих пептидогликан клеточной стенки. Таким образом они регулируют характер отложение новых элементов на оболочку бактерий, которая собственно и является определяющим фактором в поддержании постоянной формы. Подобным образом микротрубочки растительной клетки влияют на её форму, направляя включения молекул целлюлозы в клеточную стенку. [3] У многих бактерий (в частности, и у E.coli и B.subtilis) ген mreB является частью оперона, в состав которого входят также гены mreC и mreD. Этот оперон входит в большой кластер генов, необходимых для биосинтеза пептидогликана. Продукты генов mreC и mreD — это белки внутренней мембраны грамотрицательных бактерий, они взаимодействуют с белком MreB и принимают участие в организации его комплекса с ферментами, задействованными в биосинтезе муреина, такими как муреинтранспептидаза PBP2. [1] Также в состав этого комплекса входят трансмембранные белки RodZ и RodA. [5]
Филаменты MreB также принимают участие в определении некоторых аспектов полярности клетки, в частности концентрации на одном или обоих полюсах некоторых белков, например, тех, что отвечают за хемотаксис, подвижность, секрецию и вирулентность.
Ещё одной функцией MreB и его гомологов является участие в расхождении копий бактериальной хромосомы во время деления. Среди мутантов, у которых этот белок отсутствует, были обнаружены клетки с несколькими нуклеоидами в цитоплазме, а также и клетки, не имевшие хромосом. Местом прикрепления белков MreB к бактериальной ДНК является точка oriC, присоединение происходит или непосредственно, или при участии других белков. Во время деления филаменты цитоскелета обеспечивают расхождение точек oriC двух копий ДНК к противоположным концам клетки, механизм этого процесса пока (2006 год) не выяснен. Также неизвестно каким образом происходит расхождение хромосом у кокков, у которых отсутствует ген mreB и его гомологи. [1]
Белок разделения плазмид ParM
Много малокопийных (~1-5 копий) плазмид бактерий имеют специальные системы, обеспечивающие их расхождение после репликации. Эти механизмы необходимы для того, чтобы после деления каждая из дочерних клеток получила, по крайней мере, одну молекулу плазмидной ДНК. Известно три типа систем, обеспечивающих расхождение малокопийных плазмид, в каждой из которых используются разные моторные белки (тип I — ParA-подобные белки, тип II — TubZ-подобные белки, тип III — ParM-подобные белки). Один из этих белков — ParM (вид англ. partitioning motor ) — является гомологом эукариотического актина. Впервые он был обнаружен при исследовании пламзиды R1 E.coli. Сейчас эта система сегрегации плазмидной ДНК является лучше всего изученной. [6] Схожая система была обнаружена и и в других плазмидах, в частности, тех, что отвечают за распространение устойчивости ко множеству препаратов (англ. multidrug resistance ). [3]
Структура и динамика филаментов ParM
Как и все элементы цитоскелета, филаменты ParM состоят из мономерных белковых субъединиц. Эти субъединицы способны к полимеризации in vitro в присутствии АТФ или ГТФ. Образованные нитки состоят из двух протофиламентов, закрученных один вокруг другого (структура схожа с F-актином). В живых клетках мономеры ParM формируют длинные неразветвлённые филаменты, которые размещаются вдоль оси бактерии. В отличие от актина и MreB и его аналогов, ParM не образует пучков.
Полимеризация и диссоциация мономеров ParM зависит от присоединения и гидролиза АТФ. Новые субъединицы включаются в состав филамента в АТФ-связанной форме, причём присоединение может происходить на обоих концах филамента. Одновременно со включением новой ParM-АТФ субъединицы происходит гидролиз АТФ в последней присоединённой белковой молекуле. Таким образом, весь филамент состоит из белков ParM-АДФ, и только на концах находятся ParM-АТФ субъединицы, которые «кепуют» всю структуру, стабилизируя её.
При отсутствии соответствующей плазмиды полимеризация филаментов ParM продолжается до тех пор, пока они не достигают определённой критической длины. После этого они начинают очень быстро диссоциировать, причём скорость их этого процесса приблизительно в 100 раз превышает таковую для F-актина. Таким образом, по динамике распада эти элементы больше напоминают микротрубочки эукариот. [1] [6]
Принцип функционирования филаментов ParM
Ген parM входит в локус par плазмиды R1, кроме него, тут также содержится участок parC (от англ. centromere ), играющий роль, аналогичную центромере в хромосомах эукариот, а также ген parR, продукт которого ParR (от англ. repressor ) присоединяется к участку parC и осуществляет ауторегуляцию транскрипции локуса par, а также служит адаптером для присоединения белка ParM.
После репликации плазмиды R1 до обеих её копий в участке parC присоединяется белок ParR. В таком состоянии он может связывать и стабилизировать филаменты ParM, которые постоянно собираются и разбираются в цитоплазме. После этого полимерные нитки ParM начинают удлиняться, присоединяя на каждом конце новые мономеры. Этот процесс сопровождается гидролизом АТФ. Вследствие удлинения филамента две плазмиды, что присоединены к его краям, располагаются в разные стороны, пока не достигают полюсов клетки. После этого происходит диссоциация полимера ParM. [1] [6]
Белок организации магнетосом MamK
Ещё один прокариотический гомолог актина MamK принимает участие в организации мембран магнетосом. Магнетосомы — это органеллы бактерий родов Magnetospirillum и Magnetococcus, которые содержат кристаллы магнетита, окружённые мембраной, и помогают бактерии ориентироваться в геомагнитном поле. В клетке магнетосомы расположены в ряд, с ними всегда ассоциированы длинные филаменты белки MamK. [7]
Гомологи тубулина
В большинстве прокариот также имеются гомологи эукароитического белка тубулина, из которого состоят микротрубочки. Лучше всего изученным из этих гомологов является белок FtsZ, который принимает участие в цитокинезе. Тубулин и FtsZ имеют достаточно мало идентичности в аминокислотной последовательности, косервативным является только ГТФазный домен, однако по пространственной структуре они схожи между собой. Также у отдельных представителей бактерий и архей были обнаружены и другие гомологи тубулина: например, белки BtubA/BtubB Prosthebacter dejoneii, а также TubZ и RepX, которые кодируются плазмидными генами бактерий рода Bacillus. [8]
Клетки под давлением

Обзор
Автор
Редактор
Статья на конкурс «био/мол/текст»: Вы не задумывались, что привычные нам животные, да и мы сами, могли бы выглядеть иначе? Жизнь началась с того, что образовалась клетка — единица всего живого, развитие которой происходило под действием внешних физических полей: гравитационного и электромагнитного. Изменение внешнего воздействия приводит к изменению механического напряжения внутри клетки, которое должно сопровождаться адекватной реакцией клетки без потери способности к самовоспроизведению и полноценной жизнедеятельности. Выраженность и последствия деформаций будут зависеть от собственных механических характеристик клетки и чувствительности ее механосенсоров, на роль которых претендуют различные структуры. Рассмотрим, что же известно о четырех из них: внеклеточном матриксе, механочувствительных ионных каналах, подмембранном и внутреннем цитоскелете.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Клетка — структурная единица всего живого — развивается под постоянным действием внешних стимулов — тепла, пищи, регуляторных гормонов. Однако есть еще один тип стимуляции, который должна воспринимать живая клетка — механическое напряжение. Изменение внешнего воздействия (его вектора, амплитуды) закономерно должно приводить к изменению механического напряжения внутри клетки. Степень выраженности и последствия этих деформаций для жизнедеятельности клетки будут зависеть от собственных механических характеристик клетки и чувствительности ее механосенсоров [1], в роли которых могут выступать различные структуры, способные чувствовать механическую стимуляцию и реагировать на нее. Можно выделить четыре основных типа механосенсоров: внеклеточный матрикс, механочувствительные ионные каналы, подмембранный цитоскелет и комплексы компонентов внутреннего цитоскелета. Рассмотрим, что же известно на сегодня о каждом из них.
Внеклеточный матрикс и мембранные белки
Первый претендент на роль механосенсора — внеклеточный матрикс и связанные с ним мембранные белки (рис. 1). Одной из причин такого предположения послужила реакция этих структур на внешнее механическое воздействие. Было показано, что приложение растягивающей силы к культуре нейронов или гладкомышечных клеток через внеклеточный матрикс приводит к увеличению полимеризации микротрубочек [2, 3].
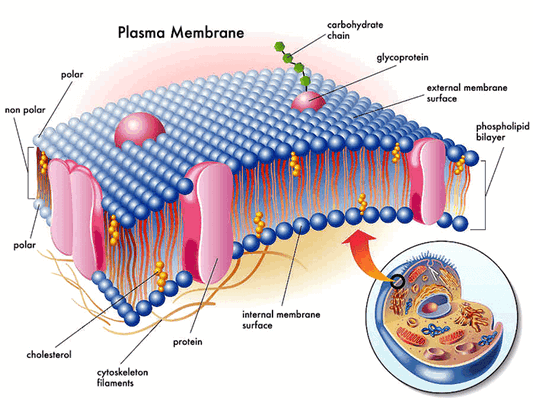
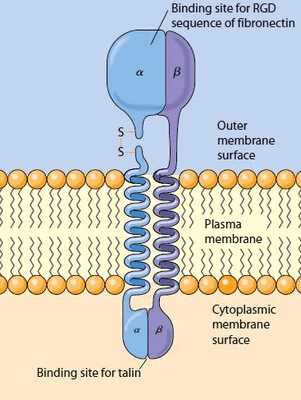
Каким же образом это могло произойти? Попробуем рассмотреть этот процесс на молекулярном уровне. Интегрины — трансмембранные гетеродимерные клеточные рецепторы, формирующие связи с различными белками внеклеточного матрикса (фибронектином, витронектином, коллагеном, ламинином) и передающие межклеточные сигналы, образуют первичный участок трансдукции и поэтому могут рассматриваться как механосенсор. Что совсем не удивительно, ведь интегрины — неотъемлемые участники процессов клеточной адгезии, пролиферации и перемещения.
Интегриновые рецепторы — это гетеродимеры, состоящие из одной α- и одной β-субъединицы (рис. 2). У человека синтезируется как минимум 18 α- и 8 β-субъединиц, из которых в разных комбинациях строится 24 типа интегрина [4], различающихся по специфичности взаимодействия с лигандами. Субъединицы α определяют специфичность интегрина к лиганду, а β связаны со структурами цитоскелета и обеспечивают передачу сигнала внутри клетки. Интегрины присутствуют в мембране постоянно, но для связывания лиганда они должны активироваться, а это происходит, например, при взаимодействии других клеточных рецепторов с цитокинами [5].
У внутренней поверхности клеточной мембраны в зонах образования интегриновых контактов с адгезивными белками внеклеточного матрикса целый ряд белков собирается в фокально-адгезивный комплекс. Это существенно затрудняет анализ вклада каждого из них в механотрансдукцию и пока не позволяет выявить ведущую роль какого-либо из них. Однако представляется очевидным, что внешняя механическая сила может приводить к конформационным изменениям одного или нескольких белков фокально-адгезивного комплекса, запуская далее каскад нижележащих сигнальных путей [6].
Механочувствительные ионные каналы
Второй претендент — механочувствительные ионные каналы. В настоящее время они являются самым малоизученным классом ионных каналов и представляют особый интерес для понимания механизмов клеточной сигнализации.
Впервые такие каналы были обнаружены в электрофизиологических экспериментах с использованием метода патч-кламп (patch-clamp). Было выявлено, что при растягивании мембраны меняется катион-транспортная активность механочувствительного канала — в результате конформационных изменений липидного бислоя [6, 7] или воротных доменов самогό канала.
Наглядно это было представлено на наиболее просто устроенных живых организмах — бактериях. А именно — на механочувствительном канале MscL, представляющем собой пору большого диаметра с низкой ионной селективностью. Эксперименты показали, что увеличение натяжения мембраны, контролируемое путем варьирования глубины всасывания в пипетку, вызывает увеличение проводимости канала в случае, когда силы, действующие на канал, превышают определенную величину [8]. Авторы отметили, что напряжение в этом случае оказывалось чуть ниже (10 -2 Па·м), чем напряжение, приводящее к разрыву (6 × 10 -2 Па·м), что может иметь большое физиологическое значение, например, при разбухании бактериальной клетки вследствие осмотического шока.
В эукариотических клетках в качестве механочувствительных каналов можно рассматривать эпителиальные натриевые каналы ENaCs (рис. 3) — семейство ионных каналов из суперсемейства дегенрин/ENaC (DEG/ENaC), — обнаруженные в клетках различных натрий-абсорбирующих типов эпителия [9].
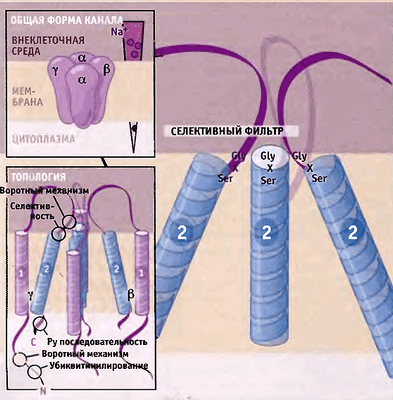
Рисунок 3. Схема строения эпителиальных Na + -каналов. Предполагается, что каждая субъединица состоит из двух трансмембранных участков, выпетливания на поверхности клетки и N- и C-концевых доменов, находящихся внутри клетки. Рисунок из [9].
Накапливается всё больше доказательств того, что ENaC могут активироваться механическими силами; как минимум напряжение сдвига при ламинарном течении жидкости может быть адекватным стимулом, имеющим физиологическое значение [10, 11]. Также косвенным аргументом в пользу механочувствительности может служить тот факт, что гены этих высокоселективных Na + -каналов экспрессируются в тканях, которые наиболее подвержены механическим воздействиям, а именно — на которые действует напряжение сдвига: дистальный отдел нефрона [10, 12], эпителий легкого [13], сосудистая ткань 16, чувствительные нервные окончания, включая те, что участвуют в механосенсорных процессах [17]. Активность этих каналов служит лимитирующим фактором поглощения натрия и скорости трансэпителиального движения воды (осмоса) [18]. Таким образом, ENaC является регулятором транспорта ионов в почке, и именно с ним могут быть связаны механозависимые адаптивные ответы, существенные для обеспечения ионного гомеостаза.
Подмембранный цитоскелет
Третий претендент — подмембранный цитоскелет (рис. 4), роль которого в регуляции ионных каналов доказана в ряде исследований. Рассмотрим некоторые из них.
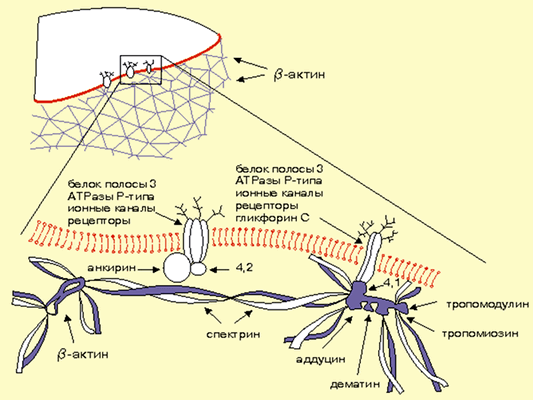
В эксперименте при обработке культуры клеток (например, К562) цитохалазином D* происходит активация натриевых каналов, а полимеризация актина на цитоплазматической стороне клеточной мембраны вызывает их инактивацию [19]. При этом в клетках линии К562 фрагментация актиновых филаментов, ассоциированных с плазматической мембраной, может быть основным фактором, влияющим на активность натриевых каналов в ответ на повышение внутриклеточной концентрации ионов кальция [20].
* — Цитохалазины — группа структурно родственных метаболитов плесневых грибов. Они связываются с быстро растущим концом актинового филамента и блокируют (иногда не полностью) как присоединение, так и отсоединение субъединиц на этом конце.
С помощью метода патч-кламп было показано, что актиновые микрофиламенты принимают участие в регуляции хлорных каналов [21, 22], Na + -K + -АТФазы [23], электровозбудимых натриевых каналов в клетках мозга [24], натриевых каналов в клетках реабсорбирующего эпителия [25].
Авторы работ, посвященных изучению богатых холестерином липидных микродоменов плазматической мембраны (рафтов) как фактора, определяющего активность интегральных мембранных белков и ионных каналов 29, считают, что нарушения структуры рафтов, обусловленные снижением уровня мембранного холестерина, препятствуют реализации клеточных функций, включающих перестройки актиновой сети [29, 32].
В клетках с пониженным содержанием холестерина наблюдалось повышение порога активации и снижение вероятности открытого состояния каналов. При этом измерения механозависимых токов в разных условиях и комплементарные данные флуоресцентной микроскопии свидетельствовали о том, что подавление активности механочувствительных каналов опосредовано реорганизацией актина, инициированной, по мнению ученых, нарушением целостности рафтов из-за снижения уровня мембранного холестерина [33, 34].
Внутриклеточные структуры
И последний по счету, но не по значимости претендент — внутриклеточные структуры. Хорошо известно, что внешнее силовое воздействие может привести к изменениям уровня экспрессии генов. При приложении силы через мембраносвязанные рецепторы в некоторых случаях деформируется ядро [35], то есть можно предположить прямое влияние внешних сил на хроматин, а значит, и на уровень экспрессии генов [36]. Силы в этом случае могут трансдуцироваться через цитоскелетную сеть к ядерной оболочке, а затем через ламининовую сеть (рис. 5) к хроматину. Кроме того, внешнее силовое воздействие может передаваться на микротрубочки, приводить к их разрыву, деполимеризации и запуску сигнальных путей [37].
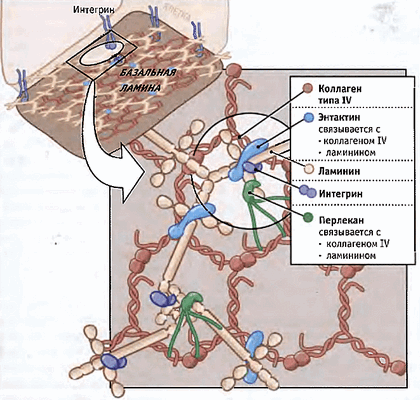
Рисунок 5. Схема полимеризации ламинина в базальной мембране. Ламинин связан по меньшей мере с тремя другими белками внеклеточного матрикса, образуя сеть в базальной ламине. Ламинины также связываются с интегриновыми рецепторами, которые вытягиваются от поверхности клеток, прикрепленных к базальной ламине. Рисунок из [9].
Следует отметить, что конформационные изменения различных белков могут претендовать на роль механосенсора, но прямых доказательств этого практически нет. Хотя существует как минимум один пример того, что биохимическая реакция обусловлена конформационными изменениями белков. Свернутые домены фибронектина могут быть выявлены при действии силы, растягивающей молекулу и провоцирующей формирование фибрилл. Этот процесс исследовался экспериментально, а также методами динамического молекулярного моделирования [38, 39], и в результате было показано, что сила 3-5 пН достаточна для разворачивания доменов, а дальнейшее увеличение силы до 5 пН может привести к удлинению исходной молекулы в пять раз [39, 40]. Эти уровни силы сравнимы с теми, которые, согласно оценкам, могут инициировать механотрансдукцию.
По сути, любой белок, участвующий в механотрансдукции от внеклеточных контактов внутрь клетки, может быть механосенсором и стимулировать разворачивание интегринов [41] и ассоциированных с ними белков [42].
Согласно теории Дональда Ингбера [43], цитоскелет в целом реагирует на изменения механического напряжения, передающиеся посредством внеклеточного матрикса и ассоциированных с ним интегринов, реорганизуя микрофиламенты и микротрубочки. В то же время кортикальный цитоскелет, как жесткий 3D-каркас, поддерживающий плазматическую мембрану, находится в напряженном состоянии во внешнем механическом поле [44]. Поэтому можно полагать, что практически все вероятные механизмы первичной механотрансдукции зависят от состояния подмембранного кортикального цитоскелета, целостность которого обусловливает механические свойства (жесткость) того или иного типа клеток.
Заключение
Участие клеточной механочувствительности во множестве физиологических процессов и довольно скудное количество безусловно установленных фактов делают рассматриваемую область исследований очень привлекательной для молекулярных биологов, цитологов и физиологов. Механозависимая регуляция процессов жизнедеятельности клетки может по праву считаться новым механизмом негуморальной регуляции. Выяснение вклада каждого возможного механосенсора будет способствовать расшифровке основ морфогенеза живого организма на ранних стадиях развития и при различных внешних параметрах.
Характеристики, функции, структура и компоненты цитоскелета
цитоскелет Это клеточная структура, состоящая из нитей. Он рассредоточен по цитоплазме, и его функция в основном заключается в поддержке, чтобы поддерживать архитектуру и клеточную форму. Конструктивно он состоит из трех типов волокон, классифицированных по размеру.
Это актиновые волокна, промежуточные нити и микротрубочки. Каждый из них предоставляет определенное свойство сети. Внутренняя часть ячейки - это среда, в которой происходит перемещение и перемещение материалов. Цитоскелет опосредует эти внутриклеточные движения.
Например, органеллы - такие как митохондрии или аппарат Гольджи - статичны в клеточной среде; они движутся, используя цитоскелет в качестве пути.
Хотя цитоскелет явно преобладает у эукариотических организмов, аналогичная структура была отмечена у прокариот.
- 1 Общая характеристика
- 2 функции
- 2.1 Форма
- 2.2 Движение и клеточные узлы
- 3.1 Нити актина
- 3.2 Промежуточные нити
- 3.3 Микротрубочки
- 4.1 В бактериях
- 4.2 При раке
Общие характеристики
Цитоскелет представляет собой чрезвычайно динамичную структуру, которая представляет собой «молекулярные леса». Три типа нитей, которые составляют его, являются повторяющимися единицами, которые могут формировать очень различные структуры, в зависимости от способа, которым эти фундаментальные единицы объединены.
Если мы хотим создать аналогию с человеческим скелетом, цитоскелет эквивалентен костной системе и, кроме того, мышечной системе..
Однако они не идентичны кости, потому что компоненты могут быть собраны и дезинтегрированы, что позволяет изменять форму и придает клетке пластичность. Компоненты цитоскелета не растворимы в моющих средствах.
функции
форма
Как следует из названия, «интуитивная» функция цитоскелета заключается в обеспечении стабильности и формы клетки. Когда нити объединяются в этой сложной сети, это дает клетке свойство сопротивляться деформации.
Без этой структуры клетка не сможет поддерживать определенную форму. Тем не менее, это динамическая структура (в отличие от человеческого скелета), которая дает клеткам свойство изменять форму.
Движение и клеточные развязки
Многие клеточные компоненты связаны с этой сетью волокон, рассеянных в цитоплазме, способствуя их пространственному расположению.
Ячейка не похожа на бульон с различными элементами, плавающими по течению; и при этом это не статическая сущность. Напротив, это организованная матрица с органеллами, расположенными в определенных зонах, и этот процесс происходит благодаря цитоскелету.
Цитоскелет участвует в движении. Это происходит благодаря моторным белкам. Эти два элемента объединяют и допускают смещения внутри ячейки.
Он также участвует в процессе фагоцитоза (процесс, в котором клетка захватывает частицу из внешней среды, которая может быть или не быть пищей).
Цитоскелет позволяет физически и биохимически связать клетку с ее внешней средой. Эта роль соединителя позволяет формировать ткани и соединения клеток..
Структура и компоненты
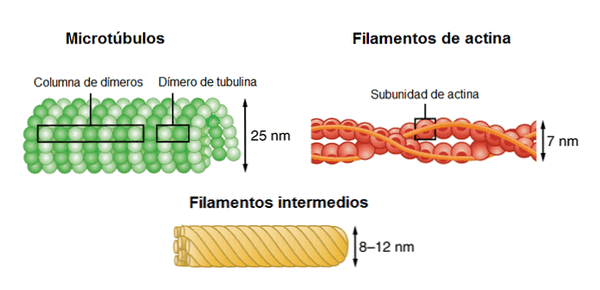
Цитоскелет состоит из трех различных типов филаментов: актина, промежуточных филаментов и микротрубочек..
В настоящее время предлагается новый кандидат в качестве четвертой цепи цитоскелета: септина. Далее подробно описывается каждая из этих частей:
Актиновые филаменты
Актиновые филаменты имеют диаметр 7 нм. Они также известны как микрофиламенты. Мономеры, из которых состоят нити, представляют собой частицы в форме шара.
Хотя они являются линейными структурами, они не имеют форму стержня: они вращаются вокруг своей оси и напоминают пропеллер. Они связаны с рядом специфических белков, которые регулируют их поведение (организация, местоположение, длина). Существует более 150 белков, способных взаимодействовать с актином.
Крайности могут быть дифференцированы; один называется плюсом (+), а другой минус (-). Из-за этих крайностей нить может расти или сокращаться. Полимеризация заметно быстрее, в крайнем случае; для того, чтобы произошла полимеризация, требуется АТФ.
Актин также может быть мономером и быть свободным в цитозоле. Эти мономеры связаны с белками, которые препятствуют их полимеризации.
Актиновые филаментные функции
Актиновые филаменты играют роль, связанную с движением клеток. Они позволяют различным типам клеток, как одноклеточных, так и многоклеточных организмов (например, клетки иммунной системы), перемещаться в окружающей среде..
Актин хорошо известен своей ролью в сокращении мышц. Вместе с миозином они сгруппированы в саркомеры. Обе структуры делают возможным это АТФ-зависимое движение.
Промежуточные нити
Приблизительный диаметр этих нитей составляет 10 мкм; отсюда и название «промежуточный». Его диаметр является промежуточным по отношению к двум другим компонентам цитоскелета.
Каждая нить структурирована следующим образом: головка в форме шара на N-конце и хвост с аналогичной формой на конце углерода. Эти концы связаны друг с другом линейной структурой, образованной альфа-спиралями.
Эти «веревки» имеют шаровые головки, которые имеют свойство наматываться на другие промежуточные нити, создавая более толстые переплетенные элементы..
Промежуточные филаменты расположены по всей клеточной цитоплазме. Они распространяются на мембрану и часто прикрепляются к ней. Эти нити также находятся в ядре, образуя структуру, называемую «ядерный лист».
Эта группа подразделяется на подгруппы промежуточных филаментов:
Функция промежуточных нитей
Это чрезвычайно прочные и стойкие элементы. Фактически, если мы сравним их с двумя другими нитями (актином и микротрубочками), промежуточные волокна приобретают стабильность.
Благодаря этому свойству его основной функцией является механическая, противостоящая клеточным изменениям. Они встречаются в изобилии в типах клеток, которые подвергаются постоянному механическому стрессу; например, в нервных, эпителиальных и мышечных клетках.
В отличие от двух других компонентов цитоскелета, промежуточные нити не могут быть собраны и расположены на их полярных концах.
Они представляют собой жесткие конструкции (чтобы выполнять свою функцию: опора клетки и механическая реакция на напряжение), а сборка нитей является процессом, зависящим от фосфорилирования..
Промежуточные филаменты образуют структуры, называемые десмосомами. Вместе с рядом белков (кадгеринов) эти комплексы создаются, которые образуют связи между клетками.
микротрубочки
Микротрубочки - это полые элементы. Они являются крупнейшими нитями, которые составляют цитоскелет. Диаметр микротрубочек во внутренней его части составляет около 25 нм. Длина довольно изменчива, в диапазоне от 200 нм до 25 мкм.
Эти нити незаменимы во всех эукариотических клетках. Они возникают (или рождаются) из небольших структур, называемых центросомами, и оттуда простираются до краев клетки, в отличие от промежуточных нитей, которые распространяются по всей клеточной среде..
Микротрубочки состоят из белков, называемых тубулинами. Тубулин представляет собой димер, образованный двумя субъединицами: α-тубулин и β-тубулин. Эти два мономера связаны нековалентными связями.
Одной из ее наиболее важных характеристик является способность расти и укорачиваться, будучи достаточно динамичными структурами, как в актиновых филаментах..
Два конца микротрубочек можно отличить друг от друга. Поэтому сказано, что в этих нитях есть «полярность». На каждом конце, называемом более положительным и менее или отрицательным, происходит процесс самосборки.
Этот процесс сборки и деградации нити приводит к явлению "динамической нестабильности".
Функция микротрубочек
Микротрубочки могут образовывать очень разнообразные структуры. Они участвуют в процессах клеточного деления, образуя митотический веретен. Этот процесс помогает каждой дочерней клетке иметь одинаковое количество хромосом.
Они также образуют кнутоподобные придатки, используемые для подвижности клеток, такие как реснички и жгутики.
Микротрубочки служат в качестве путей или «дорог», по которым движутся различные белки, которые имеют транспортную функцию. Эти белки подразделяются на два семейства: кинезины и динеины. Они могут путешествовать на большие расстояния внутри клетки. Транспортировка на короткие расстояния обычно осуществляется на актине.
Эти белки являются «пешеходами» дорог, образованных микротрубочками. Его движение напоминает довольно прогулку по микротрубочке.
Транспортировка включает в себя перемещение различных типов элементов или продуктов, таких как везикулы. В нервных клетках этот процесс хорошо известен, потому что нейротрансмиттеры выделяются в пузырьки.
Микротрубочки также участвуют в мобилизации органелл. В частности, аппарат Гольджи и эндосплазматический ретикулум зависят от этих нитей, чтобы занять их правильное положение. В отсутствие микротрубочек (в экспериментально мутированных клетках) эти органеллы заметно меняют свое положение.
Другие последствия цитоскелета
В бактериях
В предыдущих разделах был описан цитоскелет эукариот. Прокариоты также имеют сходную структуру и имеют компоненты, аналогичные трем волокнам, которые составляют традиционный цитоскелет. К этим нитям мы добавляем одну из наших собственных принадлежностей к бактериям: группу MinD-ParA.
Функции цитоскелета у бактерий очень похожи на функции, которые они выполняют у эукариот: поддержка, деление клеток, поддержание формы клеток, среди других.
При раке
Клинически компоненты цитоскелета связаны с раком. Поскольку они вмешиваются в процессы деления, они считаются «мишенями», чтобы иметь возможность понимать и атаковать неконтролируемое развитие клеток.
Цитоскелет
![]()
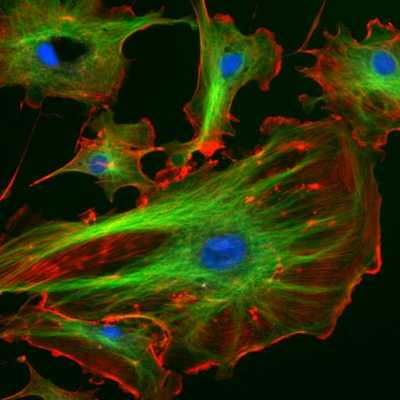
Цитоскелет эукариот. Актиновые микрофиламенты окрашены в красный, микротрубочки — в зелёный, ядра клеток — в голубой цвет.
Цитоскеле́т — это клеточный каркас или скелет, находящийся в цитоплазме живой клетки. Он присутствует во всех клетках эукариот, причем в клетках прокариот обнаружены гомологи всех белков цитоскелета эукариот. Цитоскелет - динамичная, изменяющаяся структура, в функции которой входит поддержание и адаптация формы клетки ко внешним воздействиям, экзо- и эндоцитоз, обеспечение движения клетки как целого, активный внутриклеточный транспорт и клеточное деление.
![]()
Цитоскелет образован белками, выделяют несколько основных систем, называемых либо по основным структурным элементам, заметным при электронно-микроскопических исследованиях (микрофиламенты, промежуточные филаменты, микротрубочки), либо по основным белкам, входящим в их состав (актин-миозиновая система, кератины, тубулин-динеиновая система).
Цитоскелет эукариот
Клетки эукариот содержат три типа так называемых филаментов. Это супрамолекулярные, протяжённые структуры, состоящие из белков одного типа, сходные с полимерами. Разница заключается в том, что в полимерах связь между мономерами ковалентная, а в филаментах связь составных единиц обеспечивается за счёт слабого нековалентного взаимодействия.
Актиновые филаменты (микрофиламенты)
Порядка 7 нм в диаметре, микрофиламенты представляют собой две цепочки из мономеров актина, закрученные спиралью. В основном они сконцентрированы у внешней мембраны клетки, так как отвечают за форму клетки и способны образовывать выступы на поверхности клетки (псевдоподии и микроворсинки). Также они участвуют в межклеточном взаимодействии (образовании адгезивных контактов), передаче сигналов и, вместе с миозином — в мышечном сокращении. С помощью цитоплазматических миозинов по микрофиламентам может осуществляться везикулярный транспорт.
Промежуточные филаменты
Диаметр промежуточных филаментов составляет от 8 до 11 нанометров. Они состоят из разного рода субъединиц и являются наименее динамичной частью цитоскелета.
Микротрубочки
Микротрубочки представляют собой полые цилиндры порядка 25 нм диаметром, стенки которых составлены из 13 протофиламентов, каждый из которых представляет линейный полимер из димера белка тубулина. Димер состоит из двух субъединиц — альфа- и бета- формы тубулина. Микротрубочки — крайне динамичные структуры, потребляющие ГТФ в процессе полимеризации. Они играют ключевую роль во внутриклеточном транспорте (служат «рельсами», по которым перемещаются молекулярные моторы — кинезин и динеин), образуют основу аксонемы ундилиподий и веретено деления при митозе и мейозе.
Цитоскелет прокариот
Долгое время считалось, что цитоскелетом обладают только эукариоты. Однако с выходом в 2001 году статьи Jones и соавт. (PMID: 11290328), описывающей роль бактериальных гомологов актина в клетках Bacillus subtilis, начался период активного изучения элементов бактериального цитоскелета. К настоящему времени найдены бактериальные гомологи всех трех типов элементов цитоскелета эукариот — тубулина, актина и промежуточных филаментов [1] . Также было установлено, что как минимум одна группа белков бактериального цитоскелета, MinD/ParA, не имеет эукариотических аналогов.
Бактериальные гомологи актина
К наиболее изученным актиноподобным компонентам цитоскелета относятся MreB, ParM и MamK.
MreB и его гомологи
Белки MreB и его гомологи являются актиноподобными компонентами цитоскелета бактерий, играющими важную роль в поддержании формы клетки, сегрегации хромосом и организации мембранных структур. Некоторые виды бактерий, такие как Escherichia coli, имеют только один белок MreB, тогда как другие могут иметь 2 и более MreB-подобных белков. Примером последних служит бактерия Bacillus subtilis, у которой были обнаружены белки MreB, Mbl (MreB-like) и MreBH (MreB homolog).
В геномах E. coli и B. subtilis ген, отвечающий за синтез MreB, находится в одном опероне с генами белков MreC и MreD. Мутации, подавляющие экспрессию данного оперона, приводят к образованию клеток сферической формы с пониженной жизнеспособностью.
Субъединицы белка MreB образуют филаменты, обвивающие палочковидную бактериальную клетку. Они располагаются на внутренней поверхности цитоплазматической мембраны. Филаменты, образуемые MreB, динамичны, постоянно претерпевают полимеризацию и деполимеризацию. Непосредственно перед делением клетки MreB концентрируется в области, в которой будет формироваться перетяжка. Считается, что функцией MreB также является координация синтеза муреина — полимера клеточной стенки.
Гены, отвечающие за синтез гомологов MreB, были обнаружены только у палочковидных бактерий и не были найдены у кокков.
Белок ParM присутствует в клетках, содержащих малокопийные плазмиды. Его функция заключается в разведении плазмид по полюсам клетки. При этом субъединицы белка формируют филаменты, вытянутые вдоль большой оси палочковидной клетки.
Филамент по своей структуре представляет собой двойную спираль. Рост филаментов, образуемых ParM, возможен с обоих концов, в отличие от актиновых филаментов, растущих только на ±полюсе.
MamK — это актиноподобный белок Magnetospirillum magneticum, отвечающий за правильное расположение магнитосом. Магнитосомы представляют собой впячивания цитоплазматической мембраны, окружающие частички железа. Филамент MamK выполняет роль направляющей, вдоль которой, одна за другой, располагаются магнитосомы. В отсутствие белка MamK магнитосомы располагаются беспорядочно по поверхности клетки.
Гомологи тубулина
В настоящее время у прокариот найдены 2 гомолога тубулина: FtsZ и BtubA/B. Как и эукариотический тубулин, эти белки обладают ГТФазной активностью.
Белок FtsZ чрезвычайно важен для клеточного деления бактерий, он найден практически у всех эубактерий и архей. Также гомологи этого белка были обнаружены в пластидах эукариот, что является ещё одним подтверждением их симбиотического происхождения.
FtsZ формирует так называемое Z-кольцо, выполняющее роль каркаса для дополнительных белков клеточного деления. Вместе они представляют собой структуру, ответственную за образование перетяжки (септы) [2] .
BtubA/B
В отличие от широко распространенного FtsZ, эти белки обнаружены только у бактерий рода Prosthecobacter. Они более близки к тубулину по своему строению, чем FtsZ.
Кресцентин, гомолог белков промежуточных филаментов
Белок был найден в клетках Caulobacter crescentus. Его функцией является придание клеткам C. crescentus формы вибриона. В случае отсутствия экспрессии гена кресцентина клетки C. crescentus приобретают форму палочки. Интересно, что клетки двойных мутантов, кресцентин − и MreB − , имеют сферическую форму.
MinD и ParA
Эти белки не имеют гомологов среди эукариот.
MinD отвечает за положение сайта деления у бактерий и пластид. ParA участвует в разделении ДНК по дочерним клеткам.
См. также
Примечания
- ↑Shih Y.-L., Rothfield L. The Bacterial Cytoskeleton. // Microbiology And Molecular Biology Reviews. — 2006. — V. 70., No. 3 — pp. 729—754. PMID: 16959967
- ↑ de Boer PA. (2010). «Advances in understanding E. coli cell fission». Curr Opin Microbiol.13: 730—737. DOI:10.1016/j.mib.2010.09.015. PMID 20943430.
Актины (A1, A2, B, C1, G1, G2)
Миозины (1A, 1B, 1C, MYH1, MYH2, MYH3, MYH4, MYH6, MYH7, MYH7B, MYH8, MYH9, MYH10, MYH11, MYH13, MYH14, MYH15, MYH16)
Тропомодулин (1, 2, 3, 4) · Тропонин (T 1 2 3, C 1 2, I 1 2 3) · Тропомиозин (1, 2, 3, 4)
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 15 мая 2011.Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Цитоскелет" в других словарях:
цитоскелет — цитоскелет … Орфографический словарь-справочник
цитоскелет — совокупность нитевидных белковых структур - микротрубочек и микрофиламентов, составляющих опорно двигательную систему клетки. Цитоскелетом обладают только эукариотические клетки, в клетках прокариот (бактерий) его нет, что является важным… … Биологический энциклопедический словарь
цитоскелет — Термин цитоскелет Термин на английском cytoskeleton Синонимы Аббревиатуры Связанные термины биологические моторы, кинезин, клетка, протеом, протеомика Определение Клеточный каркас или скелет, находящийся в цитоплазме живой клетки. Описание… … Энциклопедический словарь нанотехнологий
Цитоскелет прокариот — Цитоскелет прокариот это система нитеподобных структур, которые преимущественно являются упорядоченными полимерами белков одного класса, наличествует в клетках бактерий и … Википедия
цитоскелет — совокупность находящихся в гиалоплазме микротрубочек и микрофиламентов; определяет форму клетки и влияет на перемещение внутриклеточных структур … Анатомия и морфология растений
Живая клетка — Клетка элементарная единица строения и жизнедеятельности всех живых организмов (кроме вирусов, о которых нередко говорят как о неклеточных формах жизни), обладающая собственным обменом веществ, способная к самостоятельному существованию,… … Википедия
Клетка (биология) — Клетка элементарная единица строения и жизнедеятельности всех живых организмов (кроме вирусов, о которых нередко говорят как о неклеточных формах жизни), обладающая собственным обменом веществ, способная к самостоятельному существованию,… … Википедия
Клетка — У этого термина существуют и другие значения, см. Клетка (значения). Клетки крови человека (РЭМ) … Википедия
Комплексный справочник по Биологии — Термин Биология был предложен выдающимся французким естествоиспытателем и эволюционистом Жаном Батистом Ламарком в 1802 году для обозначения науки о жизни как особым явлении природы. Сегодня биология представляет собой комплекс наук, изучающих… … Википедия
Актин
Актин — белок, полимеризованная форма которого образует микрофиламенты — один из основных компонентов цитоскелета эукариотических клеток. Вместе с белком миозином образует основные сократительные элементы мышц — актомиозиновые комплексы саркомеров.
Водорастворимый глобулярный белок (М 42 000), состоящий из 376 аминокислотных остатков (G-актин). С каждой молекулой G-актина связана одна молекула АТФ. При добавлении Mg 2+ и некоторых других ионов актин быстро полимеризуется (с образованием неорганического фосфата), образуя двунитчатую спиральную структуру — F-актин, содержащий АДФ. Тонкие филаменты мышцы образованы такими двунитчатыми структурами, внутри которых молекулы актина связаны между собой нековалентными связями.
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
Смотреть что такое "Актин" в других словарях:
Актин(ы) — * актын(ы) *actin(s) белок мышечных волокон с М. м. 42 кДа, существующий в двух формах фибриллярной ( актин) и глобулярной ( актин). А. имеет участки, комплементарные участкам молекул миозина (см.), и входит в состав актомиозина основного… … Генетика. Энциклопедический словарь
АКТИН — белок мышечных волокон. Мол. м. 42 000. Две формы: глобулярная (Г А.) и фибриллярная (Ф А.), к рая образуется при полимеризации Г А. в присутствии АТФ и ионов Mg+ + . На каждой молекуле А. имеются участки, комплементарные определённым участкам на … Биологический энциклопедический словарь
АКТИН — белок, фибриллярная форма которого образует с миозином основной сократительный элемент мышц актомиозин … Большой Энциклопедический словарь
АКТИН — АКТИН, белок мышечных волокон, участвующий в сократительных процессах в клетке. Содержится преимущественно в клетках мускульных тканей; реагируя с миозином, образует АКТОМИОЗИН … Научно-технический энциклопедический словарь
актин — сущ., кол во синонимов: 1 • белок (99) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
актинідія — іменник жіночого роду … Орфографічний словник української мови
Актин — белок мышечных волокон. Молекулярная масса около 70 000. Существует в двух формах: глобулярной (Г актин) и фибриллярной (Ф актин), являющейся продуктом полимеризации Г актина. В покоящейся мышце А. находится в форме Ф актина, образуя с… … Большая советская энциклопедия
актин — белок, фибриллярная форма которого образует с миозином основной сократительный элемент мышц актомиозин. * * * АКТИН АКТИН, белок, фибриллярная форма которого образует с миозином основной сократительный элемент мышц актомиозин … Энциклопедический словарь
актин — actin актин. Белок мышечных волокон (молекулярная масса 42 кД), существует в двух формах фибриллярной и глобулярной, имеет участки, комплементарные участкам молекул миозина , и входит в состав актомиозина … … Молекулярная биология и генетика. Толковый словарь.
Читайте также: