Анкилозирующий спондилит (АС): атлас фотографий
Добавил пользователь Владимир З. Обновлено: 09.01.2026
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург, Россия
ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, Саратов, Россия
Эффективность теноксикама у больных с анкилозирующим спондилитом
Цель исследования. Изучить изменение болевого синдрома и отдельных его характеристик у больных с анкилозирующим спондилитом, получающих лечение теноксикамом после неэффективного приема нестероидных противовоспалительных препаратов (НПВП) в режиме «по требованию». Материал и методы. В исследование включены 40 пациентов с анкилозирующим спондилитом, имевших BASDAI ≥4,0 исходно и через 52 нед приема НПВП в режиме «по требованию». Больные были рандомизированы в 2 группы: 30 пациентам назначили постоянный пероральный прием теноксикама в дозировке 20 мг/сут, 10 пациентов продолжали проводимую ранее терапию. Рассчитывали индексы BASDAI, ASDAS через 52 и 56 нед лечения. Результаты и заключение. На фоне постоянного приема НПВП (теноксикам) уменьшились исходно повышенные индексы BASDAI и ASDAS. Показатели активности анкилозирующего спондилита у больных, принимавших НПВП по требованию, не изменились. Замена неэффективного длительного приема НПВП в режиме «по требованию» на постоянный прием теноксикама ассоциируется с быстрым (в течение 4 нед) уменьшением клинической активности анкилозирующего спондилита.
Анкилозирующий спондилит (АС) (М45.0) — хроническое воспалительное заболевание из группы спондилоартритов, характеризующееся обязательным поражением крестцово-подвздошных суставов и/или позвоночника с потенциальным исходом в анкилоз, с частым вовлечением в патологический процесс энтезисов и периферических суставов [1]. Распространенность А.С. составляет 0,1—1,4%, первые симптомы появляются до 45 лет [1]. Поражение опорно-двигательного аппарата при АС приводит к снижению качества жизни и потере трудоспособности пациентов [2—4].
У больных с АС достаточно быстро происходит хронизация болевого синдрома, который представлен воспалительным, механическим, спастическим, полинейропатическим и центральным компонентами [5—6]. Наиболее часто в клинической практике наблюдается сочетание воспалительного компонента, обусловленного наличием переднего или заднего спондилита, и механического компонента, обусловленного ремоделированием позвоночника с формированием синдесмофитов и анкилоза [5—6].
Показана способность лекарственных средств (нестероидные противовоспалительные препараты — НПВП, ингибиторы фактора некроза опухоли альфа, блокаторы интерлейкина 17А, бисфосфонаты) подавлять активность АС [2—4]. НПВП не только снимают воспаление, но и уменьшают избыточную костную пролиферацию (образование синдесмофитов) при АС [5—6]. При этом известно, что препараты с разной способностью влиять на активность циклооксигеназ 1 и 2 не одинаково воздействуют на боль в целом и отдельные компоненты болевого синдрома. Данные по влиянию НПВП на процессы ремоделирования кости достаточно противоречивы. Ряд работ показывает преимущество постоянного приема НПВП, другие работы демонстрируют сопоставимую эффективность постоянного приема НПВП и приема НПВП в режиме «по требованию» [2—6]. Ведется активная дискуссия — через какое время от начала приема НПВП следует оценивать их эффективность и через какое время следует выполнять замену одного НПВП на другой. В этой связи представляется актуальным изучение особенностей изменения боли в спине и ее компонентов у больных с АС, получающих НПВП в разных режимах, что явилось целью настоящей работы.
Материал и методы
В клинической программе ПРОГРЕСС пациенты принимали НПВП в режиме «по требованию» в течение 52±8 нед. В рамках программы выполнялась оценка клинических данных об активности АС на момент вступления (визит 0) и через 52±8 нед лечения. Пациентам, у которых по истечении 52 нед участия в исследовании ПРОГРЕСС сохранялась высокая активность заболевания, определяемая как сохранение Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) 4,0 и выше [8], было предложено продолжить участие в исследовании ЭТИКА. В рамках исследования ЭТИКА (1-й визит) пациентов в случайном порядке разделили на 2 группы: 30 пациентам (основная группа) были назначены таблетки теноксикама (тексамен, «Mustafa Nevzat Ilac Sanayii», Турция) перорально по 20 мг 1 раз в сутки после еды в течение 30 сут, 10 пациентов (группа сравнения) продолжали ранее проводимую терапию. На 30-е сутки после рандомизации в рамках исследования ЭТИКА (2-й визит) пациентам повторно исследовали активность АС.
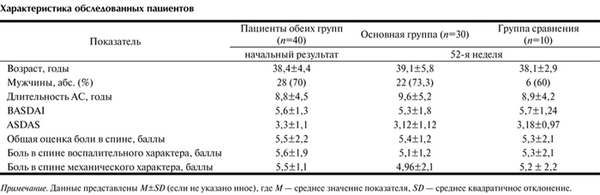
Характеристика пациентов, участвующих в исследовании, представлена в таблице, Характеристика обследованных пациентов Примечание. Данные представлены M±SD (если не указано иное), где M — среднее значение показателя, SD — среднее квадратичное отклонение. все сравниваемые группы были сопоставимы по основным клиническим характеристикам.
Выбор препарата определялся равным влиянием теноксикама на подавление обеих изоформ циклооксигеназы (ЦОГ-1 и ЦОГ-2) и удобством приема препарата (1 раз в сутки перорально), что представляется важным для сохранения приверженности терапии. Ни один из пациентов не принимал теноксикам ранее.
Критерии исключения: выраженный полинейропатический компонентй боли, интенсивный спастический синдром, остеопороз любого генеза, дефицит 25-(ОН) холекальциферола сыворотки крови (исследование в рамках программы ПРОГРЕСС); перенесенные инфаркт миокарда или инфаркт мозга, неконтролируемая артериальная гипертензия, сахарный диабет, почечная или печеночная недостаточность; наличие эрозивных или язвенных изменений желудочно-кишечного тракта, кровотечений в анамнезе; бронхиальная астма или обострение других хронических заболеваний; вирусный гепатит, ВИЧ, онкологические и онкогематологические заболевания, беременность. Кроме того, в исследование не включали пациентов, принимавших анальгетики, глюкокортикоиды, генно-инженерные биологические препараты, средства для лечения остеопороза (бисфосфонаты, деносумаб, терипаротид). Доза других препаратов, принимаемых по поводу АС (сульфасалазин), не должна была превышать рекомендованные и быть стабильной в течение последнего года.
Для оценки активности АС и эффективности лечения использовались индексы активности BASDAI и Ankylosing Spondylitis Disease Activity Score (ASDAS) [8—13]; уровень C-реактивного белка (С-РБ) определяли с помощью аппарата Hitachi [13]. Оценивали болевой синдром в целом, боль воспалительного и механического характера. Для количественной оценки боли применяли числовую рейтинговую шкалу. Болью воспалительного характера считали боль, соответствующую критериям воспалительной боли Assessment of Spondylo Arthritis international Society (ASAS): боль, дебютировавшая в возрасте до 45 лет, уменьшающаяся при движении, но не в покое, максимальная выраженность воспалительной боли должна наблюдаться в предутренние и ранние утренние часы.
Болью механического характера считали боль, возникающую или усиливающуюся при движении, с максимальной выраженностью во второй половине дня, уменьшающуюся в покое, но не при движении.
Оценка безопасности терапии была выполнена путем учета нежелательных явлений, контроля состояния жизненно важных функций, выполнения физикального обследования и лабораторного контроля.
Исследование было одобрено локальным этическим комитетом Саратовского ГМУ им. В.И. Разумовского.
Статистическая обработка данных проводилась с использованием программ Microsoft Excel, SPSS17. Для проверки соответствия распределения признака нормальному распределению применяли методы Колмогорова—Смирнова и Шапиро—Уилка, нормальным считалось распределение при p>0,05. Для описания нормально распределенных количественных признаков использовалось среднее значение признака и среднее квадратичное отклонение (M±SD); для описания выборочного распределения признаков, отличающегося от нормального указывались медиана, верхний и нижний квартили — Me [Q25; Q75]. Для сравнения двух групп с нормальным распределением количественного признака определялся t-критерий Стьюдента для независимых групп (с учетом вида дисперсии признака, определенного методом Левена). Корреляция двух нормально распределенных количественных признаков изучалась с помощью метода Пирсона, при отклонении распределения от нормального, а также при анализе ассоциации качественных признаков использовался метод Спирмена. Подсчитывали число (процент) пациентов. Сравнение достоверности разницы количественных значений внутри одной группы рассчитывали путем определения критерия Вилкоксона. Различия считались достоверными при p
Результаты
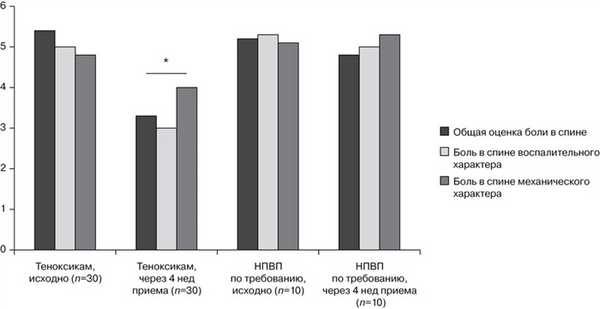
Было отмечено неодновременное изменение показателей болевого синдрома, характерного для воспалительной боли и боли механического характера, а также неодинаковый эффект при разных режимах применения НПВП (см. рисунок). Динамика показателей болевого синдрома при разных режимах применения НПВП. * — различия между показателями общей оценки боли, боли воспалительного и механического характера через 4 нед лечения у больных, получавших теноксикам, и соответствующими исходными показателями достоверны (p<0,05). Интенсивность оценки боли и ее составляющих у больных группы сравнения, получавших НПВП по требованию, не изменилась, в то время как показатели боли при постоянном приеме теноксикама снизились. Интересно, что больший эффект достигнут при лечении воспалительной боли (p=0,034 для различий интенсивности механической и воспалительной боли на 56-й неделе).
Серьезных нежелательных явлений за время исследования зафиксировано не было. Имело место развитие 16 нежелательных явлений, не потребовавших отмены препарата: 8 случаев диспепсии (эрозивных изменений при эзофагогастрофиброскопии не установили), 4 случая головной боли, не связанной с повышением артериального давления, повышение артериального давления в 2 случаях, активация урогенитальной инфекции и чувство дискомфорта в правом подреберье, без признаков нарушения функции печени и другой органной патологии.
В настоящей работе показана эффективность НПВП в лечении хронической боли в спине и возможность влияния на ее воспалительный и механический компоненты. При этом выявлено, что прием НПВП в режиме «по требованию» как на протяжении 52 нед, так и на протяжении 4 нед не уменьшает значимо боль у больных с высокой продолжительностью болезни, выраженными механическим и воспалительным компонентами. В то же время на фоне постоянной терапии теноксикамом, помимо снижения клинической и лабораторной активности АС у больных, не достигших таковой при непостоянном приеме других НПВП, уменьшаются как воспалительный, так и механический компоненты боли. Причем уменьшение боли воспалительного характера превосходит снижение механической боли. Полученные результаты совпадают с данными исследователей группы ASAS [15, 16], показавших превосходство НПВП у больных с воспалительной болью. Однако пациенты со структурными изменениями в позвоночнике почти всегда имеют механический компонент боли, на который НПВП воздействует медленней. Соответственно, заключение о неэффективности НПВП при АС, сделанное в ранние сроки лечения на основании оценки общей боли, может быть ошибочным и определяться наличием механического компонента боли, который необходимо лечить дольше или корригировать ортопедически.
Кроме того, полученные в настоящем исследовании данные согласуются с данными авторов [2—5], изучавших прогрессирование изменений опорно-двигательного аппарата при АС с применением методов визуализации, показавших способность НПВП к торможению рентгенологической прогрессии через большой срок от начала лечения (разрешение воспалительных изменений, наблюдавшихся при МРТ, занимает несколько месяцев, а торможение структурных изменений — несколько лет). Применявшийся в исследовании теноксикам, частично ингибируя ЦОГ-2, может влиять на болевой синдром, процессы воспаления. Причем показана сопоставимая эффективность субакромиального введения теноксикама и глюкокортикоидов [17—19]. Представляется важным факт получения быстрого ответа со стороны воспалительной и механической боли при переключении пациента с неэффективного нерегулярного приема НПВП на клинически эффективный постоянный прием препарата.
Таким образом, в будущих исследованиях необходимо предусмотреть возможность сопоставления полученных клинических и лабораторных результатов с результатами оценки прогрессирования изменений опорно-двигательного аппарата, полученных с применением визуальных методов, в том числе — в долгосрочной перспективе у больных, получающих НПВП в разных режимах.
Режим приема НПВП «по требованию» не приводит к изменению средних показателей интенсивности воспалительной и механической боли в спине у больных с активным АС.
Замена неэффективного длительного приема НПВП в режиме «по требованию» на постоянный прием противовоспалительных препаратов ассоциируется с быстрым (в течение 4 нед) уменьшением клинической активности АС и снижением как воспалительной, так и механической боли.
У больных с АС, принимающих НПВП, снижение интенсивности механического компонента боли в спине происходит в меньшей степени, чем снижение воспалительного компонента боли.
У больных с АС предпочтителен постоянный прием НПВП. При этом оценку эффективности лечения следует выполнять с применением количественной оценки всех компонентов болевого синдрома.
Анкилозирующий спондилит
Анкилозирующий спондилит или болезнь Бехтерева - термин, описывающий форму артрита, который главным образом затрагивает суставы позвоночника. («Анкилоз» - означает становиться неподвижным или ригидным; «спондил» - означает позвоночник; «ит» - означает воспаление.)
При анкилозирующем спондилите возникает воспаление вне сустава, в тех местах, где связки и сухожилия прикрепляются к кости, тогда как при большинстве форм артрита, воспаление затрагивает внутреннюю часть сустава. Это заболевание обычно затрагивает небольшие суставы между позвонками и уменьшает подвижность этих суставов. Таким образом, основной особенностью воспаления суставов является постепенное ограничение их подвижности с образованием анкилозов (сращений костей друг с другом). Одновременно происходит окостенение связок, укрепляющих позвоночник. В результате позвоночник может полностью утрачивать свою гибкость.
Анкилозирующий спондилит - хроническое (то есть продолжительное, длительное) состояние, но в большинстве случаев симптомы умеренно выражены. С вовремя поставленным диагнозом и надлежащим лечением боль и скованность при анкилозирующем спондилите могут быть минимизированы, а недееспособность и деформации, значительно уменьшены или даже предотвращены.
Анкилозирующий спондилит - это системное заболевание из группы ревматических артритов, то есть при этом отмечается воспаление не только в области межпозвоночных суставов, но и в других тканях. Это означает, что воспаление может затронуть и другие суставы (бедренные, плечевые, коленные или стопы), а также ткани глаза, почек, сердца и легких.
Анкилозирующий спондилит обычно поражает молодых людей 13 - 35 лет (средний возраст 24 года), но может появиться в старшей возрастной группе.
Мужчины поражаются приблизительно в три раза чаще, чем женщины.
Каковы причины анкилозирующего спондилита?
Как и при других формах артрита, причина не известна, но не отрицается наследственный фактор (ген HLA B27 находят у 90 % людей с анкилозирующим спондилитом, хотя наличие гена не означает, что у Вас разовьете анкилозирующий спондилит).
Симптомы анкилозирующиго спондилита
Обычно заболевание развивается постепенно, появляются небольшие боли в пояснице, которые со временем усиливаются и распространяются на другие отделы позвоночника. Боли бывают стойкие и лишь на время уменьшаются после приема лекарств. Обычно рано утром скованность и боль в пояснице выражены сильнее.
Постепенно появляется ограничение подвижности позвоночника, что порой происходит незаметно для самого больного и выявляется только при специальном обследовании врачом. Иногда боли бывают очень слабыми или даже отсутствуют, а единственным проявлением болезни является нарушение подвижности позвоночника. Изменения позвоночника распространяются обычно снизу вверх, поэтому затруднения при движении шеи появляются довольно поздно. В некоторых случаях ограничения движений и боли в шейном отделе позвоночника наблюдаются с первых лет заболевания.
Боль не всегда ограничена спиной. У некоторых людей время от времени боль возникает в груди.
Наряду с уменьшением гибкости позвоночника ограничивается подвижность суставов, связывающих ребра с грудными позвонками. Это приводит к нарушению дыхательных движений и ослаблению вентиляции легких, что может способствовать возникновению хронических легочных заболеваний.
У некоторых больных помимо изменений позвоночника появляются боли и ограничение движений в плечевых, тазобедренных, височно-нижнечелюстных суставах, реже боли и припухание суставов рук и ног, боли в грудине. Эти явления могут быть умеренными и непродолжительными, но в ряде случаев они отличаются стойкостью и протекают довольно тяжело. Одна сторона обычно более болезненная, чем другая.
Боль и скованность увеличение после длительных сидячих периодов, и это состояние может быть прервано сном до начала утренней боли и скованности.
В отличие от артритов при других заболеваниях, воспаление суставов при анкилозирующем сподилите редко сопровождается их разрушением, но способствует ограничению подвижности в них.
Диагностика
Учитывают симптомы заболевания, обязательно делают рентгенографию костей и суставов (в первую очередь костей таза, где видны самые первые проявления заболевания). В некоторых случаях делают анализы крови на HLA B27 ген.
Диагноз является часто трудным на ранних стадиях или в легких случаях. Диагноз подтверждается рентгеновскими снимками, но потому что изменения в суставах возникают через несколько лет заболевания, что может говорить о том, что невозможно сделать определенный диагноз первоначально.
Лечение
В настоящее время нет никакого специфического лечения для анкилозирующего спондилита, но есть много видов терапии для каждого человека, которые позволяют контролировать симптомы и повышают качество жизни пациентов.
Основной задачей лечения является уменьшение болей и сохранения подвижности позвоночника, обеспечить правильное положение позвоночника насколько это возможно.
Возможность работы
Люди с анкилозирующим спондилитом способны к выполнению большинства типов работы. Идеальное занятие - то, которое позволяет чередовать периоды сидения, стояния и ходьбы, в то время как постоянно сидячая работа не является подходящей для таких пациентов.
Прогноз
Поскольку люди стареют, позвоночник постепенно становится естественно менее подвижным. У лиц старше 50 ле возраста эта потеря подвижности более выражена у тех, кто болеет анкилозирующим спондилитом. Поскольку анкилозирующий спондилит бывает очень разным по степени тяжести, невозможно предсказать, насколько у человека будет потеряна подвижность позвоночника.
Если следовать индивидуально подобранной грамотным специалистом программе комплексного лечения, то последствия анкилозирующего спондилита, мешающие нормальной жизни, можно свести к минимуму.
Что можете сделать Вы?
Пациенты, которые хорошо информированы о своем заболевании и ведут правильный образ жизни, отмечают меньше болей, реже посещают врачей, более самоуверенны и остаются более активными, несмотря на болезнь.
Очень большое значение имеют регулярные занятия лечебной физкультурой. Она обеспечивает сохранение подвижности позвоночника, не позволяя позвонкам срастаться между собой. Пациенты, регулярно занимающиеся физкультурой, длительно сохраняют относительно хорошее функциональное состояние и способность работать, несмотря на продвинутые стадии заболевания.
Что можете сделать Ваш врач?
Врач проведет тщательный осмотр, возьмет все необходимые анализы и инструментальные исследования. Иногда минимальные изменения при болезни видны на рентгеновских снимках, в то время как внешне заболевание никак не проявляется. Тогда врач сможет вовремя поставить Вам диагноз и предотвратить нежелательный, инвалидизирующий исход заболевания.
Анкилозирующий спондилит (АС): атлас фотографий
Анкилозирующий спондилит (АС) относится к системным воспалительным заболеваниям, при котором преимущественно поражается позвоночник. Протекающий в позвоночнике патологический процесс постепенно приводит к сращению отдельных позвонков между собой (анкилозированию), следствием чего является развитие ограничения подвижности вследствие образования анкилозов (сращений костей друг с другом). Отсюда и происходит и название болезни. Одновременно происходит окостенение связок, окружающих позвоночник. В результате позвоночник может полностью утрачивать свою гибкость и превращаться в сплошную кость.
Симптомы
Обычно заболевание развивается в молодом возрасте и имеет постепенное начало в виде болей в пояснице, которые со временем распространяются на другие отделы позвоночника. Боли могут возникать эпизодически, но чаще носят стойкий характер и лишь на время уменьшаются после приема лекарств. Характер болей имеет следующие особенности:
- боли усиливаются в покое, особенно во вторую половину ночи или утром;
- сопровождаются скованностью;
- уменьшаются или проходят полностью после физических упражнений;
- быстро купируются приемом нестероидных противовоспалительных препаратов.
Изменения позвоночника распространяются обычно снизу вверх, поэтому затруднения при движении шеи появляются довольно поздно. Наряду с уменьшением гибкости позвоночника могут появится и ограничения подвижность суставов. У некоторых больных помимо изменений позвоночника появляются боли и ограничение движений в плечевых, тазобедренных, височнонижнечелюстных суставах, реже боли и припухание суставов рук и ног, боли в грудине. Эти явления могут быть умеренными и непродолжительными , но в ряде случаев они отличаются стойкостью и протекают довольно тяжело. В отличие от артритов при других заболеваниях, воспаление суставов у больных анкилозирующим спондилитом редко сопровождается их разрушением, но приводит ограничению подвижности в них.
Истинная причина возникновения АС (болезни Бехтерева) пока не ясна.
Внесуставные проявления
Кроме позвоночника и суставов иногда наблюдается поражение различных органов и систем (поражения сердца, почек, глаз). Наиболее часто поражаются глаза (увеит), проявляется это болью и покраснением одного глаза, слезотечением, светобоязнью, затуманиванием зрения. В таких случаях больные должны наблюдаться не только у ревматолога, но и у офтальмолога. Увеит при АС, как правило, односторонний и при адекватном лечении обычно проходит в течение 2-3 месяцев без последствий. Если своевременно не назначают адекватное лечение, то увеит может привести к осложнениям.
Диагностика
При подозрении на заболевание, обязательно проводится исследование на носительство HLA-В27 (гена предрасположенности к АС), его наличие иногда является существенным аргументом в пользу диагноза АС.
Среди лабораторных методов наибольшее значение имеет определение СОЭ и С-реактивного белка (СРБ). Эти показатели дают возможность ориентировочно судить, насколько активно протекает воспалительный процесс. Однако, они не всегда правильно отражает состояние больного, и нормальные цифры СОЭ сами по себе еще не позволяют сделать заключение об отсутствии воспаления.
При первичном обследовании проводится также возможно более полное обследование пациента для выявления сопутствующих заболеваний и выявления внесуставных проявлений АС.
Основная трудность в диагностике АС - это распознать болезнь на ранних стадиях, что в большей мере зависит от анализа чисто клинических, а не структурных изменений в скелете и от опыта и квалификации врача ревматолога.
Тесты по самодиагностике доступны по ссылке
Лечение
Медикаментозная терапия должна назначаться врачом специалистом, в зависимости от стадии и активности заболевания.
В настоящее время имеются все возможности для успешного лечения анкилозирующего спондилита.
Лечение должно быть комплексным и обязательно включать помимо лекарственной терапии и лечебную физкультуру (ЛФК).
Среди немедикаментозных методов лечения анкилозирующего спондилоартрита основное место занимают регулярные физические упражнения (ЛФК) и обучающие занятия, проводимые на школах пациентов. Пациент должен регулярно заниматься ЛФК. Регулярные занятия ЛФК при анкилозирующем спондилоартрите обеспечивают сохранения подвижности позвоночника и суставов. Роль других физиотерапевтических методов лечения анкилозирующего спондилоартрита таких как массаж, магнитолазаротерапия, акупунктура и др. не доказана.
В настоящее время в арсенале ревматологов имеются лекарственные средства, которые эффективно лечат это заболевание, особенно если его удалось диагностировать на ранних стадиях.
Сотрудничество с лечащим врачом
Пациенту АС необходимо постоянно наблюдаться у врача ревматолога, который может Вас всегда внимательно выслушать и квалифицированно помочь.
Старайтесь регулярно проходить рекомендуемое обследование, аккуратно сохраняйте медицинскую документацию, рентгеновские снимки. Приходя к врачу, готовьте заранее ваши вопросы и пожелания. Обсуждайте любые вопросы изменения лечения, а также использование околонаучных методов лечения.
В настоящее время разработано мобильное приложение ASpine для самоконтроля при болезни Бехтерева, которая работает на всех современных смартфонах. Программу можно скачать бесплатно.
Специалисты отдела спондилоартритов ФГБНУ НИИР им. В.А. Насоновой, являются главными экспертами в лечении и диагностике анкилозирующего спондилита (Болезни Бехтерева).
Анкилозирующий спондилит (болезнь Бехтерева)

Анкилозирующий спондилит (болезнь Бехтерева) — заболевание из группы спондилоартри- тов, для которого характерно хроническое воспалительное поражение позвоночника и крестцово-подвздошных суставов, иногда периферических суставов, энтезов (мест прикрепления к костям связок и сухожилий), возможно поражение внутренних органов.
Кто занимается лечением анкилозирующего спондилита?
Пациентов с анкилозирующим спондилитом наблюдает и лечит врач-ревматолог.
Возможно ли излечение анкилозирующего спондилита?
Анкилозирующий спондилит является первично хроническим заболеванием, излечить его полностью невозможно. Целью лечения заболевания является достижение ремиссии — полного контроля над клиническими проявлениями, отсутствия лабораторных признаков активности и рентгенологической прогрессии болезни.
Какова распространенность заболевания в популяции?
Анкилозирующим спондилитом страдают от 0,5% до 2% населения. Анкилозирующий спондилит занимает второе место по распространенности среди ревматических заболеваний после ревматоидного артрита и первое место — среди воспалительных заболеваний позвоночника.
Кто чаще болеет анкилозирующим спондилитом?
Наиболее часто анкилозирующим спондилитом болеют мужчины молодого возраста. Однако в последнее время увеличивается количество женщин, страдающих анкилозирующим спондилитом.
Что является причиной возникновения анкилозирующего спондилита?
Непосредственно причины заболевания не установлены. Большое значение имеет генетическая предрасположенность. В частности, носительство антигена HLA-B27. Заболевание развивается у 1-2% носителей HLA-B27. В случае наличия заболевания у родственников первой линии родства риск болезни увеличивается до 20%.
Какова вероятность наследования анкилозирующего спондилита?
Вероятность развития заболевания у детей пациентов с анкилозирующим спондилитом составляет от 4% до 30%, однако при наличии у детей антигена HLA-B27 вероятность заболевания повышается. В среднем риск заболевания детей у пациента с анкилозирующим спондилитом с партнером, не имеющим этой болезни, около 11 %.

Каковы особенности боли в спине при анкилозирующем спондилите?
Боль в спине при анкилозирующем спондилите имеет воспалительный характер. Она довольно сильная, постоянная, в большей степени беспокоит ночью, утром, сразу после пробуждения, иногда мешает спать.
Характерными чертами боли является улучшение самочувствия после физических упражнений, но отсутствие улучшения после отдыха, усиление боли в ранние утренние часы. Боль часто сопровождается скованностью, в дальнейшем — ограничением объема движений в позвоночнике.
Что происходит в позвоночнике при анкилозирующем спондилите?
Первичными очагами воспаления являются зоны соприкосновения фиброзного кольца дисков и краев костной ткани позвонков. Воспалительный процесс приводит вначале к разрушению хрящевой и костной ткани, а затем происходит уплотнение пораженных очагов и их замещение хрящевой и костной тканью, развиваются анкилозы. Вследствие разрастания костной ткани в зонах воспаления между парными позвонками формируются костные мостики — синдесмофиты, в результате чего позвоночный столб превращается в малоподвижную структуру, называемую «бамбуковой палкой».
Прогрессирование болезни приводит к изменению осанки: исчезновению физиологических изгибов позвоночника, формируется поза «просителя» — исчезновение поясничного лордоза, выраженный грудной кифоз и шейный гиперлордоз.
Как поражаются при анкилозирующем спондилите крупные суставы?
При анкилозирующем спондилите поражаются плечевые и тазобедренные суставы. Поражение плечевого сустава обычно имеет доброкачественный характер, протекает с поражением связочного аппарата и мест внедрения сухожилий в кость (энтезопатия), а поражение тазобедренного сустава имеет типичный воспалительный характер (коксит). Клиническими признаками коксита является боль воспалительного характера, иррадиирующая в паховую область, бедро или коленный сустав. Характерные рентгенологические признаки появляются, как правило, через 3-5 лет после возникновения боли, что затрудняет диагностику поражения.
Прогрессирование коксита приводит к существенному ограничению подвижности тазобедренного сустава, формированию сгибательной контрактуры сустава, возникает утиная походка. Коксит часто приводит к необходимости протезирования тазобедренного сустава. Коксит — фактор неблагоприятного прогноза при анкилозирущем спондилите, особенно если он возникает у молодых мужчин в дебюте заболевания.
КоРСАр — когорта раннего спондилоартрита
КПС — крестцово-подвздошные суставы
МРТ — магнитно-резонансная томография
НПВП — нестероидные противовоспалительные препараты
нр-аксСпА — нерентгенологический аксСпА
ПОП — поясничный отдел позвоночника
СРБ — С-реактивный белок
Спондилоартриты (СпА) представляют собой группу воспалительных ревматических заболеваний, к которым относятся анкилозирующий спондилит (АС), псориатический артрит, реактивный артрит, артриты, ассоциированные с хроническими воспалительными заболеваниями кишечника (язвенный колит и болезнь Крона), а также недифференцированный СпА [1]. Объединяющими признаками данных нозологий, помимо воспалительного поражения крестцово-подвздошных суставов (КПС) и позвоночника, служат такие клинические проявления, как периферический олигоартрит, поражающий преимущественно нижние конечности, энтезиты, дактилиты, воспалительные заболевания глаз, кожи и кишечника, а также семейная предрасположенность и частое выявление антигена B27 [1]. Исходя из клинической картины СпА разделяют на две группы — аксиальный СпА (аксСпА), характеризующийся преимущественным поражением осевого скелета, и периферический СпА, преимущественно поражающий периферические суставы [2]. В свою очередь к аксСпА относят АС и нерентгенологический аксСпА (нр-аксСпА) [2]. Рентгенологическое выявление двустороннего сакроилиита (СИ) II стадии и выше, или одностороннего СИ III—IV стадии, является обязательной частью диагностики АС согласно модифицированным Нью-Йоркским критериям, опубликованным в 1984 г. [3]. Однако рентгенологический СИ, который подразумевает деструктивные процессы в КПС, выявляется на довольно поздних сроках болезни, через много лет от начала первых клинических проявлений, что служит одной из основных причин поздней диагностики АС, которая зачастую опаздывает на 5—10 лет [4, 5] и соответственно это затягивает сроки назначения эффективной терапии. В связи этим в начале 90-х годов прошлого века созданы классификационные критерии Европейской группы по изучению СпА (European Spondyloarhropathy Study Group — ESSG) [6] и критерии Амора [7] для выявления СпА на ранних стадиях, однако они охватывали клинические проявления как аксиального, так и периферического СпА. В 2009 г. Международное общество по оценке спондилоартритов ASAS (The Assessment of SpondyloArthritis international Society) разработало критерии, которые позволяют диагностировать аксСпА двумя путями: первый базируется на выявлении СИ инструментальным методом (магнитно-резонансная томография — МРТ или рентгенография) в сочетании с одним и более клиническим проявлением СпА, второй — при наличии HLA-B27 с двумя и более клиническими признаками, характерными для СпА (см. рисунок) [8]. Данный подход позволяет выявлять аксСпА на ранних стадиях до появления достоверных рентгенологических изменений в аксиальном скелете.
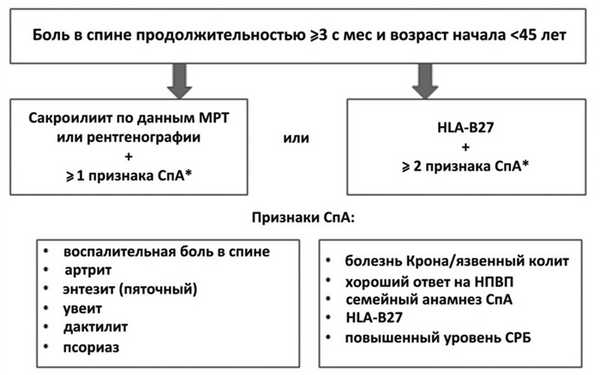
Классификационные критерии ASAS для аксСпА, 2009 г. НПВП — нестероидные противовоспалительные препараты; СРБ — С-реактивный белок.
Исследования КПС и позвоночника у пациентов со СпА с помощью МРТ внесли большой вклад в понимание эволюции заболевания, ранней диагностики и были использованы в качестве объективного критерия оценки эффективности при клинических испытаниях. С внедрением этого метода появилась возможность диагностировать доструктурные изменения костной ткани, которые не выявлялись рентгенологическим методом, — ее воспаление (остеит) и дегенерацию (жировая дистрофия) [9]. Однако до настоящего времени неясна взаимосвязь воспаления костной ткани и прогрессирования ее структурных повреждений при аксСпА.
В последние годы в таких странах, как Германия, Франция, Испания и Нидерланды, проводится активное исследование когорт пациентов с ранним аксСпА, в котором сравниваются клинические проявления нр-аксСпА с АС [10—12]. По результатам таких исследований не выявлено достоверных различий по клиническим проявлениям и активности заболевания согласно индексу BASDAI между данными группами. В отличие от АС, который несколько чаще поражает мужчин, нр-аксСпА имеет более сбалансированное распределение по половому признаку [10—12]. В немецкой когорте GESPIC (2009) в отличие от французского и голландского исследований у пациентов с АС выявлялась более высокая лабораторная активность, определяемая по уровню СРБ, и более низкий функциональный статус [10]. Исходя из сопоставимости клинической картины АС и нр-аксСпА мы поставили перед собой задачу по выяснению, является ли нр-аксСпА начальной стадией А.С. Для решения этой задачи с 2013 г. в ФГБНУ НИИР продолжаются формирование и исследование когорты пациентов КоРСАр (когорта раннего спондилоартрита) с длительностью симптоматики аскСпА менее 5 лет.
Материалы и методы
Набор когорты осуществлялся методом последовательного включения всех пришедших на консультативный прием в ФГБНУ НИИР им. В.А. Насоновой пациентов, удовлетворяющих критериям включения и отказа от включения в исследование. После включения всех пациентов обследовали по специально разработанному протоколу, включающему клинические, лабораторные, рентгенологические методы оценки состояния больных и МРТ с использованием комплекса показателей, характеризующих отдельные проявления заболевания в динамике на фоне лечения (в соответствии с рекомендациями ASAS).
Основные критерии включения: проживание в Москве или Московской области; возраст от 18 до 45 лет на момент включения; наличие воспалительных болей в позвоночнике, удовлетворяющих критериям экспертов ASAS длительностью ≥3 мес и ≤5 лет; добровольное желание участвовать в исследовании.
Основные критерии отказа от включения: беременность; наличие противопоказаний к проведению МРТ (пейсмекер, эндопротез тазобедренного сустава, металлоконструкции на позвоночнике и др.); клинически значимое состояние, которое, по мнению исследователя, может повлиять на данные, полученные в ходе исследования, или на полноценное участие пациента в нем (алкоголизм, наркомания, психические заболевания, тяжелая органная патология и т. д.).
Каждый пациент подписал добровольное информированное согласие на участие в исследовании.
Исследование одобрено локальным этическим комитетом.
В настоящее время в когорту КоРСаР включены 132 больных аксСпА, из которых в предварительный анализ вошли 69 больных, наблюдавшихся не менее 12 мес. Средний возраст этих 69 пациентов на момент включения в исследование составил 28,1±5,5 года, средняя продолжительность заболевания — 24,7±15,8 мес, 63 (91,3%) больных позитивны по HLA-B27.
Пациентов разделили на 2 группы: в 1-ю вошел 41 больной с достоверным рентгенологическим СИ, т. е. с диагнозом АС, а во 2-ю — 28 пациентов с нр-аксСпА. Исходная клиническая характеристика пациентов представлена в табл. 1.
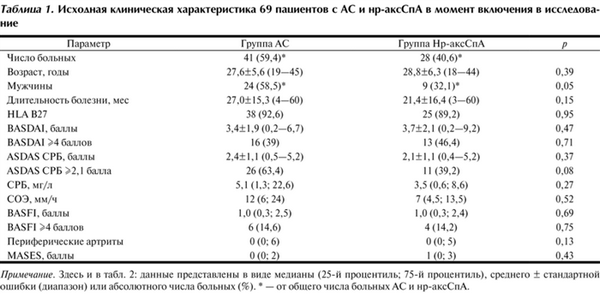
Таблица 1. Исходная клиническая характеристика 69 пациентов с АС и нр-аксСпА в момент включения в исследование Примечание. Здесь и в табл. 2: данные представлены в виде медианы (25-й процентиль; 75-й процентиль), среднего ± стандартной ошибки (диапазон) или абсолютного числа больных (%). * — от общего числа больных АС и нр-аксСпА.
В группе АС преобладали мужчины (58,5% против 32,1% в группе нр-аксСпА; р=0,05), в отличие от группы нр-аксСпА, в которой было больше женщин (67,9%). Возраст на момент включения в исследование и длительность болезни не различались, как и частота выявления антигена B27, периферических артритов, энтезитов. Активность заболевания, определяемая с помощью индекса BASDAI, и функциональный статус (BASFI) были сопоставимы между данными группами. Обращает внимание некоторое преобладание повышенного уровня СРБ (Ме 5,1 и 3,5 мг/л), СОЭ (Ме 12 и 7 мм/ч) и индекса ASDAS СРБ ≥2,1 балла (63,4 и 39,2%) в группе больных АС и группе нр-аксСпА соответственно, однако данные различия недостоверны.
Методы, используемые в научно-исследовательской работе. Оценку клинической активности СпА и функционального статуса пациентов выполняли согласно общепринятым рекомендациям с использованием индексов ASAS. Для определения активности заболевания использовали индексы BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [13], ASDAS CРБ (Ankylosing Spondylitis Disease Activity Score) [13]. Функциональный статус оценивали по индексам BASFI (Bath Ankylosing Spondylitis Functional Index) и BASMI (Bath Ankylosing Spondylitis Metrology Index) [13]. Для оценки боли в спине, утренней скованности, глобальной оценки общего самочувствия пациентов, BASDAI и BASFI использовали числовую рейтинговую шкалу с числом баллов от 0 до 10. При подсчете болезненных энтезисов применяли индекс MASES (Maastricht Ankylosing Spondylitis Enthesitis Score) [13]. Помимо клинического обследования и стандартных лабораторных исследований (общий анализ крови, биохимический анализ крови, исследование уровня высокочувствительного СРБ) у всех пациентов определяли наличие HLA-B27, а также проводили обзорную рентгенографию костей таза и поясничного отдела позвоночника (ПОП) с захватом двух последних грудных позвонков (в боковой проекции). Всем пациентам проводили МРТ КПС и ПОП (на низкопольном аппарате Signa Ovation 0,35 Тесла, матрица 288×192). ПОП исследовали в сагиттальных проекциях, КПС — в полукоронарных. Активные воспалительные изменения (ВИ) определялись в режиме подавления жира (STIR) с толщиной срезов 4 мм. Выявление явного субхондрального отека костного мозга (остеита), визуализируемого как гиперинтенсивный сигнал в режиме STIR, расценивали в качестве признака спондилита, и/или СИ, и/или коксита. Наличие В.И. в КПС и позвоночнике констатировали в случае, если признаки остеита определялись как минимум на двух срезах или если выявлялось более двух гиперинтенсивных очагов активного воспаления на одном срезе. Для диагностики АС использовали модифицированные Нью-Йоркские критерии 1984 г. [1]. Для диагностики аксСпА применяли критерии ASAS для СпА с преимущественной аксиальной симптоматикой [8].
Статистическую обработку данных выполняли с использованием пакета прикладных программ Statistica 6.0 (StatSoft, США). Анализ включал общепринятые процедуры описательной статистики, непараметрические методы сравнения.
В течение 12 мес все пациенты получали НПВП в терапевтических дозах согласно рекомендациям ASAS. Клиническая характеристика больных через 12 мес представлена в табл. 2. Через 12 мес наблюдения число пациентов с АС увеличилось до 48, т. е. у 7 (25%) пациентов с нр-аксСпА развился достоверный рентгенологически выявленный СИ, и они перешли в группу А.С. Изначально среди них у 2 (28,5%) имелись выявляемые при МРТ признаки активного СИ, у 4 (57,1%) — признаки хронического СИ, а у 1 (14,4%) патологические изменения по данным МРТ не выявлены. Среди 20 (75%) пациентов с нр-аксСпА, у которых за этот период не развился рентгенологически определенный СИ, выявляемые МРТ-признаки жировой дистрофии без активного остеита, имелись у 6 (30%), в то время как у 9 (45%) — признаки активного СИ.

Таблица 2. Клиническая характеристика 69 пациентов с АС и нр-аксСпА через 12 мес наблюдения
Периферические артриты, энтезиты и лабораторные показатели между группами через 12 мес наблюдения достоверно не различались, как и активность заболевания, определяемая BASDAI и ASDAS СРБ. Следует отметить, что в целом активность заболевания на фоне терапии НПВП снизилась в 1,5 раза в обеих группах, но высокая функциональная недостаточность (BASFI >4 баллов) сохранялась у пациентов АС, в то время как в группе нр-аксСпА высокие показатели BASFI не регистрировались.
КоРСар — первая и единственная когорта в России, целью которой является изучение клинических проявлений и эволюции раннего аксСпА. Сравнивая результаты нашего исследования с когортами других стран, мы пришли к выводу, что наши данные подтверждают некоторое превалирование мужского пола в группе А.С. Однако оно не столь выражено, как это считалось раньше. Это можно объяснить более быстрой скоростью прогрессирования и высокой активностью заболевания у мужчин [14]. Учитывая небольшую длительность болезни на момент включения в наше исследование — менее 5 лет, можно предположить, что спустя более длительное время число мужчин и женщин в группе АС будет равным, особенно с учетом того, что у пациентов мужского пола пролиферация костной ткани быстрее протекает в поясничном отделе позвоночника и КПС [14], благодаря чему и устанавливается диагноз А.С. Однако достоверно более высокую активность и функциональную недостаточность у больных АС, чем у пациентов с нр-аксСпА, на нашей когорте подтвердить не удалось. С нашей точки зрения, важную роль в подавлении активности заболевания и как следствие сохранении функционального статуса играет вовремя подобранная адекватная терапия. В данном случае пациенты как с АС, так и с нр-аксСпА при первичном амбулаторном приеме ревматолога сразу стали получать НПВП в адекватных терапевтических дозах.
Кроме того, немалое значение имеет увеличение числа пациентов, имеющих достоверные рентгенологические признаки СИ (25%), а значит соответствующих критериям диагноза АС, спустя короткий срок — 12 мес. Среди данных пациентов изначально у 57,1% имелись признаки жировой дистрофии в КПС по данным МРТ в отличие от больных, у которых рентгенологическое прогрессирование СИ (30%) не отмечено. Эти данные подтверждают, что жировая перестройка костной ткани является пре-диктором пролиферации кости. Согласно данным литературы, около 20% пациентов с аксСпА, имевших остеит КПС, спустя 2 года имеют рентгенологически достоверный СИ [15—17]. Вследствие этого возникает вопрос: почему у некоторых пациентов с клинической картиной аксСпА структурные изменения аксиального скелета прогрессируют в течение короткого периода (1—2 года), в то время как у остальных либо не возникают, либо протекают значительно медленнее. Можно предположить, что разные стадии заболевания протекают с разной скоростью прогрессирования, не в последнюю очередь связаны с генетическими особенностями. Согласно результатам гистологических исследований, проведенных на экспериментальной модели мышей (протеогликаниндуцированный спондилит), установлена определенная последовательность патофизиологических процессов, т. е. активное воспаление костной ткани должно сначала уменьшиться или разрешиться, а затем возникает остеопролиферация [18]. Это доказывает исследование W. Makcymowych и соавт. [19], согласно которому синдесмофиты у больных АС образуются чаще на углах позвонков с хроническим (по данным МРТ) воспалением. Таким образом, данные изменения указывают на раннюю, промежуточную и позднюю стадии болезни [18].
Исходя из полученных результатов нашего исследования, т. е. сопоставимости клинических проявлений (наличию периферических артритов и энтезитов), активности заболевания (согласно индексам BASDAI, ASDAS СРБ, лабораторным показателям — СРБ, СОЭ) и функционального статуса (индекс BASFI) пациентов с АС и нр-аксСпА исходно и через 12 мес, можно предположить, что нр-аксСпА соответствует начальной стадии АС. В связи с этим целесообразно раннее назначение адекватного лечения для сохранения функционального статуса пациентов и контроля активности заболевания на низком и умеренном уровнях для улучшения качества жизни больных и, возможно, торможения прогрессирования болезни.
Читайте также:
