Апоневротические швы. Техника наложения швов на апоневроз.
Добавил пользователь Alex Обновлено: 28.01.2026
Проблема послеоперационных вентральных грыж (ПОВГ) весьма актуальна ввиду роста количества операций на брюшной полости. После срединной лапаротомии формирование вентральной грыжи встречается в 2—28% случаев [1—6]. При ушивании лапаротомной раны важно выполнить пластику без натяжения тканей, учитывая равномерную нагрузку на швы, несоблюдение этих правил ведет к прорезыванию швов, нарушает микроциркуляцию и трофику в тканях и способствует возникновению ПОВГ и эвентрации [4, 7—10]. В связи с этим важность выбора рационального способа ушивания белой линии живота, особенно в ургентной хирургии, не вызывает сомнения.
На практике выбор способа ушивания раны больше связан с предпочтениями и устоявшимися стереотипами, из-за отсутствия опыта и мануального навыка новые методы применяют с опасением или вообще не используют. В связи с этим актуален вопрос внедрения и обучения новым методикам лапарорафии с целью профилактики развития ПОВГ. При этом обучение должно проводиться на специально разработанных для этого тренажерных системах, что будет способствовать отработке навыка в условиях, приближенных к клиническим, и мотивировать применение полученного опыта на практике [2].
Цель исследования — улучшение результатов лечения больных, подвергшихся лапаротомии, путем внедрения в практику разработанного способа ушивания апоневроза после лапаротомии.
Материал и методы
На кафедре общей хирургии РязГМУ разработан и запатентован способ ушивания апоневроза после лапаротомии (патент РФ на изобретение № 2644846). После успешного проведения кадаверного и экспериментального исследования на лабораторных животных, согласно правилам проведения работ с использованием экспериментальных животных от 12.08.77 № 755, а также принципам надлежащей лабораторной практики (Principles of Good Laboratory Practice) с изменениями от 1997 г., инкорпорированными в Директиву Е.С. 2004/10/ЕС, решено внедрить новый способ лапарорафии для клинического применения.
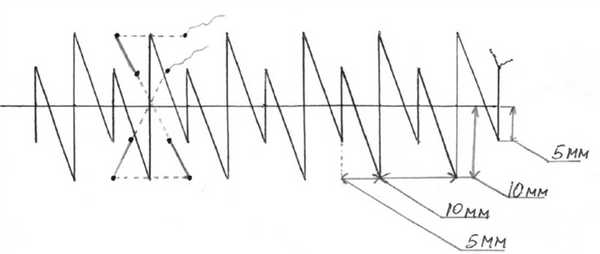
Сущность способа состоит в том, что после шва брюшины апоневроз лапаротомной раны ушивают укрепляющими швами, расстояние между которыми составляет 5 см, затем накладывают непрерывный шов с расположением стежков в шахматном порядке — непрерывный шахматный шов (рис. 1). Рис. 1. Схема наложения непрерывного шахматного шва на апоневроз.
Задачами использования являются уменьшение нагрузки на непрерывный шахматный шов, укрепление наименее прочных участков белой линии живота, предупреждение натяжения краев раны и нити при наложении непрерывного шахматного шва, профилактика несостоятельности шва апоневроза в случае возможной ревизии раны при ее нагноении. Преимуществом укрепляющего шва является его высокая прочность благодаря двум линиям фиксации в вертикальном и горизонтальном направлении относительно линии разреза. При этом нагрузка равномерно распределяется на все стежки шва, уменьшается излишнее сдавление краев раны и, как следствие, снижается их ишемизация.
Преимуществами непрерывного шахматного шва в отличие от классического непрерывного шва являются большие прочностные характеристики благодаря двум линиям фиксации с каждой стороны от разреза, что уменьшает вероятность разволокнения апоневроза и более равномерно распределяет нагрузку на него. Данный шов накладывается с чередованием малых и больших стежков. Расстояние между стежками составляет 0,5 см, от края раны при малых стежках — 0,5 см, при больших — 1 см.

Для организации процесса обучения данной методике разработан и запатентован медицинский тренажер для обучения технике ушивания лапаротомной раны (патент РФ на полезную модель № 181388) (рис. 2). Рис. 2. Медицинский тренажер для обучения технике ушивания лапаротомной раны.
В зажимы тренажера закрепляют импровизированный апоневроз с нанесенными на него метками, располагающимися на расстояниях, соответствующих расстояниям между стежками при наложении укрепляющего и непрерывного шахматного швов. Материал ушивают на расстоянии 18 см. С целью определения обучаемости способу ушивания апоневроза в процессе мануальной отработки навыка привлечены три группы: 1-я — 22 студента III курса, не имеющих общехирургических навыков; 2-я — 12 клинических ординаторов, обучающихся по специальности «Хирургия», имеющих начальные общехирургические навыки; 3-я — 12 врачей-хирургов первой и высшей квалификационных категорий, владеющих навыком лапарорафии на высоком уровне. Проведена оценка обучаемости методике путем сравнения времени ушивания апоневроза предлагаемым способом и классическими отдельными узловыми швами на протяжении всего цикла обучения. Расстояние между узловыми швами, как и между стежками шахматного, составило 5 мм.
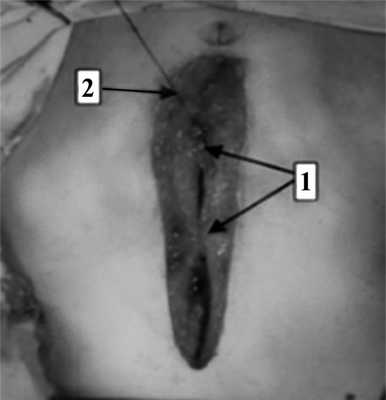
На следующем этапе, после проведения обучения, новый способ лапарорафии внедрили в клиническую практику (рис. 3). Рис. 3. Ушивание лапаротомной раны (интраоперационная фотография). 1 — наложены укрепляющие швы; 2 — наложение непрерывного шахматного шва.
Проспективно обследованы 130 больных, прооперированных в экстренном порядке на органах брюшной полости с использованием срединного лапаротомного доступа. В основную группу вошли 70 пациентов (32 (46%) мужчины и 38 (54%) женщин) в возрасте от 31 года до 94 лет (средний возраст 66,5±13,2 года), которым белую линию живота ушивали разработанным способом. По поводу аппендицита с перитонитом оперированы 9 (13%) больных, кишечной непроходимости — 15 (21%), перфоративной язвы желудка — 11 (16%), калькулезного гангренозного холецистита — 7 (10%), опухоли толстой кишки — 13 (18%), холедохолитиаза — 11 (16%), открытой травмы живота — 4 (6%). Пациентам контрольной группы (n=60) апоневроз ушивали отдельными узловыми швами. Больные были репрезентативны по возрасту, полу, основным и сопутствующим заболеваниям.
При сравнении исследуемых групп применялся критерий t-Стьюдента. Для корреляционного анализа использовали ранговую корреляцию Спирмена. Достоверность результатов оценивали положительно при p
Результаты
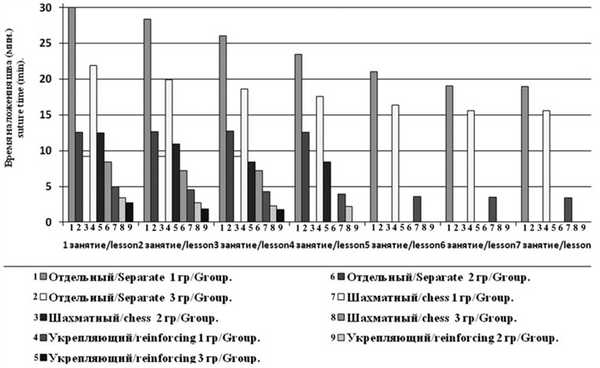
В группе студентов на 1-м занятии время наложения отдельного шва составило 24,1—36,2 мин (в среднем 30,6±1,82 мин), непрерывного шахматного — 17,1—28,1 мин (в среднем 21,8±2,7 мин), двух укрепляющих швов — 4,1—5,9 мин (в среднем 4,9±0,5 мин). При последующих занятиях отмечено ускорение процесса ушивания. К 7-му занятию отработка навыка подошла к концу, так как результаты данного занятия и результаты 6-го занятия достоверно не различались: время наложения отдельного шва от 16,9 до 25,5 мин (в среднем 18,9±2,3 мин) (t=0,326; р<0,05), непрерывного шахматного — от 12,8 до 19,1 мин (в среднем 15,5±1,3 мин) (t=2,571; р <0,05), двух укрепляющих — от 2,7 до 4,1 мин (в среднем 3,4±0,4 мин) (t=0,125;р <0,05) (рис. 4). Рис. 4. Динамика времени ушивания лапаротомной раны в группе студентов.
Во 2-й группе на 1-м и последующих занятиях скорость наложения отдельного узлового шва достоверно не изменялась и составила 11,2—14,1 мин (в среднем 12,6±0,8 мин), что связано с отработкой навыка ранее. А вот динамика обучения другим видам шва была более интенсивной. Для обучения ординаторов понадобилось 4 подхода к отработке навыка. Время наложения непрерывного шахматного шва на 1-м занятии составило 11,4—13,5 мин (в среднем 12,4±0,7 мин), а к последующим занятиям оно уменьшилось до 7,9—9,2 мин (в среднем 8,3±0,5 мин) (t=1,294; р<0,05). Такая же тенденция наблюдалась и с укрепляющими швами. Время при первом освоении навыка 2,9—4,1 мин (в среднем 3,4±0,4 мин), к последнему занятию 1,9—2,5 мин (в среднем 2,1±0,3 мин) (t=0,344; р<0,05).
В группе врачей время наложения отдельных узловых швов на 1-м занятии составило 7,8—9,6 мин (в среднем 9,1±0,5 мин) и достоверно не изменялось и при 2-м (t=0,518; р>0,05) и 3-м (t=1,325; р>0,05) подходе, поскольку в повседневной практике они используют этот способ ушивания. С непрерывным шахматным швом установлена такая же тенденция, как и в группе ординаторов. К 1-му занятию время манипуляции составило 7,8—9,1 мин (в среднем 8,2± 0,4 мин) с тенденцией к ускорению наложения шва на 3-м занятии — 6,6 до 8,2 мин (в среднем 7,2±0,4 мин) (t=2,163; р>0,05). Время наложения укрепляющих швов на 1-м занятии 2,1—3,1 мин (в среднем 2,7±0,4 мин), к 3-му — 1,4—2,1 мин (в среднем 1,7±0,23 мин) (t=0,378; р>0,05).
Таким образом, степень обучаемости новой технике лапарорафии зависит от уровня подготовки обучаемого (r=-0,737, р=0,004). Так, у студентов динамика уровня освоения навыка была одинаковой как в случае распространенного в хирургической практике отдельного узлового шва, так и предлагаемого способа ушивания. У ординаторов и врачей обучаемость отдельному узловому шву не прослеживалась, так как они уже владели этим навыком, хотя время наложения данного шва было меньше в группе врачей, что связано с их более высокой квалификацией и опытом. При освоении ушивания апоневроза новым способом в обеих группах отмечалась тенденция к уменьшению времени наложения швов, различия отмечены лишь во времени, затраченном на освоение манипуляции в пользу 3-й группы.
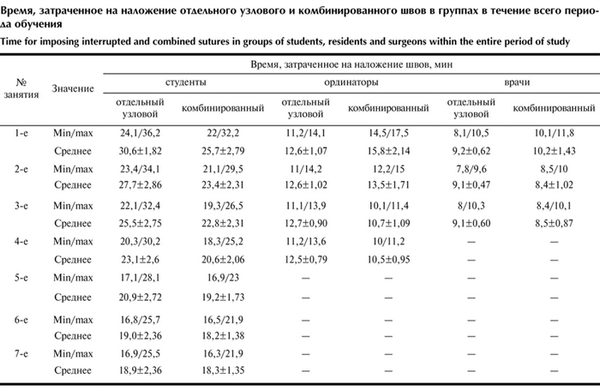
Немаловажно, что в результате обучения время наложения отдельных узловых швов и восстановления апоневроза предлагаемым способом (сумма времени наложения шахматного и укрепляющих швов) в 1-й группе составило в среднем 18,9±2,36 и 18,3±1,35 мин, во 2-й группе — 12,5±0,79 и 10,5±0,95 мин, в 3-й группе — 9,1±0,6 и 8,5±0,87 мин. Предлагаемый способ по временны́м характеристикам не противоречит узловой лапарорафии (см. таблицу). Время, затраченное на наложение отдельного узлового и комбинированного швов в группах в течение всего периода обучения
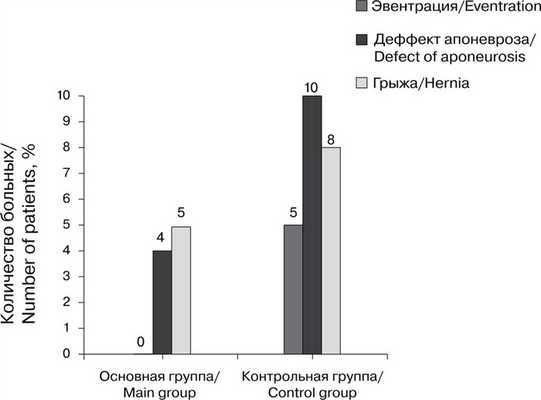
При сравнении способов ушивания в клинике в раннем послеоперационном периоде в контрольной группе выявлены эвентрации у 3 (5%) больных, а через год наблюдения — дефекты апоневроза у 6 (10%) больных и ПОВГ у 5 (8%). В основной группе эвентрации не было, дефекты апоневроза установлены у 2 (3%) больных, ПОВГ — у 3 (5%). Дефекты апоневроза выявляли путем УЗИ (рис. 5). Рис. 5. Осложнения в основной и контрольной группах больных.
Таким образом, представленная модель и этапность внедрения нового способа ушивания апоневроза после лапаротомии позволили не только изменить взгляд на лапарорафию, но и снизить частоту развития послеоперационной вентральной грыжи и эвентрации в ургентной хирургии. Предлагаемый способ ушивания апоневроза после лапаротомии по временно́му параметру не отличается от классической узловой лапарорафии. Внедрению в практику непрерывного, в том числе и шахматного укрепляющего, шва должно предшествовать цикло-вое обучение независимо от квалификации хи-рурга.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Шов кожи с точки зрения общего хирурга
Ни для кого не секрет, что весьма нередко наши пациенты качество работы хирурга, даже после сложнейших полостных вмешательств, оценивают по внешнему виду кожного рубца. Да, мы не занимаемся эстетической хирургией - «хирургией удовольствия», мы возвращаем людям здоровье и, нередко, жизнь. Однако, расхожей фразы о том, что «потеряв голову по волосам не плачут» для сегодняшних чрезмерно требовательных пациентов часто недостаточно для объяснения появления грубого деформированного рубца на брюшной стенке. А такие случаи, как мы знаем, не редкость. Безусловно, часть ран заживает вторичным натяжением. Но это составляет не более 10% от всех лапаротомий. В чем же дело? Может быть в том, что кожному шву в конце операции мы уделяем значительно меньше внимания, чем он того заслуживает. Или вообще поручаем его наложение начинающим хирургам: где же им еще учиться работе с тканью и иглой. Самое интересное заключается в том, что по мнению коллег - пластических хирургов кожа является очень «благодарной» тканью, чье заживление нарушается лишь при очень грубых ошибках хирургической техники.
Под нарушением репаративных процессов в коже понимают не столько ее расхождение после снятия швов (это - легко устранимая проблема), сколько возникновение гипертрофических рубцов.
Гипертрофические рубцы состоят из плотной фиброзной ткани в зоне повреждённой кожи. Они формируются при избыточном синтезе коллагена. Рубцы обычно грубые, тугие, возвышаются над поверхностью кожи, имеют красноватый оттенок, отличаются повышенной чувствительностью и болезненностью, часто вызывают зуд. Гипертрофические рубцы разделяют на две основные категории.
1. Обычный гипертрофический рубец соответствует границам предшествующей раны и никогда не распространяется за пределы зоны повреждения. В развитии гипертрофических рубцов ведущую роль играют следующие факторы: большие размеры заживающего раневого дефекта, ишемизация кожи в зоне шва, длительное заживление и постоянная травматизация рубца. Через 6-12 месяцев рубец обычно стабилизируется, приобретает чёткие очертания, отграничиваясь от атрофической части рубца и неповреждённой кожи, несколько уменьшается и размягчается.
2. Келоид — рубец, внедряющийся в окружающие нормальные ткани, до этого не вовлечённые в раневой процесс. В отличие от гипертрофических рубцов келоиды нередко образуется на функционально малоактивных участках. Его рост обычно начинается через 1-3 мес после эпителизации раны. Рубец продолжает увеличиваться даже через 6 мес и обычно не уменьшается и не размягчается. Типично отсутствие параллелизма между тяжестью травмы и выраженностью келоидных рубцов, они могут возникать даже после незначительных повреждений (укол, укус насекомого) и часто после ожога IIIА степени. Стабилизация состояния келоидного рубца обычно наступает через 2 года после его появления. Характерно, что келоидные рубцы практически никогда не изъязвляются.
Патогенез келоидов неизвестен. Некоторые авторы расценивают их как доброкачественные опухоли. По-видимому, наиболее правильно представление о том, что образование келоидов обусловлено нарушением развития соединительной ткани. Возможна аутоагрессия вследствие избыточного содержания в тканях биологически активных веществ. Не исключена роль эндокринных нарушений, индивидуальная предрасположенность к развитию келоидов, преобладание среди имеющих такие рубцы пациентов молодого и среднего возраста.
Гипертрофические рубцы с трудом поддаются лечению. Иссечение рубца может привести к его повторному развитию. Инъекции стероидов в область рубца (и/или их инъекции вслед за его иссечением), а также близкофокусная лучевая терапия могут предотвратить повторное развитие рубца.
Мы ни в коем случае не призываем к приданию чрезмерной важности эстетическим аспектам кожного шва на лапаротомной ране - основное поле деятельности и проявления мастерства абдоминальных хирургов скрыто от посторонних глаз. Однако, кроме «субстрата косметического эффекта», кожа является еще и частью операционной раны передней брюшной стенки, что требует не меньшей тщательности в формировании кожных швов, чем при ушивании апоневроза. Тем более, что кожный шов не требует неких невероятно сложных технических и временных затрат (как об этом слишком часто говорят в специализированных учреждениях…).
При формировании кожного шва следует:
- придерживаться прецизионной техники с точным сопоставлением эпидермального и дермального слоев;
- стремиться к эвертированию краев кожи; инвертирование (вворачивание краев кожи внутрь раны) недопустимо;
- использовать минимально травматичный шовный материал (монофиламентные или комплексные нити размерами 3/0-0 на атравматичной режущей или обратно-режущей игле в ½ окружности) ;
- использовать атравматичные пинцеты или однозубые крючки для тракции кожи;
- избегать натяжения кожи нитью (только аппозиция и иммобилизация) ;
- ликвидировать полости и карманы в подкожно-жировом слое;
- формировать шов таким образом, чтобы каждая нить проходила через кожу только однажды, сводя к минимуму перекрестное инфицирование вдоль всей линии швов;
- использовать съемные или абсорбируемые нити;
- не препятствовать естественному дренированию раны в первые два-три дня послеоперационного периода;
- оставлять в ране минимально возможное количество шовного материала.
Следует заметить, что наличие некоего специального «косметического шва» - это всего лишь расхожее заблуждение. Любой кожный шов, отвечающий вышеприведенным требованиям в полной мере может считаться косметическим. В настоящее время для ушивания раны кожи наиболее распространены несколько видов швов.
Простой узловой шов - одиночный шов, накладываемый в вертикальной плоскости, наиболее распространен для аппозиции и иммобилизации краев кожной раны, благодаря простоте наложения, гемостатическому эффекту, возможности хорошей адаптации краев раны.
К нюансам формирования простого узлового шва кожи относят следующие обязательные к выполнению технические моменты:
- вкол и выкол производятся строго перпендикулярно поверхности кожи;
- вкол и выкол должны находиться строго на одной линии, перпендикулярной длиннику раны;
- расстояние от края раны до места вкола должно составлять 0, 5-1 см, что зависит от глубины раны и выраженности клетчаточного слоя;
- нить проводится с захватом краев, стенок и, обязательно, дна раны для предотвращения формирования полостей в ране;
- при значительной глубине раны и невозможности наложения отдельного шва на подкожную клетчатку следует использовать многостежковые швы (например, шов Стручкова) ;
- расстояние между швами на коже передней брюшной стенки должно составлять 1-1, 5 см; более частые стежки приводят к нарушению микроциркуляции, более редки - к появлению диастаза краев раны;
- во избежание микроциркуляторных нарушений и неудовлетворительного косметического эффекта (поперечные линии на рубце) затягивание шва не должно быть чрезмерным, с образованием выраженного «валика» над кожей, нить должна обеспечивать лишь плотное сопоставление слоев кожи;
- сформированный узел должен находиться сбоку от линии ушитой раны, но не на ней.
Шов Мак Миллена-Донати (McMillen-Donati) - одиночный вертикальный П-образный узловой шов с массивным захватом подлежащих тканей и целенаправленной адаптацией краев раны. Эффективно применяется при ушивании глубоких ран с большим диастазом краев. Накладывается с помощью большой режущей иглы. Вкол производят на расстоянии 2 и более см от края раны, далее вкалывают так, чтобы захватить как можно больше и проводят до дна раны, где поворачивают иглу в направлении к срединной линии раны и выкалывают в самой ее глубокой точке. Затем на стороне выкалывания, по ходу стяжка, в нескольким мм от края раны иглу вновь вкалывают и выводят в толщу дермы на противоположной стороне, иглу таким же образом проводят в обратном направлении. При затягивании узла однородные ткани сопоставляются. К недостаткам шва следует отнести неудовлетворительный косметический результат вследствие образования грубых поперечных полос.
Несколько видоизмененным вариантом шва Мак Миллена-Донати является шов по Алльговеру (Allgower), отличающийся тем, что нить не проводится через поверхность кожи с контралатеральной стороны. Одиночные узловые швы кожи имеют как преимущества, так и недостатки. К преимуществам одиночных узловых швов следует отнести их относительную простоту и малые временные затраты для их наложения, наличие естественного дренирования полости ушитой раны в первые дни послеоперационного периода через промежутки между швами, возможность ограниченного раскрытия раны при снятии одного или нескольких швов. К недостаткам одиночных швов относится недостаточный косметический эффект при их использовании, даже при условии технически правильного их формирования. Дело в том, что одиночные швы - съемные, а для правильного формирования рубца необходима иммобилизация краев кожной раны максимально долгое время. Кроме того, при формировании отдельных швов неизбежно появление поперечных полос или рубцов в точках вкола-выкола иглы. Исходя из требований к косметическому эффекту, J. Chassaignac и W. Halstedt предложили формирование непрерывного внутрикожного шва на всю длину раны.
Шов Шассеньяка-Холстеда (Chassaignac-Halsted) - непрерывный внутренний адаптирующий. Шовная нить проходит в толще дермы, в плоскости, параллельной поверхности кожи. Иглу вкалывают на одной стороне разреза, проводя ее только интрадермально. После этого переходят на другую сторону разреза. С обеих сторон в шов захватывают одинаковое количество дермы (0, 5 - 1 см). По сути этот шов - непрерывный горизонтальный П-образный. В конце шва иглу выкалывают на коже, отступив от угла раны 1см. Нить фиксируется либо узлами непосредственно над раной, либо специальными якорными устройствами.
Формирование шва Холстеда обеспечивает полную адаптацию эпидермального и дермального слоев кожи и, соответственно, наилучший косметический эффект. При форимровании этого шва требуются особенно тщательный гемостаз, предварительная ликвидация остаточной полости ушиванием подкожной клетчатки и отсутствие натяжения кожи. В случае большой протяженности раны (свыше 8 см) теоретически могут возникнуть затруднения при извлечении длинной неабсорбируемой нити, поэтому при наложении такого шва рекомендуется через каждые 8 см осуществлять выкол на поверхности кожи, чтобы иметь возможность впоследствии удалить нити частями.
Как уже было отмечено, непременным условием применения непрерывного внутрикожного шва является тщательное сопоставление покожно-жировой клетчатки. Помимо гемостатического эффекта и профилактики остаточных полостей ушивание клетчатки способствует сведению краев кожной раны и обеспечивает возможность наложения кожного шва без натяжения. В этой связи J. Zoltan предложил усовершенствованный вариант внутрикожного шва.
Шов Холстеда-Золтана (Halsted - Zoltan) - двурядный непрерывный. Первый ряд накладывают приблизительно посредине подкожной основы, второй - внутрикожно. Первый укол иглы производят вблизи конца раны, на расстоянии 2 см от одного из краев. Затем иглу вкалывают и выкалывают поочередно в одной и другой стенке раны, проводя ее только по посредине толщины подкожной клетчатки в горизонтальной плоскости (непрерывный П-образный шов). Закончив формирование глубокого ряда шва, нить выводят на поверхность кожи. Оба конца нити натягивают, сближая таким образом края раны. Для формирования второго ряда кончик иглы выводят в дерму. Продолжают шить таким образом, чтобы точки вкола и выкола распологались симметрично относительно линии разреза, как при обычном шве Холстеда. До завершения наложения поверхностного шва нити удерживают натянутыми, затем формируют узел, связывая концы нитей на коже.
Непременным условием формирования непрерывного внутрикожного шва является использование только монофиламентной нити размером 3/0 - 2/0 на режущей или, лучше, обратно-режущей игле. Вопрос о предпочтении использования для непрерывного внутрикожного шва абсорбируемой (несъемной) или неабсорбируемой (съемной) монофиламентной нити на сегодняшний день остается открытым: часть хирургов остается убежденными сторонниками Prolene, другая же часть неизменно применяет Monocryl.
Для достижения наилучшего косметического эффекта, во многом связанного с травматизацией кожи при проведении нити, применяются комбинированные методики закрытия кожной раны. В последнее время все большей популярностью пользуется метод, включающий в себя в качестве одного из компонентов, использование клеевой аппликации для иммобилизации кожи после сведения и защиты раны от воздействия внешней среды. При этом в качестве средства иммобилизации и защиты применяется Dermabond - медицинский клей, имеющий в своей основе 2-окинцианокрилат и фиолетовый краситель для контрастирования с кожным покровом. После нанесения на кожу Dermabond вследствие контакта с воздухом в течение 30-60 секунд переходит из жидкой фазы в фазу упруго-эластического геля с исключительно прочной адгезией к кожным покровам. При этом на коже формируется прочная пленка, предотвращающая диастаз краев раны и защищающая края и стенки раны от контаминации микроорганизмами (использование клея исключает необходимость применения асептических повязок на послеоперационную рану). Dermabond обеспечивает иммобилизацию краев кожной раны на срок до 7-8 суток и по прошествии этого времени самостоятельно фрагментируется и удаляется с кожи. Обязательными условиями применения клея Dermabond являются тщательный гемостаз и плотное сведение краев раны швом подкожной клетчатки: возможно применение непрерывного шва или отдельных швов абсорбируемым материалом. Именно поэтому данный метод закрытия кожной раны является комбинированным - шовным и клеевым. Можно полагать, что внедрение в клиническую практику соединения краев кожной раны с помощью клеевой аппликации само по себе указывает на направление эволюции методов соединения тканей в хирургии: от нити к полимерным адгезирующим материалам.
Швы на апоневроз
Края апоневроза могут быть соединены следующими способами:
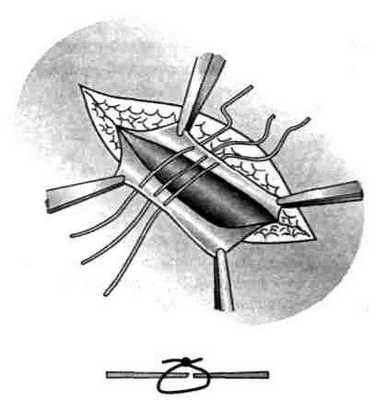
1) с помощью краевого шва (рис. 34);
2) «внахлест» (рис. 35);
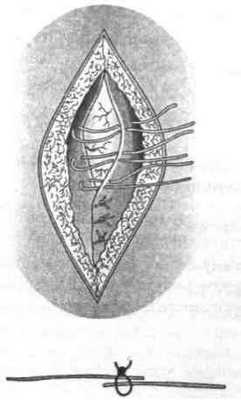
3) с образованием дубликатуры (рис. 36).
Условия, необходимые для наложения швов на апоневроз
1. Сохранение переднего и заднего листков фасции, покрывающей соответствующие поверхности апоневроза. Скрепляя его волокна между собой, фасциальные пластинки играют «цементирующую» роль. После их удаления значительно снижается эластичность и прочность апоневроза (в частности, апоневрозов широких мышц живота, широчайшей мышцы спины, большой приводящей мышцы и др.).
2. Хороший обзор поверхностей соединяемого апоневроза для исключения повреждения глубжележащих сосудов и нервов.
Для хорошего доступа к поверхности апоневроза следует использовать классическую технику работы с желобоватым зондом и скальпелем. При выделении апоневроза тупым способом рекомендуется применение края тупфера или марлевого шарика.
Для предупреждения нарушения кровоснабжения апоневроза не следует отслаивать ткани на значительной его площади. В то же время недостаточное отделение тканей от поверхности апоневроза может способствовать увеличению напряжения краев раны и прорезыванию швов.
Требования к швам, накладываемым на апоневроз
1. Простота и надежность.
2. Исключение разволокнения.
3. Обеспечение максимальной прочности соединения.
4. Механическое скрепление краев апоневроза на время, достаточное для образования прочного соединительнотканного рубца.
Варианты кругового шва, накладываемого на апоневроз
1. Узловые круговые швы, наложенные нерассасывающимся материалом на расстоянии 5-7 мм друг от друга.
Узловые круговые швы, расположенные поперечно по отношению к направлению апоневротических волокон, могут при затягивании привести к их разволокнению, надрыву и даже отрыву. Поэтому необходимо места вкола и выкола иглы располагать не линейно-упорядоченно, а «хаотично», исключая возможность такого осложнения (рис. 37).
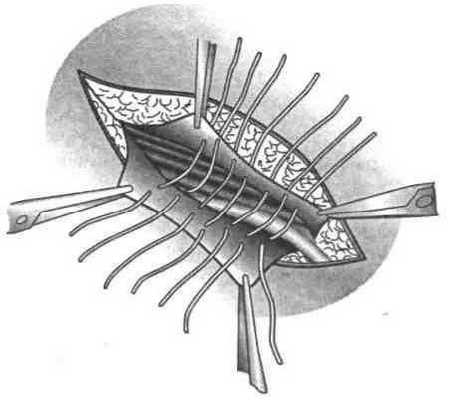
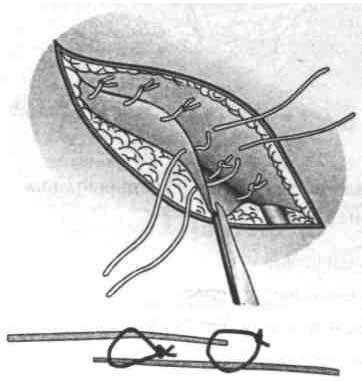
2. Использование П-образных швов наиболее рационально, так как ими захватывают участок тканей большой площади. В результате увеличивается площадь непосредственного контакта соединяемых тканей и соответственно уменьшается натяжение на каждую единицу этой площади (рис. 38).
Для повышения прочности П-образных швов используют следующие приемы:
швы должны быть ориентированы под некоторым углом по отношению к ходу волокон апоневроза;
для предотвращения возможности разволокнения апоневроза швы накладывают не по одной линии, а беспорядочно (хаотично).
При выполнении шва через «подвернутый» апоневроз наружной косой мышцы живота (паховую связку) необходимо учитывать, что под ней на границе медиальной и средней третей длины проходят бедренные сосуды — артерия и вена.
Грубое прошивание пупартовой связки может привести к повреждению стенок этих сосудов с развитием кровотечения. Поэтому при наложении шва игла должна просвечивать через апоневротические волокна. Это свидетельствует о поверхностном проведении нитей и служит критерием правильности наложения шва.
3. Края рассеченного апоневроза могут быть соединены с помощью непрерывного обвивного шва.
Однако применение такого варианта с большой степенью вероятности может привести к формированию грубого послеоперационного рубца.
При соединении краев апоневроза «внахлест» могут быть использованы узловые круговые или П-образные швы по ранее сформулированным правилам.
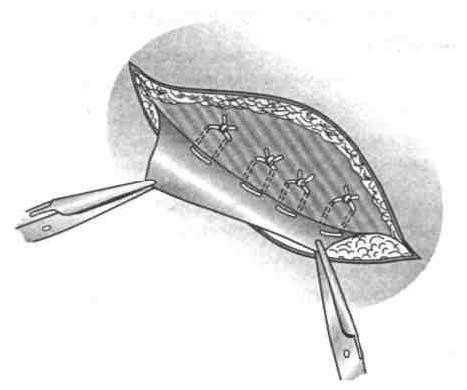
Формирование дубликатуры из апоневроза производят обычно двухрядным узловым круговым швом (рис. 39).
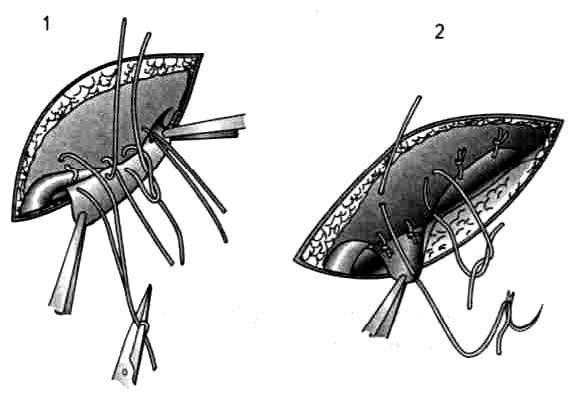
Рис. 39. Этапы формирования дубликатуры апоневроза наружной косой мышцы живота при укреплении передней стенки пахового канала по способу Мартынова:
1 — наложение швов первого ряда; 2 — швы второго ряда.
Апоневротические швы. Техника наложения швов на апоневроз.
Кафедра общей хирургии ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава РФ, Рязань, Россия
ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Рязань, Россия
Сравнительный анализ способов ушивания лапаротомной раны
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(6): 37‑40
Цель исследования — оценка способов ушивания апоневроза после лапаротомии в эксперименте. Материал и методы. Проведено экспериментальное исследование на лабораторных животных. Всем выполняли лапаротомию, ушивание апоневроза отдельным, непрерывным швом и непрерывным швом с расположением стежков на разном уровне. На 7, 14, 60-е сутки проводили тензиометрическое исследование участков ткани вместе со швами с последующим гистологическим исследованием. Результаты. Отмечена взаимосвязь способа ушивания апоневроза и показателей прочности, эластичности, течения раневого процесса. Вывод. Ушивание лапаротомной раны непрерывным швом по сравнению с отдельным способствует образованию более зрелой грануляционной ткани и формированию в дальнейшем более прочного рубца с низким показателем эластичности.
Проблема послеоперационной вентральной грыжи (ПОВГ) на сегодняшний день весьма актуальна [1, 3, 5—9].
Операции, выполняемые из срединного лапаротомного доступа, сопровождаются развитием ПОВГ в 7—24% наблюдений [3, 5, 7, 9]. По нашим данным, ПОВГ образуется в течение первого года у 17% больных [5]. Важным направлением предупреждения развития ПОВГ является применение правильной техники ушивания тканей передней брюшной стенки после лапаротомии [2—4, 10, 11].
Среди сформулированных еще в начале ХХ века требований выделяют необходимость прочного соединения краев дефекта брюшной стенки с минимальными натяжением и травматизацией прямых мышц живота и окружающей подкожной жировой клетчатки. Швы также должны противостоять повышенному внутрибрюшному давлению, что весьма актуально в ургентной хирургии, и напряжению мышц передней брюшной стенки на протяжении всего периода раневого процесса, вплоть до окончания реорганизации рубца. В связи с этим важным принципом является выполнение пластики без натяжения тканей с учетом равномерной нагрузки на шов, несоблюдение этих правил ведет к прорезыванию швов, нарушению микроциркуляции в тканях и их трофику, способствует возникновению послеоперационной грыжи передней брюшной стенки и эвентрации [2, 4, 6, 10—12].
Цель исследования — оценка различных способов ушивания апоневроза после лапаротомии в эксперименте.
В эксперименте использовано 36 половозрелых белых крыс массой тела 220—300 г. Животных содержали в стандартных условиях вивария со свободным доступом к пище и воде. Всем животным в асептических условиях производили срединную лапаротомию с последующим ушиванием раны. С учетом способа ушивания крысы разделены на три группы. В 1-ю группу вошли 12 животных, которым апоневроз ушивали отдельными узловыми швами с шагом 4—5 мм, расстояние от края раны 4—5 мм. Во 2-й группе, включающей 12 особей, применяли непрерывный шов с аналогичным шагом и расстоянием от края раны. В 3-й группе (12 животных) белую линию ушивали непрерывным швом с расположением стежков на разном уровне. Расстояние от большого стежка до края раны составило 6 мм, от малого — 3 мм. Промежутки между стежками составляли 4—5 мм. Для наложения швов использовали монофиламентную нить Prolen 3/0. Кожную рану ушивали лавсаном. На 7, 14 и 60-е сутки участки апоневроза с мышечной тканью размером 2×3 см с исследуемыми швами в каждой группе были иссечены. Эти животные выведены из эксперимента.
Тензиометрическое исследование полученного материала проводили не электронном динамометре АЦД/1Р-0,1/1И-2 (НПО «Мега Тонн Электронные Динамометры», Санкт-Петербург). Для этого участки ушитого апоневроза закрепляли в разрывном устройстве прибора при расстоянии между зажимами 1 см, подвергая деформации. С помощью динамометра измеряли прочность в Ньютонах (Н). Эластичность (Е) определяли в процентах по формуле:
где Lконеч. — конечная длина апоневроза с исследуемыми швами при его разрыве, Lначальн. — начальная длина до растяжения.
Проводили гистологическое исследование оставшихся участков апоневроза вместе со швами. Оценивали площадь клеточного инфильтрата, площадь очагов некроза, площадь новообразованных сосудов, активность ангиогенеза, степень зрелости грануляционной ткани.
Результаты и обсуждение
Тензиометрическое исследование показало, что на 7-е сутки прочность отдельного узлового шва составила от 2,7 до 5,8 Н (в среднем 3,94±0,9 Н), непрерывного шва — от 4,2 до 8,3 Н (в среднем 6,05±1,15 Н), непрерывного шва с расположением стежков на разном уровне — от 5,4 до 9,1 Н (в среднем 7,2±1,45 Н). К 14-м суткам наблюдалось увеличение прочности всех исследуемых швов. Показатель прочности отдельного узлового шва был от 11,7 до 16,6 Н (в среднем 13,9±1,7 Н), в случае непрерывного шва — от 13,7 до 20,5 Н (в среднем 17,3±2,2 Н), непрерывного шва с расположением стежков на разном уровне — от 19,1 до 24,5 Н (в среднем 21,35±1,57 Н). На 60-е сутки прочность отдельного узлового шва составляла от 31,3 до 50,2 Н (в среднем 43,8±6,2 Н), в случае обвивного шва — от 44,1 до 68,6 Н (в среднем 54,8±7,1 Н), непрерывного шва с расположением стежков на разном уровне — от 45,2 до 67,3 Н (в среднем 55,1±7,6 Н) (рис. 1).
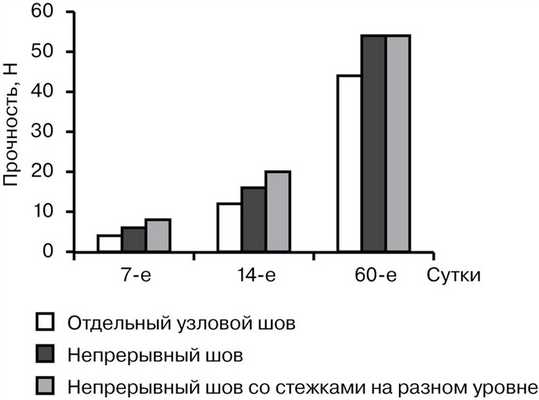
Рис. 1. Сравнительная характеристика прочности швов.
Таким образом, наименьшей оказалась прочность отдельного узлового шва во все сроки наблюдения. Непрерывный шов с расположением стежков на разном уровне превосходил по прочности классический непрерывный шов при их анализе на 7-е и 14-е сутки на 16 и 19% соответственно. К 60-м суткам прочностные характеристики непрерывного шва и непрерывного шва с расположением стежков на разном уровне были практически одинаковыми. Эластичность швов находилась в обратной зависимости от прочности, т. е. с увеличением прочности эластичность уменьшалась. При этом эластичность была наибольшей в случае отдельного шва (от 172,2 до 85,64%) и наименьшей при растяжении непрерывного шва с расположением стежков на разном уровне (от 155,5 до 61,2%) (рис. 2).
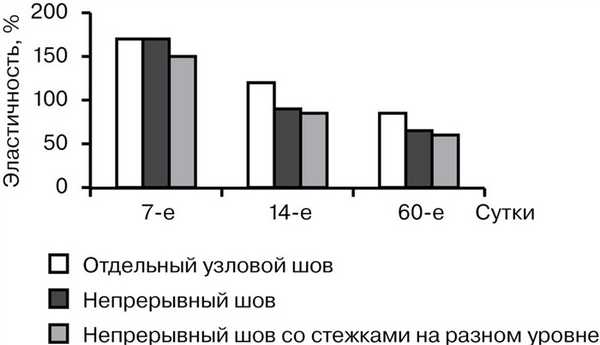
Рис. 2. Сравнительная характеристика эластичности швов.
При гистологическом исследовании на 7-е и 14-е сутки площадь клеточного инфильтрата достоверно была больше в случае отдельного шва (рис. 3).
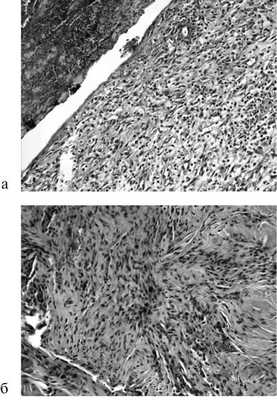
Рис. 3. Микрофотография отдельного шва на 7-е (а) и 14-е (б) сутки. Окраска гематоксилином и эозином. Ув. 200.
В группах, в которых использовали непрерывный шов, в случае расположения стежков на разном уровне инфильтрация была меньше, чем при обычном непрерывном шве. Очаги некроза отсутствовали в группах с непрерывным швом и присутствовали небольшой площадью или отсутствовали в случае с отдельным швом. Неоангиогенез с большей площадью новообразованных сосудов преобладал в случае применения непрерывного шва (рис. 4).
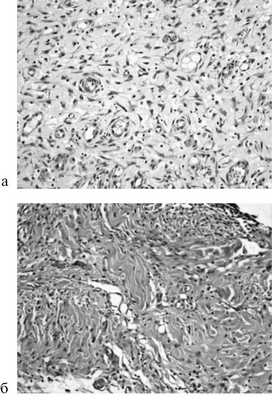
Рис. 4. Микрофотография непрерывного шва (а) и непрерывного шва с расположением стежков на разном уровне (б) на 14-е сутки. Окраска гематоксилином и эозином. Ув. 200.
На 7-е сутки степень развития грануляционной ткани была большей при непрерывном шве с расположением стежков на разном уровне, а наименьшей в случае отдельного шва. На 14-е сутки достоверных различий этого критерия в группах отмечено не было. На 60-е сутки во всех группах сформировался зрелый соединительнотканный рубец, при этом отсутствовали очаги некроза, инфильтрация, хотя имелась олеогранулема в случае отдельного шва (рис. 5).
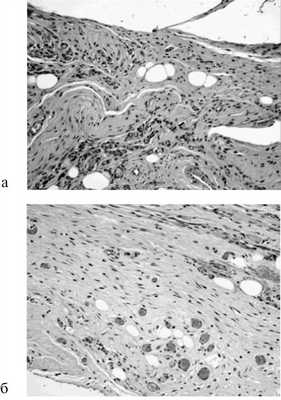
Рис. 5. Микрофотография отдельного шва (а) и непрерывного шва с расположением стежков на разном уровне (б) на 60-е сутки. Окраска гематоксилином и эозином. Ув. 200.
Таким образом, ушивание лапаротомной раны непрерывным швом по сравнению с отдельным швом не вызывает чрезмерного сдавления тканей в местах проколов апоневроза, равномерно распределяя нагрузку по всей длине шва, что проявляется меньшей инфильтрацией тканей, более выраженным неоангиогенезом и формированием зрелой грануляционной ткани.
Образовавшийся после ушивания апоневроза отдельными узловыми швами послеоперационный рубец уступает по прочности (от 20 до 27%) рубцу после непрерывного способа ушивания, отличается более высокой растяжимостью, что является одним из факторов, способствующих образованию послеоперационной грыжи передней брюшной стенки.
Непрерывный шов с расположением стежков на разном уровне в отличие от классического непрерывного ушивания способствует более равномерному распределению нагрузки на края апоневроза, снижая риск его разволокнения, тем самым повышая его прочность до 67,3 Н и снижая эластичность до 61,2%.
Кафедра общей хирургии Кубанского государственного медицинского университета, Краснодарская краевая клиническая больница №1 им. проф. С.В. Очаповского
Кафедра общей хирургии Кубанского государственного медицинского университета, Краснодар
Кафедра общей хирургии Кубанского государственного медицинского университета, Краснодар;
краевая клиническая больница №1 им. проф. С.В. Очаповского, Краснодар
ГБУЗ «НИИ — Краснодарская краевая клиническая больница №1 им. проф. С.В. Очаповского»
МБУЗ «Сочинская городская больница №4»
МБУЗ «Усть-Лабинская ЦРБ» Краснодарского края, Россия
Способы закрытия лапаротомной раны при распространенном перитоните
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(7): 30‑35
Цель — улучшить результаты лечения распространенного перитонита. Материал и методы. Изучены результаты лечения 743 больных с распространенным перитонитом. В зависимости от способов лечения сформированы 2 основные группы и 1 группа сравнения (контроль). Результаты. Использование программированных релапаротомий в сочетании с закрытием лапаротомной раны съемными дренирующими мышечно-апоневротическими швами (СДМАШ) позволило снизить летальность при вторичном и третичном распространенном перитоните с 47,8±2,7 до 24,1±2,3% (p
При непрерывном совершенствовании способов хирургического лечения распространенного вторичного перитонита, осложненного абдоминальным сепсисом (АС), послеоперационная летальность остается в пределах 25—30% и в последние годы не проявляет тенденции к снижению. После вынужденных релапаротомий при третичном перитоните летальность возрастает до 50—60% и более [2, 5, 6, 19, 20]. Cпособы закрытия брюшной полости и методика шва лапаротомной раны при перитоните изучены недостаточно, однако существует мнение, что при традиционном выполнении этой процедуры интраабдоминальные и раневые осложнения встречаются чаще [6, 10, 11]. Следовательно, поиск путей снижения летальности и частоты операционных осложнений при хирургическом лечении вторичного и третичного распространенного перитонита заслуживает должного внимания.
АС констатировали только у больных в стадии кишечной или полиорганной недостаточности (ПОН) перитонита, факт его возникновения считали доказанным исключительно при развитии синдрома системной воспалительной реакции. При этом температура тела превышает 38 °C и имеется высокий лейкоцитоз со сдвигом влево. Вместе с тем у наиболее тяжелобольных встречаются субфебрилитет и лейкопения, но количество незрелых нейтрофилов всегда достигает или превышает 10%. Появляются одышка, тахикардия, умеренная артериальная гипотензия, тромбоцитопения и снижается оксигенация крови [17, 22]. Перитонит развивался в результате прободений пилородуоденальных и кишечных язв, ободочных дивертикулов, распадающихся опухолей толстой кишки и паратуморозных абсцессов. Реже причиной перитонита являлись травмы внутренних органов живота, некроз кишки при непроходимости, деструктивный холецистит и аппендицит. Особенностью изученного контингента больных было наличие у 52,2% из них самого тяжелого, третичного перитонита, развившегося в результате послеоперационных интраабдоминальных осложнений. Хирургическая тактика и технология закрытия лапаротомной раны определяли принадлежность больных к контрольной группе или к одной из двух основных групп наблюдений.
В контрольную группу вошли 278 больных, оперированных в 1976—1987 гг. В этих наблюдениях из срединного доступа устраняли источник перитонита, выполняли назоинтестинальную интубацию и обильно промывали брюшную полость. После установки 3—5 двухпросветных дренажей апоневротическую рану зашивали обычными узловыми нерассасывающимися швами. Кожные края сближали редкими швами, а при избыточной подкожной клетчатке применяли первично-отсроченный шов. До стабилизации общего состояния больных лечили в отделении реанимации. Большое количество летальных исходов и осложнений (табл. 1 и 2) побудили пересмотреть такую тактику лечения.
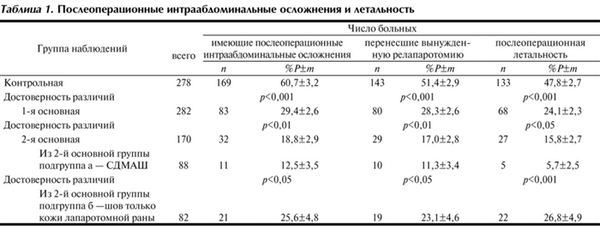
Таблица 1. Послеоперационные интраабдоминальные осложнения и летальность
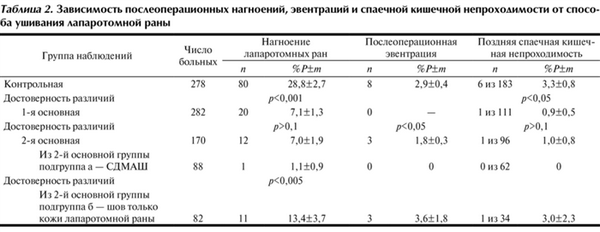
Таблица 2. Зависимость послеоперационных нагноений, эвентраций и спаечной кишечной непроходимости от способа ушивания лапаротомной раны
В 1-й основной группе было 282 больных, леченных в период с 1988 по 2009 г. Отличительной особенностью явилось лечение этих больных с помощью программированных релапаротомий (ПР), входивших в то время в практику [11, 15, 19]. Показаниями к ПР служили вторая и третья стадии распространенного гнойного перитонита, сомнительно жизнеспособные ткани, оставленные в брюшной полости, а также любой герметизирующий шов полых органов, выполненный в условиях перитонита. Во время первой, основной лапаротомии устраняли источник перитонита, тщательно промывали брюшную полость, устанавливали дренажи, но апоневротическую рану не зашивали. Живот временно закрывали редкими кожными швами, а чтобы нити не травмировали кишечные петли, их проводили в толще подкожной клетчатки. Между линией кожного шва и органами живота, вдоль раны, располагали сквозной проточно-аспирационный дренаж (СПАД), предложенный для этой цели Н.Н. Каншиным [10, 11]. Для предотвращения залипания и присасывания трубки СПАД к окружающим органам и тканям ее фиксировали к коже прочным швом в виде нити-поводка длиной 3—4 см, что позволяло ежедневно выполнять продольные и ротационные дозированные перемещения всего дренажа [4, с. 174—179]. Через 48—72 ч под кратковременным наркозом кожные швы снимали, снова промывали брюшную полость и на кожную рану снова накладывали шов с оставлением СПАД. Эту операцию повторяли 3—7 раз через каждые 2—3 дня, пока не восстанавливалась перистальтика и не начинала уменьшаться выраженность признаков острого воспаления брюшины. Количество П.Р. ограничивали 7 процедурами из-за опасности перфорации стрессовых язв тощей кишки. После последней ПР операционную рану окончательно закрывали съемными дренирующими мышечно-апоневротическими швами (СДМАШ; патент № 2143231 от 27.12.99) с оставлением СПАД еще на 2—4 сут. Перитонит поддавался лечению с помощью ПР [11, 19], а СДМАШ и СПАД позволяли предотвратить нагноение раны и эвентрацию [3, 15].
Во 2-ю основную группу вошли 170 больных, оперированных в период с 2010 по 2014 г. с применением ПР по описанной выше методике. Отличие заключалось в выборе способа закрытия лапаротомной раны. Больным, у которых до окончания курса ПР сохранялся синдром абдоминальной гипертензии, рану операционного доступа окончательно закрывали только кожными швами без ушивания апоневроза. Это снижало риск летального исхода, но обрекало больного на образование вентральной грыжи. В случае нормализации внутрибрюшного давления до завершения лечения с помощью ПР рану зашивали послойно, используя СДМАШ.
У 126 больных из обеих основных групп осуществляли цитологический контроль регенерации лапаротомной раны, закрытой СДМАШ. Для этого, выполняя «активацию» на 1, 2, 3 … 7-е сутки после операции, мы аспирировали экссудат из подкожной и предбрюшинной клетчатки, пользуясь шприцем с притупленной иглой. Экссудат наносили на предметные стекла и изготавливали препараты «раневых отпечатков» [8, 14].
Отдельно рассматриваются относящиеся к основным группам наблюдений 13 пациентов с АС, у которых на предшествующих этапах лечения развилась неклостридиальная анаэробная инфекция лапаротомной раны с обширным гнилостным поражением тканей. У этих пациентов ПР производили в сочетании с повторными хирургическими обработками нагноившихся лапаротомных ран. В результате образовались эвентрационные дефекты брюшной стенки площадью более 200 см 2 , препятствующие ушиванию или пластическому закрытию местными тканями. Из этих 13 больных у 9 имела место свободная, нефиксированная эвентрация, лечение ПР завершалось формированием лапаростомы. Для этого к краям раневого дефекта временно подшивали «заплату» из эндопротеза аорты или сетки, применяемой в хирургии. В результате петли кишок прирастали к краям раневого дефекта, благодаря чему эвентрация становилась фиксированной. Через 5—7 дней после последней релапаротомии протез удаляли, а рану обрабатывали пульсирующей струей раствора антисептика [12]. Тотчас после такой деконтаминации на петли кишок, образующие дно эвентрационной раны, трансплантировали расщепленные кожные лоскуты толщиной порядка 0,6 мм с нанесенными редкими перфорационными отверстиями. При указанной толщине дермального слоя под трансплантатами формировался тонкий слой жировой клетчатки, обеспечивающий смещаемость прижившей кожи и препятствующий ее рубцовому прирастанию к кишечным петлям. У 4 больных, поступивших со стихающими клиническими проявлениями перитонита и фиксированной эвентрацией, пересадку кожи выполняли без временного ксенопротезирования дефекта.
Наиболее часто тяжелые осложнения возникали у больных контрольной группы. Прогрессирование перитонита и перфорация стрессовых язв, приводящие к ПОН, стали причиной почти 50% летальности. Вынужденные релапаротомии, травматичные из-за необходимости обширного висцеролиза, усугубляли ССВР [16]. Почти у 1/3 больных лапаротомные раны нагноились, что становилось причиной эвентрации (см. табл. 2).
У больных 1-й основной группы повторные санации брюшной полости во время ПР прерывали экссудативную фазу перитонита и снижали число внутрибрюшинных осложнений, что отмечают и другие авторы [2, 11, 15, 19]. Уменьшилось количество вынужденных релапаратомий, а летальность снизилась в 2 раза (см. табл. 1). Важно, что СДМАШ достоверно способствовали четырехкратному снижению частоты нагноений. Неожиданно выявилась прямая зависимость развития поздней спаечной кишечной непроходимости (СКН) от частоты нагноений лапаротомных ран. В 1-й основной группе поздняя СКН развилась только в 0,9±0,5% наблюдений, в то время как в контрольной группе она выявлена у 3,3±0,8% больных (р<0,05). Помимо этого, выполненное с нашим участием параллельное изучение перитонита у других 545 больных также показало, что и в этой группе наблюдений СДМАШ способствовали снижению частоты нагноений и поздней СКН [15].
Во 2-й основной группе вопрос о показаниях к закрытию лапаротомной раны решался дифференцированно. В последние годы установлено, что при перитоните развивается синдром абдоминальной гипертензии. Он препятствует диафрагмальному дыханию, затрудняет портокавальный кровоток, что способствует развитию ПОН и отягощает прогноз [1, 2]. В связи с этим из 2-й основной группы были выделены две подгруппы больных по признаку наличия или отсутствия у них синдрома абдоминальной гипертензии при выполнении последней ПР.
В подгруппу, а вошли 88 больных, у которых до завершения лечения ПР нормализовалось внутрибрюшное давление, поэтому лапаротомную рану у них ушили СДМАШ. У большинства пациентов этой подгруппы имелась вторая стадия вторичного перитонита, вследствие чего летальность и количество осложнений оказались небольшими.
В подгруппе б у 50 из 82 больных имелся тяжелый третичный перитонит и с помощью ПР не удалось снизить абдоминальную гипертензию, превышающую 20 мм рт.ст. Все это стало причиной некоторого повышения показателей осложнений и летальности по сравнению с таковыми в подгруппе а. Тем не менее у больных 2-й группы в целом летальность оказалась вполне сопоставимой с таковой в 1-й основной группе и во всяком случае не превышала показателей летальности, приводимых авторами, применяющими сложные и не всем доступные методы лечения [2, 6, 19, 20]. Это положительное явление мы склонны считать результатом отказа от шва апоневроза с ушиванием только кожной раны, в результате чего объем брюшной полости увеличивался, что способствовало снижению внутрибрюшного давления. К сожалению, при закрытии лапаротомной раны окончательно и во время ПР у больных подгруппы «б» хирурги стали реже применять СПАД, что несколько увеличило частоту нагноений единственного ряда кожных швов и число эвентраций (см. табл. 2). В целом же во 2-й основной группе по сравнению с 1-й основной группой летальность достоверно снизилась.
Цитологические исследования экссудата операционных ран, выполненные в первые дни после операций у 126 больных обеих основных групп, выявили три типа течения раневого процесса. Первый тип — воспалительно-регенеративный — наблюдался у 94 (74,6±3,8%) больных. Второй тип — воспалительно-дегенеративный — имел место у 26 (20,6±3,6%) пациентов. Третий тип — дегенеративно-некротический — был выявлен только в 6 (4,8±1,7%) наблюдениях. Достоверность различий между числовыми значениями каждого из трех типов течения раневого процесса очень высокая — p
У больных с воспалительно-регенеративным типом раневого процесса в мазках определялись нейтрофильная реакция и активный фагоцитоз. Дегенерация лейкоцитов была редкостью. Спустя 3 сут снизилось количество нейтрофилов и появились фибробласты. У этих больных на 3—4-е сутки исчезли симптомы раневого воспаления и наступило заживление лапаротомных ран первичным натяжением.
У больных с воспалительно-дегенеративным типом эволюции ран при «активации» на 3—4-е сутки выделялся необильный серозно-гнойный или гнойный экссудат, однако инфильтрации в области шва не обнаруживалось. В мазках на 4-е сутки выявлялся максимальный нейтрофилез. Количество бактерий, расположенных внутри- и внеклеточно, было в 2 раза больше, чем в подгруппе «а». Одновременно увеличивалось количество дегенеративно измененных и погибших нейтрофилов, превратившихся в гнойные тельца. После 4—6-го дня по мере исчезновения дегенерации появлялись фибробласты, знаменующие начало регенерации. На 7-е сутки их количество удваивалось. Нейтрофилез прогрессивно снижался и исчезали гнойные тельца. Экссудат при «активации» вновь приобретал серозный характер. У всех 26 больных подгруппы «б» начинающееся нагноение оказалось обратимым и раны зажили по типу первичного натяжения.
Иное течение наблюдалось у 6 больных с цитологией экссудата, характерной для дегенеративно-некротического типа клеточной реакции. Регресса нейтрофилеза у них не наблюдалось. Прогрессировали дегенеративные изменения лейкоцитов и увеличивалось количество гнойных телец, а также содержание клеточного и тканевого детрита. Гистиоциты и макрофаги на 4—5-е сутки исчезали из мазков, а фибробласты не появлялись вообще. При «активации» из раны с 3—5-го дня выделялся гной, количество которого увеличивалось. Пальпаторно в области шва и в глубине раны отмечалась болезненная инфильтрация. У всех больных выявлено клинически значимое нагноение, потребовавшее снятия кожных, а в 4 наблюдениях и апоневротических швов, и выполнения вторичной хирургической обработки раны.
Свободная кожная пластика может стать методом выбора для закрытия больших раневых дефектов брюшной стенки при перитоните. Малое количество наблюдений, недостаточное для построения кривой распределения, не позволяет оценить этот способ лечения с позиций доказательной медицины. Тем не менее из 11 больных, которым пластическое закрытие больших эвентрационных дефектов не производилось, умерли 5 (45,4%). Причиной смерти 3 из 5 пациентов явились несформированные истощающие кишечные свищи, осложнившие эвентрацию. Из 13 аналогичных больных, оперированных методом свободной кожной пластики, умерли от перитонита 3 (23%), но кишечные свищи у них не образовались. В сроки от 3 мес до 8 лет обследованы 6 из 10 выписанных больных. Существенных расстройств пищеварения у них не было, трансплантированная кожа сохраняла ограниченную подвижность по отношению к подлежащим органам брюшной полости, признаки вентральных грыж были выражены неотчетливо. Последнее можно объяснить способностью дермального слоя кожи срастаться с краями апоневротического дефекта и приобретать свойства достаточно прочной опорной структуры [13, 21].
На материале обследования 571 больного выявлена корреляция между балльной оценкой по шкале АРАСНЕ III и исходом лечения больных. Так, у всех умерших экстраполирование усредненной суммы баллов с учетом утроеной стандартной ошибки средней арифметической (±3m) образовало доверительный интервал от 127,8 до 118,2 (M±3m=123,0±4,8). Следовательно, при АС оценка тяжести общего состояния выше 118 баллов оказалась прогностически неблагоприятной. Кроме того, у выздоровевших больных доверительный интервал, вычисленный тем же способом [23], составил от 96,0 до 87,2 балла (M±3m=92,1±3,9). Несовпадение доверительных интервалов балльных оценок умерших и выздоровевших пациентов (p<0,001) свидетельствует о достоверной практической значимости данных шкалы АРАСНЕ III для математического прогнозирования.
Таким образом, преимущество по основным качественным показателям операции, включающей применение программированных релапаротомий и съемных дренирующих мышечно-апоневротических швов, позволяет считать это вмешательство методом выбора для лечения гнойного распространенного перитонита. Предлагаемый способ доступен широкому кругу хирургов, не требует специального оснащения и каких-либо дополнительных затрат. Отказ от шва апоневроза лапаротомной раны для увеличения объема брюшной полости при упорно не снижающейся абдоминальной гипертензии имеет свои основания. Во всяком случае уменьшение частоты летальных исходов в группе наиболее тяжелобольных, оперированных с учетом показателей внутрибрюшного давления, свидетельствует о правомерности избранной тактики, однако при этом возникает потребность в поиске мер профилактики послеоперационной грыжи. Предварительные результаты закрытия больших эвентрационных дефектов брюшной стенки при перитоните путем свободной пересадки расщепленных кожных лоскутов в случае безвыходной ситуации подтверждают целесообразность применения этого способа лечения. Балльная оценка общего состояния больных с распространенным перитонитом по шкале АРАСНЕ III имеет достоверное прогностическое значение.
Читайте также:
- Случай симптоматического злоупотребления алкоголем на фоне тревожно-депрессивного расстройства
- Советы молодому хирургу
- Синдром Фрейнда (Freund)
- Техника, этапы операции ревизионного тотального эндопротезирования локтевого сустава
- Интраоперационная эндоскопия при желудочно-кишечном кровотечении. Выбор хирургической тактики при желудочно-кишечном кровотечении.
