Артерии внутренних органов эмбриона. Формирование артерий внутренних органов плода
Добавил пользователь Morpheus Обновлено: 22.01.2026
Это — естественные шунты, «шунты во спасение» растущего плода. Без них плод оказывается нежизнеспособным, а при их преждевременном закрытии возникают тяжелейшие врожденные пороки. В хирургии врожденных пороков сердца искусственное (временное или постоянное) создание таких шунтов является одним из широко применяющихся способов лечения. Но об этом — позже.
Сброс слева направо
Когда определенный объем крови с каждым сокращением отклоняется от нормального пути и уходит из левых отделов в правые, то, естественно, возникают две проблемы: недостаток крови в большом круге и — переполнение круга малого. Большой круг при этом не страдает: быстро включаются сложные механизмы компенсации. А вот малому кругу приходится тяжелее.
Сброс справа налево и цианоз
После рождения ребенка сердце, как и при пороках со сбросом слева-направо, работает с перегрузкой, особенно его правые отделы, и мы поговорим об этом, когда будем описывать отдельные пороки. Но здесь мы хотим подчеркнуть, что само существование цианоза может быть опасным, так как недостаточное содержание кислорода в артериальной крови вызывает ее сгущение, увеличение числа эритроцитов и может привести к закупорке мелких сосудов тела, в том числе и мозга со всеми вытекающими последствиями.
Понятие о перекрестном сбросе
В некоторых ситуациях, когда дефекты в перегородках достаточно большие, а сопротивление кровотоку почти одинаковое на выходе из обоих желудочков, кровь может частично перетекать через дефект в обоих направлениях в различные фазы сердечного цикла. То есть в какой-то отрезок времени в ходе одного сокращения имеется сброс слева-направо, а в другой отрезок в ходе того же цикла, но через несколько долей секунды происходит сброс справа-налево.
В таких случаях говорят о «перекрестном сбросе», и степень недосыщения артериальной крови кислородом будет зависеть от преимущественного направления тока крови. Соответственно видимой и выраженной будет степень цианоза.
Скажем здесь, что к порокам с таким «перекрестным сбросом» относятся чаще всего очень сложные, комбинированные пороки, включающие сочетания разных нарушений развития сердца.
Препятствия кровотоку
Врожденные препятствия нормальному кровотоку обычно возникают вследствие неправильного развития в местах соединений сердечных камер друг с другом или с магистральными сосудами. Чаще всего это относится к клапанам. Сужение называют «стенозом», если оно вызвано изменением клапанов, а когда это касается аорты, то говорят о ее «коарктации».
Подробно мы разберем это ниже, но здесь хочется отметить несколько моментов, касающихся кровотока. Поскольку к восьмой неделе внутриутробной жизни плода сердце, в основном, сформировано и кровообращение уже происходит, то влияние сужения, затруднения нормальному кровотоку сказывается уже на ранних стадиях развития эмбриона. Если больше никаких дефектов нет, то желудочкам приходится работать с повышенной нагрузкой, результатом которой станет утолщение стенок, уменьшение размеров полости, недоразвитие сердечных камер. После рождения эти явления только прогрессируют и могут стать жизнеопасными уже в первые дни жизни ребенка.
Если такие препятствия сочетаются с дефектами в перегородках, то сердцу легче работать, т.к. есть другие пути для крови, в которых сопротивление меньше и поток выбирает такие пути меньшего сопротивления.
Но мы уже вплотную подошли к классификации пороков, т.е. к тому, какие пороки бывают и что при этом происходит с ребенком, справляется ли сердце с ними и каким образом.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Артерии внутренних органов эмбриона. Формирование артерий внутренних органов плода
Рева И.В. 1, 2 Гармаш А.И. 1 Садовая Я.О. 1 Шиндина А.Д. 1 Индык М.В. 1 Калинин И.О. 1 Шек Л.И. 1 Фургал А.А. 1 Сорокин В.А. 1 Рева Г.В. 1, 2
Для создания фундаментальной платформы по внедрению клеточных технологий в лечение сосудистой патологии необходимо исчерпывающее знание и понимание процессов эмбрионального васкулогенеза и механизмов постнатального ангиогенеза. Противоречивые данные не только по механизмам индукции и ингибирования развития сосудов, но и источников развития эндотелия, противоречия в сроках эмбрионального васкулогенеза, и даже по размерам эмбриона в разные сроки, особенно в самый ранний сразу после имплантации, тормозят развитие не только ангиологии, но и трансплантологии. Клеточные взаимодействия в условиях васкулогенеза изучены в эксперименте на лабораторных животных, а полученные результаты только условно могут быть экстраполированы на человека. На материале эмбриона человека установлено, что васкулогенез в различных органах имеет морфологические отличия, в сердце, печени и нервной трубке кровеносные сосуды отсутствуют, а первичные капилляры идентифицируются в экто- и мезенхиме. Идентификация клеток с рецепторами CD68 и CD163 свидетельствует об их участии в морфо- и васкулогенезе. Полученные данные об особенностях васкулогенеза в различных органах эмбриона человека способствуют пониманию органной специфичности эндотелия.

1. Kupatadze D.D., Nabokov V.V., Malikov S.A., Polozov R.N., Kanina L.Ia., Veselov A.G. Current problems in the reconstructive surgery of the locomotor apparatus in children //Vestn. Khir. Im. I.I. Grek. 1997; 156(2):94-6.
2. Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. Expansion and angiogenic potential of mesenchymal stem cells from patients with critical limbischemia // J. Vasc. Surg. 2017 Mar; 65(3):826-838.e1. DOI: 10.1016/j.jvs.2015.02.061.
3. Banin VV. Role of pericytes in mechanism of vessel neovascularisation in the regenerating connective tissue // Morfologiia. 2004; 125(1):45-50.
5. Liu X., Li Q., Niu X., Hu B., Chen S., Song W., Ding J., Zhang C., Wang Y. Exosomes Secreted from Human-Induced Pluripotent Stem Cell-Derived Mesenchymal Stem Cells Prevent Osteonecrosis of the Femoral Head by Promoting Angiogenesis // Int J Biol Sci. 2017 Feb 6; 13(2):232-244. DOI: 10.7150/ijbs.16951.
6. Tournois C., Pignon B., Sevestre M.A., Al-Rifai R., Creuza V., Poitevin G., Franсois C., Nguyen P. Cell therapy in critical limb ischemia: A comprehensive analysis of two cell therapy products // Cytotherapy. 2017 Feb; 19(2):299-310. DOI: 10.1016/j.jcyt.2016.10.013.
7. Nguyen H.L., Boon L.M., Vikkula M. Vascular Anomalies Caused by Abnormal Signaling within Endothelial Cells: Targets for Novel Therapies // Semin Intervent Radiol. 2017 Sep; 34(3):233-238. DOI: 10.1055/s-0037-1604296.
8. Varazashvili M.N., Mchedlishvili G.I. The hematocrit in the microcirculatory bed of the brain // Fiziol. Zh SSSR Im I.M. Sechenova. 1991 Jun; 77(6):12-9.
9. Mchedlishvili G.I. Disturbances of the normal structuring of the blood flow in the microvessels as the cause of hemorheological disorders // Fiziol. Zh Im I M Sechenova. 1996 Dec; 82(12):41-7.
11. Catani L., Sollazzo D., Bianchi E., Ciciarello M., Antoniani C., Foscoli L., Caraceni P., Giannone F.A., Baldassarre M., Giordano R., Montemurro T., Montelatici E., D’Errico A., Andreone P., Giudice V., Curti A., Manfredini R., Lemoli R.M. Molecular and functional characterization of CD133 + stem/progenitor cells infused in patients with end-stage liver disease reveals their interplay with stromal liver cells // Cytotherapy. 2017 Sep 13. pii: S1465-3249(17)30660-6. DOI: 10.1016/j.jcyt.2017.08.001.
12. Dreyer C.H., Kjaergaard K., Ditzel N., Jоrgensen N.R., Overgaard S., Ding M. Optimizing combination of vascular endothelial growth factor and mesenchymal stem cells on ectopic bone formation in SCID mice // J Biomed Mater Res A. 2017 Sep 6. DOI: 10.1002/jbm.a.36195.
13. Caporali A., Martello A., Miscianinov V., Maselli D., Vono R., Spinetti G. Contribution of pericyte paracrine regulation of the endothelium to angiogenesis // Pharmacol Ther. 2017 Mar; 171:56-64. DOI: 10.1016/j.pharmthera.2016.10.001.
14. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. Angiogenic Mechanisms of Human CD34 + Stem Cell Exosomes in the Repair of Ischemic Hindlimb // Circ Res. 2017 Apr 28; 120(9):1466-1476. DOI: 10.1161/CIRCRESAHA.116.310557.
15. Rigato M., Fadini G.P. Circulating stem/progenitor cells as prognostic biomarkers in macro- and microvascular disease. A narrative review of prospective observational studies.//Curr Med Chem. 2017 Sep 20. DOI: 10.2174/0929867324666170920154020.
17. Wu Q.H., Ma Y., Ruan C.C., Yang Y., Liu X.H., Ge Q., Kong L.R., Zhang J.W., Yan C., Gao P.J. Loss of osteoglycin promotes angiogenesis in limb ischaemia mouse models via modulation of vascular endothelial growth factor and vascular endothelial growth factor receptor 2 signalling pathway // Cardiovasc Res. 2017 Jan; 113(1):70-80. DOI: 10.1093/cvr/cvw220.
20. Guerin C.L., Rossi E., Saubamea B., Cras A., Mignon V., Silvestre J.S., Smadja D.M. Human very Small Embryonic-like Cells Support Vascular Maturation and Therapeutic Revascularization Induced by Endothelial Progenitor Cells // Stem Cell. 2017 Aug; 13(4):552-560. DOI: 10.1007/s12015-017-9731-7.
21. Welt K., Schippel K., Mironov V.A., Mironov A.A., Alimov G.A., Bobrik I.I., Banin V.V., Karaganov J.L. Vascular endothelium (review). I. General morphology. 2A: histogenesis of the vascular endothelium // Gegenbaurs Morphol Jahrb. 1990; 136(2):163-99.
22. Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. Synergistic Therapeutic Effect of Three-Dimensional Stem Cell Clusters and Angiopoietin-1 on Promoting Vascular Regeneration in Ischemic Region // Tissue Eng Part A. 2017 Sep 26. DOI: 10.1089/ten.TEA.2017.0260.
23. Banin V.V., Muller F.S. Effect of hydrogen peroxide on the permeability of the walls of the mesenteric venules for fluorescein // Fiziol Zh SSSR Im I M Sechenova. 1988 Aug; 74(8):1149-57.
24. Calderon G.A., Thai P., Hsu C.W., Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. Tubulogenesis of co-cultured human iPS-derived endothelial cells and human mesenchymal stem cells in fibrin and gelatin methacrylate gels // Biomater Sci. 2017 Jul 25; 5(8):1652-1660. DOI: 10.1039/c7bm00223h.
26. Du W., Zhang K., Zhang S., Wang R., Nie Y., Tao H., Han Z., Liang L., Wang D., Liu J., Liu N., Han Z., Kong D., Zhao Q., Li Z. Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer // Biomaterials. 2017 Jul; 133:70-81. DOI: 10.1016/j.biomaterials.2017.04.030.
28. Bikfalvi A. History and conceptual developments in vascular biology and angiogenesis research: a personal view // Angiogenesis. 2017 Jul 24. DOI: 10.1007/s10456-017-9569-2.
29. Putman D.M., Cooper T.T., Sherman S.E., Seneviratne A.K., Hewitt M., Bell G.I., Hess D.A. Expansion of Umbilical Cord Blood Aldehyde Dehydrogenase Expressing Cells Generates Myeloid Progenitor Cells that Stimulate Limb Revascularization // Stem Cells Transl Med. 2017 Jul; 6(7):1607-1619. DOI: 10.1002/sctm.16-0472.
30. Rossi E., Smadja D., Goyard C., Cras A., Dizier B., Bacha N., Lokajczyk A., Guerin C.L., Gendron N., Planquette B., Mignon V., Bernabеu C., Sanchez O., Smadja D.M. Co-injection of mesenchymal stem cells with endothelial progenitor cells accelerates muscle recovery in hind limb ischemia through an endoglin-dependent mechanism // Thromb Haemost. 2017 Aug 3; 117(10). DOI: 10.1160/TH17-01-0007.
31. Кнорре А.Г. Краткий очерк эмбриологии человека с элементами сравнительной, экспериментальной и патологической эмбриологии. - 1967. - С. 202-209.
32. Robertson D.J. Congenital arteriovenous fistulae of the extremities // J. Cardiovasc Surg (Torino). 1965 Sep-Oct; 5(6):Suppl:237-40.
Врожденные пороки развития сосудов являются причиной приблизительно 20 % смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике, детской хирургии и ортопедии, патологической анатомии [1]. Аномалии развития артерий и вен, такие как агенезия, аплазия, артериальные и венозные аневризмы, недоразвитие клапанного аппарата вен возникают при нарушении образования сосудистых стволов. По данным Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. (2017) нарушения ангиогенеза, критичные для жизни, наблюдаются среди населения в 1 % случаев [2], а связанные с заболеванием периферических артерий - в 10 % 4. При этом традиционные варианты реваскуляризации возможны только у 50 % пациентов, остальным потребуются методы клеточной терапии, с использованием клеток костного мозга, мезенхимальных стволовых клеток (мск), обладающих большим потенциалом в качестве альтернативы реваскуляризационной терапии [6]. Nguyen H.L., Boon L.M., Vikkula M. (2017) указывают на то, что возникают сосудистые аномалии как следствие неправильного развития и регуляции ангиогенеза [7]. Исследуя ангиогенез, Varazashvili M.N., Mchedlishvili G.I. (1991), Mchedlishvili G.I. (1996) пришли к выводу, что агрегация эритроцитов вызывает нарушения кровотока и ишемию 9.
Знания о патофизиологических основах сосудистых аномалий резко возросли за последние 5 лет, дополнив теорию эмбриогенеза сосудистой системы молекулярно-генетическими находками [11]. Нарушения общих внутриклеточных сигнальных путей, часто активирующие мутации, по мнению автoров новых концепций, вызывают эндотелиальную клеточную дисфункцию 12. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. (2017) большую роль отводят СD34+ стволовым клеткам, которые, по их мнению, способны через паракринную секрецию влиять на ангиогенез. Подавляя и одновременно модулируя экспрессию генов, участвующих в ангиогенезе, ответственных за синтез сосудистого эндотелиального фактора роста, ангиопоэтина 1 и ангиопоэтина 2 (ANG1, ANG2), metallopeptidase 9 (MMP9), thrombospondin 1(TSP1), они оказывают терапевтический эффект при ишемии задних конечностей у мыши, что может быть перспективным для экстраполяции в медицинскую практику [15].
Предметом острых дискуссий является вопрос происхождения эндотелия. Rigato M., Fadini G.P. (2017) считают, что циркулирующие прогениторные клетки (circulating progenitor cells, СРС) и эндотелиальные прогениторные клетки (endothelial progenitor cells, ЕРС) являются незрелыми клетками, участвующими в сосудистой регенерации и связанными со многими аспектами макро-и микрососудистых заболеваний [16]. Lu W., Li X. (2017) считают стволовые/прогениторные клетки (VSCs) выполняющими ключевую роль в развитии организма и важным источником всех видов сосудистых клеток, необходимых для создания, поддержания, регенерации и ремоделирования кровеносных сосудов. Авторы выделяют четыре основных типа VSCs, в том числе эндотелиальные прогениторные клетки (Ерс), гладкие мышечные прогениторные клетки (SMPCs), перициты и мезенхимальные стволовые клетки (Мск) [17]. Lin C.S., Lue T.F. (2013) подвергают сомнению роль перицитов, как стволовых, с учётом экспериментальных доказательств их ингибирующих ангиогенез свойств и функционального разнообразия [18]. Мезенхимальные стволовые клетки (мск) существуют в большинстве тканей взрослого человека и располагаются вблизи или внутри кровеносных сосудов. Ibrahim M., Richardson M.K. (2017) свидетельствуют о важности изучения ангиогенеза, так как состояние этого вопроса тормозит развитие трансплантологии, методов репаративной регенерации во всех областях медицины, и на современном этапе имеет недостаточность в изучении на материале человека [19]. Guerin C.L., Rossi E., Saubamea B., Mignon V., Silvestre J.S., Smadja D.M. (2017), подтвердив результаты Банина В.В., Куприянова В.В., Karaganov J.L., Мчедлишвили, Welt с соавторами [20] выдвинули концепцию реваскуляризации критически ишемизированной конечности за счёт выделенных из костного мозга мелких эмбрионально подобных плюрипотентных эндотелиальных прогениторных клеток, способных дифференцироваться в эндотелиоциты с терапевтическим реваскуляризационным потенциалом [21].
Поскольку ангиодисплазии не относятся к казуистическим находкам, существует острая необходимость разработки стратегий консервативного лечения на основе клеточных технологий. Однако, по данным Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. (2017), в клинической практике использование взрослых стволовых клеток имеет ряд ограничений, таких, как низкая выживаемость клетки и низкая терапевтическая эффективность [22]. Несмотря на значительные успехи в изучении ангиогенеза, наличие нескольких противоречивых концепций развития сосудов в теле эмбриона человека (из мезенхимы и целома), а также участия в ангиогенезе циркулирующих ангиобластов, свидетельствуют о том, насколько далека эта проблема от решения. Множество концепций ангиодисплазий учитывают экзо- и эндогенные, молекулярно-генетические, метаболические и другие факторы, которые на современном этапе не получили окончательного подтверждения, а теория эмбриогенеза сосудистой системы требует значительной доработки, поэтому гистогенез эндотелия на современном этапе является одной из важнейших проблем васкуло- и ангиогенеза [23]. Calderon G.A., Thai P., Hsu C.W, Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. (2017) подтвердили исследования Banin V.V. [24]. Jeong H.W., Hernfndez-Rodriguez B., Kim J., Kim K.P., Enriquez-Gasca R., Yoon J., Adams S., Scholer H.R., Vaquerizas J.M., Adams R.H. (2017) указывают, что молекулярные механизмы, регулирующие эндотелиальную активность клеток на различных этапах сосудистого роста, ремоделирования, созревания и покоя, остаются неясными [25]. Васкуло- и ангиогенез представляют собой сложные процессы, которые требуют скоординированных изменений в эндотелиальных клетках [26]. Многочисленные гипотезы происхождения эндотелиоцитов трактуют их развитие в связи с теорией трех зародышевых листков [27]. Существенная роль кровеносных сосудов в тканях и органах человека, понимание функциональных свойств и основополагающей молекулярной основы VSC имеет решающее значение для фундаментальных исследований [28]. Современное неудовлетворительное состояние данных по вопросу эмбрионального ангиогенеза определило направление нашего исследования.
Цель исследования - изучить кровеносные сосуды эмбриона человека в эмбриональном периоде.
Материалы и методы исследования
Исследование выполнено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Биоптаты эмбрионов были получены в соответствии с приказом Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий» и в соответствии с номенклатурой клинических лабораторных исследований МЗ РФ (приказ 21 февраля 2000 г. № 64). Изучен материал эмбрионов человека 3, 5, 8 недель эмбрионального развития. Распределение материала представлено в табл. 1.
Кровообращение плода: особенности внутриутробного периода
Сердечно-сосудистая система обеспечивает функционирование внутренних органов и нервных структур. Кровообращение плода имеет ряд отличий от взрослого. Это связано с длительным внутриутробным развитием, когда кровь поступает из сосудов беременной. Знание основ формирования сосудистой системы и сердца позволяет понять механизмы развития болезней у новорожденного и детей старшего возраста.
Схема кровообращения

Кровообращение плода: особенности и схема
Кровообращение плода обеспечивается сосудами плаценты. Это орган, обеспечивающий взаимодействие между организмами матери и развивающегося плода. Первые признаки его активности наблюдаются на 4-5 неделе внутриутробного периода.
Плацента имеет ворсины. Это соединительнотканные структуры, содержащие большое количество сосудов. С помощью них кислород и питательные вещества попадают из крови женщины в кровь плода.
Начинается кровообращение с пупочной вены, которая впадает в печень. Из органа кровь поступает в венозный или аранциев проток, сообщающийся с нижней полой веной.
Аномалии строения сосудов у ребенка могут приводить к врожденным порокам развития сердечно-сосудистой системы.
Из нижней полой вены кровь переходит в правое предсердие, а затем в одноименный желудочек. Отсюда она попадает в легочной ствол, отходящий к легким. Часть крови через овальное окно напрямую попадает из правого предсердия в левое. Из него — в левый желудочек и аорту.
Так как органы дыхания у плода не функционируют, они не нуждаются в кровоснабжении. Поэтому кровь из легочного ствола через Боталлов проток устремляется в аортальный сосуд. Он, благодаря своим ветвям, кровоснабжает все внутренние органы и структуры нервной системы.
Венозная кровь собирается в пупочную артерию, которая вновь направляется в плаценту. На этом круг кровообращения плода замыкается.
Особенности плацентарного кровообращения
Внутриутробное развитие плода и кровоток через плаценту приводят к тому, что часть сердечно-сосудистой системы у ребенка имеет отличия от организма взрослого. Это влияет и на функционирование органов. Отличительные черты кровообращения следующие:
- артерии и вены устроены таким образом, что кровь, богатая кислородом и питательными веществами, напрямую попадает в организм и артериальные сосуды плода. Это обеспечивает насыщение плазмы кислородом и питательными молекулами;
- малый круг кровообращения, обеспечивающий у взрослого человека поступление в кровь кислорода, не работает. Это следствие отсутствия у ребенка легочного дыхания;
- более 95% крови находится в большом круге кровообращения. Подобное состояние связано с наличием овального окна и Боталлова протока;
- давление в магистральных сосудах (легочной ствол и аорта) низкое и находится на одинаковом уровне, так как они сообщаются друг с другом.
Плацентарное кровообращение сохраняется до рождения ребенка. После этого в сердечно-сосудистой системе наблюдаются структурные и функциональные изменения.
Сердце у новорожденного
После рождения ребенок совершает первый вдох. Это обеспечивает расправление легких и начало дыхания с их помощью. На фоне этого кровь из правого желудочка устремляется в легочной ствол и попадает в сосуды органа. Боталлов проток начинает закрываться и постепенно полностью зарастает соединительной тканью.
Рост давления в правом предсердии приводит к тому, что ток крови через овальное окно прекращается. Оно постепенно зарастает мышечной перегородкой, в которой находится проводящая система сердца. Это отражает окончание изменений в кровообращении ребенка.
Врожденные аномалии сердечно-сосудистой системы встречаются у женщин, имеющих факторы риска: вредные привычки, тяжелые заболевания внутренних органов, внутриутробные инфекции и т.п.
Особенности кровообращения во время беременности появились в результате эволюции. Они позволяют внутренним органам и головному мозгу плода получать достаточное количество кислорода и питательных веществ.
Любые нарушения строения сердца и сосудов приводят к врожденным аномалиям различной степени выраженности. При этом, если анатомические особенности остаются после рождения, это также приводит к появлению патологий, требующих лечения.
Видео

Читайте в следующей статье: ктр плода
* Представленная информация не может быть использована для самостоятельной постановки диагноза, определения лечения и не заменяет обращение к врачу!
Сердечно-сосудистая система плода

Эмбрион после зачатия начинает стремительно развиваться в связи с наличием закладок для формирования систем органов. Примерно на 2 неделе зарождается сердечно-сосудистая система плода из двух эндотелиальных трубок, что образуют одну сердечную трубку и кровяных клеток, что образовывают первичные сосуды. Оболочка эндотелиальных трубок является основой развития эндокарда и миокарда. Потом уже происходит выделение отделов сердца.
Развитие сердечно-сосудистой системы проходит через разные этапы, например, когда сердечная трубка в результате роста изгибается, то образуются клапаны, что разделяют желудочки и предсердия, тогда сердце становится двухкамерным. На 6 недели у зародыша образуется еще и перегородка, которая делит сердце на половины и создает окончательные его формы. Так как желудочек тоже разделяется, то сердце становится четырехкамерным. Положение сердца плода становится ниже, смещаясь в грудную часть тела. Заканчиваются структурные изменения приблизительно на 8 неделе.
Первые месяцы развития плода очень важны для дальнейшего развития организма. В этот период лучше максимально обезопасить его, не попадая под воздействие негативных факторов и болезней, что могут навредить. Это самая вероятная причина наличия врожденных пороков. При первых симптомах заболеваний или даже при возникновении сомнений рекомендуем в срочном порядке проконсультироваться с врачом.
У плода сердце по размерам и массе в процентном соотношении достаточно большое и увеличивается за счет мышечной массы. Клетки стенок сердца находятся в стадии их разделения. Развитие сосудов происходит в результате деления аорты на легочную артерию и аорту. При этом у плода имеется плацентарное кровообращение и кислород поступает вместе с кровью через пупочную вену. Особенностью сердца плода является овальное окно, что распределяет кровь ко всем органам, а малый круг кровообращения не функционирует через отсутствие лёгочного дыхания.
Развитие сердечно-сосудистой системы ребёнка после рождения
После рождения ребёнка все изменения и особенности развития сердечно-сосудистой системы связаны с активацией нового кровообращения. Новорожденный делает первый вздох легкими, так как пуповина перерезана и завязана. Свои функции перестают исполнять пупочные сосуды. Овальное окно и проток постепенно закрываются и возникает два круга кровообращения. В дальнейшем сердце меняет свою форму, положение и вес вместе с ростом ребёнка. Частота сердечных сокращений постепенно уменьшаются, соответственно — цикл увеличивается.
Развитие сердечно-сосудистой системы взрослых
Сердечно-сосудистая система продолжает развиваться в подростковом возрасте и приобретает характеристики, присущие взрослым, после чего практически мало меняется. Форма сердца становится овальной с рельефным преобладанием желудочков, а его вес стабилизируется и зависит от пола (в пределе 200-300 г). У взрослых сердце расположено ниже, чем у детей, что связано с ростом тела. Артериальное давление, как функциональный показатель работы сердечно-сосудистой системы, выше детского.
Плацента и ее роль в развитии беременности
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
С самого начала беременности и вплоть до ее окончания формируется и функционирует система мать-плацента-плод. Важнейшим компонентом этой системы является плацента, которая представляет собой комплексный орган, в формировании которого принимают участие производные трофобласта и эмбриобласта, а также децидуальная ткань. Функция плаценты, в первую очередь, направлена на обеспечение достаточных условий для физиологического течения беременности и нормального развития плода. К этим функциям относятся: дыхательная, питательная, выделительная, защитная, эндокринная. Все метаболические, гормональные, иммунные процессы во время беременности обеспечиваются через сосудистую систему матери и плода. Несмотря на то, что кровь матери и плода не смешивается, так как их разделяет плацентарный барьер, все необходимые питательные вещества и кислород плод получает из крови матери. Основным структурным компонентом плаценты является ворсинчатое дерево.
Схема структуры плаценты и маточно плацентарного кровообращения
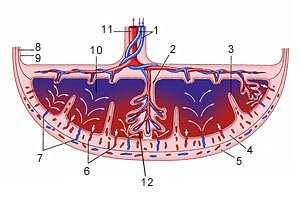
1 - артерии пуповины
2 - стволовая ворсина
3 - децидуальная перегородка
4 - децидуальный слой
5 - миометрий
6 - вены
7 - спиральные артерии
8 - хорион
9 - амнион
10 - межворсинчатое пространство
11 - вена пуповины
12 - котиледон
Зрелая плацента представляет собой дискообразную структуру диаметром 15-20 см и толщиной 2,5 - 3,5 см. Ее масса достигает 500-600 гр. Материнская поверхность плаценты, которая обращена в сторону стенки матки, имеет шероховатую поверхность, образованную структурами базальной части децидуальной оболочки. Плодовая поверхность плаценты, которая обращена в сторону плода, покрыта амниотической оболочкой. Под ней видны сосуды, которые идут от места прикрепления пуповины к краю плаценты. Строение плодовой части плаценты представлено многочисленными ворсинами хориона, которые объединяются в структурные образования - котиледоны. Каждый котиледон образован стволовой ворсиной с разветвлениями, содержащими сосуды плода. Центральная часть котиледона образует полость, которая окружена множеством ворсин. В зрелой плаценте насчитывается от 30 до 50 котиледонов. Котиледон плаценты условно сравним с деревом, в котором опорная ворсина I порядка является его стволом, ворсины II и III порядка - крупными и мелкими ветвями, промежуточные ворсины - маленькими ветками, а терминальные ворсины - листьями. Котиледоны отделены друг от друга перегородками (септами), исходящими из базальной пластины.
Межворсинчатое пространство с плодовой стороны образовано хориальной пластиной и прикрепленными к ней ворсинами, а с материнской стороны оно ограничено базальной пластиной, децидуальной оболочкой и отходящими от неё перегородками (септами). Большинство ворсин плаценты свободно погружены в межворсинчатое пространство и омываются материнской кровью. Различают также и якорные ворсины, которые фиксируются к базальной децидуальной оболочке и обеспечивают прикрепление плаценты к стенке матки.
Схема циркуляции крови в организме плода
1 - верхняя полая вена
2 - овальное отверстие
3 - нижняя полая вена
4 - венозный проток
5 - портальный синус
6 - воротная вена
7 - вена пуповины
8 - артерии пуповины
9 - плацента
10 - надчревные артерии
11 - артериальный проток
Спиральные артерии, которые являются конечными ветвями маточной и яичниковой артерий, питающих беременную матку, открываются в межворсинчатое пространство 120-150 устьями, обеспечивая постоянный приток материнской крови, богатой кислородом, в межворсинчатое пространство. За счет разницы давления, которое выше в материнском артериальном русле по сравнению с межворсинчатым пространством, кровь, насыщенная кислородом, из устьев спиральных артерий направляется через центр котиледона к ворсинам, омывает их, достигает хориальной пластины и по разделительным септам возвращается в материнский кровоток через венозные устья. При этом кровоток матери и плода отделены друг от друга. Т.е. кровь матери и плода не смешивается между собой.
Переход газов крови, питательных веществ, продуктов метаболизма и других субстанций из материнской крови в плодовую и обратно осуществляется в момент контакта ворсин с кровью матери через плацентарный барьер. Он образован наружным эпителиальным слоем ворсины, стромой ворсины и стенкой кровеносного капилляра, расположенного внутри каждой ворсины. По этому капилляру течет кровь плода. Насыщаясь таким образом кислородом, кровь плода из капилляров ворсин собирается в более крупные сосуды, которые в конечном итоге объединяются в вену пуповины, по которой насыщенная кислородом кровь оттекает к плоду. Отдав кислород и питательные вещества в организме плода, кровь, обедненная кислородом и богатая углекислым газом, оттекает от плода по двум артериям пуповины к плаценте, где эти сосуды делятся радиально в соответствии с количеством котиледонов. В результате дальнейшего ветвления сосудов внутри котиледонов кровь плода вновь попадает в капилляры ворсин и вновь насыщается кислородом, и цикл повторяется. За счет перехода через плацентарный барьер газов крови и питательных веществ реализуется дыхательная, питательная и выделительная функция плаценты. При этом в кровоток плода попадает кислород и выводится углекислый газ и другие продукты метаболизма плода. Одновременно в сторону плода осуществляется транспорт белков, липидов, углеводов, микроэлементов, витаминов, ферментов и многого другого.
Схема строения плацентарного барьера
1 - эндотелий капилляров терминальных ворсин
2 - капилляр ворсины
3 - строма ворсины
4 - эпителиальный покров ворсин
Плацента осуществляет важную защитную (барьерную функцию) посредством плацентарного барьера, который обладает избирательной проницаемостью в двух направлениях. При нормальном течении беременности проницаемость плацентарного барьера увеличивается до 32 -34 недель беременности, после чего определенным образом снижается. Однако, к сожалению, через плацентарный барьер сравнительно легко проникают в плодовый кровоток достаточно большое количество лекарственных препаратов, никотин, алкоголь, наркотические вещества, пестициды, другие токсические химические вещества, а также целый ряд возбудителей инфекционных заболеваний, что оказывает неблагоприятное воздействие на плод. Кроме того, под воздействием патогенных факторов барьерная функция плаценты нарушается еще в большей степени.
Плацента анатомически и функционально связана с амнионом (водная оболочка), который окружает плод. Амнион представляет собой тонкую мембрану, которая выстилает поверхность плаценты, обращенной к плоду, переходит на пуповину и сливается с кожей плода в области пупочного кольца. Амнион активно участвует в обмене околоплодных вод, в ряде обменных процессов, а также выполняет и защитную функцию.
Плаценту и плод соединяет пуповина, которая представляет собой шнуровидное образование. Пуповина содержит две артерии и одну вену. По двум артериям пуповины течет обедненная кислородом кровь от плода к плаценте. По вене пуповины к плоду течет кровь, обогащенная кислородом. Сосуды пуповины окружены студенистым веществом, которое получило название "вартонов студень". Эта субстанция обеспечивает упругость пуповины, защищает сосуды и обеспечивает питание сосудистой стенки. Пуповина может прикрепляться (чаще всего) в центре плаценты и реже сбоку пуповины или к оболочкам. Длина пуповины при доношенной беременности в среднем составляет около 50 см.
Плацента, плодные оболочки и пуповина вместе образуют послед, который изгоняется из матки после рождения ребенка.
УЗИ сканер WS80
Читайте также:
