Аутоиммунные эндокринные нарушения, вызванные применением лекарственных препаратов
Добавил пользователь Евгений Кузнецов Обновлено: 02.02.2026
Представлены современные сведения о патогенезе аутоиммунных заболеваний. Дан анализ факторов, провоцирующих развитие этой патологии. Приведены основные клинические формы органоспецифичных и органонеспецифичных аутоиммунных болезней. Представлены данные по изменению клинического течения миастении гравис, демиелинизирующих полиневропатий и рассеянного склероза. Приведены современные способы лечения этих заболеваний, а также перспективные направления в их терапии.
аутоиммунные заболевания, миастения, полиневропатия, рассеянный склероз
В настоящее время структура болезней человека существенно изменилась. Ушли в прошлое заболевания, уносившие жизни сотен тысяч людей: чума, холера, оспа, испанка. Однако на их место пришли болезни цивилизованного общества - расстройства адаптации, неврозы, синдром хронической усталости и др. Среди последних особое место занимают аутоиммунные заболевания (АЗ). АЗ - группа болезней с окончательно не уточненной этиологией, в основе которых лежит агрессия собственной иммунной системы против неизмененной ткани человека [1, 4, 9, 13]. Они встречаются во всем мире, но преобладают в Северной Европе, Северной Америке, Новой Зеландии, южной части Австралии и поражают лиц любого возраста [14]. За последние годы достигнут несомненный прогресс в понимании механизмов развития АЗ, разработаны и внедрены стандарты их диагностики, а также современные методы лечения. Однако ряд вопросов остается не ясен, результаты лечения еще далеки от идеальных, что придает этой проблеме актуальность для практикующих врачей различных специальностей.
Патогенез аутоиммунных заболеваний
На сегодня установлено, что причинами развития АЗ могут быть: 1) гиперактивность В- или Т-лимфоцитов; 2) изменения в системе распознавания чужеродных или собственных антигенов (АГ); 3) нарушение регулирующих механизмов, ограничивающих развитие иммунного ответа [1]. В патогенезе многих АЗ определенную роль играют генетические факторы, что подтверждается частотой встречаемости этих болезней в некоторых семьях и высокой конкордантностью по ним у однояйцевых, но не двухъяйцевых близнецов [14]. Изучение наследования АЗ в эксперименте и немногочисленных клинических исследованиях позволило сделать вывод о полигенной природе этой патологии, обусловленной несколькими независимыми генами. Для многих АЗ установлена связь с определенными гаплотипами главного комплекса гистосовместимости (HLA), что указывает на предрасположенность к АЗ от генетически обусловленных различий в строении молекул HLA и механизмах представления АГ Т-лимфоцитам. Установлена связь между носительством гена HLA-В27 и анкилозирующим спондилоартритом, гена HLA-DR3 и аутоиммунным гепатитом, гена HLA-В5 и сахарным диабетом I типа [4, 13]. Иногда выработка аутоантител (АТ) происходит при нормальной функции иммунной системы. В основе этого явления лежит молекулярная мимикрия - молекулярное сходство между чужеродными и собственными АГ организма, в результате которого при нормальном иммунном ответе на чужеродный АГ (особенно на полисахариды) вырабатываются АТ, атакующие некоторые виды собственной ткани человека. Примерами такой мимикрии, имеющими клиническое значение, могут быть выработка АТ к холинорецепторам, вызывающих миастению, АТ к отдельным фракциям миелина, вызывающих демиелинизирующие полиневропатии (ПНП), или АТ к ДНК, эритроцитам и тромбоцитам, вызывающих системную красную волчанку [1, 6, 8].
Механизмы развития АЗ имеют различия в зависимости от географической распространенности, возраста дебюта, частоты системных проявлений и рецидивов, специфичности поражения определенного органа или системы [4]. Наиболее частой причиной АЗ является нарушение распознавания собственных АГ Т-хелперами, которые активируют специфические цитотоксические АТ и цитокины, такие как фактор некроза опухоли альфа, интерлейкины 1а и 2. Цитокины являются медиаторами иммунного ответа, стимулируют фибробласты и эндотелиальные клетки к избыточной выработке коллагена и гликозаминогликанов, которые, соединяясь с белками, образуют протеогликаны, способные связывать воду и вызывать отек и повреждение тканей. Другим механизмом развития АЗ может быть появление в отдельном органе (или системе) посткапиллярных венул с высоким эндотелием. Повышенное количество молекул адгезии на таком эндотелии приводит к накоплению клеток памяти и эффекторных лимфоцитов, которые вызывают повреждение этой ткани. При отсутствии органоспецифичности поражения АЗ развиваются вследствие нарушения иммунологической толерантности к собственным АГ [1]. В экспериментальной модели АЗ (на мышах линии MRL) показана патогенная роль экспрессии дефектных молекул СД95 на Т-лимфоцитах. При их отсутствии аутореактивные Т-лимфоциты не погибают, а заселяют периферические органы иммунной системы [12]. Кроме того, доказано, что при АЗ ускоряется апоптоз - программированная гибель клеток [10]. Апоптоз необходим для уничтожения аутореактивных Т-лимфоцитов в процессе негативной селекции в тимусе, зрелых аутореактивных В- и Т-лимфоцитов при их контакте с собственными АГ организма, а также клеток, инфицированных вирусом, и опухолевых клеток. Нарушение этих механизмов приводит к преждевременной гибели клетки [14]. Существует гипотеза развития АЗ вследствие дефектов стволовых клеток или их ближайших потомков [12].
Чрезвычайно важное влияние на развитие АЗ оказывают провоцирующие факторы, запускающие каскад патологических реакций с участием иммунной системы. К их числу относят вирусную (вирусы герпеса, Эпштейна - Барр) и бактериальную (клебсиелла, трипаносома и др.) инфекции, стресс, введение лечебных сывороток и вакцин, воздействие неблагоприятных экологических факторов [3, 7]. Установлена триггерная роль при АЗ ухудшения качества воздуха с накоплением в организме оксидов углерода, азота, серы, углеводородов, пылевых частиц, тяжелых металлов (свинец, ртуть, мышьяк, кадмий, никель) [10]. Доказано негативное влияние на формирование АЗ загрязненной питьевой воды, так как существующие современные методики очистки питьевой воды не позволяют очистить ее от хлорированных производных бензольного ряда, фенолов, нитратов [5]. Определенное значение имеют такие климатические явления, как глобальное потепление, влияние ультрафиолетового излучения за счет разрушения озонового слоя [10]. До конца не изучено влияние на развитие АЗ последствий ядерных испытаний и техногенных катастроф. Для загрязненных территорий Беларуси и Украины неоднозначны влияния последствий аварии на Чернобыльской атомной станции на развитие АЗ. Среди прочих провоцирующих факторов аутоиммунных заболеваний обсуждается роль производственных вредностей (поливинилхлориды, асбест, хром, пестициды), токсических и мутагенных добавок в продуктах питания (нитраты, нитриты, стимуляторы роста, антибиотики), недостаточного, избыточного либо несбалансированного питания, вредных привычек (злоупотребление алкоголем, курение), самолечения (недобросовестная реклама ряда лекарственных препаратов, расширение безрецептурного списка) [10].
Аутоиммунные заболевания включают большое количество нозологических форм с различной клинической картиной, но общими механизмами патогенеза и принципами лечения. Существует систематизация АЗ в зависимости от тропности к поражению отдельного органа или системы.
Общие клинические признаки и патоморфоз аутоиммунных заболеваний
Клинические признаки АЗ существенно различаются и зависят от возраста, пола, географической распространенности, поражения определенного органа или системы. Общими признаками всех АЗ являются генетическая предрасположенность, прогрессирующее или рецидивирующее течение, склонность к спонтанным ремиссиям, сочетание нескольких аутоиммунных процессов у одного больного, возможность воспроизведения на лабораторных животных, обнаружение в крови АТ, лимфоидная инфильтрация тканей с отложением в них циркулирующих иммунных комплексов, терапевтический эффект иммуносупрессоров [7].
Клинические проявления аутоиммунных заболеваний изучены достаточно подробно, однако в последние годы имеет место существенный патоморфоз их течения и симптоматологии. Реже встречаются классические формы, чаще - стертые и атипичные проявления АЗ. Вероятно, это связано с ослаблением иммунного реагирования либо с достаточной компенсацией иммунной системы человека.
Изучая многолетний опыт наблюдений за значительным числом пациентов (более 3000 чел.) с неврологическими АЗ (среди них 315 больных с острыми и хроническими воспалительными демиелинизирующими ПНП, 1098 больных с миастенией гравис и миастеническим синдромом Ламберта - Итона, более 1500 чел. с рассеянным склерозом - РС) и другими более редкими клиническими формами, мы обратили внимание на следующие особенности их патоморфоза:
В настоящее время нечасто встречаются классические формы миастении, при которых поражение нервно-мышечной передачи идет сверху вниз, когда первыми поражаются глазные, затем глоточно-лицевые, скелетные мышцы и лишь спустя несколько лет от начала болезни наступает генерализация мышечной слабости. Сейчас нередки случаи дебюта миастении с генерализованной формы, а иногда сразу с миастенического криза после, казалось бы, незначительных причин (наркоз во время операции, голодание и др.).
Значительно чаще диагностируются демиелинизирующие ПНП, причем преобладают формы с первично-хроническим течением, а случаи восходящего паралича Ландри становятся казуистикой. Так, в период с 1982 по 1985 г. (до аварии на ЧАЭС) в нашей клинике наблюдался всего 21 больной с демиелинизирующими ПНП, из них с хроническим течением было 8 чел. (38 %). С 1987 по 1991 г. их число увеличилось до 48, в том числе с хроническим течением было 14 чел. (29,1 %). С 2003 по 2007 г. количество таких пациентов возросло в 5 раз - 108 чел. (P < 0,05), из них с хроническим течением было уже 63 чел. (59,4 %), в том числе с мультифокальной моторной ПНП - 9 чел.
Численность больных с РС изменилась не так явно, однако все чаще встречаются пациенты с доброкачественным течением процесса.
Приведенные факты носят эмпирический характер, и мы допускаем, что отчасти они связаны с субъективными причинами (расширение диагностических возможностей, особенности нашей клиники - до 2005 г. базы НИИ неврологии, нейрохирургии и физиотерапиии др.). Однако некоторые схожие эпидемиологические данные получены другими авторами с применением современных статистических программ и соответствующего дизайна исследований [2, 3, 11].
Лечение аутоиммунных заболеваний
В настоящее время золотым стандартом лечения всех АЗ является проведение иммуносупрессивной терапии, которая включает назначение кортикостероидов (КС), цитостатиков или плазмафереза (ПФ) [4, 8, 13]. Применительно к группе неврологических АЗ в отношении целесообразности назначения КС научная полемика продолжается. Так, ряд исследователей не рекомендуют назначать КС, особенно больным с острыми демиелинизирующими ПНП, считая подобную практику серьезной врачебной ошибкой [6]. С другой стороны, при обострениях РС проведение КС-терапии рекомендуется Европейским протоколом по ведению таких больных [14]. Консенсусом может стать назначение КС максимально коротким курсом и в высокой дозе (пульс-терапия - 1000-1500 мг метилпреднизолона внутривенно, на курс - 5 инфузий). В случаях хронизации процесса допускается последующее назначение преднизолона (предпочтительно медрола) в дозе 1-1,5 мг на килограмм массы тела ежедневно или через день до достижения клинического эффекта с последующим постепенным снижением дозы [3, 7].
Цитостатики (азатиоприн, циклофосфан) давно и прочно заняли свое место в комплексной терапии АЗ. Наиболее предпочтительной схемой их назначения, особенно при прогрессирующем характере процесса, является инфузионное введение препарата с последующим переходом на таблетированные формы в дозе 2,5-5 мг курсом до 6-12 месяцев [7]. Современное поколение цитостатиков, таких как митоксантрон, включено в Европейский протокол как доказанное средство в терапии первично, и вторично, прогрессирующего течения РС [14]. Негативной стороной назначения цитостатиков является токсическое влияние на показатели крови (вплоть до агранулоцитоза), печень, почки и др., что требует мониторинга лабораторных показателей в процессе лечения.
Плазмаферез относительно недавно вошел в арсенал терапии АЗ. Несмотря на ряд технических разногласий, большинство специалистов признают его методом старт-терапии наиболее частых АЗ [5, 6]. Доказан максимальный клинический эффект метода при остром течении этих заболеваний. Его доказательная база в отношении хронического течения АЗ значительно меньше. В подобных случаях допустима комбинация ПФ с КС [8, 14]. Разработаны методики иммуносорбции спинномозговой жидкости при демиелинизирующих ПНП с использованием специальных мелкоячеистых фильтров [7].
За последние 10 лет на фармацевтическом рынке появилась группа иммуноглобулинов для внутривенного введения (сандоглобулин и другие российские и украинские аналоги). Поначалу эта группа препаратов позиционировалась как почти единственный чудо-препарат в лечении АЗ. В последующем при накоплении клинического опыта по их применению (в том числе в нашей клинике у 32 больных) они получили неоднозначную оценку. Н.П. Волошина и соавторы, анализируя результаты применения иммуноглобулинов у 173 больных, назвали свою статью эмоционально - «Большие надежды и маленькие разочарования» [2]. В большинстве исследований констатируется их позитивный эффект, особенно в случаях тяжелого и прогрессирующего течения АЗ, даже при отсутствии эффекта от всех ранее проведенных видов терапии [3, 6, 14]. Однако мнение специалистов (в том числе собственный опыт) таково, что эти препараты не являются панацеей и требуют более жестких показаний к их назначению, особенно на территории постсоветского пространства, с учетом их высокой цены.
Стремительно развивающиеся клеточные технологии лечения привели к появлению двух абсолютно новых способов терапии: пересадки стволовых клеток и применения препаратов бета-интерферонового ряда (бетаферон, ребиф, авонекс), эффективность последних пока доказана только в отношении РС [14]. Значительное количество публикаций за последние годы по проблеме пересадки стволовых клеток с позиции доказательной медицины убедительно свидетельствует, что аллогенная или аутологичная трансплантация в большинстве случаев способствует стойкой и длительной ремиссии большинства АЗ [12]. Даже с учетом ряда пока не решенных вопросов (летальность в процессе лечения, этические и технические) следует полагать, что этот метод в ближайшем будущем займет свою нишу в арсенале практикующего врача. Уже завершенные мультицентровые плацебо-контролируемые клинические испытания доказали, что бета-интерфероны изменяют течение РС [14]. В основе их лечебного эффекта лежит описанный выше механизм молекулярной мимикрии, при котором молекула препарата сходна по антигенным свойствам с молекулой миелина и, попадая в организм, представляет ложную мишень для АТ и внеклеточных протеаз. Во многих европейских странах (в том числе в России и Украине) накоплен большой клинический опыт по их использованию [3, 14]. Проведенные фармакоэкономические расчеты показали, что даже с учетом высокой цены препаратов для общества более выгодно их использование, так как своевременно начатое лечение сохраняет трудоспособность и предупреждает инвалидизацию больных с РС молодого возраста [3]. В настоящее время проводится ряд мультицентровых клинических испытаний во II и III фазах (в том числе в нашей клинике) по оценке эффективности нового поколения бета-интерферонов, лишенных ряда негативных побочных эффектов.
Перспективными в терапии АЗ в неврологии могут быть следующие новые лечебные стратегии [9]:
проведение ПФ с использованием моноклональных АТ, что позволит осуществлять сорбцию из крови только провоспалительных цитокинов (интерлейкины 1 и 6, ФНО-альфа, хемокины);
выполнение трансплантации стволовых клеток в сочетании с одновременным назначением моноклональных АТ (натализумаб) и интерферонов;
Таким образом, аутоиммунные заболевания представляют собой значительную группу болезней с общим патогенезом, связанным с нарушением иммунного реагирования. Отмечены изменения клинического течения некоторых АЗ в неврологии. Использование доступных и перспективных технологий позволяет улучшить результаты терапии.
Литература
1. Внутренние болезни по Тинсли Р. Хариссону. - М., 2005. - Т. 5. - С. 2135-2137.
2. Волошина Н.П., Егоркина О.В., Василовский В.В., Чепненко М.Е. // Укр. вест. психоневрол. - 2006. - Т. 14. - Вып. 4. - С. 115-119.
3. Гусев Е.И., Завалишин И.А., Бойко А.Н. Рассеянный склероз и другие демиелинизирующие заболевания нервной системы. - М., 2004.
4. Ивашкин В.Т., Буеверов А.О. Аутоиммунные заболевания печени в практике клинициста. - М., 2001. - 102 с.
5. Корбут Т.В. Клинико-эпидемиологическая характеристика миастении гравис в Республике Беларусь: Автореф. дис… канд. мед. наук. - Минск, 2003.
6. Пирадов М.С. Синдром Гийена - Барре. - М., 2004.
7. Пономарев В.В. Редкие неврологические синдромы и болезни. - СПб., 2005. - 216 с.
8. Пономарева Е.Н. Миастения. - Минск, 2002. - 174 с.
9. Сучков С.В., Введенская О.Ю., Вострикова И.А. // Вестн. Рос. акад. мед. наук. - 2007. - № 7. - С. 32-36.
10. Чиркин В.В., Карандашов В.И., Палеев Ф.Н. Иммунореабилитация. - М., 2003. - С. 87-121.
11. Шамова Т.М. Рассеянный склероз: состояние проблемы и пути оптимизации лечебно-диагностического процесса: Автореф. дис… докт. мед. наук. - Минск, 2008.
12. Шевченко Ю.Л., Бойцов С.А., Новик А.А., Лядов К.Б. // Вестн. Рос. акад. мед. наук. - 2004. - № 9. - С. 40-44.
13. Autoimmune Endocrine diseases // Ed. P. Kendal- Taylor. - 1995. - Vol. 9. - № 1. - 202 p.
14. Differential diagnosis of multiple sclerosis and other demyelinating diseases. 11 th Congress of the EFNS. Teaching Course 13. - Brussels, 2007.
Аутоиммунные эндокринные нарушения, вызванные применением лекарственных препаратов
Люди, получающие препараты для лечения рака под названием ингибиторы иммунных контрольных точек Иммунотерапия при раке Иммунотерапия используется, чтобы стимулировать иммунную систему организма для борьбы с онкологическими заболеваниями. Эти методы лечения нацелены на особые генетические характеристики опухолевых. Прочитайте дополнительные сведения , имеют повышенный риск развития аутоиммунных нарушений Аутоиммунные нарушения Аутоиммунное нарушение является дисфункцией иммунной системы организма, заставляющей организм атаковать собственные ткани. Пока неизвестно, что именно провоцирует аутоиммунные нарушения. Симптомы. Прочитайте дополнительные сведения , включая эндокринные нарушения. Возникает воспаление гипофиза (гипофизит), аутоиммунное заболевание щитовидной железы, вызывающее гипотиреоз Гипотиреоз Гипотиреоз — пониженная активность щитовидной железы, которая приводит к нарушенной выработке гормонов щитовидной железы и замедлению жизненно важных функций организма. У пациента появляется. Прочитайте дополнительные сведения , сахарный диабет Сахарный диабет (СД) Сахарный диабет — заболевание, при котором уровень сахара (глюкозы) в крови слишком высок, потому что организм не вырабатывает достаточного количества инсулина либо не может эффективно использовать. Прочитайте дополнительные сведения 1-го типа и снижение функции надпочечников Недостаточность надпочечников При недостаточности надпочечников они не вырабатывают достаточного количества гормонов. Недостаточность надпочечников может быть вызвана заболеванием надпочечников, заболеванием гипофиза или. Прочитайте дополнительные сведенияВрачи измеряют уровень гормонов в крови.
Лечение предусматривает возмещение гормонов, недостаточность которых документально подтверждена. Такие гормоны могут включать гормон щитовидной железы, инсулин и глюкокортикоиды.
ПРИМЕЧАНИЕ: Это — пользовательская версия ВРАЧИ: Нажмите здесь, чтобы перейти к профессиональной версии
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Синдромы полигландулярной недостаточности
(Аутоиммунные полигландулярные синдромы; Синдромы полигландулярной недостаточности)
, MD, Children's Hospital Colorado, Division of Pediatric Endocrinology
Синдромы полигландулярной недостаточности — это наследственные заболевания, при которых наблюдается одновременное или последовательное нарушение функции нескольких эндокринных желез.
Эндокринные железы Эндокринные железы Эндокринная система включает группу желез и органов, которые регулируют и контролируют различные функции организма, вырабатывая и секретируя гормоны. Гормоны — это химические вещества, оказывающие. Прочитайте дополнительные сведения — это органы, которые секретируют один или несколько особых гормонов. Фактическая причина нарушения функции эндокринной железы может быть связана с аутоиммунной реакцией Аутоиммунные нарушения Аутоиммунное нарушение является дисфункцией иммунной системы организма, заставляющей организм атаковать собственные ткани. Пока неизвестно, что именно провоцирует аутоиммунные нарушения. Симптомы. Прочитайте дополнительные сведения , при которой иммунная защита организма ошибочно атакует собственные клетки организма. Могут быть задействованы генетические факторы и провоцирующие факторы окружающей среды (например, вирусные инфекции, факторы питания или прием некоторых лекарственных препаратов). Синдромы полигландулярной недостаточности бывают трех типов.
Тип 1: Тип 1 также называется аутоиммунной полиэндокринопатией — кандидозной эктодермальной дистрофией [АПКЭД]). При этом типе, который развивается у детей, возможно снижение функции паращитовидных желез и надпочечников Недостаточность надпочечников При недостаточности надпочечников они не вырабатывают достаточного количества гормонов. Недостаточность надпочечников может быть вызвана заболеванием надпочечников, заболеванием гипофиза или. Прочитайте дополнительные сведения Candida (грибок) из-за нарушения. Прочитайте дополнительные сведенияТип 2: Тип 2 также называется синдромом Шмидта. При этом типе, который развивается у взрослых пациентов (в частности у женщин), снижается функция надпочечников и щитовидной железы, хотя иногда активность щитовидной железы повышается. У пациентов с полигландулярной недостаточностью 2-го типа может также возникнуть диабет Сахарный диабет (СД) Сахарный диабет — заболевание, при котором уровень сахара (глюкозы) в крови слишком высок, потому что организм не вырабатывает достаточного количества инсулина либо не может эффективно использовать. Прочитайте дополнительные сведения .
Тип 3: Этот тип очень похож на 2-й тип, но функция надпочечников остается нормальной.
У людей с синдромом полигландулярной недостаточности симптомы зависят от того, какие эндокринные органы подвержены воздействию. Гормональная недостаточность не всегда появляется одновременно, и ее развитие может потребовать нескольких лет. Синдромы недостаточности наблюдаются не в определенной последовательности, и не у каждого человека развиваются все виды недостаточности, связанные с каждым типом.
Симптомы
У людей с синдромом полигландулярной недостаточности симптомы зависят от того, какие эндокринные органы подвержены воздействию.
Снижение функции надпочечников Недостаточность надпочечников При недостаточности надпочечников они не вырабатывают достаточного количества гормонов. Недостаточность надпочечников может быть вызвана заболеванием надпочечников, заболеванием гипофиза или. Прочитайте дополнительные сведения Недостаточная активность щитовидной железы Гипотиреоз Гипотиреоз — пониженная активность щитовидной железы, которая приводит к нарушенной выработке гормонов щитовидной железы и замедлению жизненно важных функций организма. У пациента появляется. Прочитайте дополнительные сведенияНедостаточно активные паращитовидные железы: покалывание вокруг рта, судороги рук и ног и судорожные припадки
Диагностика
Анализы крови для измерения уровня гормонов
Врачи предполагают синдром полигландулярной недостаточности на основе конкретных симптомов. Диагноз подтверждается путем обнаружения недостаточных уровней гормонов в образцах крови. Иногда врачи также измеряют специфические антитела для выявления аутоиммунной реакции на пораженную железу.
Поскольку функция других эндокринных органов может быть не нарушена в течение многих лет, врачи обычно назначают лицам с гормональной недостаточностью анализы крови через регулярные интервалы времени, чтобы выявить любую новую недостаточность как можно скорее.
Поскольку эти синдромы часто передаются по наследству, могут проводиться также генетические анализы у родственников соответствующего пациента.
Лечение
Лечение направлено на замещение недостающих гормонов. Лечение недостаточности нескольких гормонов может быть более сложным, чем лечение недостаточности одного гормона. Пациентам, имеющим предрасположенность к молочнице, может потребоваться долгосрочное лечение с помощью противогрибковых лекарственных препаратов.
Аутоиммунный тиреоидит (тиреоидит Хашимото) - симптомы и лечение
Что такое аутоиммунный тиреоидит (тиреоидит Хашимото)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Хронический аутоиммунный (лимфоматозный) тиреоидит (ХАИТ) — хроническое заболевание щитовидной железы аутоиммунного происхождения, было описано Х. Хасимото в 1912 г. Заболевание чаще наблюдается у женщин и наиболее часто диагностируется среди известных патологий щитовидной железы. Аутоиммунный тиреоидит выявляется у одной из 10-30 взрослых женщин. [1]
Рассматриваемое заболевание аутоиммунной природы, и для него обязательно присутствие антител. Впервые опубликовали данные об обнаружении антител к ткани щитовидной железы в сыворотке у пациентов с аутоиммунным тиреоидитом в 1956 году. Впоследствии выяснилось, что аутоиммунный тиреоидит подразумевает наличие антител к тиреоглобулину, второму коллоидному антигену и тиреопероксидазе (микросомальному антигену).
Провоцирующие факторы
Сегодня принято считать, что апоптоз, то есть программируемая гибель фолликулярных клеток щитовидной железы — одна из главных причин аутоиммунного тиреоидита и других патологий щитовидной железы. [2] Предполагается, что запуску апоптоза способствуют вирусы и генетические нарушения.
Чем опасен тиреоидит во время беременности
Аутоиммунный тиреоидит у женщины никак не отражается на возможности забеременеть и родить здорового ребёнка при условии, что у пациентки нормальный уровень гормонов — тиреотропный гормон (ТТГ) до 2,5 мЕд/л, в том числе в первом триместре беременности.
При гормональном нарушении возможны следующие осложнения:
- ;
- выкидыш;
- преждевременные роды;
- проблемы со сном;
- поздний токсикоз; ;
- кровотечения после родов;
- гипоксия плода;
- неонатальный тиреотоксикоз.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы аутоиммунного тиреоидита
Изначально, на протяжении некоторого времени, больные не высказывают никаких жалоб. Постепенно с течением времени регистрируют медленное развитие клинической картины снижения функции щитовидной железы, вместе с тем в части ситуаций будет отмечаться прогрессирующее уменьшение размеров железы или же наоборот ее увеличение. [3]
Клинические проявления при хроническом аутоиммунном тиреоидите начинают появляться с нарушением функции щитовидной железы, но в части ситуаций симптомов может и не быть. Все симптомы аутоиммунного тиреоидита щитовидной железы неспецифические, т. е. могут быть при многообразных заболеваниях. Но несмотря на это, все же обозначим клинические проявления, имея которые следует обратиться к эндокринологу для обследования.

Патогенез аутоиммунного тиреоидита
Эндогенный (внутренний) критерий наследования аутоиммунных заболеваний взаимосвязан с клонами Т-лимфоцитов.
- Чтобы произошло развитие хронического заболевания с учетом имеющейся наследственной предрасположенности, нужно влияние экзогенных факторов (вирусных и любых других инфекций, фармпрепаратов), которые способствуют активации Т-лимфоцитов, те впоследствии активируют В-лимфоциты, запуская цепную реакцию.
- Далее Т-клетки, кооперируясь с антитиреоидными антителами, воздействуют на эпителиальные клетки фолликулов, содействуя их деструкции, вследствие чего снижается численность правильно функционирующих структурных единиц щитовидной железы. [1][4]
Количество антитиреоидных антител при этом заболевании непосредственно отражает выраженность аутоиммунного процесса и иногда имеет склонность уменьшаться по мере увеличения продолжительности заболевания. Только присутствия антитиреоидных антител недостаточно, чтобы травмировать структурные элементы щитовидной железы.
Для реализации токсических свойств имеющимся антителам необходимо вступить во взаимодействие с Т-лимфоцитами, которые чувствительны к антигенам щитовидной железы при ХАИТ, чего не бывает при наличии обычного зоба или если патология щитовидной железы не выявлена.
В норме все клетки имеют иммунологическую нечувствительность к другим клеткам собственного организма, которая приобретается во время внутриутробного развития (еще до рождения), во время взаимодействия зрелых лимфоцитов со своими антигенами. Любые нарушения в данном взаимодействии и синтез особых клонов Т-лимфоцитов, которые вступают во взаимодействие со своими же антигенами, и могут стать той причиной, которая приводит к нарушению иммунологической нечувствительности и впоследствии привести к формированию любых аутоиммунных патологий, включая и ХАИТ.
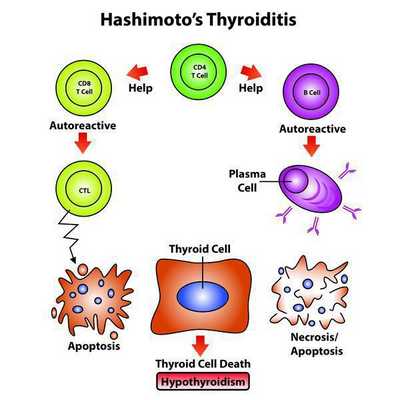
Классификация и стадии развития аутоиммунного тиреоидита
Формы ХАИТ с учетом объема железы и данных клиники:
- Гипертрофическая (тиреоидит Хасимото). Наиболее распространена. Щитовидная железа отличается плотностью, увеличена до II или III степени. Функция железы чаще не изменена, однако в большинстве ситуаций регистрируют тиреотоксикоз или гипотиреоз. Встречается у 15-20% больных.
- Атрофическая. Щитовидная железа в норме или незначительно увеличена, а на момент осмотра может быть даже уменьшена. Функционально — гипотиреоз. Встречается у 80-85% пациентов.
Еще одна классификация аутоиммунного тиреоидита щитовидной железы: [2]
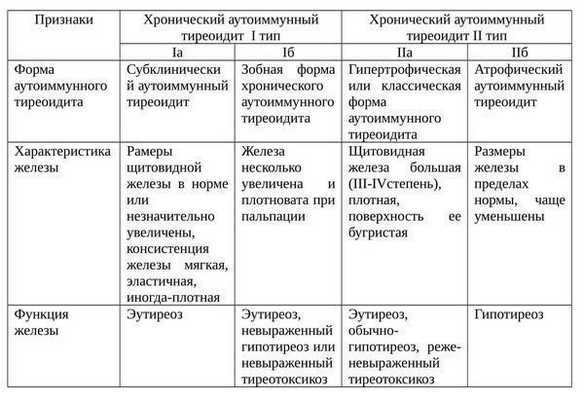
Фазы ХАИТ с учетом клинической картины заболевания:
- Эутиреоидная. Бессимптомное продолжительное (иногда пожизненное) течение, без изменений в функции щитовидной железы.
- Субклиническая. Если заболевание прогрессирует, то поскольку происходит деструкция клеток щитовидной железы и уменьшается уровень тиреоидных гормонов, повышается синтез тиреотропного гормона (ТТГ), который в свою очередь чрезмерно стимулирует щитовидную железу, благодаря чему организм поддерживает на нормальном уровне секрецию Т4.
- Фаза тиреотоксикоза. Поскольку заболевание продолжает развиваться, в кровь высвобождаются имеющиеся тиреоидные гормоны и формируется тиреотоксикоз. Не считая этого, в кровь попадают разрушенные части внутренних структур фолликулярных клеток, в результате образуются антитела к клеткам щитовидной железы. Когда при прогрессирующей деструкции щитовидной железы концентрация гормонопродуцирующих клеток снижается ниже допустимого предела, концентрация в крови Т4 стремительно уменьшается, развивается стадия явного гипотиреоза.
- Фаза гипотиреоза. Продолжается приблизительно в течение года, чаще всего после этого происходит восстановление функции щитовидной железы. Иногда гипотиреоидная фаза продолжается всю жизнь.
ХАИТ преимущественно протекает только с одной фазой заболевания. [5]
Осложнения аутоиммунного тиреоидита
ХАИТ — условно безопасное заболевание, не приводящее к осложнениям только при условии сохранения необходимой концентрации гормонов в крови, т. е. эутиреоидного состояния. И, соответственно, тогда никаких осложнений не развивается. Но при наступлении гипотиреоза могут наблюдаться осложнения. При отсутствии лечения гипотиреоза могут возникать осложнения: нарушение репродуктивной функции, выраженное снижение памяти, вплоть до слабоумия, анемия, но самое грозное и тяжелое осложнение гипотиреоза — гипотиреоидная или мексидематозная кома — возникает при резкой недостаточности гормонов щитовидной железы. [5] [6]
Диагностика аутоиммунного тиреоидита
Диагностика ХАИТ состоит из нескольких пунктов. Для определения данного заболевания у больного необходим минимум один большой критерий, если таких критериев не обнаружено, то диагноз лишь вероятен. [1]
Большие диагностические критерии:
- первичный гипотиреоз (причем возможен как манифестный, так и устойчивый субклинический);
- присутствие антител к ткани щитовидной железы;
- ультразвуковые критерии аутоиммунной патологии.
Пальпация щитовидной железы
Какие анализы нужны, чтобы определить АИТ
Для установления аутоиммунного тиреоидита необходимо сдать кровь на тиреотропный гормон ( ТТГ), тироксин свободный (Т4 свободный) и антитела к тиреопероксидазе (ТПО). Если антитела к ТПО повышены, но ТТГ в пределах нормы, то диагноз АИТ носит вероятный характер.
Нужно заметить, что при обнаружении у больного гипотиреоза манифестного или стабильного субклинического, диагностирование аутоиммунного тиреоидита важно для установления причины уменьшения функции железы, но несмотря на это постановка диагноза никак не меняет терапевтических методов. Лечение заключается в употреблении заместительной гормональной терапии препаратами тиреоидных гормонов.
Использование пункционной биопсии щитовидной железы не показано для установления хронического аутоиммунного тиреоидита. Ее необходимо проводить, только если имеются узлы щитовидной железы, более 1 см в диаметре.
Важно отметить, что нет надобности контролировать в течение болезни количество имеющихся антител к щитовидной железе, потому что данная процедура не имеет диагностической роли для анализа прогрессирования аутоиммунного тиреоидита. [7]
Лечение аутоиммунного тиреоидита
Терапия аутоиммунного тиреоидита щитовидной железы неспецифическая. При формировании фазы тиреотоксикоза достаточно применения симптоматической терапии. При формировании гипотиреоза главным вариантом медикаментозной терапии является назначение тиреоидных гормонов. Сейчас в аптечной сети РФ возможно приобрести только таблетки Левотироксина натрия (L-тироксин и Эутирокс). Применение таблетированных препаратов тиреоидных гормонов нивелирует клинику гипотиреоза и при гипертрофической форме аутоиммунного тиреоидита вызывает уменьшение объема щитовидной железы до допустимых значений.
В случае обнаружения у пациента манифестного гипотиреоза (повышение уровня тиреотропного гормона и снижение концентрации Т4 свободного) необходимо использование в лечении левотироксина натрия в средней дозе 1,6 - 1,8 мкг/кг массы тела пациента. Показателем правильности назначенного лечения будет являться уверенное удержание в пределах референсных значений тиреотропного гормона в крови больного.
Когда у больного диагностирован субклинический гипотиреоз (увеличена концентрация ТТГ в совокупности с неизмененной концентрацией Т4 свободного), необходимо:
- Спустя 3-6 месяцев вторично провести гормональное обследование для доказательства наличия изменения функции щитовидной железы;
- Когда в течение беременности у пациентки обнаружено увеличение уровня тиреотропного гормона, даже при сохраненной концентрации Т4 свободного, назначить левотироксин натрия в полной расчетной заместительной дозе сразу же;
- Лечение левотироксином натрия нужно при постоянном субклиническом гипотиреозе (увеличение концентрации тиреотропного гормона в крови свыше 10 мЕд/л, и еще в ситуациях не менее двукратного определения концентрации тиреотропного гормона между 5 - 10 мЕд/л), но если этим больным более 55 лет и у них имеются сердечно-сосудистые патологии, лечение левотироксином натрия назначается только при отличной переносимости лекарства и при отсутствии сведений о декомпенсации данных болезней на фоне приема тироксина;
- Показатель достаточности лечения субклинического гипотиреоза представляет собой стабильное удержание уровня ТТГ в пределах референсных значений в крови.
Если у женщин перед планированием беременности, выявлены антитела к ткани щитовидной железы и/или ультразвуковые признаки аутоиммунного тиреоидита, нужно определить гормональную функцию щитовидной железы (концентрацию тиреотропного гормона и концентрацию Т4 свободного) и обязательно определять уровень гормонов в каждом триместре беременности. [8]
Если поставлен диагноз аутоиммунный тиреоидит, но не выявляются изменения в работе щитовидной железы, применение препаратов левотироксина натрия не показано. [9] Оно возможно иногда в исключительных ситуациях внушительного увеличения объема щитовидной железы, спровоцированного аутоиммунным тиреоидитом, при этом решение принимается по каждому пациенту индивидуально. [10]
Физиологическое количество калия йодита (приблизительно 200 мкг/сутки) не могут спровоцировать формирование гипотиреоза и не осуществляют негативного воздействия на функцию щитовидной железы при ранее развившемся гипотиреозе, вызванном аутоиммунным тиреоидитом.
Питание при аутоиммунном тиреоидите
Продуктов, которые влияют на течение аутоиммунного тиреоидита, не существует. Глютен или лактоза не имеют отношения к гипотиреозу на фоне АИТ. Поэтому рекомендации по питанию для людей с аутоиммунным тиреоидитом такие же, как и для всех остальных: разнообразное сбалансированное питание с достаточным употреблением воды.
Существуют ли народные способы лечения
Аутоиммунный тиреоидит лечат только медицинскими препаратами, которые назначает эндокринолог. Отсутствие адекватной терапии может грозить опасными осложнениями: нарушением репродуктивной функции, выраженным снижением памяти (вплоть до слабоумия), анемией и комой, которая возникает при резкой недостаточности гормонов щитовидной железы.
Прогноз. Профилактика
Хронический аутоиммунный тиреоидит прогрессирует обычно крайне медленно, с развитием гипотиреоидного состояния спустя несколько лет. В отдельных ситуациях состояние и трудоспособность сохраняются в течение 15-18 лет, даже с учетом непродолжительных обострений. В фазе обострения тиреоидита регистрируются симптомы невыраженного либо гипотиреоза, либо тиреотоксикоза.
Сегодня методов профилактики хронического аутоиммунного тиреоидита не найдено.
Аутоиммунные болезни от нервов: уже доказано!

Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 12.12.2019
- Reading time: 3 минут чтения
Ученые выяснили, что аутоиммунные заболевания вызываются стрессом.
Среди множества заболеваний эти патологии считаются наиболее слабоизученными. При их возникновении по каким-то неизвестным причинам организм вдруг начинает «атаковать» собственные ткани или клетки, принимая их за чужие.
Это приводит к возникновению воспалительных процессов, поражающих практически все органы - кожу, суставы, сердце, печень, почки, репродуктивную систему, кишечник, щитовидную железу.
Механизм возникновения аутоиммунных патологий
Иммунную систему можно сравнить с армией, охраняющей организм от вирусов, микробов, простейших и других «названных гостей». Иммунитет также уничтожает раковые и другие патологические клетки.
Любой инородный белок, попавший в организм, оценивается по принципу свой-чужой. При обнаружении угрозы иммунная система приступает к уничтожению. Для этого плазматические клетки, вырабатывают особые вещества - антитела- иммуноглобулины (Ig). Их задача - связать «пришельцев» и «пометить» их для последующего уничтожения. Возникают комплексы антиген-антитело, которые распознаются и уничтожаются специальными белками или клетками-фагоцитами.
Уничтожением чужеродных белков занимается ещё один вид иммунных клеток Т-лимфоциты. Они отыскивают « пришельцев» по специфическим комплексам, образующимся в организме в ответ на их внедрение. Т- лимфоциты уничтожают даже собственные клетки, если они заражены.
Образующиеся при иммунном ответе иммуноглобулины Ig сохраняются после выздоровления. При повторном заражении они быстро нейтрализуют возбудителей и болезнь не возникает. Поэтому краснухой, свинкой, ветрянкой, корью и некоторыми другими инфекциями можно переболеть всего один раз.
Здоровая иммунная система умеет отличать «своих» от «чужих», давая команду на уничтожение только болезнетворных микроорганизмов и не трогая нужные белки, соединения и ткани. Такое свойство называют толерантностью.

Уничтожение болезнетворных микроорганизмов
Однако, в некоторых случаях, по каким-то причинам толерантность иммунной системы нарушается. Она начинает атаковать ткани собственного организма, ферменты и белки, принимая их за чужеродные компоненты.
В результате образуется аутоантитела к собственным клеткам и нужным веществам, вырабатываемым организмом. У больного развивается аутоиммунное заболевание. В крови обнаруживаются патологические антитела и маркеры воспаления- С-реактивный белок, ускоренное СОЭ.
Эти патологии могут затрагивать самые разные органы и ткани:
- Суставы, с возникновением множественных воспалений - полиартритов.
- Сердце, с возникновением сердечных пороков.
- Поджелудочной железы, с развитием юношеского диабета.
- Нервной системы с возникновением рассеянного склероза.
- Кожи. При аутоиммунных патологиях на ней появляются высыпания, корочки, язвы.
- Почек, с развитием аутоиммунного нефрита- поражения, приводящего к почечной недостаточности.
- Репродуктивной системы, с возникновением аутоиммунного оофорита.
- Щитовидной железы, с развитием воспаления - тиреоидита Хашимото.
- Надпочечников, с развитием болезни Аддисона, при которой эти органы не могут вырабатывать достаточное количество гормонов.
- Слюнных и слёзных желез с развитием синдрома Шегрена, сопровождающегося сухостью глаз и слизистых оболочек.
- Кишечника с развитием болезни Крона. При этой патологии на его стенке образуются язвы и уплотнения (инфильтраты). Больные страдают от боли в животе, нарушений пищеварения и кровотечений.
Некоторые аутоиммунные заболевания, например, красная волчанка, поражают весь организм, вызывая изменения в сосудах, суставах, почках, коже.
Лечатся аутоиммунные заболевания очень тяжело. Больным назначают гормоны, а иногда даже химиопрепараты, которые обычно применяются при раке. Причины этих заболеваний доподлинно неизвестны, но недавно ученые выяснили, что они чаще развиваются на фоне стрессов.
Стресс нарушает работу иммунной системы
Чтобы понять взаимосвязь между стрессом и аутоиммунными заболеваниями в Швеции провели исследование, в котором участвовали 106 464 пациента, подвергшихся воздействию стрессовых ситуаций, и 1 064 640 лиц, не подвергшихся такому воздействию. Обследовали 126 652 братьев и сестер пациентов, перенёсших серьезные нервные потрясения.
Средний возраст пациентов составил 41 год, а всего в исследовании участвовали лица в возрасте 30-50 лет, 40% из них которых были мужчинами. В течение 10 лет заболеваемость аутоиммунными патологиями в группе лиц, переживших стрессовую ситуацию, составила 9,1 на 1000 чел. / год.
У лиц, не подвергавшихся стрессовым ситуациям количество аутоиммунных патологий было гораздо ниже - 6 на 1000 чел./ год. Примерно такой же показатель наблюдался у братьев и сестёр пациентов, перенёсших стресс и заболевших аутоиммунными болезнями. Это указывает на слабую связь заболеваний с наследственностью и высокую - с отрицательными воздействиями на нервную систему.
Особенно высоким было число аутоиммунных заболеваний у пациентов, подвергшихся посттравматическому стрессовому расстройству. Так называется состояние, возникшее на фоне выраженных психотравмирующих обстоятельств - военных действий, природных катаклизмов, дорожно-транспортных происшествий, насилия, террористических актов.
Заболеваемость аутоиммунными патологиями надпочечников у больных после посттравматического стрессового расстройства превышала средние показатели более, чем в 2 раза. Сахарный диабет и аутоиммунный тиреоидит у них возникали на нас 40-50% чаще.

Сахарный диабет
У пострадавших в ходе террористических актов, произошедших в Париже 13.11.15 года, была описана настоящая «эпидемия» болезни Крона и рассеянного склероза . Это еще раз показывает связь аутоиммунных патологий и стрессовых ситуаций.
Поэтому после перенесенных тяжелых психотравмирующих ситуаций нужно обратиться к врачу и обследоваться. Следует сдать кровь на общий анализ, на С-реактивный белок, антитела и основные биохимические показатели. Нужно также сдать общий анализ мочи. Так можно выявить аутоиммунные патологии на самых ранних стадиях, чтобы вовремя начать их лечение.
Гормоны, которые выделяются при стрессе, влияют на активность клеток иммунной системы. При сильных переживаниях человек может стать более восприимчивым к действию возбудителей вирусных инфекций. Именно поэтому при сильном стрессе люди чаще болеют гриппом и другими ОРВИ.
Для предупреждения таких случаев врачи назначают препарат, который снижает риск развития осложнений, требующих приема антибиотиков, в 4 раза. Это новый для вирусов препарат Нобазит. Случаи устойчивости возбудителей разных типов гриппа и ОРВИ к действующему веществу (энисамия йодид) встречаются крайне редко. Исследования, проведенные в Иллинойском технологическом институте, США, показали, что введение энисамия йодида уже через 4 часа приводит к 100-кратному снижению концентрации вируса AH1N1 (свиной грипп).
Нобазит обладает прямым противовирусным действием в комплексе с противовоспалительным. Препарат быстро снижает выраженность основных клинических симптомов и способствует сокращению продолжительности заболевания.
Читайте также:
