Аутологичная трансплантация гемопоэтических стволовых клеток (ауто-ТГСК) при остром миелобластном лейкозе (ОМЛ) - эффективность
Добавил пользователь Владимир З. Обновлено: 13.01.2026
Резюме. Цель исследования. Оценить эффективность аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК) у пациентов с острым миелобластным лейкозом в первой ремиссии в зависимости от режимов кондиционирования, источника трансплантата, особенностей реципиента и донора. Материалы и методы. У 66 пролеченных пациентов сравнивали эффективность алло-ТГСК от родственного (n=26) и неродственного (n=40) доноров, в том числе частично HLA-несовместимого (n=4). По данным цитогенетического обследования, 7 (11%) пациентов относились к группе низкого риска, 31 (47%) - к группе промежуточного и 10 (15%) - к группе высокого риска. Результаты. Пятилетняя общая выживаемость (ОВ) и летальность, связанная с трансплантацией, составили при родственной алло-ТГСК 56 и 22%, при HLA-совместимой - 68 и 23%, при частично HLA-несовместимой - 71 и 25% соответственно (р=0,8 и р=0,7). Риск развития рецидива при неродственной алло-ТГСК был значительно ниже, чем при родственной, - 13 и 35% соответственно (р=0,08). При монофакторном анализе результаты ОВ зависели от цитогенетической группы риска (в группе высокого риска ОВ составила 24%, в группе промежуточного - 64%; р=0,027). Показано, что вероятность развития рецидивов при наличии хронической реакции трансплантат против хозяина - РТПХ (р=0,01) и острой РТПХ 3-й степени меньше, чем при с острой РТПХ 1-2-й степени (р=0,06). Заключение. Результаты ОВ после алло-ТГСК от родственного и неродственного доноров сопоставимы и не зависели от источника трансплантата, режима кондиционирования и других особенностей донора и реципиента.
Ключевые слова
Полный текст
Аллогенная трансплантация гемопоэтических стволовых клеток при остром миелобластном лейкозе в первой ремиссии. - Резюме. Цель исследования. Оценить эффективность аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК) у пациентов с острым миелобластным лейкозом в первой ремиссии в зависимости от режимов кондиционирования, источника трансплантата, особенностей реципиента и донора. Материалы и методы. У 66 пролеченных пациентов сравнивали эффективность алло-ТГСК от родственного (n=26) и неродственного (n=40) доноров, в том числе частично HLA-несовместимого (n=4). По данным цитогенетического обследования, 7 (11%) пациентов относились к группе низкого риска, 31 (47%) - к группе промежуточного и 10 (15%) - к группе высокого риска. Результаты. Пятилетняя общая выживаемость (ОВ) и летальность, связанная с трансплантацией, составили при родственной алло-ТГСК 56 и 22%, при HLA-совместимой - 68 и 23%, при частично HLA-несовместимой - 71 и 25% соответственно (р=0,8 и р=0,7). Риск развития рецидива при неродственной алло-ТГСК был значительно ниже, чем при родственной, - 13 и 35% соответственно (р=0,08). При монофакторном анализе результаты ОВ зависели от цитогенетической группы риска (в группе высокого риска ОВ составила 24%, в группе промежуточного - 64%; р=0,027). Показано, что вероятность развития рецидивов при наличии хронической реакции трансплантат против хозяина - РТПХ (р=0,01) и острой РТПХ 3-й степени меньше, чем при с острой РТПХ 1-2-й степени (р=0,06). Заключение. Результаты ОВ после алло-ТГСК от родственного и неродственного доноров сопоставимы и не зависели от источника трансплантата, режима кондиционирования и других особенностей донора и реципиента.
Об авторах
С Н Бондаренко
Институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, СПбГМУ им. акад. И.П. Павлова
Е В Семенова
В Н Вавилов
Н В Станчева
Е В Морозова
А Л Алянский
Е В Бабенко
Н Э Осипова
Л С Зубаровская
Б В Афанасьев
Список литературы
© ООО "Консилиум Медикум", 2013
Эта статья доступна по лицензии Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
ЭФФЕКТИВНОСТЬ ВЫСОКОДОЗНОЙ КОНСОЛИДАЦИИ И АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА В ПЕРВОЙ РЕМИССИИ ОСТРОГО МИЕЛОИДНОГО ЛЕЙКОЗА
Введение. Вопрос выбора наиболее адекватной стратегии лечения острого миелоидного лейкоза (ОМЛ) в случаях, когда по какимлибо причинам невозможно выполнить аллогенную трансплантацию гемопоэтических стволовых клеток (аллоТГСК), до сих пор остается открытым.
Цель исследования - оценка долгосрочной выживаемости у пациентов с ОМЛ, получивших в качестве консолидации химиотерапию (ХТ) или аутологичную ТГСК (аутоТГСК) в 1-й ремиссии заболевания.
Материалы и методы. В исследовании участвовали 135 пациентов в возрасте от 18 до 67 лет с диагнозом ОМЛ (кроме М3 по классификации FAB). Из них 100 пациентов получали только программную ХТ, 35 больным в качестве консолидации проведена аутологичная трансплантация костного мозга. Пациенты, достигшие ремиссии после завершения индукционных курсов ХТ, в качестве консолидации получали 1 из 3 вариантов лечения: 1) ХТ стандартной интенсивности (сХТ); 2) высокодозную ХТ (ВДХТ); 3) аутоТГСК после 1-2 курсов высокодозной ХТ. К неблагоприятным факторам прогноза были отнесены: возраст >40 лет, гиперлейкоцитоз >50,0 × 10 9/л, а также неблагоприятный цитогенетический и молекулярно-биологический риск.
Результаты. В соответствии с количеством факторов неблагоприятного прогноза в дебюте заболевания безрецидивная выживаемость (БРВ) составила 47 % при их отсутствии, 45 % - при наличии 1 фактора, при наличии 2 факторов - 14 % (p = 0,000) вне зависимости от варианта консолидационной терапии (сХТ, ВДХТ, аутоТГСК). Исходный высокий уровень лейкоцитов при проведении только ХТ (сХТ и ВДХТ) негативно влияет на общую выживаемость (ОВ) (38 % против 22 %) и увеличивает частоту рецидивов (52 % против 69 %). При исходном уровне лейкоцитов >50,0 × 10 9/л 5-летняя ОВ при проведении аутоТГСК и ВДХТ составила 60 %. Выполнение аутоТГСК при недостижении ремиссии после 1-го индукционного курса ХТ ассоциировано с лучшей 2-летней ОВ (62 % против 35 %, p = 0,05), бессобытийной выживаемостью (БСВ) (50 % против 22 %, p = 0,05) и БРВ (50 % против 37 %, p = 0,05) по сравнению с ВДХТ и сХТ. В группе благоприятного цитогенетического риска при проведении аутоТГСК 5-летняя БРВ составила 80 %, при проведении только ХТ - 67 %, что не отразилось на 5-летней ОВ - она составила 80 % вне зависимости от варианта консолидационной терапии.
Заключение. АутоТГСК - предпочтительный вариант консолидации у пациентов группы благоприятного риска и у лиц, не достигших ремиссии после 1-го курса ХТ.
Ключевые слова
Об авторах
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, ФГБОУ ВО Первый Санкт-Петербургский государственный медицинский университет им. И. П. Павлова Минздрава России; СПбГБУЗ «Городская клиническая больница № 31»
Россия
Самородова Ирина Анатольевна
197022 Санкт-Петербург, ул. Льва Толстого, 6/8, 197110 Санкт-Петербург, пр-т Динамо, 3
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, ФГБОУ ВО Первый Санкт-Петербургский государственный медицинский университет им. И. П. Павлова Минздрава России
Россия
197022 Санкт-Петербург, ул. Льва Толстого, 6/8
Аутологичная трансплантация гемопоэтических стволовых клеток (ауто-ТГСК) при остром миелобластном лейкозе (ОМЛ) - эффективность
алло-ТГСК — аллогенная трансплантация гемопоэтических стволовых клеток
БВ — безрецидивная выживаемость
Д+ — день после трансплантации
КМ — костный мозг
МAК — миелоаблативные режимы кондиционирования
ОВ — общая выживаемость
ОМЛ — острый миелобластный лейкоз
ПСКК — периферические стволовые клетки крови
РИК — режим кондиционирования со сниженной интенсивностью
РТПЛ — реакция трансплантат против лейкоза
РТПХ — реакции трансплантат против хозяина
TRM (transplant-related mortality) — летальный исход, связанный с трансплантацией
Не вызывает сомнения, что аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) — один из наиболее эффективных методов лечения пациентов со злокачественными заболеваниями системы крови. Терапевтический эффект алло-ТГСК связан с двумя принципиально различными механизмами воздействия на лейкозные клоногенные клетки: использованием цитостатических препаратов и иммунологической реакцией трансплантат против лейкоза (РТПЛ).
Острый миелобластный лейкоз (ОМЛ) — одно из наиболее частых показаний к алло-ТГСК (родственной, неродственной, гаплоидентичной) [1]. Двухлетняя общая выживаемость (ОВ) пациентов составляет 18—30 и 52% соответственно при сравнении результатов терапии без алло-ТГСК и c проведенной алло-ТГСК [2—4]. До последнего времени факторами, ограничивающими проведение алло-ТГСК, были возраст пациента, стадия заболевания, высокий индекс коморбидности, обусловленный сопутствующими заболеваниями [5]. Внедрение режимов кондиционирования со сниженной токсичностью и новых препаратов для поддерживающей терапии существенно расширило границы применения метода, сняв ограничения по возрасту и стадии заболевания для проведения алло-ТГСК. Дополнительным фактором, определяющим сроки проведения алло-ТГСК, является наличие/отсутствие HLA-совместимого донора. Хорошо известно, что совместимый родственный донор доступен не более чем 30% пациентов, возможность нахождения неродственного донора для остальных колеблется от 40 до 80% и напрямую зависит от этнической принадлежности реципиента. Тем не менее рост числа алло-ТГСК при ОМЛ за последние годы в основном происходит за счет алло-ТГСК от неродственного донора у пациентов в первой ремиссии [6].
Интенсивность применения алло-ТГСК на более ранних стадиях заболевания по-прежнему ограничивает летальность, связанную с трансплантацией, которая более высокая в группе пациентов, получивших алло-ТГСК от неродственного донора [7—9]. Это обстоятельство сохраняет тенденцию к взвешенному подходу и попытке сохранения баланса при принятии решения в пользу алло-ТГСК между летальностью после алло-ТГСК и риском рецидива ОМЛ.
Решающим показанием к алло-ТГСК в первой ремиссии ОМЛ в настоящее время служит наличие факторов, прогнозирующих рецидив ОМЛ. Особая роль при определении показаний к алло-ТГСК принадлежит цитогенетическим [10] и молекулярно-биологическим [11] факторам прогноза. На основании структурных и количественных хромосомных аберраций пациенты с ОМЛ делятся на 3 группы риска. Доля больных благоприятной группы риска составляет 10—20% (кариотип — t(8;21)(q22;q22); inv(16)(p13.1q22) или t(16;16)(p13.1;q22); мутации в генах NPM1, CEBPA). По данным рандомизированных исследований, алло-ТГСК в этой группе больных в первой ремиссии не имеет преимуществ по сравнению с химиотерапией (ХТ) [12—14]. Пятилетняя ОВ и безрецидивная выживаемость (БВ) равна 55 и 46% соответственно [15]. Доля пациентов высокой группы риска составляет 30—40% (кариотип — inv(3)(q21q26.2) или t(3;3)(q21;q26.2); t(6;9)(p23;q34); t(v;11)(v;q23); -5 или del(5q); -7; abnl(17p); комплексные аномалии кариотипа). Алло-ТГСК этой группе пациентов показана в первой ремиссии как общепринятый стандарт. 3-летняя ОВ пациентов с ОМЛ в первой ремиссии и неблагоприятными хромосомными аномалиями после родственной и неродственной алло-ТГСК составляет 45 и 37%, а трехлетняя БВ — 42 и 34% соответственно [16], что существенно выше данных ХТ — 3,6—5 и 8% соответственно [15, 17]. Почти 40—50% пациентов находятся в группе промежуточного прогноза. У них имеется нормальный кариотип и отсутствуют молекулярно-биологические маркеры. Для этой группы пациентов вопрос необходимости алло-ТГСК в первой ремиссии остается открытым.
Цель исследования: оценить эффективность алло-ТГСК у пациентов с ОМЛ в первой ремиссии заболевания в зависимости от режимов кондиционирования, источника трансплантата, особенностей реципиента и донора.
Материалы и методы
В исследование включили 66 пациентов в возрасте от 8 до 60 лет с диагнозом ОМЛ, которым проведена алло-ТГСК в первой ремиссии в период с 2003 по 2012 г.; медиана наблюдения 12 мес (3—101 мес).
В соответствии с цитогенетическими группами риска больные распределились следующим образом: низкий риск (t(8;21)(q22;q22); inv(16)(p13.1q22) или t(16;16)(p13.1;q22)) — у 7 (11%), промежуточный риск (нормальный кариотип, хромосомные аномалии, не относящиеся к низкому и высокому риску) — у 31 (47%) и высокий риск (inv(3)(q21q26.2) или t(3;3)(q21;q26.2); t(6;9)(p23;q34); t(v;11)(v;q23); -5 или del(5q); -7; abnl(17p); комплексные аномалии кариотипа) — у 10 (15%). Цитогенетическое исследование не проводилось у 18 (27%) пациентов.
Показанием к алло-ТГСК у больных ОМЛ в первой ремиссии с низким риском по цитогенетической классификации явилось наличие признаков минимальной остаточной болезни после окончания курсов консолидации или первичная резистентность, характеризующаяся отсутствием ремиссии острого лейкоза после двух курсов индукционной терапии.
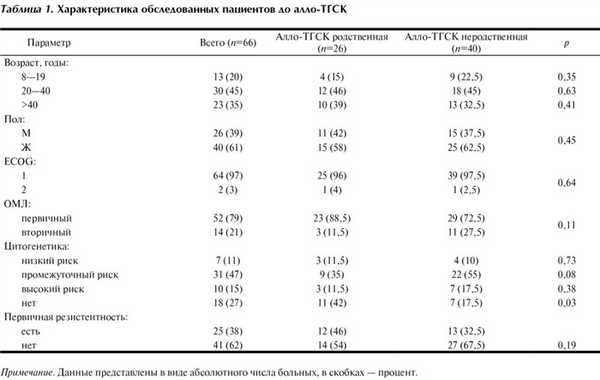
Характеристика пациентов до алло-ГСК представлена в табл. 1.
Алло-ТГСК от родственного донора проведена 26 пациентам, алло-ТГСК от неродственного донора — 40, из них 4 от частично HLA-несовместимых в локусах генов А, С и DQB1 доноров. Миелоаблативные режимы кондиционирования (MAК) включали бусульфан в дозе 16 мг/кг и циклофосфан в дозе 120 мг/кг, режимы кондиционирования со сниженной интенсивностью (РИК) — сочетание флюдарабина — 150 мг/м 2 с бусульфаном 8 мг/кг или мелфаланом 140 мг/м 2 .
Для профилактики острой реакции трансплантат против хозяина (РТПХ) использовали циклоспорин А или такролимус в комбинации с метотрексатом (15 мг/м 2 в 1-й день после трансплантации — Д+1 и 10 мг/м 2 в 3-й и 6-й дни после трансплантации — Д+3 и Д+6) или мофетила микофенолатом (30 мг/кг 2 раза в сутки). При алло-ТГСК от неродственного донора с целью профилактики острой РТПХ в режим кондиционирования добавляли антилимфоцитарный глобулин в дозе 60 мг/кг.
Режимы кондиционирования со сниженной токсичностью назначали пациентам с высокой степенью «предлеченности», осложнениями тяжелой степени при проведении ХТ, в возрасте старше 40 лет, с высоким индексом коморбидности.

Источником трансплантата при родственной алло-ТГСК наиболее часто был костный мозг (КМ) — у 28 (42%) пациентов, а в случае неродственной алло-ТГСК — периферические стволовые клетки крови (ПСКК) — у 37 (56%). Подробные характеристики реципиента, донора и трансплантата представлены в табл. 2.
Статистический анализ данных выполняли в программе SPSS Statistics v.17 и Statistica 8. ОВ рассчитана по методу Каплана—Майера. Летальность, связанная с трансплантацией, и вероятность рецидива определяли с помощью программы R Statistic. Сравнение ОВ выполняли при помощи логрангового теста, сравнительный анализ долей — с использованием точного критерия Фишера. Так называемыми конечными точками, т.е. оцениваемыми исходами, были алло-ТГСК, смерть, связанная с трансплантацией, рецидив, острая и хроническая РТПХ. Данные о пациентах, которые оставались в состоянии ремиссии на момент анализа, представлены на 01.09.12.
Результаты
Первичное неприживление трансплантата отмечено у 1 (4%) пациента после родственной и у 1 (2,5%) пациента после неродственной алло-ТГСК. Пациент после родственной алло-ТГСК умер на Д+28 от тяжелого геморрагического синдрома, после неродственной алло-ТГСК — на Д+39 в результате сепсиса и полиорганной недостаточности, несмотря на реинфузию аутологичных клеток КМ, выполненную на Д+30.
Общая выживаемость пациентов после различных видов алло-ТГСК. 9-летняя ОВ пациентов с ОМЛ после алло-ТГСК в первой ремиссии вне зависимости от типа донора и источника трансплантата составила 65%, БВ — 50% (табл. 4). Не выявлена зависимость ОВ от источника трансплантата и степени совместимости по HLA-системе пары реципиент—донор. Результаты 5-летней ОВ при алло-ТГСК от родственного, полностью или частично HLA-несовместимого неродственного донора сопоставимы: 56, 68 и 71% (р=0,8) (см. рисунок, а). Рисунок 1. ОВ пациентов с ОМЛ в первой ремиссии после алло-ТГСК в зависимости от типа донора и HLA-совместимости (а; n=66).
ОВ пациентов также не зависела от возраста на момент проведения алло-ТГСК: от 8 до 19 лет — 67%, от 20 до 40 лет — 63%, старше 40 лет — 60% (р=0,45). Пятилетняя ОВ пациентов с вторичными ОМЛ не отличалась от таковой у больных первичным ОМЛ — 80 и 60% соответственно (р=0,36). ОВ при использовании МАК была выше, чем при РИК, — 78 и 58% соответственно, однако различие не достигало статистической значимости (р=0,4).
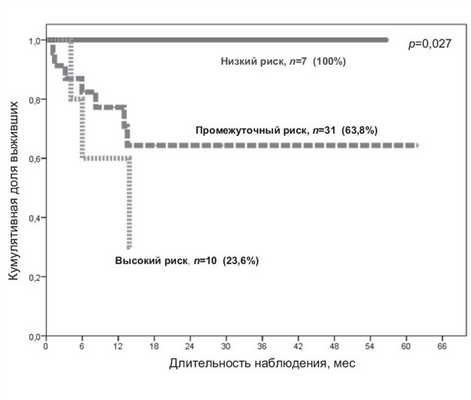
В нашем исследовании показано, что ОВ зависит от цитогенетической группы риска: в группе высокого риска ОВ составила 24%, в группе промежуточного риска — 64%, в группе низкого риска — 100% (р=0,027) (см. рисунок, б). Рисунок 1. ОВ пациентов с ОМЛ в первой ремиссии после алло-ТГСК в зависимости от цитогенетических групп риска (б; n=48).
Не выявлено влияния на ОВ первичной химиорезистентности, ЦМВ-статуса донора и реципиента, их несовместимости по полу и группе крови по системе АВ0, а также использования КМ по сравнению с ПСКК. Профилактика острой РТПХ на основе режимов, содержащих циклоспорин А, несколько увеличивала ОВ пациентов — 71%, при применении такролимуса — 53%, однако это различие не было статистически значимым (р=0,55) (см. табл. 4).
Из неинфекционных осложнений, связанных с алло-ТГСК, только острая РТПХ IV степени оказывала существенное влияние на выживаемость пациентов — 0. При вариантах I—II и III степени острой РТПХ 5-летняя ОВ была равна 80%.
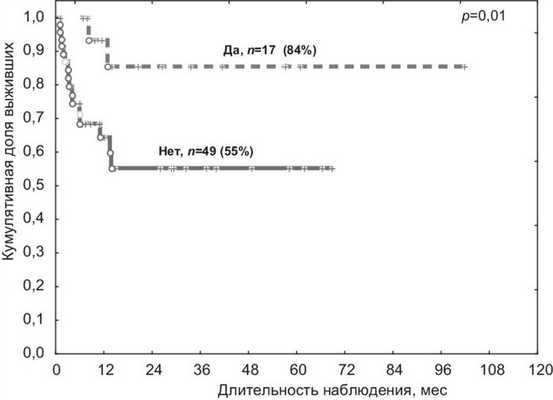
При долгосрочном наблюдении пациентов с ОМЛ в первой ремиссии с хронической РТПХ выявлено достоверное увеличение 5-летней ОВ по сравнению с пациентами без хронической РТПХ — 84 и 55% соответственно (р=0,01) (см. рисунок, в), Рисунок 1. ОВ пациентов с ОМЛ в первой ремиссии после алло-ТГСК в зависимости от развития хронической РТПХ (в; n=66). что было ассоциировано со снижением риска рецидива в общей группе пациентов (р=0,01) (см. табл. 4).
Осложнения после алло-ТГСК. Вероятность рецидива и летальность, связанная с трансплантацией, не зависели от возраста и пола пациента, вида ОМЛ (первичный или вторичный), наличия первичной химиорезистентности, ЦМВ-статуса донора и реципиента, их несовместимости по полу и группе крови по системе АВ0, источника трансплантата (КМ, ПСКК), режима кондиционирования и профилактики острой РТПХ.
Вероятность рецидива была выше после родственной алло-ТГСК по сравнению с алло-ТГСК от неродственного донора — 35 и 13% (р=0,08), тогда как летальность, связанная с трансплантацией, не отличалась — 22 и 23% (р=0,7) и была меньше при использовании ПСКК по сравнению с КМ — 13 и 34% (р=0,09) соответственно.
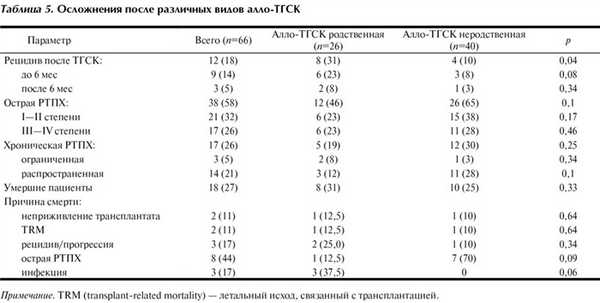
Рецидив развился у 12 (18%) пациентов, из них у 9 (75%) в период до 6 мес после алло-ТГСК (р=0,08) (табл. 5). Число рецидивов после родственной алло-ТГСК оказалось достоверно больше, чем после неродственной, — 8 (31%) и 4 (10%) соответственно (р=0,04). При констатации рецидива пациентам отменяли иммуносупрессивную терапию, проводили курс высокодозной ХТ по схеме FLAG или HDARA-C с последующей инфузией донорских лимфоцитов, иногда стимуляцией иммуноадоптивного эффекта интерлейкином-2 или α-интерфероном.
В нашем исследовании вероятность рецидива в зависимости от цитогенетических групп была следующей: в группе низкого риска — 43%, промежуточного — 26%, высокого риска — 15%, различия статистически незначимы (р=0,37).
Развитие острой РТПХ отмечалось у 38 (58%) пациентов, в том числе клинически значимой III—IV степени тяжести у 17 (45%). Статистически значимых различий по частоте развития острой РТПХ между родственной и неродственной алло-ТГСК не выявлено (р=0,1).
Хроническую РТПХ после алло-ТГСК оценивали у пациентов, проживших более 100 дней. Распространенная форма хронической РТПХ чаще отмечалась после неродственной алло-ТГСК, чем после родственной, — в 11 (92%) и 3 (60%) случаев соответственно (р=0,1). Частота развития ограниченной РТПХ, наоборот, выше после родственной алло-ТГСК — 2 (8%) и 1 (3%) случай. Однако различия статистически незначимы (р=0,34).
Летальность при родственной и неродственной алло-ТГСК не различалась — 8 (31%) и 10 (25%) соответственно (р=0,33). При алло-ТГСК от родственного донора у большинства пациентов причиной смерти служили инфекционный процесс (р=0,06) и рецидив заболевания (р=0,34), а при неродственной — острая РТПХ (р=0,09).
По результатам нашего исследования не получено существенных различий по ОВ и летальности, связанной с трансплантацией, при родственной и неродственной алло-ТГСК, в том числе от частично HLA-совместимого донора. По результатам ранее проведенных исследований из Сиэтла у 85 пациентов с неродственным донором и 135 пациентов с родственным донором, отнесенных в группу промежуточного риска (58 и 83 пациентов соответственно, остальные — с нормальным кариотипом), ОВ составила 37, 33 и 22% соответственно, что не отличается от результатов, представленных нами [18].
Полученное различие по 5-летней ОВ пациентов в зависимости от цитогенетической группы риска (100% при низком риске, 64% при промежуточном и 24% при высоком риске; р=0,027) подтверждает важность выполнения этого исследования в дебюте заболевания. По результатам исследований HOVON/SAKK и EORTC/GIMEMAAML-10, алло-ТГСК при ОМЛ в первой ремиссии также обеспечивает длительную ремиссию и общую выживаемость 40 и 58% соответственно, даже у пациентов с высоким цитогенетическим риском [19, 20], тогда как у пациентов данной категории, получавших ХТ, 4-летняя вероятность рецидива составляла 73% [18].
Более низкая вероятность рецидива при алло-ТГСК от неродственного донора (13%), в большей степени от частично HLA-несовместимого донора (0) по сравнению с алло-ТГСК от родственного донора (35%) (р=0,08), а также при наличии хронической РТПХ (р=0,01) и острой РТПХ III степени по сравнению с острой РТПХ I—II степени (р=0,06) свидетельствует о возможном влиянии эффекта РТПЛ.
У пациентов, получивших MAК по сравнению с РИК, достигнуты несколько более высокая 5-летняя ОВ (78% против 58%; р=0,4) и меньшая 5-летняя вероятность рецидива (14% против 26%; р=0,4) в отсутствие различия по летальности, ассоциированной с трансплантацией (25 и 21%; р=0,9), однако эти различия статистически незначимы. Показания к проведению РИК или MAК при ОМЛ в первой ремиссии не имеют объективных критериев и основаны на оценке перед алло-ТГСК индекса коморбидности [21], определения риска летального исхода в баллах [22], что в сочетании с возрастом помогает объективизировать критерии для выбора оптимального режима кондиционирования. Например, пациенты с высоким риском рецидива должны рассматриваться как кандидаты на применение МАК, а пациенты более старшего возраста и/или при наличии сопутствующих заболеваний — на применение РИК. Важно отметить, что большинство исследований сообщали о схожих результатах по БВ и ОВ у пациентов с MAК и РИК, другие — о снижении летальности, связанной с трансплантацией, при РИК по сравнению с МАК [23, 24] или об отсутствии различий этого показателя [25, 26].
Заключение
Таким образом, эффективность алло-ТГСК у пациентов с ОМЛ в первой ремиссии напрямую зависит от факторов прогноза, в нашем исследовании — цитогенетических. Другие факторы, такие как возраст, тип донора, режим кондиционирования, несовместимость по группе крови, полу, HLA-системе, профилактике острой РТПХ, не имеют принципиального значения и относятся к параметрам выбора индивидуализированного подхода при выполнении алло-ТГСК. У пациентов с ОМЛ и неблагоприятными прогностическими факторами выполнение алло-ТГСК показано в первой ремиссии при наличии HLA-совместимого родственного или неродственного донора. Показания к алло-ТГСК для группы пациентов с благоприятными цитогенетическими признаками, гетерогенны, поскольку эти пациенты нуждаются в уточнении факторов прогноза на основании более детального обследования с помощью молекулярно-биологических методов в момент установления диагноза.
Роль аутологичной трансплантации кишечной микробиоты в лечении острого миелоидного лейкоза
Острый миелоидный лейкоз (ОМЛ) - опухолевое заболевание кроветворной ткани, связанное с мутацией в клетке-предшественнице гемопоэза, следствием которой становится бесконтрольная пролиферация незрелых миелоидных клеток. Лечение ОМЛ включает индукционную химиотерапию, целью которой является достижение ремиссии, и консолидирующую терапию (химиотерапия с трансплантацией гемопоэтических стволовых клеток или без таковой) для профилактики рецидива. В связи с развитием иммуносупрессии на фоне химиотерапии больным часто требуется введение антибиотиков для профилактики и лечения инфекционных осложнений.
В ходе проведенных ранее исследований установлено, что многократные курсы антибактериальной терапии у больных ОМЛ ведут к изменению состава кишечной микробиоты - отмечается снижение степени микробного разнообразия, увеличение числа бактерий, обладающих провоспалительной активностью, а также рост резистентных штаммов. Кроме того, установлено, что состав кишечной микробиоты влияет на вероятность развития инфекционных осложнений и определяет прогноз пациентов с ОМЛ.
С целью восстановления состава кишечной микробиоты исследователи из Франции провели аутологичную фекальную трансплантацию 25 пациентам с ОМЛ. После забора кала для последующей трансплантации все пациенты прошли курс индукционной химиотерапии и получали антибиотики широкого спектра действия. Процедура трансплантации кишечной микробиоты проводилась после завершения курса индукционной химиотерапии. Период наблюдения за пациентами составил один год. В ходе исследования установлено, что аутологичная фекальная трансплантация позволяет восстановить степень микробного разнообразия до исходного уровня, а также уменьшить количество генов антибиотикорезистентности. Кроме того, количество бактерий с провоспалительной активностью ( Enterobacteriaceae, Enterococceae) , которые преобладали в составе микробиоты до проведения химиотерапии, снизилось до исходного уровня после проведения фекальной трансплантации.
Авторы исследования подчеркивают, что аутологичная фекальная трансплантация является многообещающим методом для восстановления состава кишечной микробиоты при ОМЛ, а дальнейшие исследования в данной области позволят улучшить прогноз пациентов с данным заболеванием.
Источник: Malard F, Vekhoff A, Lapusan S, et al. Gut microbiota diversity after autologous fecal microbiota transfer in acute myeloid leukemia patients. Nat Commun. 2021;12(1):3084.
Пересадка костного мозга при онкологических заболеваниях крови

Впервые сталкиваясь с таким страшным диагнозом, как, лейкоз, или лейкемия, лимфома - у человека после первого шока начинается хаос в голове из огромного количества вопросов: как, почему я, или мой ребенок, что делать, как лечить, какие шансы, нужна ли пересадка костного мозга, где найти донора…
Ниже мы выстроили систему из этих вопросов и попробуем ответить на каждый. Это и будет неким планом действий для человека, которому поставили диагноз - рак крови.
Как диагностировать рак крови?
Как лечить лейкоз, лейкемию или лимфому? Можно ли вылечить навсегда?
Какая бывает пересадка костного мозга? Где найти донора?
Как происходит пересадка костного мозга? Что делают перед ТКМ? Сколько времени занимается вся процедура пересадки?
Сколько стоит пересадка костного мозга?
Где лучше делать трансплантацию?
Какой прогноз после пересадки костного мозга?
Как определить рак крови: лейкоз, лейкемию. Как выявить лимфому?
Виды рака крови:
- лейкоз (острый и хронический)
- лейкемия
- лимфома (Ходжкина, неходжкинская)
- миелома
Как диагностировать рак крови на ранней стадии, как он проявляется и как его заметить самостоятельно?
Внимание на симптомы:
- Постоянные головокружения
- Периодическая слабость и сонливость
- Температура постоянно держится на 37 градусах и выше
- Ломота в суставах, костях, как при гриппе
- Кровотечение из носа и десен
- Тошнота, рвота, потеря веса
- Увеличенные лимфоузлы
Вы заметили эти симптомы у себя? У ребенка? Если испытываете подобные симптомы больше 1-2 недель, срочно проходите первичное обследование, а именно:
- Общий анализ крови. Обращайте внимание на: снижение количества тромбоцитов от нормы, увеличение количества бластных (незрелых) клеток от нормы, увеличение лимфоцитов, лимфобластных клеток, появление в крови моноклональных иммуноглобулинов.
- Рентген грудной клетки и головы.
- УЗИ брюшной полости. Внимание на: внимание на увеличение селезенки, печени и лимфоузлов.
Именно по общему анализу крови врач может распознать серьезные отклонения от нормы. Если это случилось, необходимо делать пункцию и проводить иммуногистохимический анализ клеток костного мозга для определения вида рака крови.
Далее, в зависимости от типа рака крови, грамотный врач должен обследовать пациента с помощью ПЭТ КТ, или МРТ, КТ, сцинтиграфии.
Как лечить лейкоз, лейкемию или лимфому? Можно ли вылечить навсегда?
Как лечится рак крови:
- Цитостатики - лекарственные препараты
- Химиотерапия, таргетная терапия
- Моноклониальные антитела
- Иммунотерапия (Т-киллеры)
- Облучение (только перед трансплантацией, ТКМ)
- Пересадка костного мозга (особенно, когда случается рецидив)
Ранняя стадия рака лейкоза, лейкемии или лимфомы: у 75% пациентов ремиссия наступает уже при первой линии лечения цитостатиками и химиотерапией.
Важно: первая линия лечения может длиться от 3 до 9 месяцев.
Вторая и третья стадии лимфомы, лейкемии и остром лейкозе: кроме цитостатиков и химиотерапии, применяют таргетную терапию и иммунотерапию. Комплексное лечение серьезно повышает шансы онкологического пациента на выход в ремиссию.
Важно: иммунотерапия не применяется как самостоятельный метод лечения рака крови, этот новейший метод биологического лечения является сильным вспомогательным лечением.
Четвертая, терминальная стадии, рецидив: требуется пересадка костного мозга, от донора или собственных стволовых клеток.
Важно: Некоторые виды лейкоза, лейкемии и лимфом даже на ранних стадиях предполагают впоследствии пересадку костного мозга. Поэтому если полученный диагноз по протоколу предполагает в будущем ТКМ (трансплантацию), сразу сдавайте анализы на типирование антигенов HLA сами и все ваши родные. Заранее определитесь, подходит ли кто-то из родственников как донор.
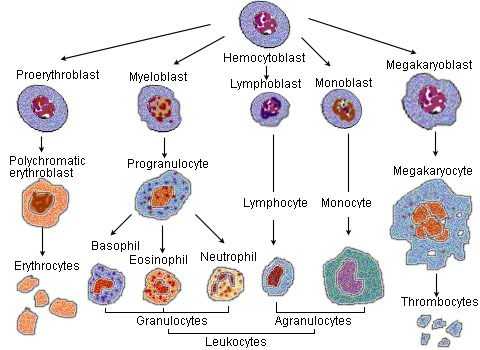
Какая бывает пересадка костного мозга? Где найти донора?
Виды трансплантации:
- Аллогенная трансплантация костного мозга. То есть от донора.
- Позволяет пациенту выйти в длительную ремиссию и вылечиться.
- Всего у 10% пациентов обнаруживаются совпадения по антигенам HLA с родственниками. Остальным 90% приходится ожидать очереди на донора в общей базе данных, с которым будет совпадение.
- Осложнения во время и после пересадки в виде не приживаемости, отторжения донорских клеток, вплоть до летального исхода.
- Выживаемость пациентов после аллогенной трансплантации составляет 3-4 пациента из 10. Тем не менее, это лучше, когда без трансплантации вообще ноль шансов выжить.
- Пожизненный прием иммуносупрессоров, препаратов, подавляющих иммунную систему больного, чтобы она не атаковала донорские клетки. Подобная терапия серьезно влияет на качество жизни и вызывает массу сопутствующих заболеваний.
- Аутологичная трансплантация собственных стволовых клеток костного мозга пациента. Метод самый современный, практически всегда используется как единственный в Израиле, в Германии, в Южной Корее, в Таиланде, Китае, Индии, Испании.
- Позволяет пациенту выйти в длительную ремиссию и вылечиться.
- Отсутствие осложнений, прогноз полной приживаемости, так как это собственные клетки.
- Отсутствие последующей иммуно-подавляющей терапии в течение всей жизни.
- Трансплантация может быть недоступна пациенту в связи с тяжестью состояния его организма.
- Выживаемость пациентов при аутологичной трансплантации гемопоэтических клеток 9 из 10. Смертность возможна из-за инфекции во время приживаемости клеток, когда организм почти не защищен, или от токсичности высокодозной химиотерапии, в связи индивидуальной непереносимостью.
Как происходит пересадка костного мозга? Что делают перед ТКМ? Сколько времени занимается вся процедура пересадки?
Пересадка костного мозга является либо завершающим этапом лечения, когда предыдущие методы не дали 100% положительного результата, либо основным при рецидиве рака крови.
В случае аллогенной трансплантации забор клеток костного мозга производится у донора. Напомним, что 9 пациентам из 10 необходимо ожидать в очереди на получение донора из общей базы при совпадении антител HLA.
Если планируется пересадка собственных стволовых клеток костного мозга, то забор этих клеток делают заранее. Если от донора, то незадолго до процедуры. Особая подготовка не требуется, только обследование.
Стволовые клетки для пересадки берут из тазовой кости пункцией, однако, наиболее современный и щадящий способ - это фильтрование стволовых клеток из периферийной крови после лекарственной стимуляции выброса нужных клеток в кровь (недельный прием препарата). Болезненные последствия для донора или самого пациента отсутствуют. Не больно.
Перед процедурой необходимо буквально «убить» собственный костный мозг, который производит мутированные кровяные клетки. Для этого проводится интенсивная высокодозная химиотерапия или высокоточная лучевая терапия. Если вариант ТКМ с донором, то дополнительно применяют большие дозы иммуносупрессоров, чтобы организм сразу не отверг чужой костный мозг.
Операция по пересадке костного мозга не что иное, как переливание, ведь костный мозг выглядит просто как пакет крови для переливания.
На 2-4 недели после пересадки пациента помещают в стерильную палату клиники, так как он находится в состоянии цитопении: старый костный мозг убит и не работает, новый костный мозг еще не прижился. В этот период для пациента опасны любые возможные инфекции, даже самые незначительные.
Еще в течение 2 месяцев после выписки из стерильной палаты пациента наблюдают или стационарно или амбулаторно. Каждую неделю он сдает анализы крови, мочи, находится под контролем своего онколога.
По окончании всего этапа лечения, пациент проходит обследование каждые 3 месяца в течение 1 года. Далее еще 4 года - каждые 6 месяцев. Перешагнув 5-летний рубеж выживаемости, пациент вступает в период длительной ремиссии, что в 80% случаях означает полное излечение. Обследование раз в год!
Итак, вся процедура трансплантации костного мозга при лейкозе крови, лейкемии, при множественной миеломе (миеломной болезни), лимфоме Ходжкина и неходжкинской лимфоме занимает 3-4 месяца.
Читайте также:
