Барьерная функция носа. Защитная функция носа
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Наш организм может полноценно жить и развиваться лишь в том случае, если между ним и средой обитания постоянно происходит обмен веществ. Одной из важнейших форм связи организма с окружающей средой, не прерывающейся в течение всей жизни человека, является связь через дыхательную систему. Нос, являющийся начальным отделом дыхательного тракта, представляет собой мощный защитный барьер, информирующий центры о контакте с различными агентами внешней среды, осуществляющий кондиционирование вдыхаемого воздуха, задерживающий и обезвреживающий вещества, которые могут поступить в организм с воздухом [7].
Ведущая роль в защитной функции носа принадлежит слизистой оболочке, которая покрыта псевдомногослойным эпителием, состоящим из мерцательных, бокаловидных, а также коротких и длинных вставочных эпителиоцитов. Мерцательная клетка на своем свободном конце имеет многочисленные реснички.
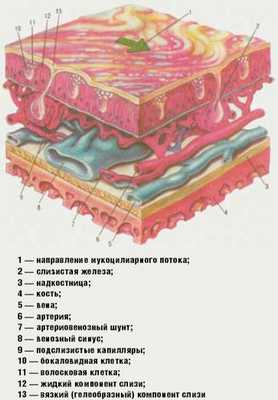 |
| Рис. Строение слизистой оболочки полости носа |
Реснитчатые клетки имеют по 250-300 ресничек длиной 7 и высотой 0,3 микрона. Каждая ресничка состоит из 9 пар микротрубочек, расположенных в виде кольца и окружающих две непарные центральные микротрубочки. Движение ресничек мерцательного эпителия слизистой оболочки носа осуществляется посредством скольжения микротрубочек. Движение ресничек строго направлено — от преддверия полости носа в сторону носоглотки. Мукоцилиарный клиренс обеспечивается назальным секретом. Источник секрета, покрывающего эпителий полости носа, — слизистые железы слизистой оболочки носа, бокаловидные клетки, транссудация из субэпителиальных капилляров, слезных желез, секрет специализированных Боумановых желез из ольфакторной зоны носа [7] (рис.).
Объем назальной секреции за 24 ч составляет от 100 мл до 1-2 л. Слизистая оболочка задних двух третей полости носа обновляется каждые 10-15 мин. Функция ресничек оптимальна при температуре 28-33 °C, достаточном количестве секрета с рН 5,5-6,5. Потеря влаги, понижение температуры до 7-10 °C, увеличение рН секрета более 6,5 вызывает прекращение колебания ресничек [8, 11].
Слизистая оболочка полости носа является первым барьером защиты дыхательных путей, поэтому на слизистой оболочке полости носа ежесекундно осаждаются тысячи микроорганизмов. Большинство из них являются представителями сапрофитной микрофлоры и не причиняют человеку никакого вреда, тогда как другие способны спровоцировать развитие инфекционного заболевания. При инфекционном рините размножение микробов на слизистой носа приводит к ее повреждению и отслаиванию верхней части эпителия. Этот процесс и объясняет все проявления насморка: чувство жжения в носу, истечение слизи (экссудата), заложенность носа, изменения голоса (гнусавость) и др. [9].
Ринит редко бывает самостоятельным заболеванием. Чаще всего насморк является симптомом какой-либо другой нозологической формы. Насморк наблюдается при различных ОРВИ или ОРЗ (грипп, парагрипп, аденовирусная инфекция, корь и др.). Острые респираторные заболевания являются наиболее распространенными в структуре инфекционных заболеваний. В России ежегодно регистрируется около 50 млн случаев инфекционных заболеваний, из них до 90% случаев приходится на острые респираторные вирусные инфекции. При патологии ЛОР-органов в первую очередь страдает слизистая оболочка с ее железистыми клетками.
Помимо инфекционных заболеваний, в индустриально развитых странах в настоящее время от 10% до 20% населения страдают острыми аллергическими заболеваниями. Кроме того, в патогенезе воспалительных заболеваний верхних дыхательных путей наряду с местным и общим воздействием возбудителя играют роль сенсибилизация организма и иммунологические сдвиги непосредственно в слизистой оболочке носа и околоносовых пазух [4].
Слизистая носа является той зоной, которая подвергается воздействию самых разнообразных инородных частиц. Молекулы аллергенов чрезвычайно быстро вызывают аллергическую реакцию, вследствие чего уже через минуту после проникновения аллергенов возникают чиханье, зуд в полости носа, ринорея [5, 6].
В качестве других этиологических факторов поражения слизистой оболочки могут быть неблагоприятная экология, профессиональные вредности, вредные привычки (табакокурение, наркомания). В городе, непосредственно у поверхности земли, обнаруживается наибольшая концентрация всех видов ксенобиотиков — свободно-радикальные соединения, канцерогены, соли тяжелых металлов, все виды аллергенов, ну и, конечно, патогенные микроорганизмы. Слизистая оболочка носа, полости рта и глотки находится в постоянном контакте с вдыхаемым воздухом и, таким образом, подвергается воздействию вредных факторов внешней среды, что приводит к ее отеку. В любом случае возникают условия, при которых слизистая носа легко инфицируется, реагируя появлением значительного отека [3].
Принимаемые при различных заболеваниях лекарственные препараты в качестве побочного действия часто дают субатрофию слизистой оболочки полости носа за счет системного действия, что особенно важно у представителей голосоречевых профессий в связи с наступающими изменениями в резонаторном тракте [1, 10].
При некоторых заболеваниях, например, при сахарном диабете, за счет нарушений в микроциркуляторном русле часто развиваются атрофические и субатрофические риниты. С учетом распространенности данного заболевания, в частности, в связи со снижением возраста впервые заболевших (трудоспособное население) проблемы увлажнения слизистой оболочки полости носа носят социальный характер.
Как показывают исследования, население планеты стареет, увеличивается средняя продолжительность жизни и соответственно возрастают требования к качеству жизни в данной группе населения. Известно, что со снижением уровня половых гормонов, обусловленных менопаузой у женщин и снижением функции половых желез у мужчин, вероятность развития субатрофических и атрофических процессов на коже и слизистых резко возрастает.
Таким образом, в нормализации функции слизистой оболочки полости носа ведущими направлениями терапии являются:
1) стимуляция кровообращения местного и общего, т. е. усиленное снабжение слизистой оболочки питательными веществами;
2) увлажнение слизистой оболочки носа и препятствование образованию корок;
3) борьба с местной патологической микрофлорой.
Таким принципам отвечают препараты топического действия, содержащие важнейшие микроэлементы, регулирующие реологические свойства слизи. Считается, что содержащиеся в изотоническом растворе микроэлементы, такие как Са, Fе, К, Мg, Сu, способствуют повышению двигательной активности ресничек, активизации репаративных процессов в клетках слизистой оболочки носа и нормализации функции ее желез [7]. Перечисленные микроэлементы содержатся в препаратах, которые готовят из морской воды, стерилизуя ее и доводя содержание солей до изотонической концентрации, и из воды минеральных источников, обладающей лечебными свойствами.
Известно, что морская вода очень полезна для человеческого организма, так как содержит много ценных микро- и макроэлементов. Морская вода активизирует все жизненные процессы организма, повышает его сопротивляемость к различным заболеваниям, она обладает местным антисептическим действием.
Целебные свойства морской воды:
- Промывание полости носа морской воды оказывает антибактериальное действие, смывая пыль, вирусы и бактерии.
- Полоскание горла теплой морской водой лечит заболевания горла и восстанавливает голосовые связки.
- Морские ванны и воздух стимулируют эндокриную систему.
- Морская вода ускоряет заживление ссадин и порезов благодаря содержанию большого количества солей и микроэлементов.
- Полоскание рта теплой морской водой укрепляет зубы и десны.
Одним из новых препаратов этой группы является Отривин Море [2], представляющий собой очищенный, деконтаминированный изотонический раствор океанической воды из Бретани, добываемой в экологически чистом районе Атлантического океана, богатой натуральными микроэлементами. Он содержит 18 минералов и микроэлементов.
Благодаря такому составу препарат Отривин Море идеально подходит для защиты слизистой оболочки носа от неблагоприятных условий города, а также для облегчения носового дыхания во время болезни. Отривин Море обеспечивает быструю элиминацию возбудителей и аллергенов, то есть многократно снижает их концентрацию и способствует механическому очищению поверхности слизистой оболочки носа. Помимо этого, Отривин Море стимулирует клетки мерцательного эпителия, способствует нормализации выработки слизи и ее разжижению, а также повышает местный иммунитет. Важным преимуществом препарата является отсутствие какого-либо системного действия на организм пациента, что крайне важно для людей, страдающих различными соматическими заболеваниями и опасающихся приема традиционных топических вазоконстрикторов из-за риска развития побочных эффектов. Кроме того, у пациента появляется возможность снизить дозировку других лекарственных средств, применяемых для комплексного лечения, и ускорить выздоровление.
Отривин Море можно использовать как в профилактических и лечебных целях, так и для ежедневной гигиены полости носа. Новинка не содержит консервантов и дополнительных химических ингредиентов. Основными показаниями для назначения препарата являются острый ринит (включая аллергический) и заложенность носа. При насморке и аллергии Отривин Море облегчает дыхание, деликатно очищая носовые ходы, а также оказывает антисептическое действие. Кроме того, средство можно использовать для гигиены полости носа перед применением других лекарственных препаратов. В целях профилактики возможно использование препарата Отривин Море в период эпидемий различных вирусных заболеваний, что препятствует развитию различных форм инфекционного процесса на слизистой носа. Препарат также может применяться с целью гигиены полости носа, эффективно очищая слизистую носа и бережно увлажняя ее. Натуральный состав Отривин Море не только обеспечит высокую безопасность проводимого лечения, но и позволяет применять препарат для промывания носа при аллергии.
Многие назальные спреи вызывают дискомфортные ощущения при их приеме, что связано с раздражением слизистой оболочки полости носа. Отривин Море в форме назального душа лишен данного побочного эффекта. Бережно промывая полость носа, препарат удаляет пыль, бактерии и секрет и предотвращает ее пересыхание, тем самым оберегая от раздражающего воздействия внешних факторов, что особенно важно людям, работающим в помещениях с чрезмерно сухим воздухом (например, там, где установлены кондиционеры или возле нагревательных приборов).
Большое значение имеет форма выпуска препарата. При использовании носовых капель большая часть введенного раствора стекает по дну полости носа в глотку. В этом случае не достигается необходимый лечебный эффект. В этом плане намного более выгодным выглядит назначение дозированных аэрозолей, так, особенностью препарата Отривин Море является выпуск в форме назального спрея.
Также Отривин Море можно использовать и для ежедневной гигиены полости носа. Эта процедура известна уже с древности и важна для нашего здоровья не менее, чем чистка зубов. В современном мире, в тесных и пыльных мегаполисах, ежедневное профилактическое промывание носа морской водой приобрело особую актуальность.
Для удобства пациентов Отривин Море выпускается во флакончиках оптимального объема — 50 и 100 мл, которые будут уместны и в домашней, и в дорожной аптечках. Кроме того, флакон Отривин Море снабжен универсальной насадкой, подходящей для всей семьи и может быть рекомендован детям с трехмесячного возраста. При этом распыляющий наконечник обеспечит аккуратное и равномерное увлажнение полости носа, а специальный клапан, защищающий лекарство от попадания в него микроорганизмов, гарантирует длительный срок использования после первого применения.
Таким образом, препарат Отривин Море является надежным средством, очищающим слизистую оболочку носа у взрослых и детей, восстанавливая ее физиологическую функцию, не вызывая при этом ее сухости и обладая стойким длительным эффектом, предотвращая тем самым развитие грозных осложнений и одновременно бережно воздействуя на ее структурные компоненты. Отривин Море может применяться как для лечения, так и для профилактики насморка, а также для защиты слизистой носа от раздражающего воздействия окружающей среды.
Литература
- Волошина И. А., Туровский А. Б. Ирригационная терапия атрофического ринита. С. 1906.
- Государственный реестр лекарственных средств. М.: МЗ РФ, 2008.
- Гуров А. А. Отек слизистой оболочки верхних дыхательных путей. Как с ним бороться? 1254 с.
- Карпова Е. П., Усеня Л. И. Топические деконгестанты для терапии воспалительных заболеваний полости носа и околоносовых пазух у детей. С. 18.
- Марков Г. И. Транспортная функция мерцательного эпителия слизистой оболочки полости носа при воспалительных заболеваниях // Вестник оториноларингологии. 1985. № 4. С. 36-37.
- Пальчун В. Т., Магомедов М. М., Лучихин Л. А. Оториноларингология. М.: Медицина. 2002. 576 с.
- Пискунов Г. З., Пискунов С. З. Клиническая ринология. М., 2002. 390 с.
- Плужников М. С., Шантуров А. Г., Лавренова Г. В., Носуля Е. В. Слизистая оболочка носа. Механизмы гомеостаза и гомокинеза. СПб. 1995. С. 5-18.
- Рязанцев С. В. Современные деконгестанты в комплексной терапии острых и хронических заболеваний ЛОР-органов // Российская оториноларингология. 2008, № 6 (19).
- Deitmer T., Scheffler R. The effect of different preparations of nasal decongestans in ciliary beat frequency in vitro // Rhinology. 1993; 31-151-3 (14).
- Satir P. How cillia move // Scientific American. 1974. Vol. 231. P. 45-46.
Н. Э. Бойкова, кандидат медицинских наук
Научно-клинический центр оториноларингологии Федерального медико-биологического агентства, Москва
Слизистая носа на страже здоровья
Одна из главных функций слизистой оболочки носа — барьерная функция. Она обеспечивает защиту организма от проникновения в него вирусов, инфекционных агентов и других потенциально опасных инородных частиц.
Как работают защитные механизмы слизистой оболочки носа
Барьерный механизм слизистой верхних дыхательных путей — это сложная комплексная система, элементы которой можно разделить на три группы:
- Неспецифические факторы: продольное течение проходящего воздуха, выделение слизи и продукция ферментов, движение ресничек поверхностных клеток слизистой оболочки. Все эти факторы способствуют самоочищению дыхательных путей.
- Специфические иммунные механизмы — выработка иммуноглобулинов — веществ, участвующих в формировании местного иммунного ответа.
- Неспецифические иммунные механизмы — выработка лизоцима, интерферона, антимикробных белков и других веществ, способствующих разрушению инфекционных агентов, попадающих на поверхность дыхательных путей.
Однако в некоторых случаях слаженная работа этого механизма нарушается. Тогда и происходит заражение ОРВИ. Это становится возможным в результате сбоев внутри организма, приводящих к повышенной проницаемости слизистой оболочки (ослабленный иммунитет и др.) или под влиянием интенсивного воздействия внешней среды (высокая концентрация вирусных частиц в воздухе, повышенная сухость воздуха, атмосферные загрязнения и т.д.). В таких случаях организму нужна помощь в виде создания дополнительного защитного барьера на поверхности верхних дыхательных путей. Наиболее эффективным решением данной проблемы является использование барьерных средств, таких как «Назаваль Плюс». В его состав входит микронизированная растительная целлюлоза, которая создаёт на поверхности дыхательных путей дополнительный гелеобразный слой, препятствующий контакту вирусов и аллергенов с клетками слизистой носа. Назальный спрей не нарушает физиологическую функцию слизистой оболочки дыхательных путей, не всасывается в кровь и не препятствует свободному дыханию.
«Назаваль Плюс» является эффективным средством для усиления барьерной защиты слизистой оболочки верхних дыхательных путей с целью профилактики ОРВИ.
Барьерная функция носа. Защитная функция носа
Для цитирования: Нормализация слизистой оболочки полости носа как медико-социальная проблема. РМЖ. 2010;24:1457.
Наш организм может полноценно жить и развиваться лишь в том случае, если между ним и средой обитания постоянно происходит обмен веществ. Одной из важнейших форм связи организма с окружающей средой, не прерывающейся в течение всей жизни человека, является связь через дыхательную систему. Нос как начальный отдел дыхательного тракта представляет собой мощный защитный барьер, информирующий центры о контакте с различными агентами внешней среды, осуществляющий кондиционирование вдыхаемого воздуха, задерживающий и обезвреживающий вещества, которые могут поступить в организм с воздухом [7].
Ведущая роль в защитной функции носа принадлежит слизистой оболочке, которая покрыта псевдомногослойным эпителием, состоящим из мерцательных, бокаловидных, а также коротких и длинных вставочных эпителиоцитов. Мерцательная клетка на своем свободном конце имеет многочисленные реснички.
Реснитчатые клетки имеют по 250-300 ресничек длиной 7 и высотой 0,3 мк. Каждая ресничка состоит из 9 пар микротрубочек, расположенных в виде кольца и окружающих две непарные центральные микротрубочки. Движение ресничек мерцательного эпителия слизистой оболочки носа осуществляется посредством скольжения микротрубочек. Движение ресничек строго направлено - от преддверия полости носа в сторону носоглотки. Мукоцилиарный клиренс обеспечивается назальным секретом. Источник секрета, покрывающего эпителий полости носа, - слизистые железы слизистой оболочки носа, бокаловидные клетки, транссудация из субэпителиальных капилляров, слезных желез, секрет специализированных Боумановых желез из ольфакторной зоны носа [7] (рис. 1).
Объем назальной секреции за 24 ч составляет от 100 мл до 1-2 л. Слизистая оболочка задних двух третей полости носа обновляется каждые 10-15 мин. Функция ресничек оптимальна при температуре 28-33°C, достаточном количестве секрета с рН 5,5-6,5. Потеря влаги, понижение температуры до 7-10°C, увеличение рН секрета более 6,5 вызывает прекращение колебания ресничек [8,11].
Слизистая оболочка полости носа является первым барьером защиты дыхательных путей, поэтому на ней ежесекундно осаждаются тысячи микроорганизмов. Большинство из них являются представителями сапрофитной микрофлоры и не причиняют человеку никакого вреда, тогда как другие способны спровоцировать развитие инфекционного заболевания. При инфекционном рините размножение микробов на слизистой носа приводит к ее повреждению и отслаиванию верхней части эпителия. Этот процесс и объясняет все проявления насморка: чувство жжения в носу, истечение слизи (экссудата), заложенность носа, изменения голоса (гнусавость) и др. [9].
Ринит редко бывает самостоятельным заболеванием. Чаще всего насморк является симптомом какой-либо другой нозологической формы. Насморк наблюдается при различных ОРВИ или ОРЗ (грипп, парагрипп, аденовирусная инфекция, корь и др.). Острые респираторные заболевания являются наиболее распространенными в структуре инфекционных заболеваний. В России ежегодно регистрируется около 50 млн случаев инфекционных заболеваний, из них до 90% случаев приходится на острые респираторные вирусные инфекции. При патологии ЛОР-органов в первую очередь страдает слизистая оболочка с ее железистыми клетками
Помимо инфекционных заболеваний, в индустриально развитых странах в настоящее время от 10 до 20% населения страдают острыми аллергическими заболеваниями. Кроме того, в патогенезе воспалительных заболеваний верхних дыхательных путей наряду с местным и общим воздействием возбудителя играют роль сенсибилизация организма и иммунологические сдвиги непосредственно в слизистой оболочке носа и околоносовых пазух [4].
Слизистая носа является той зоной, которая подвергается воздействию самых разнообразных инородных частиц. Молекулы аллергенов чрезвычайно быстро вызывают аллергическую реакцию, вследствие чего уже через минуту после проникновения аллергенов возникают чиханье, зуд в полости носа, ринорея [5,6].
В качестве других этиологических факторов поражения слизистой оболочки могут выступать неблагоприятная экология, профессиональные вредности, вредные привычки (табакокурение, наркомания). В городе, непосредственно у поверхности земли, обнаруживается наибольшая концентрация всех видов ксенобиотиков - свободно-радикальные соединения, канцерогены, соли тяжелых металлов, все виды аллергенов, ну и, конечно, патогенные микроорганизмы. Слизистая оболочка носа, полости рта и глотки находится в постоянном контакте с вдыхаемым воздухом и таким образом подвергается воздействию вредных факторов внешней среды, что приводит к ее отеку. В любом случае возникают условия, при которых слизистая носа легко инфицируется, реагируя появлением значительного отека [3].
Принимаемые при различных заболеваниях лекарственные препараты в качестве побочного действия часто дают субатрофию слизистой оболочки полости носа за счет системного действия, что особенно важно у представителей голосо-речевых профессий в связи с наступающими изменениями в резонаторном тракте [1,10].
При некоторых заболеваниях, например при сахарном диабете, за счет нарушений в микроциркуляторном русле часто развиваются атрофические и субатрофические риниты. С учетом распространенности данного заболевания, в частности в связи со снижением возраста впервые заболевших (трудоспособное население), проблемы увлажнения слизистой оболочки полости носа носят социальный характер.
Как показывают исследования, население планеты стареет, увеличивается средняя продолжительность жизни и, соответственно, возрастают требования к качеству жизни в данной группе населения. Известно, что с падением уровня половых гормонов, сопровождающим менопаузу у женщин и снижение функции половых желез у мужчин, вероятность развития субатрофических и атрофических процессов на коже и слизистых резко возрастает.
Таким образом, в нормализации функции слизистой оболочки полости носа ведущими направлениями терапии являются:
1) стимуляция кровообращения местного и общего, т.е. усиленное снабжение слизистой оболочки питательными веществами;
2) увлажнение слизистой оболочки носа и препятствование образованию корок;
3) борьба с местной патологической микрофлорой.
Таким принципам отвечают препараты топического действия, содержащие важнейшие микроэлементы, регулирующие реологические свойства слизи. Считается, что содержащиеся в изотоническом растворе микроэлементы, такие как Са, Fе, К, Мg, Сu, способствуют повышению двигательной активности ресничек, активизации репаративных процессов в клетках слизистой оболочки носа и нормализации функции ее желез. Перечисленные микроэлементы содержатся в препаратах, которые готовят из морской воды, стерилизуя ее и доводя содержание солей до изотонической концентрации, и из воды минеральных источников, обладающей лечебными свойствами.
Известно, что воздействие морской воды невероятно полезно для человеческого организма, ведь в ней содержатся почти все элементы таблицы Менделеева.
Морская вода активизирует все жизненные процессы организма, повышает его сопротивляемость к различным заболеваниям, она обладает обеззараживающим действием и может быть использована как местный антибиотик.
Целебные свойства морской воды:
• промывание полости носа морской воды оказывает антибактериальное действие, смывая пыль, вирусы и бактерии;
• полоскание горла теплой морской водой лечит заболевания горла и восстанавливает голосовые связки;
• морские ванны и воздух стимулируют эндокринную систему;
• морская вода ускоряет заживление ссадин и порезов благодаря содержанию в ней большого количества солей и микроэлементов;
• полоскание рта теплой морской водой укрепляет зубы и десны.
Одним из новых препаратов этой группы является Отривин Море [2], представляющий собой очищенный, обеззараженный изотонический раствор океанической воды, добываемой в Бретани (Франция), в экологически чистом районе Атлантического океана. Препарат содержит 18 минералов и микроэлементов.
Отривин Море идеально подходит для защиты слизистой оболочки носа от неблагоприятных условий города, а также для облегчения носового дыхания во время болезни. Отривин Море обеспечивает быструю элиминацию возбудителей и аллергенов, то есть многократно снижает их концентрацию и способствует механическому очищению поверхности слизистой оболочки носа. Помимо этого, Отривин Море стимулирует клетки мерцательного эпителия, способствует нормализации выработки слизи и ее разжижению, а также повышает местный иммунитет. Важным преимуществом препарата является отсутствие какого-либо системного действия на организм пациента, что крайне важно для людей, страдающих различными соматическими заболеваниями и опасающихся приема традиционных топических вазоконстрикторов из-за риска развития побочных эффектов. Кроме того, у пациента появляется возможность снизить дозировку других лекарственных средств, применяемых для комплексного лечения, и ускорить выздоровление.
Отривин Море можно использовать как в профилактических и лечебных целях, так и для ежедневной гигиены полости носа. Новинка не содержит консервантов и дополнительных химических ингредиентов. Основными показаниями для назначения препарата являются острый ринит (включая аллергический) и заложенность носа. При насморке и аллергии Отривин Море облегчает дыхание, деликатно механически очищая носовые ходы, а также оказывает определенное антибактериальное воздействие. Кроме того, средство можно использовать для гигиены полости носа перед применением других лекарственных препаратов. В целях профилактики возможно использование препарата Отривин Море в период эпидемий различных вирусных заболеваний с целью предотвратить развитие различных форм инфекционного процесса на слизистой носа. Препарат также может применяться для гигиены полости носа, эффективно очищая слизистую и бережно увлажняя ее. Полностью натуральный состав Отривин Море не только обеспечивает высокую безопасность проводимого лечения, но и позволяет применять препарат для промывания носа при аллергии.
Многие назальные спреи вызывают дискомфортные ощущения при их приеме, что связано с раздражением слизистой оболочки полости носа. Отривин Море лишен данного побочного эффекта. Промывая полость носа, препарат удаляет пыль, бактерии и секрет и предотвращает ее пересыхание, тем самым оберегая от раздражающего воздействия внешних факторов, что особенно важно людям, работающим в помещениях с чрезмерно сухим воздухом (например, там, где установлены кондиционеры или возле нагревательных приборов).
Большое значение имеет форма выпуска препарата. При использовании носовых капель большая часть введенного раствора стекает по дну полости носа в глотку. В этом случае не достигается необходимый лечебный эффект. В этом плане намного более выгодным выглядит назначение дозированных аэрозолей. Уникальной особенностью препарата Отривин Море является выпуск в форме назального спрея.
Также Отривин Море можно использовать и для ежедневной гигиены полости носа. Эта процедура известна уже с древности и важна для нашего здоровья не менее, чем чистка зубов. В современном мире, в тесных и пыльных мегаполисах ежедневное профилактическое промывание носа морской водой приобрело особую актуальность.
Для максимального удобства пациентов Отривин Море выпускается во флакончиках оптимального объема - 50 мл, которые будут уместны и в домашней, и в дорожной аптечках. Кроме того, флакон Отривин Море снабжен универсальной насадкой, подходящей для всей семьи. При этом распыляющий наконечник обеспечит аккуратное и равномерное увлажнение полости носа, а специальный клапан, защищающий лекарство от попадания в него микроорганизмов, гарантирует длительный срок использования после первого применения.
Таким образом, препарат Отривин Море является надежным средством, очищающим слизистую оболочку носа у взрослых и детей, восстанавливая ее физиологическую функцию не вызывая при этом ее сухости и обладая стойким длительным эффектом, предотвращая тем самым развитие грозных осложнений и одновременно бережно воздействуя на ее структурные компоненты. Отривин Море может применяться как для лечения, так и для профилактики насморка, а также для защиты слизистой носа от раздражающего воздействия окружающей среды.
Литература
1. Волошина И.А., Туровский А.Б. Ирригационная терапия атрофического ринита. С. 1906
2. Государственный реестр лекарственных средств. М.: МЗ РФ, 2008.
3. Гуров А.А. Отек слизистой оболочки верхних дыхательных путей. Как с ним бороться? 1254 с.
4. Карпова Е.П., Усеня Л.И. Топические деконгестанты для терапии воспалительных заболеваний полости носа и околоносовых пазух у детей. С. 18.
5. Марков Г.И. Транспортная функция мерцательного эпителия слизистой оболочки полости носа при воспалительных заболеваниях // Вестник оториноларингологии. 1985. № 4. С. 36-37.
6. Пальчун В.Т., Магомедов М.М., Лучихин Л.А. Оториноларингология //М.: Медицина, 2002. 576 с.
7. Пискунов Г.З., Пискунов С.З. Клиническая ринология. М., 2002. 390 с. (175)
8. Плужников М.С., Шантуров А.Г., Лавренова Г.В., Носуля Е.В. Слизистая оболочка носа. Механизмы гомеостаза и гомокинеза. СПб., 1995. С. 5-18.
9. Рязанцев С.В. Современные деконгестанты в комплексной терапии острых и хронических заболеваний ЛОР-органов // Российская оториноларингология. №6 (19). 2008 (13).
10. Deitmer T., Scheffler R. The effect of different preparations of nasal decongestans in ciliary beat frequency in vitro // Rhinology. 1993. 31-151-3 (14).
11. Satir P. How cillia move // Scientific American. 1974. Vol. 231. P. 45-46.
Список сокращений:
ИЦК — индекс цитолиза клеток
СПД — средний показатель деструкции
ИДК — индекс деструкции клеток
АГД — аглютеновая диета
Лимфоидные скопления, которые получили название «мукоза-ассоциированная лимфоидная ткань» (mucosa-associated lymphoid tissue), располагаясь в разных областях пищеварительного и дыхательного трактов, имеют общность клеточной организации дискретных Т- и В-клеточных областей и их субпопуляций и обеспечивают реализацию иммунного ответа лимфоидной ткани слизистых оболочек организма в целом [10, 11].
Согласно данным литературы, в основе развития целиакии лежат разнообразные патогенетические механизмы, однако ведущим является нарушение врожденного и адаптивного иммунитета [12—14]. Поэтому патогенетические механизмы иммунорегуляции при целиакии, обусловленные генами гистосовместимости, в процессе презентации антигенов иммунокомпетентными клетками в слизистой оболочке пищеварительного тракта имеют сходство с механизмами иммунорегуляции, происходящими в слизистых оболочках дыхательного тракта [15].
У больных целиакией наблюдаются изменения слизистой оболочки полости носа атрофического характера, проявляющиеся выраженной деструкцией реснитчатого эпителия, а также воспалительной реакцией, характеризующейся увеличением количества нейтрофильных гранулоцитов, что указывает на снижение барьерной функции носа [16].
Ведущая роль в защитной функции носа принадлежит слизистой оболочке, которая покрыта псевдомногослойным эпителием, состоящим из мерцательных, бокаловидных, а также коротких и длинных вставочных эпителиоцитов. В основе поражения верхних дыхательных путей при целиакии, как и при системном аутоиммунном заболевании, лежат расстройства механизмов иммунорегуляции и гиперреактивность организма.
В связи с вышеизложенным изучение морфофункционального состояния слизистой оболочки полости носа как выполняющей его барьерную функцию у больных целиакией является актуальной задачей.
Цель исследования — изучить цитологические особенности мазков-отпечатков со слизистой оболочки носа у больных целиакией.
Пациенты и методы

Обследованы 46 пациентов с целиакией в возрасте от 18 до 55 лет, средний возраст составил 31,4±11,0 года (табл. 1), Таблица 1. Распределение пациентов с целиакией по полу и возрасту которые составили основную группу наблюдения.
Риноцитологическое исследование проводилось для определения клеточного состава назального секрета, получаемого по методике Л.В. Ковальчука и соавт. [11]. Подсчет проводили с помощью 100-кратного увеличения, просматривали 20—30 полей не менее 400 клеток, в том числе нейтрофилов, макрофагов, лимфоцитов, эозинофилов и эпителиальных клеток. Морфологические свойства нейтрофилов и эпителиальных клеток оценивали с помощью методики, предложенной Л.А. Матвеевой (1993), с определением класса (0—4) и индекса деструкции клеток (ИДК), среднего показателя деструкции (СПД) и индекса цитолиза клеток (ИЦК) [Л.А. Матвеева, 1993]. Для исследования использовали микроскоп «Микромед-1» (Россия).
Для сравнительной оценки количественных и качественных характеристик риноцитограммы мазков-отпечатков пациентов основной группы использовали аналогичные показатели здоровых людей (группа контроля).
Клиническое обследование пациентов включало анализ жалоб и анамнестических данных, оценку объективного статуса, результаты лабораторных и инструментальных исследований.
Результаты и обсуждение
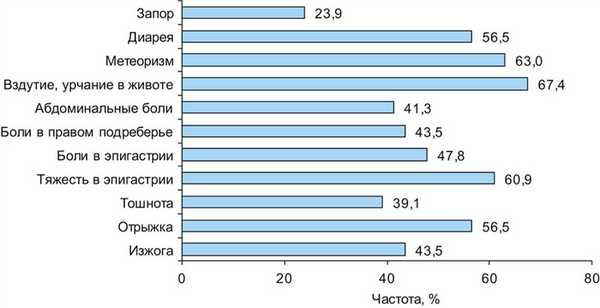
Пациенты с целиакией предъявляли жалобы на отрыжку, изжогу, абдоминальные боли, метеоризм, диарею и другие состояния, характерные для данного заболевания. Преобладающими были жалобы на тяжесть в эпигастрии, отрыжку, вздутие, урчание и метеоризм (р <0,01) (рис. 1). Рис. 1. Частота гастроэнтерологических симптомов у обследованных пациентов с целиакией.
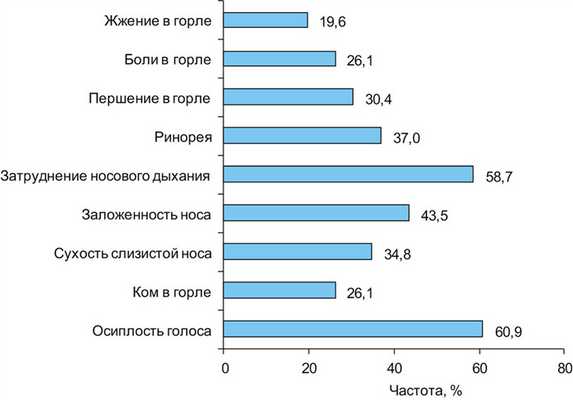
Из рис. 2 следует, Рис. 2. Частота оториноларингологической симптоматики у обследованных пациентов с целиакией. что у больных целиакией симптомы патологии ЛОР-органов были представлены жалобами на осиплость голоса, ощущение комка в горле, сухости слизистой оболочки носа, заложенность носа, затруднение носового дыхания, ринорею.
Структура патологии ЛОР-органов у пациентов с целиакией была представлена такими заболеваниями, как хронический, вазомоторный, аллергический и атрофический риниты, хронический тонзиллит, хронический полипозный риносинусит, хронический верхнечелюстной синусит, атрофический фарингит, а также искривлением носовой перегородки.

При этом наиболее часто встречались искривление носовой перегородки (52,2%), атрофический (45,7%) и аллергический (28,2%) риниты, а также хронический тонзиллит (36,9%) (табл. 2). Таблица 2. Структура патологии ЛОР-органов у пациентов с целиакией
Результаты риноцитограммы у пациентов с целиакией показали, что количество клеток (2,83±0,28%) у них было больше по сравнению с данным показателем в контрольной группе (2,31±0,29%). Так, количество макрофагов было в 2 раза больше у пациентов основной группы, чем в группе контроля, что свидетельствует о повышенной фагоцитарной активности иммунокомпетентных клеток. В мазках обследуемых контрольной группы отмечалось также достаточно низкое содержание клеточных элементов, среди которых встречались отдельно лежащие клетки реснитчатого цилиндрического эпителия и немногочисленные нейтрофилы с сохраненной цитоплазмой и четкими ядрами, выявлялись нейтрофилы с ядром синего цвета и цитоплазмой, полностью заполненной гранулами катионных белков ярко-зеленого цвета, свободно лежащих гранул катионных белков в мазках обнаружено не было.
У больных целиакией с атрофическими изменениями слизистой оболочки носа количество клеток эпителия, нейтрофилов, макрофагов и бокаловидных клеток было сниженным по сравнению с соответствующими показателями пациентов с другими формами патологии ЛОР-органов (p<0,05).
У пациентов с целиакией и аллергическим ринитом в риноцитограмме отмечалось повышенное содержание эозинофилов и тучных клеток (p<0,05).
При полипозном риносинусите у больных целиакией выявлено повышенное содержание в риноцитограмме бокаловидных клеток и нейтрофилов.
При сравнительном анализе количественных и качественных характеристик нейтрофилов в риноцитограмме пациентов с целиакией установлено их достоверное повышение (29,7±2,2% на 100 клеток) по сравнению с аналогичным показателем в группе контроля (11,3±2,7% на 100 клеток).

Как видно из табл. 3, при Таблица 3. Сравнительная характеристика количественных показателей риноцитограммы пациентов с целиакией и лиц контрольной группы (M±s) Примечание. * — р
Значения СПД, ИДК, ИЦК нейтрофилов у больных целиакией также оказались достоверно выше, чем в контрольной группе, что свидетельствует о выраженных нарушениях местной иммунологической резистентности.
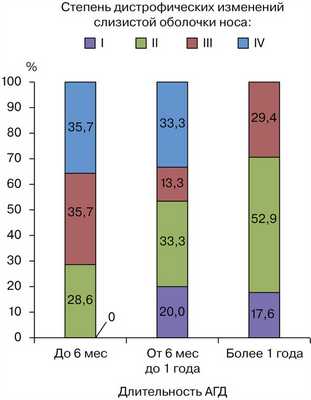
Для оценки эффективности патогенетической терапии и ее влияния на показатели риноцитологического исследования все пациенты основной группы были распределены на три подгруппы в зависимости от длительности аглютеновой диеты (АГД) (рис. 3). Рис. 3. Распределение пациентов с целиакией по степени дистрофических изменений слизистой оболочки носа в зависимости от продолжительности АГД. Анализируя эффективность АГД у пациентов с хронической ЛОР-патологией, мы наблюдали положительную динамику. Однако следует отметить, что продолжительность диеты менее 1 года является недостаточным сроком для полного восстановления слизистой оболочки носа, так как доля пациентов без дистрофических изменений слизистой оболочки увеличилась по сравнению с исходным периодом незначительно и составила лишь 20,0%. В целом АГД имела положительную динамику у больных целиакией, ассоциированной с ЛОР-патологией. На фоне АГД наблюдалось улучшение морфофункционального состояния слизистой оболочки полости носа.
Заключение
До настоящего времени существуют нерешенные вопросы, касающиеся диагностики и лечения внекишечных проявлений целиакии, механизмов формирования патологических изменений со стороны различных органов и систем при этом заболевании. Как показали исследования, риноцитограмма больных целиакией характеризуется высокой частотой значительных деструктивных изменений нейтрофилов и эпителиальных клеток, что может играть определенную роль в нарушении местной защиты слизистой оболочки верхних дыхательных путей, приводя к дисфункции ее защитных механизмов и хронизации воспалительного процесса верхних дыхательных путей [11]. Атрофические изменения слизистой оболочки полости носа, выявленные в ходе наблюдения, по-видимому, являются вторичными, патогенетически связанными с целиакией.
Кислород имеет значение: роль гипоксии в патогенезе риносинусита
Эпителий дыхательных путей - первый защитный барьер против факторов окружающей среды. В данной статье рассмотрены патогенетические механизмы нарушения работы этого барьера, приводящие к развитию синуситов.
Авторы Hyung-Ju Cho и Chang-Hoon Kim. Впервые опубликовано 02/2018 в журнале BMB Reports. Оригинал статьи доступен по ссылке.
Введение
Эпителий дыхательных путей представляет собой первую линию защиты от факторов окружающей среды, выступая в качестве механического барьера наряду с мукоцилиарным транспортом (MЦT) как составляющая врожденного иммунитета (1). Для поддержания этой физиологической роли необходимо постоянное производство энергии, которое обеспечивается адекватной оксигенацией (2). Некоторые патологические состояния могут привести к снижению уровня кислорода в эпителии дыхательных путей. При хронических заболеваниях дыхательных путей, таких как синусит, аллергический ринит, астма и хроническая обструктивная болезнь легких, снижение количества кислорода может происходить из-за патологических изменений в микрососудистых структурах или из-за увеличения метаболических потребностей (3). Эти заболевания обычно сопровождаются такими патологическими явлениями, как инфильтрация воспалительными клетками, реорганизация тканей или гиперсекреция слизи (4).
Хронический синусит является одним из заболеваний верхних дыхательных путей, связанных с гипоксией. Слизистая оболочка пазух состоит из ресничного столбчатого эпителия и бокаловидных клеток. Реснички эпителиальных клеток играют важную роль в транспортировке слизи из пазухи через соустье и поддержании нормального физиологического состояния гайморовых пазух. Нормальный мукоцилиарный транспорт необходим для поддержания врожденной защиты дыхательных путей, и показано, что при риносинусите происходит снижение эффективности мукоцилиарного транспорта. Дефект мукоцилиарного транспорта может развиться из-за изменений вязкости слизи или воздействия токсинов (5). Гипоксия является еще одним потенциальным фактором развития синусита, и в данном обзоре рассмотрен патогенез синусита, связанного с гипоксией.
Cвязанная с гипоксией гиперсекреция слизи, опосредованная HIF-1α
Механическая непроходимость пазухи снижает концентрацию кислорода внутри нее, что приводит к синуситу (6). Гиперплазия бокаловидных клеток является одним из основных гистопатологических изменений при хроническом риносинусите (7). В гипоксических условиях гипоксически-индуцируемый фактор-1 (HIF-1) необходим для транскрипционной экспрессии эритропоэтина (8), фактора роста эндотелия сосудов (VEGF) (9), гемоксигеназы-1 (10) и трансферрина (11). HIF-1 состоит из гетеродимера, α и β-субъединиц (12), и активация HIF-1α служит проводником для сигнального пути ERK (extracellular signal-regulated kinase) (13). Хотя гипоксия является эффективным стимулятором воспаления (4), роль гипоксии в перепроизводстве слизи и связанных с этим механизмах не доказана однозначно. Элемент гипоксия-ответ (HRE — hypoxia-response element) обычно присутствует в проксимальном промоторе и включает в себя один или несколько участков связывания HIF-1 (14). Мутация в локусе HRE инактивирует транскрипционный ответ на гипоксию (15, 16). Промоторная область гена MUC5AC включает в себя последовательность, аналогичную HRE (17, 18). Поэтому мы провели исследование промоторной области гена MUC5AC, чтобы понять механизм действия индуцированного гипоксией гена MUC5AC в эпителии дыхательных путей. В основном мы использовали первичные человеческие назальные эпителиальные (HNE) клетки, которые были культивированы и дифференцированы в воздушно-жидкой системе, в экспериментах in vitro (19). В гипоксическом состоянии клетки HNE индуцировали экспрессию мРНК MUC5AC и белка MUC5AC (20). Было также зафиксировано повышение экспрессии HIF-1α в клетке HNE, вызванное гипоксией, и эксперимент с уменьшением или усилением функции подтвердил роль HIF-1α в экспрессии MUC5AC в гипоксической среде. Чтобы определить степень связывания ДНК HIF-1α с промотором MUC5AC при гипоксии, мы провели анализ иммунопреципитации хроматина (ChIP). Было показано, что регуляторная область HRE промотора MUC5AC играет важную роль в увеличении транскрипционной активности MUC5AC, вызванной гипоксией (20). Иммуногистохимическое окрашивание продемонстрировало значительную экспрессию MUC5AC и HIF-1α в эпителии слизистой оболочки пазухи. Эти данные свидетельствуют о том, что гипоксическое состояние в пазухе связано с синуситом через избыточное производство MUC5AC посредством HIF-1α-опосредованного механизма.
Эпителиальный барьер при гипоксии: VEGF-опосредованный механизм
Было изучено несколько аспектов патофизиологии повреждения эпителия. Было продемонстрировано, что гипоксия способствует разрушению эпителиального барьера посредством VEGFR-1 (рецептор фактора роста эндотелия сосудов — 1) в эпителии сетчатки (21). Действие IL-13 (интерлейкина — 13) приводит к нарушению плотного соединения в бронхиальном эпителии (22). Риновирусная инфекция является фундаментальным предрасполагающим фактором для последующей бактериальной инвазии, диссоциируя белки плотных контактов zona occludens-1 (23). Насколько нам известно, это первый отчет, который разъясняет роль оси гипоксия-HIF-VEGF в регуляции эпителиальной парацеллюлярной проницаемости в эпителии дыхательных путей.
Нарушение функции эпителиального барьера является важным гистологическим изменением, имеющим клиническое значение. Этот факт дает возможность разработки новых терапевтических средств для улучшения функции эпителиальных барьеров при различных заболеваниях дыхательных путей. Уязвимость к адгезии или инвазии патогенов может быть увеличена из-за повышенной проницаемости эпителиального барьера. Мы также подтвердили, что в гипоксических условиях бактериальная проницаемость назального эпителия растет по сравнению с проницаемостью при нормоксии.
Эпителиальный барьер при гипоксии: механизм, опосредованный белками плотных контактов
Функцию эпителиального барьера поддерживают плотные и адгезивные контакты. Плотные контакты находятся в апикальной зоне клеток и отделяют просвет, находящийся апикальнее, от базолатеральных структур. ZO-1 представляет собой компонент плотного контакта, который присутствует в верхней части эпителия (33). Адгезивные контакты также важны для межклеточной связи, поскольку они предоставляют сайт для стыковки сигнальных молекул (34, 35). Основным компонентом адгезивного контакта является E-кадгерин — трансмембранный белок, который образует кальций-зависимые гемофильные межклеточные связи между эпителиальными клетками (36). В слизистой оболочке носа человека вирусная инфекция приводит к нарушениям в комплексах плотных и адгезивных контактов, особенно ZO-1. Было показано, что это способствует увеличению интраназальной инокуляции бактерий у мышей (23). При аллергии в слизистой оболочке носа происходит снижение уровня мРНК ZO-1 (37). Снижение уровня ZO-1 в совокупности с повышением уровня E-кадгерина наблюдалось и в эпителии назального полипа (38). Следовательно, изменения уровня ZO-1 или E-кадгерина могут привести к нарушению эпителиального барьера при различных патологических состояниях (39).
Чтобы доказать влияние гипоксии на барьерную функцию, мы исследовали влияние гипоксии на уровни экспрессии ZO-1 и E-кадгерина (40). После 8 часов в гипоксических условиях экспрессия ZO-1 и E-кадгерина значительно уменьшалась. Факт нарушения эпителиального барьера было также подтвержден при измерении TEER. Уменьшенная экспрессия ZO-1 и E-кадгерина была также выявлена при хроническом синусите в эпителии пазух, который подвержен значительному влиянию гипоксии. Таким образом, гипоксия приводит к даунрегуляции молекул плотных контактов и увеличению TEER, что указывает на нарушение нормальной барьерной функции носового эпителия.
Воспаление при гипоксии: HMGB-1 опосредованный механизм
Амфотерин (HMGB1 — high-mobility group protein B1) представляет собой белок небольшого размера, который действует как шаперон ДНК. Амфотерин выделяется во внеклеточное пространство либо активно, либо пассивно. Высвобождение амфотерина после провоспалительной стимуляции является активным процессом. Его же высвобождение после апоптоза и некроза — пассивный процесс.
Амфотерин, который высвобождается во внеклеточное пространство, связывается с толл-подобным рецептором (TLR) 2 или TLR 4 и рецептором конечных продуктов гликирования (RAGE). Это приводит к активации провоспалительных сигнальных путей (41-43). Функция амфотерина, который перемещается из ядра в цитоплазму, зависит от посттрансляционных модификаций (фосфорилирования, ацетилирования и окисления). Важную роль в этом процессе играют активные формы кислорода (ROS — reactive oxygen species) (41, 42, 44, 45). Недавно мы сообщали об обнаружении повышенного количества амфотерина в назальном лаваже пациентов с хроническим риносинуситом (46). Существует вероятность того, что при гипоксии амфотерин может переместиться из ядра в цитоплазму и высвободиться во внеклеточное пространство. Тогда он будет служить характерным маркером повреждения ткани, связанного с гипоксией (47, 48). Поэтому мы исследовали роль амфотерина в прогрессировании воспалительных заболеваний верхних дыхательных путей в гипоксических условиях. Гипоксия индуцирует перемещение амфотерина из ядра во внеклеточное пространство клеток RPMI 2650 (среда для культур клеток и тканей) и клеток HNE (human nasal epithelial). Иммунофлуоресцентный анализ (ELISA и western blotting) выявил увеличение концентрации амфотерина в цитоплазме при гипоксии и в супернатанте клеток HNE (49). Гипоксия увеличивает локальный окислительно-восстановительный потенциал из-за изменений в производстве ROS (50). Производство ROS зависит от содержания кислорода: умеренная степень гипоксии стимулирует продукцию ROS, но тяжелая гипоксия ее ингибирует (50). Изменения концентрации кислорода по-разному влияют на окислительно-восстановительный потенциал структуры амфотерина, изменяя таким образом его функцию. В наших экспериментальных условиях гипоксия значительно повысила количество ROS. Это подтверждалось тем, что предварительное введение акцептора ROS, N-ацетилцистеина (NAC), подавляло индуцированный гипоксией рост концентрации ROS. Иммунофлуоресцентный анализ показал снижение перемещения амфотерина в цитоплазму, что подразумевает зависимость амфотерина от увеличения количества ROS.
Также был выявлен факт внеклеточной секреции амфотерина. Предварительная обработка ацетилцистеином уменьшала уровень амфотерина из собранных апикальных супернатантов при иммунофлюоресцентном анализе ELISA и western blotting (49). NADPH-оксидазы могут генерировать ROS и двойную оксидазу (DUOX) 1 и 2. Подтипы NADPH-оксидазных ферментов играют важную роль в производстве ROS при воспалении дыхательных путей (51). Нокдаун гена DUOX 2 с использованием короткой РНК, образующей шпильки, привел к (shDUOX2) снижению продукции ROS в клетках HNE, но при нокдауне гена DUOX 1 изменений не наблюдалось. Клетки HNE с внедренной shDUOX2 также демонстрировали снижение секреции амфотерина под воздействием гипоксии (49). Таким образом, очевидно, что именно DUOX2, а не DUOX1, играет важную роль в секреции амфотерина при гипоксии, и именно DUOX2 может приводить к ROS-активации TLR2 и TLR4 в эпителии верхних дыхательных путей (51).
Носовые выделения пациентов с хроническим риносинуситом могут содержать триптазу тучных клеток, эластазу нейтрофилов, эозинофильный катионный белок, метаболиты оксида азота, IL-1, IL-5 или IL-8, что предполагает, что эти молекулы участвуют в развитии хронического воспаления в верхних дыхательных путях (52-55). Амфотерин связывается с несколькими специфическими рецепторами клеточной поверхности, такими как RAGE или TLR, и действует как цитокиноподобный белок, индуцирующий хемотаксис и высвобождение цитокинов. Мы выявили амфотерин, TNF-α, IL-1β и IL-8 в носовых выделениях пациентов с хроническим риносинуситом и провели корреляционный анализ с использованием шкалы Ланда-Маккея — системы подсчета баллов, указывающую на тяжесть симптомов синусита.
TNF-α был обнаружен только у 21% пациентов, а IL-1β был обнаружен у 44% пациентов без корреляции с тяжестью симптомов (46). Впрочем, как амфотерин, так и IL-8 были обнаружены во всех пробах назальной жидкости у пациентов, и их уровень коррелировал с оценкой по шкале Ланда-Маккея. Интересно отметить, что уровень HMGB1 был связан и с уровнем IL-8 (46). Поэтому мы исследовали IL-8 в клетках HNE под гипоксией и обнаружили, что секреция IL-8 увеличивалась при гипоксии и снижалась при предварительной обработке ацетилцистеином. Это открытие позволяет предположить, что секреция IL-8 регулируется сигнальным механизмом ROS. Кроме того, введение рекомбинантного амфотерина (rHMGB1) млекопитающих индуцировало секрецию IL-8 в супернатантах культуры апикальных клеток. Применение анти-HMGB1 антительного блокатора для ингибирования функции секретируемого белка амфотерина прерывало производство IL-8 (49). Это наблюдение очень интересно, потому что амфотерин может быть связан с конкретными цитокинами, такими как IL-6, IL-8 и IL-33 в носовом эпителии (56, 57). Амфотерин также индуцирует высвобождение IL-1α, IL-1β, IL-6, IL-8 и TNF-α в макрофагах и TNF-α, IL-1β и IL-8 в нейтрофилах (58). В эндотелиальных клетках амфотерин может увеличить производство тканевого фактора — первоначального белка коагуляционного каскада, также участвующего в регуляции фибринолиза (59, 60).
Заключение
Анализ результатов вышеперечисленных исследований показал, что гипоксия играет важную роль в патогенезе воспаления верхних дыхательных путей, особенно при хроническом риносинусите (рис.1). HIF-1α является ключевым фактором гомеостаза кислорода в эпителии и опосредует избыточное производство MUC5AC. HIF-1α-опосредованная гиперэкспрессия VEGF и функциональные изменения белков контактов (ZO-1 и E-кадгерина) также являются важными аспектами, приводящими к нарушению эпителиального барьера при гипоксии. Кроме того, гипоксия индуцирует транслокацию амфотерина в цитоплазму и высвобождение IL-8 посредством ROS-зависимого механизма в эпителии дыхательных путей. Предполагается, что исследование патофизиологии гипоксии в эпителии дыхательных путей поможет в поиске новых путей лечения заболеваний верхних дыхательных путей.
.jpg)
Рис.1. Патофизиология гипоксия-индуцированного воспаления верхних дыхательных путей. При гипоксии HIF-1α служит ключевым фактором, опосредующим избыточную продукцию MUC5AC. Гипоксия стимулирует HIF-1α-зависимую гиперэкспрессию VEGF, приводящую к нарушению функции эпителиального барьера и функциональным изменениям белков связей (E-кадгерина и ZO-1). Кроме того, гипоксия индуцирует перемещение амфотерина (HMGB1) в цитоплазму и высвобождение IL-8 посредством ROS-зависимого механизма в эпителии дыхательных путей.
Читайте также:
