Характеристика свойств раковых клеток
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Под термином «онкологическое заболевание» понимают более сотни разных патологий. Все они объединены некоторыми общими признаками: в определенных клетках возникают генетические мутации, в результате которых эти клетки становятся «неправильными», перестают адекватно реагировать на внешние сигналы и начинают бесконтрольно размножаться. В организме возникает злокачественная опухоль. Постепенно она растет, вторгается в окружающие ткани, соседние органы. Некоторые злокачественные клетки отрываются от материнской опухоли, мигрируют в другие органы и образуют вторичные очаги — метастазы.
Без лечения рак прогрессирует, все сильнее распространяется в организме. Его становится все сложнее лечить, ухудшается прогноз. Если на начальных этапах опухоль можно относительно легко удалить, то с появлением метастазов ремиссия становится практически невозможной. Для того чтобы понимать, насколько запущено заболевание у конкретного пациента, были разработаны специальные системы стадий рака (иногда ошибочно употребляют термин «степени рака»).
При всех злокачественных опухолях применяются универсальные принципы стадирования, но при каждом типе рака они имеют определенные нюансы. Правильное определение стадии опухоли — одна из первостепенных задач, которая стоит перед онкологом на этапе обследования пациента.

Для чего нужно определять стадию рака?
Определение стадии злокачественной опухоли помогает решать важные задачи:
- Правильно спланировать лечение.
- Определить прогноз для пациента. Для каждой стадии каждого типа рака известны средние показатели пятилетней выживаемости. Врач может заранее примерно прогнозировать, какого результата можно ожидать, насколько высока вероятность наступления ремиссии и рецидива в будущем.
- Контролировать течение заболевания и эффективность лечения.
- Обеспечить преемственность в оказании медицинской помощи. Благодаря тому, что существует единая классификация стадий онкозаболеваний, онкологи из разных клиник «разговаривают на одном языке». Например, когда врач говорит, что у пациента рак легкого T4N1M1, его коллеги из любой клиники мира легко поймут, о чем речь.
Стадии злокачественных опухолей TNM
TNM — основная система классификации стадий раковых заболеваний, она была разработана еще в середине прошлого столетия. Последняя, седьмая редакция Классификации TNM была принята в 2009 году. Она останется неизменной до тех пор, пока не накопятся новые технологии диагностики и лечения рака, из-за которых ее придется пересмотреть.
В классификации TNM учитываются три основные характеристики злокачественных опухолей, они соответствуют буквам аббревиатуры:
- T — tumor — характеристики первичной опухоли.
- N — nodus — распространение опухолевых клеток в регионарные лимфатические узлы.
- M — metastasis — наличие отдаленных метастазов.
В зависимости от характеристик конкретной злокачественной опухоли, при определении стадии к каждой букве приписывают цифру или специальное обозначение:
Характеристики первичной опухоли (T)
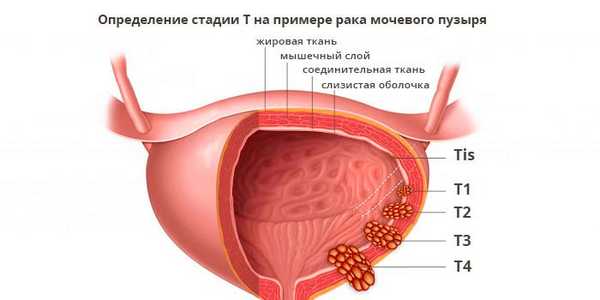
- TX — не получается оценить первичную опухоль.
- T0 — первичная опухоль не обнаружена.
- Tis — «рак на месте» (in situ). При этом появляется скопление раковых клеток, но они не прорастают в соседние ткани. Можно сказать, что это самая начальная стадия рака.
- T1—4 — с увеличением цифры увеличиваются размеры первичной опухоли и степень прорастания в окружающие ткани.
- NX — не получается оценить регионарные лимфоузлы.
- N0 — раковые клетки в регионарных лимфоузлах отсутствуют.
- N1—3 — с увеличением цифры увеличивается степень распространения опухолевого процесса в лимфатические узлы.
- M0 — отдаленные метастазы отсутствуют.
- M0 — отдаленные метастазы отсутствуют.
- M1 — отдаленные метастазы обнаружены.
Если нужно уточнить стадию, к цифре дополнительно добавляют букву. Например, M1a при немелкоклеточном раке легкого означает, что опухолевые клетки распространились во второе легкое, либо присутствуют в плевральном выпоте (жидкости вокруг легких), либо в перикардиальном выпоте (жидкости вокруг сердца).
Иногда перед аббревиатурой TNM ставят букву, которая обозначает, каким образом был установлен диагноз:
- p — стадия рака была диагностирована патологоанатомами, после того как опухоль была удалена и оценена под микроскопом;
- c — клинический диагноз, установленный до проведения биопсии по данным обследования.
В некоторых случаях проводят сентинель-биопсию — оценку сторожевого лимфатического узла. Этим термином обозначают лимфоузел, который находится первым на пути оттока лимфы от злокачественной опухоли. Во время операции в опухоль вводят радиофармпрепарат или флуоресцентный краситель. Эти вещества всасываются в лимфатические сосуды и распространяются с током лимфы, «прокрашивая» сторожевой лимфатический узел. Его удаляют и проверяют, нет ли в нем раковых клеток. Это помогает определить, распространилась ли опухоль в регионарные лимфоузлы, нужно ли их удалять и назначать пациенту дополнительное лечение.
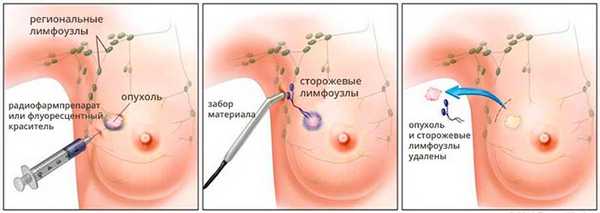
Оценивая результаты сентинель-биопсии, врачи применяют следующие обозначения:
- pNX(sn) — сторожевой лимфоузел не удалось оценить;
- pN0(sn) — в сторожевом лимфоузле не обнаружено метастазов;
- pN1(sn) — в сторожевом лимфоузле обнаружен метастаз.
Другие системы определений стадий опухолевого процесса
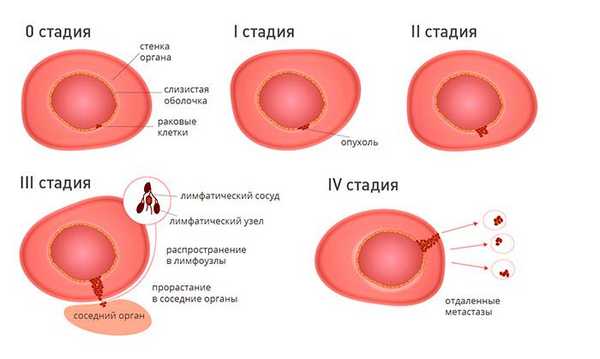
Врачи-онкологи часто используют упрощенную классификацию по стадиям злокачественных опухолевых образований. Она опирается на систему TNM, но в ней выделяют всего пять стадий, которые обозначаются римскими цифрами:
- 0 стадия рака обозначает «рак на месте». Эта злокачественная опухоль имеет небольшие размеры, находится там, где возникла изначально, и не прорастает в соседние ткани. Такие новообразования обычно просто удалить. Практически у 100% пациентов удается добиться ремиссии.
- I стадия — это небольшая опухоль, которая находится в пределах одного органа. Такие новообразования называют «раком на ранней стадии». Его относительно просто лечить, пятилетняя выживаемость приближается к 100%.
- II стадия диагностируется в случаях, когда опухоль имеет большие размеры по сравнению с I стадией, более глубоко прорастает в толщу органа, но не распространяется за его пределы. При некоторых онкологических заболеваниях на II стадии опухолевые клетки распространяются в лимфатические узлы. — рак, распространившийся за пределы органа, в котором он изначально возник. Опухоль распространяется на соседние органы либо в регионарные лимфатические узлы.
- IV стадия — рак с отдаленными метастазами. Прогноз в данном случае наименее благоприятный. Как правило, ремиссия невозможна. Иногда IV стадию называют «пятая стадия рака», что в некоторой степени логично, если рассматривать в качестве первой стадии нулевую.
Иногда, для того чтобы уточнить подстадию, к цифрам приписывают латинские буквы A, B, C. Например, диагноз может звучать как «стадия IIIB рака шейки матки».
Степень злокачественности
Под микроскопом раковые клетки отличаются от нормальных, и степень этого различия говорит о том, насколько агрессивно они себя ведут. В свою очередь, от этого зависит успешность лечения, вероятность рецидива, прогноз для пациента. Поэтому, наряду с общепринятой классификацией по стадиям, выделяют степени злокачественности рака. Их обозначают буквой G, к которой приписывают соответствующие индексы:
- GX — степень злокачественности онкологического заболевания не удалось оценить.
- G1 — высокодифференцированные опухоли. Опухолевая ткань сильно похожа на нормальную. Такой рак ведет себя наименее агрессивно, редко метастазирует. Прогноз для пациента наиболее благоприятный.
- G2 — умеренно дифференцированная опухоль. Раковые клетки уже довольно сильно отличаются от нормальных и ведут себя более агрессивно.
- G3 и G4 — низкодифференцированные и недифференцированные опухоли. Они отличаются наибольшей степенью злокачественности, ведут себя очень агрессивно, плохо реагируют на лечение.
Классификация злокачественных опухолей после операции
Для того чтобы оценить, насколько успешно прошло хирургическое лечение рака, иногда онкологи используют специальную постоперационную классификацию:
- RX — сложно проверить, осталась ли опухолевая ткань в организме пациента после хирургического лечения.
- R0 — опухоль в организме пациента после операции отсутствует.
- R1 — обнаружена остаточная опухоль по данным микроскопического исследования.
- R2 — оставшаяся опухоль настолько большая, что обнаруживается при осмотре, без микроскопии.
Стадирование отдельных типов злокачественных опухолей
Некоторые онкологические заболевания не укладываются в рамки общепринятой системы TNM:
- Опухоли у детей — это отдельная категория онкологических заболеваний. Они сильно отличаются от злокачественных опухолей, которые обнаруживаются у взрослых. Для них разработаны специальные системы классификаций, мы не будем их рассматривать в этой статье.
- Рак крови. Такие онкологические заболевания, как лимфома, лейкемия, множественная миелома не могут быть описаны системой TNM, потому что при них чаще всего нет солидной (плотной) опухоли с определенной локализацией. В каждом случае применяется своя специфическая классификация по стадиям.
- Опухоли нервной системы обычно не распространяются за пределы головного и спинного мозга. В настоящее время для них нет единой общепринятой классификации. Чаще всего, определяя стадию при таких онкологических заболеваниях, врачи используют только букву T.
Как определяют стадию онкологического заболевания?
В онкологии применяется много разных методов диагностики. Они обладают разной информативностью, позволяют установить диагноз с разной степенью точности. Соответственно, определить стадию можно тоже разными способами, с разной степенью достоверности. Для этого применяют специальные обозначения:
- C1 — стадия рака определена с помощью стандартных диагностических процедур — осмотра пациента врачом, рентгенографии, эндоскопического исследования. Это наименее точный метод.
- C2 — диагноз установлен на основании специальных, более точных методов диагностики: компьютерной томографии, МРТ, ПЭТ-сканирования, специальных разновидностей рентгенографии, эндосонографии, биопсии и др.
- C3 — выполнено диагностическое хирургическое вмешательство, получен фрагмент патологически измененной ткани, проведено цитологическое и гистологическое исследование.
- C4 — стадия опухоли установлена после полноценного хирургического вмешательства и исследования удаленной опухоли.
Важно понимать: стадия рака не меняется в процессе лечения
Стадию заболевания при раке устанавливают на момент первичного обследования — то есть сразу после того, как диагностировано онкологическое заболевание. Даже если в будущем опухоль уменьшится или, напротив, будет прогрессировать, стадия не изменится. Это важно понимать. Выживаемость и прогноз рассчитываются именно по стадии, которая диагностирована изначально.
У женщины был диагностирован рак молочной железы II стадии. Было успешно проведено лечение, но позже опухоль рецидивировала в виде метастазов в костях. Основной диагноз будет по-прежнему звучать как «рак молочной железы II стадии». Четвертая стадия была бы диагностирована только в том случае, если бы метастазы были обнаружены сразу, как только пациентка впервые обратилась к врачам.
Как быстро развивается рак?
При копировании ДНК во время клеточных делений неизбежно возникают ошибки. В организме человека регулярно появляются «неправильные» клетки. К счастью, в нашем теле работает противоопухолевый иммунитет и другие защитные механизмы, которые уничтожают этих «мутантов-повстанцев». Но иногда им все же удается выжить. Клетки с измененными генами активно размножаются, и со временем их становится настолько много, что они образуют опухоль.
Может ли рак появиться за месяц или за несколько дней? Если человека начали беспокоить симптомы, и у него диагностировали злокачественную опухоль, то это отнюдь не означает, что она возникла вчера или неделю назад. Раковые клетки могли находиться в организме годами. Вообще, онкологические заболевания очень сложно диагностировать на ранней стадии, потому что симптомы зачастую отсутствуют. Сложно сказать, сколько времени прошло с момента возникновения первой раковой клетки до появления злокачественной опухоли, которую удалось обнаружить во время УЗИ или эндоскопии. Ведь разные типы рака ведут себя по-разному. Одни очень агрессивны и растут быстро, другие годами «сидят на месте» и не приводят к каким-либо проблемам.
За сколько времени рак переходит в 4 стадию? Здесь сроки тоже сильно различаются. Это зависит от агрессивности опухоли, от того, насколько рано больной обратился к врачу, какое проводилось лечение. Например, есть меланома, которая метастазирует очень быстро, а есть базальноклеточный рак кожи — он очень редко дает метастазы.

Сколько времени нужно «неправильной» клетке, чтобы стать раковой опухолью?
В онкологии есть такой показатель — время удвоения объема опухоли. Исследования показали, что масса быстрорастущих опухолей легких увеличивается вдвое примерно за 223 дня, а медленнорастущих — за 545 дней. Для аденокарцином этот срок составляет в среднем 303 дня, для плоскоклеточного рака — 77 дней, мелкоклеточного рака легких — 70.
Для того чтобы узнать, за какое время опухоль достигнет объема 1 см3, нужно время удвоения объема умножить на 30. Нехитрые расчеты показывают, что зачастую на это уходят годы.
Если рак диагностирован «на ранней стадии», вполне вероятно, опухоль находится в организме человека уже 5-10 лет. Просто раньше она не давала о себе знать.
На какой стадии можно излечиться от рака?
В онкологии вместо терминов «излечение» и «выздоровление» принято говорить «ремиссия». Это значит, что во время обследования у пациента не обнаруживают никаких признаков присутствия рака в организме. Но всегда остается риск рецидива. Если в течение пяти лет болезнь не вернулась, в определенном смысле человека можно считать выздоровевшим.
Конечно же, это очень обобщенные данные. Всегда нужно говорить не о раке в целом, а о его конкретных типах. Потому что рак бывает разным.
Раковые клетки
Раковые клетки (злокачественные, атипичные, опухолевые клетки) - это клетки, которые в результате мутаций изменили свой внешний вид и функции, перестали быть похожими на нормальные клетки в соответствующей ткани. Наиболее характерные свойства раковых клеток: «бессмертие», способность к бесконтрольному размножению и распространению в организме. Строго говоря, раковыми можно назвать только клетки злокачественных опухолей из эпителиальных тканей. По отношению к другим злокачественным новообразованиям термин «рак» не применяют.

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
- находиться в отведенном ей месте: это обеспечивается за счет клеточной адгезии, то есть способности клеток «слипаться» между собой;
- размножаться только тогда, когда это необходимо;
- специализироваться на выполнении определенных функций: для этого каждая клетка сознательно себя ограничивает, активирует одни гены и «отключает» другие;
- «чинить» свою ДНК, если в ней произошли «поломки», мутации;
- совершить «самоубийство», если в ней произошли непоправимые патологические изменения, или если она «состарилась».
Во многом эти функции обеспечиваются за счет того, что клетки в организме постоянно «общаются» между собой и реагируют на определенные сигнальные молекулы. Раковая клетка эти сигналы игнорирует. Она начинает жить так, как будто она тут одна и не должна считаться с интересами соседей:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не слипается с соседними клетками. На поверхности «бунтарей» исчезают молекулы, которые удерживают их в нужном месте среди соседей. За счет этого раковая клетка может отрываться от первичной опухоли и путешествовать по организму. Во время этого путешествия она погибает или оседает в каком-нибудь органе, создает свои клоны и образует новый опухолевый очаг — метастаз.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Не «ремонтируют» свою ДНК. В итоге в опухолевых клетках накапливается все больше мутаций, они становятся менее дифференцированными и быстрее размножаются. Они не подвержены апоптозу — запрограммированной клеточной смерти.
При предраковых состояниях клетки тоже теряют свойства нормальных. Но они отличаются и от раковых, в первую очередь тем, что не могут распространяться в организме.
Особая разновидность злокачественных опухолей — так называемый «рак на месте» (in situ). Клетки уже являются раковыми, но пока еще не распространились за пределы своей изначальной локализации. Технически карцинома in situ — не рак, но ее принято рассматривать как самую раннюю стадию рака.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Гены-супрессоры опухолей сдерживают размножение клеток, восстанавливают поврежденную ДНК, вызывают апоптоз — запрограммированную клеточную смерть. Примеры таких генов: BRCA1, BRCA2, TP53 (кодирует белок p53 — «страж генома», который запускает апоптоз в поврежденных клетках).
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).
Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.

Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадъювантной терапией.
Другие методы лечения:
- Химиопрепараты обладают разными механизмами действия, но все они сводятся к повреждению и уничтожению быстро размножающихся клеток. В первую очередь, конечно же, раковых, но страдают и некоторые нормальные ткани, из-за этого могут возникать серьезные побочные эффекты.
- Лучевая терапия действует аналогично химиопрепаратам, поражая быстро размножающиеся клетки.
- Таргетные препараты воздействуют на молекулы, которые помогают раковым клеткам быстро размножаться, выживать и защищаться от иммунной системы. Например, существуют блокаторы HER2, о котором речь шла выше, ингибиторы VEGF — вещества, с помощью которого опухолевые клетки «выращивают» для себя кровеносные сосуды.
- Иммунотерапия помогает иммунной системе обнаруживать и уничтожать опухолевые клетки.
В «Евроонко» применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Что такое рак: онкология
Многие пациенты совершенно однозначно интерпретируют термины «рак», «онкология», «злокачественное новообразование». Однако нужно понимать, что это не одна болезнь, а скорее целый класс заболеваний, имеющих между собой как сходства, так и значительные отличия.
Рак — это злокачественная опухоль, при которой происходит бесконтрольное размножение клеток, сопровождающееся инвазией в подлежащие ткани и метастазированием в отдаленные органы с током лимфы и/или крови. В народе раком называют любую злокачественную опухоль, но ученые сюда относят только карциномы — опухоли, произрастающие из эпителиальных тканей. Злокачественные новообразования из других тканей называют саркомами, злокачественные новообразования лимфатической системы называют лимфомами, а кроветворной — лейкозами.
Зачастую онкология воспринимается пациентами, как смертный приговор. Однако в реальности далеко не все злокачественные опухоли приводят к гибели человека. Более половины всех пациентов благополучно излечиваются и люди забывают о перенесенном заболевании навсегда.
Несмотря на значительные успехи в лечении онкологии, все же данная патология характеризуется достаточно высоким уровнем летальности и, безусловно, для успешного лечения требует к себе самого пристального внимания со стороны высококвалифицированных докторов.
Механизм возникновения рака
В основе онкологического заболевания лежит нарушение процессов регуляции тканевого роста.
Клетки нашего организма постоянно обновляются. В процессе их деления всегда существует вероятность возникновения ошибок в генах (мутации). Это происходит и в норме, но их частота значительно возрастает при воздействии на организм таких неблагоприятных факторов, как канцерогенные вещества, ионизирующее излучение и др.
Для предупреждения и исправления мутаций существуют различные механизмы. Если они не срабатывают, клетка с поврежденной ДНК развивается и многократно делится, не подчиняясь контролирующим системам организма. В итоге формируется образование, которое принято называть термином «злокачественная опухоль».

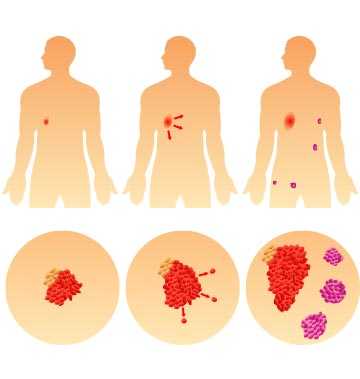
Злокачественные опухоли характеризуются тремя ключевыми отличиями от доброкачественных:
- Неконтролируемый бесконечный рост.
- Прорастание (инвазия) в соседние ткани и органы с нарушением их функционирования.
- Способность к метастазированию — процессу миграции раковых клеток с током крови или лимфы в другие части тела
Именно данные характеристики определяют агрессивность процесса и его злокачественность.
Опухоль может состоять из плотной ткани и тогда говорят о солидном образовании. Однако она может иметь и жидкую консистенцию, как при лейкозах и лимфомах.
Трудности в лечении рака
Онкологическое заболевание может возникнуть у любого живого организма в любом возрасте. Однако данный риск увеличивается с возрастом. Считается, что более 64% случаев заболевания выявляются у людей старше 65 лет. Тем не менее, в настоящее время онкологи говорят об омоложении таких пациентов. Все чаще болезнь диагностируется в возрасте до 40 лет.
Существуют две основные проблемы в лечении данной патологии:
- Распространенность опухолевого процесса, что ограничивает возможности радикального хирургического лечения.
- Гетерогенность клеточного состава опухоли. Можно подобрать препараты, которые убьют 99% опухолевых клеток, но если хотя бы несколько из них уцелеют, то они снова будут делиться, и разовьется рецидив
заболевания.

Причины появления рака
Причины онкологических заболеваний очень разнообразны, но все они приводят
к тому, что в клетках организма возникает мутация, которая приводит к их
бесконтрольному размножению. Спровоцировать образование и размножение
таких клеток могут следующие факторы:
Неправильное питание
Оно является одной из главных причин возникновения рака. И здесь есть несколько аспектов. Во-первых, во многих продуктах, которые люди употребляют ежедневно, содержится определенное количество пищевых канцерогенов. К таким продуктам относят копчености, маринады и другие консервированные и жареные блюда, овощи и фрукты, выращенные с применением химических удобрений и пестицидов и др. Во-вторых, имеет значение сбалансированность питания. Например, есть данные, что избыток мяса в рационе приводит к увеличению риска развития колоректального рака, в то же время большое количество растительных волокон и клетчатки снижает эти риски. Несбалансированное питание может привести к развитию ожирения, которое является фактором риска таких злокачественных новообразований как рак поджелудочной железы.
Старение
В подавляющем большинстве случаев злокачественные опухоли возникают у людей старше 50 лет. Это связывают с накоплением действия факторов риска и ослаблением механизмов защиты и уничтожения мутировавших клеток.
Наследственность
Когда говорят о наследственных причинах онкологии, имеют ввиду два аспекта — генетическую предрасположенность и наследственные формы злокачественных новообразований. В целом вероятность заболеть той или иной формой рака в течение жизни составляет 5-10%. Однако при наличии в семье случаев злокачественных новообразований, эта вероятность увеличивается более, чем в два раза. Это называется генетической предрасположенностью. Помимо этого, есть наследственные формы рака, при которых имеются мутации в определенных генах. В качестве примера можно привести мутации в генах BRCA, при наличии которых вероятность развития рака молочной железы или яичников составляет около 80%.
Вирусы
Вирус папилломы человека высокого онкогенного риска вызывает рак шейки матки. Вирусы гепатитов В и С увеличивают вероятность возникновения рака печени. Инфицирование вирусом Эпштейна-Барр может привести к развитию лимфомы, а Т-лимфотропный вирус может вызвать развитие лейкоза.
Вредные привычки и химическая зависимость
Курение, злоупотребление алкоголем и наркомания также являются серьезными причинами развития рака. Например, каждый пятый случай развития злокачественного новообразования связывают именно с курением. Причем речь идет не только о раке легких. Табачный дым увеличивает риск развития рака ЛОР-органов и органов пищеварительной системы, то же касается и алкоголя. Наркомания приводит к серьезным нарушениям обмена веществ и работы всех систем организма, в том числе и иммунной. На этом фоне развиваются неоплазии, характерные для иммунодефицитов — лимфомы, лейкозы, саркомы.
Ионизирующее излучение
Когда говорят об ионизирующем излучении как о причине развития онкологии на постсоветском пространстве, большинство людей имеет ввиду катастрофу на ЧАЭС. И с этим сложно спорить, поскольку после взрыва отмечалось увеличение случаев развития злокачественных неоплазий, в том числе лейкозов, лимфом и рака щитовидной железы. Однако, помимо этого, нельзя забывать об опасности воздействия солнечного излучения, которое может неблагоприятно воздействовать на кожу и органы зрения. Также увеличивает риск развития вторичных раковых опухолей прохождение лучевой терапии.
Предраковые заболевания
Некоторые виды рака развиваются на фоне имеющейся патологии. Например, колоректальный рак в большинстве случае происходит из аденоматозных кишечных полипов, рак эндометрия может происходить на фоне миом или эндометриоза, раку кожи могут предшествовать пигментный кератоз, лейкоплакия или кожный рог, раку легкого — некоторые профессиональные заболевания легких, раку шейки матки — воспалительные и диспластические процессы. Поэтому важно регулярно проходить скрининговое обследование для своевременного выявления предраковых заболеваний и их лечения.
Неблагоприятная экологическая обстановка и воздействие промышленных и химических канцерогенов
Наиболее агрессивные канцерогены — это асбест, сажа, выхлопные газы автомобилей, некоторые виды продуктов переработки нефти.
Характеристика свойств раковых клеток
Чубенко Вячеслав Андреевич
Заведующий отделением химиотерапии Санкт-Петербургского клинического научно-практического центра специализированных видов медицинской помощи (онкологического),
кандидат медицинских наук, Санкт-Петербург
Моисеенко Владимир Михайлович
Директор ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», Заслуженный врач РФ, Лауреат премии Правительства РФ, Председатель регионального отделения RUSSCO, главный редактор Практических рекомендаций RUSSCO, член-корреспондент РАН, профессор, доктор медицинских наук, Санкт-Петербург
Одним из признаков злокачественной опухоли является изменение метаболических свойств клеток [1]. К ним относятся:
- нарушение регуляции утилизации глюкозы и аминокислот,
- активация «новых» способов получения питательных веществ,
- использование промежуточных продуктов гликолиза и цикла трикарбоновых кислот для биосинтеза никотинамидадениндинуклеотида фосфата (НАДФ),
- повышенная потребность в азоте,
- изменения в регуляции генов метаболизма,
- метаболические взаимодействия с микроокружением [2].
Особенностью является выраженная гетерогенность энергетического гомеостаза опухолевых клеток вследствие огромного числа причин, в том числе:
- молекулярного фенотипа (KRAS-мутация; Her2/neu гиперэкспрессия; EGFR-мутация; BRCA-мутация и др.),
- стадии опухолевого процесса,
- локализации первичной опухоли или метастаза,
- размера опухоли,
- этапа клеточного цикла (S-фаза, M-фаза, G0, ),
- условий микроокружения [3].
Более 100 лет прошло с тех пор, как Отто Варбург провел первые экспериментальные исследования метаболизма в опухолевых клетках, 74 года с момента внедрения Сидни Фарбер антифолатов в лечение лейкоза и 20 лет изучения взаимосвязи онкогенов и способов потребления энергии [4]. Однако, к сожалению, на сегодняшний день подобные аспекты не учитываются при планировании лекарственной терапии. Кроме того, без внимания остаются метаболические особенности клеток микроокружения (например, фибробластов) и иммунной системы, которые играют ключевую роль в инициации опухоли и ее прогрессии. Безусловно, терапевтические воздействия на ключевые метаболические мишени как в опухолевых клетках, так и в ее микроокружении, могут быть перспективной стратегией с точки зрения влияния на контроль злокачественного роста и продолжительность жизни больных. К ним относятся:
- исключение важнейших метаболитов,
- голодание и ограничение калорий, кетодиета,
- физические нагрузки,
- ингибирование отдельных этапов метаболизма,
- использование метаболических особенностей опухолей как «ахиллесову пяту»,
- перегрузка клеток глюкозой,
- борьба с закислением микроокружения,
- потенцирование эффективности стандартной терапии.
Исключение важнейших метаболитов
Впервые в 1988 году Prager M. и Baechtel F. продемонстрировали зависимость роста клеток рака почки от наличия в среде аспарагиназы [5]. Данный фермент гидролизует основные энергетические субстраты светлоклеточного рака, такие как аспарагин и глутамин (около 2-3%). К 6 дню эксперимента лишь 6% злокачественных клеток оставались жизнеспособными по сравнению с 66% в обычных условиях. На сегодняшний день аспарагиназа входит в стандарты лечения острого лимфобластного лейкоза у детей [6]. Интересно отметить, что эффективность подобного лечения коррелирует с экспрессией аспарагин синтетазы в злокачественных клетках. Li H. с соавторами протестировали 225 метаболитов в 928 клеточных линиях 20 типов опухолей [7]. Оказалось, что в случае снижения функции данного фермента в различных видах опухолей (чаще при раке желудка и печени) отмечалось значительное подавление опухолевого роста. Эти результаты позволяют предположить, что лечение аспарагиназой в случае наличия предиктивного маркера (отсутствие фермента или его гиперметилирование) может рассматриваться как перспективный метод метаболической терапии различных солидных опухолей [7].
Голодание и ограничение калорий, кетодиета
Ограничение калорий, изменение характера питания и различные диетические подходы зарекомендовали себя в лечении различных заболеваний, в том числе трудноизлечимой эпилепсии у детей, сахарного диабета 2 типа, ожирения, дисбактериоза. В исследовании II фазы (DIRECT) продемонстрирована эффективность голод-имитирующей диеты у больных ранним раком молочной железы на фоне неоадъювантной химиотерапии по сравнению с обычным режимом питания [8]. При этом оценивался как клинический ответ, так и влияние на качество жизни (восприятие болезни, переносимость химиотерапии). Голод-имитирующая диета включала в себя растительную пищу с низким содержанием аминокислот. Она представляла собой суп, бульон, витамины и чай в течение 3-х дней до цикла химиотерапии и в день цитостатического лечения. При этом калорийность рациона снижалась с первого (~1200 ккал) до 2-4 дня (~200 ккал). В итоге у больных на фоне депривации основных энергетических субстратов была более выражена стрессоустойчивость и лучшая переносимость проводимой химиотерапии. Кроме того, согласно опросникам по качеству жизни, у них нарастали показатели эмоционального, физического, ролевого, когнитивного и социального функционирования. При этом снижались параметры усталости, тошноты и бессонницы [8]. Таким образом, подобный подход может быть рассмотрен как дополнительная опция к проводимой стандартной терапии.
Кетогенная диета (КД) - это режим питания с высоким содержанием жиров, несколько ограниченным потреблением белков и очень низким содержанием углеводов, который имитирует метаболизм в состоянии голодания, вызывая выработку кетоновых тел [9]. Соотношение основных нутриентов представлено в таблице 1.
Таблица 1. Характеристика кетогенной диеты.
| Нутриент | Стандартная диета (%) | Кетогенная диета (%) |
|---|---|---|
| Углеводы | 62 | 3 |
| Жиры | 6 | 72 |
| Белки | 27 | 15 |
| Энергетический состав (ккал/гр) | 4,4 | 7,2 |
| Жиры/ углеводы + белки | 0,07 | 4 |
Особенностью КД, в отличие от голодания, является сохранение калорий, необходимых для энергетического метаболизма клеток. В норме образование кетоновых тел происходит в печени за счет продукции ацетил кофермента А (ацетил-коА) и окисления жирных кислот. Кетогенез контролируется инсулином и глюкагоном. Зачем нужны кетоновые тела? Они являются альтернативным источником энергии для клеток головного мозга, поперечнополосатой и сердечной мускулатуры, однако не могут использоваться раковыми клетками.
Как известно, основным источником энергии для опухоли является глюкоза. Для того, чтобы поддерживать высокий пролиферативный потенциал в злокачественных клетках, активирован гликолиз даже в присутствии кислорода (эффект Варбурга). Таким образом, терапевтический подход в депривации основного нутриента может быть эффективным с точки зрения торможения их роста. В случае КД опухолевые клетки имеют ограниченный доступ к глюкозе и не могут использовать кетоновые тела для производства энергии в связи с измененной функцией митохондрий, а также снижением ферментативной активности потребления кетонов [9].
Положительным аспектом КД является возможность потенцировать эффект химиотерапии или лучевой терапии, например, при раке легкого или нейробластоме [9]. Кроме того, наблюдается синергизм при применении ингибиторов контрольных точек [9]. В экспериментальных работах было показано, что 3-β-гидроксибутират подавляет экспрессию PD-L1 в миелоидных клетках, увеличивая число CXCR3+ Т-клеток и экспрессию интерферона 1. Ключевым механизмом является активация AMPK, которая фосфорилирует PD-L1, что приводит к его последующей деградации [9].
Что касается клинических результатов, то в рандомизированном исследовании применения КД у больных раком молочной железы, получающих стандартную химиотерапию, было отмечено значительное снижение фактора некроза опухоли α (ФНО-α) после 12 недель терапии (р<0,001), повышение интерлейкина-10 (ИЛ-10) (р<0,001), снижение уровня инсулина (р<0,002), а также уменьшение размеров опухоли и снижение стадии процесса при местнораспространенном новообразовании по сравнению с контрольной группой (27 и 6 мм, р=0,01) [10].
Эпидемиологические исследования демонстрируют снижение риска развития около 13 видов злокачественных опухолей на фоне физической активности [11]. Очевидно, что в основе этого эффекта лежит перепрограммирование метаболических процессов в организме в целом. При этом предклинические исследования на грызунах показывают, что бег на колесе, на беговой дорожке или плавание снижают частоту возникновения опухолей, их рост и метастазирование независимо от выбранной модели (перевиваемые или индуцированные) [11]. С чем это может быть связано? Физические упражнения изменяют возможные регуляторные механизмы роста злокачественных опухолей, что неизбежно сопровождается выраженными метаболическими изменениями. К ним относятся: изменение кровотока, регуляция pH, активация симпатической нервной системы, гипертермия, изменение концентрации половых гормонов и гормонов стресса (инсулин, лептин, глюкокортикоиды, катехоламины), изменение уровня циркулирующих экзосом, цитокинов и миокинов, а также факторов роста, деактивация сигнальных путей (HIPPO/YAP или Akt/mTOR), повышение активности иммунной системы за счет эпинефрин-зависимой стимуляции (ИФН1, NK-клетки), снижение функции опухолевой лактатдегидрогеназы (ЛДГ) и, тем самым, подавление секреции лактата в микроокружении [11].
В недавно опубликованном клиническом исследовании влияния физической нагрузки на эффективность неоадъювантной химиотерапии у больных раком пищевода было установлено значительное уменьшение объема опухоли по сравнению с контрольной группой: TRG 1-3 n=15/20 (75%) и n=7/19 (36,8%), p=0,025, соответственно. При этом было отмечено сокращение размеров региональных лимфатических узлов (42,9% и 15,8%, р=0,089, соответственно) и изменение иммунологических показателей (CD3, CD8, ИЛ-6, VEGF, ИФН1, ФНО-α) [11].
Ингибирование отдельных этапов метаболизма
Важным аспектом, с учетом гетерогенности опухолевого метаболизма, является поиск предиктивных маркеров перед назначением препаратов, влияющих на отдельные этапы энергетического гомеостаза. Например, к ним относятся:
Использование метаболических особенностей опухолей как «ахиллесову пяту» (витамин С и ферроптоз)
Ферроптоз - это один из сравнительно недавно открытых (в 2012 г.) механизмов клеточной гибели. В отличие от некроза, апоптоза, пироптоза или аутофагии, он обусловлен накоплением в клетке свободных радикалов (активных форм кислорода) из-за железо-опосредованного перекисного окисления липидов [13]. Считается, что опухолевые клетки в большей степени подвержены ферроптозу в связи с их выраженной пролиферативной и метаболической активностью. Данное обстоятельство делает подобный механизм клеточной гибели перспективной терапевтической мишенью.
Витамин С является незаменимым микроэлементом благодаря множеству функций, которые он выполняет в организме. Его «незаменимость» у человека определяется отсутствием фермента гулонолактон оксидазы, необходимого для синтеза витамина С в связи с окислением глюкозы. Витамин С в организме является кофактором гидроксилирования пролина и лизина, необходимых для синтеза коллагена типа 1. Кроме того, его стандартные дозы являются компонентом антиоксидантной защиты [14].
Одно из первых рандомизированных исследований, в котором оценивалась эффективность витамина С у больных злокачественными опухолями, было проведено Creagan E. с соавторами в 1979 г. Значимых различий с точки зрения общей выживаемости, лечебного эффекта и качества жизни достигнуто не было. Похожие данные были получены Moertel с соавторами у больных метастатическим колоректальным раком [14].
В последующих экспериментальных работах была предпринята попытка объяснить полученные негативные результаты. Оказалось, что основное терапевтическое значение имеет доза препарата и способ его введения. Предклинические и клинические исследования показали, что при внутривенном введении в высоких дозах витамин С оказывает противоопухолевое действие. Благодаря сложной фармакокинетике подобный эффект наблюдается при достижении его концентрации в плазме не менее 0,25 ммоль. Регуляция транспорта витамина С в опухолевую ткань осуществляется транспортерами (SVCT и GLUT), экспрессия которых зависит от типа клеток. Основным противоопухолевым механизмом действия витамина С является индукция образования свободных радикалов вследствие реакции Фентона. Важно отметить, что помимо общепризнанных прооксидантных эффектов, витамин С модулирует ферменты TET, способствующие деметилированию ДНК, и действует как кофактор гидроксилаз HIF, активность которых необходима для протеасомной деградации HIF-1α. Указанные особенности открывают новые возможности лечения опухолей со специфическими молекулярными дефектами (например, наличие KRAS-мутации, гиперэкспрессия HIF-1α или изменения TET2, IDH1/2 и WT1). Более того, действие витамина С на уровне ДНК может стать рациональной основой для комбинированной терапии с ингибиторами PARP и гипометилирующими агентами. На сегодняшний день растет число публикаций о клинической эффективности высоких доз витамина С [14]. В нашей клинической практике у пожилого больного с диссеминированным колоректальным раком (KRAS-мутация) при прогрессировании после 3-х линий лекарственной терапии было отмечено снижение биомаркера РЭА с 1661 до 188 нг/мл и торможение роста метастатических очагов на фоне внутрипеченочной инфузии высоких до витамина С при отсутствии клинически значимых побочных эффектов и субъективном улучшении общего состояния.
Перегрузка клетки глюкозой (гипертермия с перекислением)
Борьба с закислением микроокружения
Кислотность (pH) является одной из важнейших особенностей метаболизма опухолевой клетки. Обычно наблюдается внеклеточный ацидоз и внутриклеточный алкалоз или ощелачивание. Подобный градиент обеспечивает возможность пролиферации клеток, защиту от апоптоза, метаболическую адаптацию, миграцию и инвазивную способность клеток, активность микроокружения (иммунной системы и фибробластов). Безусловно, понимание механизмов pH-зависимого поведения клеток обеспечит развитие новой терапевтической стратегии опухолей [16].
В предклинических работах было показано, что у мышей на фоне приема бикарбоната натрия наблюдается меньшее число метастазов и увеличивается продолжительность жизни. Кроме того, алкализация микроокружения потенцирует эффект ингибиторов контрольных точек. Клинические исследования также подтверждают подобную гипотезу. У больных диссеминированным раком поджелудочной железы наблюдалось значительное увеличение продолжительности жизни на фоне приема бикарбоната по сравнению с контрольной группой (15,4 и 10,8 мес. соответственно; р<0,005) [16].
Потенцирование эффективности стандартной терапии
Оксид азота (NO) является стабильным свободным радикалом, который участвует во многих физиологических и патологических процессах в организме. В предклинических работах было показано, что NO повышает эффективность химио- и лучевой терапии, особенно в случае выраженной гипоксии в опухоли, за счет усиления кровотока и снижения потребления кислорода [17]. В качестве терапевтической стратегии было предложено введение доноров NO. Однако данный подход оказался весьма токсичным в связи с системной вазодилатацией и гипотензией, а также малоэффективным из-за замедления кровотока в опухоли, усугубления гипоксии и снижения pH. Альтернативой является стимуляция продукции NO за счет назначения L-аргинина как эндогенного субстрата фермента синтетазы оксида азота (NOS). Существует 3 изоформы данного белка. При этом в опухолевой ткани, как и при воспалении, и гипоксии, значение приобретает NOS2. Наибольшая экспрессия фермента наблюдается в клетках рака молочной железы, рака легкого, а также в церебральных метастазах. Назначение L-аргинина активно используется для лечения больных с эндотелиальной дисфункцией и генетической патологией митохондрий для улучшения микроциркуляции. При этом подобный подход нивелирует гемодинамические нарушения, которые обусловлены гиперпродукцией NO. В этой связи достаточно перспективным является применение L-аргинина в NOS-экспрессирующих опухолях в качестве сенсибилизатора к повреждению ДНК на фоне стандартной терапии в результате NO-индуцированного подавления метаболизма. В качестве доказательства подобной концепции было проведено исследование у 63 больных с метастатическим поражением головного мозга. Одна группа больных (n=31) получала 10 г L-аргинина внутрь за 1 час перед каждой фракцией облучения (1,6 Гр, 20 фракций, СОД 32 Гр). Другой группе (n=32) проводилось только облучение головного мозга. Объективный ответ составил 22% в группе контроля и 77,4% в группе L-аргинина (р<0,001) соответственно. При этом клинический эффект наблюдался у 93,5% больных по сравнению с контрольной группой (50%) [17].
Таким образом, метаболизм опухолевой клетки является сложным и пластичным процессом с выраженной гетерогенностью в зависимости от различных факторов. Безусловно, на сегодняшний день предпринимаются попытки поиска ключевых мишеней энергетического гомеостаза опухолевой клетки с целью терапевтического воздействия для увеличения продолжительности жизни больных. Без сомнения, подобное направление является перспективной стратегией лекарственной терапии злокачественных опухолей. Основными проблемами, которые требуют решения, являются:
Страшней клешней на свете нет.

Обзор
Karkinos (или Carcinus) — гигантский краб, древнегреческое мифологическое существо, бывшее помощником Гидры в борьбе с Гераклом. Герой раздавил его, но в награду за свою службу Karkinos был помещен среди звезд в виде созвездия Рака. Гиппократ (460-370до н.э.) ввел термин «карцинома», обозначавший злокачественную опухоль с перифокальным воспалением. Кровеносные сосуды вокруг злокачественных опухолей казались ему когтями ракообразного. В I в. до н.э. римский врач Авл Корнелий Цельс (Aulus Cornelius Celsius) перевёл греческое слово carcinus на латынь (cancer — краб).
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Каждое заболевание, будь то бубонная чума или обычная бородавка, имеет первичные и вторичные причины. Например, первичной причиной чумы является ее возбудитель — чумная палочка, — а вторичная причина — крысы, грязь и блохи, которые переносят эту палочку от крысы к человеку. Первопричина любой болезни — это то, что мы можем наблюдать и идентифицировать в каждом случае заболевания. Рак, в отличие от других заболеваний, имеет множество вторичных причин. Общее свойство у всех раковых клеток, похоже, только одно — замена трёхэтапного процесса клеточного дыхания на более древний и примитивный гликолиз.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Рак — это злокачественная опухоль, которая дает выросты в окружающие ее ткани, похожие на конечности ракообразного (отсюда и название). Ежегодно это заболевание уносит более 300 тысяч жизней. Основными причинами рака являются три группы факторов: физические (ионизирующее излучение, в т.ч. ультрафиолет), химические (канцерогенные вещества) и биологические (некоторые вирусы и бактерии). Под влиянием этих факторов клетки могут стать атипичными, поменять облик и свойства, что отражается во множестве молекулярно-генетических признаков, отличающих их от здоровых клеток:
- Увеличение лабильности и текучести клеточной мембраны, снижение адгезивности и контактного торможения. В норме клетки, вступая в контакт друг с другом, прекращают деление. В опухолевых клетках отсутствие контактного торможения приводит к безудержной пролиферации.
- Нарушение регуляции роста и дифференцировки опухолевых клеток. В нормальных клетках процессы роста и дифференцировки уравновешивает модулятор — кальций-зависимая протеинкиназа. В опухолевых клетках активность этого белка повышена, что приводит к резкой индукции пролиферации.
- Атипичный энергетический обмен, который проявляется в преобладании гликолиза. Нормальные дифференцированные клетки в присутствии кислорода в качестве основного источника энергии используют трёхэтапный процесс утилизация глюкозы (см. врезку):
- гидролиз высокомолекулярных органических соединений;
- гликолиз;
- окислительное фосфорилирование и цикл Кребса.
![Здоровая и раковая клетки печени]()
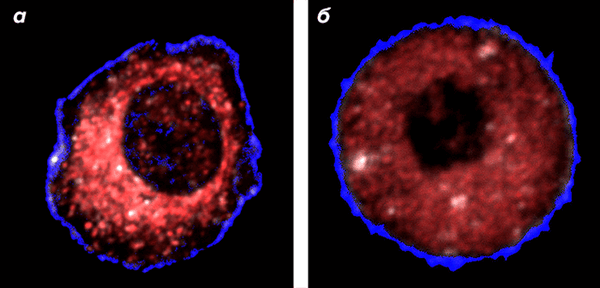
Рисунок 1. Здоровая (а) и раковая (б) клетки печени. Митохондрии помечены флуоресцентным красным красителем. У здоровой клетки митохондрии расположены кластерами вокруг ядра и отсутствуют вблизи внешней биомембраны. В раковой клетке митохондрии располагаются повсеместно и кластеров не образуют, поэтому интенсивность свечения снижается.
Особенности энергетического обмена
Живой организм — это открытая система, характеризующаяся постоянным обменом веществом и энергией с окружающей средой. На клеточном уровне существуют пластический (анаболизм) и энергетический (катаболизм) виды обмена. В ходе пластического обмена из простых веществ синтезируются более сложные (с затратой энергии). Энергетический обмен обеспечивает клетку энергией в виде АТФ. Все вещества в ходе энергетического обмена распадаются, а АТФ синтезируется. У животных энергетический обмен протекает в 3 этапа:
- Расщепление сложных органических веществ до более простых. Например, расщепление гликогена до глюкозы, фруктозы и галактозы. У многоклеточных организмов происходит в пищеварительном тракте, у одноклеточных — в лизосомах.
- Бескислородное окисление или гликолиз (расщепление глюкозы). Происходит в цитоплазме клетки без участия кислорода. На этом этапе из одной молекулы глюкозы образуется две молекулы пировиноградной кислоты и две молекулы АТФ. Также происходит восстановление молекулы НАД + до НАД•2Н. У животных и некоторых бактерий при недостатке кислорода происходит молочнокислое брожение с образованием молочной кислоты (лактата).
- Окислительное фосфорилирование и цикл Кребса происходят в митохондриях только в присутствии кислорода. На этом этапе расходуется пировиноградная кислота, ацетил-КоА, 12 молекул НАД•2Н и образуется 36 молекул АТФ.
Суммарно в ходе трёхэтапного цикла энергетического обмена из одной молекулы глюкозы образуется 38 молекул АТФ.
И голодно, и холодно, или раковый обмен
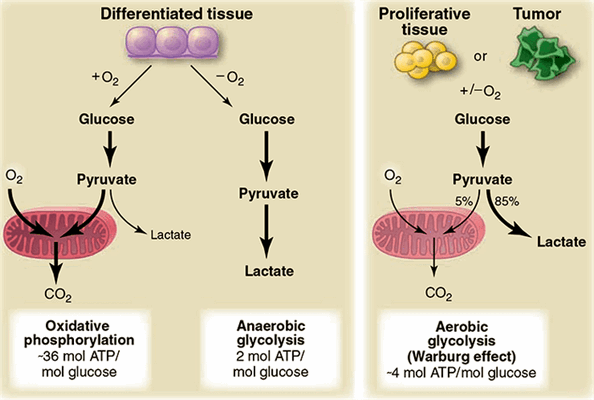
В 1926 г. Отто Варбург, исследуя образование молочной кислоты в здоровых и злокачественных (опухолевых) клетках обнаружил, что раковые клетки расщепляют глюкозу до молочной кислоты легче и быстрее, чем это делают нормальные клетки. По данным Варбурга, опухолевая ткань продуцирует молочную кислоту со скоростью в восемь (!) раз больше, чем работающая мышца. Производство лактата с такой скоростью полностью обеспечивает опухолевую ткань энергией (хотя на две молекулы лактата приходится всего две молекулы АТФ). На основе этих данных Варбург предположил существование так называемого «ракового обмена» [6]. Он считал, что в раковых клетках образуется дефект в митохондриях, что и приводит к необратимым нарушениям аэробной стадии энергетического обмена и последующей зависимости от гликолитического метаболизма. В этом случае гликолиз компенсирует энергетическую неполноценность поврежденного дыхания [7]. Он показал, что раковые клетки продолжают использовать гликолиз для получения энергии даже тогда, когда кислород присутствует в тканях в достаточном количестве. Это явление получило название эффекта Варбурга (рис. 2).
![Эффект Варбурга]()
Рисунок 2. Различия между реакциями окислительного фосфорилирования, анаэробного гликолиза и аэробного гликолиза (эффект Варбурга). В присутствии кислорода в нормальных дифференцированных тканях в процессе гликолиза происходит расщепление глюкозы до пирувата, который затем в митохондриях в процессе окислительного фосфорилирования полностью окисляется до СО2. Кислород является необходимым компонентом полного окисления глюкозы; когда кислорода оказывается недостаточно, в клетках в процессе гликолиза синтезируется лактат. Лактат не является субстратом для реакции окислительного фосфорилирования, и полного окисления глюкозы в этом случае не происходит. Такой путь расщепления глюкозы до лактата способен поддерживать стабильный синтез минимального количества АТФ. Варбургом было отмечено, что раковые клетки имеют тенденцию к производству лактата, а не пирувата, независимо от присутствия кислорода в клетках. Это свойство также характерно и для нормальных пролиферирующих клеток. Часть митохондрий в раковых клетках остаются функционально активными, и как в раковых, так и в нормальных пролиферирующих клетках доля окислительного фосфорилирования может составлять примерно 10%.
За последние 80 лет тема «ракового обмена» получила широкое распространение среди онкологов и клеточных и молекулярных биологов. Первые работы в этом направлении действительно свидетельствуют о пониженном содержании ключевых компонентов дыхательной цепи митохондрий — цитохрома c, сукцинатдегидрогеназы и цитохромоксидазы 10 — и увеличении интенсивности аэробного гликолиза в раковых клетках. Однако ряд последующих работ показал, что в большинстве опухолевых клеток нарушения функции митохондрий не происходит [11], [12], и предлагает объяснение «ракового обмена» на основе детального изучения обмена пролиферирующих клеток.
Общебиологические законы ракового обмена
Одноклеточные организмы состоят всего из одной клетки, но эта клетка — целостный организм, ведущий самостоятельное существование. Одноклеточные организмы хорошо приспособлены к окружающей среде, в которой они растут и размножаются (рис. 3). Основным фактором эволюционного давления для одноклеточных, ограничивающим их размножение, является доступность питательных веществ. Поэтому метаболизм одноклеточных эволюционно развивался так, чтобы запасы питательных веществ и свободной энергии были направлены, в первую очередь, на построение структур, необходимых для возникновения новой клетки. Большинство одноклеточных размножается с использованием энергии гликолиза, даже когда кислорода достаточно. Следовательно, несмотря на низкую эффективность (две молекулы АТФ против 36), гликолиз может обеспечить достаточно энергии для клеточной пролиферации.
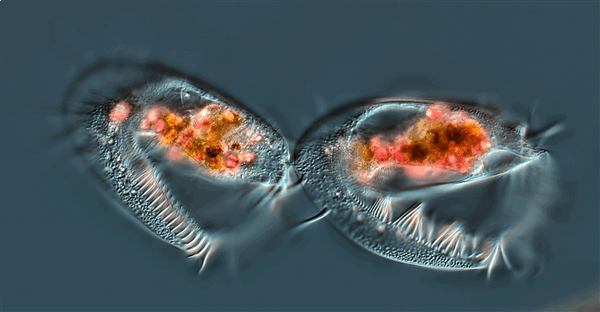
![Завершающая стадия клеточного деления инфузории]()
Рисунок 3. Завершающая стадия клеточного деления инфузории. Фотография сделана с использованием дифференциального интерференционного контраста ×40.
У многоклеточных организмов, напротив, клетки дифференцированы и напрямую с окружающей средой не взаимодействуют. В зависимости от функции, предназначенной им природой, клетки формируют ткани, а ткани — органы. За счет разделения функций, клетки в тканях имеют постоянный приток питательных веществ, поэтому деление клеток этим фактором ограничиваться не может. Для предотвращения неконтролируемого деления клеток у многоклеточных организмов появляются дополнительные системы управления. Например, экзогенные факторы роста стимулируют пролиферацию клеток, как бы давая «разрешение» на возможность делящейся клетке использовать питательные вещества из внешней среды [12], [13]. Опухолевые клетки многоклеточного организма способны преодолевать зависимость пролиферации от факторов роста посредством приобретения генетических мутаций, затрагивающих клеточные рецепторы, и использовать питательные вещества из внешней среды постоянно (рис. 2). Кроме того, мутации могут привести к чрезмерному поглощению глюкозы, превышающему биоэнергетические требования нормальных растущих или пролиферирующих клеток (рис. 4) [7], [14].
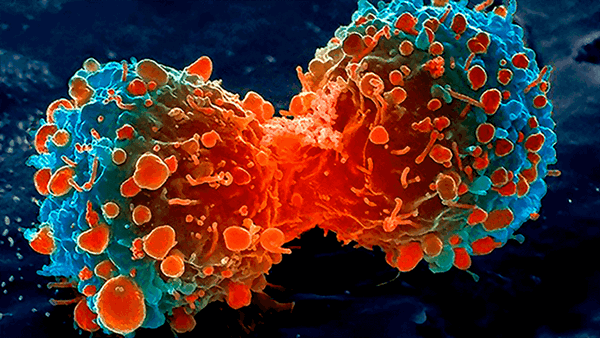
![Пролиферация раковых клеток легкого]()
Рисунок 4. Пролиферация раковых клеток легкого, сканирующий электронный микроскоп (STEM)
Но почему же менее эффективный обмен веществ (с точки зрения производства АТФ) предпочтителен для размножения одноклеточных организмов или безудержной пролиферации раковых клеток?
Одно из возможных объяснений состоит в идее самой пролиферации. Для осуществления процесса деления необходимо наличие большого количества строительного материала — нуклеотидов, аминокислот и липидов [15]. Глюкоза обеспечивает клетку энергией (расщепление дает до 38 молекул АТФ в трёхэтапном процессе), но также используется как стройматериал в процессе биосинтеза (поскольку содержит шесть атомов углерода). Например, в ходе биосинтеза одного из основных компонентов клеточных мембран — пальмитата (эфира пальмитиновой кислоты) — необходимо 16 атомов углерода и семь молекул АТФ [16]. Для синтеза аминокислот и нуклеотидов также требуется больше углерода, чем энергии. Так, одна молекула глюкозы может обеспечить 36 молекул АТФ, либо предоставить свои шесть атомов углерода. Очевидно, что в пролиферирующей клетке бóльшая часть глюкозы не может участвовать в производстве АТФ посредством окислительного фосфорилирования, поскольку одну молекулу глюкозы выгоднее использовать для синтеза 16-ти углеродной цепи пальмитиновой кислоты, в процессе окисления которой образуется 35 молекул АТФ.
Альтернативное объяснение заключается в том, что здоровые клетки многоклеточного организма не испытывают недостатка в поставке глюкозы из циркулирующей крови, и АТФ синтезируется постоянно [17], [18]. При этом даже незначительные колебания содержания АТФ/АДФ в таких клетках могут нарушить их рост. Нормальные клетки с дефицитом АТФ подвергаются апоптозу [19], [20]. Поддержание оптимального уровня АТФ/АДФ обеспечивается активностью специальных регуляторных киназ, которые снижают производство АТФ путем преобразования двух молекул АДФ в одну молекулу АТФ и одну АМФ; пролиферация при этом условии блокируется.
Опухолевые клетки используют в качестве основного источника энергии гликолиз и характеризуются генерацией избыточного лактата (содержащего три атома углерода), который выводится из клетки, хотя мог быть использован для синтеза АТФ или биосинтеза. Но, возможно, вывод избыточного углерода (в виде лактата) имеет смысл, поскольку он позволяет ускорить включение углерода в биомассу и облегчить деление клеток. Для большинства делящихся клеток важным является не выход АТФ, а скорость метаболизма. Например, иммунные реакции и заживление ран зависят от скорости пролиферативного умножения эффекторных клеток. Чтобы выжить, организм должен максимизировать скорость роста клеток. Клетки, которые наиболее эффективно превращают глюкозу в биомассу, растут быстрее. Кроме того, если для организма питательных веществ оказывается недостаточно, включается механизм активной утилизации избытка лактата. В печени в цикле Кори происходит переработка лактата, запасающегося в результате метаболизма активно пролиферирующей ткани [16]. Такой способ переработки органических отходов, образующихся в результате пролиферации клеток при иммунном ответе в результате заживления ран, частично пополняет энергетические запасы организма.
Заключение
В настоящее время гликолитический фенотип раковых клеток — это, по сути, универсальный маркер заболевания. «Раковый обмен» происходит по общебиологическим законам, но изменения касаются, прежде всего, количественной, а не качественной стороны. Эпигенетические изменения в клетках на ранних этапах злокачественной трансформации приводят к потере функциональной активности митохондрий, ингибированию апоптоза, активации пролиферации. Все эти факторы заставляют раковые клетки в качестве основного источника энергии использовать гликолиз даже в присутствии достаточного количества кислорода. Но неэффективный с точки зрения производства АТФ гликолиз дает раковым клеткам определенное преимущество. Безудержная пролиферация раковых клеток требует наличия большего количества биоматериала для репликации клеточных структур, чем энергии АТФ, и только гликолиз способен поддерживать такой путь метаболизма.
Читайте также:
- КТ, пиелография при переходноклеточном раке мочеточника
- Инструкция по соблазнению. Как покорить мужчину своей мечты?
- Советы по исследованию сосудов при нарушении мозгового кровообращения
- Кардиоверсия. Показания и техника кардиоверсии
- Легочный свищ после экстраплеврального пневмоторакса. Ведение пациента после экстраплеврального пневмоторакса